A associação de hipotiroidismo e puberdade precoce é pouco frequente e ocorre especialmente em situações graves não tratadas durante um longo período de tempo. A puberdade precoce periférica induzida por hipotiroidismo pode incluir telarca, galactorreia e menarca na ausência de pelo púbico. Outra manifestação importante inclui atraso no crescimento estatural.
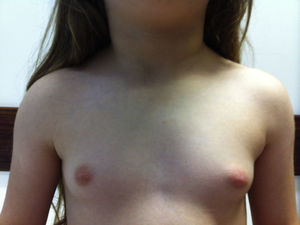
É apresentado o caso de uma menina de 6 anos com desenvolvimento mamário bilateral com 2 meses de evolução. A ecografia pélvica mostrou endométrio espessado, ovários de dimensões aumentadas e com folículos. A investigação subsequente demonstrou hipotiroidismo decorrente de tiroidite autoimune.
The association between hypothyroidism and precocious puberty is uncommon in children and occurs in untreated situations for a long period of time. Peripheral precocious puberty induced hypothyroidism may include thelarche, menarche and galactorrhoea in the absence of pubic hair. Other important characteristic include delayed linear growth.
The authors present a 6 year old girl with bilateral breast augmentation with 2 months of evolution. Pelvic ultrasonography showed thickened endometrium and enlarged ovaries with follicles. Subsequent investigation showed hypothyroidism due to autoimmune thyroiditis.
A causa mais frequente de hipotiroidismo em idade pediátrica é a tiroidite autoimune (ou tiroidite de Hashimoto ou tiroidite linfocitária crónica). É caracterizada pela presença de auto‐anticorpos contra proteínas envolvidas na regulação do metabolismo tiroideu (a peroxidase e a tiroglobulina). Pode cursar com eutiroidismo ou com hipotiroidismo. Quando cursa com hipotiroidismo é necessária a reposição farmacológica de hormona tiroideia (L‐tiroxina) que deve ser ajustada de acordo com o défice da mesma 1.
O atraso pubertário é uma manifestação pouco comum de hipotiroidismo. A puberdade precoce associada ao mesmo é ainda mais rara e designa‐se de Síndroma Van Wyk‐Grumbach. Pode apresentar‐se como telarca (com ou sem galactorreia) seguida de menarca, sem a presença de pelo púbico. O atraso no crescimento estatural é uma manifestação importante para o diagnóstico diferencial, uma vez que ocorre o oposto (aumento do crescimento) na puberdade precoce central 2.
Os autores apresentam um caso de hipotiroidismo associado a puberdade precoce.
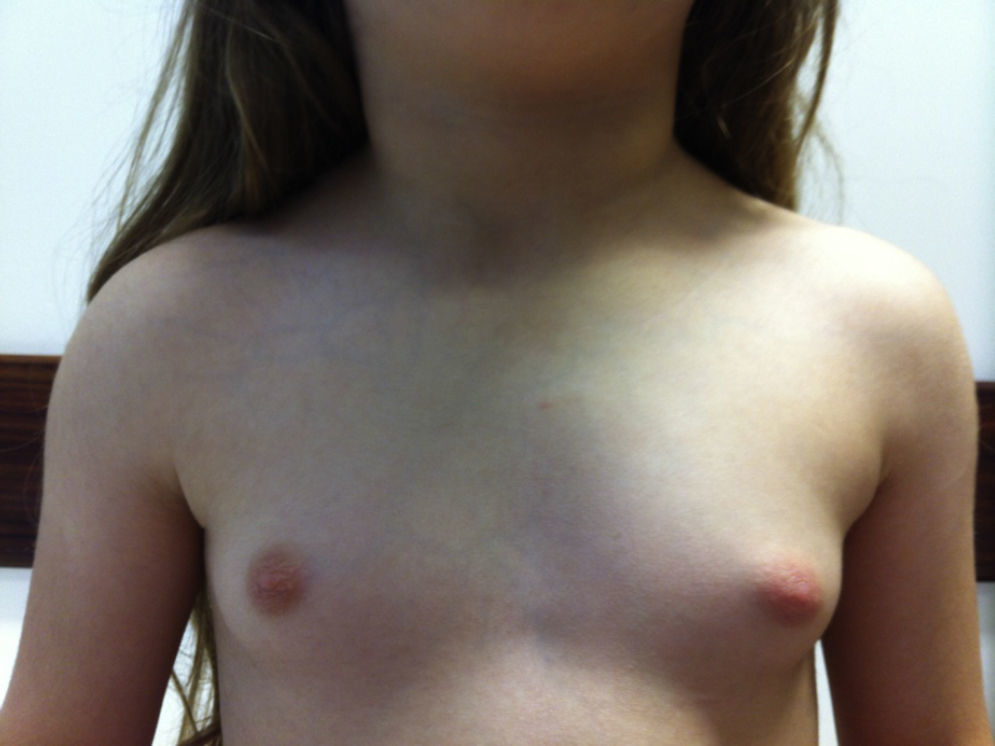
Descrição do caso clínicoCriança do sexo feminino, com 6 anos e 11 meses, que foi observada na consulta de Endocrinologia por aumento mamário bilateral com 2 meses de evolução. Apresentava dor esporádica da mama, não apresentava galactorreia ou sinais inflamatórios. A mãe referia também alteração do timbre de voz. Negava alteração do odor corporal, acne, leucorreia ou hemorragia vaginal.
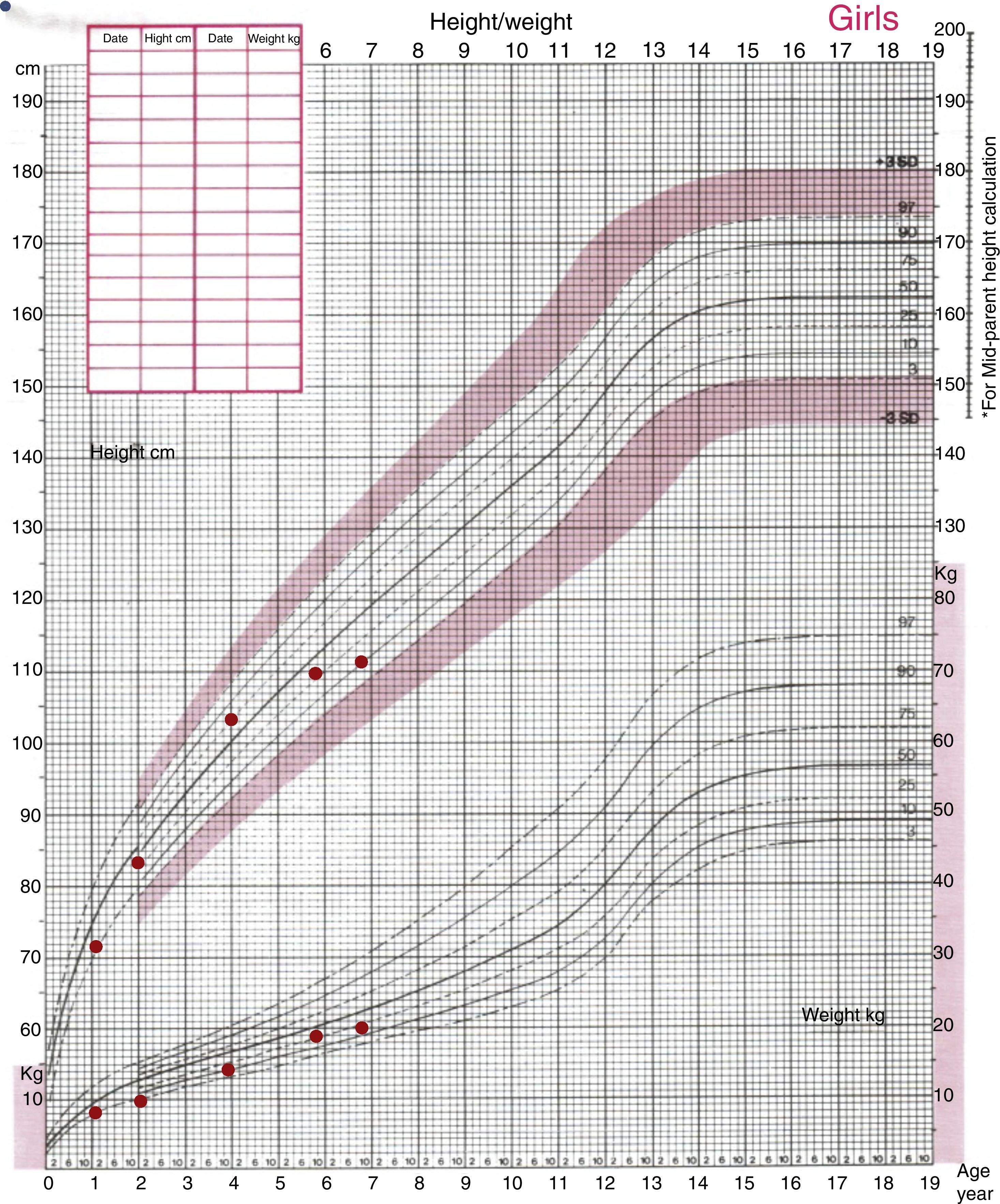
No último ano apresentava diminuição da velocidade de crescimento (2cm/ano – fig. 1). O desenvolvimento psicomotor era adequado à idade e frequentava o 2° ano de escolaridade, com bom aproveitamento escolar. Negava alterações do apetite, urinárias ou intestinais.
Tratava‐se de uma ex‐prematura de 28 semanas, fruto de gravidez gemelar complicada (por morte de um dos fetos no primeiro trimestre). O parto foi eutócico com índice Apgar 4‐5‐8 com necessidade de entubação orotraqueal e ventilação mecânica. O peso ao nascimento era de 1.090g (P50), comprimento 38,5cm (P50‐75), perímetro craniano 27cm (P50‐75). Internada durante o período neonatal em cuidados intensivos por doença das membranas hialinas e sépsis com boa evolução clínica. Apresentava também comunicação inter‐auricular e persistência do canal arterial, que encerraram espontaneamente. A recuperação do crescimento ocorreu nos primeiros 13 meses de vida. Sem outros antecedentes relevantes desde o primeiro ano de vida.
A mãe tinha 39 anos, era saudável e tinha tido a menarca aos 11 anos. O pai tinha 40 anos, era saudável, não tendo sido possível determinar com exatidão a cronologia da puberdade. Tinha uma irmã de 14 anos saudável, com menarca aos 13 anos. A estatura alvo familiar era de 160,5cm. Foram negados outros antecedentes relevantes na família.
Ao exame objetivo apresentava a seguinte somatometria: peso 20kg (SDs ‐1,72), estatura 111,5cm (SDs ‐1,68). Estava apirética, as mucosas apresentavam‐se húmidas e coradas. A FC era de 75 bpm e a tensão arterial no membro superior direito era de 74/39mmHg (fig. 2). A tiroide era palpável, móvel com a deglutição e não apresentava nódulos ou massas. A auscultação cardiopulmonar era normal. O abdómen era depressível e não apresentava massas ou organomegálias palpáveis.
Foi pedida ecografia pélvica que mostrou: «Bexiga sem alterações; útero em anteflexão, 5,7x1,2x2,3cm, com espessamento do endométrio; ovários um pouco aumentados para a faixa etária, principalmente o direito (ovário direito 3,4x1,7cm, ovário esquerdo 2,2x1,2cm); o ovário direito apresentava imagens nodulares compatíveis com folículos».
Realizou também avaliação analítica: LH <0,1 mUI/mL (<0,3), FSH 4,3 mUI/mL (<3), estradiol 26,1 pg/mL (<15), prolactina 62,9 ng/mL (1,9‐25,0), TSH >150 UI/L (0,7‐6,4), T4 livre 0,3 ng/dL (0,8‐1,9), testosterona total <10 ng/mL (<20), testosterona livre 0,25 pg/mL (0,15‐0,6), androstenediona <0,3 ng/mL (<1,7), DHEA‐SO4 <15 ng/mL (5‐77), ACTH 21,9 pg/mL (<46), cortisol 8,8 ug/dL (5‐25), IGF‐1 190 ng/mL (média – +1SD, 62‐248), IGF‐BP3 3,3 ug/mL (1,4‐6,1).
A idade óssea era concordante com a idade cronológica.
Constatou‐se assim hipotiroidismo primário. Iniciou tratamento com levotiroxina (1,25μg/kg/dia).
Foi agendada reavaliação clínica e analítica para o mês seguinte. Na 2a consulta apresentava M2‐P1 com restante exame objetivo normal. Analiticamente apresentava prolactina 44,3 ng/mL (1,9‐25), TSH>150 UI/L (0,6‐6,4), T4 livre 0,7 ng/dL (0,8‐1,9), foram também pedidos anticorpos antitiroideus que foram positivos: Acs anti‐peroxidase >1.000 UI/mL (<35) e Acs anti‐tiroglobulina 330 UI/mL (<40). Assumiu‐se então o diagnóstico de tiroidite de Hashimoto com hipotiroidismo. Decidiu‐se também aumentar a dose de levotiroxina para 2,5μg/kg/dia e reavaliar clinicamente e laboratorialmente 2 meses após início da terapêutica.
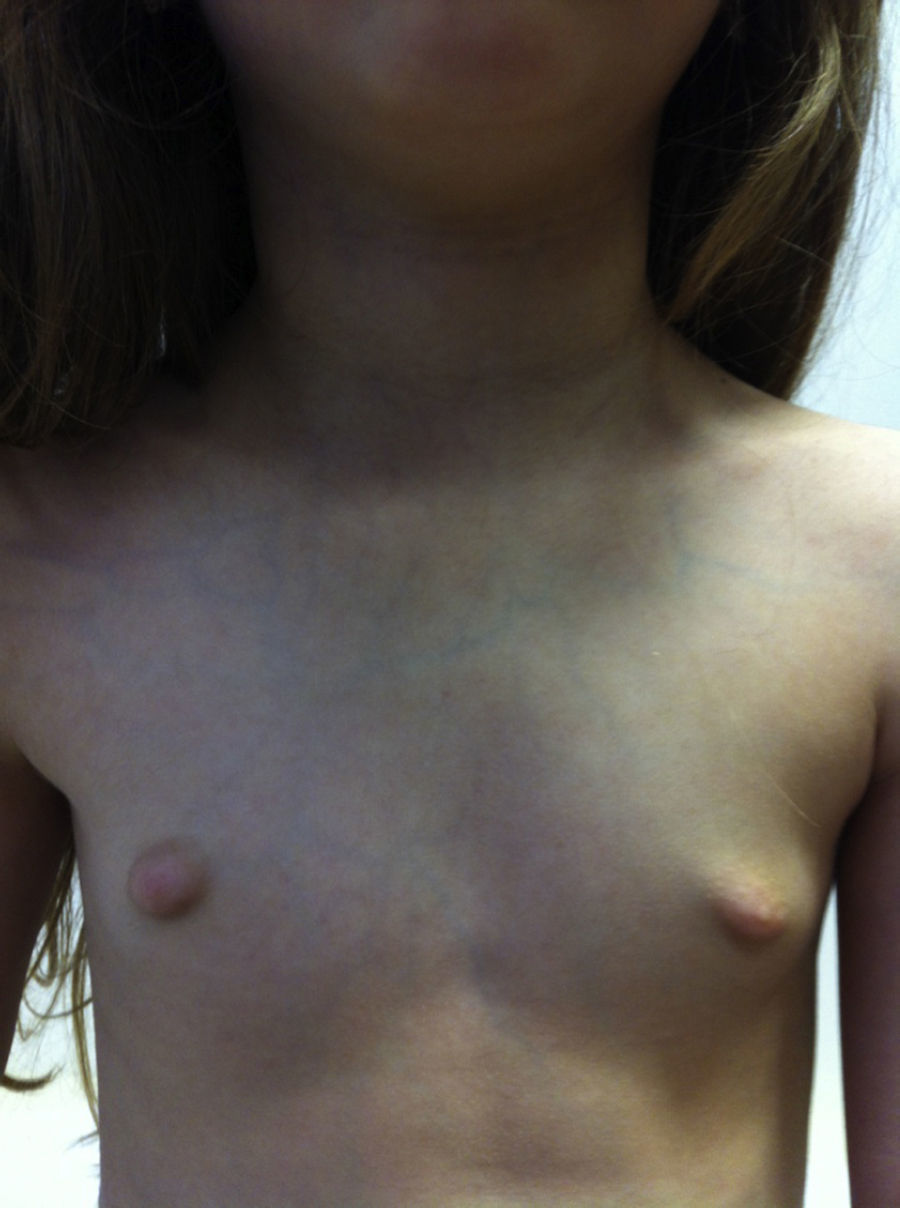
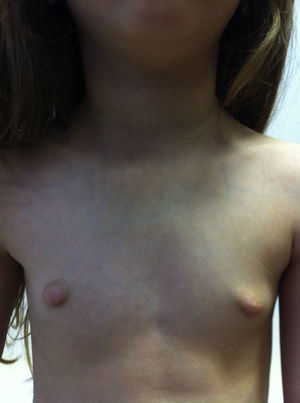
Na 3a consulta apresentava regressão completa da telarca bilateralmente (M1‐P1) (fig. 3). O restante exame objetivo era normal. Analiticamente apresentava, TSH 2,1 UI/L (0,6‐6,4), T4 livre 1,5 ng/dL (0,8‐1,9) e calcitonina 2,6 pg/mL (<5).
Foi então realizada ecografia cervical que mostrou tiroide de dimensões normais e «textura discretamente heterogénea de forma difusa, observando‐se algumas áreas hipoecogénicas punctiformes dispersas, alterações sugestivas de tiroidite». Repetiu, também, ecografia pélvica que mostrou diminuição das dimensões do útero e dos ovários.
Manteve seguimento na consulta de endocrinologia, estando a realizar terapêutica com levotiroxina 2,5μg/Kg/dia. Manteve‐se assintomática, sendo o estadio Tanner M1‐P1 e restante exame objetivo normal. Na última avaliação analítica (6 meses após início de tratamento) apresentava valores de T4 livre e TSH normais.
ComentárioA síndrome van Wyk‐Grumbach (puberdade precoce associada a hipotiroidismo grave) é uma situação muito rara. O diagnóstico pode ser suspeitado pela presença de telarca na ausência de pelo púbico e atraso no crescimento estatural 2. No presente caso clínico, estavam também presentes aumento das dimensões dos ovários (com folículos), espessamento do endométrio, aumento ligeiro da prolactina, gonadotrofinas e androgénios normais.
A associação do hipotiroidismo a puberdade precoce pode ocorrer em 24 a 36% das crianças com hipotiroidismo grave não tratado 3,4. Podem ocorrer desenvolvimento mamário e hemorragia menstrual. A última pode ocorrer mesmo com aumento mamário mínimo. A causa é habitualmente uma tiroidite auto‐imune e mais raramente em consequência de tiroidectomia ou tratamento excessivo com antitiroideus 2.
No presente caso clínico foi confirmada a tiroidite auto‐imune (aumento dos anticorpos anti tiroglobulina e anti peroxidase).
O mecanismo exato da puberdade precoce associada ao hipotiroidismo permanece por esclarecer, mas são várias as hipóteses que o pretendem justificar. Por um lado, a diminuição das hormonas tiroideias vai induzir a libertação de TRH e TSH (direta e indiretamente) através do feedback negativo 4. A TSH pode atuar diretamente nas gónadas, com efeitos «FSH‐like» pela semelhança estrutural entre os seus recetores 5. Por outro lado, a TRH pode estimular diretamente a produção de FSH 3,4,6.
A TRH estimula também a libertação de prolactina, que aumenta a sensibilidade dos ovários às gonadotrofinas (mesmo para valores pré‐pubertários) e diminui a frequência de pulsos de GnRH (inibindo a secreção de LH e estimulando a de FSH) 3–5. Os níveis elevados de estradiol e testosterona podem resultar da estimulação gonodal, mas também da redução da clearence metabólica associada ao hipotiroidismo 4. No presente caso, verificou‐se um aumento significativo de TSH com T4 livre baixa, elevação da prolactina, elevação de FSH e estradiol, traduzindo hipotiroidismo grave associado a puberdade precoce FSH predominante independente de GnRH.
O tratamento da puberdade precoce deve ser dirigido à causa da mesma 7. Assim, o tratamento da puberdade precoce associada ao hipotiroidismo faz‐se com a reposição de hormona tiroideia, a levotiroxina 1,7. A regressão da telarca e das características púberes dos ovários e útero dá‐se ao atingir‐se o estado de eutiroidismo 8,9, como ocorreu no caso descrito. Relativamente à estatura final, estudos revelam uma diferença muitas vezes superior a ‐2SDs da estatura‐alvo, que poderá estar associada à aceleração da maturação óssea no início da terapêutica com levotiroxina 3.
Ao relatar este caso, os autores pretendem realçar a importância de identificar o hipotiroidismo primário grave como causa de puberdade precoce e a possibilidade de reverter a situação clínica com terapêutica de reposição, sem necessidade de uma abordagem mais exaustiva ou invasiva.
Conflito de interessesOs autores declaram não haver conflito de interesses.