Recientemente se ha planteado que las alteraciones de las capas de la retina podrían ser un biomarcador de determinados trastornos mentales, al derivar esta de la misma capa embrionaria que el cerebro y estar conectada con este a través del nervio óptico. El objeto del presente artículo es ofrecer una revisión sistemática de la literatura y una síntesis temática sobre el estado actual de las alteraciones de las capas de la retina identificadas mediante tomografía de coherencia óptica en los pacientes con esquizofrenia, trastorno bipolar y depresión mayor. Para ello se realizó una búsqueda sistemática de la literatura, la lectura crítica de los artículos seleccionados y la síntesis temática de los resultados.
Los pacientes con esquizofrenia son los que presentan más alteraciones, seguidos de los pacientes con trastorno bipolar, siendo muy escasos los hallazgos en la depresión. La capa de fibras nerviosas de la retina es la capa retiniana con más alteraciones en la esquizofrenia y en el trastorno bipolar, mientras que ningún estudio en depresión mayor encontró alteraciones en ella. De los parámetros clínicos, la duración de la enfermedad correlaciona significativa e inversamente con el grosor de las distintas capas en todos los trastornos.
A la hora de interpretar estos datos es necesario tener en cuenta las limitaciones y diferencias de los estudios, especialmente el tiempo medio de evolución de los trastornos. Dado que este era muy diferente entre los 3 trastornos (más del doble en el caso de la esquizofrenia respecto a la depresión mayor), las diferencias en los resultados encontrados podrían deberse más al efecto del tiempo de evolución que al trastorno en sí.
En conclusión, los hallazgos de la tomografía de coherencia óptica son esperanzadores, ya que podrían proporcionar biomarcadores de la neurodegeneración y/o neuroprogresión tanto de la esquizofrenia como del trastorno bipolar.
It has recently been suggested that alterations of the layers of the retina could be a biomarker of specific mental disorders since they originate in the same embryonic layer as the brain and both are interconnected through the optic nerve. The purpose of this article is to offer a systematic review of the literature and a thematic synthesis on the current state of the alterations of the retina layers identified by optical coherence tomography in patients with schizophrenia, bipolar disorder and major depression. For this purpose, we performed a bibliographic search, a systematic review of the studies and a thematic synthesis of the reported findings.
Patients with schizophrenia have more abnormal findings followed by patients with bipolar disorder, with very few findings in depression. The nerve fiber layer is the retinal layer with more abnormal findings both in schizophrenia and in bipolar disorder, while no study in major depression found alterations in it. Of the clinical parameters, the duration of the illness correlates significantly and inversely with the thickness of the different layers in all disorders.
When interpreting these data, it is necessary to take into account the limitations and differences of the studies, especially the mean length of the disorders. Given that this was very different among the 3 disorders (more than doubled in the case of schizophrenia respect to major depression), the differences in the results found could be due more to the effect of the length of illness than to the disorder itself.
In summary, optical coherence tomography findings are promising, since they could provide biomarkers of neurodegeneration and/or neuroprogression of both schizophrenia and bipolar disorder.
A punto de finalizar la segunda década del siglo xxi, no se tienen datos consistentes sobre la patofisiología de los trastornos mentales graves y su diagnóstico sigue basculando en la identificación de los signos y síntomas característicos a través de la entrevista clínica. Sin embargo, su presentación clínica, especialmente en las fases iniciales, puede ser extremadamente variable, predominando manifestaciones que van desde signos y síntomas psicóticos y/o afectivos hasta una disminución del nivel de funcionalidad, pasando por alteraciones cognitivas, lo que dificulta considerablemente la precisión diagnóstica de la enfermedad. Por ello, en los últimos 15 años se están realizando esfuerzos importantes para identificar marcadores objetivos y cuantificables que ayuden a entender la patofisiología de estas enfermedades y mejorar nuestra precisión diagnóstica mediante la incorporación de marcadores biológicos1. Entre los marcadores en estudio se encuentra la imagen cerebral, pero, a pesar de su importancia, la neuroimagen no ha demostrado aún ser de gran utilidad en el diagnóstico de estos trastornos, siendo además un método relativamente caro y molesto para los pacientes.
Recientemente se ha postulado la retina, al proceder de la misma capa embrionaria que el cerebro y estar conectada con este a través del nervio óptico, como una ventana que permite la observación directa del cerebro a través del estudio de su estructura y/o función. Distintos autores2–4 han planteado que los cambios en la estructura de la retina pueden ir en paralelo o reflejar los cambios en el tejido cerebral, por lo que serían un marcador de fácil acceso de la integridad estructural y/o funcional del cerebro.
La tomografía de coherencia óptica (OCT) es una técnica de imagen rápida, no invasiva, de no contacto y sin efectos secundarios conocidos, que proporciona la visualización in vivo detallada y precisa de la arquitectura de la retina, especialmente en el área macular foveal. Los cortes axiales que proporciona permiten obtener una «biopsia óptica» de la superficie en estudio, logrando delinear con gran detalle las 10 capas que conforman la retina. La OCT se considera el análogo óptico de la imagen por ultrasonido. Esta técnica emite pulsos cortos de luz infrarroja que se dirigen hacia el ojo y a un espejo de referencia. La diferencia entre la composición de frecuencia espectral de la luz devuelta por el ojo (el perfil de frecuencia espectral original menos lo absorbido por las estructuras retinianas) y la devuelta inalterada por el espejo de referencia se usa para reconstruir bi- o tridimensionalmente las imágenes de las capas de la retina. En oftalmología ha constituido el mayor avance tecnológico de los últimos años, convirtiéndose en el método diagnóstico por excelencia para el análisis y el seguimiento de las enfermedades que afectan a la retina y el nervio óptico.
En la actualidad, la OCT se está utilizando en la investigación de enfermedades neurodegenerativas como la esclerosis múltiple, la enfermedad de Parkinson y la demencia de Alzheimer. Teniendo en cuenta el paralelismo neurodegenerativo entre estas enfermedades y los trastornos mentales graves, especialmente la esquizofrenia (ESQ), recientemente se ha incorporado esta técnica al estudio de los trastornos del espectro autista, la ESQ, el trastorno bipolar (TB) y la depresión mayor (DM), con el objetivo de determinar si sus hallazgos podrían ser biomarcadores de la neurodegeneración y/o neuroprogresión que caracteriza a estos trastornos. Además, el interés es mayor por ser esta una técnica no invasiva, sencilla, de poco tiempo de aplicación y más barata que las técnicas de neuroimagen convencionales.
Si bien recientemente se han publicado algunas revisiones sobre las alteraciones retinianas identificadas mediante la OCT en los trastornos mentales4–7, estas están circunscritas a la ESQ ?aunque Adams y Nasrallah6 realizan también una pequeña síntesis de los hallazgos en otros trastornos mentales?. Por ello, el objetivo de este artículo es realizar una revisión sistemática y una síntesis temática cualitativa de las alteraciones de la retina, identificadas mediante la OCT, en las personas con ESQ, TB y depresión.
MétodosSe trata de una revisión sistemática y una síntesis temática sobre las alteraciones de la retina identificadas mediante OCT en las personas con trastornos mentales graves, esto es ESQ, TB y DM. En primer lugar, se realizó una búsqueda sistemática de la literatura, luego se realizó la lectura crítica de los estudios seleccionados, para finalmente realizar la síntesis temática de las alteraciones retinianas descritas, así como la identificación de áreas de mejora con base en las debilidades de los estudios analizados.
Búsqueda sistemática de la literaturaSe realizó una búsqueda sistemática en la base de datos de PubMed utilizando los siguientes buscadores (Optical Coherence Tomography [All Fields]) AND ((Schizophrenia [All Fields]) OR (Bipolar Disorder [All Fields]) OR (Major Depression [All Fields])) y sin limitación temporal alguna. Se obtuvo un total de 45 artículos, de los cuales se seleccionaron un total de 19 (10 de ESQ, 5 de depresión, 3 de TB y uno de psicosis). Además, se realizó la misma búsqueda, pero en esta ocasión los buscadores de los trastornos mentales operaron como MeSH Terms en lugar de All Fields, arrojando un total de 22 artículos, 19 de los cuales ya se habían obtenido en la búsqueda previa y 3 nuevos y relevantes para esta revisión (uno de cada trastorno).
Los criterios de relevancia establecidos para que un artículo fuera seleccionado para el análisis de resultados consistían en que el artículo debería describir los resultados de la OCT en los pacientes con el trastorno mental seleccionado y estuviera escrito en español o inglés, sin restricciones en cuanto a tamaño muestral o diseño del estudio. Sobre la base de estos criterios se eliminaron 8 artículos más: uno de psicosis8, ya que incluía 6 pacientes con 2 trastornos mentales (3 con ESQ y 3 con TB) y no proporcionaba los resultados por separado de ambos trastornos; 5 de ESQ, puesto que eran revisiones4–7 o incluían pacientes con trastorno esquizoafectivo también2; y 2 de depresión9,10, ya que se trataba de unas cartas al editor sobre las limitaciones del artículo de Schönfeldt-Lecuona et al.11 y la respuesta de los autores del artículo a los comentarios de la carta.
Se realizó también una búsqueda en PsycINFO y otra manual en las referencias de los artículos encontrados, que no proporcionaron ningún artículo adicional.
Lectura crítica de los artículosLa lectura crítica de los artículos de ESQ fue realizada por LGA, de TB por LFT y de depresión por AVI. La primera autora (MPGP) realizó también una lectura crítica independiente de todos los artículos. Posteriormente, se llegó a un consenso entre las 4 autoras sobre las debilidades y fortalezas de los estudios, y los resultados obtenidos.
Síntesis temáticaPara la realización de la síntesis temática se identificaron 2 temas principales de interés: alteraciones de la retina y de la coroides en cada uno de los trastornos mentales y correlación entre las alteraciones retinianas y coroideas y las variables clínicas de cada trastorno (tiempo de evolución, gravedad clínica y psicométrica, hospitalizaciones, refractariedad al tratamiento, tratamiento farmacológico). Cada una de las revisoras realizó de forma individual la extracción de los hallazgos organizándolos en estos 2 temas, así como las limitaciones de los estudios de su trastorno. La primera autora unificó y sintetizó los hallazgos de los 3 trastornos y realizó las apreciaciones o atribuciones pertinentes.
ResultadosEsta revisión sistemática y síntesis temática sobre las alteraciones de la retina en las personas con trastorno mental grave está basada en un total de 14 artículos: 6 de ESQ, 4 de TB y 4 de depresión.
Alteraciones de la retina en los trastornos mentales graves (tabla 1)EsquizofreniaLos escasos estudios realizados con OCT en pacientes con ESQ han demostrado en su mayoría un adelgazamiento global del grosor de la retina, sobre todo a expensas de la capa de fotorreceptores, en las regiones de la fóvea y la parafóvea temporal y nasal12, pero también del grosor de la capa de fibras nerviosas de la retina (GCNR) global3,13–15 y en los cuadrantes superior e inferior3,14, y una disminución del volumen de la capa de las células ganglionares (CCG)15 y de la capa plexiforme interna (IPL)15 comparados con controles sanos. Además, los pacientes que tenían comorbilidad con enfermedades sistémicas como la diabetes o la hipertensión presentaban un menor grosor de la CCG y de la IPL que los controles sin diabetes o hipertensión, y de la mácula con respecto a los pacientes y los controles sin diabetes o hipertensión16.
Diferencias entre pacientes y controles sanos en los parámetros de la tomografía de coherencia óptica
| Primer autor, año y país | Tipo de estudio | Sujetos de estudio | Técnica | Parámetros de estudio | Resultados |
|---|---|---|---|---|---|
| Esquizofrenia | |||||
| Samani et al.12, 2018, Reino Unido | Casos y controles | 35 pacientes con ESQ, edad media 40,6 años, tiempo medio evolución enfermedad 16,3 años 50 controles sanos | SD-OCT | Grosor total de la retina y de las distintas capas | Grosor total retina menor (p<0,05) en las regiones fóvea y parafóvea nasal y temporal en pacientes vs. controles Grosor capa fotorreceptores, CNE e CSI menor (p<0,05) en las regiones fóvea y parafóvea nasal y temporal en pacientes vs. controles Grosor CFNR e CPI menor (p<0,05) en la región parafóvea nasal en pacientes vs. controles Grosor CCG menor (p<0,05) en la región parafóvea temporal en pacientes vs. controles |
| Silverstein et al.16, 2018, EE. UU. | Casos y controles pareados a nivel de grupo, por edad y sexo | 32 pacientes con ESQ: 21 sin D/HTA y 11 con D/HTA Edades medias: 40,5 años para el total de pacientes y 35,1 y 50,9 años para cada subgrupo, respectivamente 32 controles sanos: 21 sin D/HTA y 11 con D/HTA | SD-OCT | Grosor de la CFNR global y de 4 cuadrantes, y simetría CFNR Grosor CCG-CPI Volumen de la mácula y grosor de 4 cuadrantes Cabeza del nervio óptico: volumen de la copa óptica y ratio copa:disco | Grosor y simetría CFNR no diferencias ni entre pacientes-controles ni entre los 4 grupos Grosor CCG-CPI no diferencias entre pacientes y controles Pacientes con D/HTA menor grosor (p<0,05) vs. controles sin D/HTA Grosor mácula en cuadrante externo nasal izquierdo menor (p<0,05) en los pacientes vs. controles Pacientes con D/HTA menor grosor (p<0,05) en todos los cuadrantes excepto los inferiores en ambos ojos vs. pacientes sin D/HTA y controles sin D/HTA Volumen copa óptica mayor (p<0,05) en pacientes vs. controles en ojo derecho Ratio copa:disco mayor (p<0,05) en pacientes vs. controles en ambos ojos Pacientes con y sin D/HTA mayor ratio copa:disco (p<0,05) vs. controles con y sin D/HTA Pacientes y controles con D/HTA adelgazamiento (p<0,05) de la mayor parte de las estructuras retinianas sobre todo en el ojo izquierdo vs. pacientes y controles sin D/HTA |
| Celik et al.15, 2016, Turquía | Casos y controles | 40 pacientes con ESQ-RT y 41 pacientes con ESQ-rT, edades medias 35,7 y 35,4 años, respectivamente, tiempo medio evolución enfermedad 14,5 y 12,0 años, respectivamente 41 controles sanos | SD-OCT | Grosor de la CFNR global y de 6 cuadrantes Volumen de la CCG e CPI Grosor de la coroides | Grosor CFNR ojo derecho global y en los cuadrantes temporales superior e inferior menor (p<0,05) en pacientes vs. controles Volumen CCG y CPI ojo derecho menor (p<0,05) en pacientes vs. controles Volumen CCG e CPI ojo derecho menor (p<0,05) en pacientes ESQ-RT vs. ESQ-rT Grosor coroides ojo derecho menor (p<0,05) en pacientes ESQ-RT vs. ESQ-rT |
| Ascaso et al.14, 2015, España | Casos y controles pareados por edad y sexo | 30 pacientes con ESQ: 10 ER episodio reciente (en el último mes) y 20 N-ER no episodio reciente (estable y sin episodios en los últimos 6 meses) Edades medias 45,1 para el total de pacientes y 41,5 y 46,8 años para cada subgrupo, respectivamente Tiempo medio evolución enfermedad 16 años para el total de pacientes y 17,6 y 13,7 años para cada subgrupo 30 controles sanos | TD-OCT | Grosor de la CFNR global y de 4 cuadrantes Grosor de la mácula (anillos externo e interno y fóvea) y volumen mácula | Grosor CFNR ojo derecho global y en cuadrante superior, ojo izquierdo en cuadrante inferior menor (p<0,05) en pacientes vs. controles N-ER grosor CFNR ojo derecho global y en cuadrantes superior y nasal menor (p<0,05) vs. pacientes ER y controles Grosor anillo interno, fóvea y volumen mácula ojo izquierdo menor (p<0,05) en pacientes vs. controles N-ER grosor anillo interno ojo derecho y volumen mácula ojo izquierdo menor (p<0,05) vs. pacientes ER y controles N-ER y ER grosor anillo interno ojo izquierdo menor (p<0,05) vs. controles |
| Ascaso et al.13, 2010, España | Casos y controles pareados por edad | 10 pacientes con ESQ, edad media 39,2 años 10 controles sanos | TD-OCT | Grosor de la CFNR global y de 4 cuadrantes Grosor y volumen de la mácula Cabeza del nervio óptico (ratio área copa:disco y ratios horizontal y vertical) | Grosor CFNR global y en cuadrante nasal menor (p<0,05) en pacientes vs. controles |
| Lee et al.3, 2013, Malasia | Casos y controles pareados por edad, sexo y raza | 30 pacientes con ESQ, edad media 37,2 años 5 agudos (≤2 años duración enfermedad) 13 crónicos (>2-10 años) 12 crónicos de larga duración (>10 años) 30 controles sanos | SD-OCT | Grosor de la CFNR global y de 4 cuadrantes Grosor de la mácula global, en los anillos interno y externo y área central, y volumen mácula | Grosor CFNR global y en cuadrantes superior, inferior y temporal menor (p<0,05) en pacientes vs. controles Grosor CFNR global menor (p<0,05) en crónicos y crónicos de larga duración vs. controles y agudos Grosor mácula global, en los anillos interno y externo y área central, volumen mácula menor (p<0,05) en pacientes vs. controles Grosor mácula global menor (p>0,05) en crónicos y crónicos de larga duración vs. controles, y en crónicos de larga duración vs. agudos Volumen mácula menor (p<0,05) en crónicos y crónicos de larga duración vs. controles, y en crónicos de larga duración vs. agudos |
| Trastorno bipolar | |||||
| García-Martín et al.19, 2018, España | Casos y controles | 30 pacientes con TB, edad media 49,7 años y tiempo medio evolución enfermedad 16,5 años 80 controles sanos | SD-OCT | Grosor total de la retina y de las distintas capas Volumen de la retina, de la CCG, de la CPI y de la INL | Grosor total de la retina menor (p<0,005) en el anillo interior superior, nasal y temporal y en el anillo exterior superior en pacientes vs. controles Grosor peripapilar CFNR global, temporal superior, temporal y temporal inferior (p<0,005) en pacientes vs. controles Grosor CCG anillo interior superior, nasal, inferior y temporal menor (p<0,05) en pacientes vs. controles Grosor CPI en el anillo interior nasal, inferior y temporal menor (p<0,05) en pacientes vs. controles Reducción del espesor central mínimo en CPI (p<0,05) en pacientes vs. controles Grosor INL en el anillo interior superior y temporal, y en el anillo exterior superior, nasal, inferior y temporal mayor (p<0,05) en pacientes vs. controles Volumen CCG global menor (p<0,05) en pacientes vs. controles Volumen INL global superior (p<0,05) en pacientes vs. controles |
| Khalil et al.18, 2017, Egipto | Casos y controles pareados por edad y sexo | 40 pacientes con TB-I hospitalizados sin síntomas psicóticos, edad media 30,9 años y tiempo medio evolución enfermedad 7 años 40 controles sanos | SD-OCT | Grosor de la CFNR global y de 4 cuadrantes Volumen de la CCG global y superior e inferior | Grosor CFNR global y en todos los cuadrantes menos el nasal menor (p<0,05) en pacientes vs. controles Volumen CCG global en ambos ojos y superior e inferior solo en el ojo izquierdo menor (p<0,05) en pacientes vs. controles |
| Kalenderoglu et al.20, 2016, Turquía | Casos y controles | 43 pacientes con TB-I en eutimia por 6 meses, edad media 35,5 años y tiempo medio evolución enfermedad 6,8 años 43 controles sanos | SD-OCT | Grosor de la CFNR global y de 6 cuadrantes, y de la coroides Volumen de la CCG | Grosor CFNR global menor (p<0,05) en pacientes vs. controles Grosor CFNR global menor (p<0,05) en los pacientes en tratamiento con valproato vs. litio o sin ninguno de estos 2 fármacos Volumen CCG menor (p<0,05) en pacientes vs. controles |
| Mehraban et al.17, 2016, Irán | Casos y controles pareados por edad | 30 pacientes con TB, edad media 33,8 años y tiempo medio evolución enfermedad 10,6 años 30 controles sanos | 3D-OCT | Grosor de la CFNR global y de 4 cuadrantes | Grosor CFNR global y en todos los cuadrantes, menos el temporal, menor (p<0,05) en pacientes vs. controles |
| Depresión mayor | |||||
| Schöenfeldt-Lecuona et al.11, 2018, Alemania | Casos y controles pareados por edad | 28 pacientes con DM, edad media 46,9 años y tiempo medio evolución enfermedad 5,3 años 20 controles sanos | SD-OCT | Volumen total y grosor de la retina Volumen y grosor de 5 capas retinianas | No diferencias significativas en ningún parámetro entre los pacientes y los controles En los pacientes, diferencia significativa en el volumen total de la retina entre los 2 ojos |
| Sönmez et al.22, 2017, Turquía | Casos y controles pareados por edad y sexo | 30 pacientes con DM, edad media 34,5 años y tiempo medio evolución enfermedad 5,7 años 30 controles sanos | OCT | Grosor de la CFNR global y de 6 cuadrantes | No diferencias significativas en ningún parámetro entre los pacientes y los controles |
| Kalenderoglu et al.23, 2016, Turquía | Casos y controles | 50 pacientes con PE-DM y 50 pacientes con TDR, edades medias 39,1 y 40,8 años, respectivamente 50 controles sanos | SD-OCT | Grosor de la CFNR Volumen de la CCG e CPI Grosor de la coroides | Volumen CCG e CPI menor (p<0,05) en pacientes vs. controles Volumen CCG e CPI menor (p<0,05) en pacientes TDR vs. PE-DM Grosor coroides mayor (p<0,05) en pacientes vs. controles Grosor coroides mayor (p<0,05) en pacientes TDR vs. PE-DM |
| Yildiz et al.21, 2016, Turquía | Casos y controles | 58 pacientes con DM, edad media 44,6 años y tiempo medio evolución enfermedad 6,5 años 57 controles sanos | HD-OCT | Grosor de la CFNR global y de 4 cuadrantes Grosor de la GC-CPI Grosor de la mácula | No diferencias significativas en ningún parámetro entre los pacientes y los controles |
CCG: capa de las células ganglionares; CCGPI: capa de las células ganglionares y capa plexiforme interna; CFNR: capas de fibras nerviosas de la retina; CNE: capa nuclear externa; CPI: capa plexiforme interna; CSI: capa del segmento interno; D: diabetes; DM: depresión mayor; ESQ: esquizofrenia; ESQ-rT: esquizofrenia con respuesta al tratamiento; ESQ-RT: esquizofrenia resistente al tratamiento; GCIPL: ganglion cell inner plexiform layer; HD-OCT: high-domain optical coherence tomography; HTA: hipertensión arterial; OCT: optical coherence tomography; PE-DM: primer episodio de depresión mayor; SD-OCT: spectral-domain optical coherence tomography; TB: trastorno bipolar; TD-OCT: time-domain optical coherence tomography; TDR: trastorno depresivo recurrente.
Asimismo, se han descrito diferencias entre pacientes y controles a nivel de la mácula3,14,16 y del disco óptico16. En el caso de la mácula respecto a los controles sanos, los pacientes presentaban un menor grosor3,16 y volumen3,14,16 de la misma, así como un menor grosor a nivel de la fóvea y los anillos interno3,14 y externo3. Respecto a las alteraciones del disco óptico, los pacientes presentaban un mayor volumen de la excavación y una mayor ratio excavación:disco que los controles sanos16.
Trastorno bipolarLos 4 estudios publicados sobre TB encontraron una disminución marcada del grosor de la GCNR en los pacientes con TB frente a los controles sanos, difiriendo en la localización de esta alteración. Así, Mehraban et al.17 describieron una reducción marcada en los cuadrantes inferior, superior y nasal, Khalil et al.18 en los cuadrantes inferior, superior, temporal y global, García-Martín et al.19 en los cuadrantes temporal superior, temporal, temporal inferior y global, y Kalenderoglu et al.20 tan solo global. Además, Kalenderoglu et al.20, Khalil et al.18 y García-Martín et al.19 encontraron una disminución del volumen de la CCG en los pacientes con TB respecto a los controles. Estos últimos autores también encontraron una reducción del grosor del anillo interior de la CCG en los 4 cuadrantes comparado con los controles sanos. En cuanto a la IPL, García-Martín et al.19 hallaron una reducción en el anillo interior de los cuadrantes inferior, nasal y temporal, así como una reducción del espesor central mínimo en relación con los controles. Por último, los mismos autores encontraron un aumento global del volumen de la capa nuclear interior, concretamente del grosor del anillo interior en los cuadrantes superior e inferior, y del anillo exterior en los 4 cuadrantes.
Depresión mayorEn el caso de la DM, 3 de los 4 estudios publicados no obtuvieron diferencias significativas entre los pacientes y los controles sanos en ninguno de los parámetros OCT estudiados11,21,22. Tan solo Kalenderoglu et al.23 encontraron un volumen menor de la CCG y la IPL en los pacientes con DM respecto a los controles sanos y en los pacientes con múltiples episodios frente a aquellos con un único episodio.
Finalmente, Schöenfeldt-Lecuona et al.11 encontraron que en los pacientes con DM el volumen total de la retina del ojo izquierdo era significativamente mayor que el del derecho (8,72 vs. 8,69mm3, p=0,03).
Alteraciones de la coroides en los trastornos mentales graves (tabla 1)Los estudios revisados describieron alteraciones del grosor de la coroides únicamente en los pacientes con DM. En concreto, Kalenderoglu et al.23 encontraron que los pacientes con DM mostraban un grosor mayor de la coroides respecto a los controles sanos, al igual que los pacientes con múltiples episodios frente a los que habían tenido un único episodio.
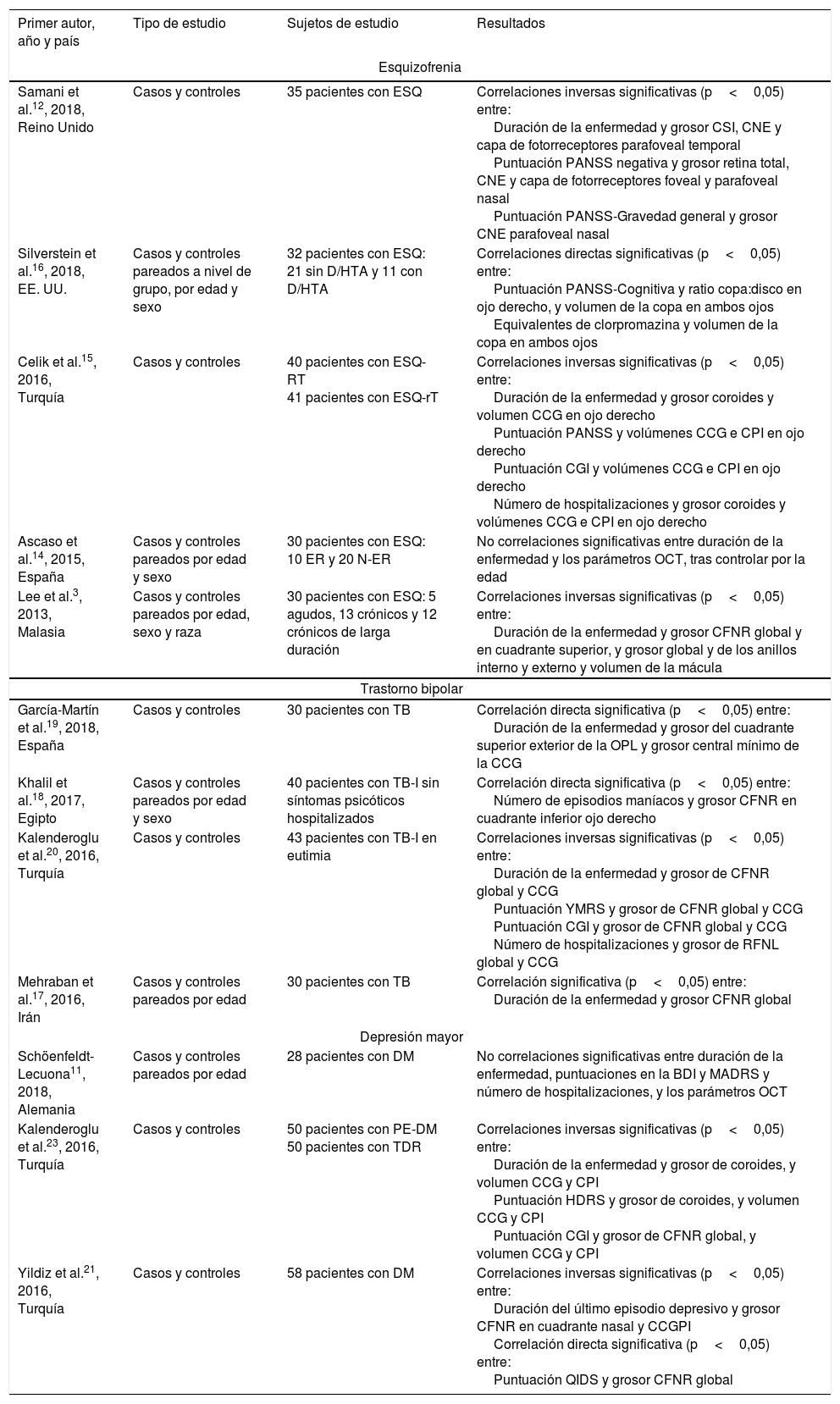
Correlación entre las alteraciones oculares y las dimensiones clínicas (tabla 2)EsquizofreniaEn cuanto al impacto del tiempo de evolución de la enfermedad en estos parámetros, Lee et al.3 demostraron una disminución del grosor de la GCNR global en los pacientes con más de 2 años de evolución de la enfermedad comparado con los pacientes con menos de 2 años de evolución y los controles. Además, en los pacientes con un episodio no reciente (definido como>6 meses desde el último episodio) encontraron reducciones significativas del grosor de la GCNR global y de los cuadrantes superior, inferior y nasal, y del anillo interno de la mácula, así como del volumen macular respecto a los controles14. Asimismo, observaron un adelgazamiento en el anillo interno de la mácula3,14 y una disminución del volumen macular3,14 en los estadios avanzados de la enfermedad comparado con los sujetos control.
Correlaciones entre los parámetros de la tomografía de coherencia óptica y las características clínicas de la enfermedad
| Primer autor, año y país | Tipo de estudio | Sujetos de estudio | Resultados |
|---|---|---|---|
| Esquizofrenia | |||
| Samani et al.12, 2018, Reino Unido | Casos y controles | 35 pacientes con ESQ | Correlaciones inversas significativas (p<0,05) entre: Duración de la enfermedad y grosor CSI, CNE y capa de fotorreceptores parafoveal temporal Puntuación PANSS negativa y grosor retina total, CNE y capa de fotorreceptores foveal y parafoveal nasal Puntuación PANSS-Gravedad general y grosor CNE parafoveal nasal |
| Silverstein et al.16, 2018, EE. UU. | Casos y controles pareados a nivel de grupo, por edad y sexo | 32 pacientes con ESQ: 21 sin D/HTA y 11 con D/HTA | Correlaciones directas significativas (p<0,05) entre: Puntuación PANSS-Cognitiva y ratio copa:disco en ojo derecho, y volumen de la copa en ambos ojos Equivalentes de clorpromazina y volumen de la copa en ambos ojos |
| Celik et al.15, 2016, Turquía | Casos y controles | 40 pacientes con ESQ-RT 41 pacientes con ESQ-rT | Correlaciones inversas significativas (p<0,05) entre: Duración de la enfermedad y grosor coroides y volumen CCG en ojo derecho Puntuación PANSS y volúmenes CCG e CPI en ojo derecho Puntuación CGI y volúmenes CCG e CPI en ojo derecho Número de hospitalizaciones y grosor coroides y volúmenes CCG e CPI en ojo derecho |
| Ascaso et al.14, 2015, España | Casos y controles pareados por edad y sexo | 30 pacientes con ESQ: 10 ER y 20 N-ER | No correlaciones significativas entre duración de la enfermedad y los parámetros OCT, tras controlar por la edad |
| Lee et al.3, 2013, Malasia | Casos y controles pareados por edad, sexo y raza | 30 pacientes con ESQ: 5 agudos, 13 crónicos y 12 crónicos de larga duración | Correlaciones inversas significativas (p<0,05) entre: Duración de la enfermedad y grosor CFNR global y en cuadrante superior, y grosor global y de los anillos interno y externo y volumen de la mácula |
| Trastorno bipolar | |||
| García-Martín et al.19, 2018, España | Casos y controles | 30 pacientes con TB | Correlación directa significativa (p<0,05) entre: Duración de la enfermedad y grosor del cuadrante superior exterior de la OPL y grosor central mínimo de la CCG |
| Khalil et al.18, 2017, Egipto | Casos y controles pareados por edad y sexo | 40 pacientes con TB-I sin síntomas psicóticos hospitalizados | Correlación directa significativa (p<0,05) entre: Número de episodios maníacos y grosor CFNR en cuadrante inferior ojo derecho |
| Kalenderoglu et al.20, 2016, Turquía | Casos y controles | 43 pacientes con TB-I en eutimia | Correlaciones inversas significativas (p<0,05) entre: Duración de la enfermedad y grosor de CFNR global y CCG Puntuación YMRS y grosor de CFNR global y CCG Puntuación CGI y grosor de CFNR global y CCG Número de hospitalizaciones y grosor de RFNL global y CCG |
| Mehraban et al.17, 2016, Irán | Casos y controles pareados por edad | 30 pacientes con TB | Correlación significativa (p<0,05) entre: Duración de la enfermedad y grosor CFNR global |
| Depresión mayor | |||
| Schöenfeldt-Lecuona11, 2018, Alemania | Casos y controles pareados por edad | 28 pacientes con DM | No correlaciones significativas entre duración de la enfermedad, puntuaciones en la BDI y MADRS y número de hospitalizaciones, y los parámetros OCT |
| Kalenderoglu et al.23, 2016, Turquía | Casos y controles | 50 pacientes con PE-DM 50 pacientes con TDR | Correlaciones inversas significativas (p<0,05) entre: Duración de la enfermedad y grosor de coroides, y volumen CCG y CPI Puntuación HDRS y grosor de coroides, y volumen CCG y CPI Puntuación CGI y grosor de CFNR global, y volumen CCG y CPI |
| Yildiz et al.21, 2016, Turquía | Casos y controles | 58 pacientes con DM | Correlaciones inversas significativas (p<0,05) entre: Duración del último episodio depresivo y grosor CFNR en cuadrante nasal y CCGPI Correlación directa significativa (p<0,05) entre: Puntuación QIDS y grosor CFNR global |
BDI: Beck Depression Inventory; CCG: capa de las células ganglionares; CCGPI: capa de las células ganglionares y capa plexiforme interna; CFNR: capas de fibras nerviosas de la retina; CGI: Clinical Global Impression Scale; CNE: capa nuclear externa; CPI: capa plexiforme interna; CSI: capa del segmento interno; D: diabetes; DM: depresión mayor; ER: episodio reciente (en el último mes); ESQ: esquizofrenia; ESQ-rT: esquizofrenia con respuesta al tratamiento; ESQ-RT: esquizofrenia resistente al tratamiento; HD-OCT: high-domain optical coherence tomography; HDRS: Hamilton Depression Rating Scale; HTA: hipertensión arterial; MADRS: Montgomery-Asberg Depression Rating Scale; N-ER: no episodio reciente (estable y sin episodios en los últimos 6 meses); OCT: optical coherence tomography; OPL: capa plexiforme externa; PANSS: Positive and Negative Syndrome Scale; PE-DM: primer episodio de depresión mayor; QIDS: Quick Inventory of Depressive Symptomatology; SD-OCT: spectral-domain optical coherence tomography; TB: trastorno bipolar; TD-OCT: time-domain optical coherence tomography; TDR: trastorno depresivo recurrente; YMRS: Young Mania Rating Scale.
Respecto a la relación entra las distintas dimensiones psicopatológicas de la ESQ y los cambios en la arquitectura de la retina, Samani et al.12 obtuvieron una correlación inversa, moderada y significativa entre la gravedad de los síntomas negativos de la ESQ y el grosor de las capas de fotorreceptores (r=−0,54) y nuclear externa (r=−0,47) en la fóvea. Los síntomas cognitivos, por su parte, se relacionaron con un aumento del volumen de la excavación en ambos ojos (izquierdo, r=0,48; derecho, r=0,45) y de la relación excavación:disco óptico en el ojo derecho (r=0,41)16. Estos mismos autores encontraron también una correlación directa y significativa entre la dosis de antipsicóticos (equivalentes de clorpromazina) y el volumen de la excavación en ambos ojos (izquierdo, r=0,41; derecho, r=0,38).
Finalmente, los pacientes con ESQ refractaria al tratamiento, comparados con aquellos otros con una respuesta adecuada, mostraron una disminución mayor del volumen de la CCG y de la IPL15.
Trastorno bipolarEn el TB, el tiempo de evolución de la enfermedad correlacionaba significativa e inversamente con el grosor de la GCNR global (r=−0,25020, valor de la r no proporcionado17) y de la CCG (r=−0,466)20, y directamente con el espesor central mínimo de la CCG (r=0,70)19 y el grosor del cuadrante superior exterior de la capa plexiforme externa (r=0,49)19. Además, el número de episodios maníacos correlacionaba significativa y directamente con el grosor de GCNR en el cuadrante inferior del ojo derecho (r=0,335)18.
En cuanto a la gravedad clínica, Khalenderoglu et al.20 demostraron correlaciones inversas y significativas entre las puntuaciones en la Young Mania Rating Scale y en la Clinical Global Impression Scale (CGI), y el número de hospitalizaciones con el grosor de la GCNR global (r=−0,265, −0,280 y −0,232, respectivamente) y de la CCG (r=−0,407, −0,456 y −0,431, respectivamente).
Depresión mayorEn relación con el tiempo de evolución de la enfermedad, se ha descrito una correlación inversa y significativa con el volumen de las capas CCG e IPL (r=−0,247 y −0,252, respectivamente) y con el grosor de la coroides (r=−0,329)23. También se ha descrito una correlación inversa entre la duración del último episodio depresivo y el grosor de la GCNR en el cuadrante nasal (r=−0,31) y de GCIPL (r=−0,32)21.
Asimismo, se encontraron correlaciones significativas entre la gravedad clínica de la depresión y los parámetros OCT. Así, las puntuaciones en la Hamilton Depression Rating Scale correlacionaban inversa y significativamente con el volumen de CCG e IPL (r=−0,200 y −0,221, respectivamente) y con el grosor de la coroides (r=−0,180)23, mientras que las puntuaciones en el Quick Inventory of Depressive Symptomatology-Self Report lo hacían de forma directa con el grosor total de la GCNR (r=0,28). Por otra parte, las puntuaciones en la CGI correlacionaban inversa y significativamente con los volúmenes de CCG e IPL (r=−0,248 y −0,268, respectivamente), pero con el grosor global de la GCNR (r=−0,162) en lugar de la coroides23.
Finalmente, la toma de antipsicóticos se asociaba significativamente con un menor volumen de CCG e IPL23.
DiscusiónTal como se ha descrito en los resultados, son escasos los estudios con OCT en los trastornos mentales tales como ESQ, TB y DM, al contrario que en la demencia o en enfermedades neurológicas como la enfermedad de Parkinson. Además, los resultados obtenidos son en ocasiones discordantes, e incluso contradictorios.
De todos los parámetros retinianos evaluados, el grosor de la GCNR es sin duda el que ha proporcionado más hallazgos significativos en los 3 trastornos mentales revisados. Con la excepción de un estudio16, todos los realizados en pacientes con ESQ o TB demuestran un adelgazamiento significativo respecto a los controles sanos, mientras que ninguno de los 4 estudios realizados en DM encuentra alteraciones significativas. Estas diferencias entre los 3 trastornos podrían indicar que la DM, al contrario que la ESQ y el TB, no está asociada a una alteración de la vía magnocelular, tal como señalan Sönmez et al.22. Sin embargo, de acuerdo con la hipótesis de la neurodegeneración y la capacidad de la OCT para identificarla, cabría pensar que las diferencias están en relación con el tiempo de evolución de la enfermedad más que con el trastorno en sí, ya que el tiempo de evolución de los pacientes con DM (de 5,5 a 6,5 años en los 4 estudios) era mucho menor que el tiempo de evolución de los pacientes con TB (en 3 estudios entre 7 y 10 años y tan solo en un estudio mayor de 10 años –concretamente 16,5 años?) y, sobre todo, que el de los pacientes con ESQ (entre 12 y 16 años). En los pacientes con ESQ, Lee et al.3 y Ascaso et al.14 obtuvieron hallazgos en este mismo sentido, lo que reforzaría la hipótesis de que las alteraciones retinianas serían la expresión de la neurodegeneración progresiva de la enfermedad. Así, demostraron que el adelgazamiento era a expensas de los pacientes crónicos de larga duración (>10 años de evolución) y crónicos (>2-10 años) frente a los agudos (≤2 años) y controles sanos3, y que se daba en los pacientes con un episodio no reciente (sin episodios en los últimos 6 meses) frente a los pacientes con un episodio reciente (último mes) y los controles sanos14.
Otras capas retinianas que han proporcionado resultados significativos son la CCG y la IPL. En este caso, se obtienen diferencias significativas respecto a los controles en los 3 trastornos estudiados, si bien la consistencia de los hallazgos es baja. El grosor/volumen de la CCG es significativamente menor respecto a controles en 2 de los 6 estudios en ESQ12,15, en 3 de los 4 estudios en TB18–20 y en uno de los 4 estudios en DM23. Además, la IPL también presentaba un menor volumen en la ESQ15, en el TB19 y en la DM23. El hecho de que las alteraciones de la CCG-IPL sean más acusadas que las de la GCNR en el TB20 y que sean las únicas alteraciones retinianas descritas en la DM23 apoyaría la hipótesis de González-López et al.24 de que la CCG-IPL sería más sensible que la GCNR para detectar alteraciones en la estructura de la retina, teniendo en cuenta los hallazgos obtenidos en pacientes con esclerosis múltiple. Además, el menor tiempo de evolución de la enfermedad en el caso de la DM y el TB respecto a la ESQ apoyaría también la hipótesis de la neuroprogresión, de tal manera que en los pacientes con menor tiempo de evolución solo aparecerían alteraciones en la CCG-IPL, que irían progresando hasta alcanzar la GCNR. En este sentido, Kalenderoglu et al.23 describieron un menor volumen en ambas capas en los pacientes con múltiples episodios de depresión frente a los pacientes con un único episodio. Por otra parte, Silverstein et al.16, que no encontraron diferencias significativas entre pacientes y controles, sí las encuentran entre el subgrupo de pacientes con diabetes o hipertensión arterial frente al subgrupo de controles que no las presentan. Estos autores, a diferencia de la mayor parte de los estudios realizados, incluyeron un subgrupo de pacientes y controles con diabetes o hipertensión arterial sin afectación retiniana identificable, para dilucidar si las alteraciones descritas en los estudios se debían realmente al trastorno mental o podían deberse a estas enfermedades sistémicas con un conocido impacto ocular y frecuentemente comórbidas con la ESQ. Sus resultados evidencian que las alteraciones retinianas se deberían más a la presencia de diabetes o hipertensión que a la ESQ, si bien es necesario señalar que el grupo de pacientes con diabetes e hipertensión tenía significativamente más edad que los pacientes y los controles sin diabetes o hipertensión. Finalmente, respecto al impacto del tratamiento farmacológico en estas 2 capas (CCG e IPL), se encontró un menor volumen de ambas en los pacientes con ESQ resistentes al tratamiento respecto a los respondedores15, y en los pacientes con DM en tratamiento con antipsicóticos frente a los que no los tomaban23, mostrando estos resultados una relación entre la refractariedad a los fármacos en ambos trastornos y una mayor neurodegeneración.
El impacto de los psicofármacos en las alteraciones retinianas encontradas es un tema controvertido que necesita estudios en mayor profundidad. Si bien se ha planteado que podrían explicarse por el bloqueo dopaminérgico de los antipsicóticos16 o por su efecto serotoninérgico y su impacto en la presión intraocular25, es necesario señalar que el valproato, sin estos mecanismos de acción, se ha asociado también a un menor grosor de la GCNR y no el litio20.
Alteraciones en el grosor de la coroides han sido descritas de forma muy puntual y con datos controvertidos. Mientras que el estudio en ESQ no encuentra diferencias entre pacientes y controles15, en la DM Kalederoglu et al.23 describieron un engrosamiento de esta capa en los pacientes frente a los controles, hecho que atribuyeron al estado inflamatorio que caracteriza la enfermedad activa. Contrarios en cierto modo a esta hipótesis son los resultados de Celik et al.15, quienes, a pesar de que la ESQ resistente se ha asociado con una inflamación periférica crónica de bajo grado26, encontraron un adelgazamiento de esta capa en los pacientes con ESQ resistentes al tratamiento frente a los que responden a este.
La relación entre las alteraciones oculares y los parámetros clínicos es muy variada y ha sido poco replicada en los distintos estudios, con la excepción del tiempo de evolución de la enfermedad. En todos los trastornos, y en gran parte de los estudios de cada trastorno, se ha descrito una relación directa entre el tiempo de evolución de la enfermedad y las alteraciones retinianas descritas, apoyando la hipótesis de la neuroprogresión de estos trastornos mentales. En el caso de la ESQ, se han descrito también correlaciones, en el sentido esperado, entre las puntuaciones en la Positive and Negative Syndrome Scale negativa y general12, la Positive and Negative Syndrome Scale cognitiva16, la Positive and Negative Syndrome Scale y la CGI-G15 con diferentes alteraciones retinianas. Además, los equivalentes de clorpromazina16 y el número de hospitalizaciones correlacionaban en el sentido esperado con el volumen de la copa óptica en ambos ojos, y el grosor de la coroides y volúmenes IPL y CCG en el ojo derecho, respectivamente. En el caso del TB, solo un estudio de los 320 encuentra correlaciones directas entre la gravedad psicopatológica (puntuaciones en la Young Mania Rating Scale y en la CGI) y las alteraciones retinianas (grosor de la GCNR y la CCG). Sin embargo, otros índices de gravedad del trastorno, como son el número de hospitalizaciones20 y el número de episodios maníacos18, se han asociado también con el grosor de la GCNR y la CCG, y de la GCNR, respectivamente. Sin embargo, es necesario señalar que, en el caso del número de episodios maníacos, la correlación no ha sido en el sentido esperado, es decir, a mayor número de episodios maníacos mayor grosor de la GCNR, sin que los autores18 den una explicación plausible a este hallazgo. Finalmente, en la DM los resultados descritos son contradictorios; mientras que una mayor gravedad clínica heteroevaluada (puntuaciones en la Hamilton Depression Rating Scale y la CGI) se ha asociado con un adelgazamiento de las estructuras retinianas23, una mayor gravedad clínica autoevaluada (puntuaciones en el Quick Inventory of Depressive Symptomatology) se ha asociado con un engrosamiento de la GCNR21.
A la hora de valorar los hallazgos descritos anteriormente es necesario tener en cuenta las limitaciones metodológicas importantes que presentan los estudios revisados. Las limitaciones tienen que ver, en primer lugar, con la muestra objeto de estudio, tanto el tamaño como la selección de los pacientes, el emparejamiento con los sujetos controles, y los criterios de inclusión y exclusión son cuestionables y diferentes de unos estudios a otros. En la mayor parte de los estudios el tamaño de la muestra oscila entre 30 y 50 sujetos por grupo, pero en algunos casos los grupos se subdividen y analizan en función de algún criterio (por ejemplo, con/sin diabetes/hipertensión arterial, agudos vs. crónicos vs. crónicos de larga duración, etc.), lo que aminora todavía más el tamaño muestral y el poder estadístico. Muy importante es el tiempo de evolución de la enfermedad, que como se ha visto al comparar los resultados de los 3 trastornos revisados, puede tener un valor fundamental a la hora de interpretar los resultados. Algo similar sucede con el estadio y la evolución de la enfermedad (agudos vs. crónicos y episodios únicos vs. múltiples episodios). Además, en el caso del TB, dada su naturaleza compleja, la heterogeneidad de los pacientes es un factor crítico a controlar. El emparejamiento entre pacientes y controles no siempre existe y no siempre es a nivel individual. En los estudios más recientes los criterios de inclusión y exclusión de los sujetos son más estrictos y numerosos que en los estudios iniciales, y el hecho de incluir pacientes con comorbilidades somáticas sin afectación clínica oftalmológica identificable16 cuestiona algunos de los resultados obtenidos en la ESQ hasta ese momento. En lo que respecta a la técnica, nuevamente los estudios más recientes utilizan técnicas de dominio espectral mejorando la capacidad de detección de anomalías respecto a los estudios previos que utilizaban OCT de dominio temporal. Por otra parte, es necesario considerar que las discrepancias en los hallazgos pueden deberse en parte a la no homologación de los aparatos utilizados. Finalmente, en cuanto a la estadística, la mayor parte de los estudios, especialmente los más antiguos, no controlan por variables posiblemente confusoras como son la edad, el tiempo de evolución de la enfermedad y otros factores que puedan interferir en los resultados obtenidos. A pesar de ser numerosas las limitaciones que señalamos, se trata de limitaciones frecuentes que se dan comúnmente en los estudios pioneros en una nueva técnica o intervención, y que a medida que avanza el conocimiento se van superando.
Entre las limitaciones del presente trabajo cabe señalar que la única fuente de información fue PubMed. No obstante, esto fue debido a que la búsqueda realizada en PsycINFO no añadió nuevos estudios. Por otra parte, aunque la falta de análisis estadísticos podría ser considerada otra limitación, los estudios para cada trastorno son muy limitados y sobre áreas ópticas muy diversas como para llevar a cabo un metaanálisis de los resultados.
En resumen, los resultados de los estudios con OCT en los pacientes con trastornos mentales graves apoyan la existencia de un gradiente de neurodegeneración en dichos trastornos, siendo más numerosas y consistentes las alteraciones retinianas en la ESQ y en el TB. La falta de hallazgos en este sentido en la DM puede deberse, bien al menor tiempo de evolución de los pacientes estudiados, lo que apoyaría la hipótesis de la neuroprogresión, bien a una no degeneración o a una incapacidad de la OCT para identificarla en este trastorno. Por otra parte, el hecho de que uno de los estudios haya identificado alteraciones en CCG e IPL, capas que han demostrado una mayor sensibilidad en enfermedades como la esclerosis múltiple, apoyaría también la neuroprogresión en estos 3 trastornos mentales. Finalmente, con la excepción del tiempo de evolución de la enfermedad, no parece que los hallazgos retinianos marquen aspectos psicopatológicos o clínicos diferenciales en cada uno de estos trastornos.
Teniendo en cuenta lo anteriormente señalado, los hallazgos de la OCT son esperanzadores, ya que podrían proporcionar biomarcadores de la neurodegeneración y/o neuroprogresión tanto de la ESQ como del TB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.