En los últimos años ha habido un aumento en los estudios sobre las implicaciones de la microbiota intestinal (MI) en niños con trastorno del espectro autista (TEA). La hipótesis es que existe una posible relación entre el estado emocional, la abundancia y/o la proporción de diferentes colonias bacterianas intestinales, aunque no haya cambios en la cantidad total, a través del llamado eje microbiota-intestino-cerebro. En este sentido, la MI disbiótica podría ser un factor que contribuye a la aparición del TEA. En este artículo de revisión sistemática se analizan los resultados de la intervención mediante prebióticos (polvo de zanahoria, vitamina A, goma guar parcialmente hidrolizada, galactooligosacáridos, etc.), probióticos (fundamentalmente: Lactobacillus, Bifidobacterium, etc.) y trasplante de microbiota fecal en niños con TEA. En general, los resultados de los estudios iniciales sugieren cambios en los síntomas TEA, síntomas gastrointestinales y composición de la MI intestinal tras las intervenciones. Sin embargo, los resultados deben tomarse con cautela dado que son muy pocos los estudios que analizan la eficacia de los tratamientos a largo plazo y las diferentes combinaciones de los mismos.
In recent years, there has been an increase in studies of the implications of the gut microbiota (GM) in children with autism spectrum disorder (ASD). There is a hypothesis which propose a relationship between the emotional state and the abundance of intestinal microbes through the so-called microbiota-intestine-brain axis. In this sense, dysbiotic GM could be a contributing factor to the appearance of ASD. This systematic review article analyzes the results of the intervention using prebiotics (carrot powder, vitamin A, partially hydrolyzed guar gum, galactooligosaccharides, etc.), probiotics (mainly: Lactobacillus, Bifidobacterium, etc.) and transplantation of fecal microbiota in ASD children. In conclusion, the results of the initial studies suggest changes in ASD symptoms, gastro-intestinal symptoms and GM composition after the interventions. However, the results should be taken with caution because there are very few studies that analyze the efficacy of long-term treatments and the different combinations of them.
El trastorno del espectro autista (TEA) es un trastorno del neurodesarrollo caracterizado por los déficits en la comunicación social e interacción social y los patrones repetitivos y restringidos1.
Diversos estudios señalan que los niños con TEA pueden presentar problemas con la alimentación. Concretamente, puede haber una mayor sensibilidad a ciertos alimentos2 y como consecuencia pueden tener una ingesta significativamente más baja de calcio y proteínas3. Por otra parte, hay una mayor prevalencia de síntomas gastrointestinales tales como diarrea, estreñimiento y dolor abdominal en niños con TEA comparados con otros niños sanos4. Una de las explicaciones de estos síntomas gastrointestinales y de la propia etiología del TEA es la propuesta por la hipótesis del eje microbiota-intestino-cerebro. Esta hipótesis se basa en un modelo explicativo que intenta relacionar la sintomatología del TEA, los hallazgos en la neurociencia y la bacteriología. El eje microbiota-intestino-cerebro se define como un sistema de comunicación bidireccional entre las vías neuronales, inmunes, endocrinas y metabólicas. La literatura científica reciente ha intentado determinar si existe un grupo de bacterias implicadas directamente en el TEA o si existe disbiosis general en la microbiota intestinal (MI) de los niños con TEA5. La disbiosis es una alteración del equilibrio microbiano de la MI normal que puede ser debida a cambios cuantitativos o cualitativos en su composición y/o cambios en las actividades metabólicas y distribución6. La abundancia de bacterias en el tracto gastrointestinal (GI) varía aproximadamente desde 108 unidades formadoras de colonias (UFC) por gramo medidas en íleon hasta 1011 UFC/g medidas en heces7, siendo Bacteroidetes, Firmicutes, Proteobacterias, Actinobacterias y Fusobacterias los principales filos bacterianos encontrados en el tracto GI de los mamíferos8. Actualmente, la caracterización de la MI se lleva a cabo, en gran medida, utilizando técnicas independientes de cultivo como la secuenciación masiva de genes 16S ARN ribosomal a través de la reacción en cadena de la polimerasa (PCR), ya que permiten identificar fácilmente una gran proporción y diversidad de bacterias, y proporcionan resultados rápidos9,10.
Sin embargo, pese a los diversos estudios publicados recientemente sobre el tema, aún se desconoce la etiología de los problemas nutricionales y gastrointestinales de niños con TEA4,11, y todo parece indicar que es una conjunción de diversos factores asociados5,12,13.
Aunque el estudio de la MI en el TEA es relativamente reciente, en los últimos años se han publicado estudios de intervención basados en la utilización de prebióticos, probióticos y terapia de transferencia de microbiota o Microbiota Transfer Therapy (MTT, por sus siglas en inglés). Los prebióticos son ingredientes de la comida no digeribles tales como almidón resistente, polisacáridos no almidonados, oligosacáridos, galactooligosacáridos y xilooligosacáridos, que son utilizados por la MI. Se trata, por lo tanto, de alimentos funcionales que estimulan el crecimiento de una o varias cepas bacterianas que habitan el tracto GI, modificando su composición y actividad, logrando así una mejora en la salud y el bienestar del huésped14. Los probióticos son microorganismos vivos no patógenos, que afectan beneficiosamente la salud humana, cuando se administran, en forma adecuada, cantidades como ingrediente alimentario o suplemento. Los probióticos utilizados habitualmente son las especies de Lactobacillus y Bifidobacterium, Saccharomyces cerevisiae y algunas especies de E. coli y Bacillus15. La MTT es una técnica donde se transfiere la MI de un donante sano a un receptor que tiene síntomas gastrointestinales y se puede realizar mediante colonoscopia, enema, sonda orogástrica o por vía oral en forma de cápsula16.
Existe gran interés dentro de la comunidad científica y profesional sobre las implicaciones que tiene este tipo de intervenciones en los síntomas del TEA. En este sentido, se pretende responder a la pregunta de si este tipo de intervenciones ayudaría a mejorar la calidad de vida de los niños que tienen TEA. En concreto, se pretende conocer el alcance de este tipo de intervenciones en: 1) la estabilización de la disbiosis en ciertas bacterias; 2) la reducción de los síntomas gastrointestinales, y 3) la reducción de los síntomas de malestar emocional en niños con TEA.
ObjetivoEl objetivo del presente estudio es realizar una revisión sistemática de los efectos psicobiológicos de los probióticos, prebióticos y la MTT en niños que tienen TEA.
MétodoLa metodología de búsqueda se realizó siguiendo el protocolo Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA)17. Los términos seleccionados para la realización de las búsquedas bibliográficas fueron: (autism* OR asd* OR «autism spectrum disorder» OR autistic*) AND (probiotic* OR «probiotic* therapy» OR prebiotic* OR «prebiotic* therapy» OR «fecal microbiota transplantation» OR «microbiota transfer therapy»). La búsqueda bibliográfica se realizó en varias bases de datos y motores de búsqueda (Scopus, Web of Science, Pubmed y PsycINFO) para artículos publicados hasta enero de 2020. Las búsquedas realizadas en las 4 bases de datos incluían todos los términos en el campo más amplio posible. Los resultados arrojados por las bases de datos fueron cruzados con el programa informático EndNote X7 para detectar posibles duplicados. Los criterios de inclusión fueron: 1) estudios con población humana con TEA; 2) artículos publicados en revistas con índice de impacto, y 3) estudios que relacionen la MI y el efecto de los probióticos, los prebióticos y el trasplante de microbiota fecal en niños con TEA. Los criterios de exclusión fueron: 1) revisiones descriptivas y revisiones sistemáticas; 2) artículos publicados en lengua no inglesa; 3) capítulos de libro o libros; 4) material editorial, cartas al editor y abstracts sin datos significativos; 5) pequeñas encuestas; 6) casos n=1; 7) efectos de los probióticos, los prebióticos y el trasplante de microbiota fecal en niños con otros trastornos mentales, y 8) artículos sobre patentes.
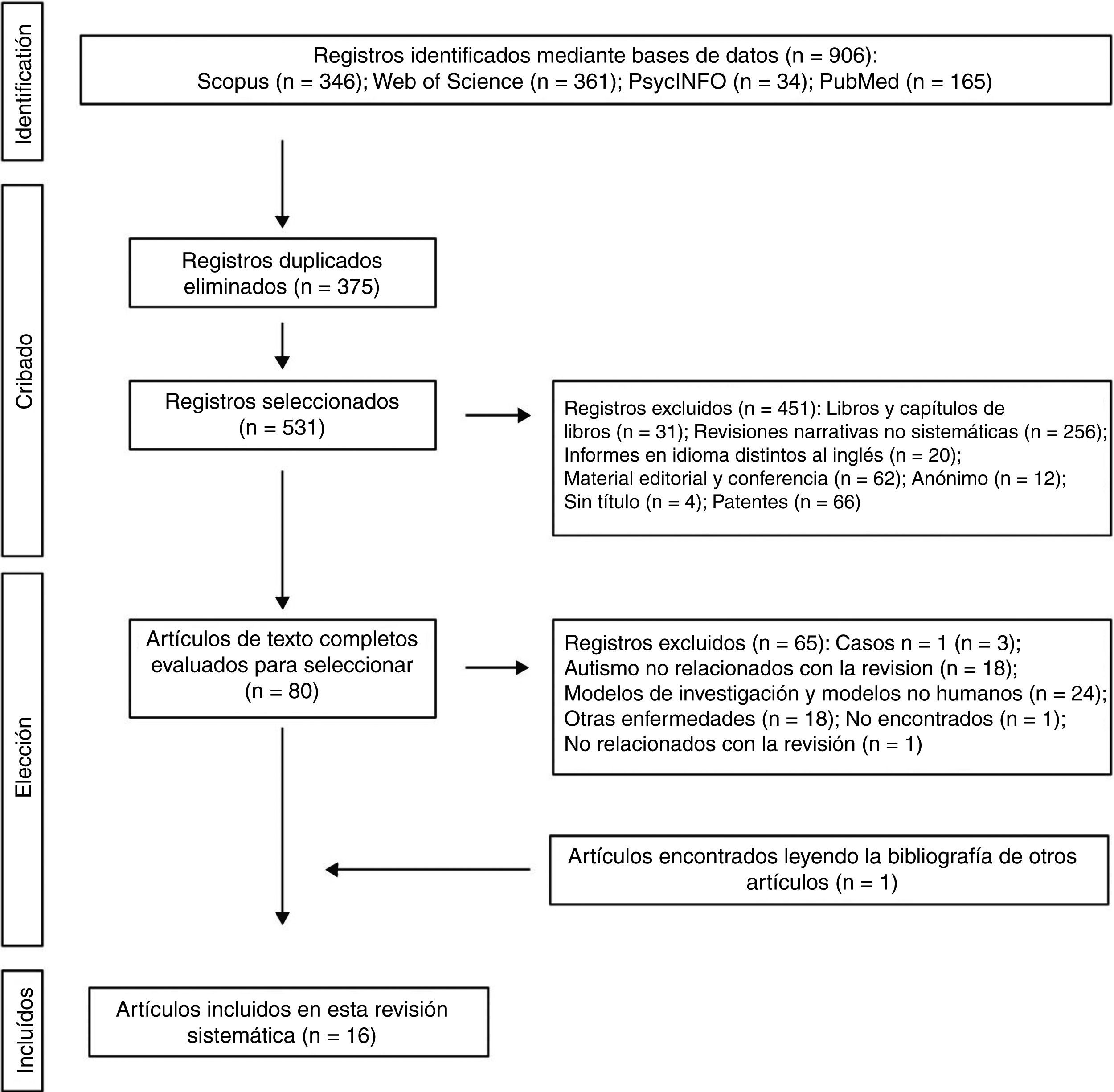
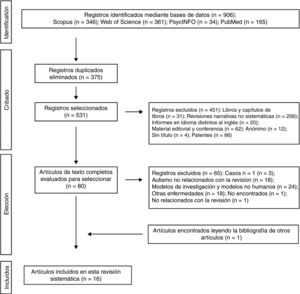
Los 2 autores de la presente revisión sistemática formaron el equipo de revisión con el fin de implementar medidas para minimizar los errores aleatorios y el sesgo en todas las etapas de revisión. También seleccionaron de forma independiente los títulos, los resúmenes y los textos completos de los artículos para su posible inclusión. Los desacuerdos sobre si un artículo debía incluirse o no se resolvieron mediante discusión. En la figura 1 se muestra el diagrama de flujo de 4 niveles para el método PRISMA utilizado en esta revisión sistemática. En primer lugar, se identificaron las referencias encontradas a través de la búsqueda en las bases de datos. En segundo lugar, se eliminaron aquellos trabajos que se habían rescatado por duplicado y se depuraron las 4 bases de datos con la selección de las publicaciones tipo artículo. En tercer lugar, tras revisar los resúmenes de cada uno de los artículos restantes, se eligieron aquellos que tenían relación con la temática del estudio. Los trabajos completos fueron descargados de diferentes páginas que ofrecen la posibilidad de realizar descargas de los mismos. Aquellos trabajos que no se pudieron obtener por esta vía, se solicitaron por e-mail a los autores. En el diseño de la presente revisión sistemática también se siguió el proceso de eliminación de documentos no relevantes según las directrices de PRISMA17, y otros autores que proponen una tabulación descriptiva de los resultados de los estudios5,13,18 (fig. 1). Es de destacar que algunas de las publicaciones descartadas pueden pertenecer a más de un grupo de eliminación, pero la decisión final fue tomada por consenso por los autores. Una vez obtenidos el número de estudios incluidos para esta revisión se inició la evaluación de la calidad de los mismos consistente en evaluar los riegos de sesgo de cada uno de los estudios, siguiendo el modelo publicado en estudios anteriores5,13 (tablas 1 y 2).
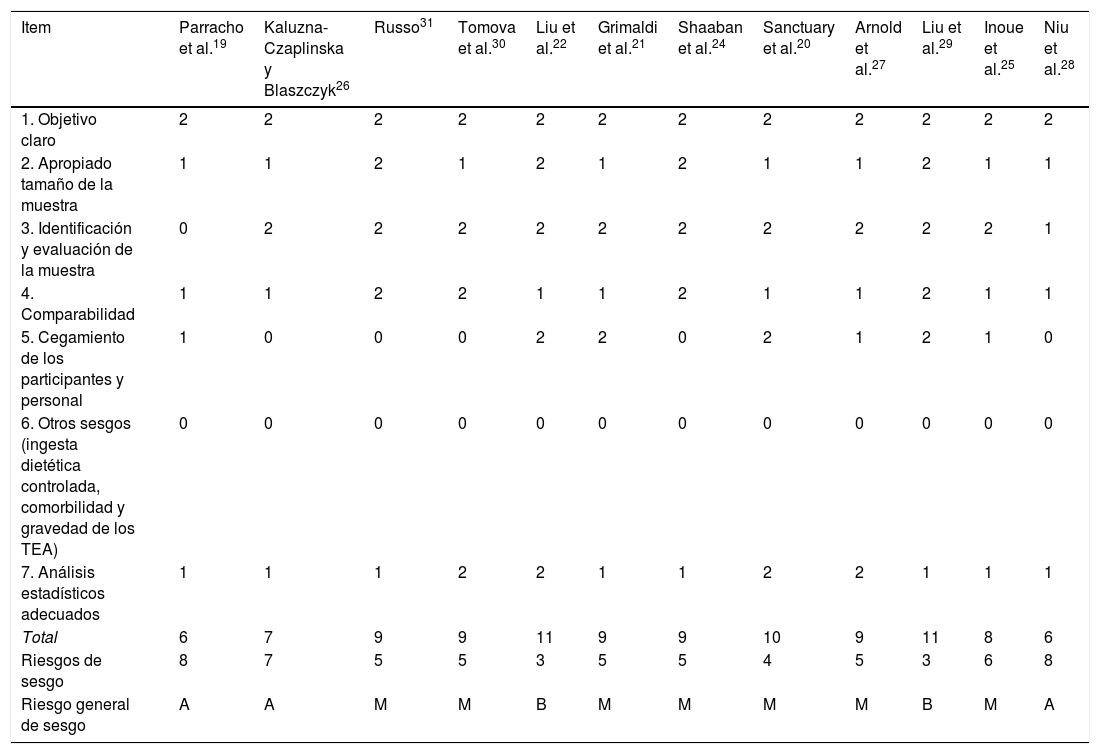
Riesgo de sesgo para la calidad metodológica de los estudios en prebiótico y probióticos para el TEA
| Item | Parracho et al.19 | Kaluzna-Czaplinska y Blaszczyk26 | Russo31 | Tomova et al.30 | Liu et al.22 | Grimaldi et al.21 | Shaaban et al.24 | Sanctuary et al.20 | Arnold et al.27 | Liu et al.29 | Inoue et al.25 | Niu et al.28 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. Objetivo claro | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| 2. Apropiado tamaño de la muestra | 1 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 1 | 2 | 1 | 1 |
| 3. Identificación y evaluación de la muestra | 0 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 1 |
| 4. Comparabilidad | 1 | 1 | 2 | 2 | 1 | 1 | 2 | 1 | 1 | 2 | 1 | 1 |
| 5. Cegamiento de los participantes y personal | 1 | 0 | 0 | 0 | 2 | 2 | 0 | 2 | 1 | 2 | 1 | 0 |
| 6. Otros sesgos (ingesta dietética controlada, comorbilidad y gravedad de los TEA) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7. Análisis estadísticos adecuados | 1 | 1 | 1 | 2 | 2 | 1 | 1 | 2 | 2 | 1 | 1 | 1 |
| Total | 6 | 7 | 9 | 9 | 11 | 9 | 9 | 10 | 9 | 11 | 8 | 6 |
| Riesgos de sesgo | 8 | 7 | 5 | 5 | 3 | 5 | 5 | 4 | 5 | 3 | 6 | 8 |
| Riesgo general de sesgo | A | A | M | M | B | M | M | M | M | B | M | A |
TEA: trastorno del espectro autista.
Nota: 0: no informado; 1: no evaluado adecuadamente o claramente; 2: evaluado adecuadamente.
M: medio (8-10); B: bajo (11-14); A: alto (7-1).
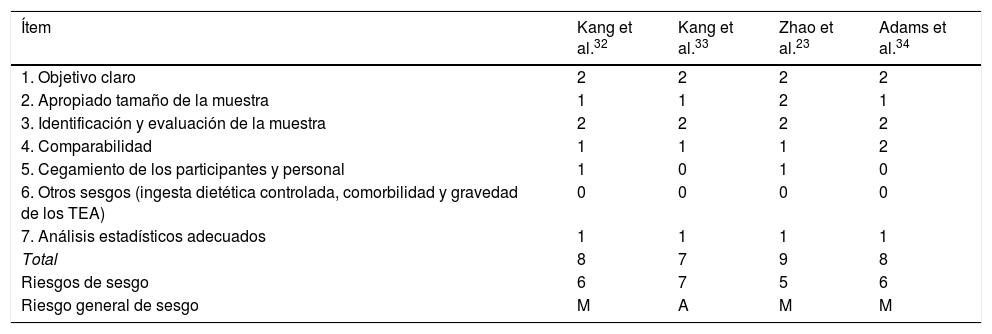
Riesgo de sesgo para la calidad metodológica de los estudios sobre MMT en el TEA
| Ítem | Kang et al.32 | Kang et al.33 | Zhao et al.23 | Adams et al.34 |
|---|---|---|---|---|
| 1. Objetivo claro | 2 | 2 | 2 | 2 |
| 2. Apropiado tamaño de la muestra | 1 | 1 | 2 | 1 |
| 3. Identificación y evaluación de la muestra | 2 | 2 | 2 | 2 |
| 4. Comparabilidad | 1 | 1 | 1 | 2 |
| 5. Cegamiento de los participantes y personal | 1 | 0 | 1 | 0 |
| 6. Otros sesgos (ingesta dietética controlada, comorbilidad y gravedad de los TEA) | 0 | 0 | 0 | 0 |
| 7. Análisis estadísticos adecuados | 1 | 1 | 1 | 1 |
| Total | 8 | 7 | 9 | 8 |
| Riesgos de sesgo | 6 | 7 | 5 | 6 |
| Riesgo general de sesgo | M | A | M | M |
TEA: trastorno del espectro autista.
Nota: 0: no informado; 1: no evaluado adecuadamente o claramente; 2: evaluado adecuadamente
M: medio (8-10); B: bajo (11-14); A: alto (7-1).
Se ha encontrado un total de 16 estudios sobre intervención con prebióticos (4 estudios), probióticos (8 estudios) y MTT (4 estudios) en niños con TEA. No se han encontrado estudios realizados con adultos. El intervalo de edad del total de estudios en la muestra con TEA estaba comprendido entre los 2 y los 17 años, mientras que el intervalo de edad para la muestra neurotípica estaba comprendida entre 2 y 16 años. El rango de la n de los estudios para la muestra con TEA estaba comprendido entre 9 y 64 sujetos, mientras que el rango de muestra para niños neurotípicos estaba comprendido entre 10 y 40 sujetos.
Se han encontrado 12 artículos que emplean prebióticos y probióticos en niños con TEA (3 de EE. UU., 2 de Reino Unido, 2 de China, uno de Polonia, uno de Egipto, uno de Taiwán, uno de Japón y uno de Eslovaquia). Solo el 18,75% (3/16) estudios incluían grupo de control sano, siendo 2 para intervención con probióticos y uno para MTT. Del mismo modo, solo el 37,5% (6/16) de los estudios seleccionados incluían en su estudio un grupo placebo. El 100% de los estudios no informaban de la existencia de discapacidad intelectual, ni del nivel de severidad del TEA en la descripción de la muestra.
El 33,33% de los estudios con probióticos y prebióticos tenían un diseño de estudio aleatorizado, de doble ciego y controlado con placebo19–22. Por otra parte, el 100% de los estudios con MTT tenían un diseño de ensayo clínico abierto y solo un estudio incluyó placebo23.
En la tabla 3 se indican los estudios seleccionados y los resultados de la intervención con prebióticos, probióticos y trasplante de microbiota fecal en niños con TEA. A continuación, se señalan los hallazgos encontrados:
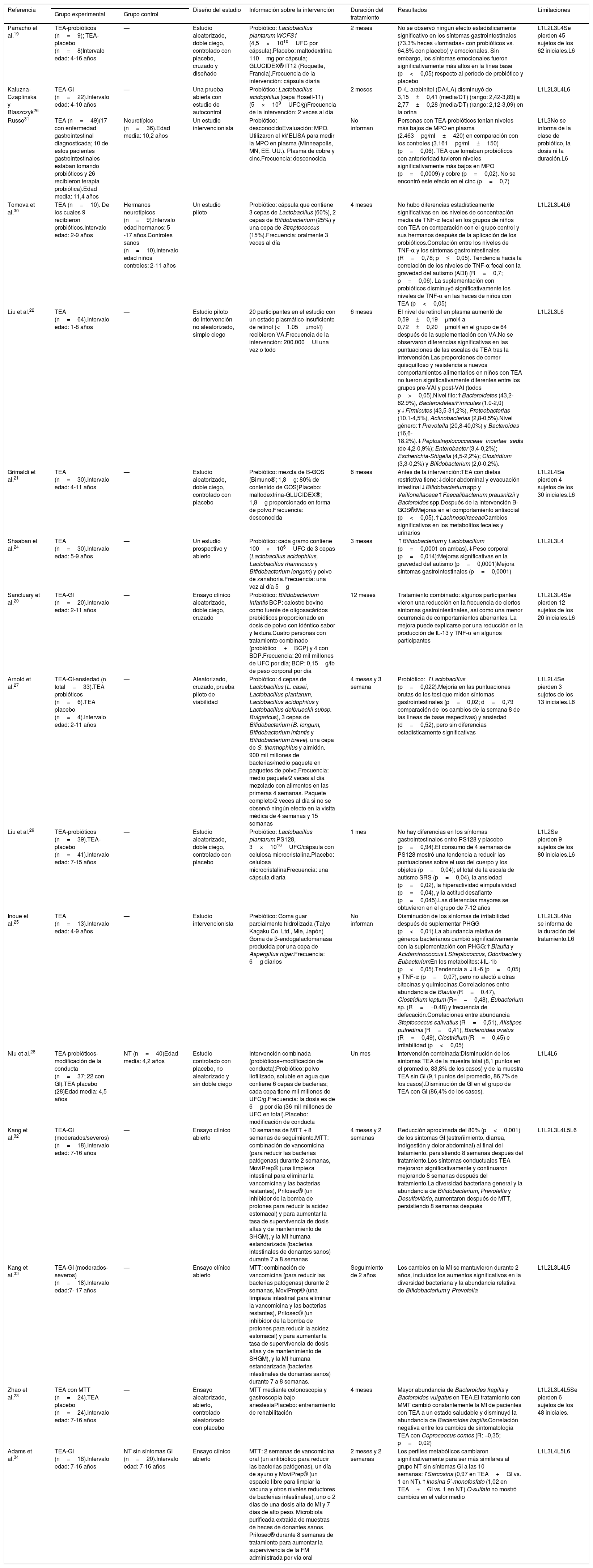
Principales características de los estudios incluidos en la revisión sistemática
| Referencia | Diseño del estudio | Información sobre la intervención | Duración del tratamiento | Resultados | Limitaciones | ||
|---|---|---|---|---|---|---|---|
| Grupo experimental | Grupo control | ||||||
| Parracho et al.19 | TEA-probióticos (n=9); TEA-placebo (n=8)Intervalo edad: 4-16 años | — | Estudio aleatorizado, doble ciego, controlado con placebo, cruzado y diseñado | Probiótico: Lactobacillus plantarum WCFS1 (4,5×1010UFC por cápsula).Placebo: maltodextrina 110mg por cápsula; GLUCIDEX® IT12 (Roquette, Francia).Frecuencia de la intervención: cápsula diaria | 2 meses | No se observó ningún efecto estadísticamente significativo en los síntomas gastrointestinales (73,3% heces «formadas» con probióticos vs. 64,8% con placebo) y emocionales. Sin embargo, los síntomas emocionales fueron significativamente más altos en la línea base (p<0,05) respecto al período de probiótico y placebo | L1L2L3L4Se pierden 45 sujetos de los 62 iniciales.L6 |
| Kaluzna-Czaplinska y Blaszczyk26 | TEA-GI (n=22).Intervalo edad: 4-10 años | — | Una prueba abierta con estudio de autocontrol | Probiótico: Lactobacillus acidophilus (cepa Rosell-11) (5×109UFC/g)Frecuencia de la intervención: 2 veces al día | 2 meses | D-/L-arabinitol (DA/LA) disminuyó de 3,15±0,41 (media/DT) (rango: 2,42-3,89) a 2,77±0,28 (media/DT) (rango: 2,12-3,09) en la orina | L1L2L3L4L6 |
| Russo31 | TEA (n=49)(17 con enfermedad gastrointestinal diagnosticada; 10 de estos pacientes gastrointestinales estaban tomando probióticos y 26 recibieron terapia probiótica).Edad media: 11,4 años | Neurotípico (n=36).Edad media: 10,2 años | Un estudio intervencionista | Probiótico: desconocidoEvaluación: MPO. Utilizaron el kit ELISA para medir la MPO en plasma (Minneapolis, MN, EE. UU.). Plasma de cobre y cinc.Frecuencia: desconocida | No informan | Personas con TEA-probióticos tenían niveles más bajos de MPO en plasma (2.463pg/ml±420) en comparación con los controles (3.161pg/ml±150) (p=0,06). TEA que tomaban probióticos con anterioridad tuvieron niveles significativamente más bajos en MPO (p=0,0009) y cobre (p=0,02). No se encontró este efecto en el cinc (p=0,7) | L1L3No se informa de la clase de probiótico, la dosis ni la duración.L6 |
| Tomova et al.30 | TEA (n=10). De los cuales 9 recibieron probióticos.Intervalo edad: 2-9 años | Hermanos neurotípicos (n=9).Intervalo edad hermanos: 5 -17 años.Controles sanos (n=10).Intervalo edad niños controles: 2-11 años | Un estudio piloto | Probiótico: cápsula que contiene 3 cepas de Lactobacillus (60%), 2 cepas de Bifidobacterium (25%) y una cepa de Streptococcus (15%).Frecuencia: oralmente 3 veces al día | 4 meses | No hubo diferencias estadísticamente significativas en los niveles de concentración media de TNF-α fecal en los grupos de niños con TEA en comparación con el grupo control y sus hermanos después de la aplicación de los probióticos.Correlación entre los niveles de TNF-α y los síntomas gastrointestinales (R=0,78; p≤0,05). Tendencia hacia la correlación de los niveles de TNF-α fecal con la gravedad del autismo (ADI) (R=0,7; p=0,06). La suplementación con probióticos disminuyó significativamente los niveles de TNF-α en las heces de niños con TEA (p<0,05) | L1L2L3L4L6 |
| Liu et al.22 | TEA (n=64).Intervalo edad: 1-8 años | — | Estudio piloto de intervención no aleatorizado, simple ciego | 20 participantes en el estudio con un estado plasmático insuficiente de retinol (<1,05μmol/l) recibieron VA.Frecuencia de la intervención: 200.000UI una vez o todo | 6 meses | El nivel de retinol en plasma aumentó de 0,59±0,19μmol/l a 0,72±0,20μmol/l en el grupo de 64 después de la suplementación con VA.No se observaron diferencias significativas en las puntuaciones de las escalas de TEA tras la intervención.Las proporciones de comer quisquilloso y resistencia a nuevos comportamientos alimentarios en niños con TEA no fueron significativamente diferentes entre los grupos pre-VAI y post-VAI (todos p>0,05).Nivel filo:↑Bacteroidetes (43,2-62,9%), Bacteroidetes/Fimicutes (1,0-2,0) y↓Firmicutes (43,5-31,2%), Proteobacterias (10,1-4,5%), Actinobacterias (2,8-0,5%).Nivel género:↑Prevotella (20,8-40,0%) y Bacteroides (16,6-18,2%).↓Peptostreptococcaceae_incertae_sedis (de 4,2-0,9%); Enterobacter (3,4-0,2%); Escherichia-Shigella (4,5-2,2%); Clostridium (3,3-0,2%) y Bifidobacterium (2,0-0,2%). | L1L2L3L6 |
| Grimaldi et al.21 | TEA (n=30).Intervalo edad: 4-11 años | — | Estudio aleatorizado, doble ciego, controlado con placebo | Prebiótico: mezcla de B-GOS (Bimuno®; 1,8g: 80% de contenido de GOS)Placebo: maltodextrina-GLUCIDEX®; 1,8g proporcionado en forma de polvo.Frecuencia: desconocida | 6 meses | Antes de la intervención:TEA con dietas restrictiva tiene:↓dolor abdominal y evacuación intestinal↓Bifidobacterium spp y Veillonellaceae↑Faecalibacterium prausnitzii y Bacteroides spp.Después de la intervención B-GOS®:Mejoras en el comportamiento antisocial (p<0,05).↑LachnospiraceaeCambios significativos en los metabolitos fecales y urinarios | L1L2L4Se pierden 4 sujetos de los 30 iniciales.L6 |
| Shaaban et al.24 | TEA (n=30).Intervalo edad: 5-9 años | — | Un estudio prospectivo y abierto | Probiótico: cada gramo contiene 100×106UFC de 3 cepas (Lactobacillus acidophilus, Lactobacillus rhamnosus y Bifidobacterium longum) y polvo de zanahoria.Frecuencia: una vez al día 5g | 3 meses | ↑Bifidobacterium y Lactobacillum (p=0,0001 en ambas).↓Peso corporal (p=0,014):Mejoras significativas en la gravedad del autismo (p=0,0001)Mejora síntomas gastrointestinales (p=0,0001) | L1L2L3L4 |
| Sanctuary et al.20 | TEA-GI (n=20).Intervalo edad: 2-11 años | — | Ensayo clínico aleatorizado, doble ciego, cruzado | Probiótico: Bifidobacterium infantis BCP: calostro bovino como fuente de oligosacáridos prebióticos proporcionado en dosis de polvo con idéntico sabor y textura.Cuatro personas con tratamiento combinado (probiótico+BCP) y 4 con BDP.Frecuencia: 20 mil millones de UFC por día; BCP: 0,15g/lb de peso corporal por día | 12 meses | Tratamiento combinado: algunos participantes vieron una reducción en la frecuencia de ciertos síntomas gastrointestinales, así como una menor ocurrencia de comportamientos aberrantes. La mejora puede explicarse por una reducción en la producción de IL-13 y TNF-α en algunos participantes | L1L2L3L4Se pierden 12 sujetos de los 20 iniciales.L6 |
| Arnold et al.27 | TEA-GI-ansiedad (n total=33).TEA probióticos (n=6).TEA placebo (n=4).Intervalo edad: 2-11 años | — | Aleatorizado, cruzado, prueba piloto de viabilidad | Probiótico: 4 cepas de Lactobacillus (L. casei, Lactobacillus plantarum, Lactobacillus acidophilus y Lactobacillus delbrueckii subsp. Bulgaricus), 3 cepas de Bifidobacterium (B. longum, Bifidobacterium infantis y Bifidobacterium breve), una cepa de S. thermophilus y almidón. 900 mil millones de bacterias/medio paquete en paquetes de polvo.Frecuencia: medio paquete/2 veces al día mezclado con alimentos en las primeras 4 semanas. Paquete completo/2 veces al día si no se observó ningún efecto en la visita médica de 4 semanas y 15 semanas | 4 meses y 3 semana | Probiótico: ↑Lactobacillus (p=0,022).Mejoría en las puntuaciones brutas de los test que miden síntomas gastrointestinales (p=0,02; d=0,79 comparación de los cambios de la semana 8 de las líneas de base respectivas) y ansiedad (d=0,52), pero sin diferencias estadísticamente significativas | L1L2L4Se pierden 3 sujetos de los 13 iniciales.L6 |
| Liu et al.29 | TEA-probióticos (n=39).TEA-placebo (n=41).Intervalo edad: 7-15 años | — | Estudio aleatorizado, doble ciego, controlado con placebo | Probiótico: Lactobacillus plantarum PS128, 3×1010UFC/cápsula con celulosa microcristalina.Placebo: celulosa microcristalinaFrecuencia: una cápsula diaria | 1 mes | No hay diferencias en los síntomas gastrointestinales entre PS128 y placebo (p=0,94).El consumo de 4 semanas de PS128 mostró una tendencia a reducir las puntuaciones sobre el uso del cuerpo y los objetos (p=0,04); el total de la escala de autismo SRS (p=0,04), la ansiedad (p=0,02), la hiperactividad eimpulsividad (p=0,04), y la actitud desafiante (p=0,045).Las diferencias mayores se obtuvieron en el grupo de 7-12 años | L1L2Se pierden 9 sujetos de los 80 iniciales.L6 |
| Inoue et al.25 | TEA (n=13).Intervalo edad: 4-9 años | — | Estudio intervencionista | Prebiótico: Goma guar parcialmente hidrolizada (Taiyo Kagaku Co. Ltd., Mie, Japón). Goma de β-endogalactomanasa producida por una cepa de Aspergillus niger.Frecuencia: 6g diarios | No informan | Disminución de los síntomas de irritabilidad después de suplementar PHGG (p<0,01).La abundancia relativa de géneros bacterianos cambió significativamente con la suplementación con PHGG:↑Blautia y Acidaminococcus↓Streptococcus, Odoribacter y EubacteriumEn los metabolitos:↓IL-1b (p<0,05).Tendencia a ↓IL-6 (p=0,05) y TNF-α (p=0,07), pero no afectó a otras citocinas y quimiocinas.Correlaciones entre abundancia de Blautia (R=0,47), Clostridium leptum (R=−0,48), Eubacterium sp. (R=−0,48) y frecuencia de defecación.Correlaciones entre abundancia Steptococcus salivatius (R=0,51), Alistipes putredinis (R=0,41), Bacteroides ovatus (R=0,49), Clostridium (R=0,45) e irritabilidad (p<0,05) | L1L2L3L4No se informa de la duración del tratamiento.L6 |
| Niu et al.28 | TEA-probióticos-modificación de la conducta (n=37; 22 con GI).TEA placebo (28)Edad media: 4,5 años | NT (n=40)Edad media: 4,2 años | Estudio controlado con placebo, no aleatorizado y sin doble ciego | Intervención combinada (probióticos+modificación de conducta):Probiótico: polvo liofilizado, soluble en agua que contiene 6 cepas de bacterias; cada cepa tiene mil millones de UFC/g.Frecuencia: la dosis es de 6g por día (36 mil millones de UFC en total).Placebo: modificación de conducta | Un mes | Intervención combinada:Disminución de los síntomas TEA de la muestra total (8,1 puntos en el promedio, 83,8% de los casos) y de la muestra TEA sin GI (9,1 puntos del promedio, 86,7% de los casos).Disminución de GI en el grupo de TEA con GI (86,4% de los casos). | L1L4L6 |
| Kang et al.32 | TEA-GI (moderados/severos) (n=18).Intervalo edad: 7-16 años | — | Ensayo clínico abierto | 10 semanas de MTT + 8 semanas de seguimiento.MTT: combinación de vancomicina (para reducir las bacterias patógenas) durante 2 semanas, MoviPrep® (una limpieza intestinal para eliminar la vancomicina y las bacterias restantes), Prilosec® (un inhibidor de la bomba de protones para reducir la acidez estomacal) y para aumentar la tasa de supervivencia de dosis altas y de mantenimiento de SHGM), y la MI humana estandarizada (bacterias intestinales de donantes sanos) durante 7 a 8 semanas | 4 meses y 2 semanas | Reducción aproximada del 80% (p<0,001) de los síntomas GI (estreñimiento, diarrea, indigestión y dolor abdominal) al final del tratamiento, persistiendo 8 semanas después del tratamiento.Los síntomas conductuales TEA mejoraron significativamente y continuaron mejorando 8 semanas después del tratamiento.La diversidad bacteriana general y la abundancia de Bifidobacterium, Prevotella y Desulfovibrio, aumentaron después de MTT, persistiendo 8 semanas después | L1L2L3L4L5L6 |
| Kang et al.33 | TEA-GI (moderados- severos) (n=18).Intervalo edad:7- 17 años | — | Ensayo clínico abierto | MTT: combinación de vancomicina (para reducir las bacterias patógenas) durante 2 semanas, MoviPrep® (una limpieza intestinal para eliminar la vancomicina y las bacterias restantes), Prilosec® (un inhibidor de la bomba de protones para reducir la acidez estomacal) y para aumentar la tasa de supervivencia de dosis altas y de mantenimiento de SHGM), y la MI humana estandarizada (bacterias intestinales de donantes sanos) durante 7 a 8 semanas. | Seguimiento de 2 años | Los cambios en la MI se mantuvieron durante 2 años, incluidos los aumentos significativos en la diversidad bacteriana y la abundancia relativa de Bifidobacterium y Prevotella | L1L2L3L4L5 |
| Zhao et al.23 | TEA con MTT (n=24).TEA placebo (n=24).Intervalo edad: 7-16 años | — | Ensayo aleatorizado, abierto, controlado aleatorizado con placebo | MTT mediante colonoscopia y gastroscopia bajo anestesiaPlacebo: entrenamiento de rehabilitación | 4 meses | Mayor abundancia de Bacteroides fragilis y Bacteroides vulgatus en TEA.El tratamiento con MMT cambió constantemente la MI de pacientes con TEA a un estado saludable y disminuyó la abundancia de Bacteroides fragilis.Correlación negativa entre los cambios de sintomatología TEA con Coprococcus comes (R: −0,35; p=0,02) | L1L2L3L4L5Se pierden 6 sujetos de los 48 iniciales. |
| Adams et al.34 | TEA-GI (n=18).Intervalo edad: 7-16 años | NT sin síntomas GI (n=20).Intervalo edad: 7-16 años | Ensayo clínico abierto | MTT: 2 semanas de vancomicina oral (un antibiótico para reducir las bacterias patógenas), un día de ayuno y MoviPrep® (un espacio libre para limpiar la vacuna y otros niveles reductores de bacterias intestinales), uno o 2 días de una dosis alta de MI y 7 días de alto peso. Microbiota purificada extraída de muestras de heces de donantes sanos. Prilosec® durante 8 semanas de tratamiento para aumentar la supervivencia de la FM administrada por vía oral | 2 meses y 2 semanas | Los perfiles metabólicos cambiaron significativamente para ser más similares al grupo NT sin síntomas GI a las 10 semanas:↑Sarcosina (0,97 en TEA+GI vs. 1 en NT).↑Inosina 5’-monofosfato (1,02 en TEA+GI vs. 1 en NT).O-sulfato no mostró cambios en el valor medio | L1L3L4L5L6 |
GI: con síntomas gastrointestinales; L1: no se describe la severidad del TEA; L2: no se incluye un grupo control sano; L3: no se incluye grupo placebo; L4: poco valor estadístico debido a la n baja; L5: no se incluye grupo con prebióticos o probióticos; L6: no se describe si la persona tiene discapacidad intelectual; MI: microbiota intestinal; MPO: mieloperoxidasa; MTT: terapia de transferencia de microbiota; NT: neurotípico; TEA: trastorno del espectro autista; UFC: unidades formadoras de colonias; VA: vitamina A; —: no incluyeron grupo control.
Se han encontrado escasos estudios con la utilización de los prebióticos en el TEA. Concretamente son 4 estudios, los cuales utilizan diferentes tipos de compuestos prebióticos. Desde polvo de zanahoria24, goma guar parcialmente hidrolizada25 o vitamina A22, hasta galactooligosasáridos21.
En cuanto a los síntomas emocionales y los síntomas TEA, mientras que unos estudios encontraron una mejora estadísticamente significativa en la sintomatología TEA tras la aplicación de los prebióticos21,25 otros estudios no encontraron dicho efecto22.
Los resultados encontrados son dispares dado que las variables estudiadas para comprobar el efecto de los prebióticos son diferentes entre sí. Así, el estudio de Inoue et al.25 encontró una disminución significativa en la diversidad microbiana, y algunas citoquinas y quimiocinas (IL-1β, IL-6 y TNF-α) tras la aplicaron de la dieta prebiótica basada en goma guar y β-endoglucanasa producida por una cepa de Aspergillus niger. Por otro lado, Grimaldi et al.21 hallaron un aumento significativo de la familia Lachnospiraceae, además de cambios significativos en los metabolitos fecales y urinarios, y en el comportamiento antisocial de los niños con TEA después de la intervención prebiótica basada en la B-GOS® (Bimuno®; 1,8g: 80% de contenido de GOS). Otro estudio también ha encontrado un aumento significativo en la proporción Bacteroidetes/Firmicutes después de un suplemento de vitamina A22.
Probióticos en el trastorno del espectro autistaLas cepas probióticas utilizadas en los diferentes ensayos han estado basadas en los géneros bacterianos Lactobacillus y Bifidobacterium principalmente: Lactobacillus plantarum19,22, Lactobacillus acidophilus26, y una mezcla de Lactobacillus acidophilus, Lactobacillus rhamnosus y Bifidobacteria longum24, y una mezcla de Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbruecki, Bifidobacterium longum y Bifidobacterium bifidum27.
A continuación, se agrupan los resultados de los estudios de intervención con probióticos en el TEA en relación a sus efectos en: la sintomatología en el TEA y en el estado emocional, los síntomas gastrointestinales, la abundancia bacteriana en la MI y el sistema inmunitario.
Los estudios que han analizado los efectos de la administración de probióticos en los síntomas del TEA y sus síntomas emocionales son muy limitados. Algunos estudios encuentran mejoras significativas en la gravedad del TEA utilizando Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus rhamnosus y Bifidobacterium longum22,24,26,28,29. Sin embargo, la mayoría de estudios encontrados no analizan estas variables o señalan que la utilización de Bifidobacterium infantis y calostro bovino como fuente de oligosacáridos prebióticos puede ayudar a reducir el comportamiento repetitivo y los síntomas emocionales en comparación con la combinación de prebióticos y probióticos22. Liu et al.29 utilizaron Lactobacillus plantarum (PS128, 3×1010 UFC/cápsula) como probiótico con celulosa microcristalina. Estos resultados mostraron mejoras en los síntomas emocionales y el comportamiento después de la intervención probiótica. Sin embargo, este estudio no analizó las diferencias estadísticas entre los grupos de probióticos y placebo. Así pues, mientras que algunos estudios encuentran diferencias estadísticas tras la aplicación de probióticos en los síntomas emocionales y síntomas en el TEA20,24,28,29 otros no encuentran dichas diferencias19,27.
Los estudios que miden los efectos de los probióticos en los síntomas gastrointestinales en el TEA son escasos, pero parecen mostrar una mejora en los síntomas gastrointestinales19,20,24,28. Concretamente, se hallan mejoras en síntomas gastrointestinales como estreñimiento, consistencia de las heces, flatulencia y dolor abdominal20,24, que se correlacionaron fuertemente con las mejoras en la gravedad del TEA después del tratamiento con probióticos24. Sin embargo, algunos estudios encuentran una disminución de los síntomas gastrointestinales gracias a la combinación de los probióticos y un programa de entrenamiento conductual28 y otros estudios no analizan dichas diferencias27,30,31.
Con respecto a los efectos de la dieta probiótica en la MI, los suplementos probióticos (fundamentalmente Lactobacillus acidophilus, Lactobacillus rhamnosus y Bifidobacterium longum) son dispares. Mientras que algunos estudios han encontrado un aumento significativo en los recuentos de colonias de Bifidobacterium y Lactobacillus en las heces de los niños con TEA24, otros encuentran una disminución en la cantidad de Firmicutes, Bifidobacterium, Desulfovibrio y Lactobacillus30.
En cuanto a los efectos de los probióticos en el sistema inmunitario, algunos estudios han encontrado una disminución en la frecuencia de ciertas células inmunes: TNF-α30 D-arabinitol y una proporción de D-/L-arabinitol26 con la intervención probiótica, la T CD4+/IL-13+ utilizando una combinación de prebióticos y probióticos20 y las células T CD8+/TNF-α+ tras el tratamiento prebiótico en los niños con TEA20. Russo31 encontró que los niveles de mieloperoxidasa y cobre en plasma fueron significativamente más bajos en niños con TEA después de la intervención probiótica. Sin embargo, este estudio no describe las características específicas de los probióticos empleados. Otro estudio reciente que empleó Lactobacillus, Bifidobacterium y S. thermophilus como probióticos, no ha encontrado diferencias estadísticamente significativas después de la intervención27.
Terapia de transferencia de microbiota (Microbiota Transfer Therapy)Se han encontrado 4 trabajos sobre la MTT en el TEA, siendo el 75% de producción americana. Un ensayo clínico evaluó el impacto del MTT en la composición MI y los síntomas gastrointestinales en el TEA. La MMT incluyó un tratamiento anterior con antibióticos durante 2 semanas y una limpieza intestinal. La escala de calificación de síntomas gastrointestinales reveló una reducción de aproximadamente el 80% de los síntomas gastrointestinales al final del tratamiento, incluidas mejoras significativas en el estreñimiento, diarrea, indigestión y dolor abdominal. Del mismo modo, las evaluaciones clínicas mostraron que los síntomas conductuales del TEA mejoraron significativamente y continuaron mejorando 8 semanas después de que finalizara el tratamiento. Además, la diversidad bacteriana general y la abundancia de Bifidobacterium, Prevotella y Desulfovibrio también aumentó y estos cambios persistieron después del tratamiento32. Igualmente, un estudio realizado con los mismos participantes encontró resultados similares, con un aumento significativo en la diversidad bacteriana y la abundancia relativa de Bifidobacterium y Prevotella manteniéndose los cambios 2 años después33. Otro estudio encontró una disminución de la abundancia de Bacteroides fragilis y síntomas en el TEA (10,8%) después de 4 meses de intervención de MMT23. Finalmente, un estudio reciente halló una mejora significativa en los perfiles metabólicos, los síntomas gastrointestinales, los síntomas TEA y en los índices de algunos metabolitos (sarcosina e inosina 5′-monofosfato) después del tratamiento con MMT34.
ConclusionesDada la heterogeneidad de los resultados y las variables incluidas en los estudios no es posible realizar un estudio de meta-análisis que permita calcular el tamaño del efecto y el análisis de moderadores. Así, por ejemplo, a nivel observacional no hay diferencias en las variables grupo de edad, tipo de bacteria empleada, duración del tratamiento, dosis, etc., entre los estudios que han encontrado diferencias estadísticas tras la aplicación de probióticos en los síntomas emocionales y síntomas en el TEA20,24,28,29, y aquellos que no han hallado diferencias19,27.
Según el diseño de investigación solo el 33,33% de los estudios con probióticos19,20,22 y prebióticos21 tienen un diseño de estudio aleatorizado, de doble ciego y controlado con placebo. Del mismo modo, solo un estudio con MTT realiza este tipo de diseño de investigación23. Por lo tanto, los resultados de estos estudios deben interpretarse con mucha cautela. Concretamente, los estudios con este tipo de diseño que emplean probióticos disponen de una muestra muy pequeña, inferior a 9 sujetos19,20, y una falta de homogeneidad en la cepa bacteriana utilizada, 2 de los 3 estudios utilizan como probiótico la cepa de Lactobacillus plantarum19,29. Aunque, ambos estudios encuentran una mejora en los síntomas emocionales de los niños con TEA una de las conclusiones que se alcanza con este estudio de revisión es que existe una crisis generalizada de replicabilidad en los estudios35. Futuros estudios deberían seguir la línea del estudio de Liu et al.29. En cuanto a los estudios con prebióticos y MTT aún queda mucho camino para poder realizar estudios con un mayor rigor metodológico.
En resumen, los estudios sobre probióticos, prebióticos y MMT son esperanzadores por el momento, pero no hay suficiente evidencia empírica. El análisis sobre el riesgo de sesgo indica que el 58,33% de los estudios sobre probióticos y prebióticos tienen un sesgo medio, alto el 25% y bajo el 16,66%, mientras que en los estudios realizados con MMT el sesgo medio está presente en el 75% de los estudios, siendo el 25% alto. En estos resultados se refleja, en cierta medida, la confiabilidad de los datos a nivel mundial, por lo que estos deben ser tomados con cautela. El riesgo de sesgo de estos estudios puede explicarse por una serie de limitaciones importante que impiden la replicación de los estudios a nivel internacional: 1) la falta de homogeneidad de las características de la muestra entre los estudios (p. ej., severidad del TEA, si presenta o no discapacidad intelectual, etc.); 2) el tamaño pequeño de la muestra o la falta de homogeneidad de los tamaños de las muestras que se comparan; 3) la heterogeneidad de las intervenciones. Por ejemplo, se emplean diferentes tipos y dosis de prebióticos y probióticos. Además, otros autores proponen compuestos naturales que aún no se han evidenciado como la utilización de las ascidias o patatas de mar36; 4) heterogeneidad metodológica (p. ej., incluir o no grupo de control en lista de espera, incluir o no placebo, tiempo del seguimiento, etc.); 4) la ausencia en la mayoría de los estudios de análisis de datos donde se incluyan las medias y desviaciones típicas, así como la magnitud de las diferencias, y 5) la falta de inclusión en los protocolos de evaluación de pruebas que midan de forma integral el TEA (p. ej., gravedad del comportamiento repetitivo, nivel de ansiedad, etc.). Futuros estudios deberán tener en consideración los estudios encontrados previamente sobre la posible disbiosis en el TEA5,12,13,18 como punto de partida para el diseño de protocolos de intervención que incluyan prebióticos, probióticos y MMT. Del mismo modo, se precisan estudios en países que tienen otras culturas diferentes a la asiática y la anglosajona, y que presentan patrones nutricionales diferentes como ocurre en los países mediterráneos (España, Italia, Grecia, etc.) y en Latinoamérica.
FinanciaciónNo hay ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses