Objetivo. El objetivo de la intervención es la reconstrucción de pérdida de sustancia ósea segmentaria del fémur proximal tras una resección tumoral amplia o después de intervenciones de revisión en la cirugía protésica de cadera.
Indicaciones. Tumores óseos benignos agresivos y malignos primarios del fémur proximal, metástasis femorales que afectan la estabilidad, pérdida extensa de sustancia ósea segmentaria del fémur proximal o fracturas periprotésicas.
Contraindicaciones. Infecciones locales floridas. Contraindicaciones relativas: tiempo de supervivencia muy corto (< 3 meses) y falta de alojamiento acetabular.
Técnica quirúrgica. Abordaje anterolateral, exposición y separación del músculo iliopsoas y del músculo glúteo medio con margen de seguridad hacia el hueso. Refuerzo de los muñones tendinosos con material de sutura no reabsorbible. Separación distal del músculo vasto lateral, músculo vasto intermedio y músculo recto femoral en función de la expansión tumoral extraósea. Osteotomía femoral distal con margen de seguridad de 3 cm como mínimo respecto al tumor. En el caso del reemplazo de fémur total, artrotomía lateral adicional con resección de los ligamentos y meniscos. Preparación con protección del canal medular mediante la utilización de pinzas Verbrügge. Después de la reposición de prueba con los componentes de prueba, implantación de los componentes definitivos bajo regulación de la antetorsión en incrementos de 5º. Antes de la reposición, cubrir y refijar la prótesis con una malla de reconstrucción. Refijación del músculo en la malla. En caso de reemplazo de fémur total, preparación de la diáfisis tibial, montaje del componente femoral y acoplamiento con el componente femoral distal.
Tratamiento posterior. Profilaxis de enfermedades infecciosas, 20 kg de carga parcial, férula de movimiento.
Resultados. Desde junio de 2007 hasta diciembre de 2011 se realizó un reemplazo de fémur MUTARS® proximal a 20 pacientes y la implantación de un fémur MUTARS® total a 2 pacientes. La edad media en el momento de la intervención fue de 62,0 ± 18,1 años (18-82 años). Las indicaciones para la intervención fueron 3 tumores óseos malignos primarios y 19 metástasis femorales. En el momento de la recopilación de datos se pudo realizar el seguimiento posterior a 15 pacientes durante un periodo de tiempo medio de 20,3 ± 17,2 meses (4-51 meses). En un total de 22 pacientes aparecieron 3 infecciones protésicas profundas (13,6%) y 2 luxaciones (9,1%). De los 15 pacientes sometidos al seguimiento posterior, 3 obtuvieron un resultado funcional muy bueno (20%), 4 un resultado bueno (26,7%), 6 uno satisfactorio (40%) y 2 (13,3%) uno malo con relación a la escala MSTS según Enneking.
Redacción
M. Rudert, Würzburg
Ilustraciones
R. Himmelhan, Heidelberg
Introducción
El fémur es una de las zonas más afectadas por los tumores óseos malignos primarios26. En la parte proximal del fémur aparecen aproximadamente el 13% de los condrosarcomas31, el 16% de los sarcomas de Ewing32 y el 10% de los osteosarcomas33. Sin embargo, las metástasis óseas son las lesiones malignas que con mayor frecuencia aparecen en el fémur, sobre todo los carcinomas de pecho, de pulmón, de riñones y de próstata7.
La benignidad o malignidad de un tumor óseo femoral se analizará mediante una biopsia. La posición de la zona de la biopsia se planificará y localizará de modo que en caso de que sea necesario efectuar una resección tumoral extensiva posterior esta se pueda realizar a lo largo de la misma incisión y que en caso de biopsias incisionales se realice la resección con suficiente margen de seguridad. El canal de la biopsia se debe encontrar lo más cerca posible del tumor y no tiene que afectar a más de un compartimento4. La extracción de muestras desde anterolateral a la altura del borde inferior del trocánter mayor en la zona de inserción del músculo vasto lateral ha dado buenos resultados en el fémur proximal. Las lesiones de la zona epifisiaria y metafisiaria se pueden biopsiar a través del cuello femoral mediante un procedimiento mínimo invasivo35.
Anteriormente, los tumores óseos malignos localizados en la zona del hueso femoral se podían controlar únicamente mediante amputaciones o desarticulaciones de cadera y, en la mayoría de los casos, suponían para el paciente la pérdida completa de la función de la extremidad afectada24. En la actualidad, los progresos alcanzados en el diagnóstico por imágenes y las técnicas quirúrgicas mejoradas, así como el uso de procedimientos (neo)adyuvantes como la radio o la quimioterapia, permiten en el 90% de los casos controlar localmente la enfermedad tumoral con preservación de la extremidad6.
El objetivo de la terapia quirúrgica de tumores óseos malignos primarios en la zona del fémur proximal es una resección amplia según Enneking10. La exposición (accidental) del tumor o de su cápsula se deberá considerar una resección marginal inadecuada desde el punto de vista quirúrgico y deberá evitase.
Hay que distinguir entre la resección intraarticular del fémur proximal, en la mayoría de los casos debida a tumores óseos malignos sin afectación de la articulación de la cadera, y la resección femoral extraarticular con afectación muy infrecuente de la articulación de la cadera. El tipo de resección a realizar se deberá decidir durante la planificación preoperatoria, puesto que una resección extraarticular de la articulación de la cadera requiere no solo de una reconstrucción de defectos femorales, sino también de una reconstrucción de defectos acetabulares.
La indicación para realizar una resección femoral total se da en el caso de múltiples lesiones en el fémur (por ejemplo, en el caso de presencia de metástasis extensivas a distancia) o en el caso de tumores diafisarios primarios, que se extienden por proximal y distal hasta sobrepasar la zona de unión epimetafisaria y que no permiten preservar suficientemente la articulación28. En caso de metástasis en hueso femoral fracturado o que amenaza fractura, los procedimientos estabilizadores como la osteosíntesis intramedular pueden provocar la expansión tumoral por la médula ósea que, en caso de una revisión posterior —por ejemplo, en caso de fracaso de la prótesis o si aparece una progresión de metástasis local— podría requerir el reemplazo de fémur total.
El principal objetivo de la cirugía de las metástasis en la zona del fémur es restablecer cuanto antes la movilidad del paciente evitando una recidiva local25. La indicación para la resección de una metástasis ósea en el fémur proximal se da en caso de lesiones solitarias, así como en grandes procesos destructivos como, por ejemplo, en metástasis del carcinoma de células renales. Debido a su crecimiento localmente agresivo y a su poca reacción ante una radioquimioterapia concomitante, en la literatura se indica una tasa de fracaso del procedimiento de estabilización intralesional (clavo intramedular, osteosíntesis combinada con placas y cemento) del 24%23. Con un diagnóstico relativamente bueno de un 50% de supervivencia total después de dos años9 y un 39% después de diez años1,12, la aplicación de los procedimientos de recesión en este colectivo de pacientes está demostrada y, por tanto, recomendamos su empleo.
En Europa se ha impuesto como alternativa a la reconstrucción después de realizar una resección femoral proximal o total llevar a cabo el reemplazo endoprotésico mediante sistemas megaprotésicos modulares. Al contrario que en las prótesis monobloc de fabricación a medida («custom made megaprothesis»), los sistemas modulares son fácilmente accesibles, económicos y se ajustan con flexibilidad a la situación intraoperatoria19. La utilización de aloinjertos osteoarticulares o de aloinjertos de tejido compuesto como alternativa «biológica» al reemplazo de fémur artificial ha pasado cada vez más a un segundo plano, por lo menos en Europa, a causa de los problemas que plantea en cuanto a disponibilidad, integración ósea, infecciones y fracturas. No obstante, resultan son una buena alternativa desde el punto de vista funcional5,13,14,36.
Todos los sistemas de megaprotésis modulares presentan un espectro de complicaciones similar, aunque la incidencia de complicaciones en los pacientes no oncológicos e inmunológicamente competentes es significativamente mayor frente a los sistemas endoprotésicos convencionales.
Cabe destacar especialmente el aflojamiento aséptico, la infección protésica profunda y la luxación15,20,22. La luxación protésica pasa aparentemente a un segundo plano a causa de la utilización de cabezas bipolares (cabeza dual) durante el reemplazo articular con hemiprótesis o del empleo de implantaciones de sistemas acetabulares en tridente durante el reemplazo de prótesis total.
La endoprótesis tumoral adquiere mayor estabilidad con la preservación de la cápsula articular, así como mediante la fijación de músculos y tendones directamente a la prótesis, por ejemplo, mediante corchetes u aperturas, o mediante la utilización de mallas de reconstrucción sintéticas, por ejemplo, de teleftalato de polietileno (PET, Trevira®)17.
Las tasas de los aflojamientos asépticos de megaimplantes en pacientes afectados por un tumor poseen, según la literatura, una incidencia del 3-27%15,19,30. Además, estos megaimplantes para la reconstrucción de defectos en la zona del fémur distal y de la tibia proximal presentan el mayor riesgo de aflojamiento21. La influencia del anclaje de vástago intramedular (cementado vs. no cementado) sobre la incidencia de aflojamientos asépticos sigue siendo poco clara debido a la gran heterogeneidad de los colectivos de pacientes y al hecho de que la mayoría de los datos son retrospectivos27,30.
A pesar de ello, en el caso de pacientes jóvenes con tumores óseos malignos primarios sin necesidad de radioterapia local es preferible utilizar el anclaje de vástago no cementado (press-fit)34. No obstante, si el nivel de resección se encuentra muy distal, entonces, en la mayoría de los casos, la geometría del fémur permite solo el procedimiento no cementado o, eventualmente, incluso con atornillamiento adicional.
En pacientes de mayor edad con lesiones secundarias como metástasis óseas se elegirá el anclaje de vástago cementado, puesto que permite al paciente la carga total postoperatoria inmediata. El concepto de anclaje óptimo de una megaprótesis sigue dependiendo de factores muy diferentes y se deberá determinar en cada caso en función de la planificación preoperatoria29.
La infección profunda representa una de las complicaciones más graves en la cirugía endoprotésica tumoral. Las tasas de infección tras la implantación de una endoprótesis tumoral en la extremidad inferior son del 3 al 13%2. El espectro de agentes patógenos abarca, además de los estafilococos detectados con más frecuencia, cada vez más subespecies multiresistentes como el MRSA o MRSE18. Los factores de riesgo para la aparición de una infección periprotésica son los tiempos quirúrgicos largos, las resecciones extensivas con mal cubrimiento de la endoprótesis con partes blandas y la resistencia inmunológica reducida debido a la radio/quimioterapia concomitante, así como debido a la misma enfermedad de base oncológica3,20,25. El efecto antibacteriano de superficies de endoprótesis tumorales modulares con recubrimiento de plata puede reducir el riesgo de infección15,16.
De manera análoga a las recomendaciones para evitar infecciones hematógenas en la cirugía endoprotésica convencional, los pacientes con megaprótesis deberían someterse a una terapia antibiótica en caso de peligro de infección, por ejemplo, en caso de una intervención quirúrgica, de tratamientos dentales o de infecciones bacterianas.
Principio y objetivo de la intervención
Reconstrucción de pérdida de sustancia ósea segmentaria del fémur proximal tras una resección tumoral o después de intervenciones de revisión durante una cirugía endoprotésica de cadera.
Ventajas
— Modularidad con longitud de reconstrucción de libre elección.
— Ajuste de la ante/retroversión del cuello protésico.
— Geometría de vástago con antirotación con posibilidad de anclaje cementado y no cementado.
— Disponible con recubrimiento de plata antimicrobiano.
— Múltiples posibilidades de combinación con sistemas de revisión de cadera y de rodilla, así como para el reemplazo de fémur total.
— Rápida disponibilidad y costes más reducidos en comparación a fabricaciones a medida.
Desventajas
— Mayor riesgo de luxación y de infección en comparación con la cirugía de endoprótesis de cadera convencional.
— Mala funcionalidad en comparación con la cirugía de endoprótesis de cadera convencional por pérdida de tejido muscular y tendinoso.
— Tratamiento de larga duración y posibilidades limitadas de retirar el implante en caso de infección periprotésica.
Indicaciones
— Tumores óseos benignos agresivos y malignos primarios del fémur proximal.
— Metástasis óseas que ponen en riesgo la estabilidad del fémur proximal con osteólisis extensa o en caso de preferir una resección curativa.
— Pérdida de sustancia ósea segmentaria grave del fémur proximal (Paprosky tipo IV) después de una cirugía endoprotésica de cadera fallida o de osteosíntesis8.
— Fracturas periprotésicas, en las que no es posible un tratamiento mediante osteosíntesis o una reconstrucción endoprotésica con implantes de revisión convencionales o que requieren una técnica quirúrgica menos agresiva para los pacientes multimórbidos.
Contraindicaciones
— Contraindicaciones médicas generales para una intervención quirúrgica.
— Infecciones floridas locales.
— Contraindicaciones relativas: tiempo de sobrevivencia muy corto (< 3 meses); falta de alojamiento acetabular.
Información para el paciente
— Riesgos quirúrgicos generales.
— Transfusión perioperatoria de concentrados de eritrocitos.
— Trombosis, embolia.
— Transfusión de sangre.
— Alteraciones en la cicatrización de la herida.
— Lesión de estructuras nerviosas y de vasos sanguíneos (nervio ciático, nervio femoral, arteria y vena femoral).
— Infección protésica profunda (infección temprana/tardía).
— Luxación.
— Desconexión, rotura del material.
— Limitaciones funcionales (insuficiencia glútea, debilidad del cuádriceps y del músculo psoas).
— Diferencia de longitud de las piernas.
— Radio/quimioterapia postoperatoria.
— Recidiva tumoral.
— Tasa de aflojamiento aséptico más alta en comparación con la prótesis estándar.
Preparación de la intervención
— Completar la estadificación tumoral (radiografía, RM, TC toraco-abdominal, cintigrafía ósea trifásica; en caso dado, angio TC).
— Planificación preoperatoria de los límites de la resección tumoral ósea y de partes blandas.
— Determinación de la longitud de reconstrucción ósea.
— Embolización tumoral preoperatoria en tumores bien vascularizados.
— Coordinación interdisciplinar de la terapia oncológica (quimioterapia, radioterapia).
— Verificación por parte del cirujano de que el sistema protésico esté completo.
Instrumental
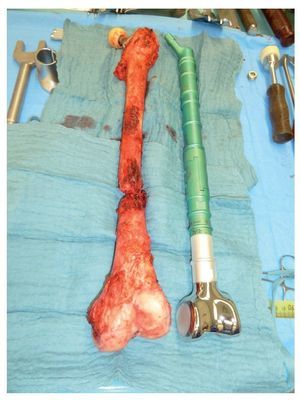
En el ejemplo se puede observar el instrumental para un reemplazo de fémur proximal/total del sistema MUTARS® (Modular Universal Tumor And Revision) de la marca Implantcast, Buxtehude, Alemania (. figs. 1a y b):
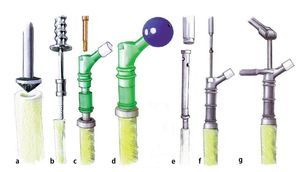
Fig. 1. El fémur MUTARS® proximal (a) y el fémur MUTARS® total (b) con superficie con recubrimiento de plata. Regulación de la ante/retroversión del cuello protésico a través del dentado frontal en incrementos de 5º (c). (Cedido amablemente por la empresa Implantcast).
— Componentes (TiAl6V4): fémur proximal (50 y 80 mm), pieza de extensión (40, 60, 80 y 100 mm), pieza de unión (100 mm), reductor (20 o 30 mm), tornillos M10 (25-225 mm).
— Todos los componentes del sistema que no están en contacto con el hueso o que no forman parte de la articulación de la endoprótesis se pueden fabricar con recubrimiento de plata.
— La longitud de reconstrucción máxima es de 340 mm (fémur proximal) y de 540 mm (fémur total).
— Dentado frontal para el ajuste de la ante/retroversión del cuello protésico con incrementos de 5º (fig. 1c).
— Vástagos no cementados (TiAl6V4, con recubrimiento de HA, geometría hexagonal): longitud 120 mm, diámetro de vástago de 12-18 mm con incrementos de 1 mm.
— Vástagos cementados (CoCrMo, geometría hexagonal): longitud 120 mm, diámetro de vástago de 11-17 mm con incrementos de 2 mm.
— Posibilidad de vástagos/orificios a medida.
— Malla de reconstrucción Trevira® (teleftalato de polietileno).
— Fémur distal (CoCrMo): 110 mm derecha/izquierda.
— Meseta tibial cementada (CoCrMo): S, M, L; superficie de deslizamiento de PE: S, M, L.
— Vástagos tibiales no cementados (TiAl6V4): longitudes 120, 160 y 200 mm, diámetro 12-18 mm con incrementos de 2 mm.
— Vástagos tibiales cementados (CoCrMo): longitudes 120, 160 y 200 mm, diámetro 11-15 mm con incrementos de 2 mm.
— Acoplamiento m-o-m (CoCrMo).
— Reemplazo de rótula (UHMW-PE): cementado.
Anestesia y posición del paciente
— Intervención con anestesia general y colocación de un catéter peridural.
— Paciente en posición de decúbito supino o en posición lateral.
— Dibujar la inserción prevista.
Técnicas quirúrgicas
(Figs. 2-13)
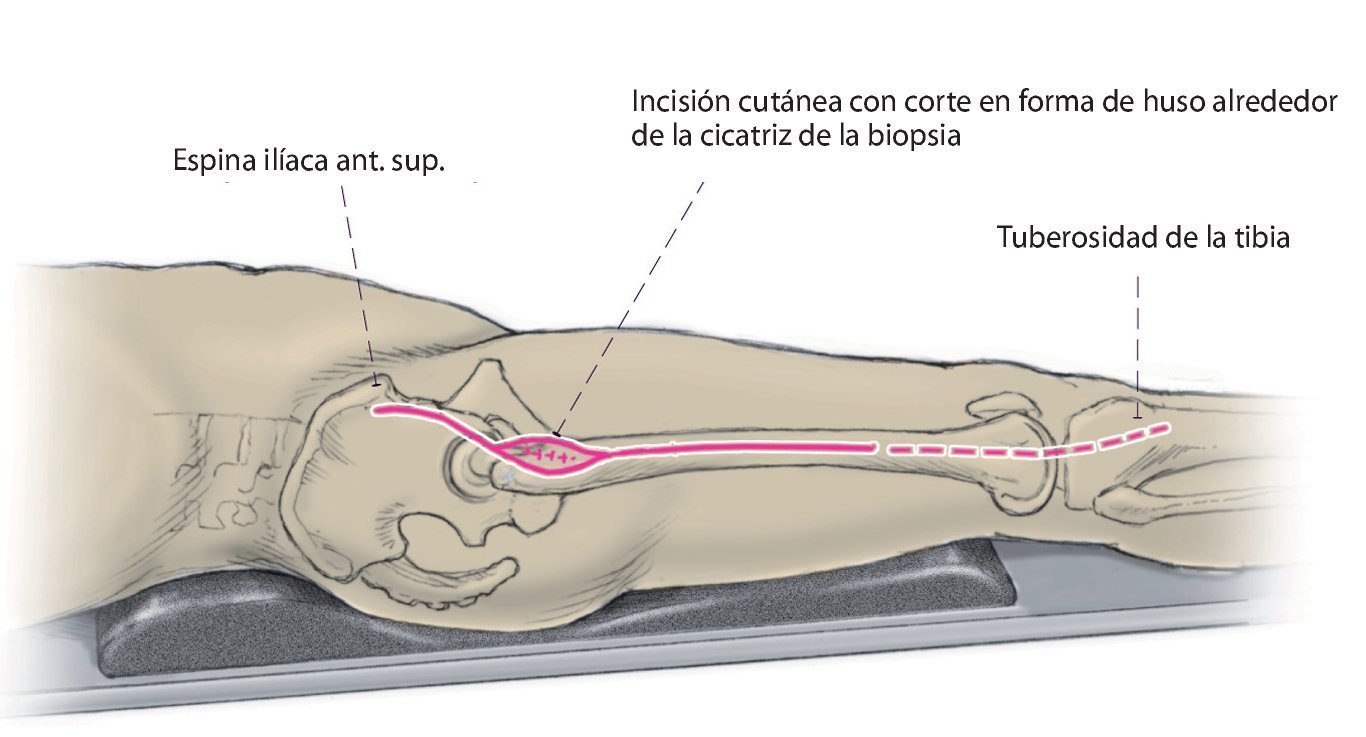
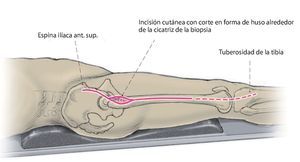
Fig. 2. La incisión cutánea transcurre algo distal de la espina ilíaca anterior superior rodeando la cicatriz de la biopsia hasta el tercio distal del músculo superior (línea continua). Para el reemplazo de fémur total, la inserción se prolongará lateralmente a la rótula pasando por la rodilla hacia distal hasta la tuberosidad de la tibia (línea discontinua).
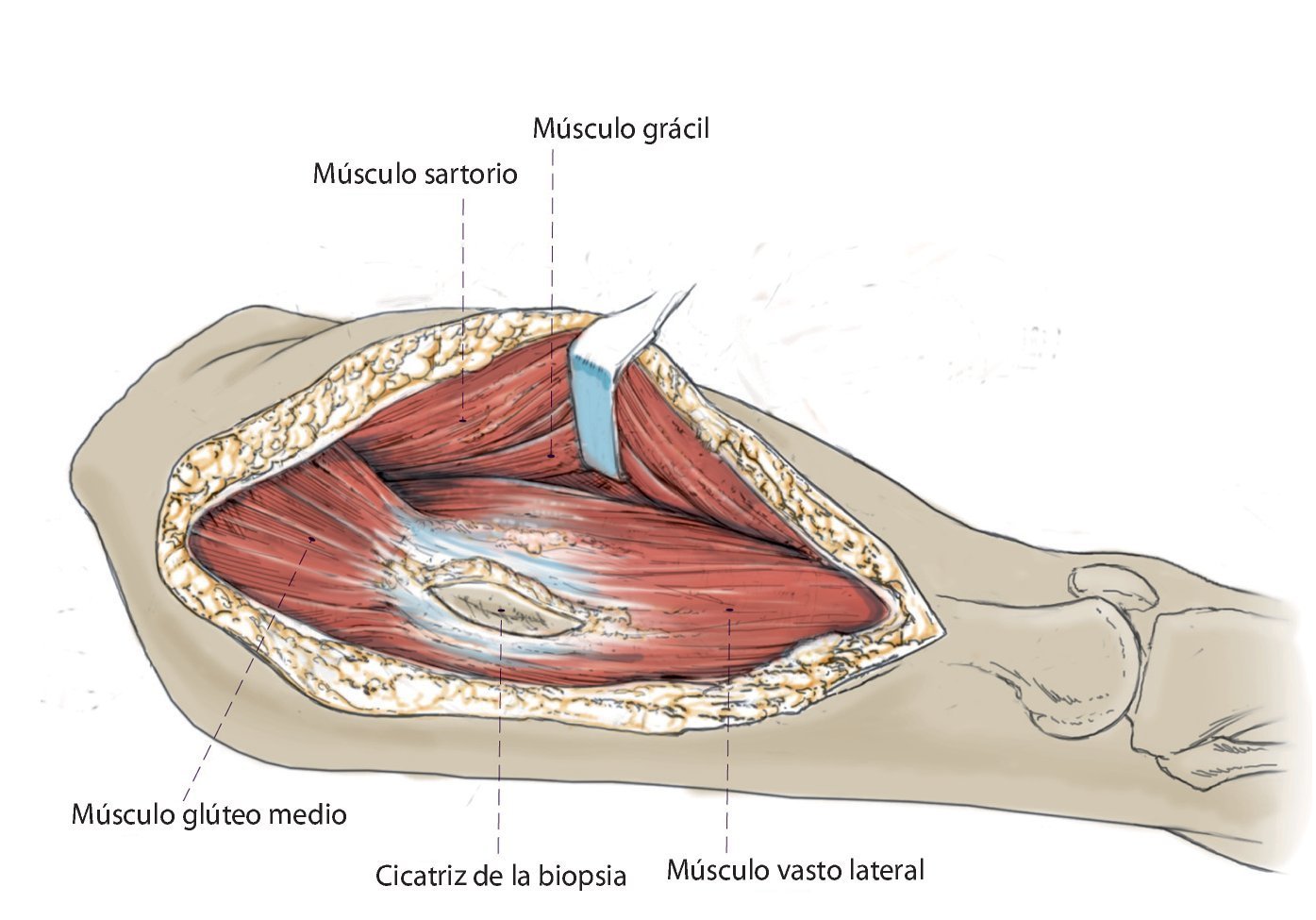
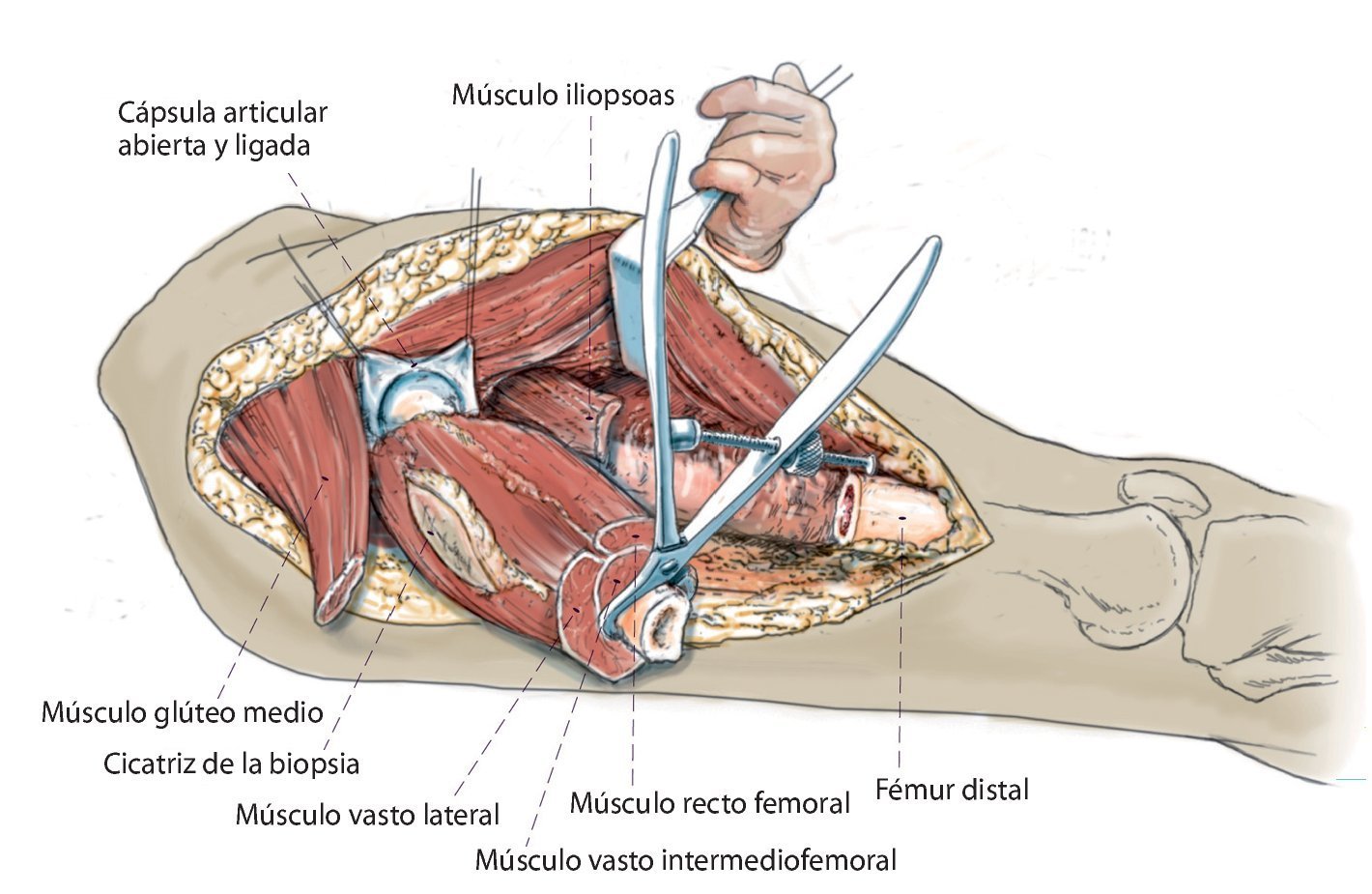
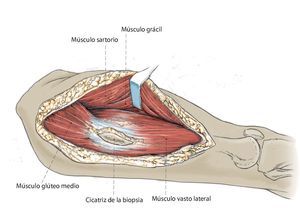
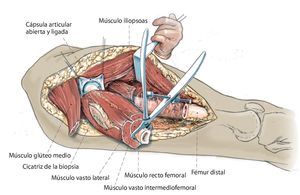
Fig. 3. Exposición de la fascia lata y apertura longitudinal de la misma a lo largo de toda la longitud del abordaje. En la espina ilíaca anterior superior se separa parcialmente la inserción del músculo tensor de la fascia lata y se mantiene sujeto hacia dorsolateral. El músculo sartorio se mantiene sujeto hacia ventral. Exposición del músculo glúteo medio y del músculo vasto lateral con sus respectivas inserciones en el trocánter mayor.
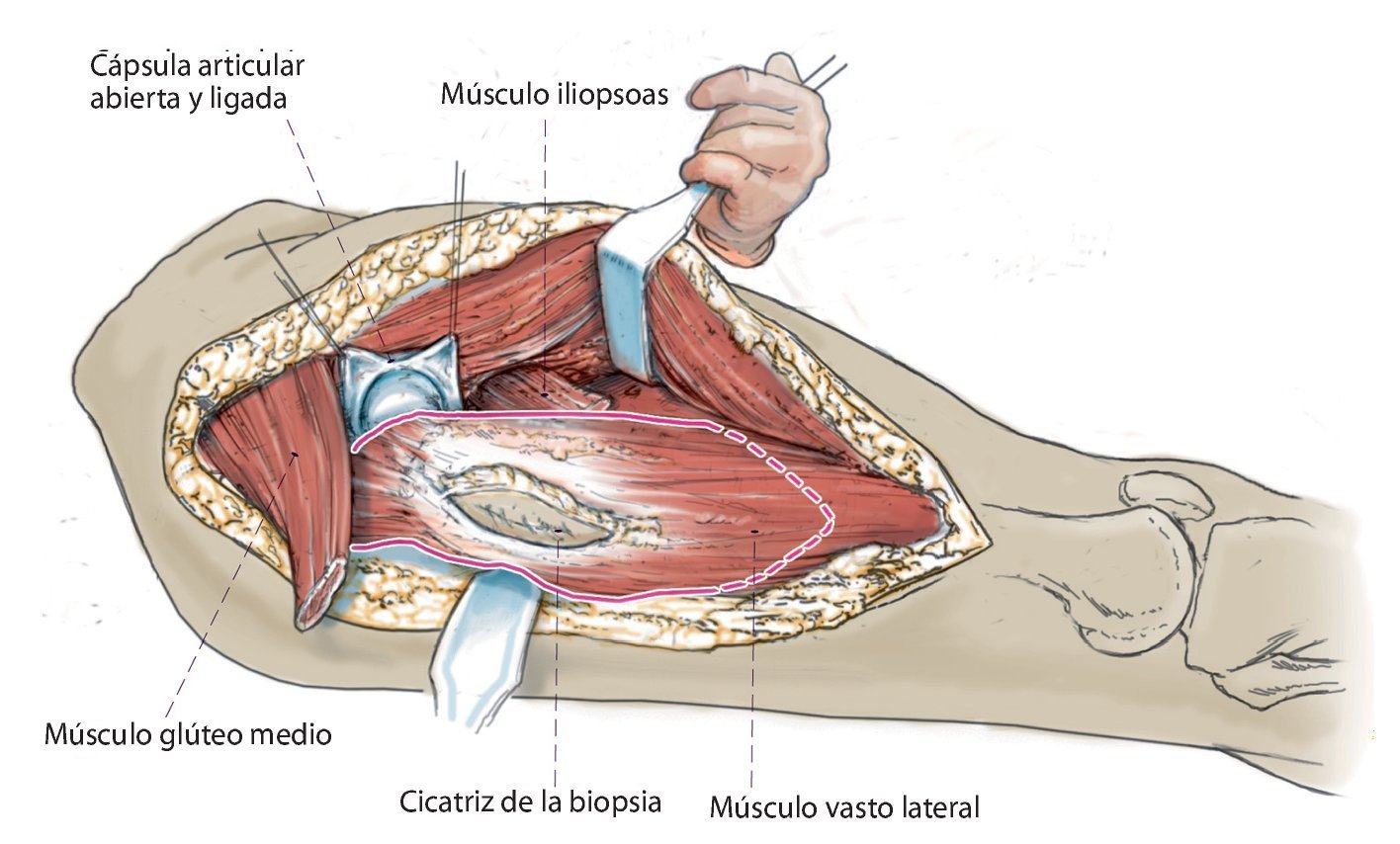
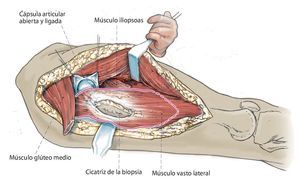
Fig. 4. Tras la ligadura/electrocauterización de algunas ramas de la arteria circunfleja femoral lateral, exposición y desprendimiento del músculo iliopsoas del trocánter menor y separación del músculo glúteo medio del trocánter mayor, con el margen de seguridad respectivo hacia el hueso. A continuación se refuerzan los muñones tendinosos con material de sutura no reabsorbible para su refijación posterior a la malla de reconstrucción. En caso de que la expansión del tumor lo permita, es aconsejable osteotomizar una porción del trocánter mayor con el músculo glúteo preservado del fémur. En caso de que la unión de músculo vasto lateral y músculo glúteo medio se pueda conservar, se recomienda hacerlo siempre.
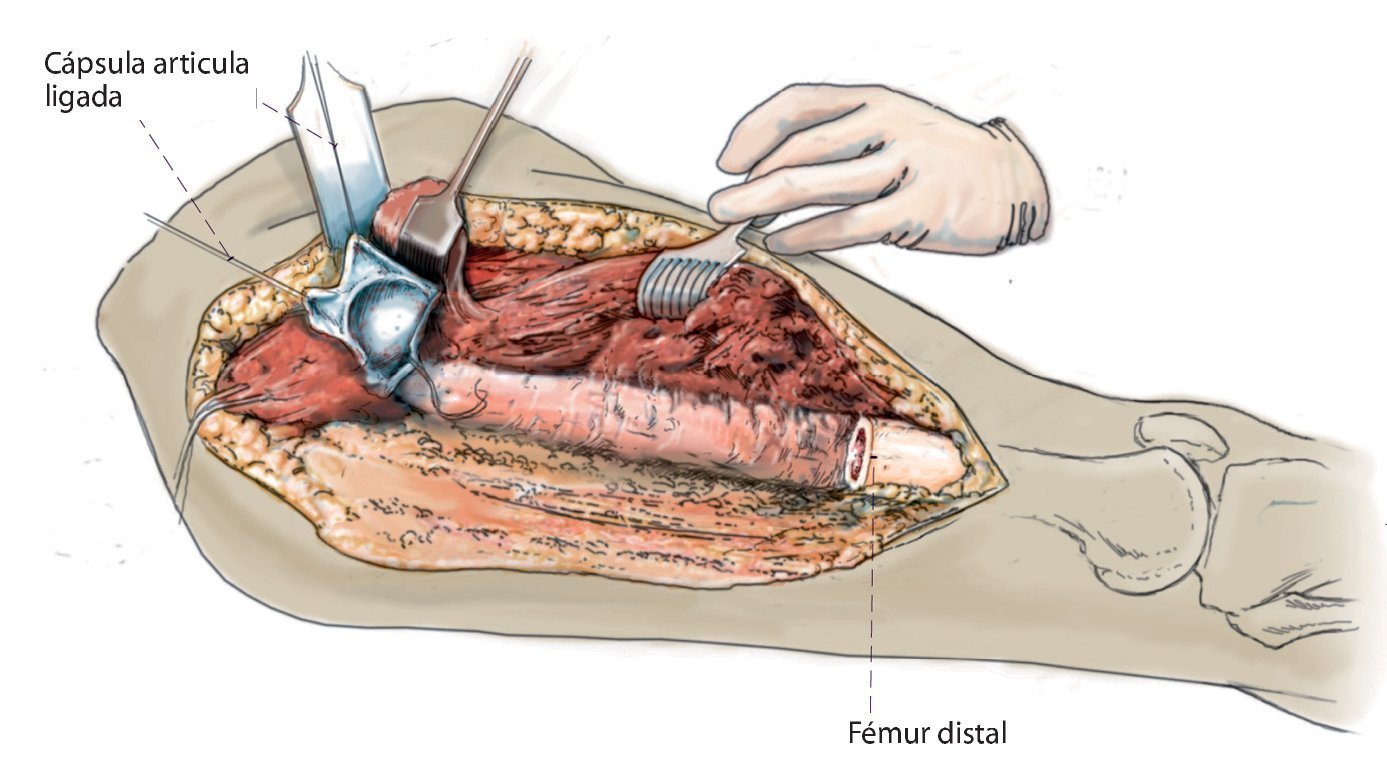
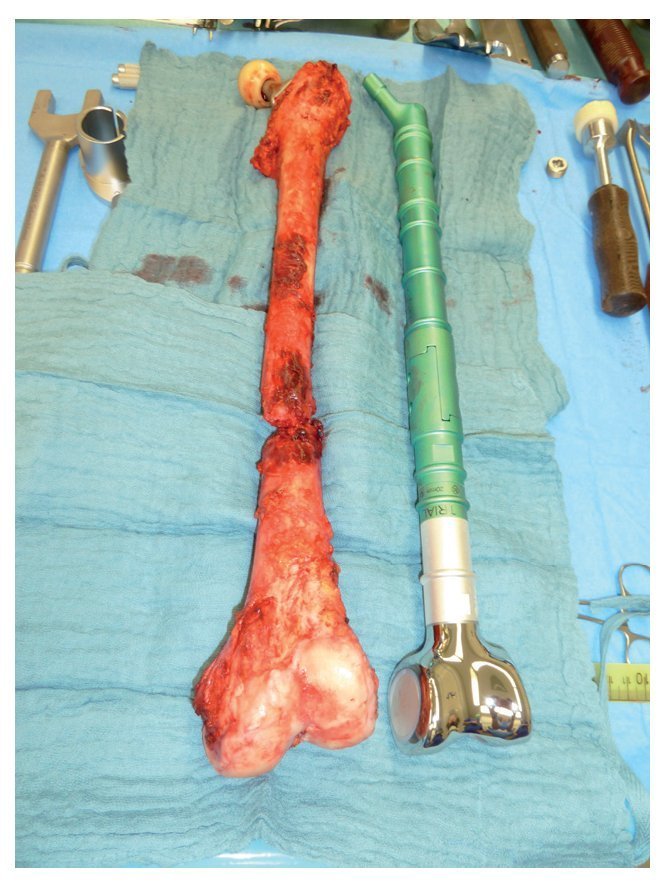
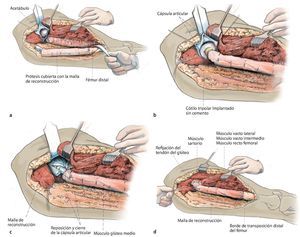
Fig. 5. Exposición de la cápsula ventral de la articulación de la cadera. La altura de la separación transversal distal que se realiza a continuación del músculo vasto lateral, del músculo vasto intermedio y del músculo recto femoral se rige en función de la extensión tumoral extraósea. La cápsula articular se conserva siempre y cuando el tumor lo permita. Se puede utilizar para cubrir el cuello del vástago de la prótesis y sirve de protección contra luxaciones. Osteotomía de fémur con 3 cm como mínimo de margen de seguridad respecto al tumor según la planificación preoperatoria. Biopsia de médula ósea del fémur distal y envío de la muestra al diagnóstico rápido histopatológico para determinar si el borde de la resección está libre las células tumorales. En el caso de un reemplazo de fémur total se realizará además una artrotomía lateral con resección del ligamento cruzado anterior y posterior, de los ligamentos colaterales y de los meniscos con preservación del aparato extensor. Sujetar el extremo distal del fémur con una pinza Verbrügge para un mejor manejo del espécimen quirúrgico. Después, separación paso a paso del grupo aductor desde el interior y del músculo glúteo máximo desde el lado dorsal.
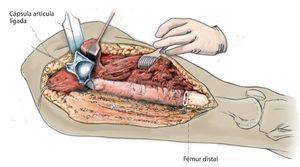
Fig. 6. Ligadura de la cápsula articular de la cadera después de la resección del fémur proximal.
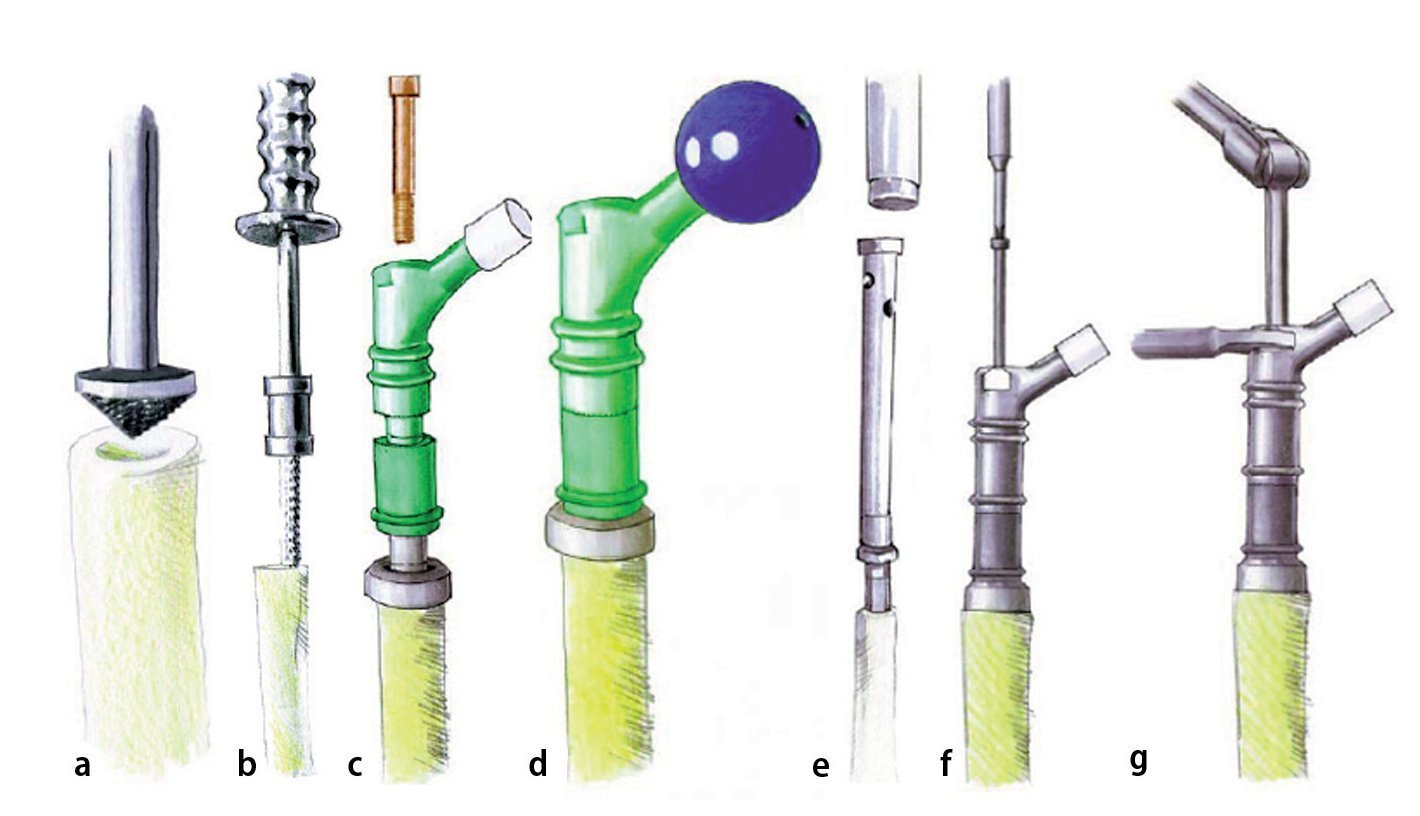
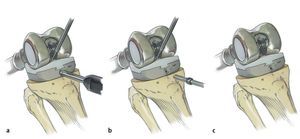
Fig. 7. Preparación del fémur. a) Fresado plano de la diáfisis distal del fémur con una fresa cónica. b) Fijación externa del fémur con una pinza Verbrügge; luego, escariar paso a paso el canal medular con la fresa teniendo en cuenta la antecurvación de la fresa (marca anterior) y del fémur hasta alcanzar un press-fit seguro. c) Montaje de los componentes de prueba en base al tamaño de la última fresa utilizada, insertada todavía dentro de la diáfisis. d) Reposición con cabeza de prueba. e) Introducción del vástago definitivo (no cementado: tamaño de vástago = tamaño última raspa; cementado = tamaño de vástago = tamaño última raspa - 2 mm). f) Montaje del componente femoral proximal definitivo según la planificación de longitudes preoperatoria con los tornillos correspondientes (tabla del proveedor) sobre el vástago implantado. Regulación de la anteversión deseada del fémur proximal con incrementos de 5º. g) Apretar el (los) tornillo(s) y el contra tornillo proximal asegurando el montaje con la llave de boca. (Cedido amablemente por la empresa Implantcast).
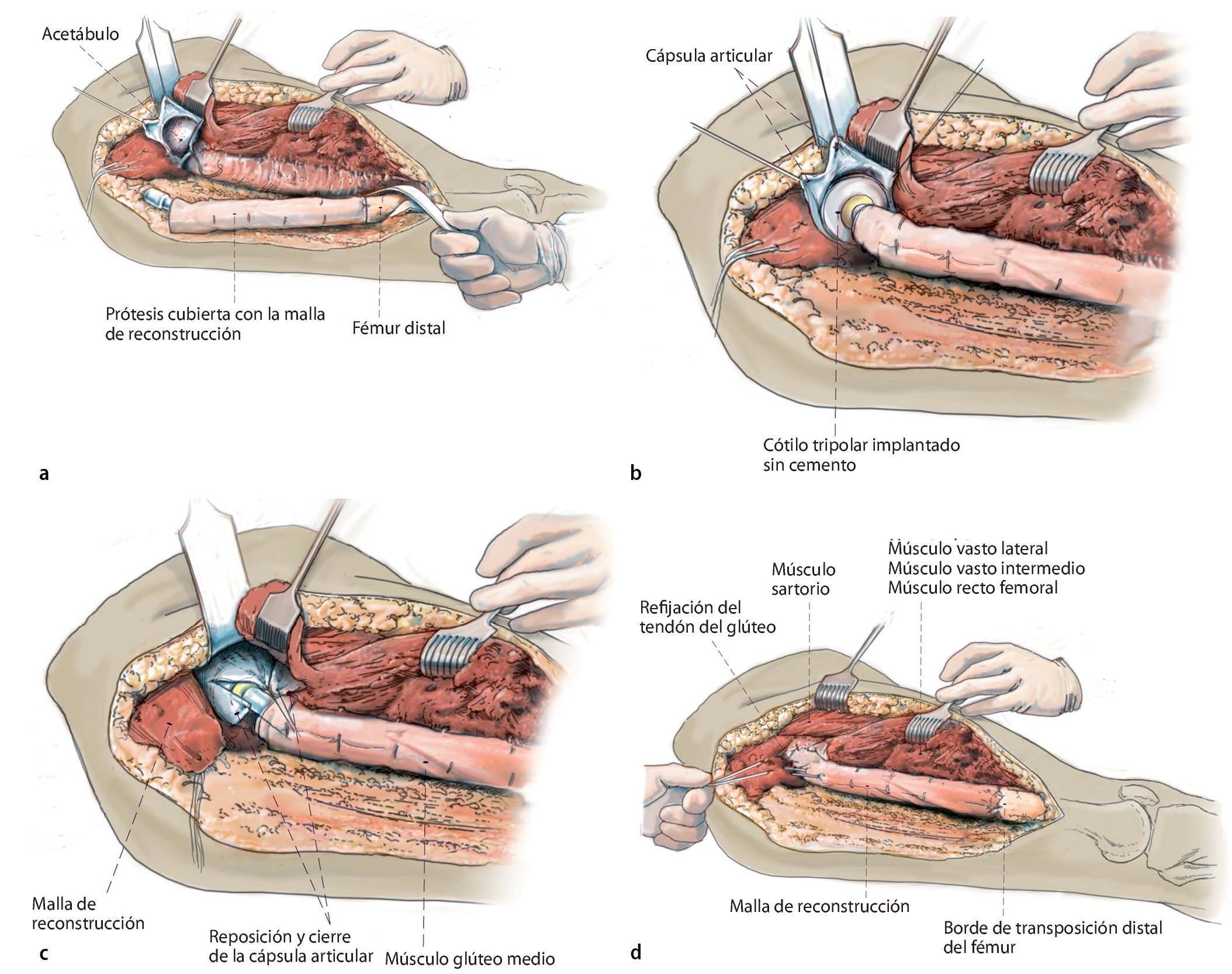
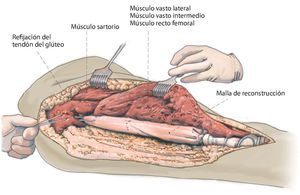
Fig. 8. Cubrir la prótesis con la malla de reconstrucción antes de montar la cabeza (a). La fijación se llevará a cabo mediante hilos de sutura no reabsorbibles (por ejemplo, Ethilbond®) en los anillos de retención de la prótesis y en los bordes de resección distal del músculo. En proximal, la malla se puede fijar a los restos de la cápsula articular de la articulación de la cadera o, en caso de que esta falte, mediante anclas de sutura. Reposición y cierre de la cápsula por encima del cuello protésico como protección ante luxaciones (b, c). La implantación no cementada de un cótilo tripolar se ha realizado previamente por el lado del acetábulo (Polarcup® Sistema de Modularidad Dual, marca Smith and Nephew, Memphis, TN, USA). A continuación, sutura de la malla a la cápsula y refijación del músculo a la malla (d).
Fig. 9. Reemplazo de fémur total. Tras la resección del fémur completo a través del abordaje lateral ampliado (. fig. 2), se determinará la longitud de la prótesis tumoral en función de la comparación con el espécimen quirúrgico colocado sobre la mesa o según la planificación preoperatoria. A continuación, montaje de los componentes de prueba (aquí, un ejemplo de una fractura patológica distal de una endoprótesis de cadera implantada).
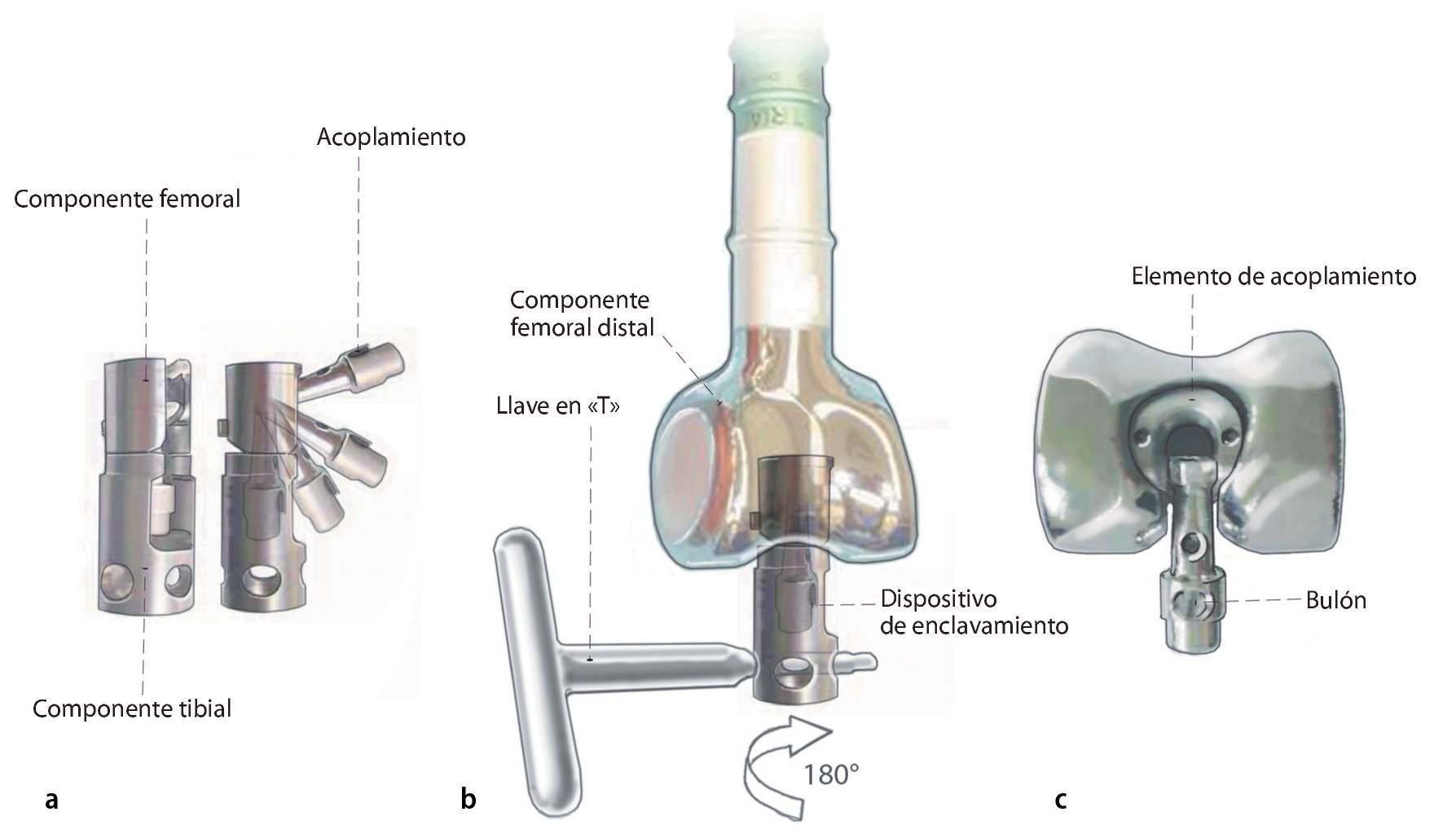
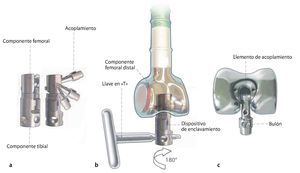
Fig. 10.a-c Preparación de la tibia. La preparación de la tibia para el reemplazo total de fémur se llevará a cabo según las indicaciones del sistema protésico utilizado y se deberá realizar, en general, de acuerdo con la técnica de implantación de una prótesis de rodilla convencional. En el caso del reemplazo de fémur MUTARS® total para acoplar los componentes femoral y tibial, se montará en primer lugar el acoplamiento. Para ello, se girará el acoplamiento del cierre 100º aproximadamente hasta que enrase en el casquillo del dispositivo de enclavamiento. A continuación, el dispositivo de enclavamiento junto con el acoplamiento se introducirá en la entalla del componente femoral distal y con ayuda de la llave en «T» se girará 180º en sentido de las agujas del reloj. El elemento de acoplamiento está posicionado correctamente cuando el bulón cae del casquillo del dispositivo de enclavamiento. A continuación, se extrae el dispositivo de enclavamiento.
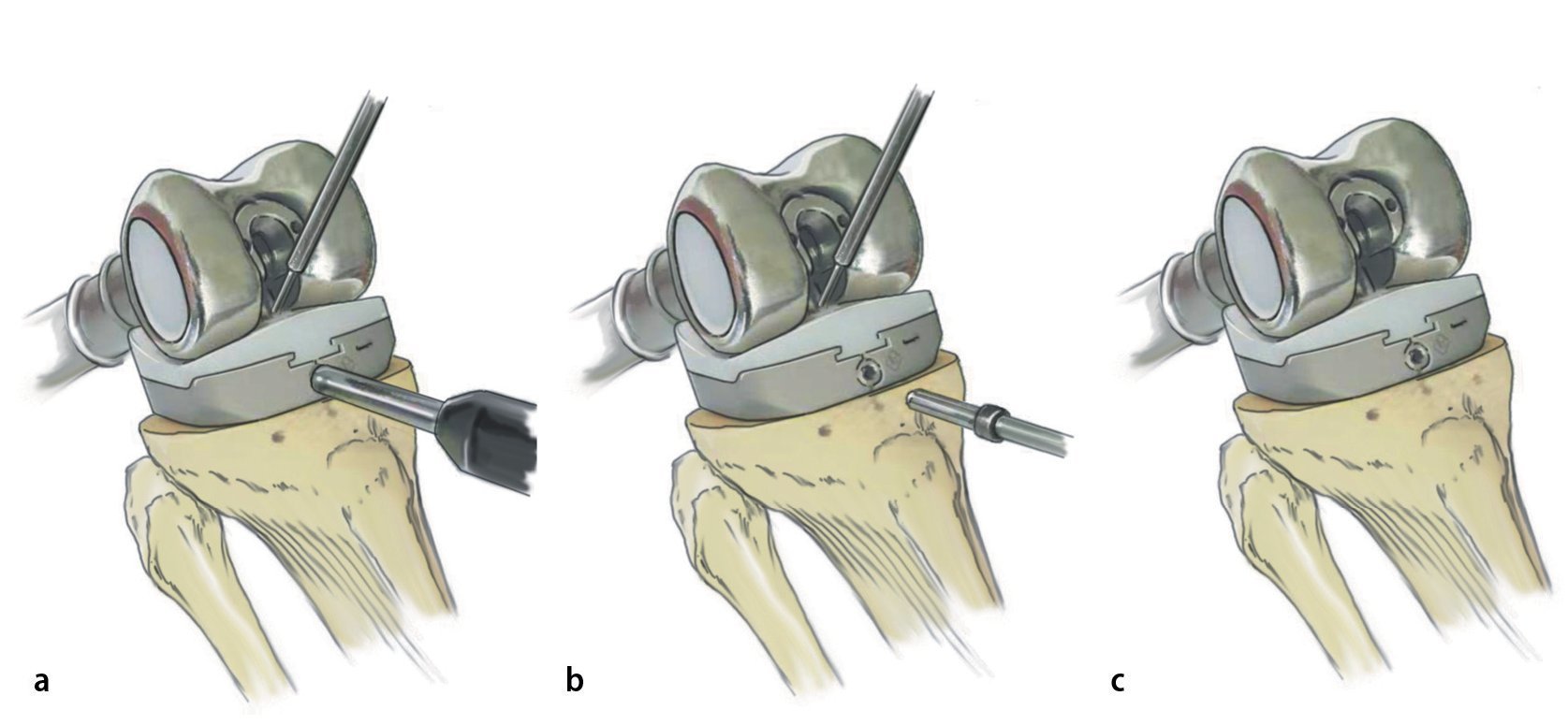
Fig. 11.a-c Después de introducir el impactador en el orificio se insertará el acoplamiento en el surco de la meseta tibial. El posicionador se introducirá desde ventral en el orificio del vástago y una vez alineado correctamente el vástago se volverá a extraer. Finalmente, los enclavamientos y el contra tornillo se atornillarán con el limitador del par de giro.
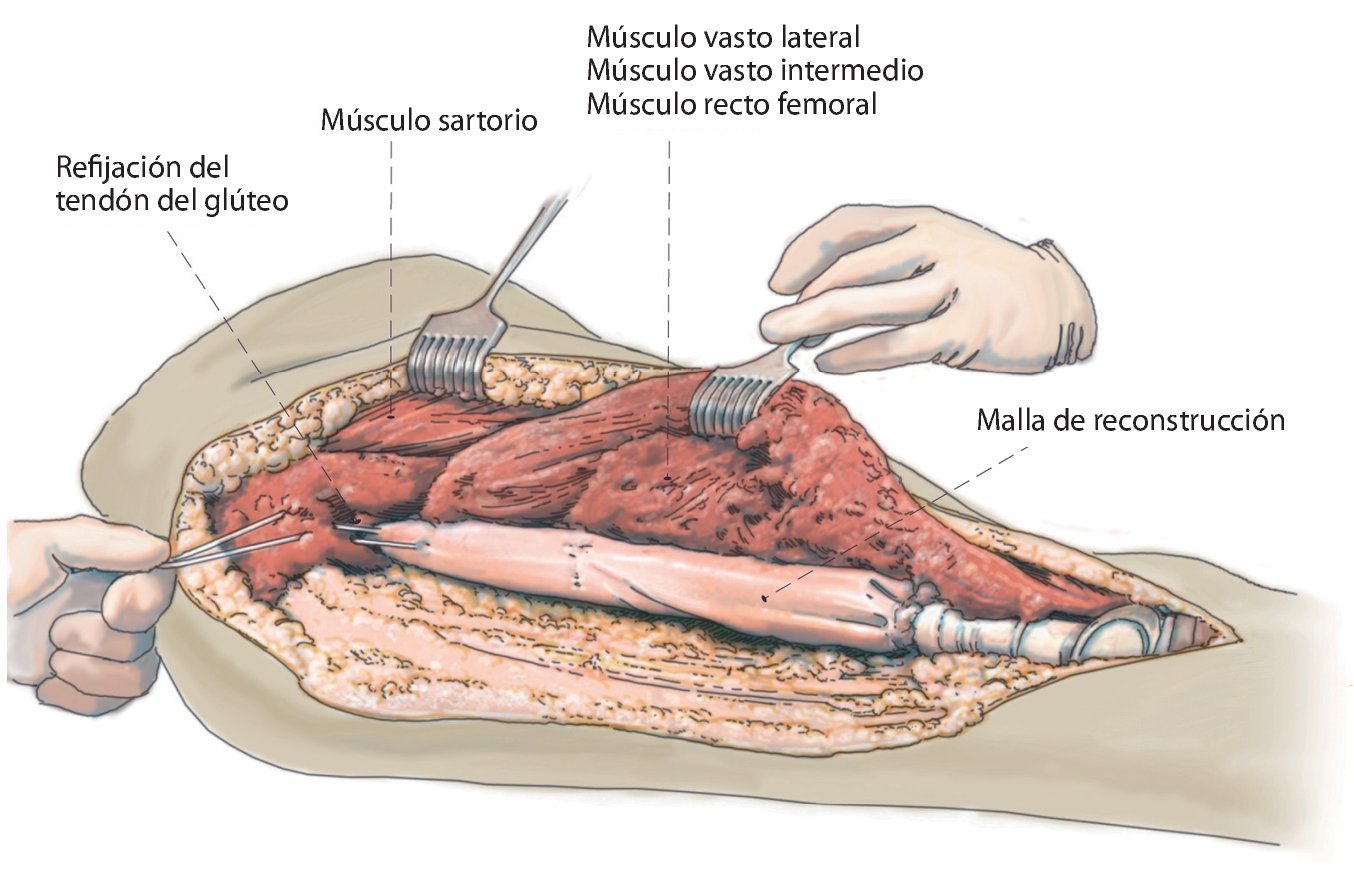
Fig. 12. Situs intraoperatorio tras la implantación de un reemplazo de fémur total con refijación del tendón del glúteo a la malla de reconstrucción.
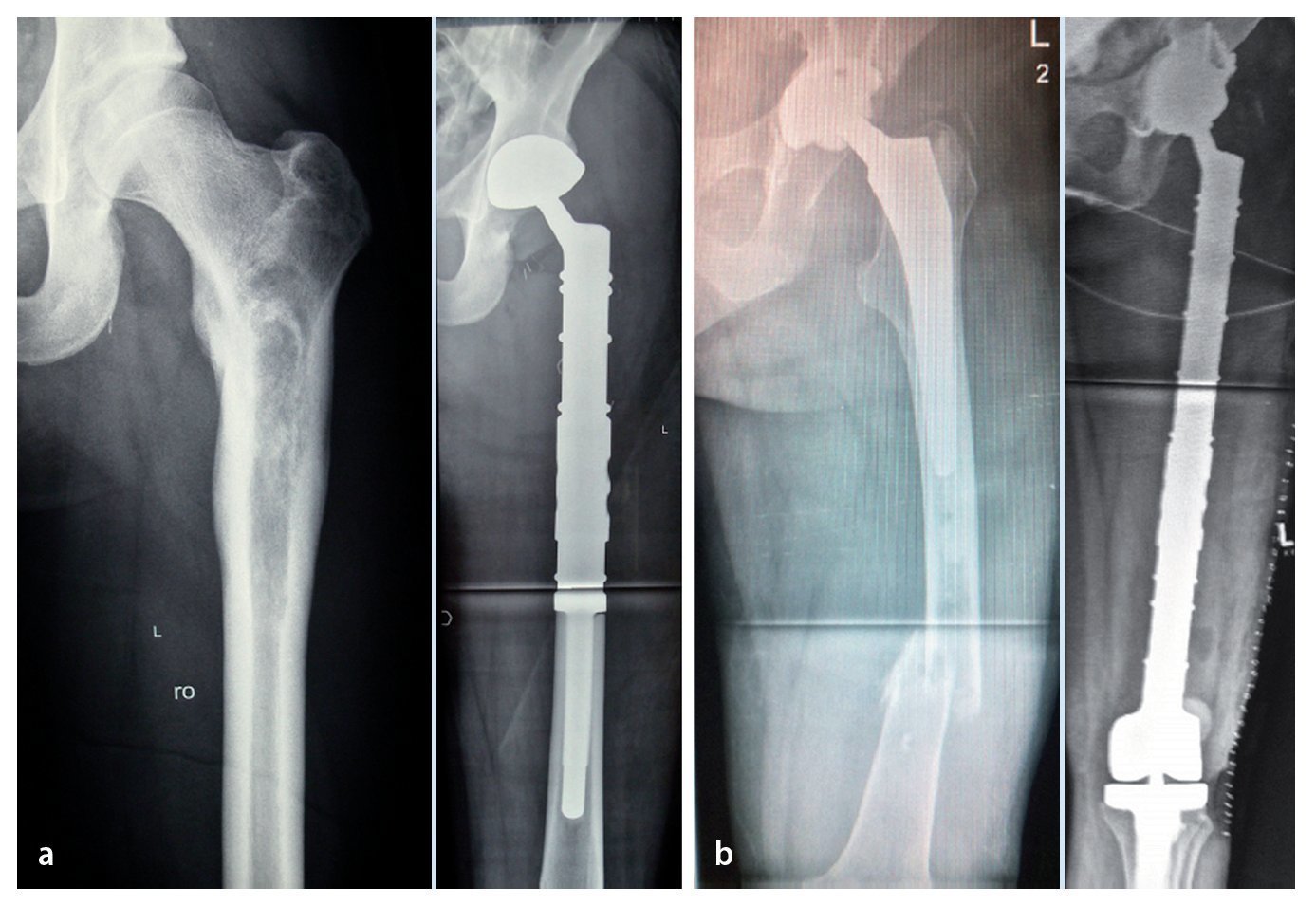
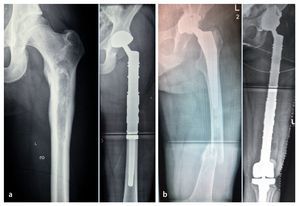
Fig. 13. Radiografías pre y postoperatorias después de la implantación de una prótesis de fémur proximal no cementada con cótilo tripolar no cementado en el caso de un sarcoma Ewing (a) y de un reemplazo de fémur total con anillo de reconstrucción acetabular y cótilo tripolar cementado en el caso de una fractura patológica distal de una artroplastia de cadera implantada en el caso de un condrosarcoma (b).
Tratamiento postoperatorio
— Profilaxis antiinfecciosa peri y postoperatoria, por ejemplo, con cefalosporina de tercera generación.
— Vendaje elástico de la pierna mediante sistema de vendaje spica.
— Profilaxis trombótica mediante medicamentos y fisioterapia hasta conseguir la carga total.
— Uso de drenajes Redon durante 3-5 días postoperatorios.
— Removilización lo más temprana posible con 20 kg de carga parcial.
— Evitar sentarse en asientos muy bajos, así como la aducción de caderas durante seis semanas postoperatorias.
— En caso de reemplazo total de fémur o amplia preparación del aparato de extensión, se recomienda el uso temprano de una férula de movimiento (CPM).
Errores, riesgos y complicaciones
— Durante el escariado paso a paso del canal medular y durante la inserción sin protección del vástago protésico con una pinza para sujeción de huesos (pinza Verbrügge) es posible fracturar la diáfisis femoral. En este caso, se realizará la reposición anatómica de los fragmentos y la osteosíntesis con alambres de cerclaje. Para aumentar la estabilidad primaria se deberá aprovechar la posibilidad del enclavamiento transversal distal del vástago.
— Las infecciones que aparecen durante las primeras cuatro semanas después de la implantación (infecciones tempranas) se pueden tratar, en la mayoría de los casos, mediante el recambio de todos los componentes modulares, un desbridamiento extensivo y una antibiosis, que se pautará en función de las bacterias con el fin de preservar la diáfisis37.
— En caso de que la infección aparezca después de las primeras cuatro semanas posteriores a la implantación primaria (infección tardía), se realizará preferentemente un cambio en dos o varios tiempos con desbridamiento de tejido óseo y de partes blandas infectado, así como una antibiosis, que se pautará según el antibiograma. El mismo procedimiento es válido independientemente del momento de la aparición de la infección en caso de presencia de bacterias o de gérmenes multirresistentes2.
— Si a pesar del empleo de un sistema acetabular con forma de tridente se produjera una luxación de la prótesis, entonces se deberá intentar en primer lugar una reposición cerrada. Esta suele ser por regla general más difícil en sistemas acetabulares en tridente que en acetábulos convencionales en la cirugía endoprotésica de cadera. También se puede producir una interposición de piezas de la malla de reconstrucción, de modo que una reposición cerrada sería imposible.
— Si la reposición cerrada tiene éxito, se recomienda la estabilización externa de la cadera con una ortesis durante seis semanas. En situaciones cerradas no reposicionables, así como en casos de luxaciones recidivantes, se realizará una revisión abierta con verificación de las posibles causas para la inestabilidad (mal posicionamiento del cótilo, antetorsión errónea del cuello protésico, insuficiente fijación de partes blandas a la prótesis).
Resultados
Durante el período de tiempo comprendido entre junio de 2007 hasta diciembre de 2011 se sometió a 20 pacientes (16 mujeres, 4 hombres) a un reemplazo de fémur MUTARS® proximal y a 2 pacientes a un reemplazo un fémur MUTARS® total según la técnica arriba descrita. La edad media en el momento de la intervención fue de 62,0±18,1 años (18-82 años).
Las indicaciones para la intervención fueron 3 tumores óseos malignos primarios (1 sarcoma de Ewing, 1 osteosarcoma y 1 condrosarcoma) y 19 metástasis femorales (9 carcinomas de mama, 4 carcinomas branquiales, 3 carcinomas de células renales, 3 tumores malignos de otro tipo). De las 19 metástasis femorales, 9 presentaban fractura patológica en el momento de la primera entrevista con el paciente. Todos los pacientes fueron sometidos a una resección femoral intraarticular. La longitud de reconstrucción femoral fue de 170 ± 94,3 mm (80-430 mm) de media. En 19 casos se utilizó una malla de reconstrucción.
En el momento de la recopilación de datos se pudo realizar el seguimiento a 15 pacientes durante un periodo de tiempo medio de 20,3 ± 17,2 meses (4- 51 meses). Cinco pacientes con metástasis femorales habían fallecido en el momento del seguimiento posterior a causa de su enfermedad de base y a 2 pacientes no se les pudo localizar.
Los 3 pacientes con tumores óseos malignos primarios no mostraron indicio alguno de recidiva local en el momento del seguimiento posterior. Una paciente con reemplazo de fémur proximal después de una resección amplia de un carcinoma de células renales presentó aproximadamente 1 año después una recidiva local de partes blandes, que requirió de una resección posterior.
En el colectivo formado por 22 pacientes aparecieron 3 infecciones de prótesis profundas (13,6%) y 2 luxaciones (9,1%). No se observó ningún caso de aflojamiento aséptico o de roturas del implante. Hubo un caso de infección temprana que se pudo controlar mediante desbridamiento quirúrgico, cambio de todos los componentes modulares y antibiosis en función de las bacterias. En un paciente fue necesaria la extracción de la prótesis debido a una infección por enterococos. El paciente falleció posteriormente durante la evolución posterior de su enfermedad de base (carcinoma bronquial).
Postoperatoriamente aparecieron dos luxaciones protésicas, que fueron repuestas mediante procedimiento cerrado con anestesia de corta duración y tratadas durante seis semanas con una ortesis estabilizadora. No se dio ningún caso de inestabilidad protésica crónica.
El resultado funcional postoperatorio fue valorado según la escala MSTS (Musculoskeletal Tumour Society) según Ennering11. La escala incluye los factores dolor, función, trayecto, necesidad de tecnologías de apoyo, aceptación emocional del resultado del tratamiento y modelo de marcha. A cada factor se le asignan entre 0-5 puntos según unos criterios establecidos; la puntuación máxima es de 30 puntos (100%). Los porcentajes comprendidos entre 0-25% son considerados malos; entre 26-50%, satisfactorios; entre 51-75%, buenos, y entre 76-100%, muy buenos.
De los 15 pacientes sometidos al seguimiento posterior 3 obtuvieron un resultado funcional muy bueno, 4 un resultado bueno, 6 un resultado satisfactorio y 2 un resultado malo.
Los presentes resultados confirman los datos de otros estudios respecto a una mayor tasa de complicaciones en este tipo de procedimientos en comparación con la cirugía endoprotésica de cadera convencional. No obstante, los resultados obtenidos tras el reemplazo de fémur proximal y total fueron en su mayoría aceptables29.
Conflicto de intereses. El autor del presente trabajo declara que ni él ni sus coautores tienen conflicto de intereses en relación con la publicación de este trabajo.
Correspondencia
PD Dr. P.H. Pennekamp
Klinik und Poliklinik für Orthopädie und Unfallchirurgie, Rheinische Friedrich-Wilhems-Universität Bonn
Sigmund-Freud-Str. 25, 53127 Bonn (Alemania)
peter.pennekamp@ukb.uni-bonn.de