Objetivo. Control oncológico local del tumor en caso de tumores óseos malignos. Preservación de la función del brazo y de la mano a partir del codo con posibilidad de llevar la mano hasta la boca. Evitar la amputación. Suspensión estable del brazo en la articulación del hombro/en la neoarticulación.
Indicaciones. Sarcoma óseo primario del húmero proximal o de la escápula con afectación articular sin infiltración del paquete vasculonervioso en caso de manifestación primaria. Metástasis óseas de tumores sólidos con grandes defectos óseos en caso de manifestaciones primarias con intención paliativa/curativa o en caso de revisión/ recidiva después del fracaso de los procedimientos previos.
Contraindicaciones. Infiltración tumoral del paquete vasculonervioso. Falta de posibilidad de cubrimiento muscular de la prótesis debido a la extensión de la infiltración tumoral a las partes blandas del brazo.
Técnica quirúrgica. Abordaje transdeltoideo con separación del músculo deltoides. Preparación del húmero afectado por el tumor con liberación extensiva del paquete vasculonervioso. Mantener un margen de separación oncológicamente suficiente alrededor de la zona reseccionada tanto de las partes blandas como del borde óseo a reseccionar. Implantación cementada o no cementada de la prótesis tumoral. Reconstrucción de la articulación y fijación del brazo mediante utilización de malla de reconstrucción. Si es preciso, formación de una articulación artificial en caso de resección extraarticular. Refijación lo más anatómica posible de la musculatura reseccionada inicialmente sobre el implante para recuperar la función.
Resultados. Inmovilización del brazo mediante, por ejemplo, un vendaje de Gilchrist durante las 4-6 semanas postoperatorias. Realización de ejercicios pasivos de la articulación del codo después de 3-4 semanas. Ejercicios activos del hombro y de la articulación del mismo a las 4-6 semanas postoperatorias como muy pronto. Drenaje linfático y bomba venosa a partir del primer o segundo día postoperatorio.
Redacción
D.C. Wirtz, Bonn
Ilustraciones
J. Kühn, Heidelberg
Introducción
El húmero y más concretamente la parte proximal del mismo es una de las zonas más afectadas por los tumores óseos malignos primarios y secundarios1,11,21.
La extracción quirúrgica del hueso afectado por el tumor resulta decisiva en la terapia multimodal de este tipo de enfermedades, tanto en el caso de tumores óseos primarios como —cada vez con mayor frecuencia— en el caso de las metástasis de tumores sólidos. Estas enfermedades van acompañadas de defectos óseos y de defectos de las partes blandas masivos que requieren de una reconstrucción compleja. Sin embargo, la radicalidad de la cirugía oncológica es notablemente diferente en los dos tipos de tumores en función de la enfermedad de base existente.
En la terapia de tumores óseos malignos primarios (por ejemplo, osteosarcoma, sarcoma de Ewing, condrosarcoma, histiocitoma fibroso maligno) se ha impuesto la resección amplia del tumor frente a la amputación1,21, sobre todo a raíz de la creación de protocolos de quimioterapia efectivos. De este modo, en la mayoría de los casos es posible preservar la extremidad y los procesos ablativos se reservan para casos excepcionales4,14,18.
La posibilidad de una resección amplia del tumor según Enneking3 con el objetivo de conservar la extremidad requiere, sin embargo, de la siguiente premisa oncológica: una capa de partes blandas de tejido sano lo suficientemente grande tiene que recubrir completamente el tumor y se debe mantener un margen de seguridad intraóseo de aproximadamente 3-4 cm de hueso sano. En caso de que existan infiltraciones del paquete vasculonervioso, no es posible conservar la extremidad desde el punto de vista oncológico. La infiltración tumoral de la articulación o de la cápsula articular requiere de una resección extraarticular. En este caso se deberá reseccionar también la articulación glenohumeral cerrada. Por regla general, siempre que sea posible hay que dar preferencia a procedimientos reconstructivos que sirven para conservar el brazo como órgano de prensión funcional frente a las intervenciones que implican la amputación.
Existen diferentes procedimientos quirúrgicos para la reconstrucción del defecto: además de la reconstrucción mediante endoprótesis tumorales, se llevan a cabo procedimientos de reconstrucción biológicos, especialmente en el caso de niños entre 6-8 años bajo indicaciones especiales. Así pues, en pacientes muy jóvenes con el cartílago de crecimiento todavía abierto uno de los posibles procedimientos es la utilización de un injerto de peroné vascularizado o, como alternativa, una intervención «clavícula pro húmero» en caso de defectos muy pequeños (< 10 cm). A causa de las tasas extremamente altas de complicaciones secundarias se ha dejado de recomendar la utilización de aloinjertos puros e incluso de aloinjertos compuestos6,8,16,17,20. Por tanto, en la mayoría de los casos se han impuesto las endoprótesis tumorales modulares para la reconstrucción del defecto óseo, cuya gran modularidad permite reaccionar fácilmente a las necesidades intraoperatorias y obtener al mismo tiempo buenos resultados a largo plazo de la vida de la prótesis. En cuanto al diseño de la prótesis, se puede elegir entre varios modelos: entre cabezas de húmero configuradas anatómicamente o bien modelos de prótesis inversas para la reconstrucción del defecto óseo. El principal factor de influencia para la elección del tipo de implante es la magnitud del defecto de partes blandas previsto. En caso de que se conserve la función deltoidea (posibilidad de conservación del nervio axilar) y pueda reconstruirse gran parte del manguito rotador, el uso de una prótesis inversa durante la resección intraarticular ofrece una ventaja funcional frente a una prótesis con forma anatómica. Ello es aplicable especialmente para el rango de movimiento activo, tal como indica Kassab en su estudio13.
En el tratamiento quirúrgico de metástasis los requisitos son diferentes. En primer lugar, hay que diferenciar entre objetivo paliativo y objetivo curativo. Las metástasis precoces e incluso las metástasis tardías de la mayoría de tumores sólidos son tratadas con cirugía paliativa. En este tipo de cirugía, además de la resección del tumor en sí, se da prioridad también a la mejora de la funcionalidad/calidad de vida del paciente, ya sea con el fin de reducir el dolor o para evitar una exulceración del tumor. Especialmente en el caso de tumores que van acompañados de la destrucción de la cabeza humeral o de defectos óseos masivos, o bien en caso de osteosíntesis (por ejemplo, intramedular, osteosíntesis de placas) sin estabilidad suficientemente larga5,22,23, se aplica el principio de que el procedimiento aplicado debería sobrevivir al paciente. Con la mejora continua de las opciones de terapia multimodales se prolonga la supervivencia de estos pacientes, por lo que también aumentan los requisitos que tienen que cumplir los tratamientos de las metástasis óseas, ya sea en relación a la función como en cuanto a la supervivencia de la reconstrucción. Así pues, también en situaciones paliativas la indicación suele ser la resección segmentaria y la implantación de una prótesis tumoral. A diferencia de los sarcomas óseos primarios, sin embargo, el borde de resección y, por consiguiente, la magnitud de la resección de partes blandas, se puede reducir siempre y cuando se trate de una resección marginal o incluso, en algún caso aislado, de una resección intralesional. Ello es posible sobre todo en caso de tumores sensibles a los efectos de la radioterapia. Por tanto, en este colectivo de pacientes es posible preservar con mayor frecuencia el nervio axilar y seguir antes la indicación de implantación de una prótesis inversa.
Las metástasis tardías solitarias de carcinomas individuales (p. ej. carcinoma de células renales) se deben considerar como casos excepcionales, cuya terapia se realiza en parte bajo puntos de vista curativos. En estos casos se debería llevar a cabo una resección amplia según el sarcoma primario.
Así pues, para realizar una resección segmentaria y una implantación de prótesis tumoral en el húmero proximal se requiere de una indicación por parte del cirujano. Los requisitos para la indicación de la implantación de un reemplazo endoprotésico de húmero proximal son un diagnóstico por imágenes local (resonancia magnética con medio de contraste, rayos X, TAC si es preciso), así como un diagnóstico completo del estado oncológico actual del paciente (TAC de tórax y abdomen, cintigrafía ósea, en caso necesario PET-TAC, determinación mediante marcador tumoral). Ello es válido tanto para pacientes con sarcomas óseos primarios como para pacientes con metástasis. El diagnóstico por imágenes sirve para determinar la amplitud necesaria de los bordes de resección y para estimar la magnitud de la intervención. Así pues, es esencial realizar una resonancia magnética con medio de contraste a fin de determinar la extensión exacta del tumor y diagnosticar, en caso necesario, la infiltración tumoral de estructuras importantes (por ejemplo, paquete vasculonervioso, articulación).
La planificación de la prótesis también se realiza en base a la resonancia magnética y a la radiografía para determinar la longitud de reconstrucción y el diámetro de vástago necesario. Con respecto a los vástagos protésicos, se puede elegir entre anclajes cementados y no cementados. Por regla general, es preferible utilizar un anclaje cementado excepto en pacientes con una esperanza de vida claramente limitada o en pacientes sometidos a radioterapia local postoperatoria. Con el sistema protésico modular utilizado por nosotros (MUTARS® de la marca Implantcast, fig. 1, 2) la longitud de reconstrucción se deberá adaptar en pasos de 2 cm a la situación intraoperatoria de cada paciente.
Fig. 1. Sistema de prótesis tumoral MUTARIS® de la marca Implantcast. Sinopsis del sistema como representación de la modularidad del implante para la reconstrucción del húmero. (Cedido amablemente por la empresa Implantcast).
Fig. 2. Bandeja de instrumentos (húmero proximal MUTARS®) de la empresa Implantcast para la implantación de la prótesis de húmero proximal. (Cedido amablemente por la empresa Implantcast).
La función postoperatoria prevista de la prótesis de húmero proximal está limitada principalmente por el defecto de partes blandas (especialmente del manguito rotador) y por la pérdida del nervio axilar, que, por regla general, no se puede preservar por consideraciones oncológicas.
El artículo siguiente tiene la finalidad de ofrecer una orientación sobre la indicación y las técnicas quirúrgicas de la reconstrucción del húmero proximal con el uso de prótesis tumorales modulares, así como mostrar los resultados y complicaciones de este tipo de intervenciones.
Principio y objetivo de la intervención
En la resección segmentaria del húmero proximal, la extensión del tumor (manifestación de tumor extrarticular e intraarticular), la entidad tumoral y el objetivo oncológico (curación/paliación) determinan la magnitud de resección necesaria (resección marginal/amplia, resección intraarticular vs. extraarticular) y, por tanto, la magnitud de la pérdida de partes blandas. Sin embargo, por regla general, cuanto mayor sea la cantidad de musculatura seccionada en la parte tendinosa, más fácilmente se podrá realizar la reconstrucción muscular y mejores serán los resultados funcionales. Además del control local oncológico, el objetivo de la intervención es la conservación de la mejor función posible del brazo. No obstante, la función activa de la articulación del hombro en caso de sección del nervio axilar se puede reconstruir solo con muchas limitaciones. Lo esencial en este caso es una suspensión del brazo que permita el uso activo de la articulación del codo y, por consiguiente, una buena función del brazo y de la mano. Ello se consigue mediante el uso de mallas de plástico (por ejemplo, Trevira®, Lars®) denominadas mallas de reconstrucción. Solo en caso de conservación del nervio axilar y, por ejemplo, de la utilización de modelos de prótesis inversas se puede conseguir también un adecuado rango de movimiento del hombro activo.
Ventajas
— Procedimiento de reconstrucción quirúrgico técnicamente sencillo en comparación, por ejemplo, con reconstrucciones biológicas.
— Alto grado de modularidad del sistema protésico, que permite una gran flexibilidad intraoperatoria (regulación de la longitud de reconstrucción en pasos de 2 cm).
— Posibilidad de una reconstrucción de defectos óseos extensivos hasta el reemplazo total humeral.
— Suspensión estable del brazo por la utilización de una malla de reconstrucción.
— Bajas tasas de complicaciones.
Desventajas
— Coste del implante.
— Función limitada del movimiento activo del hombro.
Indicaciones
Indicaciones absolutas
— Todos los tumores óseos malignos primarios del húmero proximal o tumores de escápula con infiltración de la articulación glenohumeral sin infiltración de la vaina vasculonerviosa.
— Tumores óseos malignos secundarios (metástasis de tumores sólidos/ linfomas) con destrucción ósea y/o afectación articular masivas.
— Tras una revisión después de un fracaso de osteosíntesis iniciales (por ejemplo, osteosíntesis con placas, osteosíntesis intramedular) en caso de metástasis.
— Resección extraarticular en caso de infiltraciones de la articulación glenohumeral.
Indicaciones relativas
— Niños menores de ocho años.
— Metástasis óseas sensibles a la radioterapia sin defectos óseos masivos.
Contraindicaciones
— Infiltración tumoral de la vaina vasculonerviosa.
— Niños menores de 6-8 años (falta de cubrimiento de partes blandas; se utilizarán preferentemente reconstrucciones biológicas, por ejemplo, injerto vascularizado de peroné).
— Tumores superinfectados.
— Complicaciones sépticas después de iniciar la osteosíntesis.
— Niveles bajos de células después de la quimioterapia (leucocitos por debajo de 2.000/µl, trombocitos por debajo de 50.000 µl).
Información para el paciente
— Riesgos quirúrgicos generales.
— Información sobre procedimientos alternativos (por ejemplo, procedimientos de reconstrucción biológicos en caso de sarcomas óseos primarios, procedimientos de osteosíntesis en caso de metástasis).
— Rango de movilidad activa del hombro significativamente limitado.
— Amputación en caso de complicaciones intraoperatorias.
— Resección tumoral inadecuada.
— Recidiva local.
— Infección del implante con necesidad de un cambio de prótesis en dos tiempos.
— Lesión del paquete vasculonervioso, especialmente lesiones del nervio radial en caso de tumores situados en la diáfisis.
Preparación de la intervención
— Realización de una estadificación oncológica completa (TAC de tórax y abdomen, cintigrafía ósea) para excluir posibles complicaciones y para efectuar una predicción general.
— Resonancia magnética compartimental local con medio de contraste para evaluar la expansión del tumor y para excluir lesiones a distancia.
— Radiografías con regla de medición para la planificación preoperatoria del implante.
— Análisis de laboratorio especialmente en el caso de pacientes sometidos a quimioterapia (leucocitos, Hb, trombocitos, coagulación).
— Preparación de reservas de sangre.
Instrumental e implantes
— Instrumentos especiales para el húmero proximal (marca Implant-cast, fig. 1).
— Clavos intramedulares fijos.
— Prótesis tumoral de húmero modular (MUTARS®, marca Implantcast, fig. 2).
— Sierra oscilante para la resección del húmero/escápula en caso de una resección extraarticular.
— Malla de reconstrucción Trevira®.
Anestesia y posición del paciente
— Intervención con anestesia general y colocación de un catéter braquial para la terapia del dolor perioperatorio.
— Paciente en posición de decúbito supino en caso de resección de húmero intraarticular.
— Paciente en posición lateral en caso de resección extraarticular.
— Posicionamiento del brazo con libertad de movimiento.
Técnicas quirúrgicas
(Figs. 3-11)
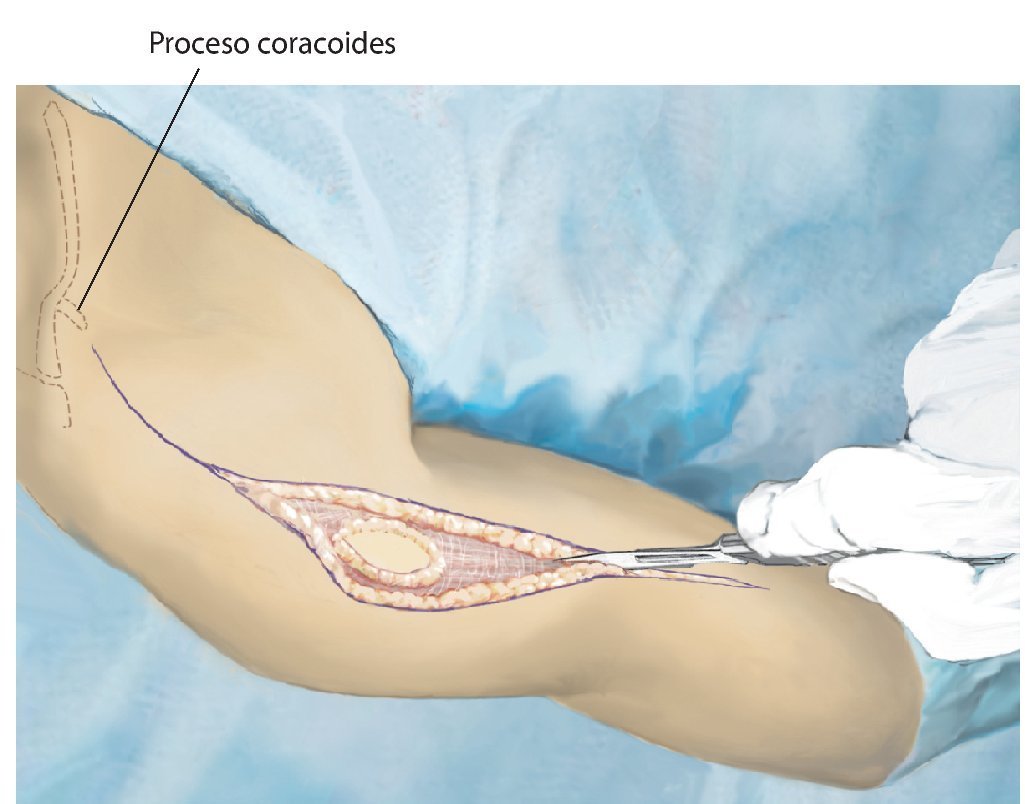
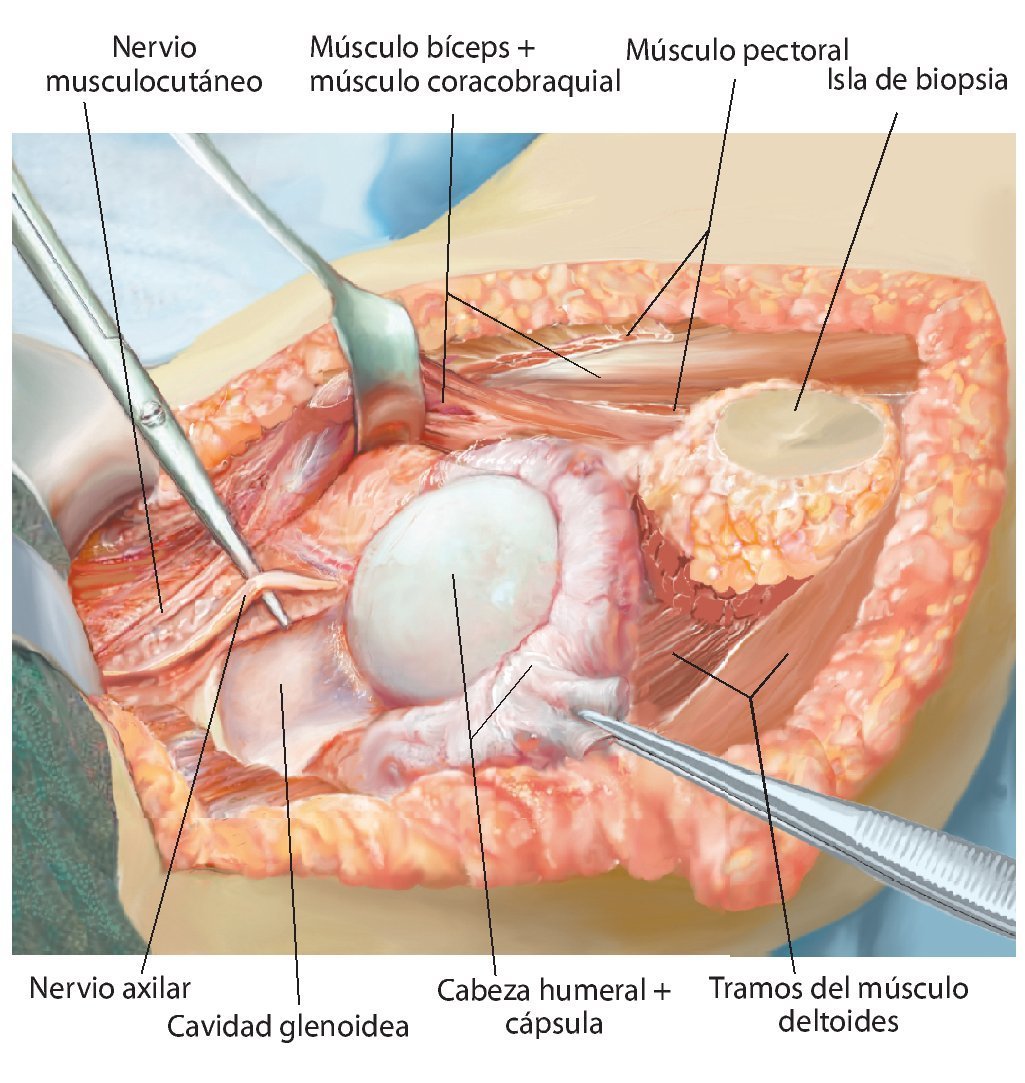
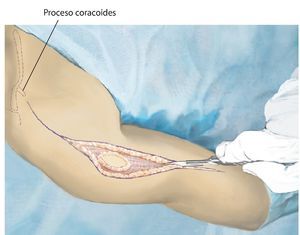
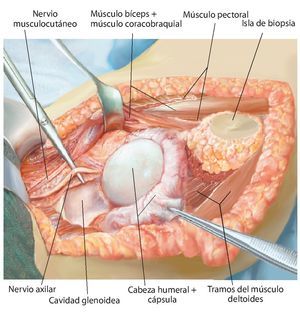
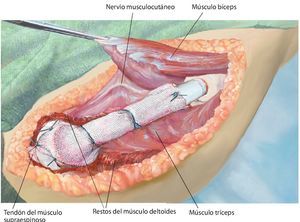
Fig. 3. Durante la realización del abordaje de la intervención se realizará una incisión fusiforme por la cicatriz previa de la biopsia y se permanecerá sobre la zona de resección. El abordaje se realiza mediante una incisión anterior que se guiará en forma de arco por encima del músculo deltoides en dirección al proceso coracoides.
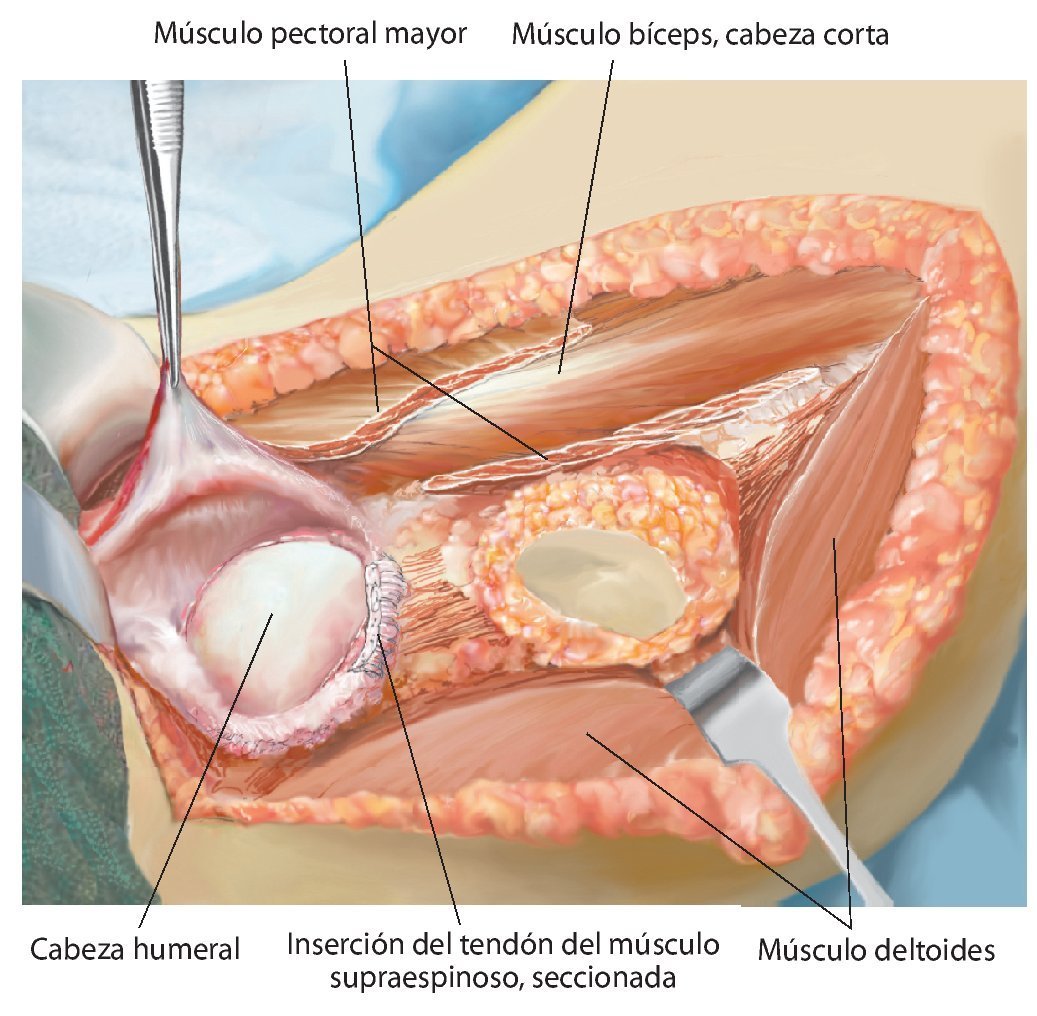
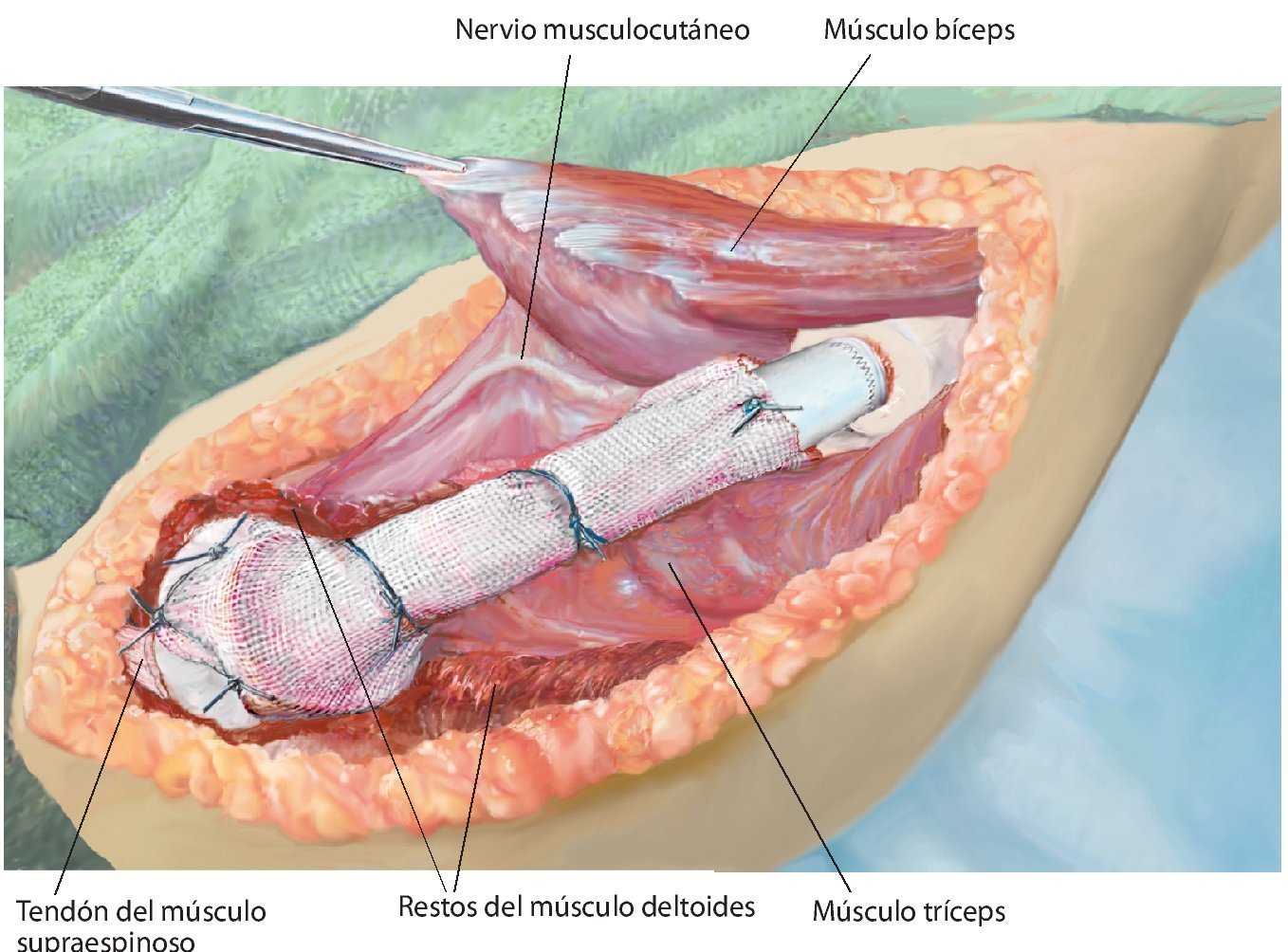
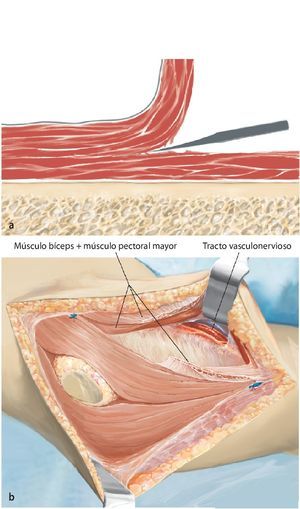
Fig. 4. Después de la preparación subcutánea y de la sección de la fascia en sentido longitudinal, queda expuesto el paquete vasculonervioso. Tras la separación del músculo deltoides (a; la musculatura deltoides preservada es un factor importante para el posterior recubrimiento del implante) se realiza en primer lugar la sección del tendón pectoral (b). A continuación se puede exponer y medializar el paquete vasculonervioso medial al músculo bíceps braquial. Para ello puede resultar de ayuda la exposición y preparación del nervio musculocutáneo, a fin de evitar una lesión del mismo.
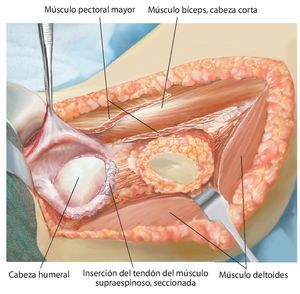
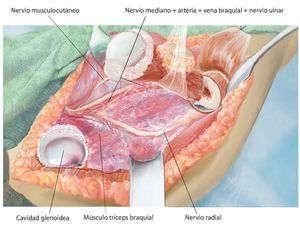
Fig. 5. Exposición de la cápsula articular y capsulotomía (en caso de una resección intraarticular) manteniendo un margen de seguridad oncológica suficiente. De este modo se obtiene una movilización más amplia de la zona de resección y al mismo tiempo una mejor visión general en la zona del paquete vasculonervioso. En el caso de realizar una resección extraarticular, la cápsula articular permanece cerrada y se realiza una osteotomía en la zona del cuello de la escápula.
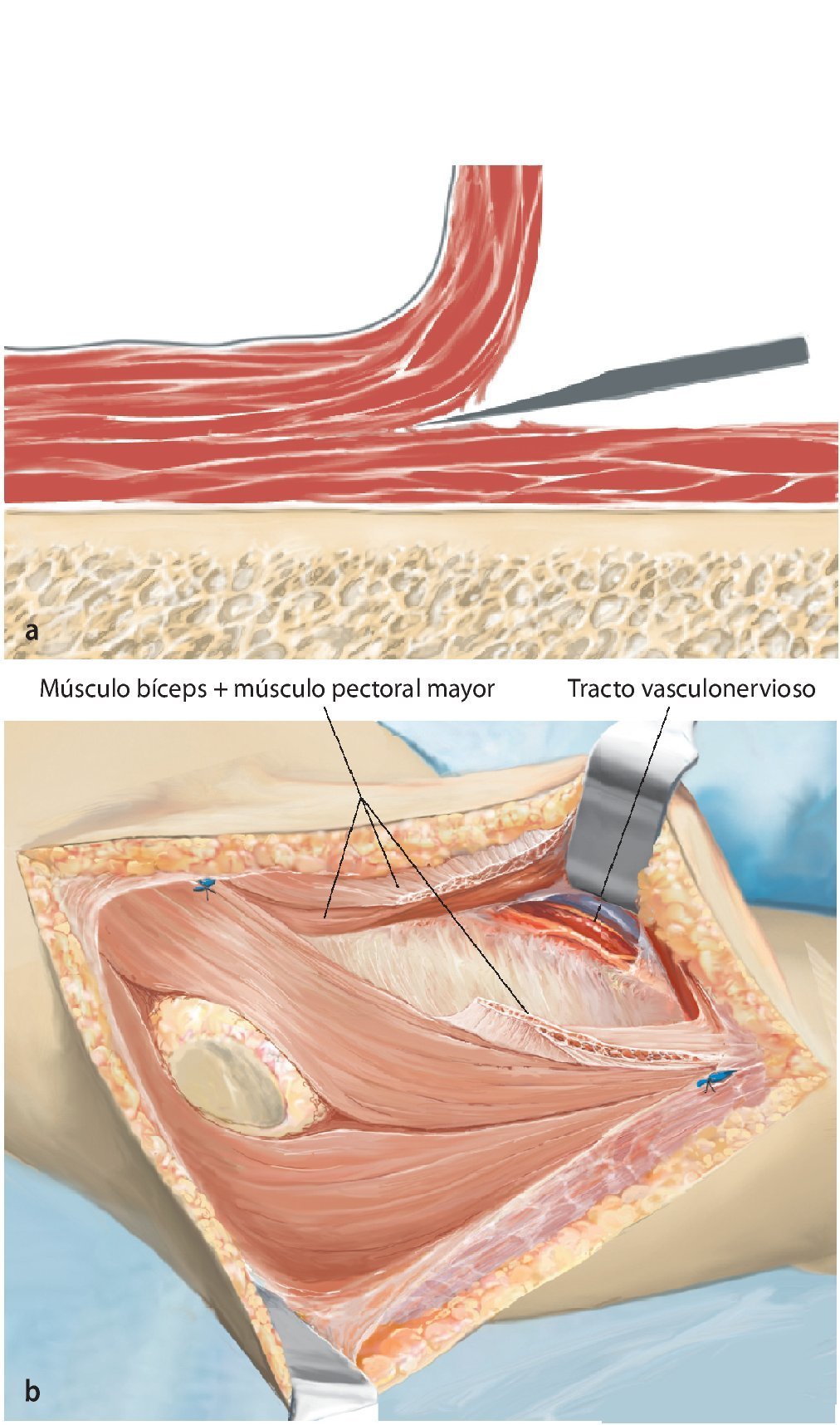
Fig. 6. Búsqueda de la salida del nervio axilar con los vasos sanguíneos acompañantes (arteria y vena circunfleja humeral posterior) en el borde inferior del tendón subescapular (armado sobre la tijera de preparación). En caso de que se considere necesario desde el punto de vista oncológico (cavidad: componente tumoral extraóseo), se ligará el nervio con sus vasos sanguíneos acompañantes. En caso de que exista posibilidad de conservación, entonces se realizará una exposición más amplia.
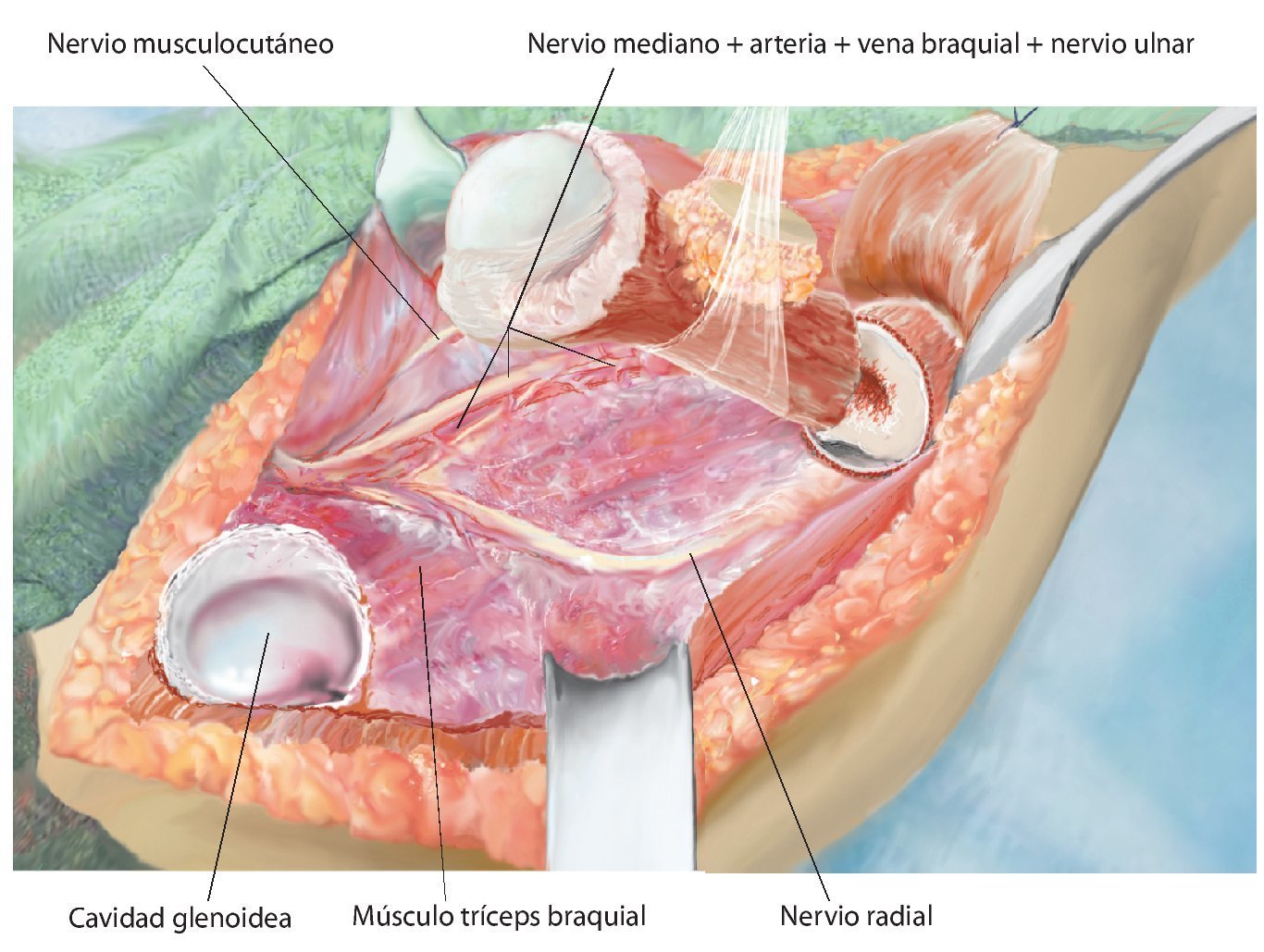
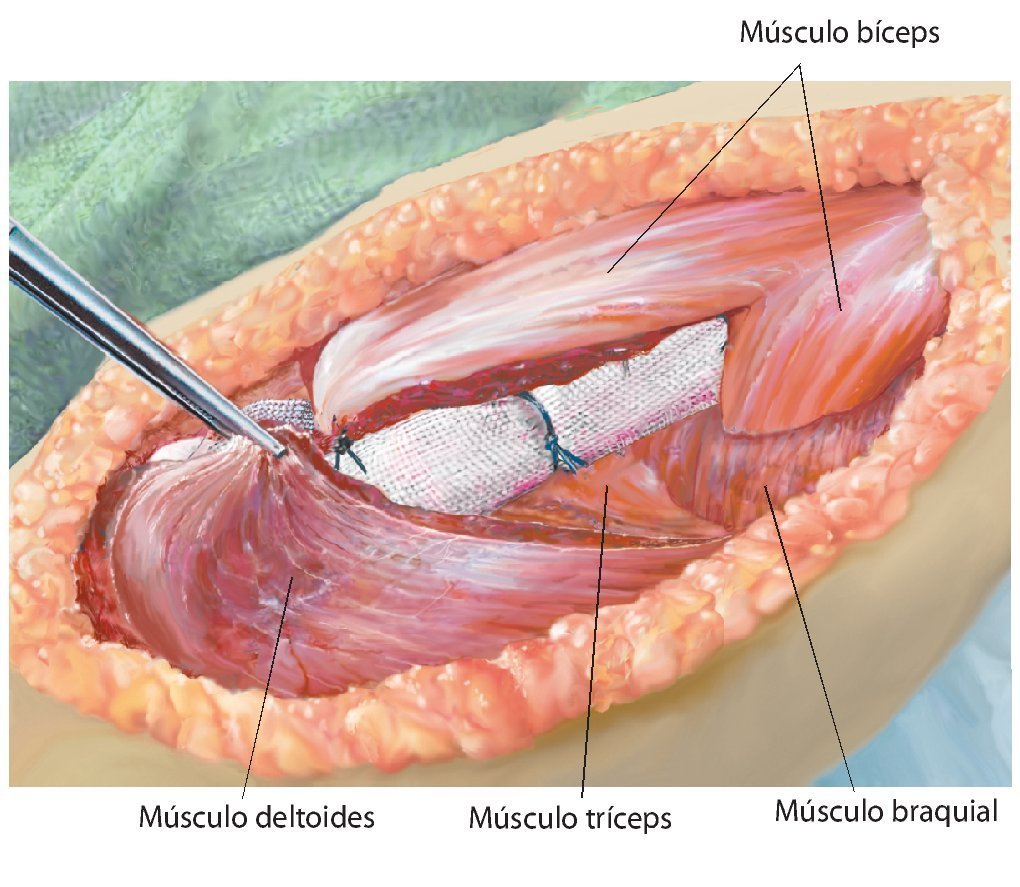
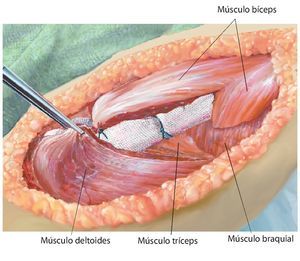
Fig. 7. Ampliación de la extracción del hueso afectado por el tumor manteniendo un margen de seguridad muscular suficiente por todos los lados. Se secciona la musculatura introducida (músculo bíceps braquial, músculo coracobraquial, músculo tríceps braquial). Además, antes de realizar la osteotomía (esta se llevará a cabo mediante una sierra oscilante con la protección de ganchos Hohmann) es esencial exponer el nervio radial (recorrido por encima del gancho Kocher inferior) para evitar una lesión involuntaria del nervio. No es necesario exponer totalmente el nervio en todos los casos de tumores; cada caso se rige principalmente en función de la expansión del tumor, así como de la posición entre los diferentes tumores. Sin embargo, este procedimiento ha dado buenos resultados especialmente en los casos de tumores con componentes de partes blandas extensas.
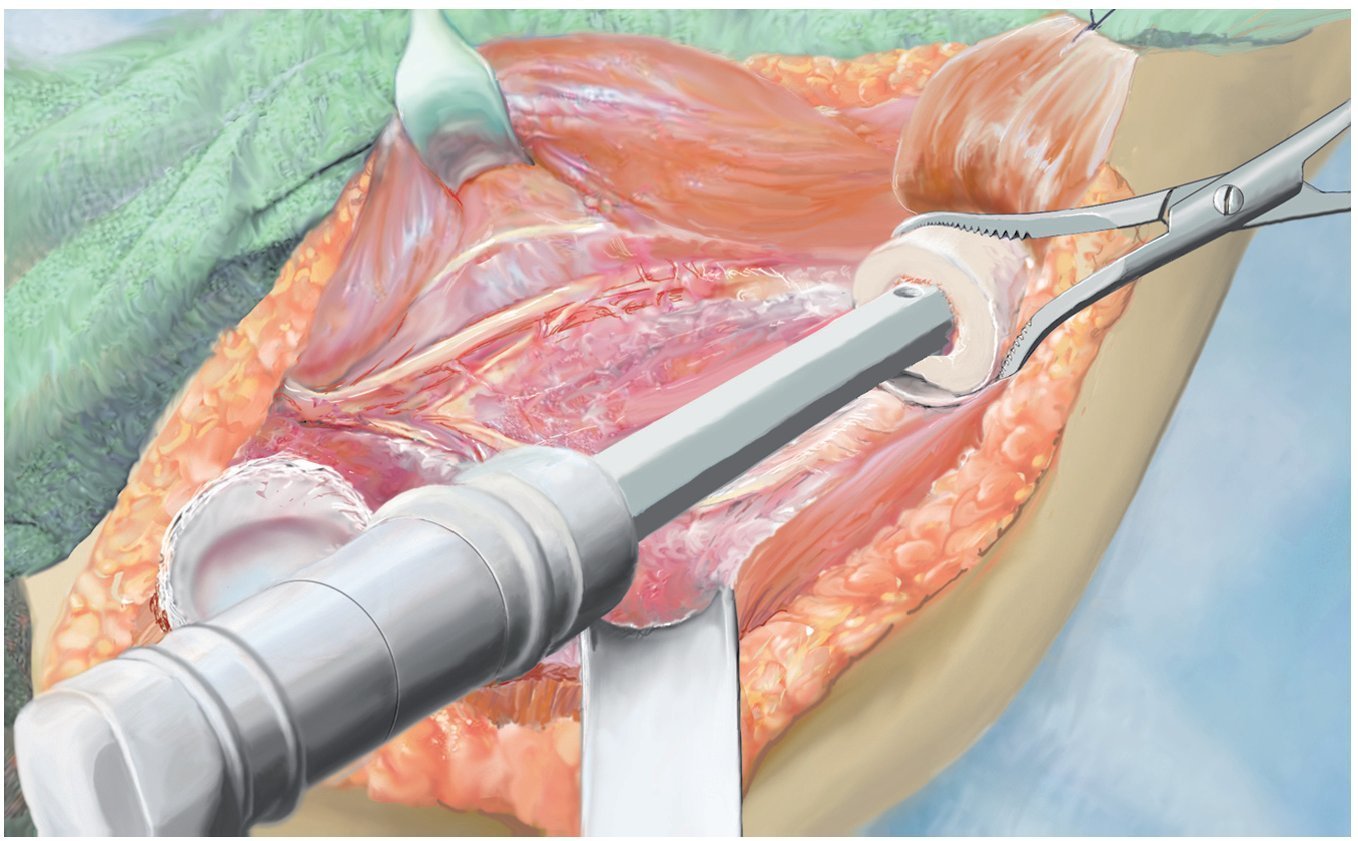
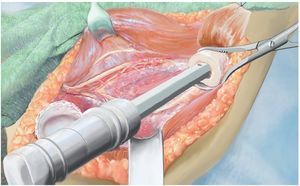
Fig. 8. Introducir el vástago del húmero según la técnica press-fit con el instrumento de impactación después de preparar previamente el canal intramedular mediante un clavo fijo (1 mm por debajo de medida en caso de anclaje no cementado) y raspa intramedular (el diámetro de la raspa debe corresponder al diámetro de vástago previsto). Para determinar la longitud de reconstrucción, se deberá verificar en primer lugar la capa de partes blandas de la que se dispone para el cubrimiento de la prótesis. De ello depende la determinación de la longitud de la reconstrucción.
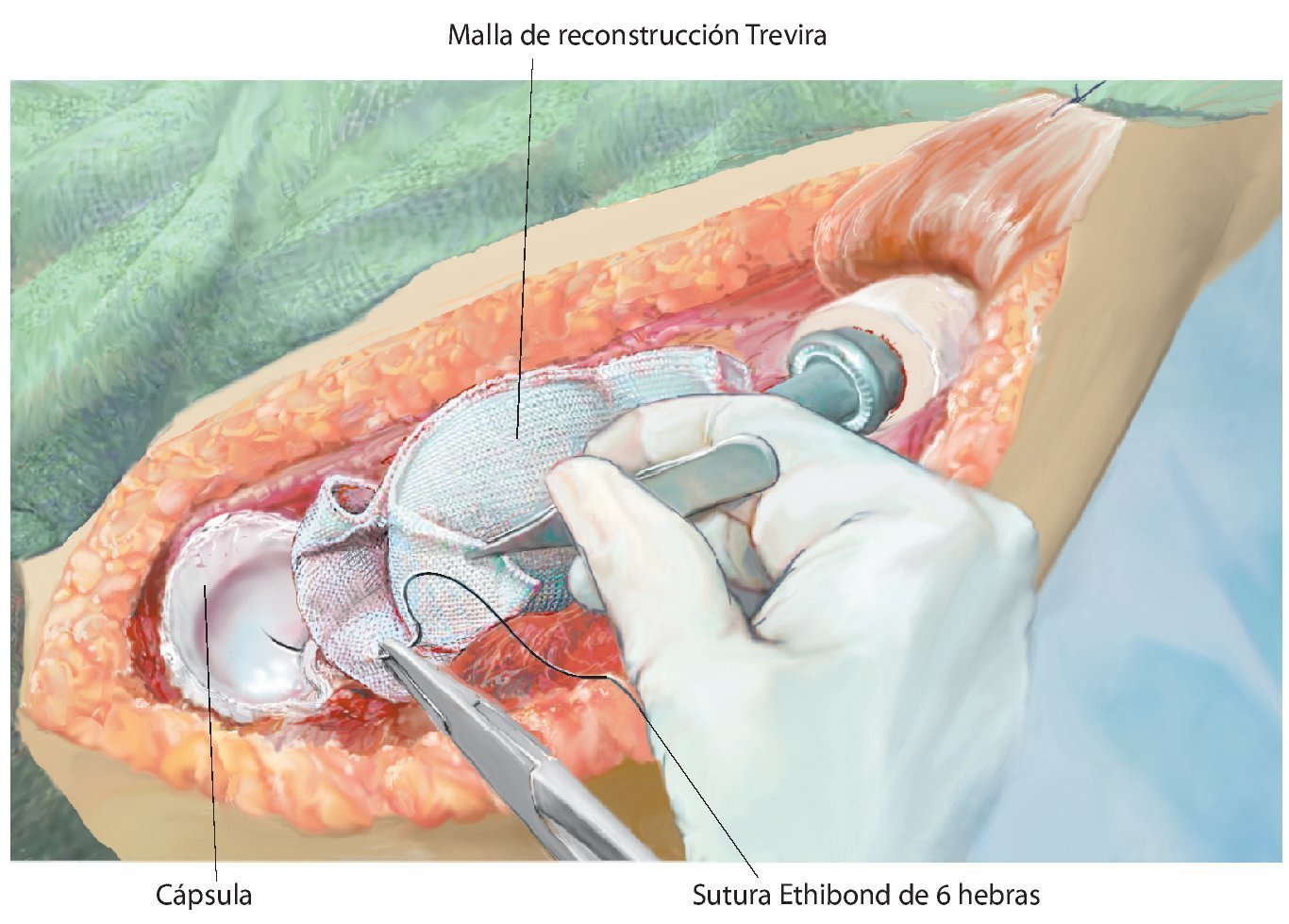
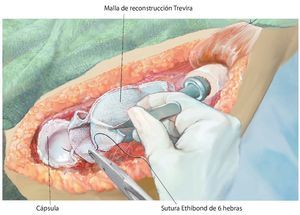
Fig. 9. Reconstrucción de cápsula mediante malla de reconstrucción (para la descripción exacta de la técnica, véase el artículo de Hardes24). Coser la malla con el remanente de las partes de cápsula (utilizar un material de sutura no reabsorbible) de la resección intraarticular para la reconstrucción de la cápsula y la suspensión fija del brazo.
Fig. 10. Insertar el implante original en la posición de rotación correcta de la cabeza (aproximadamente 20º de retroversión). Después de cubrir la prótesis con la malla de reconstrucción (Trevira®) tiene lugar la reposición en la articulación y la fijación de la malla a la prótesis con, por ejemplo, hilos Ethilbond® fuertes (de 2 o 6 haces).
Fig. 11. Reconstrucción de partes blandas bajo refijación de los tendones/ músculos separados inicialmente sobre el implante/malla en posición anatómica (de este modo, se consigue un acoplamiento mecánico entre implante y musculatura). Se deberá prestar especial atención a la tensión previa muscular en posición de extensión en la articulación del codo. Además, hay que cubrir completamente el implante con musculatura.
Ejemplos de casos clínicos
(Figs. 12-14)
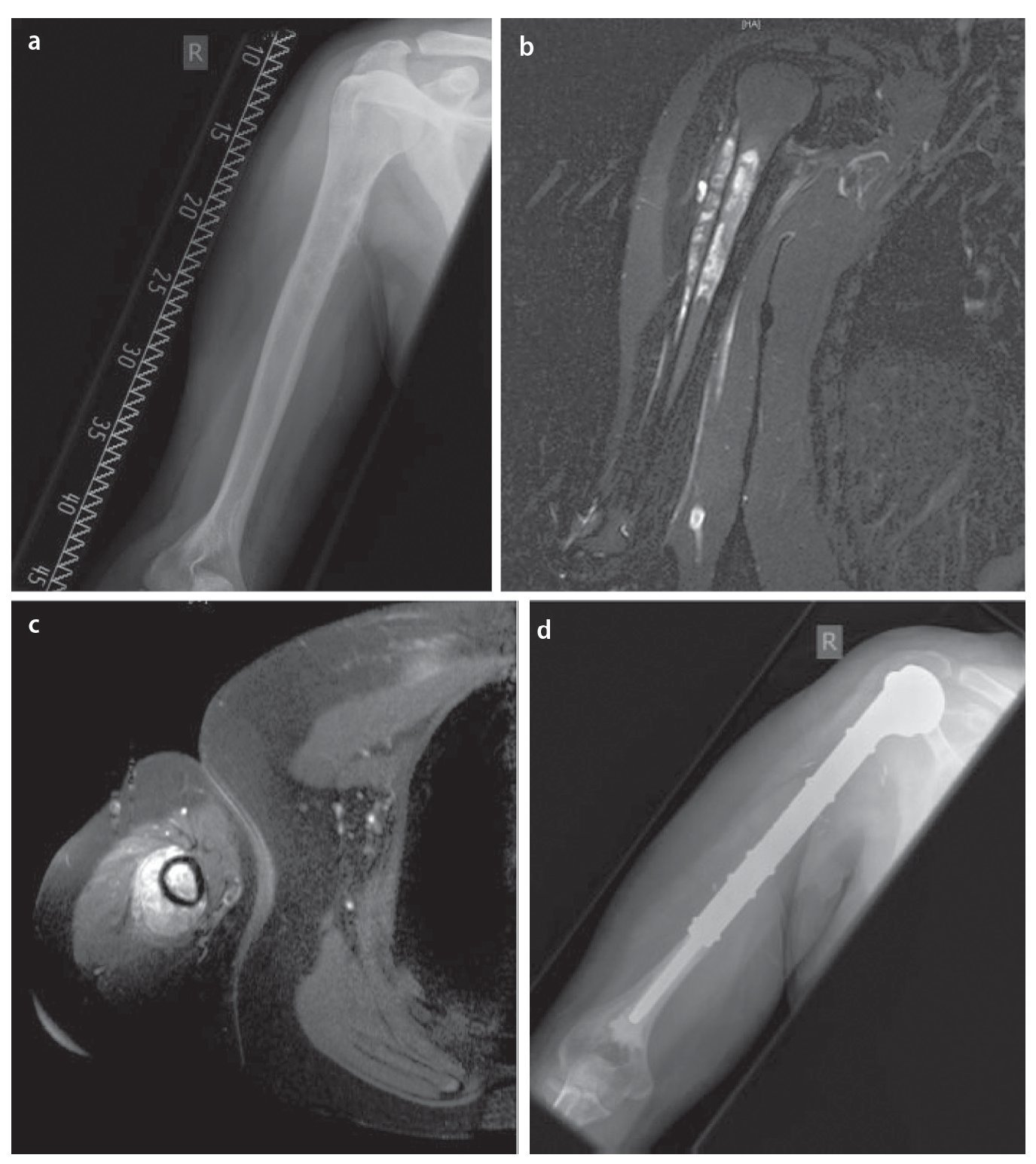
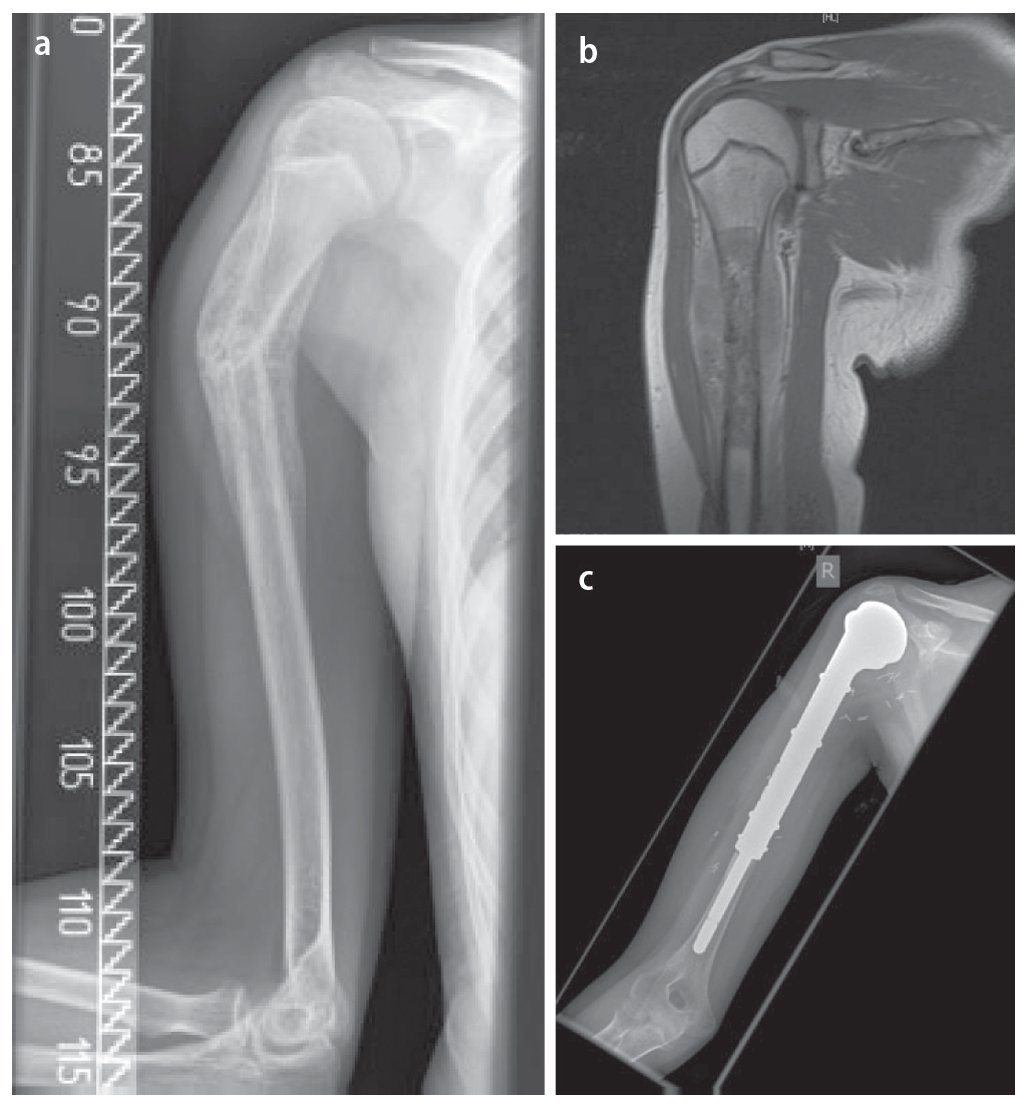
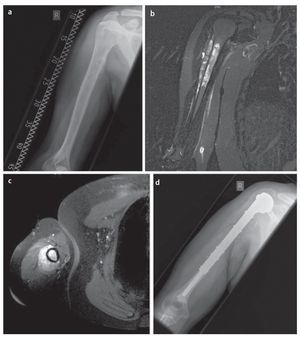
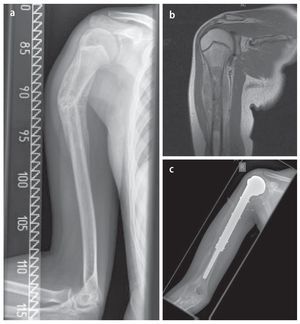
Fig. 12. Paciente de diecisiete años con sarcoma de Ewing en la diáfisis del húmero. a) Radiografía a.-p., estado preoperatorio: lesión de Lodwick de grado 3 con osteolisis permeable y desprendimiento laminar del periostio. b) RM preoperatoria, capa sagital, secuencia STIR: extensión intramedular del tumor con grandes componentes de partes blandas extraóseas. c) Secuencia T1 axial con aportación de gadolinio: exposición de los componentes extraóseos grandes con enriquecimiento visible de gadolinio. d) Radiografía postoperatoria en proyección a.-p.: posicionamiento correcto de la prótesis del fémur proximal extensivo mediante implantación de vástago cementado.
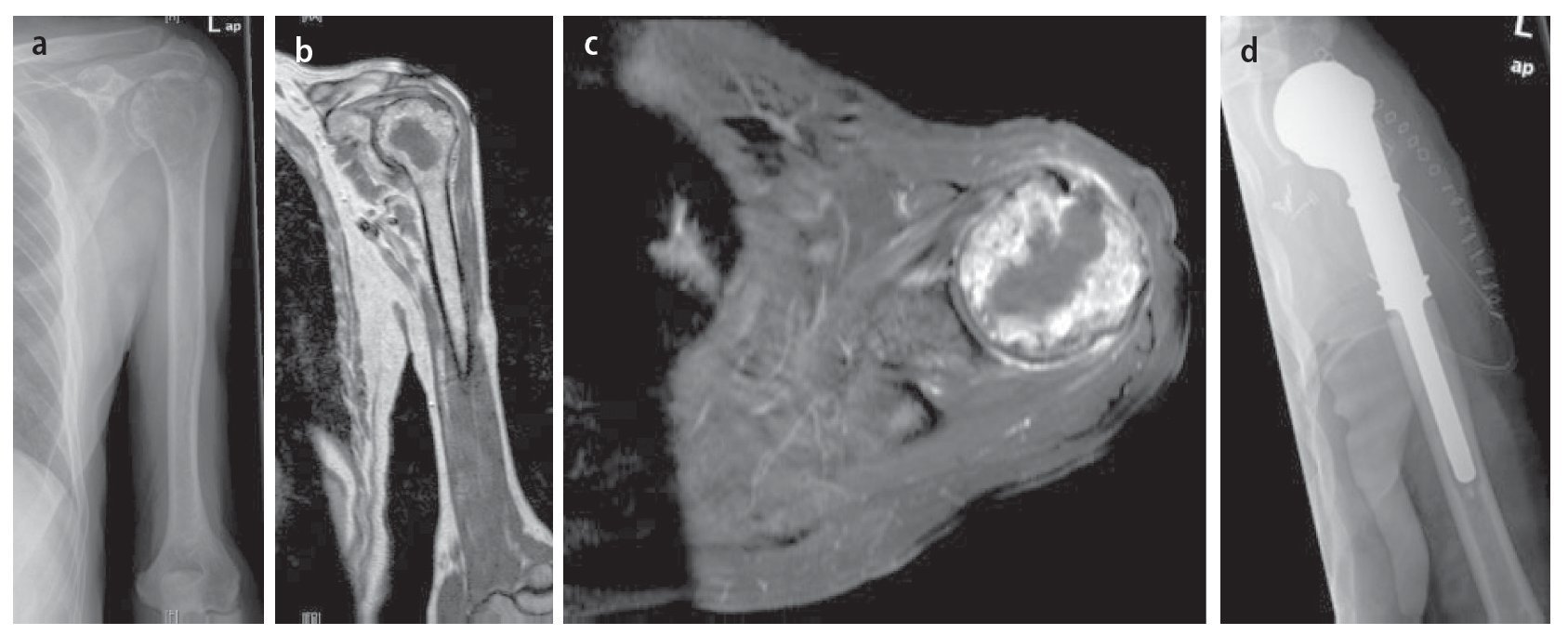
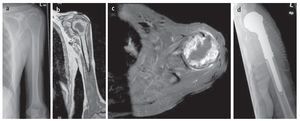
Fig. 13. Metástasis tardía solitaria de un carcinoma de células renales en un paciente de setenta y cinco años. a) Radiografía preoperatoria a.-p.: exposición de la osteolisis permeable grande del húmero proximal sin calcificaciones de matriz importantes. b) T1-TSE estratificación sagital con uso de gadolinio: RM preoperatoria con exposición de la necrosis tumoral central masiva. c) T1-STIR con gadolinio, capa axial: toma de medio de contraste no homogénea marginal en caso de necrosis central sin manifestación de tumor extraóseo significativo y sin derrame articular. d) Radiografía postoperatoria a.-p.: implante introducido correctamente después de una amplia resección tumoral (resección de húmero proximal intraarticular) e implantación de vástago cementado.
Fig. 14. Sarcoma de Ewing de una paciente de catorce años. a) Radiografía preoperatoria a.-p.: fractura de diáfisis de húmero con consolidación ósea bajo quimioterapia. b) RM de capa T1 sagital con gadolinio: exposición de los componentes tumorales intraóseos y parosteal con destrucción visible de la sustancia compacta original. c) Radiografía postoperatoria a.-p.: resultado quirúrgico después de la implantación cementada de la prótesis tumoral.
Tratamiento postoperatorio
Para el tratamiento postoperatorio hay que tener en cuenta las medidas siguientes:
— Inmovilización postoperatoria del brazo operado con vendaje de Gilchrist durante 4-6 semanas.
— Posicionamiento intermitente con el brazo en extensión (hasta 50º aproximadamente) en la articulación del codo para minimizar un estancamiento venoso y la consiguiente aparición de linfedema en el brazo/mano en caso de una flexión demasiado fuerte en la articulación del codo.
— Utilización de una bomba venosa en la mano; si es preciso, drenaje linfático a partir del primer o segundo día postoperatorio.
— Cambio de vendaje a partir del tercer día postoperatorio y, en caso necesario, extracción de los drenajes de Redon.
— Inicio de la movilización pasiva en la articulación del codo aproximadamente 2-3 semanas después de la intervención.
— A partir de la sexta semana postoperatoria, realización de ejercicios activos de la articulación del codo, así como ejercicios activos/pasivos de la articulación de hombro.
— Profilaxis antibiótica como mínimo hasta finalizada la cicatrización de la herida.
Errores, riesgos y complicaciones
En el marco de la intervención y del transcurso de cicatrización postoperatorio se debe tener en cuenta que pueden surgir las complicaciones y problemas siguientes:
Posibles problemas intraoperatorios
— Se deberá evitar el riesgo oncológico por sobrepasar los márgenes de seguridad necesarios en perjuicio de una mejor función (por ejemplo, por la separación de las incisiones musculares en la parte tendinosa y no en la muscular, conservación del nervio axilar o del nervio radial a pesar de la presencia de componentes tumorales paraóseos.
— Para evitar una lesión iatrogénica durante la exposición de nervios y de su salida, hay que tener en cuenta cualquier variante de la norma anatómica.
— Fisura de vástago especialmente en anclajes press-fit cementados; entonces, utilización de cerclajes de titanio.
Complicaciones postoperatorias tempranas
— Infección temprana de la herida/ implante.
— Lesiones por posición de los nervios a causa, por ejemplo, de un síndrome compartimental por estancamiento debido a un reflujo venoso impedido en posición de flexión del brazo dentro del vendaje de Gilchrist.
Complicaciones postoperatorias tardías
— Infección profunda de implante.
— Cranealización del brazo con dislocación de la articulación glenoidea y neoarticulación.
— Aflojamiento aséptico del vástago.
— Caudalización del implante por el peso del propio brazo.
Resultados
Durante el período de tiempo comprendido entre 1997 y 2009 fueron tratados en nuestra clínica en total 96 pacientes (56 hombres, 41 mujeres) con enfermedades tumorales malignas y se les sometió a un reemplazo de húmero modular proximal (n = 83) o total (n = 13) (marca Implantcast MUTARS®).
La edad media era de 41 años en el momento de realizar la intervención. El tiempo de seguimiento medio fue de 32 meses. La recopilación de datos se realizó de modo retrospectivo.
La indicación más frecuente fue la resección de húmero proximal en pacientes con sarcoma óseo primario (osteosarcoma: 38%; sarcoma de Ewing: 10%; condrosarcoma: 17%), seguida de metástasis de tumores sólidos (21%). En el 5% de los casos la resección del húmero proximal fue debida a un sarcoma de partes blandas, mientras que otros tumores como linfomas tuvieron un papel secundario. De este modo, la relación entre sarcomas óseos primarios y metástasis fue de 3,5:1 entre nuestro grupo de pacientes.
En cuanto al diseño de las prótesis, solo en tres pacientes (3,1%; 1 sarcoma de Ewing, 1 condrosarcoma GI, 1 metástasis de carcinoma de tiroides) se utilizó una prótesis inversa. En todos los casos el tumor tuvo una expansión puramente intraósea, de modo que, desde el punto de vista oncológico, se pudo preservar intacto el nervio axilar y gran parte de la musculatura de los manguitos rotadores. El resto de pacientes (n = 93) fue asistido con una prótesis anatómica.
En el 17% (16/96) de los casos se dio una infiltración tumoral de la articulación, de modo que a estos pacientes se les realizó una resección de húmero proximal extraarticular. En todos los casos se llevó a cabo una resección tumoral intraarticular con preservación de la cavidad glenoidea.
Con relación al resultado de la intervención hay que diferenciar entre el resultado oncológico y el funcional.
En cuanto al resultado oncológico, en el conjunto del colectivo de pacientes se dieron en total tres recidivas locales (2,9%). A dos de tres pacientes se les tuvo que practicar la amputación interescapulotorácica como terapia curativa. Tres pacientes con presencia de metástasis múltiples y aplicación de terapia paliativa fueron sometidos localmente a radioterapia para evitar la pérdida del brazo.
Por lo que respecta al resultado funcional, en un estudio previo realizado en nuestra clínica con una escala MSTS (Musculoskeletal Tumour Society) del 79% con relación al reemplazo de húmero proximal endoprotésico19, documentamos un resultado general satisfactorio. La escala MSTS es un sistema de valoración clínico que hace que suba la puntuación del resultado funcional en base a los parámetros siguientes: dolor, función y satisfacción emocional. En la extremidad superior se analizan funciones especiales, como son la función de la mano, la capacidad de elevación del brazo o la posibilidad de posicionamiento de la mano. Los valores calculados indicados en el estudio son comparables con los resultados de otras grandes series; aquí los valores medios publicados oscilan entre el 63% y el 79%. En cuanto al rango de movimiento activo, se indican, por ejemplo, para la abducción valores entre los 25º y los 55º y también en relación a la anteversión activa se publican valores situados entre 33º y 55º4,14,17-19.
Para conseguir una mejora del rango de movimiento postoperatorio, se intentó aumentar en tres pacientes del colectivo a modo experimental la función limitada de la articulación del hombro activa mediante cirugía muscular local (transferencia del trapecio según Batemann en combinación con una transposición del latissimus dorsi según Gerber). Por desgracia, en ninguno de estos pacientes se pudo evidenciar una mejora significativa de la función activa del hombro, como se ha indicado en un artículo anterior10. Puesto que la mayor complejidad quirúrgica de este procedimiento no suponía ninguna mejora funcional significativa de la extremidad, se decidió no volverlo a aplicar en más pacientes.
La supervivencia de la prótesis se ve influenciada principalmente por problemas mecánicos (por ejemplo, aflojamiento aséptico de vástago o dislocación del implante en el sentido de cranealización/caudalización) o por infección de la misma.
La infección del implante es, junto a la recidiva local, una de las complicaciones más graves. En el colectivo de pacientes analizados apareció en el 4,1% (n = 4) de los casos. En los cuatro pacientes consistió en una infección tardía (una media de 24 meses después de la intervención primaria). En tres casos se consiguió sanear la infección realizando un cambio de prótesis en dos tiempos. Un paciente presentó una infección crónica de bajo grado, que se trató únicamente con una terapia antibiótica de larga duración, puesto que el paciente estaba en situación paliativa por múltiples metástasis de osteosarcoma. Hasta su fallecimiento no fue necesario realizar ninguna intervención quirúrgica. Estudios similares muestran en parte tasas de infección de hasta el 10% más altas2,9,14,15,17,18.
Mediante el uso profiláctico desde 2003 de implantes con recubrimiento de plata en nuestra clínica intentamos seguir reduciendo el número y la gravedad de infecciones en la endoprótesis tumoral12.
Las complicaciones mecánicas e incluso también el aflojamiento aséptico del vástago protésico, que suponen tasas de revisión significativas en las prótesis tumorales de las extremidades inferiores, no tienen apenas relevancia en el reemplazo de húmero proximal. Ello es debido sobre todo a la falta de capacidad de carga del implante.
Entre nuestro colectivo de pacientes no se dio ningún caso de aflojamiento aséptico de vástago que requiriera revisión. La incidencia de aflojamiento aséptico del vástago protésico se describe en general en la literatura con una tasa muy baja del 0-6%2,7,9.
El problema de la cranealización secundaria o de la caudalización del brazo en caso de insuficiente fijación proximal y de falta de guiado muscular con luxación de la neoarticulación o de la glenoides ha pasado a un segundo plano debido a la utilización de malla de reconstrucción de plástico. Entre nuestro colectivo de pacientes solo en cuatro casos (4,1%) fue necesario realizar una revisión quirúrgica debido a molestias clínicamente significativas por la cranealización (n = 2) y la caudalización (n = 2) del implante. En los cuatro casos conseguimos la reestabilización por el uso de malla de reconstrucción. En el marco de las intervenciones de revisión, la malla de reconstrucción (Trevira®) ya existente se volvió a fijar a la prótesis o las estructuras capsulares. Solo un paciente sufrió un problema neurológico clínicamente relevante a causa de la caudalización del implante con pérdida progresiva de las funciones sensomotoras en la zona de la mano por tracción del plexo. Sin embargo, estos déficits mostraron una tendencia regresiva tras someter al paciente a una intervención de revisión.
Conflicto de intereses. El autor del presente trabajo declara que ni él ni sus coautores tienen conflicto de intereses en relación con la publicación de este trabajo.
Correspondencia
Dr. A. Streitbürger
Klinik und Poliklinik für allgemeine Orthopädie und Tumororthopädie, Universitätsklinikum Münster
Albert-Schweitzer-Str. 33, 48149 Münster (Alemania)
streitb@ukmuenster.de