Los adenocarcinomas originados en el uraco son entidades poco frecuentes; representan un reto diagnóstico ya que, por su histología, no es fácil diferenciarlos de los adenocarcinomas originados en el colon. Además, no existe un consenso sobre cuál es el mejor manejo médico o quirúrgico.
El presente es el reporte del caso de un paciente que cursa con un adenocarcinoma uracal de vejiga mal diferenciado, de tipo intestinal en un hombre de 65 años, previamente asintomático a pesar de ser un tumor de gran tamaño, así como del abordaje diagnóstico y terapéutico empleado.
Caso clínicoSe trata de un paciente de 65 años que presenta un cuadro de dolor abdominal intenso secundario a una caída desde su propia altura, por lo que se realiza una TAC de abdomen y pelvis que muestra una masa quística de gran tamaño, que desplaza el colon sigmoide y es aparentemente dependiente de la vejiga. No hay evidencia de adenopatías o compromiso de otros órganos. Se toma una TAC de tórax que descarta lesiones metastásicas en el tórax. Los marcadores tumorales muestran el ACE y el CA125 elevados.
Es llevado a laparotomía exploratoria, donde se observa una gran masa dependiente del domo de la vejiga, de bordes lisos y bien definidos, sin compromiso de estructuras vecinas. Se realiza cistectomía parcial y se reseca la masa en su totalidad. El reporte de patología evidencia un adenocarcinoma uracal de vejiga de tipo intestinal.
DiscusiónEl diagnóstico definitivo del adenocarcinoma de uraco es un reto, ya que por su origen embrionario, presenta positividad para marcadores colónicos; así mismo, su histología puede ser similar al adenocarcinoma de colon.
Los marcadores histopatológicos son una herramienta fundamental en el diagnóstico definitivo, ya que permiten diferenciarlo del primario en el colon.
En la actualidad no existe un consenso sobre el mejor manejo quirúrgico o médico para la enfermedad. Algunos autores proponen la cistectomía parcial como un método seguro en estados bajos de la enfermedad y reservan la cistectomía radical para estadios más avanzados.
ConclusiónEs llamativo el curso clínico benigno y asintomático en el paciente, a pesar de tener un tumor de gran tamaño. Según nuestra revisión no hay tumores reportados de este tamaño. En este caso nos basamos en los marcadores histopatológicos para determinar el origen uracal del tumor. Consideramos que no hay elementos que sugieran un mal pronóstico o una alta probabilidad de recurrencia tumoral, por lo que se decidió manejar con cistectomía parcial. La evidencia al respecto es limitada.
Debe hacerse un seguimiento clínico en el tiempo para vigilar la presencia de recaídas locales o sistémicas.
Adenocarcinomas originating in the urachus are rare. They represent a diagnostic challenge. Their histology is very similar to adenocarcinomas that originate in the intestine, making it difficult to differentiate them. Furthermore, there is no consensus on whether surgical or medical management is better.
The case is reported on a 65 year-old patient diagnosed with a poorly differentiated, intestinal type, urachal adenocarcinoma of the bladder that was previously asymptomatic despite its large size. A discussion is presented on the diagnostic and therapeutic approach that was used.
Clinical caseThis is the case of a 65-year-old patient, who complained of intense abdominal pain following a fall from his own height. An abdomen and pelvis computed tomography scan was performed that showed a large-sized cystic mass that displaced the sigmoid colon and was apparently dependent of the dome of the bladder. There was no evidence of lymphadenopathy or of compromise of other organs. A chest computed tomography ruled out metastatic lesions. Tumour markers show elevated CEA and CA125.
An exploratory laparotomy was performed, in which a large mass, dependent of the bladder dome was found. It had clean and well-defined edges, without compromise of the neighbouring structures. A partial cystectomy with full resection of the mass was performed. The pathology report showed an intestinal-type urachal adenocarcinoma of the bladder.
DiscussionThe definitive diagnosis of a urachal adenocarcinoma is a challenge, since, due to its embryonic origin, colon cancer markers are positive. Also, its histology may be similar to an adenocarcinoma of the colon.
The histological markers are a fundamental tool for the definitive diagnosis, as they allow the physician to differentiate between a urachal adenocarcinoma and an adenocarcinoma that primarily originated in the colon.
There is currently no consensus on the best surgical or medical management of this condition. Some authors propose partial cystectomy as a safe method for low stages of the disease, and reserve the radical cystectomy for more advanced stages.
ConclusionThe benign and asymptomatic course of the disease in the patient, despite the large size of the tumour. According to our review, there are no tumours of this size reported in the literature. In this case, we used the histopathological markers to determine the urachal origin of the tumour. As there appeared to be no clinical elements that suggest a poor prognosis or a high probability of tumour recurrence, it was decided to perform a partial cystectomy. The evidence on its management is limited.
An appropriate clinical follow-up is necessary in order to check for local or systemic recurrences.
Los adenocarcinomas primarios de la vejiga son tumores malignos poco comunes que dan cuenta de aproximadamente el 0,5-2% de los tumores malignos vesicales1. Son más frecuentes en hombres, con una relación H:M de 2,6:1 y un pico etario alrededor de la sexta década de la vida2. Se originan en el domo de la vejiga y/o están asociados con los remanentes del uraco, lo que los clasifica en adenocarcinomas de la vejiga uracales o no uracales. Los derivados del uraco, como es el caso de nuestro paciente, corresponden al 20-30% de todos los adenocarcinomas de vejiga3.
Por su parte, los tumores del uraco representan el 0,01% de los cánceres. Se clasifican histológicamente como adenocarcinomas o sarcomas. El grupo etario del paciente concuerda con el pico de presentación de los adenocarcinomas, que suele ser entre la quinta y la séptima décadas de la vida4.
Caso clínicoSe trata de un hombre de 65 años que presenta un cuadro clínico de dolor abdominal difuso secundario a caída desde su propia altura. Antes de esto se encontraba completamente asintomático, sin hematuria o dolor abdominal, tampoco presentaba otros síntomas urinarios.
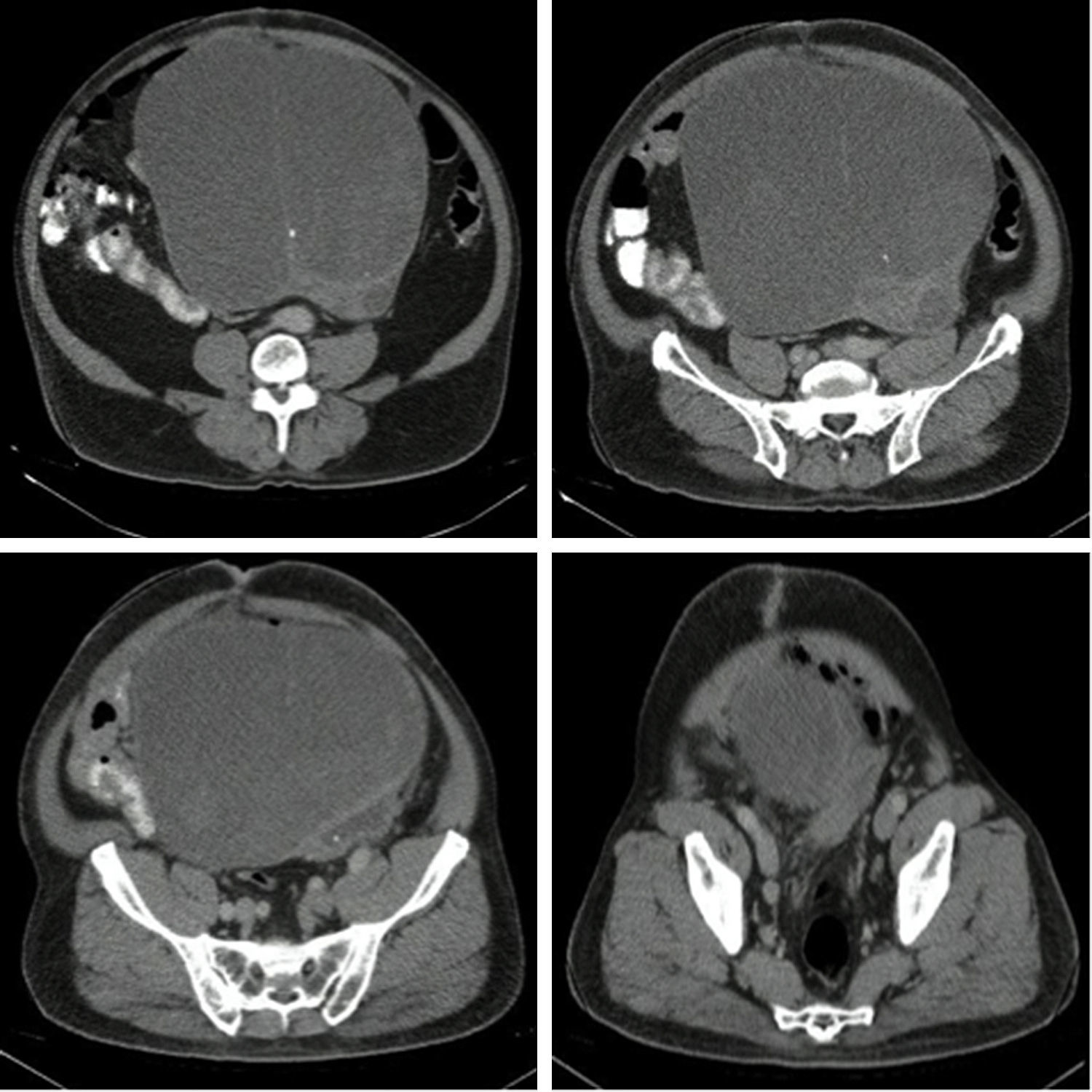
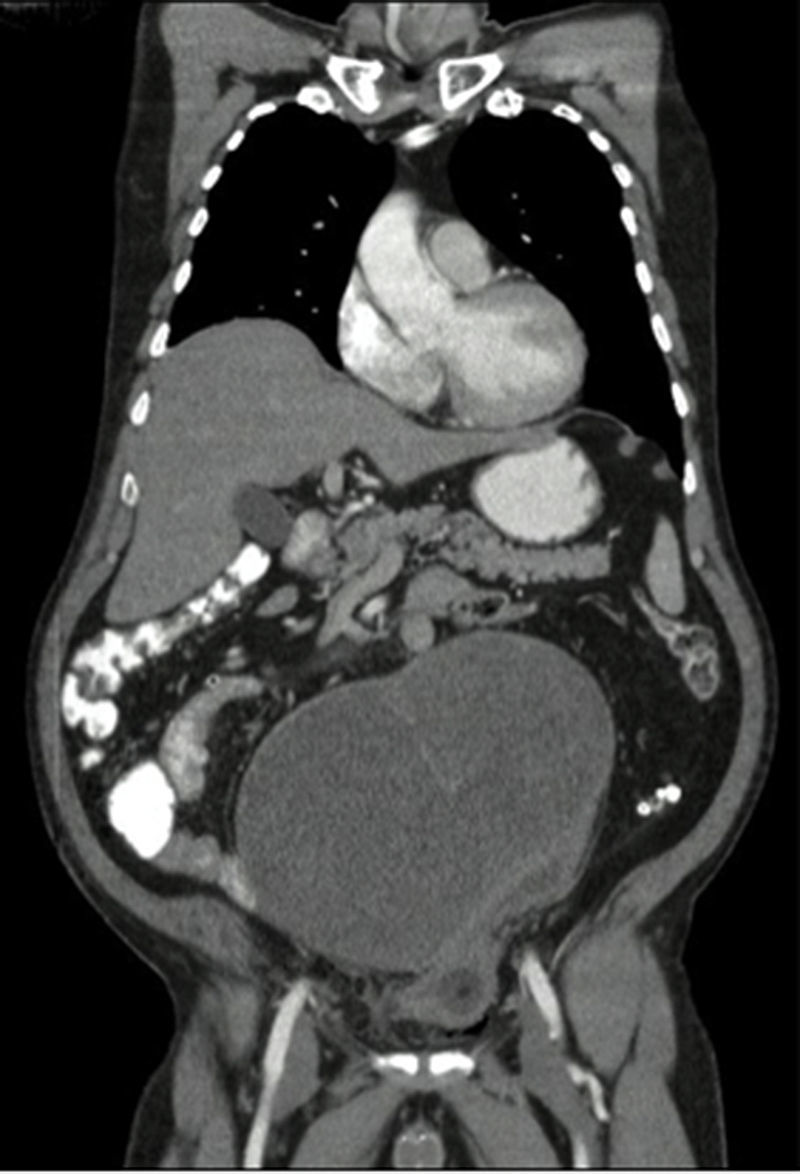
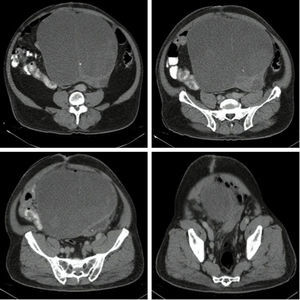
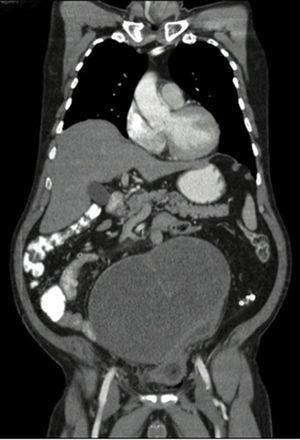
Se toma una TAC de abdomen y pelvis que muestra una masa pélvica de aspecto neoplásico de 176×190×233mm, de pared delgada y contorno regular, con un gran septo delgado en su interior y una parte sólida posterior en el lado izquierdo. Realza pobremente tras la administración de medio de contraste. Hay desplazamiento y compresión de la vejiga hacia el lado izquierdo. El colon sigmoide se encuentra comprimido y desplazado por la masa. No se evidencian adenopatías retroperitoneales. No se ven lesiones metastásicas (figs. 1 y 2). También se toma una TAC de tórax que descarta lesiones metastásicas en el tórax.
Los marcadores tumorales reportan: Ca125 53,11U/ml (0-35), CEA 787,06mg/ml (0-5) y CA19-9 menor de 0,6U/ml.
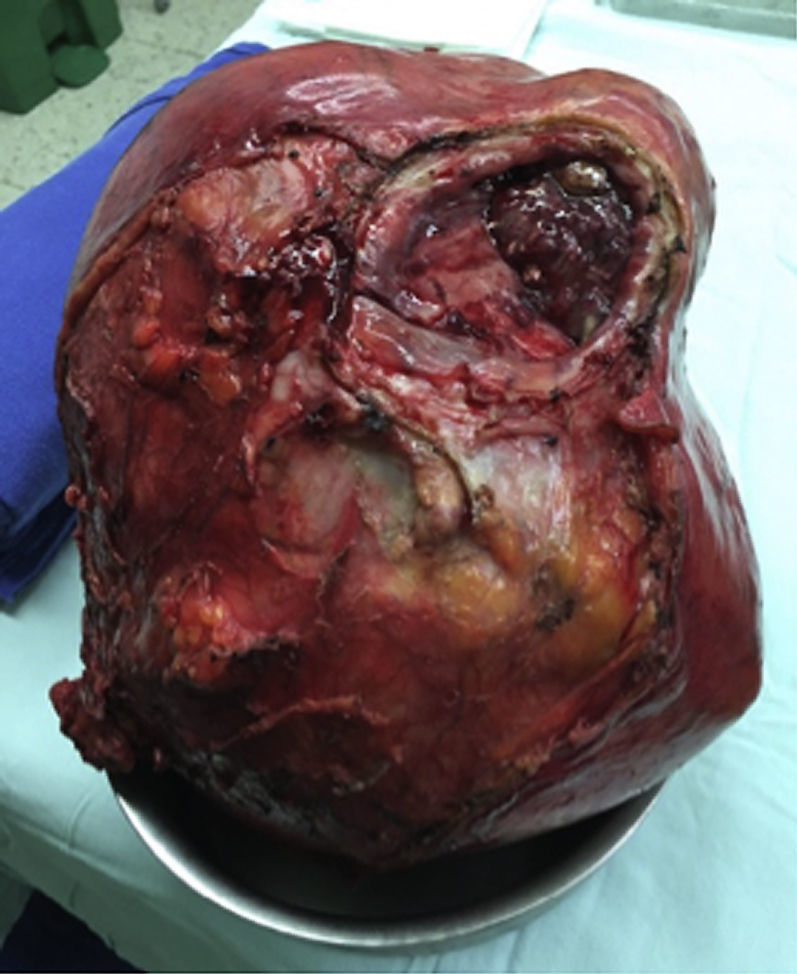
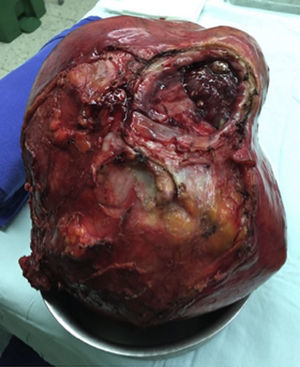
Al ser una masa de gran tamaño, aparentemente originada en la vejiga, se lleva a laparotomía exploratoria con la sospecha de un tumor maligno. Se encuentra una masa de aproximadamente 30×20cm con componente sólido/quístico, lisa, adherida únicamente al domo vesical, sin compromiso de órganos vecinos y con claro plano de disección. Por lo anterior se decide realizar una cistectomía parcial con cistorrafia en 2 planos y resección de la masa en su totalidad (fig. 3).
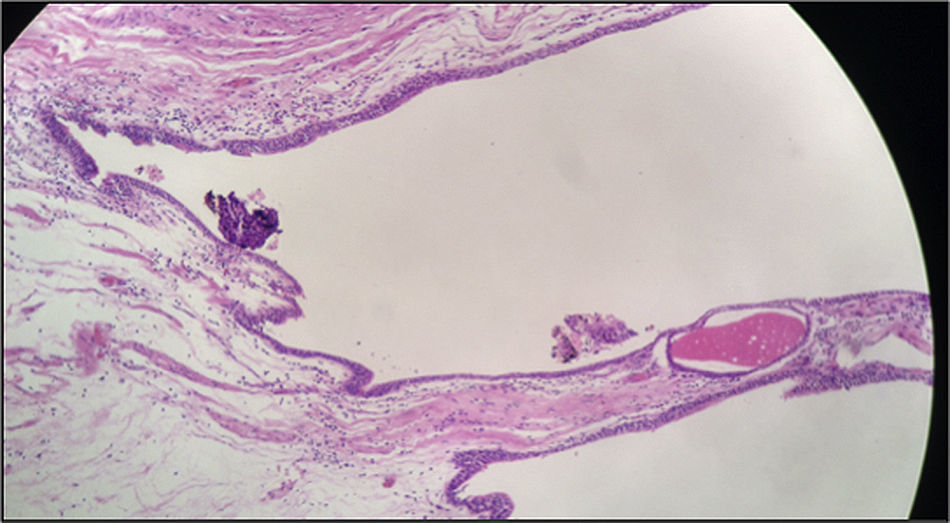
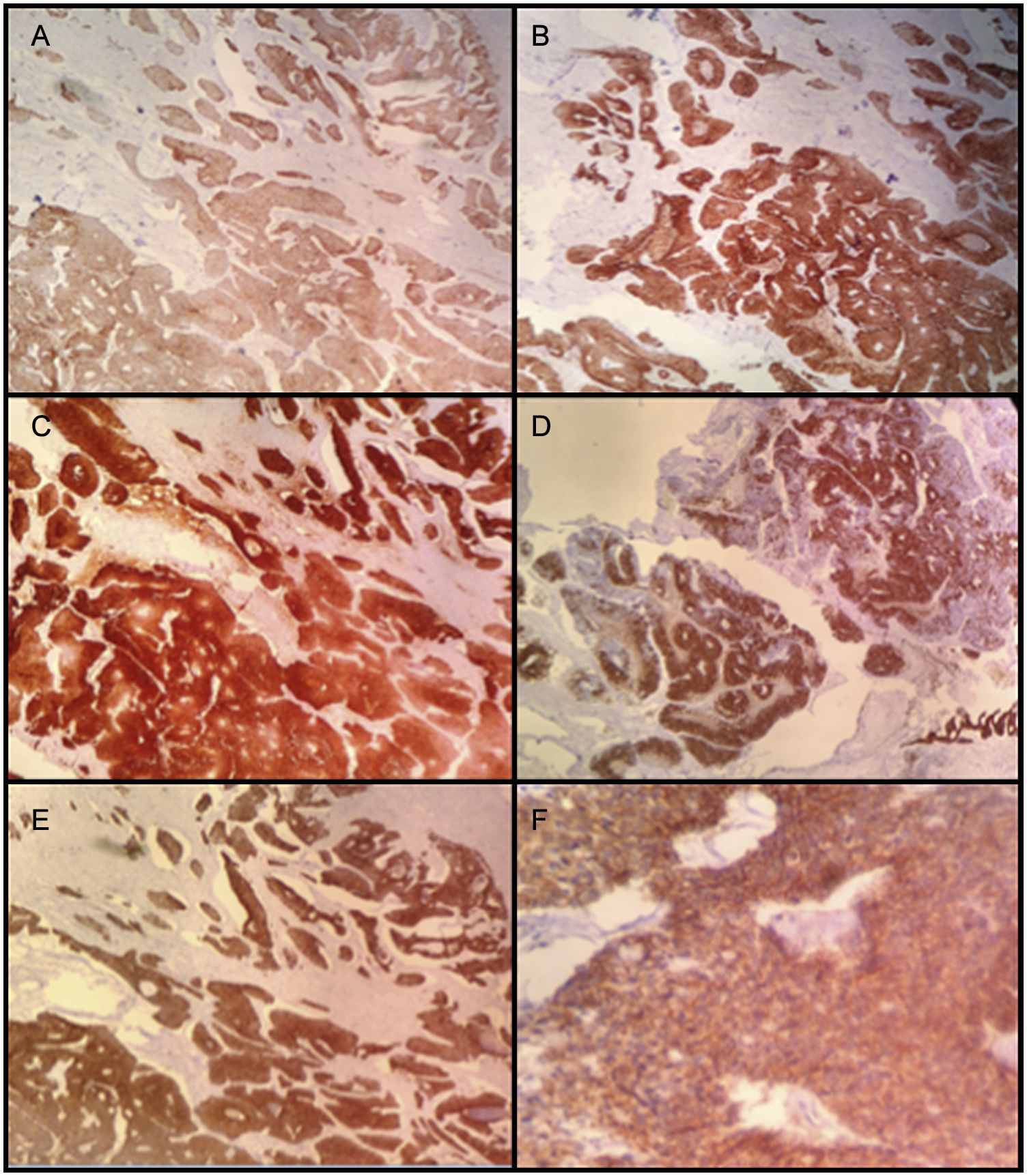
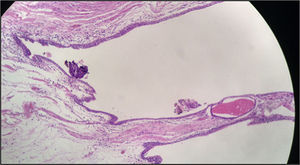
Histológicamente, los cortes estuvieron caracterizados por una masa quística recubierta por una capa muscular. En su interior se evidenció tejido necrótico y escasas áreas de tejido tumoral viable. La lesión tumoral estuvo representada por áreas sólidas y zonas compatibles con adenocarcinoma, con células de núcleos hipercromáticos, cromatina abierta, prominente nucléolo y citoplasma amplio de bordes indistinguibles con una alta tasa mitótica. Se evidenció, así mismo, que la lesión era infiltrante a lo largo de la pared, comprometiendo el tejido muscular y la superficie de la lesión quística, que en algunos de los cortes se encontró revestida por epitelio urotelial. Tras mapeo extensivo se logró identificar un foco de epitelio glandular que recuerda al epitelio uracal (fig. 4).
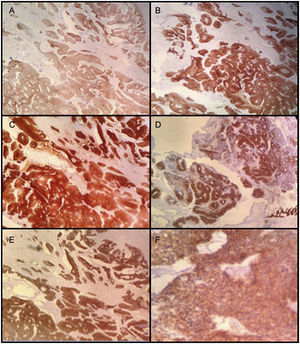
Los marcadores de inmunohistoquímica mostraron positividad en las células tumorales para CKAE1/AE3, CK7, CK20, CAM 5,2, CDX2, ACE, MUC2, B-catenina (positiva de patrón membranoso y citoplasmático). La actina de músculo liso fue positiva al nivel de la pared muscular (fig. 5). Adicionalmente, hubo positividad focal para sinaptofisina y CK34BE12 con negatividad para MUC-1, cromogranina, Ca 19.9, calretinina, GATA 3. La uroplaquina y P63 fueron negativos en la lesión tumoral. El índice de proliferación celular (Ki67) fue 95%.
Los hallazgos histopatológicos y de inmuhistoquímica documentaron una lesión de alto grado. Adenocarcinoma mal diferenciado tipo intestinal originado en un remanente embrionario de origen uracal.
DiscusiónSe cree que la mayoría de los adenocarcinomas primarios de la vejiga se originan por un proceso de metaplasia intestinal, ya sea en la presencia de extrofia vesical o de remanentes del uraco1. También se pueden presentar por extensión directa de órganos adyacentes, como el colon y la próstata y, en raros casos, como un proceso metastásico de órganos distantes, como el estómago, el colon o el ovario5.
La hematuria es el síntoma que se presenta con mayor frecuencia en el 90,5% de los casos, seguido por disuria en el 23,8% de los casos6. Algunos casos de adenocarcinoma mucinoso pueden cursar con mucusuria, sin embargo esto es poco frecuente1. En el caso de nuestro paciente, a pesar de ser un tumor de gran tamaño, el paciente se encontraba asintomático y la primera manifestación clínica fue dolor abdominal, posterior a una caída.
Dentro de las variantes histológicas del adenocarcinoma del uraco se incluyen: a) mucinoso; b) entérico o intestinal; c) no especificado; d) células en anillo de sello; y e) mixto2.
En el análisis histológico el paciente presentó una lesión compatible con adenocarcinoma uracal de tipo intestinal. Este patrón constituye un reto diagnóstico, ya que es difícil diferenciar si el adenocarcinoma es de origen uracal o no, así como es complicado diferenciarlo de un primario intestinal.
En 1955 Mostofi et al. establecieron varios criterios diagnósticos para el adenocarcinoma uracal7; sin embargo, estos han sido considerados históricamente como restrictivos. En 1985 Johnson et al. definieron los criterios más aceptados en la actualidad, que incluyen: 1) la localización en la pared vesical anterior o en el domo vesical; 2) que exista una clara demarcación entre el tumor y el epitelio superficial; y 3) que haya exclusión de adenocarcinoma primario en otro sitio del cuerpo8.
El perfil histopatológico es también de gran importancia para el diagnóstico y para diferenciar los tumores primarios de los metastásicos5. Este incluye positividad para CK7, CK20, CEA, EMA, CDX2, MUC-2, villina, E-caderina1,5 y 34BE129. En principio, CK20 y CDX-2 son fuertemente positivos en el adenocarcinoma uracal y el 50% son positivos para CK75, en contraste con el adenocarcinoma colónico, que expresa únicamente CK201. Adicionalmente, la expresión de B-catenina es rara en el tracto gastrointestinal, lo que permite confirmación ulterior del origen uracal del adenocarcinoma5.
Nuestro paciente presentó un tumor que cumple con los criterios diagnósticos de Johnson et al., y cuyo perfil histopatológico muestra positividad para CK7, CK20, CDX2, ACE, MUC-2, B-catenina, lo que concuerda con los hallazgos descritos en la literatura para adenocarcinoma del uraco.
Por otro lado, dado que el origen embrionario del uraco es el mismo del colon, el adenocarcinoma uracal puede presentar positividad para CEA, CA125 y CA 19-9, como en el caso de otros adenocarcinomas10. En nuestro caso el paciente tenía como marcadores positivos el CEA y el CA125.
La estadificación del tumor es importante para establecer el pronóstico. El sistema de estadificación de Mayo para los tumores uracales los clasifica en: estadio i tumores confinados al uraco o a la vejiga; estadio ii tumores que se extienden más allá de la muscular de la vejiga o del uraco; estadio iii compromiso ganglionar regional; y estadio iv compromiso ganglionar no regional o metástasis distantes11. Este sistema concuerda parcialmente con la clasificación según el TNM propuesta por Sheldon et al. en 1985, que indica que los tumores pT1 son aquellos que no tienen invasión más allá de la mucosa uracal; pT2 cuando la invasión está confinada al uraco; pT3 cuando hay extensión local a la a) vejiga, b) pared abdominal o c) vísceras distintas a la vejiga; y pT4 cuando hay metástasis a los a) ganglios regionales o b) a sitios distantes12.
En el caso de nuestro paciente se trata de un tumor pT3a, estadio i, ya que no hay compromiso ganglionar local o metastásico según las imágenes y los hallazgos intraoperatorios.
Gopalan et al. publican un análisis clinicopatológico de 24 pacientes con carcinoma uracal, de los cuales 9 tenían adenocarcinoma uracal de tipo intestinal. Todos ellos estaban localizados en el domo de la vejiga. El mayor tamaño reportado fue de 8cm y el menor de 0,7cm. Según la clasificación de Sheldon 3 de los tumores fueron T3a, 3 fueron T3b, uno fue T3c, uno fue T4a y uno fue T4b. Uno de los casos (pT3c) presentó recurrencia local en la próstata y en las vesículas seminales y 2 de ellos (pT4a y pT4b) presentaron metástasis a distancia al pulmón. El paciente con clasificación pT4b falleció por la enfermedad. Aunque la muestra del estudio es pequeña, los resultados sugieren que existe relación entre la clasificación de Sheldon y el pronóstico del paciente9, tendiendo a la recurrencia local en tumores pT3c.
Es de interés el gran tamaño del tumor, así como su comportamiento benigno en el paciente, que se encontraba asintomático, y en los estudios de extensión no presentó lesiones sugestivas de metástasis. En la literatura no se ha encontrado una relación directa con el pronóstico o la supervivencia, sin embargo en los pacientes analizados por Gopalan se ve un tamaño superior en los adenocarcinomas uracales de tipo intestinal9. Así mismo, en el estudio de Zhang et al. el tamaño de los adenocarcinomas uracales es en promedio superior al de los no uracales6. Kato et al. reportan un adenocarcinoma de gran tamaño, el cual tenía medidas de 7×8×10cm13.
Cuando se trata de la diferenciación entre uracal y no uracal, la supervivencia es un tema que aún no está claro. Wright et al. encontraron que los adenocarcinomas uracales tienen menor probabilidad de ser de alto grado, pero mayor probabilidad de tener metástasis distantes, y que el adenocarcinoma uracal tiene una tasa de mortalidad específica y por cualquier causa significativamente inferior que el no uracal14. Por su parte, Mostofi asoció los adenocarcinomas uracales con un pronóstico significativamente inferior7. Dandekar encontró que la diferencia entre ambos en cuestión de pronóstico no era significativa15, y Zhang concluyó que el adenocarcinoma uracal estaba asociado con un desenlace más favorable, aunque no con evidencia estadísticamente significativa6.
Es incierto el comportamiento del pronóstico de los adenocarcinomas y la literatura no es concluyente; por lo anterior, el manejo del adenocarcinoma uracal de vejiga es un tema de controversia.
En principio se ha considerado que la radioterapia es de poca o ninguna ayuda en el manejo definitivo16. Con respecto a la quimioterapia no existe suficiente información que favorezca el uso de la terapia adyuvante, y parece que el manejo quirúrgico tiene mayor repercusión en el pronóstico6.
Es claro que la resección completa del uraco y del ombligo y los márgenes de resección negativos son cruciales para el buen pronóstico5.
Los sitios más frecuentes de metástasis distantes del adenocarcinoma uracal son el pulmón (22%), el peritoneo (18%), el omento (15%) y el hígado (11%)17. Así mismo, existe una recurrencia local hasta del 51,3%, con altas tasas de compromiso ganglionar, principalmente pélvico16.
Según Johnson et al. la cistectomía parcial es un método seguro y con pocas complicaciones para el manejo de los adenocarcinomas uracales, y la cistectomía radical debe ser reservada para pacientes en los cuales no se puede asegurar un margen de resección negativo8. Por las altas tasas de recurrencia local y compromiso ganglionar, recomienda la linfadenectomía bilateral como parte del manejo, con el fin de reducir el riesgo de recurrencia de la enfermedad. Así mismo, concluye que la histología parece tener poca o ninguna influencia sobre el pronóstico, haciendo referencia al tipo de célula (coloide vs colónica), al grado de diferenciación y a la presencia de células en anillo de sello8.
En un estudio retrospectivo de 2013 que incluyó 21 pacientes con adenocarcinoma primario de la vejiga, 9 tenían adenocarcinoma uracal y 12 no uracal. El 66,7% de los pacientes tenía adenocarcinomas T2, el 14,3% estadio T3 y 19% estadio T46.
Fueron tratados con diferentes modalidades: RTU (n=7), cistectomía parcial (n=10), cistectomía radical (n=3) y quimioterapia (n=1). En el grupo de los uracales 7 fueron manejados con cistectomía parcial y los otros 2 con RTU. En el grupo de los no uracales 3 fueron llevados a cistectomía radical, 3 a cistectomía parcial, 5 a RTU y uno a quimioterapia (cisplatino)6.
Por lo menos la mitad de los tumores recurrieron en el tiempo de seguimiento (5/9 en los uracales y 5/12 en los no uracales). Se encontró una influencia significativa en la supervivencia dependiendo del estadio clínico. También hubo diferencia significativa entre el manejo con cistectomía parcial vs radical, que favorece el manejo con cistectomía radical6.
Por su parte, Kakizoe considera las tasas de recurrencia local justificación suficiente para favorecer la cistectomía radical, además que el examen histológico ulterior reporta un alto grado de compromiso muscular de la vejiga, distante al sitio original del tumor16.
La cistectomía parcial o la resección transuretral pueden estar indicadas para tumores pequeños, bien delimitados, con una buena sobrevida a largo plazo. La cistectomía radical por lo general se prefiere sobre la cistectomía parcial en casos donde los tumores no dependen del uraco, por la posibilidad de que la invasión local no pueda ser evidenciada en las imágenes1.
ConclusiónLa literatura actual sobre los adenocarcinomas uracales de vejiga expone resultados inciertos. No se ha encontrado una relación entre el tamaño y el pronóstico del paciente. Esta sí está presente en relación con el estadio patológico, sobre todo a partir de tumores pT3c. Con respecto al manejo, los resultados no son concluyentes y se dividen entre la cistectomía parcial y la radical.
Se trata de un paciente sin comorbilidades, ECOG I, con un tumor pT3a que fue manejado con cistectomía parcial, con adecuada respuesta clínica. De acuerdo al estadio patológico y clínico, la evidencia no sugiere que haya una alta probabilidad de recurrencia local, por lo cual el paciente fue llevado a cistectomía parcial. No requiere adyuvancia y debe continuar en seguimiento y vigilancia de recurrencias locales o sistémicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesDeclaramos que no existe conflicto de intereses.