En este reporte de caso se presenta y analiza cómo el incremento en la frecuencia eyaculatoria tiene efectos positivos sobre diferentes parámetros seminales convencionales (viabilidad, movilidad y morfología espermática) y marcadores de estrés oxidativo (lipoperoxidación de membranas espermáticas y marcadores de disrupción espermatogénica como el contenido de ADN espermático) en un hombre con diagnóstico de oligoteratoastenozoospermia, al punto que le permite ser un candidato más apropiado para el tratamiento de su infertilidad mediante inyección intracitoplasmática de espermatozoides.
The case is presented of a male with oligo-terato-asthenozoospermia, in whom increased ejaculatory frequency positively changed conventional (viability, motility, and morphology) and functional parameters (oxidative stress and spermatogenic alteration markers, such as lipid peroxidation and DNA content), to the point that he can be an appropriate candidate for intracytoplasmic sperm injection.
La reproducción sexual es el proceso fundamental que permite conservar la especie y pasar los genes a una nueva generación, pero en los humanos no es un proceso únicamente evolutivo, sino que involucra aspectos emocionales y psicosociales en la pareja1. Los espermatozoides son células altamente especializadas que no solo permiten llevar la información genética masculina hasta el oocito, sino que en conjunto con el plasma seminal desencadenan múltiples procesos en el tracto reproductivo femenino, como: reacciones inmunológicas, cambios estructurales en el epitelio vaginal e incremento de las secreciones hormonales uterinas. El moco cervical y el tracto reproductivo femenino seleccionan los espermatozoides más aptos para fecundar el oocito y generar un nuevo individuo2.
A pesar de la heterogeneidad de la población humana, los manuales para el procesamiento de semen humano publicados por la Organización Mundial de la Salud (OMS) desde 1980 han recopilado las características seminales que permiten definir un eyaculado como normal3,4. En la última edición del manual en 20105, la OMS definió la normalidad a través de la publicación de los límites inferiores de referencia con el percentil 5 de los parámetros seminales convencionales de hombres fértiles, y no a través de la media de los valores obtenidos en la población general, como sucedía en los manuales previos. Los nuevos referentes permiten clasificar los eyaculados de los hombres con concentración, morfología y movilidad espermática por debajo de los límites inferiores de referencia (15×106 de espermatozoides/mL, 4% de espermatozoides normales y 40% de espermatozoides móviles, respectivamente) como asteno, terato y oligozoospérmicos, respectivamente5.
La movilidad y la morfología espermática se han relacionado directamente con los casos de infertilidad masculina6; estudios recientes han demostrado que estas anomalías en los parámetros convencionales están asociadas a disfunciones fisiológicas en los espermatozoides, como la producción excesiva de especies reactivas del oxígeno, las cuales alteran el balance entre las moléculas oxidantes y las defensas antioxidantes celulares, desencadenando procesos relacionados con estrés oxidativo, como la peroxidación lipídica y el daño en la cromatina espermática7,8.
Nuevas técnicas y tecnologías han permitido la evaluación de varios parámetros fisiológicos espermáticos, contribuyendo no solo al incremento del conocimiento de las características fisiológicas óptimas de las células espermáticas9, sino también a encontrar una mejor forma de abordar la infertilidad por causa masculina10, especialmente en los casos en los que los parámetros seminales convencionales están por encima de los límites inferiores de referencia (infertilidad idiopática)11.
El tiempo que pasan los espermatozoides almacenados en el epidídimo puede ser un factor determinante en la calidad seminal; la poca frecuencia eyaculatoria se ha relacionado con una mayor exposición a los efectos del estrés oxidativo12. El tiempo de abstinencia sexual es uno de los criterios clínicos tenidos en cuenta durante el análisis seminal; el intervalo recomendado por la OMS es de 2 a 7 días. Este tiempo tiene efectos sobre varios parámetros seminales convencionales, como la viabilidad, el volumen y la concentración espermática13,14; sin embargo, sus efectos sobre los parámetros funcionales aún no están bien establecidos.
Este reporte de caso tiene como objetivo presentar un hombre diagnosticado con oligoteratoastenozoospermia y determinar los efectos de la eyaculación recurrente sobre sus parámetros seminales convencionales y funcionales.
Descripción del pacienteEn el presente reporte de caso se describe a un hombre de 37 años, ingeniero ambiental en una fábrica de pinturas, aparentemente sano con cariotipo normal 46 XY, sin antecedentes de enfermedades crónicas, que no consume cigarrillos, drogas alucinógenas o alcohol. Consultó en febrero de 2014 por infertilidad después de 2 años buscando concebir un hijo con su pareja sin utilizar ningún método anticonceptivo. En el examen general practicado por el urólogo se le detectó varicocele grado i, que fue corregido mediante cirugía.
Su pareja, una mujer profesional de 34 años, fue sometida a los 14 años de edad a un proceso de quimioterapia por cáncer renal y a la extracción de un riñón. Su periodo menstrual se vio alterado; se normalizó a los 22 años. En la actualidad, después de la evaluación por el ginecólogo, se encuentra sana y apta para concebir.
Al paciente se le realizaron 7 análisis seminales tanto convencionales (volumen seminal, concentración espermática, concentración espermática total, movilidad, viabilidad y morfología espermática)5 como funcionales (potencial de membrana mitocondrial, integridad de la membrana plasmática13, determinación de especies reactivas del oxígeno y nitrógeno intracelulares11,15, fragmentación de la cromatina espermática13,16,17, contenido de ADN en los espermatozoides18 y lipoperoxidación de las membranas celulares19).
El primer análisis seminal se le realizó en marzo de 2014, y el segundo espermograma, un año después (julio de 2015); entre julio y noviembre de 2015 se realizaron los 5 análisis siguientes. Los 2 primeros espermogramas (#1 y #2) se realizaron después de 3 a 5 días de abstinencia sexual; los análisis seminales de las muestras #3 y #4 se llevaron a cabo durante un periodo de eyaculación diaria por 15 días, haciendo la evaluación del semen recolectado por masturbación, el día 8 (#3) y el día 15 (#4) de eyaculación. Finalmente, se le realizaron 3 evaluaciones (#5, #6 y #7) con 20 días de intervalo entre ellas y con una frecuencia eyaculatoria promedio de 2 a 3 días.
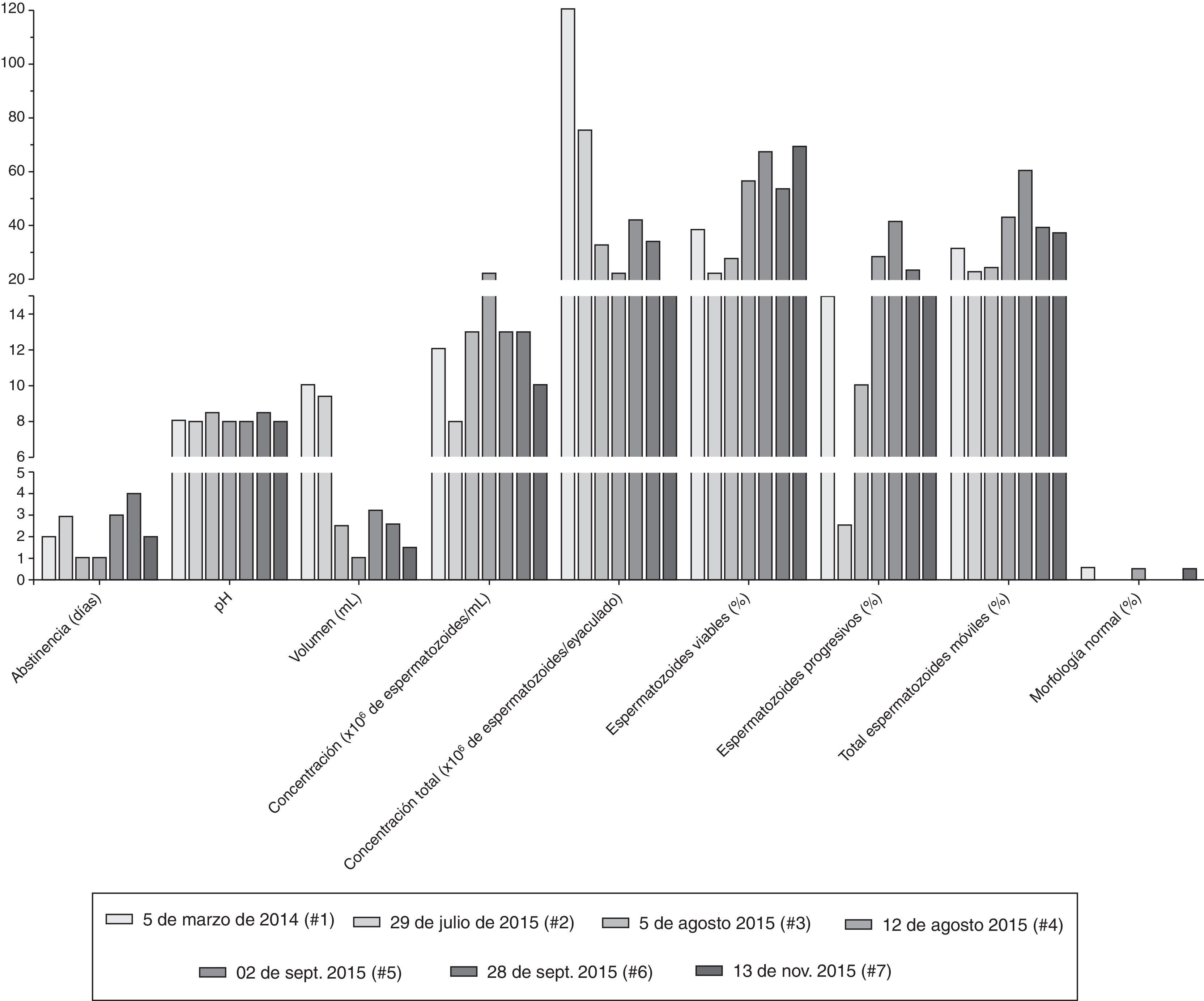
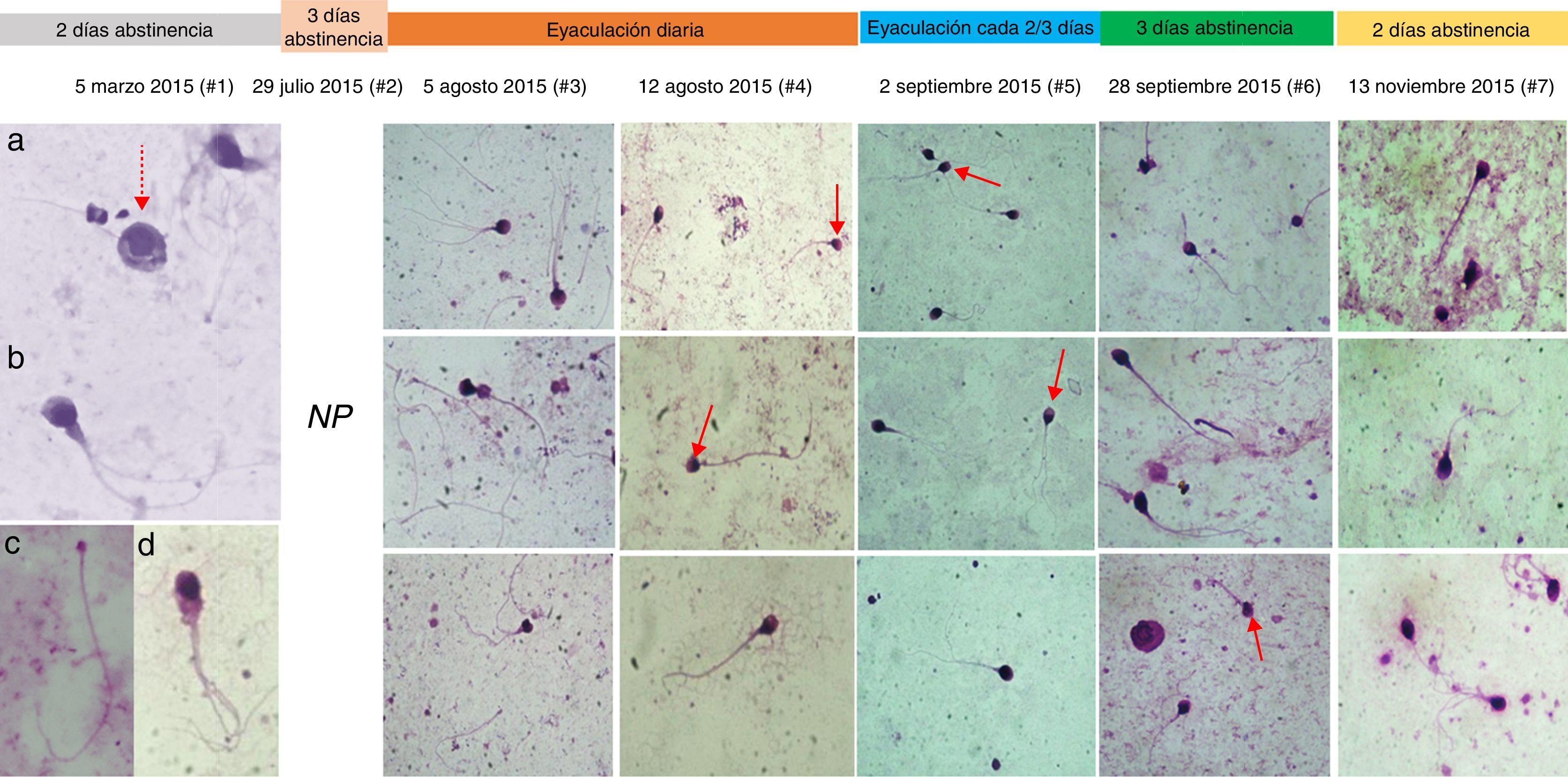
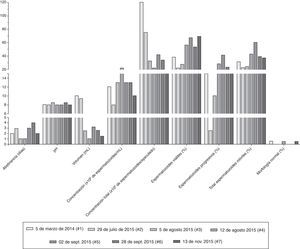
ResultadosLos parámetros seminales convencionales variaron en función de la frecuencia eyaculatoria (fig. 1). Es importante resaltar que después de pasar los 15 días de eyaculación diaria y continuar con una eyaculación más frecuente, los espermatozoides viables y con movilidad progresiva se incrementaron respecto a los valores iniciales (#1 y #2). Los 2 eyaculados iniciales (#1 y #2) presentaron oligoastenozoospermia, sumado a teratozoospermia severa, con una morfología característica: gran cantidad de espermatozoides macrocéfalos y microcéfalos, espermatozoides con 2 o más cabezas, abundantes espermatozoides multiflagelados y células inmaduras flageladas (fig. 2, análisis #1).
Valores para los días de abstinencia sexual y los parámetros seminales convencionales durante las 7 evaluaciones realizadas. Cada tipo de barra representa los valores obtenidos para cada variable en una fecha (#1 a #7) de análisis seminal determinada. El volumen en mL, la concentración en 1×106 de espermatozoides por mL de semen o por el volumen total del eyaculado (concentración total), los espermatozoides viables, los móviles progresivos, el total de espermatozoides móviles y la morfología normal se representan en porcentaje.
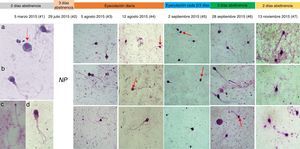
Cronología fotográfica de la morfología espermática en los 7 análisis seminales, análisis en objetivo de ×100. En las fotos del análisis #1 se observa: a) células inmaduras; b) espermatozoide macrocéfalo multiflagelado; c) espermatozoide microcéfalo; d) espermatozoide con residuo citoplasmático y multiflagelado. En el análisis #2 (29 de julio de 2015) no se realizó registro fotográfico (NR). Las flechas llaman la atención acerca del cambio en las cabezas espermáticas desde el análisis #1.
De forma interesante, aunque el porcentaje de anormalidades de la cabeza continuó siendo mayor del 80%, las formas de las cabezas espermáticas cambiaron drásticamente durante las evaluaciones realizadas después de eyacular repetidamente (#3 y #4), adquiriendo una forma que se acerca mucho más a lo descrito como cabeza normal por la OMS5; se observaron más espermatozoides con cabezas ovaladas y de tamaño moderado comparados con los observados inicialmente (fig. 2), e incluso algunos espermatozoides normales (fig. 1).
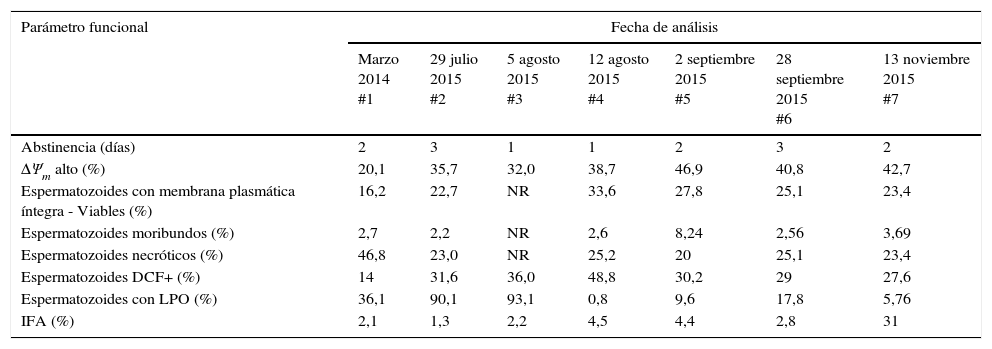
Respecto a los parámetros funcionales, se encontró que la lipoperoxidación de las membranas celulares se redujo a través de las fechas de análisis y en la última evaluación (#7) el IFA se incrementó a un 31%. Los valores de los otros parámetros funcionales fueron estables durante todos los análisis realizados (tabla 1).
Valores de los parámetros seminales funcionales evaluados en el paciente durante los 7 análisis
| Parámetro funcional | Fecha de análisis | ||||||
|---|---|---|---|---|---|---|---|
| Marzo 2014 #1 | 29 julio 2015 #2 | 5 agosto 2015 #3 | 12 agosto 2015 #4 | 2 septiembre 2015 #5 | 28 septiembre 2015 #6 | 13 noviembre 2015 #7 | |
| Abstinencia (días) | 2 | 3 | 1 | 1 | 2 | 3 | 2 |
| ΔΨm alto (%) | 20,1 | 35,7 | 32,0 | 38,7 | 46,9 | 40,8 | 42,7 |
| Espermatozoides con membrana plasmática íntegra - Viables (%) | 16,2 | 22,7 | NR | 33,6 | 27,8 | 25,1 | 23,4 |
| Espermatozoides moribundos (%) | 2,7 | 2,2 | NR | 2,6 | 8,24 | 2,56 | 3,69 |
| Espermatozoides necróticos (%) | 46,8 | 23,0 | NR | 25,2 | 20 | 25,1 | 23,4 |
| Espermatozoides DCF+ (%) | 14 | 31,6 | 36,0 | 48,8 | 30,2 | 29 | 27,6 |
| Espermatozoides con LPO (%) | 36,1 | 90,1 | 93,1 | 0,8 | 9,6 | 17,8 | 5,76 |
| IFA (%) | 2,1 | 1,3 | 2,2 | 4,5 | 4,4 | 2,8 | 31 |
DCF: diclorofluoresceína, escindida de diacetato de diclorodifluoresceína; IFA: índice de fragmentación de la cromatina espermática; LPO: lipoperoxidación; NR: no se realizó; ΔΨm: potencial de membrana mitocondrial.
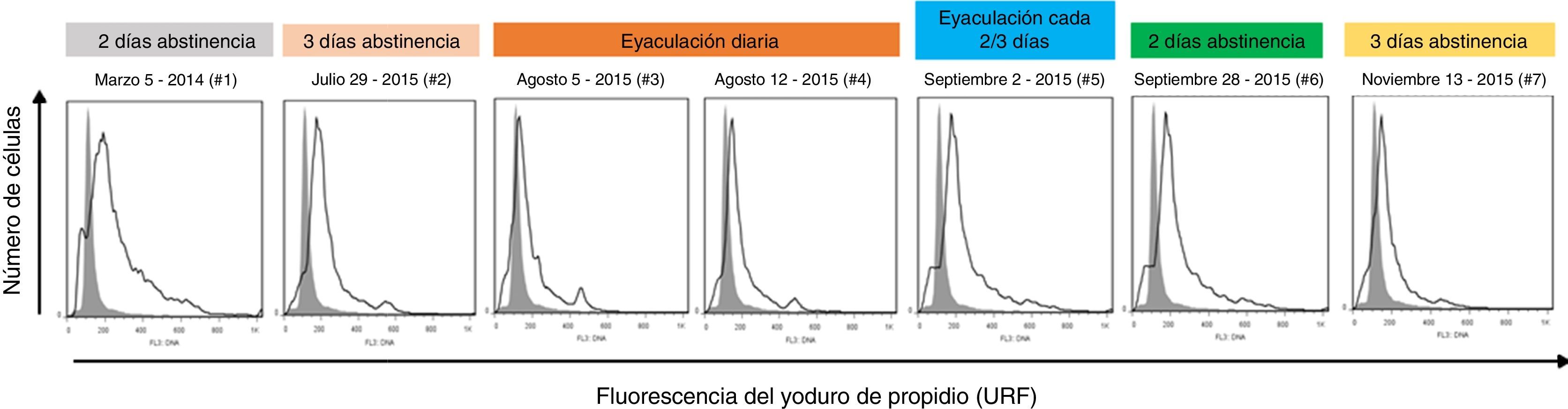
La cuantificación del contenido de ADN de las células espermáticas mediante el método de tinción de la cromatina para ciclo celular20 permitió evidenciar células espermáticas diploides e incluso tetraploides debido a que integran diferencialmente el yoduro de propidio18; no obstante, a medida que la eyaculación fue más frecuente la mayoría de las células se movieron hacia el pico del histograma con contenido de ADN haploide (fig. 3).
DiscusiónEn este reporte de caso se describe la mejoría de varios parámetros seminales convencionales y algunos parámetros funcionales en un paciente infértil diagnosticado como oligoteratoastenozoospérmico.
Se ha demostrado que los espermatozoides son blanco de los efectos deletéreos causados por las especies reactivas del oxígeno en su tránsito por el epidídimo12. En el periodo de eyaculación diaria, en el cual el sistema de producción de los espermatozoides fue sometido al estímulo de liberación acelerada, se observaron mejorías cualitativas en la morfología espermática y un aumento del porcentaje de espermatozoides móviles y viables. Esto puede estar relacionado directamente con la disminución notable de la lipoperoxidación espermática, la cual se ha demostrado que al afectar los lípidos de las membranas celulares, interfiere con las estructuras espermáticas que permiten la movilidad19,21.
La morfología espermática anormal encontrada en los análisis seminales #1 y #2 (espermatozoides macrocéfalos, microcéfalos, multicefalos y multiflagelados) se ha asociado con una estructura alterada del ADN espermático y fragmentación de la cromatina22. No obstante, es de resaltar que según los índices muy bajos de IFA obtenidos, valores que pocas veces se habían registrado en los análisis realizados en el Grupo Reproducción, el paciente era clasificado como con un potencial fértil excelente10,17,23,24.
Sin embargo, en los análisis de fragmentación de la cromatina espermática se observó que alrededor del 50% de las células teñidas con naranja de acridina correspondían a la población denominada espermatozoides con alta capacidad de tinción, los cuales tienen una mayor intensidad media de fluorescencia en verde23; estos se considera que representan a los espermatozoides inmaduros23,25. Lo anterior, sumado a la clara alteración en la morfología espermática y al hecho de que el contenido de ADN fuera mayor en los análisis iniciales, evidencia que el paciente presenta una disrupción en la espermatogénesis.
Generalmente, la alteración en la compactación del ADN espermático se ha atribuido a un recambio anormal de histonas por protaminas en la maduración de los espermatozoides, por lo que la inadecuada protaminación se ha relacionado con la mayor susceptibilidad a la fragmentación de la cromatina espermática25; esto se contrapone a los bajos valores de IFA encontrados en la mayoría de los análisis seminales realizados al paciente.
Algunas técnicas permiten aproximarse a evaluar esta madurez nuclear espermática; es el caso de la tinción con el colorante azul de anilina, que permite discriminar entre los núcleos ricos en lisina de los espermatozoides inmaduros y los núcleos ricos en arginina y cisteína de los espermatozoides maduros26. En un único análisis realizado en la última muestra seminal del paciente (#7) se encontró que el 41% de los espermatozoides presentaban inmadurez en la cromatina (valor de referencia 20%27,28). Sin embargo, es necesario realizar una evaluación en secuencia, similar a la realizada para los otros parámetros, con el fin de lograr resultados concluyentes.
En un estudio previo del Grupo Reproducción se observó que la eyaculación recurrente diaria en individuos normozoospérmicos, durante 15 días, no afectaba el IFA; sin embargo, después de 4 eyaculaciones en el mismo día, con intervalos de 2h, sí se producía un incremento en la susceptibilidad al daño de ADN14. Uno de los mayores cambios observados en los parámetros funcionales fue el incremento del IFA en la última evaluación (31%), después de aumentar la frecuencia eyaculatoria. A pesar de que este valor de IFA permitiría clasificar el potencial fértil del paciente como pobre17,23, ello reafirma que la frecuencia eyaculatoria sí tiene efecto sobre la espermatogénesis, teniendo en cuenta que a la fecha de este análisis (#7) ya había transcurrido el tiempo de producción de una nueva oleada de espermatozoides (aproximadamente 72 días) desde la primera evaluación del año 2015 (#2).
En los mamíferos la competencia espermática implica, entre otras cosas, fecundar la mayor cantidad de hembras posibles con el fin de preservar la especie, y esto involucra la producción de mejores espermatozoides a veces en condiciones aceleradas29. En humanos, la competencia de los espermatozoides por fecundar el oocito se ha abordado desde el plano de todos los espermatozoides presentes en el eyaculado, y pocas veces se le ha dado un contexto poblacional en el que una mayor frecuencia eyaculatoria, incluso por emisiones no copulatorias, implica un mayor éxito reproductivo y demanda la producción de células espermáticas óptimas para competir con las de diferentes hombres30.
Debido al oficio del paciente –ingeniero ambiental en una planta de producción de pinturas–, se realizaron diversas consultas con él buscando el origen de su oligoteratoastenozoospermia en su ambiente laboral, a causa de la asociación entre el ambiente ocupacional y la teratozoospermia. Sin embargo, se descartó esta posibilidad pues tiene contacto ocasional con los elementos químicos utilizados en el desarrollo de las pinturas y su lugar de trabajo no es contiguo a la planta de procesamientos.
De acuerdo con toda la información obtenida de las evaluaciones realizadas al paciente, se concluye que su infertilidad tiene diversas causas que pueden estar concatenadas, como el estrés oxidativo y una espermatogénesis defectuosa, aunque no de origen genético, por lo que se puede descartar del cariotipo normal, y de la recuperación progresiva, aunque lenta, de la morfología y el contenido de ADN espermático normal con la eyaculación frecuente. Estos resultados resaltan la importancia de reducir el tiempo entre eyaculaciones, especialmente cuando se busca concebir. Sin embargo, se considera necesario realizar más estudios similares, incluso involucrando pacientes con oligo, asteno o teratozoospermia por separado, que permitan apoyar las observaciones aquí descritas y dilucidar los mecanismos fisiológicos por los cuales la mayor frecuencia eyaculatoria permite la mejoría en los parámetros seminales.
En pacientes con oligoteratoastenozoospermia la técnica reproductiva más recomendada es la inyección intracitoplasmática de espermatozoides, en la cual se seleccionan espermatozoides con una morfología y ultraestructura de cabeza óptimas para fecundar el oocito31,32. De forma interesante, el cambio del paciente de tener teratozoospermia severa a observarse cabezas e incluso espermatozoides con morfología normal (figs. 1 y 2) lo hace un candidato más apto para la realización de una inyección intracitoplasmática de espermatozoides.
En conclusión, sería aconsejable continuar con un menor tiempo de abstinencia sexual y repetir la eyaculación recurrente diaria antes de recolectar la muestra de semen para algún procedimiento de reproducción asistida con el fin de retar el sistema de producción espermático y obtener mejores espermatozoides. Además, el reto al sistema de producción espermática, como una forma de competencia intereyaculatoria, puede ser una forma de mejorar los parámetros espermáticos en pacientes con alteraciones severas de origen no genético, esto con el fin de tener una mayor probabilidad de éxito en las técnicas reproductivas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl presente estudio fue financiado por la Estrategia de Sostenibilidad, Grupo Reproducción, de la Universidad de Antioquia. PCLA fue Joven Investigadora Colciencias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.