Editado por: Dra. Núria Torner CIBER Epidemiologia y Salud Publica CIBERESP Unitat de Medicina Preventiva i Salut Pública Departament de Medicina, Universitat de Barcelona
Más datosen esta investigación se evaluó la asociación de las variantes genéticas rs1800629 en TNF y rs2228145 en IL6R con la producción de anticuerpos neutralizantes contra SARS-CoV-2 y la frecuencia de eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI) en la población adulta del occidente de México con esquema de vacunación AZD1222.
Métodosse evaluaron 117 adultos (33 años [23-40], 65% mujeres). Se registró la frecuencia autoreportada de ESAVI y se cuantificó el porcentaje de anticuerpos neutralizantes posvacunación. La identificación de las variantes genéticas rs1800629 y rs2228145 se realizó mediante qPCR.
Resultadosla frecuencia de los genotipos de la variante rs1800629 en TNF fue: GG (86%) y GA (14%) y de la variante rs2228145 en IL6R: AA (20%), CA (48%) y CC (32%). El porcentaje de anticuerpos posvacunación fue similar entre hombres y mujeres (mediana 97,24%). La frecuencia de los ESAVI adinamia (p=0,0243), escalofríos (p=0,0085), artralgia (p=0,0227) y dolor en zona de aplicación (p=0,0096) fueron más frecuentes en las mujeres. El genotipo GA de rs1800629 se asoció con fiebre (p=0,0131) y artralgia (p=0,0058) post-vacunación, pero no con la producción de anticuerpos neutralizantes. La variante rs2228145 no se asoció con la producción de anticuerpos ni con la frecuencia de ESAVI.
Conclusiónlas variantes rs1800629 en TNF y rs222815 en IL6R no se asocian con la producción de anticuerpos neutralizantes contra SARS-CoV-2 después de recibir el esquema AZD1222 en la población del occidente de México; sin embargo, los resultados sugieren que la variante rs1800629 incrementa la frecuencia de los ESAVI fiebre y artralgia.
In this research, we evaluated the association of genetic variants rs1800629 in TNF and rs2228145 in IL6R with production of neutralizing antibodies against SARS-CoV-2 and the frequency of adverse effects following immunization (AEFIs) in adult population from Western of Mexico that received AZD1222 vaccination.
MethodsOne hundred-seventeen adults were evaluated (33 years [23-40], 65% women). The self-reported frequency of AEFIs was recorded and the percentage of post-vaccination neutralizing antibodies was quantified. The identification of rs1800629 variant in TNF and rs2228145 in IL6R was performed by qPCR.
ResultsThe genotype frequencies of rs1800629 variant were: GG (86%) and GA (14%), and for rs2228145 variant were: AA (20%), CA (48%) and CC (32%). The percentage of post-vaccination antibodies was similar between men and women (median, 97.24%). An association was found between the frequency of AEFIs with the sex; being adynamia (p=0.0243), chills (p=0.0085), arthralgia (p=0.0227) and pain in application area (p=0.0096) more frequent in women. The GA genotype of rs1800629 variant showed an association with fever (p=0.0131) and arthralgia (p=0.0058) post-vaccination, but no relationship was found with the production of neutralizing antibodies after AZD1222 vaccination. The rs2228145 variant was not associated with the production of antibodies nor with the AEFIs reported.
ConclusionThe genetic variants rs1800629 in TNF and rs222815 in IL6R are not associated with the production of neutralizing antibodies against SARS-CoV-2 after receiving AZD1222 scheme in population from western of Mexico; however, the results suggest that rs1800629 variant increases the frequency of post-vaccination events, particularly fever and arthralgia.
La pandemia por el virus del síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2) causante de la COVID-19 y su rápida dispersión a nivel mundial, favoreció el desarrollo y la aplicación de vacunas en un breve lapso de tiempo para controlar la propagación del virus y reducir la severidad y letalidad de la COVID-191. México reportó una de las tasas de letalidad más alta a nivel mundial (11-13%) y aunque son múltiples los factores asociados a una mayor mortalidad2, se ha reconocido que la genética del hospedero puede jugar un papel importante en la susceptibilidad a la infección y en la severidad de la misma e incidir en la respuesta inmune inducida por vacunas, así como en los efectos posteriores a su aplicación3.
En la región occidente de México, la vacuna AZD1222 (AstraZeneca, Universidad de Oxford) ha sido una de las más aplicadas; esta se basa en un vector vírico recombinante no replicativo de tipo adenovirus, que contiene información codificada para producir la proteína espiga (S) del SARS-CoV-2, estimulando la respuesta inmune humoral y celular4. La proteína S es un sitio antigénico importante al cual se unen los anticuerpos neutralizantes producidos por el hospedero para bloquear la entrada del virus5, por lo que es clave en el diseño de las vacunas como AZD1222. Los eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI) denotan un evento clínico desfavorable y no intencionado posterior a la vacunación, sin ser necesaria la relación causal con el proceso de inmunización o la propia vacuna6. Los ESAVI más frecuentemente relacionados con la vacuna de AZD1222 son dolor en la zona de aplicación, cefalea, mialgia, fatiga, artralgia y fiebre4.
Por otro lado, el factor de necrosis tumoral alfa (TNF-α) es una citoquina proinflamatoria y un regulador clave del sistema inmune innato y adaptativo; participa en el reclutamiento de linfocitos a las zonas de infección, activa las células presentadoras de antígeno y puede activar al linfocito B por la vía independiente de linfocitos T, permitiendo su proliferación y diferenciación a células plasmáticas productoras de anticuerpos7. El gen que la codifica es el TNF y es altamente polimórfico. La variante rs1800629 está situada en la región promotora del gen TNF y se ha sugerido que tiene un efecto en su expresión génica, al existir mayor expresión de TNF-α en los individuos con genotipos GA y AA, respecto a los portadores del genotipo GG8. Por su parte, la citoquina IL-6 es un inductor importante de la respuesta de fase aguda que regula genes implicados en la diferenciación, supervivencia, apoptosis y proliferación celular; para su señalización, requiere de la interacción con el receptor de IL-6 (IL-6R) el cual se puede presentar de 2 formas: transmembranal y soluble9. El gen que se encarga de codificar este receptor es IL6R y es altamente polimórfico10. La variante genética rs2228145 se encuentra en el exón 9 de IL6R y conduce a una sustitución de aminoácido a nivel de proteína (ácido aspártico [Asp] por alanina [Ala]) en la posición 358 dentro del dominio extracelular de IL-6R11. Se ha sugerido que este polimorfismo induce mayor desprendimiento de IL-6R de la superficie celular provocando alteración en la vía IL-6 clásica12 y el alelo C (358 Ala) se ha asociado con concentraciones aumentadas de sIL-6R circulante13.
La respuesta inmune generada posvacunación podría verse afectada por la presencia de variantes en genes del sistema inmune, como ha sido reportado previamente para la vacuna contra el sarampión, la rubéola, la hepatitis B, entre otras3. En este sentido, la presencia del genotipo polimórfico AA de rs1800629 en TNF, fue previamente asociada con una producción baja de anticuerpos para la vacuna contra la hepatitis B14. En otro estudio se encontró una tasa baja de seroconversión en los portadores de esta variante al recibir la vacuna contra la encefalitis japonesa, sin llegar a ser significativa15. Por su parte, el alelo C del polimorfismo rs2228145 en IL6R se ha asociado con enfermedades como la esclerosis lateral amiotrófica16, así como el desarrollo de Alzheimer de inicio temprano12 y el desarrollo de diabetes tipo 1 en la edad adulta17.
Actualmente no existen estudios que asocien a las variantes rs1800629 y rs228145 en TNF e IL6R, con la producción de anticuerpos neutralizantes contra SARS-CoV-2 tras recibir el esquema de vacunación AZD1222; además, la respuesta de los individuos inmunizados es heterogénea y no se cuenta con datos suficientes para conocer la producción de anticuerpos tras recibir dicho esquema, por lo cual, en esta investigación se planteó estudiar a la población adulta del occidente de México vacunada con el esquema AZD1222, con el objetivo de evaluar si ambas variantes en genes de respuesta inmune son un factor genético asociado a la producción de anticuerpos neutralizantes generados por la vacuna AZD1222 y a la frecuencia de ESAVI. La investigación sobre los factores inmunogenéticos asociados a la respuesta posvacunación es relevante, dado que puede explicar la heterogeneidad de esta respuesta en la población de estudio.
Material y métodoDiseño y sede del estudioEl presente estudio fue de tipo transversal-analítico, los participantes asistieron al Laboratorio de Biomedicina y Biotecnología para la Salud en el Centro Universitario del Sur de la Universidad de Guadalajara (en el periodo octubre 2021-febrero 2022), donde se realizó la obtención de una muestra sanguínea para la separación de suero y extracción de ADN genómico (ADNg). Durante la misma visita, se aplicó una encuesta de datos sociodemográficos, el cuestionario de frecuencia ESAVI y se realizó la evaluación antropométrica de los participantes.
ParticipantesLos participantes fueron reclutados por invitación. El cálculo del tamaño de la muestra se realizó utilizando el programa OpenEpi (v. 3), utilizando las frecuencias genotípicas reportadas por SNPedia en la población con ancestría mexicana (con residencia en Los Ángeles, EE. UU.) para la variante rs1800629. Se obtuvo una n = 116 con un poder estadístico de 80% y nivel de confianza de 90%. Se incluyó un total de 117 participantes, 38% hombres (n = 45) y 62% mujeres (n = 72), con un rango de edad entre 18 y 60 años. Los criterios de inclusión fueron: contar con esquema de vacunación AZD1222 de 2 dosis, contar con al menos 15 días de la aplicación de la última dosis y ser mestizo mexicano, con ancestría de por lo menos 3 generaciones anteriores del occidente de México; los criterios de exclusión fueron: contar con otro(s) esquema(s) de vacunación contra SARS-CoV-2, estar embarazada, estar en tratamiento con inmunosupresores, presentar síntomas o infección confirmada de SARS-CoV-2 o de otras enfermedades infecciosas al momento de la toma de la muestra.
Composición corporal y antropometríaSe realizó la evaluación antropométrica de los participantes, siguiendo los lineamientos establecidos por la Sociedad Internacional para el Avance de la Cineantropometría (ISAK). La medición de peso (kg) y grasa corporal (%) se realizó con un monitor de grasa corporal y báscula de bioimpedancia (BF-679W, Tanita, Japón), la talla (cm) con estadiómetro portátil (213 l, SECA, EE. UU.), mientras que la circunferencia de cintura y cadera (cm) se midió con cinta antropométrica (Lufkin, EE. UU.).
Cuantificación de anticuerpos neutralizantes contra la proteína S del SARS-CoV-2La recolección de la muestra sanguínea de los participantes se realizó por venopunción en tubos para suero. Los sueros se separaron por procedimientos estandarizados y se almacenaron a -60 °C. La cuantificación del porcentaje de anticuerpos neutralizantes contra SARS-CoV-2 se realizó mediante el ensayo cPass SARS-CoV-2 Neutralization Antibody Detection Kit (GenScript, China) basado en un ensayo de inmunoadsorción ligado a enzimas (ELISA) por bloqueo. El protocolo se realizó de acuerdo con las instrucciones del fabricante. La lectura de absorbancia fue a 450 nm y los porcentajes de neutralización se calcularon utilizando la fórmula proporcionada por el fabricante: porcentaje de neutralización = 1- (Valor densidad óptica [DO] de la muestra/Valor DO del control negativo) x100.
Extracción de ADN genómicoSe extrajo una muestra sanguínea por venopunción, a partir de la cual se realizó la extracción de ADNg mediante el kit QIAamp DNA Blood Mini Kit (QIAGEN, Alemania) siguiendo la metodología especificada por el fabricante. La cantidad y calidad del ADNg obtenido fue verificado por medio de la medición de la densidad óptica a 260 y 280 nm en un espectrofotómetro (Multiskan, Thermo Fischer Scientific, EE. UU).
Identificación de genotipos de las variantes rs1800629 y rs2228145La identificación de las variantes rs1800629 y rs2228145 se realizó por amplificación mediante la reacción en cadena de la polimerasa en tiempo real (qPCR), utilizando sondas Taqman (C_7514879_10 y C_16170664_10, Applied Biosystems, EE. UU.). Los reactivos fueron preparados según las recomendaciones del fabricante de la siguiente manera: 5 μl de TaqMan Master Mix; 0,5 μl TaqMan SNP Genotyping Assay; ∼50 ng de ADNg; ∼3,5 μl de agua estéril, completando un volumen de 10 μl por reacción. La qPCR se realizó en el termociclador QuantStudio5 (Applied Biosystems, EE. UU.), con las siguientes condiciones: activación de la polimerasa a 95 °C por 10 minutos, desnaturalización a 95 °C por 15 segundos, alineación y extensión a 60 °C por un minuto; todo lo anterior por 40 ciclos. Como control negativo y controles positivos, se utilizó agua libre de ADNasas y muestras de ADN con genotipos conocidos, respectivamente. La identificación de los genotipos se realizó mediante el software QuantStudio Design & Analysis Software v1.5.2 (Applied Biosystems, EE. UU.).
Análisis estadísticoLos datos fueron analizados y graficados mediante el software GraphPad Prism Ve.8.0.1 (GraphPad Software LLC). La distribución de datos se verificó con la prueba de normalidad de Kolmogorov-Smirnov y el test D’Agostino. Se realizaron análisis comparativos de los niveles de anticuerpos con base en el sexo o el genotipo; las variables continuas con distribución normal fueron comparadas mediante pruebas paramétricas (T Student o ANOVA) y aquellas con distribución no normal fueron comparadas mediante pruebas no paramétricas (U de Mann-Whitney o Kruskal-Wallis). Las variables categóricas se expresaron como porcentaje y frecuencias, se analizaron mediante prueba de Chi-cuadrada o prueba exacta de Fisher, según corresponda. Se consideró un nivel de significancia de p < 0,05.
ResultadosCaracterísticas sociodemográficas, antropométricas y antecedentes clínicos de los participantesLas características sociodemográficas, antropométricas y antecedentes clínicos de los participantes se muestran en la tabla 1. Se evaluaron un total de 117 individuos con una mediana de 36 (22-58) días posvacunación, los cuales se separaron considerando el sexo de los participantes. Se encontraron diferencias significativas con respecto a la edad (p = 0,0274) y el porcentaje de grasa corporal (p = 0,0001), siendo mayores en el grupo femenino. El peso (p = 0,0010), la talla (p < 0,0001) y la circunferencia de cintura (p = 0,0043) fueron mayores en el grupo masculino.
Datos demográficos, antropométricos y clínicos de los participantes con esquema de vacunación AZD1222
| Variable | Total | Masculino | Femenino | p |
|---|---|---|---|---|
| Participantes (n) | 117 | 45 | 72 | -- |
| Edad (años) | 33 (23-40) | 30 (22-37) | 34 (25-43) | 0,0274a |
| Peso (kg) | 73 (62-84) | 79 (68-92) | 70 (59-81) | 0,0010a |
| Talla (cm) | 165 (158-172) | 172 ± 7 | 161 ± 6 | <0,0001b |
| Circunferencia cintura (cm) | 89 ± 16 | 95 ± 17 | 86 ±14 | 0,0043b |
| Circunferencia cadera (cm) | 102 (95-109) | 101 (96-109) | 102 (94-109) | 0,9277a |
| Grasa corporal (%) | 34 (25-40) | 28 ± 14 | 36 ± 8 | 0,0001b |
| IMC | 27 (23-31) | 28 ± 7 | 28 ± 6 | 0,0661b |
| Días posvacunación | 36 (22-58) | 36 (23-63) | 37 (20-51) | 0,5371b |
| Enfermedades crónicas | ||||
| Diabetes mellitus tipo 2 | 6,8 (8) | 2,2 (1) | 9,7 (7) | -- |
| Hipertensión arterial | 7,7 (9) | -- | 12,5 (9) | -- |
| Colitis | 0,8 (1) | -- | 1,4 (1) | -- |
| Arritmia | 0,8 (1) | -- | 1,4 (1) | -- |
| Hepática | 0,8 (1) | -- | 1,4 (1) | -- |
| Asma | 3,4 (4) | -- | 5,6 (4) | -- |
| Tiroides | 0,8 (1) | -- | 1,4 (1) | -- |
| Dislipidemia | 0,8 (1) | -- | 1,4 (1) | -- |
| Resistencia a la insulina | 0,8 (1) | -- | 1,4 (1) | -- |
| Cáncer | 1,7 (2) | 2,2 (1) | 1,4 (1) | -- |
| Taquicardia | 0,8 (1) | -- | 1,4 (1) | -- |
| Obesidad | 29,9 (35) | 31,1 (14) | 29,2 (21) | -- |
| Antecedentes clínicos | ||||
| Alergias | 14,5 (17) | 15,6 (7) | 13,9(10) | -- |
| COVID-19 | 14,5 (17) | 24,4 (11) | 8,3 (6) | -- |
IMC: índice de masa corporal.
Los datos se presentan como media ± desviación estándar o mediana (P25%-P75%), según su distribución. Los valores significativos se muestran en negrita.
Prueba utilizada según la normalidad de los datos.
Se identificaron 2 de los 3 genotipos de la variante rs1800629: el homocigoto silvestre GG con 86,3% (n = 101) y el heterocigoto polimórfico GA con 13,7% (n = 16); siendo nula la presencia del homocigoto polimórfico AA. Se determinó que las frecuencias genotípicas de esta variante se encontraban en equilibrio de Hardy-Weinberg (p = 0,728). En el caso de la variante rs2228145, se identificaron los 3 genotipos: el homocigoto AA con el 20% (n = 25), el heterocigoto polimórfico CA con 48% (n = 55) y el homocigoto polimórfico con el 32% (n = 37). Se determinó que las frecuencias genotípicas de esta variante se encontraban en equilibrio de Hardy-Weinberg (p = 0,9243), por lo que se infiere que en la población de estudio hubo una selección aleatoria, no existen tasas altas de mutación, no se presenta migración u otros fenómenos que causen su desviación. Las frecuencias genotípicas y alélicas de ambas variantes se muestran detalladamente en la tabla 2. No se encontraron diferencias significativas al comparar la frecuencias genotípicas y alélicas con base en el sexo.
Frecuencias genotípicas y alélicas por grupo de estudio
| Total(n = 117) | Masculino(n = 45) | Femenino(n = 72) | p | OR (IC 95%) | |
|---|---|---|---|---|---|
| Genotipos | |||||
| rs1800629 | |||||
| GG | 86,3 (101) | 84,4 (38) | 87,5 (63) | 0,783 | 1 |
| GA | 13,7 (16) | 15,6 (7) | 12,5 (9) | 0,775 (0,272-2,062) | |
| AA | -- | -- | -- | -- | |
| rs2228145 | |||||
| CC | 32 (37) | 33,3 (15) | 30,6 (22) | 0,839 | 1 |
| CA | 48 (55) | 48,9 (22) | 47,2 (34) | 0,9490 (0,411-2,262) | |
| AA | 20 (25) | 17,7 (8) | 22,2 (16) | 0,7333 (0,260-2,018) | |
| Alelos | |||||
| rs1800629 | |||||
| G | 93,2 (218) | 92,2 (83) | 93,8 (135) | 0,791 | 1 |
| A | 6,8 (16) | 7,8 (7) | 6,2 (9) | 0,79 (0,3-2,07) | |
| rs2228145 | |||||
| C | 55 (130) | 57,78 (52) | 54,17(78) | 0,589 | 1 |
| A | 45 (104) | 42,22 (38) | 45,83 (66) | 0,8636 (0,5119-1,492) |
Los datos se presentan como porcentajes y frecuencia % (n). Prueba Chi-cuadrada o Prueba exacta de Fisher según corresponda..
IC: Intervalo de confianza; OR: Odds ratio.
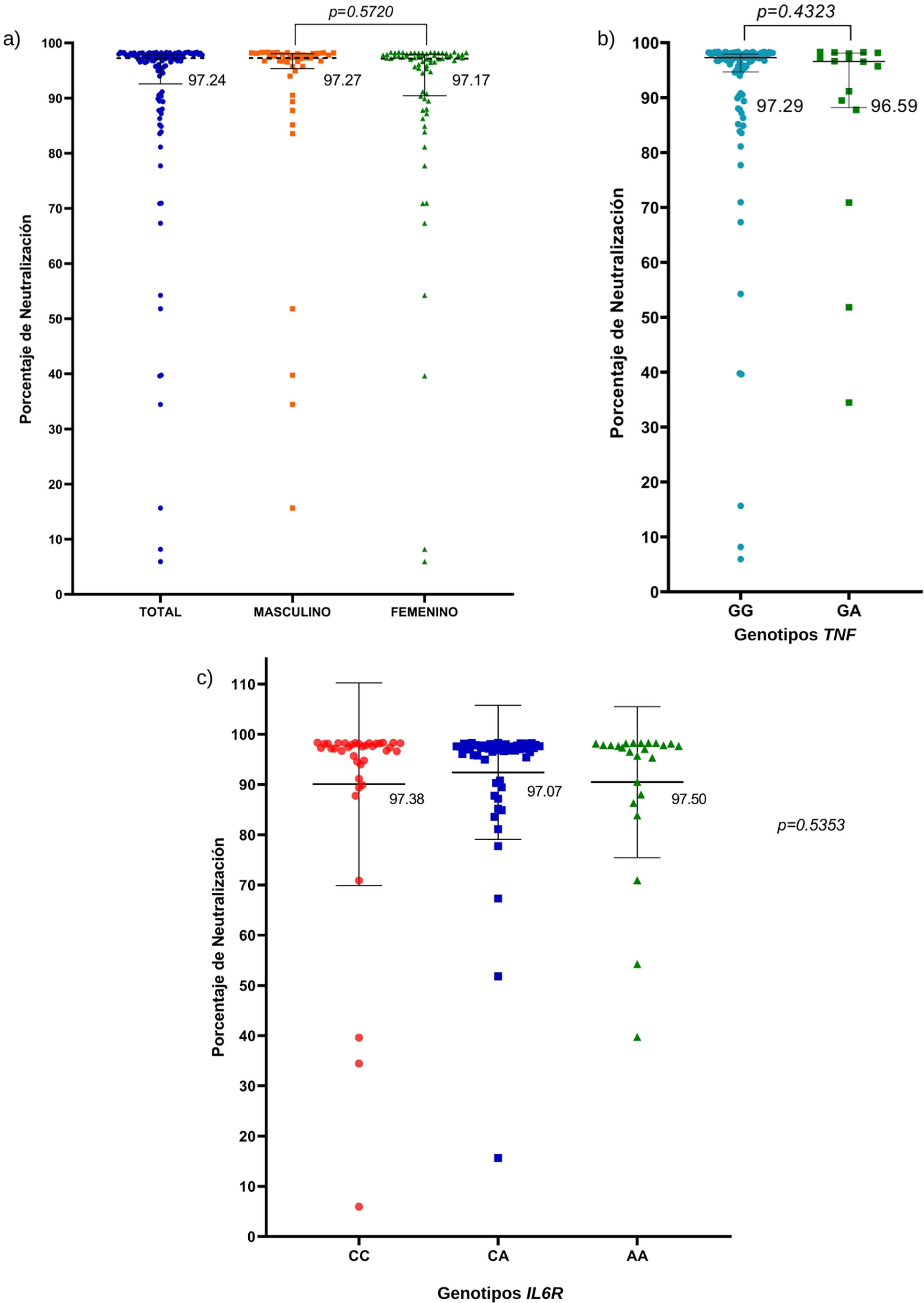
Los porcentajes de anticuerpos neutralizantes generados contra la proteína S del SARS-CoV-2 en población con el esquema AZD1222 con base en el sexo, se muestran en la figura 1A. No se encontraron diferencias significativas en los porcentajes de neutralización entre los grupos de estudio.
a) Porcentajes de neutralización contra la proteína espiga del SARS-CoV-2 con respecto al sexo; prueba U de Mann-Whitney. b) Porcentajes de neutralización contra la proteína S del SARS-CoV-2 con respecto a los genotipos de la variante rs1800629; prueba U de Mann-Whitney. c) Porcentajes de neutralización contra la proteína S del SARS-CoV-2 con respecto a los genotipos de la variante rs2228145; prueba Kruskal-Wallis. Las líneas horizontales representan mediana y rango intercuartil (P25%-P75%).
Se analizaron los porcentajes de neutralización contra la proteína S del SARS-CoV-2 con base en los genotipos de la variante rs1800629, estos fueron muy similares entre sí, por lo que no se encontraron diferencias significativas entre los genotipos de TNF (p = 0,4323) (fig. 1B). Considerando que la mayoría de participantes presentó porcentajes muy altos de anticuerpos neutralizantes posvacunación AZD1222 (superiores a 90% de neutralización), se realizó un subanálisis por genotipos en el gen de TNF, incluyendo únicamente a los participantes que presentaron porcentajes de anticuerpos menores a 90% de neutralización. Sin embargo, no se encontró relación significativa entre los porcentajes de neutralización menores a 90% con los genotipos de la variante rs1800629 (datos no mostrados).
Se realizó el análisis de los porcentajes de neutralización contra la proteína S del SARS-CoV-2 con base en los genotipos de la variante rs2228145; se obtuvo una mediana similar para los 3 genotipos, por lo que no se encontraron diferencias significativas con base en los genotipos de IL6R (fig. 1C).
Frecuencia de eventos supuestamente atribuibles a la vacunación e inmunización: asociación con el sexo y los genotipos de las variantes rs1800629 y rs2228145Los principales ESAVI reportados por los participantes se muestran en la tabla 3. Se encontró asociación entre el sexo con respecto a la adinamia (p = 0,0243), escalofríos (p = 0,0085), artralgia (p = 0,0227) y dolor en el área de aplicación (p = 0,0096); presentando mayor frecuencia en el grupo femenino. No se encontró asociación entre el sexo de los participantes con respecto al resto de ESAVI.
Principales eventos supuestamente atribuibles a la vacunación o inmunización tras la vacunación con AZD1222 por grupo de estudio con respecto al sexo
| ESAVI | Totaln = 117 | Masculinon = 45 | Femeninon = 72 | p |
|---|---|---|---|---|
| Generales, % (n) | ||||
| Fiebre | 44,4 (52) | 42,2 (19) | 45,8 (33) | 0,7021b |
| Cefalea | 59,8 (70) | 51,1 (23) | 65,3 (47) | 0,1283b |
| Astenia | 65,8 (77) | 60 (27) | 69,4 (50) | 0,2947b |
| Adinamia | 48,7 (57) | 35,6 (16) | 56,9 (41) | 0,0243b |
| Irritabilidad | 24,7 (29) | 17,8 (8) | 29,2 (21) | 0,1651b |
| Limitación del movimiento | 18,8 (22) | 20 (9) | 18,1 (13) | 0,7934b |
| Escalofríos | 48,7 (57) | 33,3 (15) | 58,3 (42) | 0,0085b |
| Mareo | 23 (27) | 20 (9) | 25 (18) | 0,5323b |
| Hiporexia | 15,3 (18) | 8,9 (4) | 19,4 (14) | 0,1874a |
| Edema | 3,4 (4) | 2,2 (1) | 4,2 (3) | NSa |
| Náusea | 14,5 (17) | 8,9 (4) | 18,1 (13) | 0,1917a |
| Vómito | 4,2 (5) | 2,2 (1) | 5,6 (4) | 0,6476a |
| Diarrea | 8,5 (10) | 2,2 (1) | 12,5 (9) | 0,0862a |
| Taquicardia | 6,8 (8) | 6,7 (3) | 6,9 (5) | NSa |
| Rinorrea | 10,2 (12) | 6,7 (3) | 12,5 (9) | 0,3664a |
| Tos | 9,4 (11) | 6,7 (3) | 11,1 (8) | 0,5270a |
| Mialgia | 46,1 (54) | 35,6 (16) | 52,8 (38) | 0,0691b |
| Artralgia | 32,4 (38) | 20 (9) | 40,3 (29) | 0,0227b |
| Reacción local | ||||
| Induración/nódulo | 15,3 (18) | 6,7 (3) | 20,8 (15) | 0,0629a |
| Dolor/sensibilidad | 67,5 (79) | 53,3 (24) | 76,4 (55) | 0,0096b |
| Eritema | 5,1 (6) | 4,4 (2) | 5,6 (4) | NSa |
| Edema | 13,6 (16) | 6,7 (3) | 18,1 (13) | 0,1010a |
| Aumento de temperatura | 22,2 (26) | 20 (9) | 23,6 (17) | 0,6476b |
ESAVI: eventos supuestamente atribuibles a la vacunación o inmunización.
Los datos se presentan como porcentaje y frecuencia absoluta % (n). Los valores significativos (p < 0,05) se resaltan en negrita.
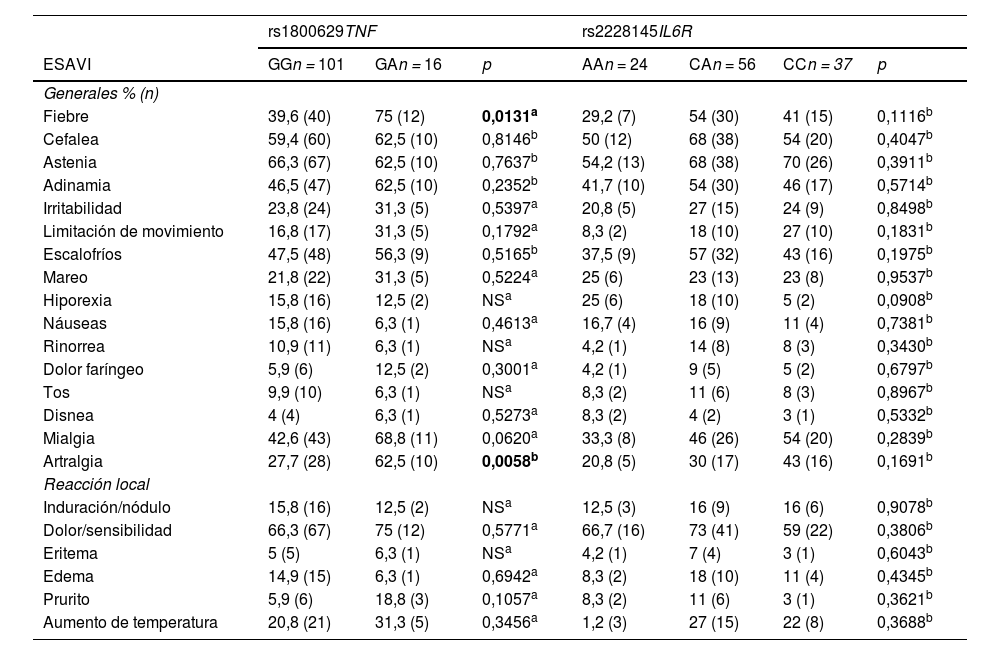
Los principales ESAVI con base en los genotipos de la variante rs1800629 del gen TNF y la variante rs2228145 del gen IL6R reportados por los participantes se muestran en la tabla 4. Se encontró asociación entre los genotipos de la variante rs1800629 con los ESAVI fiebre (p = 0,0131) y artralgia (p = 0,0058), siendo ambos más frecuentes en los participantes del grupo con el genotipo GA respecto al genotipo GG. No se encontró asociación de la variante rs1800629 de TNF con el resto de ESAVI. Con respecto a los genotipos de la variante rs2228145 en IL6R, no se encontró asociación con los ESAVI reportados por los participantes.
Principales eventos supuestamente atribuibles a la vacunación o inmunización tras la vacunación con AZD1222 con respecto a los genotipos de las variantes rs1800629 y rs2228145
| rs1800629TNF | rs2228145IL6R | ||||||
|---|---|---|---|---|---|---|---|
| ESAVI | GGn = 101 | GAn = 16 | p | AAn = 24 | CAn = 56 | CCn = 37 | p |
| Generales % (n) | |||||||
| Fiebre | 39,6 (40) | 75 (12) | 0,0131a | 29,2 (7) | 54 (30) | 41 (15) | 0,1116b |
| Cefalea | 59,4 (60) | 62,5 (10) | 0,8146b | 50 (12) | 68 (38) | 54 (20) | 0,4047b |
| Astenia | 66,3 (67) | 62,5 (10) | 0,7637b | 54,2 (13) | 68 (38) | 70 (26) | 0,3911b |
| Adinamia | 46,5 (47) | 62,5 (10) | 0,2352b | 41,7 (10) | 54 (30) | 46 (17) | 0,5714b |
| Irritabilidad | 23,8 (24) | 31,3 (5) | 0,5397a | 20,8 (5) | 27 (15) | 24 (9) | 0,8498b |
| Limitación de movimiento | 16,8 (17) | 31,3 (5) | 0,1792a | 8,3 (2) | 18 (10) | 27 (10) | 0,1831b |
| Escalofríos | 47,5 (48) | 56,3 (9) | 0,5165b | 37,5 (9) | 57 (32) | 43 (16) | 0,1975b |
| Mareo | 21,8 (22) | 31,3 (5) | 0,5224a | 25 (6) | 23 (13) | 23 (8) | 0,9537b |
| Hiporexia | 15,8 (16) | 12,5 (2) | NSa | 25 (6) | 18 (10) | 5 (2) | 0,0908b |
| Náuseas | 15,8 (16) | 6,3 (1) | 0,4613a | 16,7 (4) | 16 (9) | 11 (4) | 0,7381b |
| Rinorrea | 10,9 (11) | 6,3 (1) | NSa | 4,2 (1) | 14 (8) | 8 (3) | 0,3430b |
| Dolor faríngeo | 5,9 (6) | 12,5 (2) | 0,3001a | 4,2 (1) | 9 (5) | 5 (2) | 0,6797b |
| Tos | 9,9 (10) | 6,3 (1) | NSa | 8,3 (2) | 11 (6) | 8 (3) | 0,8967b |
| Disnea | 4 (4) | 6,3 (1) | 0,5273a | 8,3 (2) | 4 (2) | 3 (1) | 0,5332b |
| Mialgia | 42,6 (43) | 68,8 (11) | 0,0620a | 33,3 (8) | 46 (26) | 54 (20) | 0,2839b |
| Artralgia | 27,7 (28) | 62,5 (10) | 0,0058b | 20,8 (5) | 30 (17) | 43 (16) | 0,1691b |
| Reacción local | |||||||
| Induración/nódulo | 15,8 (16) | 12,5 (2) | NSa | 12,5 (3) | 16 (9) | 16 (6) | 0,9078b |
| Dolor/sensibilidad | 66,3 (67) | 75 (12) | 0,5771a | 66,7 (16) | 73 (41) | 59 (22) | 0,3806b |
| Eritema | 5 (5) | 6,3 (1) | NSa | 4,2 (1) | 7 (4) | 3 (1) | 0,6043b |
| Edema | 14,9 (15) | 6,3 (1) | 0,6942a | 8,3 (2) | 18 (10) | 11 (4) | 0,4345b |
| Prurito | 5,9 (6) | 18,8 (3) | 0,1057a | 8,3 (2) | 11 (6) | 3 (1) | 0,3621b |
| Aumento de temperatura | 20,8 (21) | 31,3 (5) | 0,3456a | 1,2 (3) | 27 (15) | 22 (8) | 0,3688b |
Los datos se presentan como porcentaje (%) y frecuencia absoluta. Los valores significativos (p < 0,05) se resaltan en negrita.
En este estudio se evaluó por primera vez la asociación de las variantes rs1800629 en TNF y rs2228145 en IL6R con la producción de anticuerpos neutralizantes contra SARS-CoV-2 y la frecuencia de ESAVI en la población adulta del occidente de México con esquema de vacunación AZD1222.
Respecto a las frecuencias genotípicas y alélicas de las variantes rs1800629 en el gen de TNF y rs2228145 en IL6R, la distribución coincide con lo previamente reportado en la población mexicana18,19. Con respecto a los porcentajes de anticuerpos neutralizantes, Chau et al. (2022) determinaron que los niveles de anticuerpos neutralizantes contra SARS-CoV-2 se mantuvieron similares entre los hombres y las mujeres20. Además, se ha reportado que no existe una diferencia entre los niveles de anticuerpos neutralizantes en individuos vacunados respecto a aquellos que los generaron postinfección y que dicha respuesta tampoco se asocia con el sexo de los participantes21. Por lo anterior, nuestros resultados coinciden con investigaciones previas, pero es importante destacar que el promedio de días (36) posvacunación de nuestros participantes fue relativamente corto y eso puede explicar los altos porcentajes de anticuerpos neutralizantes detectados contra la proteína S del SARS-CoV-2 (>90%). Se reconoce que la producción de anticuerpos neutralizantes contra SARS-CoV-2, ya sea por infección natural o tras la vacunación con AZD1221, tiende a disminuir con el tiempo.
No encontramos una asociación entre la producción de anticuerpos neutralizantes posvacunación AZD1222 con las 2 variantes genéticas evaluadas. Respecto a la variante rs1800629 en TNF no existe literatura que haya evaluado esta relación; sin embargo, Yao et al. (2020) no encontraron una asociación entre la variante rs1800629 y la producción de anticuerpos tras la inmunización con la vacuna contra la encefalitis japonesa15. Otro estudio reportó una asociación entre el promedio de anticuerpos y la presencia de la variante rs1800629 tras recibir la vacuna contra la hepatitis B14. Caso contrario, otros autores no han reportado una asociación entre la variante rs1800629 y los bajos niveles de anticuerpos en los individuos inmunizados con la vacuna contra la hepatitis B22,23. Respecto a la variante rs2228145 en IL6R, no existen publicaciones que evalúen su asociación con la producción de anticuerpos neutralizantes tras la inmunización con AZD1222, sin embargo, una investigación en población iraní, evaluó la asociación entre la variante rs2228145 con la susceptibilidad de desarrollar COVID-19, mostrando que los participantes que portan el alelo A en IL6R son más susceptibles a desarrollar COVID-1924.
En nuestro estudio, el grupo vacunado con AZD1222 de sexo femenino presentó una mayor frecuencia de todos los ESAVI, con excepción de la limitación de movimiento. La evidencia sugiere que las diferencias inmunológicas, hormonales, genéticas e incluso de microbiota intestinal con base en el sexo pueden modular la actividad del sistema inmunitario, pudiendo influir en el resultado de la respuesta ante la vacunación25. Además, se demostró que, tras la inmunización contra los virus de la influenza, parotiditis, hepatitis A y B, viruela y dengue, las mujeres desarrollan reacciones adversas más frecuentes y graves, como fiebre, dolor e inflamación a las vacunas25,26. Tran et al. (2021), determinaron que los ESAVI más frecuentes en los individuos inmunizados con AZD1222 fueron fiebre, mialgia, fatiga, dolor en la zona de aplicación y escalofríos. De forma similar a nuestro estudio, encontraron que el grupo femenino presentó ESAVI con mayor frecuencia en comparación con el grupo masculino27. Otro estudio, no reportó asociación entre la frecuencia de ESAVI con el sexo tras la aplicación de la primera dosis de AZD122228; sin embargo, cabe destacar que los participantes de nuestra investigación contaban con 2 dosis de AZD1222.
Al analizar la relación entre las variantes genéticas en TNF e IL6R con la frecuencia de ESAVI tras recibir la vacuna AZD1222, se encontró que el genotipo GA de la variante rs1800629 en TNF se asoció con mayor frecuencia de fiebre y artralgia posvacunación y se observó una tendencia a presentar mialgia con mayor frecuencia en los participantes portadores de este genotipo. No existen reportes previos sobre esta asociación, sin embargo, al considerar que TNF-α es una citoquina proinflamatoria, la asociación con estos síntomas podría deberse a los efectos fisiológicos inducidos por esta y posiblemente, una mayor expresión y producción de TNF-α en los portadores del genotipo GA. Se reconoce que esta citoquina tiene efectos fisiológicos vinculados al dolor y al aumento de temperatura29. Algunas citoquinas cuentan con la capacidad de inducir la síntesis de prostaglandina en los tejidos periféricos, lo que podría explicar por qué esta sintomatología suele acompañarse del desarrollo de mialgia y artralgia30. Con respecto al efecto de esta variante genética en la expresión de la citoquina, se ha reportado que la variante rs1800629 puede aumentar los niveles de expresión del gen TNF31; sin embargo, la evidencia disponible es controversial32, por lo que es importante confirmar experimentalmente el efecto biológico o funcional de esta variante.
Dentro de las limitaciones de esta investigación se encuentra el tamaño de la muestra, por lo cual recomendamos replicar el estudio en otras poblaciones y con un tamaño de muestra mayor; considerar otras características sociodemográficas o antropométricas de la población y su relación con los porcentajes de neutralización; así como tomar en cuenta los días posvacunación y cuantificar los niveles séricos de TNF-α e IL-6R soluble para determinar si estos presentan algún cambio posterior a la inmunización y si se asocian con la presencia de ESAVI.
En conclusión, nuestro estudio confirma un alto porcentaje de anticuerpos neutralizantes generados contra la proteína S del SARS-CoV-2 en los individuos que recibieron la vacuna AZD1222 con un promedio de 36 (22-58) días posvacunación. Los ESAVI adinamia, escalofríos, artralgia y dolor en el área de aplicación tuvieron una incidencia mayor en el grupo femenino, pero solamente fiebre y artralgia mostraron una asociación con la variante rs1800629 en TNF en esta población mexicana.
Responsabilidades éticasLa presente investigación fue aprobada por el Comité de Ética del Centro Universitario del Sur de la Universidad de Guadalajara, con código de registro: CEI/046/2021 y el Comité Técnico de Investigación, con código de registro: SAC/CIP/019/2021. Además, se siguieron los principios establecidos en la declaración de Helsinki.
Consentimiento informadoLos individuos en el presente estudio participaron de forma voluntaria y firmaron la carta de consentimiento informado.
FinanciaciónEste proyecto fue financiado por el Centro Universitario del Sur de la Universidad de Guadalajara, bajo la Convocatoria de Fortalecimiento de Cuerpos Académicos, registro: SAC/CIP/019/2021 otorgado a Zyanya Reyes-Castillo.
Conflicto de interesesNinguno.