Purificar la proteína L1 del virus del papiloma humano16 (VPH-16) codificada por un gen L1 clonado de una muestra de cáncer cervical de una paciente cubana y fusionada por su extremo carboxilo a una cola de histidinas (L1-His), a partir de Escherichia coli SHuffle® T7.
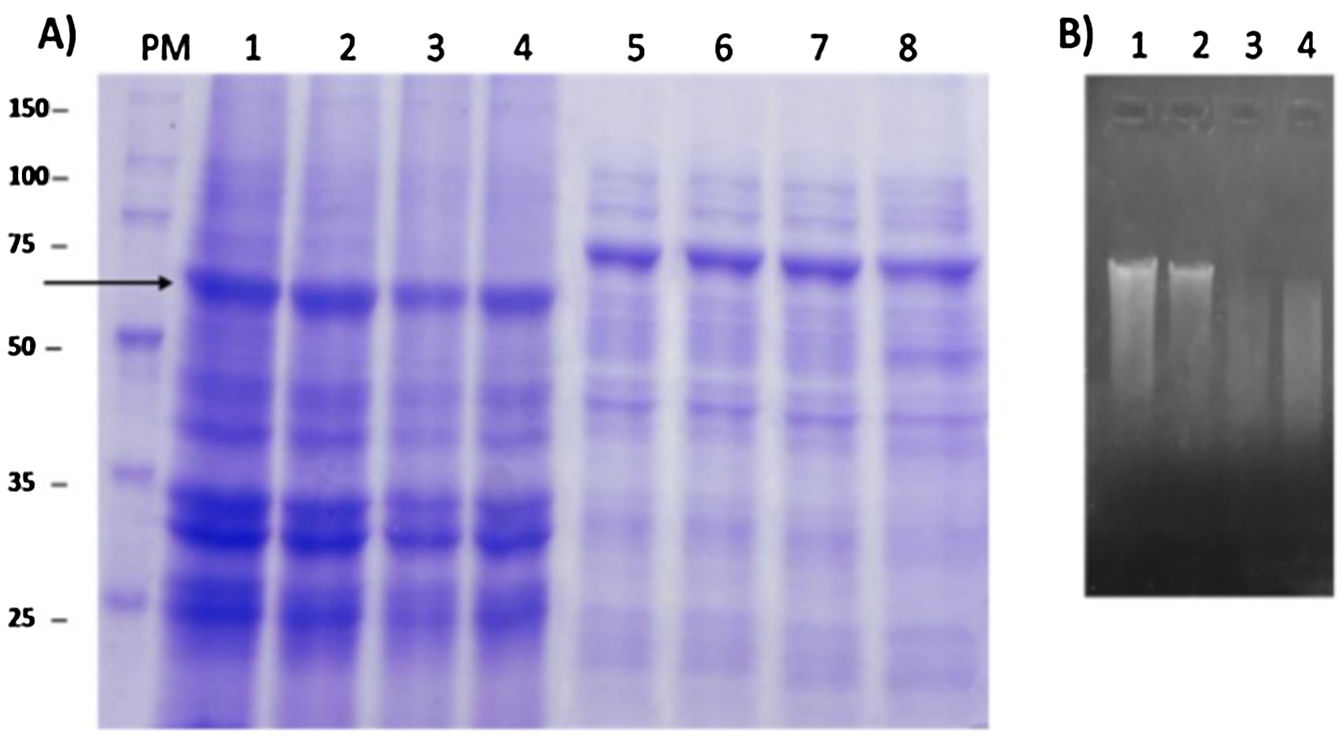
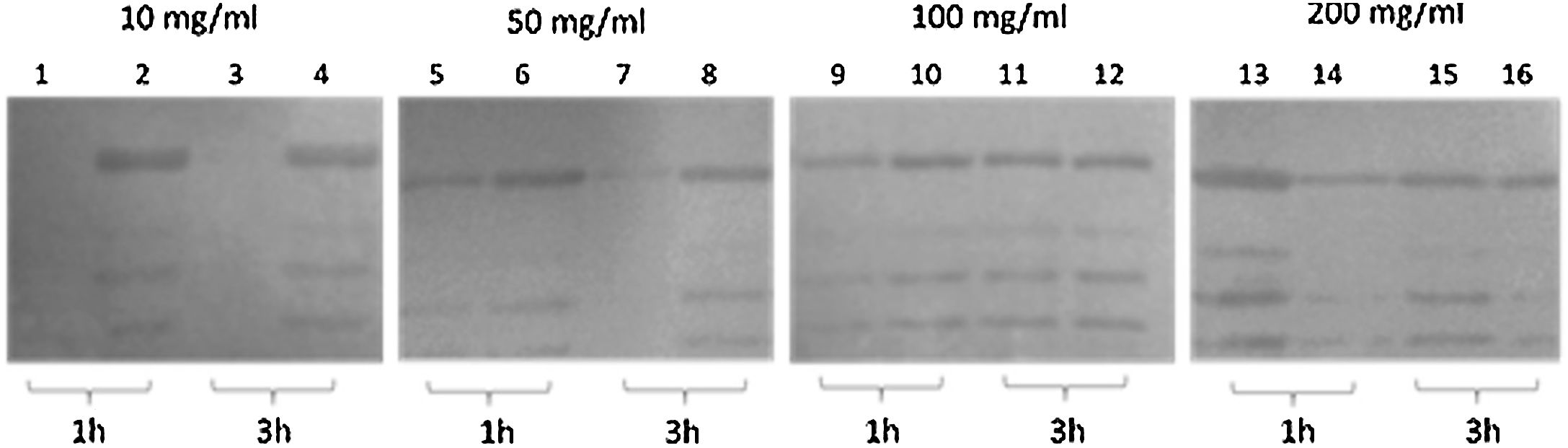
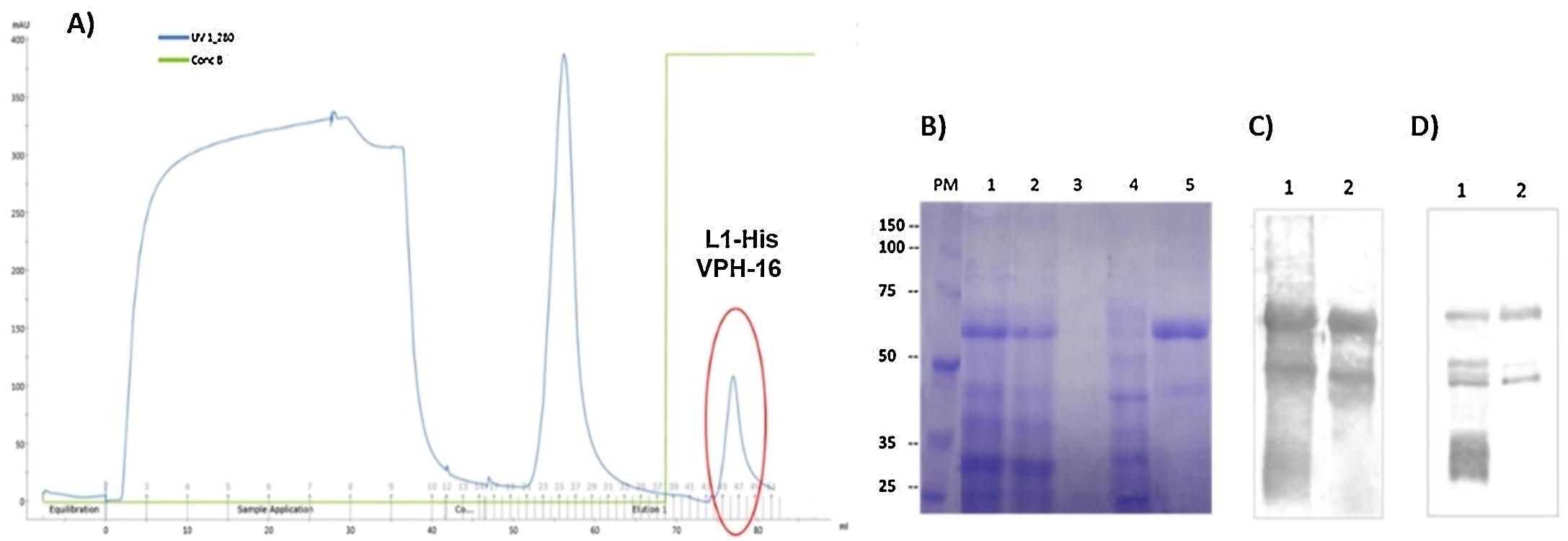
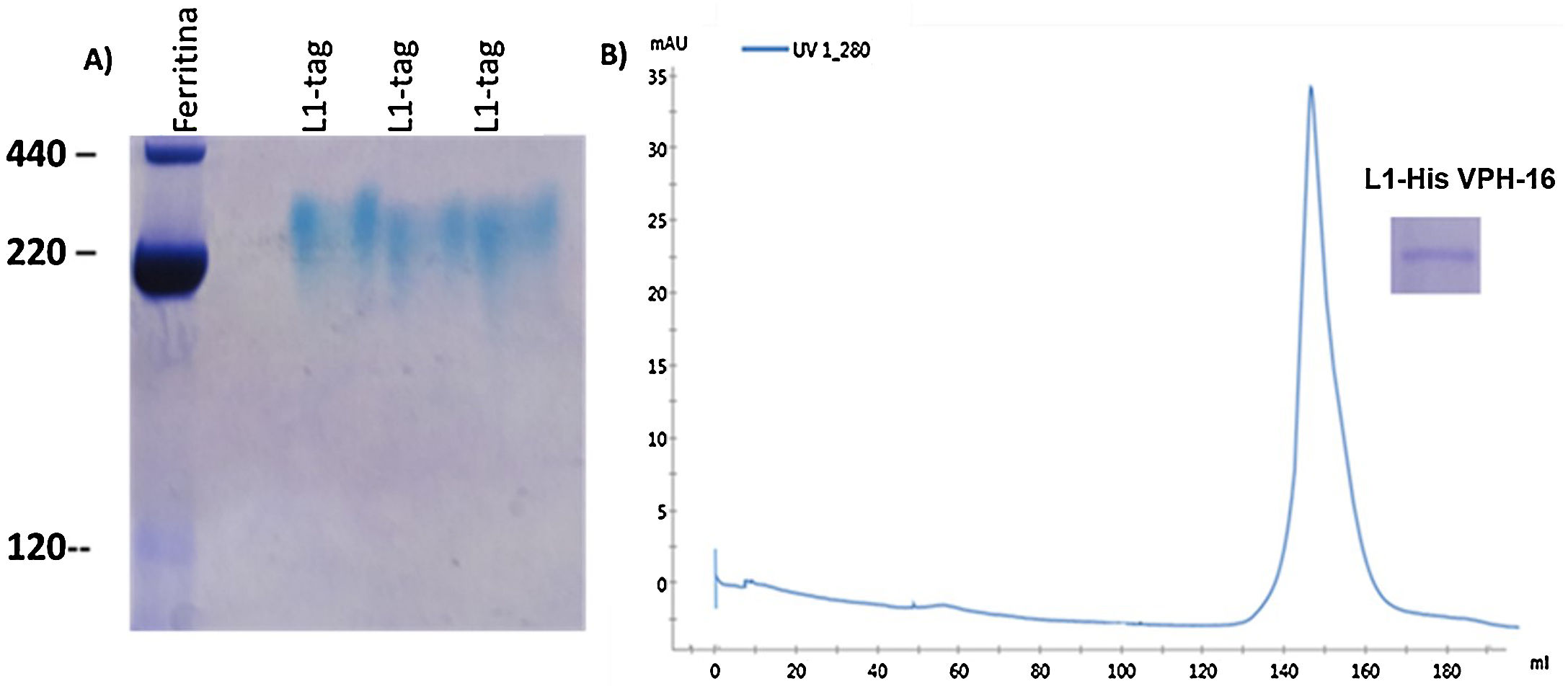
MétodosLa cepa E.coli SHuffle® T7 transformada con el plásmido pETHPV16L1myc-His se empleó para producir la proteína L1-His del VPH-16 cultivada en condiciones de autoinducción. La proteína L1-His se purificó mediante cromatografía de afinidad de quelatos de iones Ni2+ (IMAC-Ni2+) tras extracción de los cuerpos de inclusión (CI) con urea 8M y posterior renaturalización por dilución inversa. La talla molecular de la proteína L1-His renaturalizada se evaluó mediante electroforesis nativa y cromatografía de exclusión molecular.
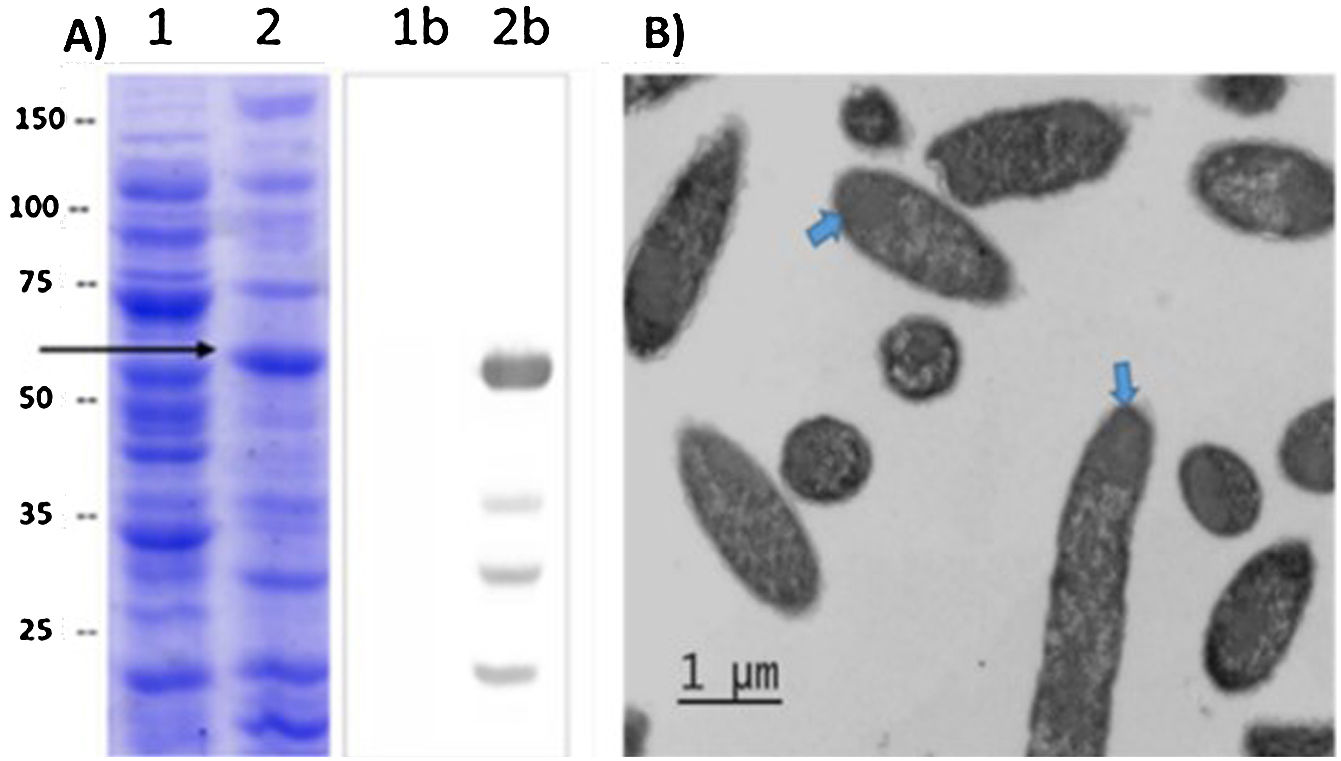
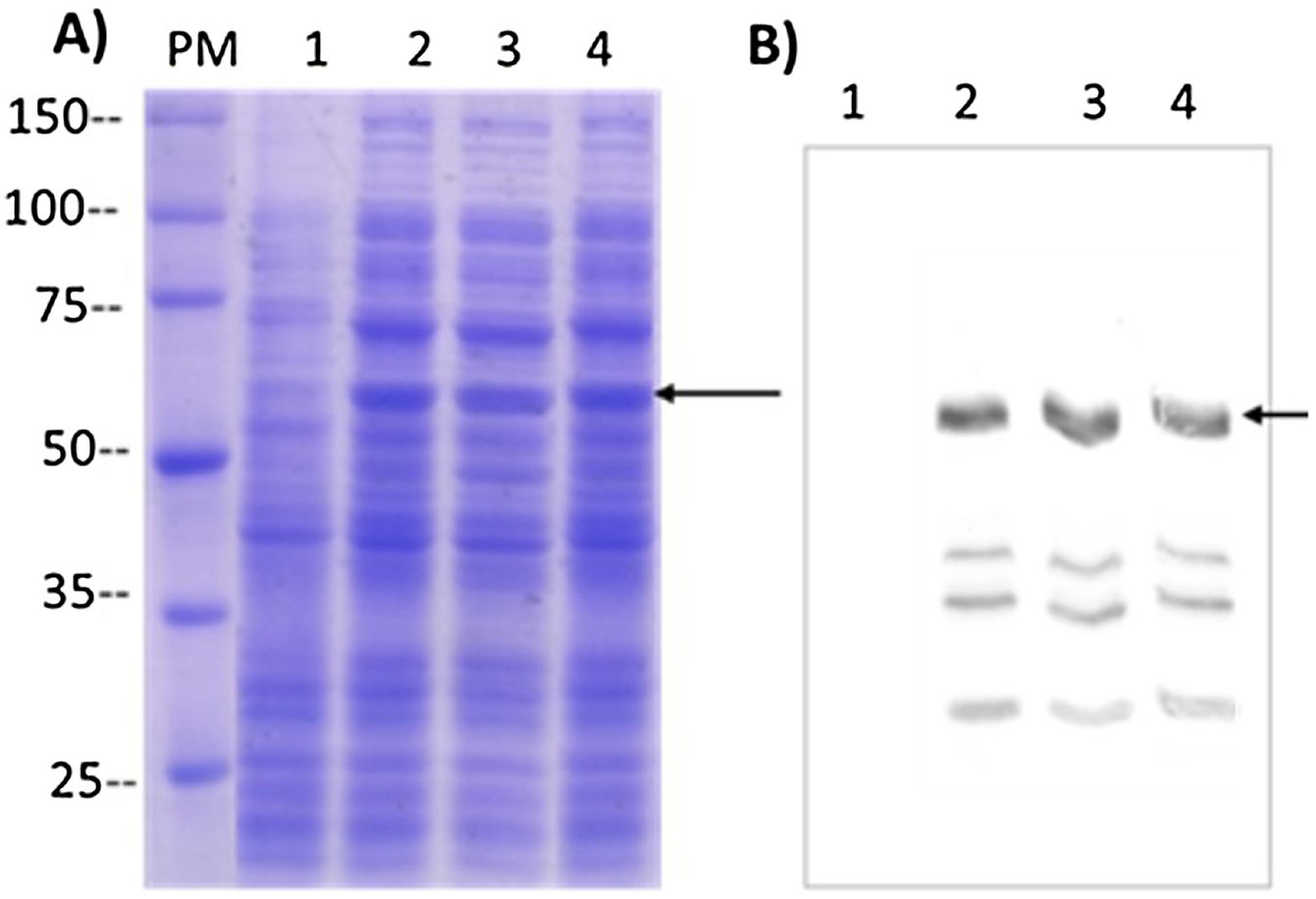
ResultadosLa proteína L1-His del VPH-16 se acumuló en CI en E.coli SHuffle® T7, representando ∼12% de las proteínas totales. Se purificó mediante IMAC-Ni2+ en condiciones desnaturalizantes, con una pureza de ∼90% y un rendimiento de ∼40%. La renaturalización de la L1-His purificada permitió obtener ∼9mg de pentámeros/L de cultivo, con un rendimiento final del proceso de ∼62%.
ConclusionesEn este trabajo se describió por primera vez la purificación de pentámeros de la proteína L1-His del VPH-16, codificada por un gen L1 clonado de una muestra de cáncer cervical de una paciente cubana, a partir de los CI de E.coli SHuffle® T7. La estrategia desarrollada podría ser una alternativa para la obtención de capsómeros de L1-His, para desarrollar un candidato vacunal contra el VPH-16.
To purify the human papillomavirus 16 (HPV-16) L1 protein encoded by a cloned L1 gene from a sample of cervical cancer from a Cuban patient and fused to a histidine tag at its carboxyl end (L1-His) from E.coli SHuffle® T7.
MethodsThe strain E.coli SHuffle® T7 with the plasmid pETHPV16L1myc-His was used to obtain the HPV-16 L1-His protein, grown under autoinduction conditions. L1-His protein was purified by Ni2+ ion-chelated affinity chromatography (Ni2+-IMAC), after extraction of the inclusion bodies (IB) with 8M urea and subsequent refolding by an inverse dilution method. The molecular size of the refolded HPV-16 L1-His protein was analyzed by native polyacrilamide gel electrophoresis and molecular exclusion chromatography.
ResultsThe HPV-16 L1-His protein accumulated in IB in E.coli SHuffle® T7 and represented ∼12% of total proteins. After its extraction with 8M urea from IB was purified by Ni2+-IMAC, with an ∼90% purity and an ∼40% yield. Renaturation of purified L1-His allowed obtaining ∼9mg of pentamers/L of culture, with a final recovery of ∼62%.
ConclusionsFor the first time it was described the purification of pentamers of HPV-16 L1-His protein encoded by a cloned L1 gene from a Cuban patient from E.coli SHuffle® T7's IB. The developed strategy could be an alternative for obtaining L1-His protein capsomers for developing a vaccine candidate against HPV-16.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora