La obesidad está estrechamente relacionada con la resistencia a la insulina (RI), pero se valora de forma dispar en las diversas definiciones de síndrome metabólico. El objetivo del estudio fue comprobar la utilidad de distintas mediciones antropométricas para predecir RI y valorar los mejores puntos de corte.
Sujetos y métodoEstudio transversal sobre población de 40 a 70 años (2.143 habitantes); se obtuvo una muestra aleatoria simple de 305 pacientes no diabéticos. Se recogieron variables sociodemográficas, exploración y analítica habituales más insulinemia. Se consideró RI un índice de HOMA (homeostasis model assessment)≥2,9. Se practicó una regresión logística por pasos hacia delante para obtener las mejores variables para predecir RI; después se construyó una ecuación logística y se comparó el área bajo la curva ROC (receiver operating characteristic) de ésta y de las distintas variables antropométricas en su capacidad de predicción, y los mejores puntos de corte según el índice de Youden.
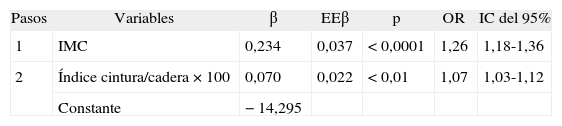
ResultadosHan entrado en el modelo el índice de masa corporal (IMC) y la razón cintura/cadera ×100. No han entrado la edad, el sexo, la cintura, la cadera y la superficie corporal. La ecuación logística hallada: p(RI)=1/1 + exp {−[−14,295]−[0,234×IMC] − [0,07×(cintura/cadera×100)]} mostró un buen ajuste, y la probabilidad calculada por ella presenta la mayor área en general y para cada sexo, seguida en mujeres por el IMC y en varones por la cintura, pero sin diferencias significativas.
ConclusionesNo se ha encontrado diferencias significativas ente IMC, cintura, cadera y un modelo logístico para predecir la RI.
Obesity is closely related to insulin-resistance (IR) but it is evaluated differently in the diverse definitions of the metabolic syndrome. The objective of this study was to verify the utility of different anthropometric measures to predict IR and to evaluate the best cut-off points.
Subjects and methodWe performed a cross-sectional study of the general population aged 40 to 70 years old (n=2,143); a simple random sample of 305 non-diabetic persons was obtained. Sociodemographic data, physical examination and routine biochemical analysis with insulinemia were obtained. IR was defined by a HOMA index (Homeostasis Model Assessment) ≥2.9. To obtain the best variables to predict IR, a forward stepwise logistic regression was performed. Subsequently, a logistic equation was constructed and its predictive capacity was compared with the different anthropometric variables by the area under the ROC (receiver-operating characteristic) curve (AUC). The best cut-off points were established according to the Youden index.
ResultsBody mass index (BMI) and the waist/hip ratio ×100 were entered into the model, but age, sex, waist, hip and body surface were not. The logistic equation found: p(RI)=1/1+exp{−[−14.295]−[0.234×IMC]−[0.07×(waist/hip×100)]} showed good adjustment, and the probability calculated on the basis of this equation showed the greatest AUC overall and in both sexes, followed in women by BMI and by waist measurement in men, but without significant differences.
ConclusionsNo significant differences were found between the BMI, waist or hip measurements and the logistic model to predict IR.
Los factores de riesgo cardiovascular se presentan combinados en ciertos individuos. Esta agregación se conoce desde hace mucho tiempo y ha recibido diversos nombres: síndrome X1, cuarteto de la muerte2, síndrome de resistencia a la insulina (RI)3 y síndrome metabólico (SM)4,5. Aunque no está claro que exista un único factor subyacente4,5, una de las teorías sostiene que la RI es la causa esencial del SM6. No hay duda de que la RI predispone a la diabetes mellitus tipo 27 y también han sido propuestas múltiples vías metabólicas que relacionan la RI y la hiperinsulinemia compensatoria con los otros factores de riesgo (FR) del SM8. En 1998, la Organización Mundial de la Salud (OMS) introdujo la primera definición clínica de SM9. Esta definición requería la evidencia de RI para su diagnóstico. El European Group for Study of Insulin Resistance (EGIR)10 (1999) utilizaba el término de síndrome de RI en lugar de SM, requería también la presencia de RI para el diagnóstico. En el año 2001, el Adult Treatment Panel III of The National Cholesterol Education Program (ATP-III)11 introdujo unos criterios totalmente clínicos para definir SM, sin necesidad del diagnóstico previo de RI. La American Association of Clinical Endocrinologists (AACE)12 en 2003 volvió a modificar los criterios, y se requiere, como condición previa al diagnóstico de SM, que haya glucemia basal alterada (GBA) (100-125 mg/dl después del ayuno nocturno) o una alteración de la tolerancia a la glucosa (ATG) (glucemia de 140-199 mg/dl 2 h después de haberse realizado una prueba oral de tolerancia a la glucosa). En el año 2005, la International Diabetes Federation (IDF)13 publicó nuevos criterios de síndrome metabólico que otra vez modificaban los criterios de la ATP-III. Consideraron que la obesidad abdominal es requisito para el diagnóstico junto con otros dos de los criterios originales de SM según ATP-III y que no eran precisas otras determinaciones más complejas para el diagnóstico de RI. El IDF reconoció diferencias étnicas en la relación entre la obesidad abdominal y los otros factores de riesgo del SM. Por esta razón, los criterios de obesidad abdominal fueron especificados por nacionalidad o etnia. El mismo año, la American Heart Association/National Heart Lung and Blood Institute (AHA/NHLBI)5 recomendaban con ligeras modificaciones los criterios ATP-III (tabla 1). En un intento de contestar a la pregunta de si existen diferencias entre las distintas variables antropométricas para predecir RI, nos planteamos como objetivos de nuestro estudio: a) conocer cuál de las variables antropométricas define mejor la RI, y b) comparar los distintos criterios antropométricos de las diversas definiciones de SM en su capacidad de predecir RI.
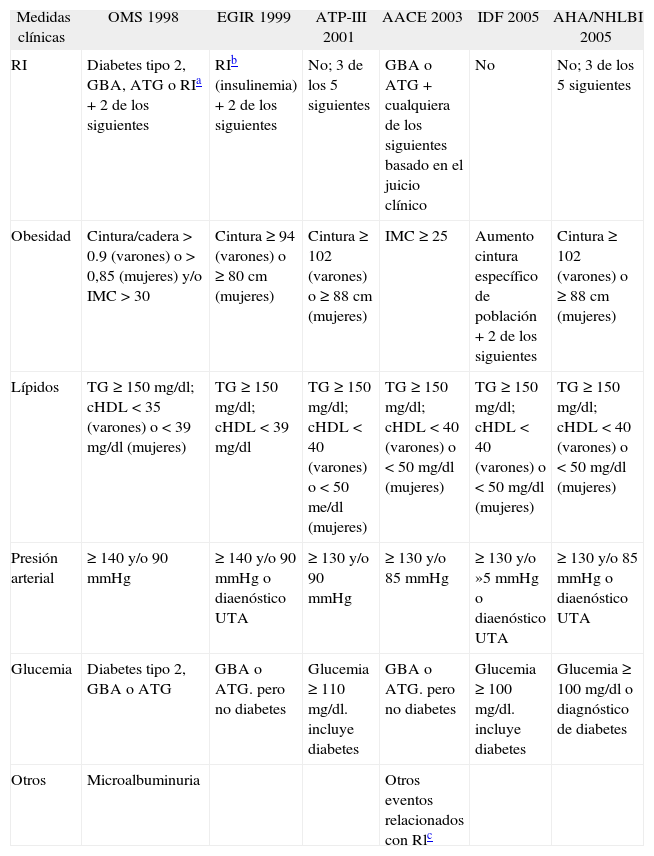
Criterios utilizados en las distintas definiciones de síndrome metabólico
| Medidas clínicas | OMS 1998 | EGIR 1999 | ATP-III 2001 | AACE 2003 | IDF 2005 | AHA/NHLBI 2005 |
| RI | Diabetes tipo 2, GBA, ATG o RIa + 2 de los siguientes | RIb (insulinemia) + 2 de los siguientes | No; 3 de los 5 siguientes | GBA o ATG + cualquiera de los siguientes basado en el juicio clínico | No | No; 3 de los 5 siguientes |
| Obesidad | Cintura/cadera > 0.9 (varones) o > 0,85 (mujeres) y/o IMC > 30 | Cintura ≥ 94 (varones) o ≥ 80 cm (mujeres) | Cintura ≥ 102 (varones) o ≥ 88 cm (mujeres) | IMC ≥ 25 | Aumento cintura específico de población + 2 de los siguientes | Cintura ≥ 102 (varones) o ≥ 88 cm (mujeres) |
| Lípidos | TG ≥ 150 mg/dl; cHDL < 35 (varones) o < 39 mg/dl (mujeres) | TG ≥ 150 mg/dl; cHDL < 39 mg/dl | TG ≥ 150 mg/dl; cHDL < 40 (varones) o < 50 me/dl (mujeres) | TG ≥ 150 mg/dl; cHDL < 40 (varones) o < 50 mg/dl (mujeres) | TG ≥ 150 mg/dl; cHDL < 40 (varones) o < 50 mg/dl (mujeres) | TG ≥ 150 mg/dl; cHDL < 40 (varones) o < 50 mg/dl (mujeres) |
| Presión arterial | ≥ 140 y/o 90 mmHg | ≥ 140 y/o 90 mmHg o diaenóstico UTA | ≥ 130 y/o 90 mmHg | ≥ 130 y/o 85 mmHg | ≥ 130 y/o »5 mmHg o diaenóstico UTA | ≥ 130 y/o 85 mmHg o diaenóstico UTA |
| Glucemia | Diabetes tipo 2, GBA o ATG | GBA o ATG. pero no diabetes | Glucemia ≥ 110 mg/dl. incluye diabetes | GBA o ATG. pero no diabetes | Glucemia ≥ 100 mg/dl. incluye diabetes | Glucemia ≥ 100 mg/dl o diagnóstico de diabetes |
| Otros | Microalbuminuria | Otros eventos relacionados con Rlc |
AACE: American Association of Clinical Endocrinologists; AHA/NHLBI: American Heart Association/National Heart Lung and Blood Institute; ATG: alteración de la tolerancia a la glucosa; ATP-III: Adult Treatment Panel III del National Cholesterol Education Program; cHDL: colesterol ligado a lipoproteínas de alta densidad; EGIR: European Group for Study of Insulin Resistance; GBA: glucemia basal alterada (glucemia de 100-125 mg/dl después del ayuno nocturno); HTA: hipertensión arterial; IDF: International Diabetes Federation; IMC: índice de masa corporal; OMS: Organización Mundial de la Salud; RI: resistencia a la insulina; TG: triglicéridos.
Estudio descriptivo transversal, realizado en el ámbito de atención primaria, sobre la población de 40 a 75 años de ambos sexos adscrita al Consultorio de Colloto (Oviedo, Asturias) (2.143 habitantes). Para una prevalencia estimada del SM de un 23%, con un intervalo de confianza (IC) del 95%, un margen de error del 4% y estimando unas pérdidas del 15%, se calculó una muestra representativa de esta población (407 pacientes), que se extrajo de modo aleatorio simple a partir del listado completo de las tarjetas sanitarias asignadas. Se excluyó a los enfermos inmovilizados y terminales, y a aquellos que residieran fuera de la zona básica de salud, y se consideró pérdidas a los que no se pudo localizar o no aceptaron participar en el estudio. De los 360 pacientes que se pudo localizar, 358 aceptaron ser incluidos en el estudio. De ellos, se excluyó luego a 39 (10,9%) con diabetes mellitus y 14 (3,9%) con intolerancia a la glucosa. Se concertó una entrevista con cada paciente en la que se recogieron los siguientes datos: edad, sexo, hábitos tóxicos, antecedentes familiares de muerte súbita precoz y de cardiopatía isquémica precoz (en familiares de primer grado, varones menores de 55 años o mujeres menores de 65 años), factores de riesgo cardiovascular (hipertensión arterial [HTA], diabetes mellitus, intolerancia a la glucosa y dislipemia). Se midió el peso y la talla y se calculó el índice de masa corporal (IMC = peso en kg/cuadrado de la talla en metros) y de obesidad abdominal (determinación de las circunferencias de cintura y cadera según las recomendaciones de Seidell14). La circunferencia de la cintura medida en la línea media entre el margen costal inferior y la cresta ilíaca (espina ilíaca anterosuperior) en bipedestación y la circunferencia de la cadera fue la mayor circunferencia sobre las nalgas a nivel de los trocánteres mayores. La presión arterial se determinó en sedestación, utilizando un tensiómetro automático validado (OMRON 705 CP); se realizaron 3 determinaciones, separadas entre sí 2 min; se adoptó como presión arterial final la media de las dos últimas y se desechó la primera. Se realizó una determinación analítica en sangre tras 12 h de ayuno, que incluyó: glucosa, urea, creatinina, ácido úrico, triglicéridos, colesterol total, colesterol ligado a lipoproteínas de alta densidad (cHDL) y colesterol ligado a lipoproteínas de baja densidad (cLDL). Se realizó a todos los pacientes una determinación de insulinemia basal en suero por el método de inmunoquimioluminiscencia DPC Immulite (Los Angeles, California, Estados Unidos), calibrado respecto al estándar internacional WHO IRP 66/304. En cada caso se calculó el índice de insulinorresistencia según HOMA (homeostasis model assessment) como expresión de RI según la fórmula de Matthews et al15: HOMA = [insulina (μU/ml) × glucemia (mmol/l)]/22,5. Se consideró RI según la definición de la OMS: cifra de HOMA que separa el cuartil superior del total de los pacientes no diabéticos ni intolerantes a la glucosa (HOMA = 2,9)9,16. Se definió cómo los individuos cumplían los criterios diagnósticos antropométricos para las distintas definiciones de SM: OMS9,16, EGIR10, ATP-III11, AACE12, IDF13 y AHA/NHLBI5 (fig. 1) y del trabajo de Wahrenberg et al17.
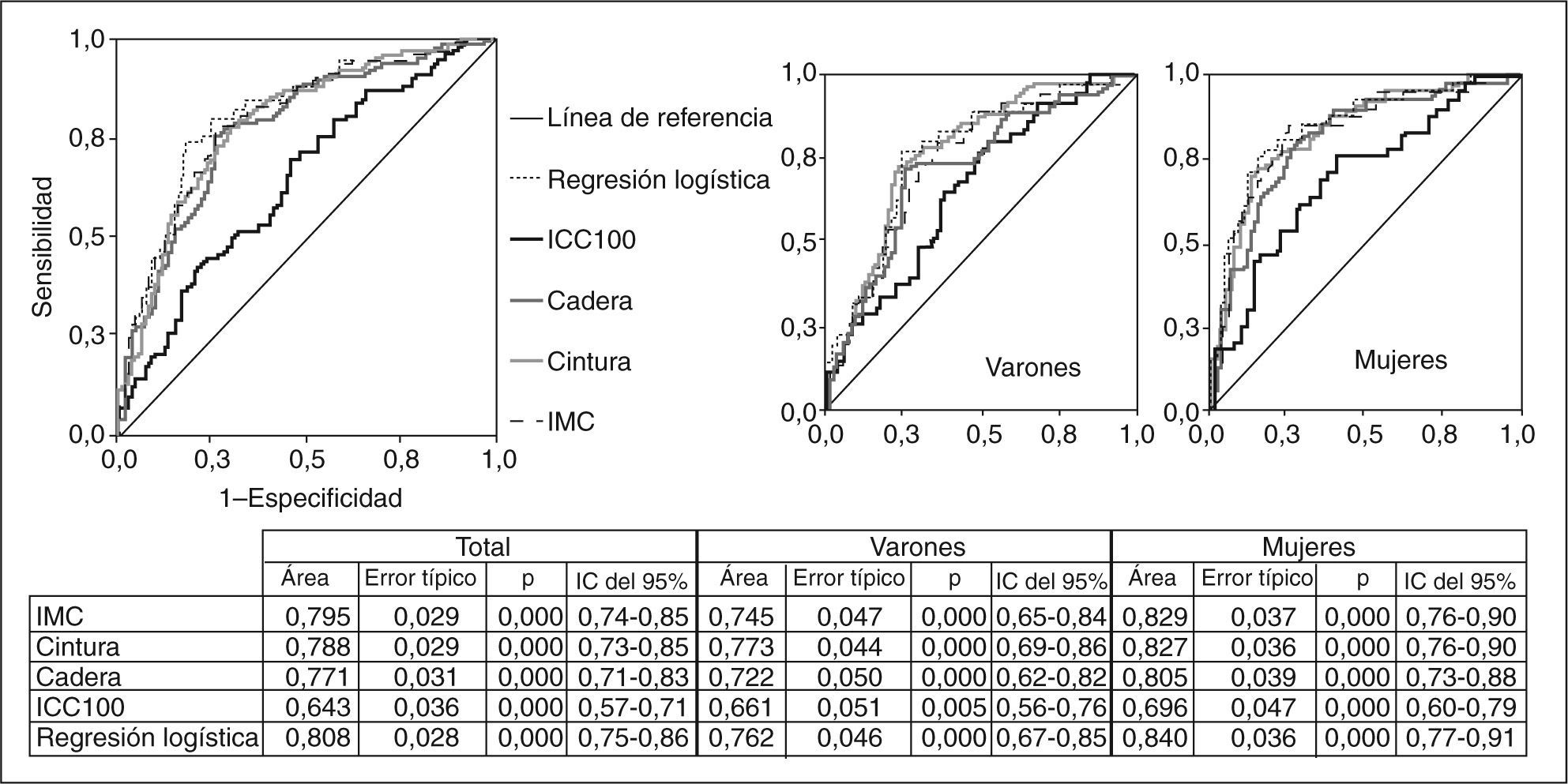
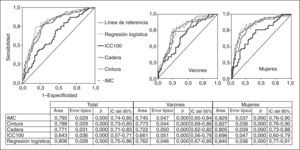
Comparación de las curvas ROC de las mediciones antropométricas con respecto a la resistencia a la insulina, en general y por sexos. No hubo diferencias significativas entre IMC, cintura, cadera y la probabilidad calculada de la regresión logística. IC: intervalo de confianza; ICC100: índice cintura (cm)/cadera (cm) × 100; IMC: índice de masa corporal.
Se calcularon las medias y desviaciones estándar de las variables cuantitativas y los porcentajes de las cualitativas. Para el cálculo de los intervalos de confianza (IC) del 95% de una proporción, se utilizó la aproximación cuadrática de Fleiss18. Para comparar variables cuantitativas, se utilizó el coeficiente de correlación. Para comparar medias, se empleó la prueba de la t de Student. Para valorar la asociación de variables cualitativas, se utilizó el test de la χ2. Para controlar interacciones y factores de confusión y como modelo predictivo se utilizó la regresión logística, siendo la variable dependiente RI y las independientes, las que presentaron p < 0,05 en el análisis bivariable o tienen especial relevancia epidemiológica (edad y sexo). Para buscar el modelo más parsimonioso, se eligió el método por pasos hacia adelante. Como test de bondad de ajuste de la regresión logística, se utilizó la prueba de Hosmer-Lemeshow. En el modelo de regresión logística se guardó para cada individuo el valor pronosticado por el modelo (entre 0 y 1). Para valorar en general la capacidad de las distintas medidas antropométricas para predecir RI, se utilizaron las curvas ROC (receiver operating characteristic) en las que se presenta la sensibilidad en función de los falsos positivos (complementario de la especificidad) para distintos puntos de corte. Se ha utilizado el área bajo la curva, que tomará valores entre 1 (prueba perfecta) y 0,5 (prueba inútil). El área puede interpretarse ante un par de individuos, uno enfermo y el otro sano, como la probabilidad de que el valor de la variable los clasifique correctamente19. Las áreas bajo las curvas ROC derivadas de los mismos pacientes fueron comparadas usando el método descrito por Hanley et al20. Para valorar los distintos criterios entre sí y para averiguar los puntos de corte que mejor predicen RI, se utilizó el índice de Youden21 = sensibilidad – (1 – especificidad) y el número de pacientes necesarios para el diagnóstico (NND)22, que sería: NND = 1/(sensibilidad – (1 – especificidad). El índice de Youden21 y el NND22 valoran globalmente las pruebas diagnósticas. Ambos combinan la sensibilidad y la especificidad en un solo término, por lo que son útiles para comparar pruebas diagnósticas entre sí. El NND es en realidad el inverso del índice de Youden, pero su significado es más comprensible, al ser conceptualmente análogo al número de pacientes que es necesario tratar para evitar un evento: indicaría el número de pruebas que es necesario hacer para obtener un diagnóstico positivo. El análisis de los datos se realizó con el programa estadístico SPSS 11.0.
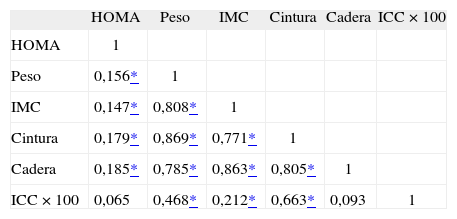
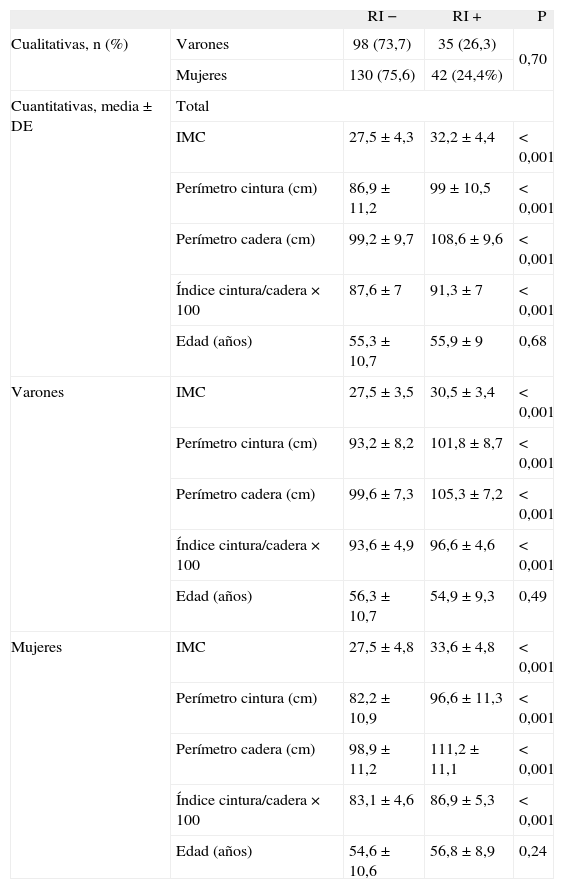
RESULTADOSEn la tabla 2 se presentan características clínicas y analíticas de la muestra en general y por sexos. En la tabla 3 se recoge la distribución por percentiles de las variables antropométricas en general y según sexo. En la tabla 4 se presentan las correlaciones entre las variables antropométricas y el HOMA. Todas las variables antropométricas están correlacionadas con el HOMA y entre sí. La prevalencia de RI (índice HOMA ≥ 2,9) fue del 25,2% (IC del 95%, 20,5-30,6). No hubo diferencias en cuanto a sexo y edad (tabla 5). Todas las variables antropométricas presentan cifras más elevadas en los pacientes con RI que en los pacientes sin RI (tabla 5). Con todas las variables que en el análisis bivariable presentaron p < 0,05, más la edad y el sexo, se realizó una regresión logística por pasos hacia adelante. En la tabla 6 se recogen las variables que entraron en el modelo y el orden de entrada en él: el IMC y la razón cintura/cadera × 100. No entraron en el modelo la edad, el sexo, la cintura, la cadera y la superficie corporal. El modelo logístico presentó un buen ajuste de los datos (χ2 de Hosmer-Lemeshow = 7,18; p = 0,52), y el área bajo la curva ROC fue 0,81 (IC del 95%, 0,75-0,86). La ecuación logística así hallada fue: probabilidad de RI = 1/1 + exp{−[−14,295] − [0,234 × IMC] − [0,07 × (cintura/cadera × 100)]}. En la figura 1 se presentan las curvas ROC de las variables antropométricas para valorar su capacidad de predecir la RI en general y según el sexo. Todas las variables antropométricas fueron mejores predictoras en mujeres que en varones. Ni en el total ni por sexos hubo diferencias significativas entre IMC, la cintura, la cadera y la probabilidad calculada de la regresión logística. Sí se halló diferencias entre ellas y el índice cintura/cadera × 100 y la superficie corporal, tanto en general como por sexo. La probabilidad calculada por la ecuación logística presentó la mayor área bajo la curva para el total y por sexo, seguida globalmente y en mujeres por el IMC y en varones por la cintura.
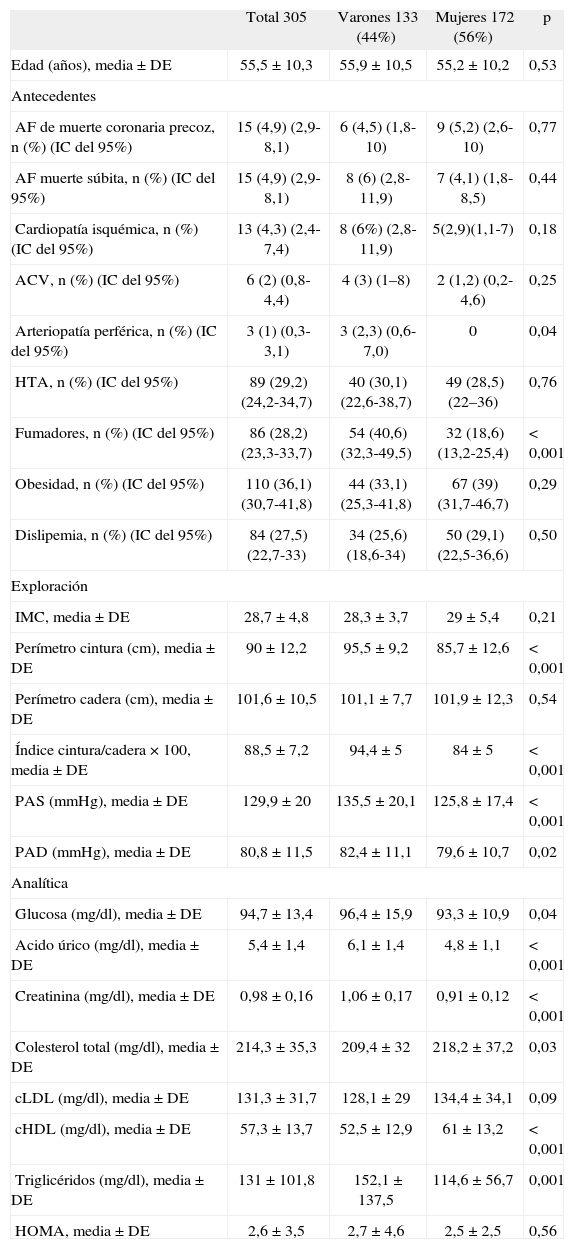
Características de la muestra
| Total 305 | Varones 133 (44%) | Mujeres 172 (56%) | p | |
| Edad (años), media ± DE | 55,5 ± 10,3 | 55,9 ± 10,5 | 55,2 ±10,2 | 0,53 |
| Antecedentes | ||||
| AF de muerte coronaria precoz, n (%) (IC del 95%) | 15 (4,9) (2,9-8,1) | 6 (4,5) (1,8-10) | 9 (5,2) (2,6-10) | 0,77 |
| AF muerte súbita, n (%) (IC del 95%) | 15 (4,9) (2,9-8,1) | 8 (6) (2,8-11,9) | 7 (4,1) (1,8-8,5) | 0,44 |
| Cardiopatía isquémica, n (%) (IC del 95%) | 13 (4,3) (2,4-7,4) | 8 (6%) (2,8-11,9) | 5(2,9)(1,1-7) | 0,18 |
| ACV, n (%) (IC del 95%) | 6 (2) (0,8-4,4) | 4 (3) (1–8) | 2 (1,2) (0,2-4,6) | 0,25 |
| Arteriopatía perférica, n (%) (IC del 95%) | 3 (1) (0,3-3,1) | 3 (2,3) (0,6-7,0) | 0 | 0,04 |
| HTA, n (%) (IC del 95%) | 89 (29,2) (24,2-34,7) | 40 (30,1) (22,6-38,7) | 49 (28,5) (22–36) | 0,76 |
| Fumadores, n (%) (IC del 95%) | 86 (28,2) (23,3-33,7) | 54 (40,6) (32,3-49,5) | 32 (18,6) (13,2-25,4) | < 0,001 |
| Obesidad, n (%) (IC del 95%) | 110 (36,1) (30,7-41,8) | 44 (33,1) (25,3-41,8) | 67 (39) (31,7-46,7) | 0,29 |
| Dislipemia, n (%) (IC del 95%) | 84 (27,5) (22,7-33) | 34 (25,6) (18,6-34) | 50 (29,1) (22,5-36,6) | 0,50 |
| Exploración | ||||
| IMC, media ± DE | 28,7 ± 4,8 | 28,3 ± 3,7 | 29 ± 5,4 | 0,21 |
| Perímetro cintura (cm), media ± DE | 90 ± 12,2 | 95,5 ±9,2 | 85,7 ± 12,6 | < 0,001 |
| Perímetro cadera (cm), media ± DE | 101,6 ±10,5 | 101,1 ±7,7 | 101,9 ±12,3 | 0,54 |
| Índice cintura/cadera × 100, media ± DE | 88,5 ±7,2 | 94,4 ± 5 | 84 ± 5 | < 0,001 |
| PAS (mmHg), media ± DE | 129,9 ± 20 | 135,5 ±20,1 | 125,8 ±17,4 | < 0,001 |
| PAD (mmHg), media ± DE | 80,8 ±11,5 | 82,4 ±11,1 | 79,6 ± 10,7 | 0,02 |
| Analítica | ||||
| Glucosa (mg/dl), media ± DE | 94,7 ± 13,4 | 96,4 ± 15,9 | 93,3 ± 10,9 | 0,04 |
| Acido úrico (mg/dl), media ± DE | 5,4 ±1,4 | 6,1 ± 1,4 | 4,8 ±1,1 | < 0,001 |
| Creatinina (mg/dl), media ± DE | 0,98 ±0,16 | 1,06 ±0,17 | 0,91 ±0,12 | < 0,001 |
| Colesterol total (mg/dl), media ± DE | 214,3 ±35,3 | 209,4 ± 32 | 218,2 ±37,2 | 0,03 |
| cLDL (mg/dl), media ± DE | 131,3 ±31,7 | 128,1 ±29 | 134,4 ±34,1 | 0,09 |
| cHDL (mg/dl), media ± DE | 57,3 ± 13,7 | 52,5 ± 12,9 | 61 ± 13,2 | < 0,001 |
| Triglicéridos (mg/dl), media ± DE | 131 ± 101,8 | 152,1 ± 137,5 | 114,6 ±56,7 | 0,001 |
| HOMA, media ± DE | 2,6 ±3,5 | 2,7 ± 4,6 | 2,5 ±2,5 | 0,56 |
ACV: accidente cerebrovascular; AF: antecedente familiar; cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; DE: desviación estándar; HOMA: homeostasis model assessment; HTA: hipertensión arterial; IC: intervalo de confianza; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
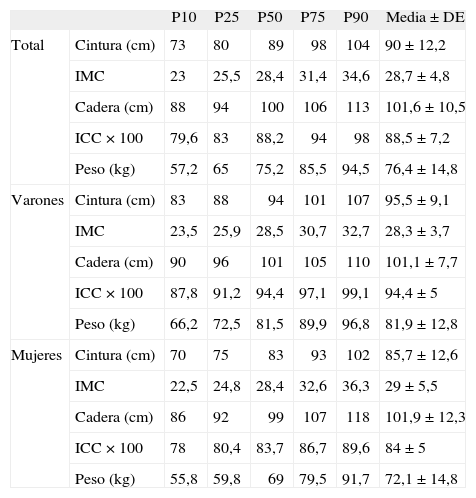
Distribución de las variables antropométricas en distintos percentiles, media y desviación estándar
| P10 | P25 | P50 | P75 | P90 | Media ± DE | ||
| Total | Cintura (cm) | 73 | 80 | 89 | 98 | 104 | 90 ± 12,2 |
| IMC | 23 | 25,5 | 28,4 | 31,4 | 34,6 | 28,7 ± 4,8 | |
| Cadera (cm) | 88 | 94 | 100 | 106 | 113 | 101,6 ± 10,5 | |
| ICC × 100 | 79,6 | 83 | 88,2 | 94 | 98 | 88,5 ± 7,2 | |
| Peso (kg) | 57,2 | 65 | 75,2 | 85,5 | 94,5 | 76,4 ± 14,8 | |
| Varones | Cintura (cm) | 83 | 88 | 94 | 101 | 107 | 95,5 ± 9,1 |
| IMC | 23,5 | 25,9 | 28,5 | 30,7 | 32,7 | 28,3 ± 3,7 | |
| Cadera (cm) | 90 | 96 | 101 | 105 | 110 | 101,1 ± 7,7 | |
| ICC × 100 | 87,8 | 91,2 | 94,4 | 97,1 | 99,1 | 94,4 ± 5 | |
| Peso (kg) | 66,2 | 72,5 | 81,5 | 89,9 | 96,8 | 81,9 ± 12,8 | |
| Mujeres | Cintura (cm) | 70 | 75 | 83 | 93 | 102 | 85,7 ± 12,6 |
| IMC | 22,5 | 24,8 | 28,4 | 32,6 | 36,3 | 29 ± 5,5 | |
| Cadera (cm) | 86 | 92 | 99 | 107 | 118 | 101,9 ± 12,3 | |
| ICC × 100 | 78 | 80,4 | 83,7 | 86,7 | 89,6 | 84 ± 5 | |
| Peso (kg) | 55,8 | 59,8 | 69 | 79,5 | 91,7 | 72,1 ± 14,8 | |
DE: desviación estándar; ICC: índice cintura/cadera; IMC: índice de masa corporal.
Correlaciones entre las variables antropométricas y el índice HOMA
| HOMA | Peso | IMC | Cintura | Cadera | ICC × 100 | |
| HOMA | 1 | |||||
| Peso | 0,156* | 1 | ||||
| IMC | 0,147* | 0,808* | 1 | |||
| Cintura | 0,179* | 0,869* | 0,771* | 1 | ||
| Cadera | 0,185* | 0,785* | 0,863* | 0,805* | 1 | |
| ICC × 100 | 0,065 | 0,468* | 0,212* | 0,663* | 0,093 | 1 |
HOMA: homeostasis model assesment; ICC × 100: índice cintura (cm)/cadera (cm) × 100; IMC: índice de masa corporal.
Relación de medidas antropométricas, edad y sexo con la resistencia a la insulina
| RI− | RI+ | P | ||
| Cualitativas, n (%) | Varones | 98 (73,7) | 35 (26,3) | 0,70 |
| Mujeres | 130 (75,6) | 42 (24,4%) | ||
| Cuantitativas, media ± DE | Total | |||
| IMC | 27,5 ±4,3 | 32,2 ± 4,4 | < 0,001 | |
| Perímetro cintura (cm) | 86,9 ±11,2 | 99 ± 10,5 | < 0,001 | |
| Perímetro cadera (cm) | 99,2 ±9,7 | 108,6 ±9,6 | < 0,001 | |
| Índice cintura/cadera × 100 | 87,6 ± 7 | 91,3 ±7 | < 0,001 | |
| Edad (años) | 55,3 ± 10,7 | 55,9 ± 9 | 0,68 | |
| Varones | IMC | 27,5 ±3,5 | 30,5 ±3,4 | < 0,001 |
| Perímetro cintura (cm) | 93,2 ±8,2 | 101,8 ±8,7 | < 0,001 | |
| Perímetro cadera (cm) | 99,6 ±7,3 | 105,3 ±7,2 | < 0,001 | |
| Índice cintura/cadera × 100 | 93,6 ±4,9 | 96,6 ±4,6 | < 0,001 | |
| Edad (años) | 56,3 ± 10,7 | 54,9 ±9,3 | 0,49 | |
| Mujeres | IMC | 27,5 ±4,8 | 33,6 ±4,8 | < 0,001 |
| Perímetro cintura (cm) | 82,2 ±10,9 | 96,6 ±11,3 | < 0,001 | |
| Perímetro cadera (cm) | 98,9 ±11,2 | 111,2 ±11,1 | < 0,001 | |
| Índice cintura/cadera × 100 | 83,1 ±4,6 | 86,9 ± 5,3 | < 0,001 | |
| Edad (años) | 54,6 ± 10,6 | 56,8 ±8,9 | 0,24 | |
DE: desviación estándar; IMC: índice de masa corporal; RI-: sin resistencia a la insulina; RI+: con resistencia a la insulina.
Factores antropométricos asociados a la resistencia a la insulina después de la regresión logística por pasos
| Pasos | Variables | β | EEβ | p | OR | IC del 95% |
| 1 | IMC | 0,234 | 0,037 | < 0,0001 | 1,26 | 1,18-1,36 |
| 2 | Índice cintura/cadera × 100 | 0,070 | 0,022 | < 0,01 | 1,07 | 1,03-1,12 |
| Constante | −14,295 |
Regresión logística por pasos hacia adelante, x2 de Hosmer-Lemeshow = 7,18 (p = 0,52). El área bajo la curva ROC ha sido 0,81 (IC del 95%, 0,75-0,86). Variables que no han entrado en la ecuación: edad, sexo, cintura, cadera y superficie corporal.
Ecuación logística para predecir RI = 1/1 + exp{−[−14,295] [0,234 × IMC] [0,07 X(cintura/cadera × 100)]}.
β: coeficiente beta de la regresión logística; EEp: error estándar del coeficiente beta; IC: intervalo de confianza; IMC: índice de masa corporal; OR: odds ratio; ROC: receiver operating characteristic.
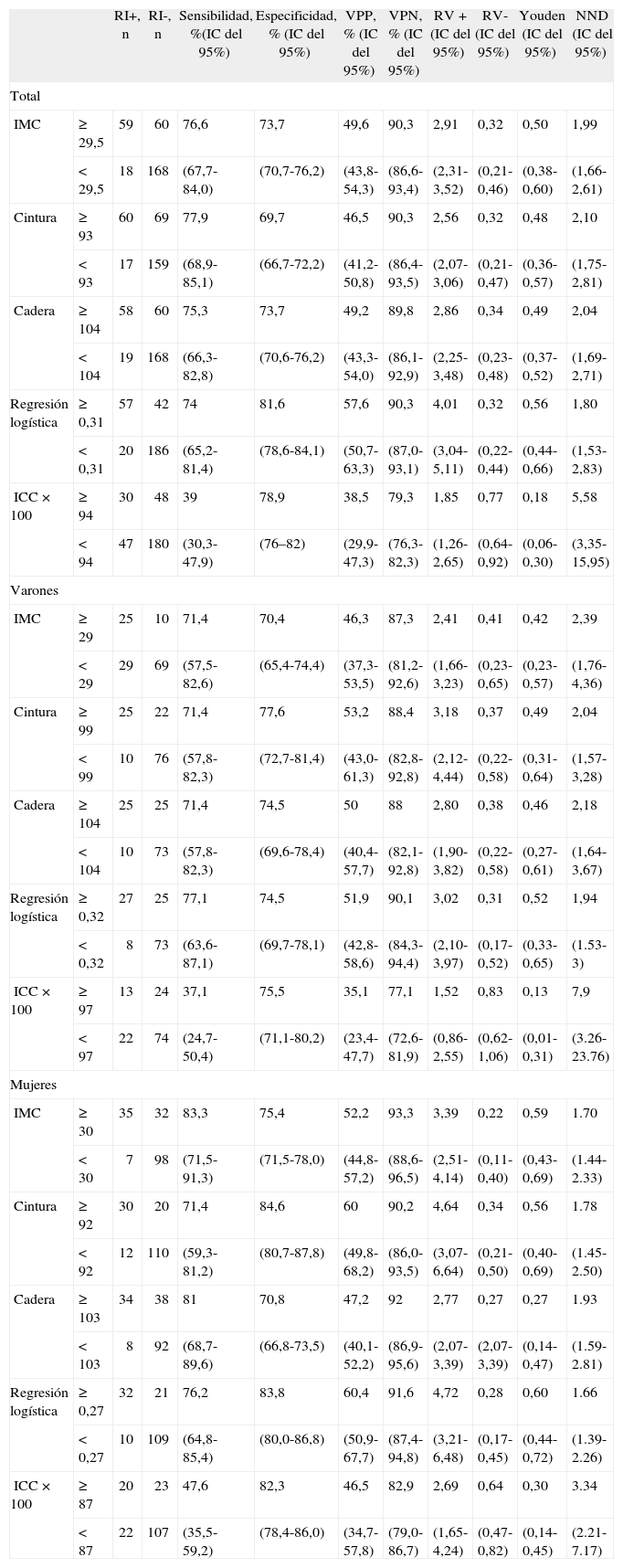
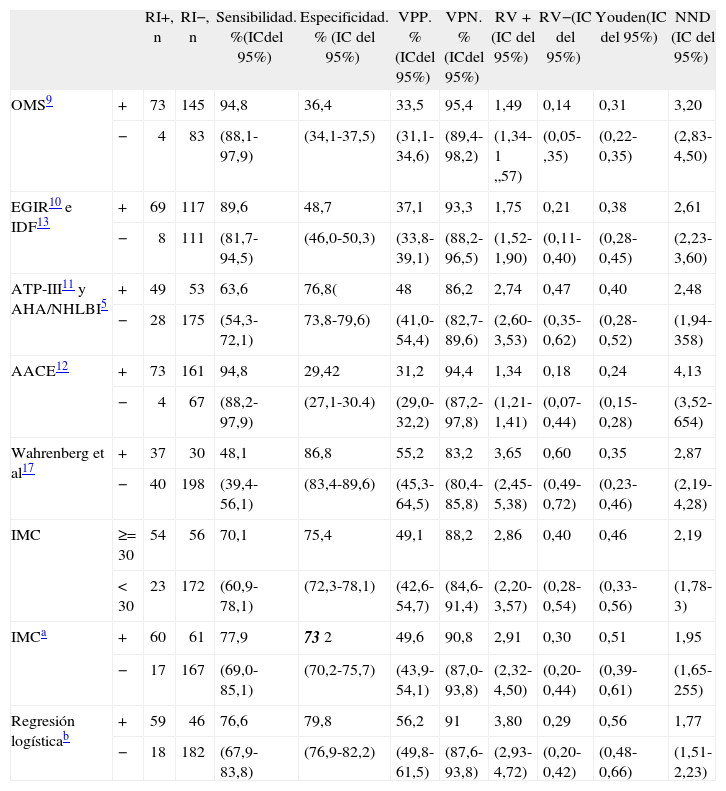
En la tabla 7 se presentan los mejores puntos de corte de las distintas variables antropométricas de nuestro estudio, en general y según sexo. En conjunto, el modelo logístico presentó el mejor NND, seguido del IMC (punto de corte ≥ 29,5). En los varones, los mejores parámetros fueron el modelo logístico y la cintura (punto de corte ≥ 99), y en mujeres, el modelo logístico y el IMC (punto de corte ≥ 30). En la tabla 8 se comparan los criterios antropométricos de las distintas definiciones de SM5,9–13, el criterio del estudio de Wahrenberg et al17, IMC ≥ 30 y los mejores puntos de corte de nuestro estudio (IMC y regresión logística). Los mejores criterios fueron el modelo logístico con diferentes puntos de corte según sexo, seguido del IMC (punto de corte en varones ≥ 29,5 y en mujeres ≥ 30) y del IMC (punto de corte ≥ 30). Los demás criterios fueron claramente peores.
Comparación entre los mejores puntos de corte de las variables antropométricas (índice de masa corporal cintura y cadera) y la regresión logística en relación con la resistencia a la insulina. Total y según sexo
| RI+, n | RI-, n | Sensibilidad, %(IC del 95%) | Especificidad, % (IC del 95%) | VPP, % (IC del 95%) | VPN, % (IC del 95%) | RV+ (IC del 95%) | RV- (IC del 95%) | Youden (IC del 95%) | NND (IC del 95%) | ||
| Total | |||||||||||
| IMC | ≥ 29,5 | 59 | 60 | 76,6 | 73,7 | 49,6 | 90,3 | 2,91 | 0,32 | 0,50 | 1,99 |
| < 29,5 | 18 | 168 | (67,7-84,0) | (70,7-76,2) | (43,8-54,3) | (86,6-93,4) | (2,31-3,52) | (0,21-0,46) | (0,38-0,60) | (1,66-2,61) | |
| Cintura | ≥ 93 | 60 | 69 | 77,9 | 69,7 | 46,5 | 90,3 | 2,56 | 0,32 | 0,48 | 2,10 |
| <93 | 17 | 159 | (68,9-85,1) | (66,7-72,2) | (41,2-50,8) | (86,4-93,5) | (2,07-3,06) | (0,21-0,47) | (0,36-0,57) | (1,75-2,81) | |
| Cadera | ≥ 104 | 58 | 60 | 75,3 | 73,7 | 49,2 | 89,8 | 2,86 | 0,34 | 0,49 | 2,04 |
| < 104 | 19 | 168 | (66,3-82,8) | (70,6-76,2) | (43,3-54,0) | (86,1-92,9) | (2,25-3,48) | (0,23-0,48) | (0,37-0,52) | (1,69-2,71) | |
| Regresión logística | ≥ 0,31 | 57 | 42 | 74 | 81,6 | 57,6 | 90,3 | 4,01 | 0,32 | 0,56 | 1,80 |
| <0,31 | 20 | 186 | (65,2-81,4) | (78,6-84,1) | (50,7-63,3) | (87,0-93,1) | (3,04-5,11) | (0,22-0,44) | (0,44-0,66) | (1,53-2,83) | |
| ICC × 100 | ≥ 94 | 30 | 48 | 39 | 78,9 | 38,5 | 79,3 | 1,85 | 0,77 | 0,18 | 5,58 |
| <94 | 47 | 180 | (30,3-47,9) | (76–82) | (29,9-47,3) | (76,3-82,3) | (1,26-2,65) | (0,64-0,92) | (0,06-0,30) | (3,35-15,95) | |
| Varones | |||||||||||
| IMC | ≥ 29 | 25 | 10 | 71,4 | 70,4 | 46,3 | 87,3 | 2,41 | 0,41 | 0,42 | 2,39 |
| <29 | 29 | 69 | (57,5-82,6) | (65,4-74,4) | (37,3-53,5) | (81,2-92,6) | (1,66-3,23) | (0,23-0,65) | (0,23-0,57) | (1,76-4,36) | |
| Cintura | ≥ 99 | 25 | 22 | 71,4 | 77,6 | 53,2 | 88,4 | 3,18 | 0,37 | 0,49 | 2,04 |
| <99 | 10 | 76 | (57,8-82,3) | (72,7-81,4) | (43,0-61,3) | (82,8-92,8) | (2,12-4,44) | (0,22-0,58) | (0,31-0,64) | (1,57-3,28) | |
| Cadera | ≥ 104 | 25 | 25 | 71,4 | 74,5 | 50 | 88 | 2,80 | 0,38 | 0,46 | 2,18 |
| < 104 | 10 | 73 | (57,8-82,3) | (69,6-78,4) | (40,4-57,7) | (82,1-92,8) | (1,90-3,82) | (0,22-0,58) | (0,27-0,61) | (1,64-3,67) | |
| Regresión logística | ≥ 0,32 | 27 | 25 | 77,1 | 74,5 | 51,9 | 90,1 | 3,02 | 0,31 | 0,52 | 1,94 |
| <0,32 | 8 | 73 | (63,6-87,1) | (69,7-78,1) | (42,8-58,6) | (84,3-94,4) | (2,10-3,97) | (0,17-0,52) | (0,33-0,65) | (1.53-3) | |
| ICC × 100 | ≥ 97 | 13 | 24 | 37,1 | 75,5 | 35,1 | 77,1 | 1,52 | 0,83 | 0,13 | 7,9 |
| <97 | 22 | 74 | (24,7-50,4) | (71,1-80,2) | (23,4-47,7) | (72,6-81,9) | (0,86-2,55) | (0,62-1,06) | (0,01-0,31) | (3.26-23.76) | |
| Mujeres | |||||||||||
| IMC | ≥ 30 | 35 | 32 | 83,3 | 75,4 | 52,2 | 93,3 | 3,39 | 0,22 | 0,59 | 1.70 |
| <30 | 7 | 98 | (71,5-91,3) | (71,5-78,0) | (44,8-57,2) | (88,6-96,5) | (2,51-4,14) | (0,11-0,40) | (0,43-0,69) | (1.44-2.33) | |
| Cintura | ≥ 92 | 30 | 20 | 71,4 | 84,6 | 60 | 90,2 | 4,64 | 0,34 | 0,56 | 1.78 |
| <92 | 12 | 110 | (59,3-81,2) | (80,7-87,8) | (49,8-68,2) | (86,0-93,5) | (3,07-6,64) | (0,21-0,50) | (0,40-0,69) | (1.45-2.50) | |
| Cadera | ≥ 103 | 34 | 38 | 81 | 70,8 | 47,2 | 92 | 2,77 | 0,27 | 0,27 | 1.93 |
| < 103 | 8 | 92 | (68,7-89,6) | (66,8-73,5) | (40,1-52,2) | (86,9-95,6) | (2,07-3,39) | (2,07-3,39) | (0,14-0,47) | (1.59-2.81) | |
| Regresión logística | ≥ 0,27 | 32 | 21 | 76,2 | 83,8 | 60,4 | 91,6 | 4,72 | 0,28 | 0,60 | 1.66 |
| <0,27 | 10 | 109 | (64,8-85,4) | (80,0-86,8) | (50,9-67,7) | (87,4-94,8) | (3,21-6,48) | (0,17-0,45) | (0,44-0,72) | (1.39-2.26) | |
| ICC × 100 | ≥ 87 | 20 | 23 | 47,6 | 82,3 | 46,5 | 82,9 | 2,69 | 0,64 | 0,30 | 3.34 |
| <87 | 22 | 107 | (35,5-59,2) | (78,4-86,0) | (34,7-57,8) | (79,0-86,7) | (1,65-4,24) | (0,47-0,82) | (0,14-0,45) | (2.21-7.17) | |
ICC: índice cintura/cadera; IC: intervalo de confianza; IMC: índice de masa corporal; NND: número de pacientes necesarios para diagnóstico; RI-: sin RI; RI+: resistencia a la insulina; RV-: razón de verosimilitud negativa; RV+: razón de verosimilitud positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Comparación entre los diversos criterios antropométricos propuestos para diagnóstico clínico de síndrome metabólico y las mejores mediciones en este estudio (índice de masa corporal y regresión logística) con relación a la resistencia a la insulina
| RI+, n | RI−, n | Sensibilidad. %(ICdel 95%) | Especificidad. % (IC del 95%) | VPP. % (ICdel 95%) | VPN. % (ICdel 95%) | RV+ (IC del 95%) | RV−(IC del 95%) | Youden(IC del 95%) | NND (IC del 95%) | ||
| OMS9 | + | 73 | 145 | 94,8 | 36,4 | 33,5 | 95,4 | 1,49 | 0,14 | 0,31 | 3,20 |
| − | 4 | 83 | (88,1-97,9) | (34,1-37,5) | (31,1-34,6) | (89,4-98,2) | (1,34-1 „57) | (0,05-,35) | (0,22-0,35) | (2,83-4,50) | |
| EGIR10 e IDF13 | + | 69 | 117 | 89,6 | 48,7 | 37,1 | 93,3 | 1,75 | 0,21 | 0,38 | 2,61 |
| − | 8 | 111 | (81,7-94,5) | (46,0-50,3) | (33,8-39,1) | (88,2-96,5) | (1,52-1,90) | (0,11-0,40) | (0,28-0,45) | (2,23-3,60) | |
| ATP-III11 y AHA/NHLBI5 | + | 49 | 53 | 63,6 | 76,8( | 48 | 86,2 | 2,74 | 0,47 | 0,40 | 2,48 |
| − | 28 | 175 | (54,3-72,1) | 73,8-79,6) | (41,0-54,4) | (82,7-89,6) | (2,60-3,53) | (0,35-0,62) | (0,28-0,52) | (1,94-358) | |
| AACE12 | + | 73 | 161 | 94,8 | 29,42 | 31,2 | 94,4 | 1,34 | 0,18 | 0,24 | 4,13 |
| − | 4 | 67 | (88,2-97,9) | (27,1-30.4) | (29,0-32,2) | (87,2-97,8) | (1,21-1,41) | (0,07-0,44) | (0,15-0,28) | (3,52-654) | |
| Wahrenberg et al17 | + | 37 | 30 | 48,1 | 86,8 | 55,2 | 83,2 | 3,65 | 0,60 | 0,35 | 2,87 |
| − | 40 | 198 | (39,4-56,1) | (83,4-89,6) | (45,3-64,5) | (80,4-85,8) | (2,45-5,38) | (0,49-0,72) | (0,23-0,46) | (2,19-4,28) | |
| IMC | ≥= 30 | 54 | 56 | 70,1 | 75,4 | 49,1 | 88,2 | 2,86 | 0,40 | 0,46 | 2,19 |
| < 30 | 23 | 172 | (60,9-78,1) | (72,3-78,1) | (42,6-54,7) | (84,6-91,4) | (2,20-3,57) | (0,28-0,54) | (0,33-0,56) | (1,78-3) | |
| IMCa | + | 60 | 61 | 77,9 | 73 2 | 49,6 | 90,8 | 2,91 | 0,30 | 0,51 | 1,95 |
| − | 17 | 167 | (69,0-85,1) | (70,2-75,7) | (43,9-54,1) | (87,0-93,8) | (2,32-4,50) | (0,20-0,44) | (0,39-0,61) | (1,65-255) | |
| Regresión logísticab | + | 59 | 46 | 76,6 | 79,8 | 56,2 | 91 | 3,80 | 0,29 | 0,56 | 1,77 |
| − | 18 | 182 | (67,9-83,8) | (76,9-82,2) | (49,8-61,5) | (87,6-93,8) | (2,93-4,72) | (0,20-0,42) | (0,48-0,66) | (1,51-2,23) | |
AACE: American Association of Clinical Endocrinologists; AHA/NHLBI: American Heart Association/National Heart Lung and Blood Institute; ATP-III: Adult Treatment Panel III del National Cholesterol Education Program; EGIR: European Group for Study of Insulin Resistance; IC: intervalo de confianza; IDF: International Diabetes Federation; IMC: indice de masa corporal; NND: numero de pacientes necesarios para diagnostico; OMS: Organizacion Mundial de la Salud; RI−: sin RI; RI+: resistencia a la insulina; RV−: razon de verosimilitud negativa; RV+: razon de verosimilitud positiva; VPN valor predictivo negativo; VPP: valor predictivo positivo.
Criterio de Wahremberg et al (2005): cintura ≥ 100 cm (varones y mujeres).
Entre las limitaciones de nuestro estudio hemos de señalar: a) la población estudiada, aunque representativa, es una población local, lo que podría limitar la generalización de los resultados; así, en nuevos estudios las variables en la regresión logística o los mejores puntos de corte podrían ser distintos, y por ello se necesita realizar estudios posteriores en otras poblaciones y razas; y b) la imposibilidad de usar el estándar (clamp euglucémico hiperinsulinémico23) para medir la RI. La insulinemia y el índice HOMA24 son válidos para el diagnóstico de RI en estudios poblacionales25. El más utilizado es el índice HOMA25,26. El HOMA presenta una fuerte correlación con el clamp euglucémico hiperinsulinémico26,27 y tiene un coeficiente de variación de un 7,8-11,7%27.
No se ha establecido un criterio absoluto (punto de corte) que clasifique a los pacientes como RI o sensibles a la insulina. En este estudio utilizamos el criterio propuesto por la OMS9,16 que define RI como el valor HOMA mayor o igual que el percentil 75 de los pacientes sin diabetes mellitus ni intolerancia a la glucosa.
En las distintas definiciones de SM se han utilizado todas las medidas antropométricas que hemos utilizado en nuestro estudio. La definición de SM de la OMS9,16 utiliza como criterio el IMC y el índice cintura/cadera, la AAEC12 utiliza el IMC; en cambio, el EGIR10, la ATP-III11, la IDF13 y la AHA/NHLBI5 utilizan la cintura. Los puntos de corte propuestos por la IDF y la ATP-III vienen de la definición de obesidad abdominal propuesta en 1998 por las National Institutes of Health Obesity Clinical Guidelines28, que era: una cintura en varones > 40 pulgadas (102 cm) y en mujeres, 38 pulgadas (88 cm). Estos límites no están basados en los mejores puntos de corte para predecir la RI, sino que identificaban aproximadamente el cuartil superior de la población estadounidense de entonces.
La IDF considera que la obesidad abdominal está tan relacionada con RI que no se precisa de otras medidas de RI más difíciles de obtener29. La cintura es condición necesaria para el diagnóstico junto a otros dos de los criterios originales del SM según la ATPIII. Ante el problema de utilizar para definir obesidad abdominal una medida sin estandarizar, la IDF reconoció diferencias étnicas en la relación entre la obesidad abdominal y otros factores de riesgo del SM. Por esta razón los criterios de obesidad abdominal fueron especificados por nacionalidad o etnia. Por ejemplo, para los europeos se considera obesidad abdominal la cintura ≥ 94 cm en varones y ≥ 80 cm en mujeres. Estos límites se aplican también a la población de origen europeo que vive en América. En población asiática (excepto Japón), los límites son la cintura ≥ 90 cm en varones y ≥ 80 cm en mujeres. Para los japoneses, la cintura ≥ 85 cm en varones y ≥ 90 cm en mujeres. En población emigrante se ha de utilizar los puntos de corte de la población origen30. Aun así, se necesitan nuevos estudios epidemiológicos para determinar los puntos de corte en otras poblaciones13.
El estudio de Wahrenberg et al17 realizado en Suecia utilizaba la cintura para predecir la RI. Una cintura > 100 cm tanto en varones como en mujeres predecía RI con una elevada sensibilidad y especificidad. Pero la media de cintura en varones en su estudio era 14 cm mayor que en el nuestro, y en mujeres, 11 cm mayor. Esto hace que sea imposible comparar ambas poblaciones por este criterio.
Por otro lado, en la práctica clínica de atención primaria no es habitual la determinación de la medida de la cintura y la medición puede ser difícil de realizar de acuerdo con el estándar cuando el sujeto es obeso14.
En resumen, en una población homogénea no hemos encontrado diferencias significativas ente IMC, cintura, cadera y un modelo logístico para predecir RI. Ante una sociedad globalizada con importantes movimientos de población, y para evitar la búsqueda de múltiples puntos de corte para distintas poblaciones según la etnia, creemos que sería necesario utilizar una medida estandarizada para comparar poblaciones. El IMC ha sido utilizado en las definiciones de la OMS9,16 y de la AACE12. La AACE utiliza el punto de corte del sobrepeso (IMC ≥ 25), pero pensamos que no es útil porque, a pesar de una alta sensibilidad, presenta muy baja especificidad (tabla 8). La OMS utiliza dos criterios antropométricos en la definición del SM, el IMC ≥ 30 y el índice de cintura/cadera9,16. En nuestro estudio demostramos que aisladamente el índice cintura/cadera no predice tan bien la RI como otras medidas antropométricas. Un IMC ≥ 30 es la mejor medida antropométrica de las estudiadas para predecir RI, por tener buenas sensibilidad y especificidad y los mejores índices globales (Youden y NND). Por otro lado se eliminaría la variabilidad de la medición de la cintura en los pacientes obesos y se utilizaría una medida habitual en la práctica clínica. Estamos de acuerdo con AHA/NHLBI5 en la utilidad clínica de los criterios de la ATP-III y en la desventaja de seguir los criterios de la IDF, que hacen énfasis en una única causa de SM, pero si nuestros hallazgos se comprueban en nuevos estudios, proponemos modificar los criterios antropométricos de SM ATP-III y AHA/NHLBI, sustituyendo la medida de la cintura por el IMC.