Introducción
Las causas más frecuentes de disfunción de los accesos vasculares son la trombosis aguda y la estenosis. Otras complicaciones que pueden poner en riesgo no sólo la viabilidad del acceso, sino también la vida del paciente son: la formación de aneurismas y seudoaneurismas, la hemorragia y la rotura del acceso, las infecciones del acceso y otras complicaciones como la isquemia distal, la hipertensión venosa y la trombosis de vasos centrales.
Aneurismas y seudoaneurismas
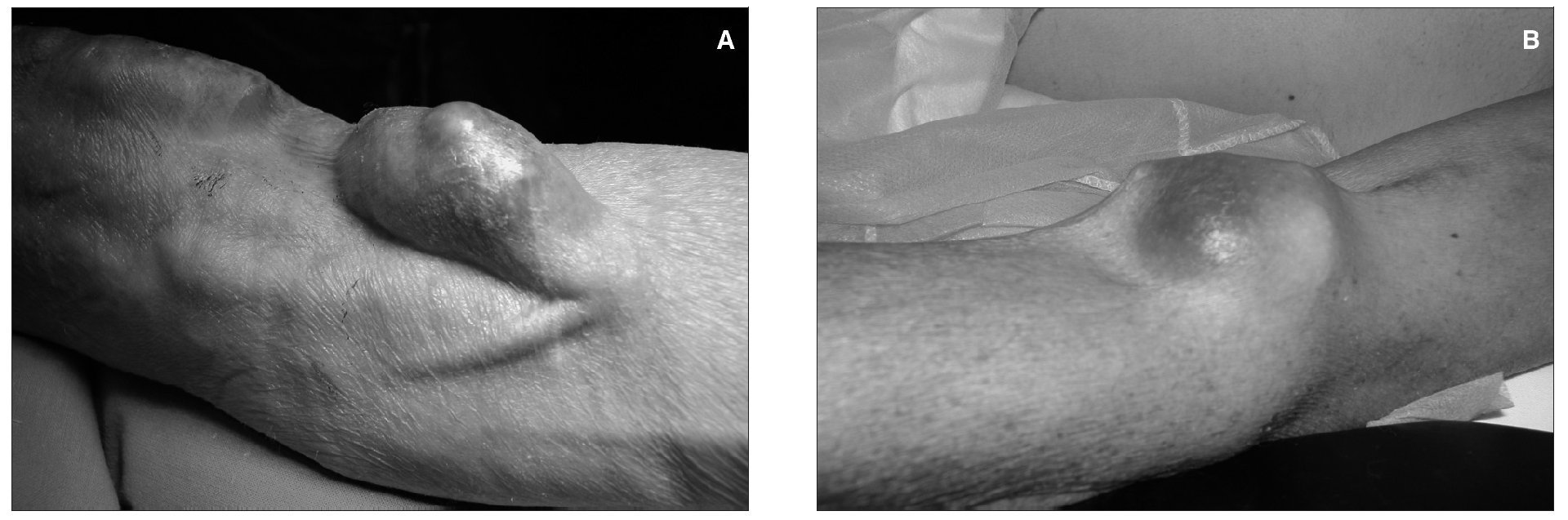
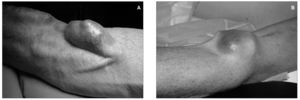
Aproximadamente un 5-8 % de las fístulas arteriovenosas (FAV) desarrollan aneurismas (fig. 1).
Figura 1. Aneurisma y seudoaneurisma.
Sus peligros potenciales son la trombosis del acceso, la embolización distal, el adelgazamiento y la erosión de la piel subyacente, que puede causar infección y/o sangrado, y el deterioro estético de la extremidad. Un aneurisma verdadero es una dilatación de un territorio de la fístula por degeneración de la matriz de colágeno de la pared vascular, pero manteniéndose íntegra la pared venosa o arterial. Lo más frecuente es que se afecte el trayecto venoso de las fístulas autólogas de larga duración. También podemos encontrar aneurismas venosos en la anastomosis de acceso venoso (AV) como consecuencia del hiperaflujo sanguíneo. Esporádicamente se han descrito aneurismas arteriales verdaderos, principalmente de la arteria axilar o la humeral, tras la ligadura de una fístula de codo. Los aneurismas verdaderos son poco frecuentes en accesos protésicos.
Los seudoaneurismas son dilataciones pulsátiles y expansibles producidas por el sangrado subcutáneo persistente a través de una pérdida de continuidad de la pared de la fístula o de la prótesis. Pueden encontrarse tanto en FAV autólogas como protésicas, y también los encontramos en las anastomosis de AV. En la etiopatogenia de los aneurismas y seudoaneurismas puede estar implicada una inadecuada técnica quirúrgica, como una manipulación poco cuidadosa de la vena, con pinzamiento, estiramiento o excesiva dilatación intraluminal, o una mala técnica de anastomosis, con discontinuidad de ésta. Pero además, la aparición de aneurismas y seudoaneurismas puede deberse a una inadecuada técnica de canulación durante las sesiones de hemodiálisis (HD): las punciones repetidas en un mismo punto pueden causar que la pared de la fístula o prótesis se debilite, con pérdida de continuidad y formación de un seudoaneurisma, o que se cree una zona de estenosis, con una dilatación venosa proximal a ella.
El diagnóstico es fundamentalmente clínico, con una masa pulsátil y expansible de crecimiento progresivo en el trayecto del acceso vascular. En ocasiones el paciente refiere dolor o hinchazón local. Como apoyo al diagnóstico clínico, puede recurrirse a la eco-Doppler, la fistulografía o la resonancia magnética.
Las indicaciones de tratamiento de los aneurismas y seudoaneurismas en los accesos vasculares son: la existencia de síntomas por compresión local o trombosis, el deterioro de la piel sobre la fístula, como la necrosis cutánea o formación de una escara, con riesgo de sangrado y/o infección, la limitación de puntos disponibles para la punción, cuando el aneurisma engloba la anastomosis arterial y el crecimiento rápido de un seudoaneurisma.
El tratamiento debe hacerse de manera preferente y suele consistir en la exclusión del aneurisma e inter-posición de un nuevo injerto (autólogo o protésico). En general, no es necesaria la exéresis completa del trayecto aneurismático, que además suele estar íntimamente adherido a la dermis. El nuevo injerto puede implantarse adyacente al antiguo segmento. La plicatura aislada del trayecto aneurismático suele recurrir precozmente, por lo que en general se prefiere la exclusión e interposición de injerto.
La dilatación del trayecto venoso en las FAV de larga evolución no dejan de ser un mero problema estético, y no se aconseja su corrección quirúrgica, a no ser que se asocie con estenosis o necrosis y trastornos cutáneos con riesgo de rotura. En el resto de los casos, únicamente hay que evitar la venopunción en estas dilataciones.
Hemorragia
El sangrado postoperatorio de los accesos vasculares para HD puede ser precoz o tardío. Los sangrados precoces suelen ocurrir a través de la línea de sutura de las anastomosis arteriovenosas o protésicas en relación con una mala técnica quirúrgica, y en ocasiones favorecido por el efecto de los agentes anticoagulantes administrados durante la HD. Con mayor frecuencia aparece un sangrado tardío prolongado de las zonas de punción durante la diálisis; en estos casos, una vez descartado un trastorno de la coagulación, la causa más frecuente es la hipertensión retrógrada generada por una estenosis en el trayecto de drenaje de la FAV.
El tratamiento dependerá de la etiología de la hemorragia. Se debe mejorar, en la medida de lo posible, la hemostasia de los pacientes: una diálisis adecuada mejora por sí misma la función plaquetaria porque elimina inhibidores de la función plaquetaria circulantes. Una simple transfusión para mantener un hematocrito superior al 30 % mejora la hemostasia, ya que aumenta el flujo plaquetario marginal y potencia el contacto plaqueta-endotelio. El mismo efecto tiene la eritropoyetina. La disfunción plaquetaria puede ser corregida temporalmente mediante la administración de DDAVP (libera factor VIII y factor de von Willebrand), análogo sintético de la vasopresina que mejora la adhesividad de las plaquetas. Su efecto es inmediato (30 min) y dura entre 4 y 12 h. Igualmente hay que realizar una cuidadosa y meticulosa técnica quirúrgica, con hemostasia minuciosa intraoperatoriamente. En caso de hemorragia precoz por la línea de sutura de la anastomosis, puede ser necesaria una revisión precoz para controlar la hemorragia y evitar la trombosis del acceso por compresión extrínseca. Y por último, hay que identificar precozmente las estenosis en el trayecto de drenaje de la FAV, mediante el adecuado seguimiento de los flujos y presiones durante las sesiones de HD, para prevenir el sangrado secundario a una hipertensión retrógrada.
Rotura de acceso
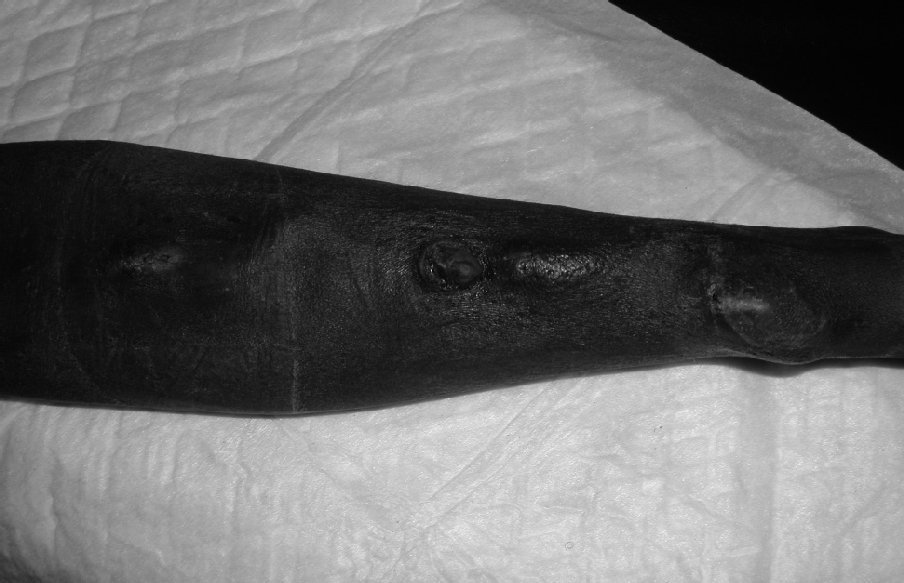
La rotura del acceso es una complicación infrecuente cuando aparece de forma espontánea. Normalmente se relaciona con la formación previa de seudoaneurismas con degeneración de la piel subyacente, rotura y hemorragia aguda (fig. 2); la infección del acceso puede afectar a la anastomosis, con el consiguiente riesgo de dehiscencia de la sutura y sangrado agudo, y más raramente un traumatismo directo sobre la fístula puede causar un sangrado agudo.
Figura 2. Decúbito cutáneo y rotura de acceso.
Requiere una actuación quirúrgica urgente, en ocasiones con ligadura del acceso o exclusión del seudoaneurisma, si lo hubiera, y reconstrucción del acceso cuando sea posible.
Infección del acceso
La infección es la segunda causa de pérdida de acceso vascular. Además, las complicaciones infecciosas causan un 15-30 % de todas las muertes en pacientes en HD. En este sentido, el acceso vascular es un factor de riesgo de infección local y desencadenante de bacteriemias que contribuye a la mortalidad de estos pacientes.
Los catéteres son los que se infectan con mayor frecuencia, seguidos de los accesos protésicos y los accesos autólogos. Por eso se recomienda priorizar el acceso autólogo sobre el protésico. Sin embargo, la generalización de los accesos protésicos, sobre todo en Estados Unidos, así como de los catéteres centrales para HD, ha producido un aumento de las complicaciones infecciosas.
Los gérmenes más frecuentemente implicados son los cocos grampositivos, especialmente Staphylococcus aureus y coagulasa negativo. Los enterococos se han encontrado en un 10-20 % de las infecciones y los gramnegativos, en el 33 %.
El catéter central para hemodiálisis es el acceso vascular con mayor riesgo de infección, con tasas de infección del 20 % a las 4 semanas y casi el 50 % a los 2 meses. Favorecen la infección ciertas localizaciones como la femoral, la deficiente higiene personal, la colonización nasal o de la piel por S. aureus y ciertas afecciones del paciente como la inmunodeficiencia, la diabetes mellitus, la hipoalbuminemia y altas concentraciones de ferritina.
Ante la sospecha de infección de catéter, se debe tomar HC e iniciar tempranamente el tratamiento empírico con antibióticos que cubran tanto gramnegativos como grampositivos y reemplazarlos por antibióticos específicos tan pronto como sea posible. Se obtienen mejores tasas de curación con la retirada del catéter y posterior colocación de un nuevo catéter en el mismo sitio. Los pacientes dializados con catéter no suelen disponer de otras opciones de acceso, por eso en muchas ocasiones se ha intentado conservar el catéter: las infecciones del sitio de salida pueden tratarse de forma conservadora con limpieza cuidadosa y antibióticos tópicos. Pero las infecciones del túnel (sensibilidad, eritema o induración > 2 cm desde el sitio de salida con o sin infección concomitante de la sangre) se tratan mejor retirando el catéter y administrando antibióticos parenterales durante 3 semanas o más. En los casos de infección de catéter complicados con infecciones metastásicas (endocarditis, artritis, osteomielitis), el catéter debe retirarse inmediatamente.
La infección de una fístula autóloga puede ser secundaria a una infección de la herida quirúrgica o a la falta de asepsia durante la diálisis. Los microorganismos implicados en la infección de accesos autólogos son similares a los de otros tipos de accesos. Puede presentarse como una celulitis difusa, en cuyo caso suele bastar con un tratamiento antibiótico durante 2-4 semanas. Si se asocia a un absceso, suele ser necesario drenarlo y prologar el tratamiento antibiótico. Las infecciones recurrentes o que afecten a la anastomosis pueden requerir la ligadura del acceso. Y por último, si se produce una infección seria de la pared vascular con degeneración aneurismática, obligaría a la exclusión de la zona con derivación con tejido autólogo a través de tejido sano o a la ligadura del acceso.
Los accesos protésicos son, tras los catéteres centrales, los que presentan mayor incidencia de complicaciones infecciosas. La infección del PTFE puede ocurrir por contaminación durante el acto quirúrgico, por punciones reiteradas durante la HD o por bacteriemias transitorias por infecciones remotas. La localización que se infecta con mayor frecuencia es el loop femoral y hay ciertos factores del paciente, como obesidad, diabetes, hipoproteinemia, inmunodeficiencia o mala higiene personal, que se consideran factores de riesgo. También las revisiones quirúrgicas para prolongar la permeabilidad secundaria del acceso aumentan las posibilidades de infección.
Las complicaciones de la infección de un acceso protésico no se limitan a implicaciones sistémicas de fiebre, sepsis y afección a distancia (endocarditis, artritis, osteomielitis, etc.), sino que también pueden derivar en trombosis del acceso, dehiscencia anastomótica y hemorragia o formación de seudoaneurismas.
Como regla general, la infección de un acceso protésico implica la necesidad de retirar todo el material protésico, con cierre arterial con material autólogo.
Isquemia distal
El robo vascular después de crear un AV es muy común si se usa la definición de inversión de flujo en el flujo de entrada de la arteria distal a la anastomosis: hay inversión de flujo en un 75 % de los accesos autólogos y en un 90 % de los protésicos. Sin embargo, el síndrome de robo sintomático es mucho menos común.
Aunque se observa algo de frialdad y leve hormigueo en los dedos en cerca de un 10 % de los pacientes, la mayoría resuelve los síntomas espontáneamente en las primeras semanas. La isquemia distal afecta a un 3-5 % de los pacientes con AV, con frecuencia decreciente cuanto más distal sea el acceso, y menor en accesos autólogos que en los protésicos (< 1 % en accesos autólogos distalmente al antebrazo y el 9 % en los injertos protésicos).
Ante todo, hay que tener en cuenta que una FAV es una conexión entre una arteria y una vena sin inter-medio de lecho capilar, de manera que al tener un importante gradiente de presión, se produce un aumento de flujo hacia el sistema venoso. Pero además, la baja presión distal que facilita el acceso hace que el flujo se invierta desde las arterias del arco digital y palmar a través de la arteria distal a la anastomosis arterial.
Esta inversión de flujo, que se ha demostrado que ocurre en la mayoría de los nuevos accesos, no siempre genera un síndrome de robo sintomático. Hay ciertos factores de riesgo o favorecedores, que son: la arteriopatía periférica, la arteriopatía diabética, la edad avanzada, la realización previa de FAV ipsolaterales, la existencia de una fístula con elevado flujo, el uso de la arteria braquial como arteria donante frente a arterias más distales, y el uso de injertos protésicos frente a fístulas autólogas.
Entre 1/2 y 2/3 pacientes que sufren robo vascular lo desarrollan dentro de los primeros 30 días. Los síntomas pueden aparecer durante la diálisis o empeorar con ella. Los síntomas son entumecimiento y dolor progresivo, frialdad, palidez, disminución de la sensibilidad, úlceras isquémicas, gangrena y atrofia muscular.
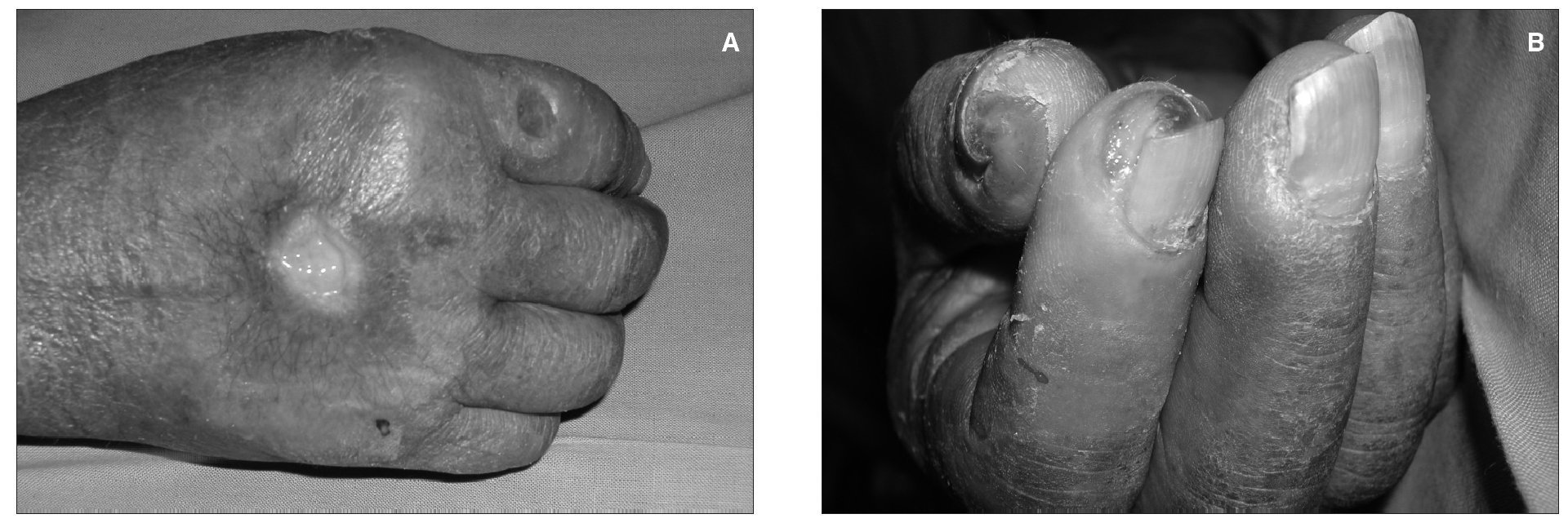
Podemos distinguir cuatro estadios de menor a mayor intensidad. Estadio I: hay palidez y/o frialdad de la mano, sin dolor franco; se observa algo de frialdad y leve hormigueo en los dedos en cerca de un 10 % de los pacientes y la mayoría resuelven los síntomas espontáneamente en las primeras semanas. En el estadio II: dolor durante el ejercicio y/o la HD; las isquemias en estadio I y gran parte en el estadio II remiten o mejoran espontáneamente y no requieren tratamiento. En el estadio III: dolor en reposo. En el estadio IV: úlceras, necrosis o gangrenas, localizadas en los dedos, la isquemia es grave y se requiere tratamiento (fig. 3).
Figura 3. Isquemia distal.
El diagnóstico se realiza por la clínica (entumecimiento, dolor progresivo, palidez, disminución de la sensibilidad, úlceras isquémicas, gangrena y atrofia muscular) y la exploración física. Los pulsos distales suelen ausentarse mientras la fístula permanece permeable, y recuperarse durante la compresión manual. Una más completa evaluación de la isquemia se realiza mediante métodos diagnósticos no invasivos, como la pletismografía digital, medición de la presión digital y del índice dedo-brazo, la eco-Doppler y la medición transcutánea de O2. Todas estas pruebas deben realizarse con el acceso funcionante y durante la compresión. Se considera isquemia grave cuando la presión digital es ≤ 50 mmHg o un índice dedo-brazo es < 0,6. Si se sospechan lesiones arteriales, se puede realizar una arteriografía con y sin compresión de la fístula.
Los cambios neurológicos en las manos y en el ante-brazo hay que diferenciarlos de neuropatías por atrapamiento como el síndrome del túnel carpiano, la neuropatía diabética o urémica y la neuropatía monomélica isquémica. El dolor óseo debido al hiperparatiroidismo también puede parecerse a los síntomas neuropáticos. Una mano caliente, con pulso radial palpable, indica un diagnóstico diferente del robo. Un estudio electromiográfico puede ayudar a un diagnóstico más preciso.
No se ha demostrado ninguna prueba preoperatoria fiable para predecir quién tendrá síndrome de robo: lo más importante para su prevención es una correcta valoración preoperatoria de los factores de riesgo y una adecuada exploración física, que incluya la exploración de pulsos y soplos, la medición de la presión arterial en ambos brazos para descartar estenosis del flujo de entrada y una prueba de Allen manual o con Doppler.
Una vez establecido el síndrome, hay pacientes con síntomas leves, en estadios I y II, que pueden beneficiarse de una conducta expectante, ya que la mayoría mejora espontáneamente en unas semanas. Estos pacientes requieren un seguimiento regular y frecuente, ya que los síntomas pueden progresar rápidamente y el paciente puede sufrir una lesión permanente. El dolor en reposo o el deterioro motor inmediatamente después de la cirugía requieren una reintervención inmediata. Y por último, los estadios III y IV suelen requerir tratamiento. La ausencia de pulso distal a la anastomosis arterial en ausencia de síntomas clínicos no es una indicación para la intervención.
Dentro de las opciones de tratamiento, la ligadura del acceso es el método más seguro para eliminar el fenómeno del robo, pero evidentemente, esto supone eliminar un acceso funcionante y hace necesaria la creación de uno nuevo y la colocación temporal de un catéter para HD.
Las otras opciones de tratamiento son limitar el flujo en la fístula o la revascularización distal con ligadura a intervalos: el procedimiento DRIL.
En el banding se intenta limitar el flujo hacia la fístula, aumentando su resistencia mediante un estrechamiento de la luz eferente. Este estrechamiento puede hacerse mediante una ligadura parcial o un parche circunferencial, generalmente de PTFE, alrededor de la vena proximal a la anastomosis. Esta segunda opción podría ser más adecuada, ya que una estenosis corta, como la que se consigue con una ligadura simple, produce una disminución pequeña del flujo hasta que alcanza una estenosis crítica: en este punto la resistencia aumentaría exponencialmente y la turbulencia generada promueve la trombosis. La banda más ancha podría generar menos turbulencia. No obstante, los resultados a largo plazo del banding resultan decepcionantes, ya que en ocasiones no se consigue una disminución suficiente del flujo para que desaparezca la isquemia distal o la fístula termina trombosándose.
La técnica DRIL consiste en crear un injerto de derivación (bypass) desde la arteria nativa proximal a la anastomosis arteriovenosa hasta una arteria distal a dicha anastomosis, y ligar la misma arteria justo distal a la anastomosis arteriovenosa, pero proximal a la anastomosis distal del injerto de derivación: este bypass actúa como una colateral de baja resistencia en paralelo, reduciendo la resistencia de la circulación periférica; al reducir la proporción de resistencia entre la circulación periférica y el acceso, la fracción de sangre hacia la fístula disminuye y aumenta la periférica.
Antes de realizar un DRIL, es aconsejable descartar estenosis arteriales tanto de entrada como de salida. Hay que tener en cuenta ciertos factores técnicos para que la técnica DRIL tenga éxito. En el segmento de arteria inmediatamente proximal a la anastomosis arteriovenosa, existe un área de baja presión (fondo de presión), debida a la gran capacitancia del flujo de salida venoso. Localizar el origen del injerto de derivación de 3-5 cm por encima de la anastomosis arteriovenosa es suficiente para evitar este fondo de baja presión, y además evita entrar en la arteria en campo reoperado. Aunque es preferible usar material autólogo, el procedimiento se ha realizado con éxito con prótesis. La anastomosis de salida debe realizarse en la arteria de salida dominante.
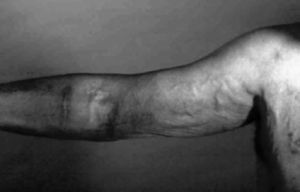
Hipertensión venosa
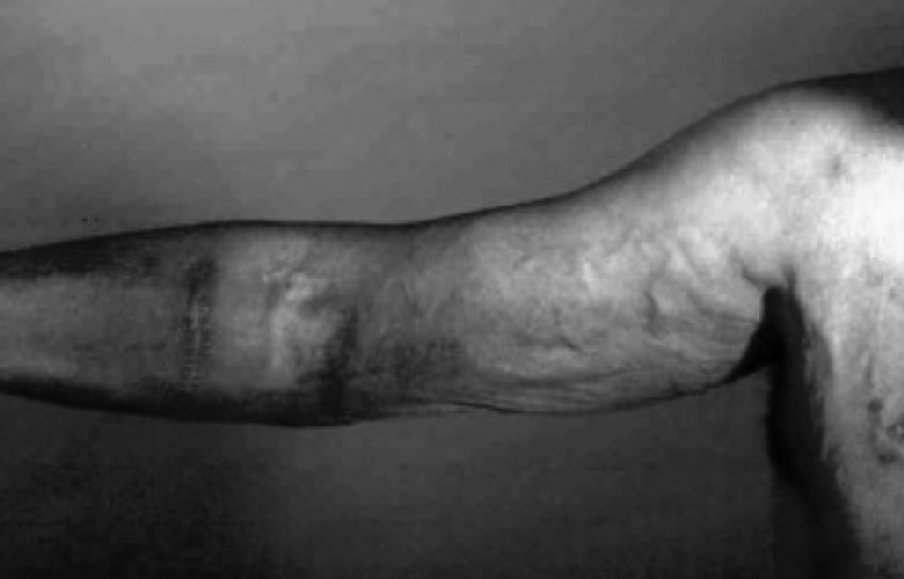
La hipertensión venosa puede causar edema importante de la extremidad (fig. 4). Suele estar causado por estenosis u obstrucción de venas proximales, a menudo en relación con el uso previo de catéteres centrales. Las posibilidades de tratamiento son: la ligadura quirúrgica o mediante embolización del acceso, la angioplastia simple o con stent de la estenosis central o la realización de un bypass axiloyugular.
Figura 4. Hipertensión venosa
Correspondencia: Dra. N. de la Fuente Sánchez.
Servicio de Angiología y Cirugía Vascular.
Hospital de Galdakao-Usansolo.
Barrio Labeaga, s/n. 48960 Galdakao-Usansolo. Bizkaia. España.
Correo electrónico: natalia.delafuentesanchez@osakidetza.net
Bibliografía general
Adams ED, Sidawy AN. Complicaciones no trombóticas de los accesos arteriovenosos para hemodiálisis. En: Rutherford, ed. Cirugía vascular. 6.ª ed. Madrid: Elsevier. p. 1692-706.
Aparicio-Martínez C, Gonzçalez-García A, Del Río-Prego A. Accesos vasculares para hemodiálisis. Complicaciones: infecciones del acceso vascular. Angiología. 2005;57 Supl 2:S129-35.
Bohórquez-Sierra JC, Doiz-Artázcoz E, Arribas-Aguilar F, Bohórquez-Sierra C. Accesos vasculares para hemodiálisis. Complicaciones:
aneurismas verdaderos y falsos, hemorragia y roturas del acceso. Angiología. 2005;57 Supl 2:S117-27.
Sáez-Martín L, Riera del Moral LF, Gutierrez-Nistal M, Estefanov E,
Riera-De Cubas L. Accesos vasculares para hemodiálisis. Otras complicaciones: isquemia distal, hipertensión venosa distal y trombosis de vasos centrales. Angiología. 2005;57 Supl 2:S117-27. SEACV. Accesos vasculares para hemodiálisis. Tratado de las enfermedades vasculares. Barcelona: Viguera; 2006. p. 1255-67.