Actualmente 2 vacunas antineumocócicas están disponibles para uso en adultos: la «clásica» vacuna neumocócica polisacárida tricosavalente (VNP23) y la «nueva» vacuna neumocócica conjugada tridecavalente (VNC13). La principal ventaja de la VNC13 sería su potencial mejor inmunogenicidad, siendo sus principales inconvenientes el elevado coste y la baja cobertura de serotipos en comparación con la VNP23. Las evidencias actualmente disponibles apoyan las siguientes recomendaciones básicas: a)en los adultos con más alto riesgo (básicamente inmunocompromiso y/o asplenia) se recomienda la vacunación dual con ambas vacunas; b)en los sujetos con riesgo elevado (básicamente personas >65 años y pacientes de 15-64años con enfermedad pulmonar o cardiaca crónica, diabetes y/o alcoholismo) se recomienda la vacunación simple con VNP23 (dosis única en primovacunados ≥65años; revacunación a los 5-10años en el caso de primovacunados antes de los 65años), y c)en el resto de adultos (riesgo normal/bajo) no se recomienda la vacunación.
There are currently two anti-pneumococcal vaccines available for use in adults: the classical 23-valent polysaccharide pneumococcal vaccine (PPV23) and the new 13-valent pneumococcal conjugate vaccine (PCV13). The main advantage of the PCV13 is the potentially better immunogenicity, with its major disadvantages being the higher cost and the lower serotype-coverage than the PPV23. The currently available scientific evidence supports the following basic recommendations: (i)among adults with greatest risk (basically asplenia and immunocompromised), a dual vaccination (PCV13+PPV23) is recommended; (ii)among adults with increased risk (basically persons >65years-old and patients 15-64years with chronic pulmonary or heart disease, diabetes and/or alcoholism), a single vaccination with PPV23 is recommended (single dose in primo-vaccinated >65years; re-vaccination at 5-10years in those primo-vaccinated <65years-old); and (iii) in the rest of adults (risk normal/low) vaccination is not recommended.
Streptococcus pneumoniae es un microorganismo del tracto respiratorio que puede causar enfermedad severa, principalmente en niños, ancianos y pacientes inmunocomprometidos. El principal reservorio es la nasofaringe, y sus posibles efectos, cuando la colonización tiene lugar en el organismo, son la persistencia asintomática durante meses (estado de portador) o la progresión hacia la enfermedad. Durante la enfermedad, la bacteria puede invadir los tejidos mucosos adyacentes causando infección de las mucosas (otitis, sinusitis, bronquitis, neumonía no bacteriémica), o también invadir el torrente sanguíneo u otros sitios estériles produciendo una enfermedad neumocócica invasiva (ENI), principalmente neumonía bacteriémica, septicemia y meningitis1.
Se estima que aproximadamente el 80% de las ENI son neumonías neumocócicas (NN) bacteriémicas, que el 80% de las NN cursan sin bacteriemia, y que entre un 10 y un 50% de todas las neumonías adquiridas en la comunidad (NAC) podrían ser causadas por el neumococo. Consecuentemente, existe un solapamiento entre la ENI, la NN y la NAC1,2.
La incidencia de ENI es difícil de estimar. Existen diferencias importantes de incidencia entre países desarrollados, con tasas que incluso se triplican o cuadriplican de unos países a otros. Parece que estas grandes diferencias reflejan en realidad la intensidad de la búsqueda del microorganismo. En otras palabras, en los países donde la incidencia descrita es baja se realizan pocos hemocultivos a pacientes con NAC, mientras que en aquellos países donde la incidencia es alta se realizan hemocultivos con mucha mayor frecuencia. Una cuidadosa comparación de estas variaciones sugiere que en los países desarrollados la incidencia de ENI se sitúa alrededor de 10 casos por 100.000 personas/año en la población general (con tasas que alcanzarían hasta 40-60 por 100.000 en personas mayores de 65años y 120 por 100.000 en individuos inmunocomprometidos)2.
Aunque es difícil de precisar, puesto que muchos casos no son diagnosticados etiológicamente (por ejemplo, por no realizarse hemocultivos, por toma previa de antibióticos o por tratarse de casos que cursan sin bacteriemia), se estima que la incidencia de NN en la población mayor de 65años puede situarse alrededor de 300 casos por 100.000 personas/año (de los que aproximadamente 50 casos serían NN bacteriémicas). En cuanto a la NAC, la incidencia reportada para personas mayores de 60años se sitúa entre 5-40 casos por 1.000 personas/año2.
Además de su estimable incidencia, las infecciones neumocócicas son una importante causa de mortalidad, especialmente entre los niños menores de 2 años, en países no desarrollados y en adultos con condiciones médicas de riesgo y/o edad avanzada1,2.
En general, la población adulta puede clasificarse en 3 estratos o grupos de riesgo según la presencia o no de factores que aumentan la susceptibilidad y el riesgo de enfermedad neumocócica grave y/o frecuente (tabla 1). El estrato1 (individuos con riesgo alto/muy alto) básicamente incluye pacientes con asplenia anatómica o funcional y pacientes inmunocomprometidos. El estrato2 (individuos con riesgo incrementado/elevado) incluye las personas mayores de 65años (estrato2a) y las personas de 15-64años inmunocompetentes con ciertas comorbilidades o condiciones de riesgo tales como enfermedad pulmonar o cardiaca crónica, hepatopatía severa, diabetes mellitus, abuso de alcohol y tabaquismo (estrato2b). El estrato3 (riesgo normal/bajo) incluye las personas sin ninguna de las condiciones mencionadas en los estratos1 o 23-7.
Estratos de riesgo para la enfermedad neumocócica en los adultos
| Estrato 1 (riesgo alto/muy alto) Personas con asplenia anatómica o funcional y/o condiciones asociadas a inmunocompromiso tales como inmunodeficiencias congénitas o adquiridas, infección por VIH, insuficiencia renal y síndrome nefrótico, leucemia, linfoma, enfermedad de Hodgkin, mieloma múltiple y otras neoplasias, trasplantes, tratamientos inmunosupresores incluyendo corticoides sistémicos (20mg/día de prednisona o equivalente) y/o radioterapia. Personas con fístulas de LCR y/o implante coclear |
| Estrato 2 (riesgo incrementado/elevado) 2a: personas mayores de 65 años (con o sin factores de riesgo) 2b: personas de 15-64 años con antecedente de enfermedad neumocócica invasiva demostrada, enfermedades crónicas y/o determinados factores de riesgo tales como enfermedad respiratoria crónica (incluyendo EPOC y asma), cardiopatía, hepatopatía severa, diabetes mellitus, alcoholismo y/o tabaquismo |
| Estrato 3 (riesgo normal/bajo) Personas de 15-64 años sin condiciones de riesgo |
La infección por S. pneumoniae debe abordarse desde 2 frentes: antibioterapia específica e inmunización activa1-7. La antibioterapia específica no ha logrado ser totalmente satisfactoria porque no se ha conseguido disminuir la mortalidad en los 3 primeros días de enfermedad, y además el porcentaje de neumococos resistentes a antibióticos de uso habitual ha aumentado.
En cuanto a la inmunización activa, la existencia de más de 90 serotipos neumocócicos distintos (diferentes en su composición química, potencial inmunogenicidad e impacto epidemiológico) ha complicado enormemente el desarrollo y la evaluación de vacunas antineumocócicas8. En la actualidad, la vacunación puede realizarse en los adultos con una vacuna neumocócica polisacárida que contiene 23 serotipos (VNP23) o con una vacuna neumocócica conjugada que contiene 13 serotipos (VNC13).
En nuestro país, antes de la introducción de la VNC13 (comercializada en 2010) se había observado escasa diferencia entre la «nueva» VNC13 y la «clásica» VNP23 en cuanto a su potencial cobertura serotípica para prevenir casos de ENI en adultos, habiéndose descrito que la proporción de casos de ENI causados por alguno de los serotipos vacunales ascendía al 62% para la VNC13 y al 69% para la VNP239. Sin embargo, pocos años después de la introducción de la vacuna tridecavalente en pediatría, se ha reportado que la proporción de casos de infección neumocócica en adultos de nuestro país (concretamente en las comunidades autónomas [CC.AA.] de Navarra y Cataluña) que fueron causados por alguno de los 13 serotipos contenidos en la VNC13 descendió al 44-52%, mientras que esta proporción fue del 65-74% para la VNP2310-12. En este mismo sentido, un artículo de revisión que ha evaluado la proporción de casos de ENI en personas mayores de 65años en 6 países ha observado un incremento en el diferencial de cobertura serotípica entre la VNC13 y la VNP23 (desde un diferencial de un 16,3% antes de 2010 hasta un 24,4% en los primeros años tras la comercialización de la VNC13)13. Debe señalarse que en la actualidad las citadas coberturas serotípicas probablemente sean aún menores como consecuencia del uso más extendido de la VNC13 (efecto indirecto por reducción en el número de portadores y la circulación de serotipos de la vacuna conjugada). Según datos de los Centres for Diseases Control (CDC), en la actualidad solo un 20-25% de los casos de ENI y un 10% de los casos totales de NAC en adultos de 65 o más años de edad en Estados Unidos estarían causados por alguno de los VNC13 serotipos5.
Vacunas antineumocócicasDesde 2012 están disponibles 2 vacunas antineumocócicas, la VNC13 y la VNP23, para su posible uso en adultos. La «clásica» VNP23 (comercializada en 1983) ha mostrado una efectividad del 50-70% para prevenir ENI en adultos inmunocompetentes, aunque el efecto protector frente a neumonía es discutido14. La «nueva» VNC13 fue comercializada en 2010 para «sustituir» a la pionera VNC7 como vacuna de uso pediátrico. En 2012, tras los buenos resultados observados en niños, fue aceptada la indicación para su posible uso en adultos, y el CDC aprobó la recomendación para la vacunación con la VNC13 (secuencialmente con la VNP23) en pacientes considerados de «alto» riesgo (asplenia anatómica o funcional, inmunocomprometidos, fístulas de LCR y/o implante coclear)4. Desde entonces, el uso de la VNC13 en adultos ha ido extendiéndose progresivamente en la práctica clínica a otros grupos considerados de riesgo «incrementado/elevado»5,6. Hacemos notar, sin embargo, que la efectividad/eficiencia de las distintas alternativas en relación con la vacunación antineumocócica en los adultos en realidad no está clara.
Algunas sociedades profesionales de nuestro país (incluida la Sociedad Española de Medicina Familiar y Comunitaria [semFYC]) recomiendan la vacunación con la «nueva» VNC13 para todos los grupos poblacionales en los que se ha descrito un incremento de riesgo (de cualquier magnitud) para la infección neumocócica, lo cual incluye, además de los pacientes inmunocomprometidos, las personas con enfermedad pulmonar/respiratoria crónica, cardiopatía, hepatopatía, diabetes, alcoholismo y/o los sujetos fumadores6. En contraposición, las autoridades sanitarias de nuestro país solo recomiendan/financian la VNC13 para las personas con más elevado riesgo (básicamente pacientes inmunocomprometidos)7. Por nuestra parte, resaltamos que el hecho de tener un riesgo incrementado de padecer una infección neumocócica (p.ej., pacientes inmunocomprometidos o con otros factores de riesgo) no implica necesariamente que la vacunación de estas personas vaya a ser una medida efectiva y eficiente en la práctica.
Vacuna neumocócica polisacárida tricosavalente (VNP23)La «clásica» VNP23 contiene polisacáridos capsulares purificados de los 23 serotipos más frecuentemente aislados en infecciones invasivas en adultos. La VNP23 provoca una respuesta inmune humoral tipo T-independiente, en la que no se generan células de memoria y no hay efecto booster tras la revacunación. La VNP23 presenta como ventajas su relativamente bajo coste y el alto número de serotipos que incluye (cubriendo actualmente el 60-70% de las infecciones invasivas en adultos)13,15.
Numerosos ensayos clínicos y estudios observacionales, algunos de ellos realizados en nuestro país14,16,17, han evaluado la eficacia/efectividad de la VNP23 en distintas poblaciones a lo largo de los últimos años. Según la última revisión Cochrane14, la VNP23 tiene una efectividad del 74% frente a ENI por serotipos vacunales, del 53% frente a NN no bacteriémica y del 29% frente a NAC por cualquier etiología.
Como principales limitaciones (ligadas a su mecanismo de acción T-independiente), la VNP23 no es inmunogénica en niños pequeños, es pobremente inmunogénica en individuos inmunocomprometidos, no genera memoria inmunitaria, los niveles de anticuerpos disminuyen con el tiempo (pudiendo ser necesaria la revacunación a los 5-10 años), provoca un cierto fenómeno de tolerancia inmunitaria (hiporrespuesta en vacunaciones sucesivas, especialmente si el intervalo intervacunación es corto) y no actúa sobre la colonización nasofaríngea14,18.
Vacuna neumocócica conjugada tridecavalente (VNC13)La VNC13, inicialmente comercializada para uso infantil en 2010, contiene 13 tipos de polisacáridos capsulares conjugados con una proteína transportadora, lo cual convierte la vacuna en T-dependiente, proporciona una respuesta de anticuerpos más potente que la VNP23 para algunos serotipos, puede emplearse en cualquier edad (a partir de las 6 semanas de vida) y genera memoria inmunitaria (efecto booster tras la revacunación)19. Como desventajas, la VNC13 es considerablemente más cara que la VNP23 y tiene una menor cobertura de serotipos (cubriendo solo el 40-50% de los casos de ENI en los adultos actualmente en nuestro ámbito)10,11,13,15. Además, es previsible que el valor protector de la VNC13 en los adultos decrezca a medida que se implante la vacunación universal con esta vacuna en los niños (efecto indirecto por reducción de la circulación de los 13 serotipos contenidos en la vacuna)13,18.
Dos estudios evaluando la inmunogenicidad de la VNC13 en adultos han reportado que proporciona una respuesta de anticuerpos significativamente superior a la VNP23 para 8 de los 12 serotipos comunes20,21, aunque la traducción clínica de este hecho es incierta, puesto que hasta la fecha no se ha podido establecer con precisión cuál sería el nivel mínimo/óptimo necesario de anticuerpos específicos y su correlación con la efectividad clínica22.
Hasta la fecha solo se ha realizado un ensayo clínico evaluando la efectividad clínica de la VNC13 en adultos (el ensayo clínico CAPITA, que incluyó 85.000 personas mayores de 65años en Holanda)23. Este ensayo clínico (que se inició en 2008 pero cuyos resultados finales no han sido publicados hasta 2015) ha reportado una eficacia del 75% frente a ENI y del 46% frente a NN no bacteriémica (datos esencialmente similares a los estimados para la VNP23 en la última revisión Cochrane)14.
A destacar que en el ensayo CAPITA la VNC13 no ha mostrado eficacia significativa en el subgrupo de pacientes inmunocomprometidos (que son precisamente aquellos en quienes más se recomienda esta vacuna). A destacar también que en el mencionado ensayo CAPITA el número total de casos prevenidos fue relativamente bajo (concretamente 21 casos de ENI y 27 de NN no bacteriémica sobre una población total de más de 300.000 personas-año23), lo cual no sugiere un buen nivel de eficiencia (coste-efectividad) de la vacunación.
Ventajas e inconvenientes de VNP23 versus VNC13 en adultosTeóricamente, la principal ventaja de la VNC13 sería su potencial mejor inmunogenicidad, y su principal inconveniente el hecho de que se dirige contra un número reducido de cepas circulantes. La principal desventaja de la VNP23 sería que podría resultar menos inmunogénica que la VNC13 en algunos individuos (especialmente en los inmunocomprometidos), siendo sus principales ventajas el menor coste y la teórica protección contra 10 serotipos adicionales. En la práctica, pese a que la principal ventaja teórica de la VNC13 sería su potencial mejor inmunogenicidad (T-dependiente) en relación con la VNP23 (T-independiente), en realidad una mayor eficacia clínica no ha podido ser demostrada en población adulta. Obvias desventajas de la VNC13 son el mayor coste y la limitada cobertura de serotipos.
Puede argumentarse que la VNC13 ofrece como ventaja el hecho de que podría proporcionar probablemente una protección más prolongada que la VNP2315. Sin embargo, incluso la promesa de una protección más larga en el tiempo puede no ser una ventaja si 5 años después de vacunar con la VNC13 a los adultos, como consecuencia de la vacunación rutinaria de los niños, la carga de enfermedad neumocócica por los 13 serotipos sea ya tan baja en la población que resultase innecesaria la vacunación/revacunación de los adultos.
Al contrario de lo que algunos expertos y sociedades profesionales sugieren6, la pregunta sobre «qué vacuna antineumocócica es mejor en los adultos» continúa abierta. Es más, se ha postulado que la vacunación antineumocócica no sería necesaria en los adultos después de la introducción universal de la VNC13 en pediatría (contando con el beneficio indirecto que se obtiene simplemente con la vacunación de los niños).
Recomendaciones sobre la vacunación antineumocócica en los adultosEn la actualidad se plantean 4 posibles escenarios sobre vacunación antineumocócica en los adultos: a)mantener la recomendación de la «clásica» VNP23; b)cambiar la VNP23 por la «nueva» VNC13 en todos o algunos subgrupos a riesgo; c)añadir la VNC13 a la VNP23 en todos o algunos subgrupos, y d)incorporar la VNC13 como vacunación universal en pediatría y considerar innecesaria la vacunación de los adultos (confiando en un efecto protector indirecto). En este sentido, en enero de 2015 el Pleno del Consejo Interterritorial del Sistema Nacional de Salud en nuestro país aprobó incorporar la vacunación infantil universal con la VNC13 en los calendarios de vacunación infantil de todas las CC.AA. en un plazo de 2años24.
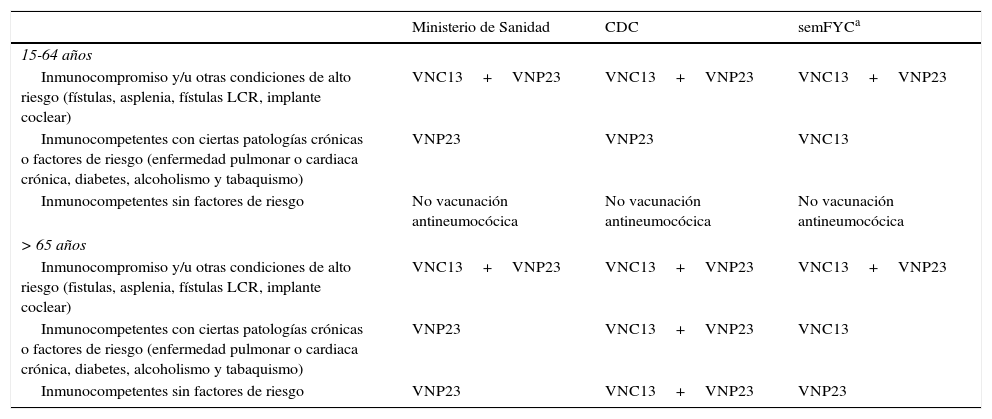
En nuestro ámbito existen actualmente 3 pautas de recomendaciones diferentes (no homogéneas/divergentes) respecto a la vacunación antineumocócica en los adultos: a)CDC; b)semFYC, y c)Ministerio de Sanidad y Departamentos de Salud de las distintas CC.AA.3-7 (tabla 2).
Comparación de las distintas recomendaciones para la vacunación antineumocócica en adultos según el Ministerio de Sanidad, CDC y semFYC
| Ministerio de Sanidad | CDC | semFYCa | |
|---|---|---|---|
| 15-64 años | |||
| Inmunocompromiso y/u otras condiciones de alto riesgo (fístulas, asplenia, fístulas LCR, implante coclear) | VNC13+VNP23 | VNC13+VNP23 | VNC13+VNP23 |
| Inmunocompetentes con ciertas patologías crónicas o factores de riesgo (enfermedad pulmonar o cardiaca crónica, diabetes, alcoholismo y tabaquismo) | VNP23 | VNP23 | VNC13 |
| Inmunocompetentes sin factores de riesgo | No vacunación antineumocócica | No vacunación antineumocócica | No vacunación antineumocócica |
| > 65 años | |||
| Inmunocompromiso y/u otras condiciones de alto riesgo (fistulas, asplenia, fístulas LCR, implante coclear) | VNC13+VNP23 | VNC13+VNP23 | VNC13+VNP23 |
| Inmunocompetentes con ciertas patologías crónicas o factores de riesgo (enfermedad pulmonar o cardiaca crónica, diabetes, alcoholismo y tabaquismo) | VNP23 | VNC13+VNP23 | VNC13 |
| Inmunocompetentes sin factores de riesgo | VNP23 | VNC13+VNP23 | VNP23 |
Respecto al uso de la VNP23, el CDC y el Ministerio básicamente coinciden en sus recomendaciones, con la salvedad de que mientras ellos recomiendan la vacunación universal a las personas mayores de 65años, algunas CC.AA. lo hacen a partir de los 60años3,7. Ello implica que el CDC no recomienda una segunda dosis en las personas mayores de 65años (excepto aquellos con determinadas condiciones de riesgo que ya hubieran recibido una primera dosis antes de los 65años), mientras que el seguimiento estricto de la pauta de las CC.AA. en las que se recomienda la vacunación a los 60años implicaría revacunarlos posteriormente (puesto que es recomendación general poner una segunda dosis de VNP23 a los 5años si la primera dosis se puso antes de los 65años)3,7.
Con respecto a la VNC13, el CDC y el Ministerio coinciden para la franja de 15-64años4,7, pero difieren en su recomendación para los mayores de 65años (el CDC recomienda la VNC13 secuencialmente con la VNP23 en todas las personas mayores de 65años5, mientras que el Ministerio y las CC.AA. en general solo indican la VNC13 para inmunocomprometidos y personas de muy alto riesgo)7.
Por su parte, distintas sociedades profesionales en nuestro país (incluida semFYC) recomiendan el uso de la VNC13 de forma mucho más amplia que el CDC, el Ministerio y las CC.AA., ampliando su recomendación a las personas del estrato de riesgo2 (inmunocompetentes con enfermedades crónicas o factores de riesgo)6. En este sentido, debe resaltarse que en España la Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia solo incluye la prestación farmacéutica de la VNC13 con cargo a fondos públicos para adultos con las siguientes indicaciones: inmunosupresión (enfermedad de Hodgkin, leucemia, linfoma, mieloma múltiple, insuficiencia renal, síndrome nefrótico, trasplante de órgano sólido o de células hematopoyéticas, tratamiento quimioterápico e infección por VIH). Por su parte, algunas CC.AA. han ampliado estas indicaciones, incluyendo también la financiación pública de la VNC13 para personas con antecedente comprobado de ENI7. En general, para los pacientes del estrato de riesgo2 (pacientes inmunocompetentes con bronquitis crónica, asma, insuficiencia cardiaca, diabetes, tabaquismo) no existe en estos momentos financiación pública, por lo que los usuarios deben abonarla íntegramente en el caso de que les sea prescrita.
ConclusionesLas infecciones neumocócicas continúan representando una importante causa de morbimortalidad, especialmente entre los adultos de alto riesgo y las personas de edad avanzada. En espera de los posibles efectos protectores indirectos en los adultos derivados de la vacunación antineumocócica infantil universal en todas las CC.AA. de nuestro país (aprobada ya por el Consejo Interterritorial del Sistema Nacional de Salud)24, los datos actualmente disponibles apoyan las siguientes recomendaciones básicas para la vacunación antineumocócica en adultos:
- a)
Salvo en el dintel etario (que varía desde 60 a 65años), existe común acuerdo acerca de que debería administrarse una dosis de VNP23 (financiada públicamente en estos pacientes) a todas las personas mayores de 65años (independientemente de que tengan o no condiciones de riesgo). No se recomiendan revacunaciones sistemáticas en estas personas (salvo que hubiesen sido primovacunadas con la VNP23 antes de los 65años).
- b)
Según los CDC y el Ministerio de Sanidad, en las personas de 15-64años inmunocompetentes pero con algunas condiciones de riesgo elevado (estrato de riesgo2 que incluye básicamente pacientes con enfermedad pulmonar/respiratoria crónica, cardiopatía, hepatopatía, diabetes, abuso de alcohol y/o tabaquismo) se recomienda también la vacunación con la VNP23 (con revacunación a los 5-10años en este caso). Alternativamente, según algunas sociedades profesionales (incluida semFYC), estos pacientes «inmunocompetentes con condiciones de riesgo elevado» deberían recibir «preferiblemente» la VNC136; sin embargo, en nuestra opinión, esta recomendación (además de ser onerosa para los pacientes puesto que solo se financia públicamente la VNP23 en estas personas) podría incurrir en inadecuada práctica clínica, puesto que se estaría privando a estos pacientes de protección frente a 11 serotipos neumocócicos incluidos en la VNP23 y no en la VNC13 (los cuales son responsables de aproximadamente un 20% de todos los casos de ENI actualmente en adultos)10,11,13. Es indudable que la vacunación dual (VNC13+VNP23) podría reportar un beneficio individual a estos pacientes, pero tal recomendación parece poco eficiente desde una perspectiva de salud pública.
- c)
Existe unanimidad (CDC, Ministerio de Sanidad y semFYC) en el hecho de que los pacientes considerados como de «muy alto» riesgo (básicamente personas inmunocomprometidas, asplenia anatómica o funcional, fístulas de LCR y/o implante coclear) deben recibir una vacunación antineumocócica dual (preferiblemente VNC13+VNP23 con un intervalo mínimo de 8semanas, o alternativamente VNP23+VNC13 con un intervalo mínimo de 12meses).
En nuestra opinión, con el fin de facilitar y homogenizar la práctica asistencial, las diferentes recomendaciones existentes actualmente sobre vacunación antineumocócica en adultos (confusas, imprecisas y divergentes en algunos casos) deberían ser uniformizadas. En cualquier caso, las vigentes recomendaciones de consenso de algunas sociedades profesionales españolas (en las que se incluye semFYC) publicadas en septiembre de 20136 deberían ser actualizadas en base a las más recientes evidencias disponibles tras la publicación final de los resultados del ensayo clínico CAPITA en marzo de 201523.
En los próximos años, las actuales recomendaciones deberán ser reexaminadas en base a nuevas evidencias provenientes de estudios que evalúen el impacto y la efectividad de la VNC13 en los adultos (incluyendo comparación directa entre VNC13 y VNP23), la evolución de la incidencia de infecciones neumocócicas en niños y adultos y la posible tendencia a un descenso de la utilidad de ambas VNC13 y VNP23 en el medio plazo. En el futuro, la comercialización de nuevas vacunas conjugadas incorporando progresivamente más serotipos (p.ej., VNC15) y el probable desarrollo de vacunas de nueva tecnología (con posible protección completa independientemente del serotipo) podrán comportar también cambios importantes en las actuales recomendaciones.
- •
Las infecciones neumocócicas representan una importante causa de morbimortalidad, especialmente en pacientes de elevado riesgo y/o edad avanzada.
- •
Actualmente dos tipos de vacunas antineumocócicas están disponibles para su posible uso en adultos: la “clásica” vacuna neumocócica polisacárida tricosavalente (VNP23) y la “nueva” vacuna neumocócica conjugada tridecavalente (VNC13).
- •
La VNP23 tiene un bajo coste, ofrece una aceptable cobertura de serotipos y ha mostrado una efectividad del 40-60% para prevenir enfermedad neumocócica invasiva y neumonía neumocócica en adultos inmunocompetentes. La VNC13 ofrece mejor respuesta inmune que la VNP23 para algunos serotipos pero una mayor eficacia/efectividad clínica no ha sido demostrada en los adultos.
- •
En los adultos de más alto riesgo (básicamente inmunocompromiso y/o asplenia) se recomienda la vacunación dual con ambas vacunas (preferiblemente VNC13+VNP23 con intervalo mínimo de 8 semanas o, alternativamente VNP23+VNC13 con intervalo mínimo de 12 meses).
- •
En las personas inmunocompetentes con riesgo elevado (básicamente personas >65 años y pacientes de 15-64 años con enfermedad pulmonar o cardiaca crónica, diabetes y/o alcoholismo) se recomienda la vacunación simple con VNP23
- •
En las personas de 15-64 años sin condiciones o factores de riesgo para sufrir enfermedad neumocócica no estaría indicada la vacunación.
Los autores agradecen la financiación del Instituto de Salud CarlosIII para el proyecto de investigación «Efectividad clínica de la vacuna antineumocócica conjugada versus vacuna polisacárida 23-valente en adultos mayores de 50años» en la convocatoria correspondiente al año 2015 de concesión de subvenciones de la Acción Estratégica en Salud 2013-2016, del Programa Estatal de Investigación Orientado a los Retos de la Sociedad, en el marco del Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016; con el código expediente PI15/01230, cofinanciado por la Unión Europea a través del Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.