El médico de familia está incorporando la ecografía clínica como técnica de exploración y diagnóstico en su actividad asistencial, del mismo modo que el resto de los especialistas. Su papel generalista lo convierte en un potencial utilizador de todas las posibles aplicaciones de esta técnica, lo cual puede causar un elevado impacto en su capacidad de manejar, enfocar y resolver un gran número de situaciones clínicas. En este artículo nos dedicamos a valorar la utilidad y la efectividad de la ecografía clínica por parte del médico de familia en sus aspectos más novedosos, como son la ecocardiografía clínica y la ecografía pulmonar.
The family doctor incorporates clinical ultrasound as an exploration and diagnosis technique in his care activity, the same way as the rest of the specialists. His generalist role makes him a potential user of all possible applications of this technique, which can provide a high impact on his ability to manage, focus and solve a large number of clinical situations. In this article we focus on assessing the usefulness and reliability of clinical ultrasound performed by the family doctor in their most novel aspects such as focused cardiac ultrasound and lung ultrasound.
La ecografía clínica se ha convertido en una herramienta en manos de cualquier médico asistencial que completa la exploración física, hasta ser invocada como su «quinto pilar»1. Rompiendo los esquemas tradicionales y las resistencias clásicas de los médicos radiólogos y no radiólogos que entendían que adentrarse en su práctica entrañaba más riesgos que beneficios, la ecografía enfocada clínicamente (en inglés, point of care ultrasound o POCUS2) se ha extendido a todas las especialidades médicas, que la han ido incorporando sin eludir en muchos casos el debate de la necesaria formación de quienes la incorporen a su quehacer3–5.
Aunque al hablar de ecografía la mayoría de nosotros aún piensa en las aplicaciones de la esfera abdominal y musculoesquelética, en la actualidad son pocas las utilidades de esta técnica que no se han extendido a especialistas no radiólogos, y esto es más patente en especialidades generalistas como Medicina Interna y Medicina Familiar y Comunitaria, donde ningún escenario es del todo ajeno a nuestra práctica6, y en las que el impacto positivo del uso de la ecografía queda fuera de toda duda.
En esta serie de artículos encaminados a recopilar la utilidad y la fiabilidad de la ecografía clínica realizada por el médico de familia en sus aplicaciones más novedosas vamos a centrarnos en la ecocardiografía y la ecografía pulmonar, dejando para el último lugar de esta serie la ecografía del tiroides, la ecografía en el paciente con traumatismo toracoabdominal y con sospecha de trombosis venosa profunda, sin cerrar la puerta en el futuro a otras como la ecografía ocular o cutánea, que están aún en un horizonte más lejano para el médico de Atención Primaria (AP).
EcocardiografíaPor su accesibilidad y los datos que proporciona, la ecocardiografía es una prueba diagnóstica imprescindible en la evaluación de cualquier paciente con sospecha de cardiopatía, pues permite obtener información en tiempo real de la anatomía y de la funcionalidad cardiaca. Como toda ecografía, es muy dependiente del operador, por lo que los estudios reglados requieren una adecuada formación7,8. No obstante, la ecografía cardiaca no ha permanecido ajena al auge que la ecografía clínica ha experimentado en los últimos años, y son muchas las especialidades médicas que la han incorporado a su práctica clínica habitual2,9. En el ámbito de la AP española es la aplicación ecográfica menos extendida a pesar de la disponibilidad de los cardiólogos para liderar la formación de los no cardiólogos en este campo10,11. La necesidad de una sonda y un software específicos ha sido una de las causas fundamentales, pero es tanta la rentabilidad de la prueba, que esperamos que este error sea subsanado en un futuro próximo, ya que diferentes estudios demuestran una alta rentabilidad diagnóstica, con una curva de aprendizaje teórico-práctica relativamente corta11–13.
Técnica de exploraciónLa ecocardiografía 2D permite evaluar la anatomía cardiaca y medir con precisión los espesores parietales y el tamaño de las cavidades. El doppler, en sus distintas modalidades, permite evaluar la velocidad de movimiento de los flujos sanguíneos y de determinadas estructuras cardiacas: el pulsado permite analizar los flujos en zonas concretas (volumen de muestra), pero no registrar flujos de alta velocidad; el continuo permite registrar flujos de alta velocidad, pero evaluando los cambios a la largo de toda la línea de exploración, sin localizar la zona de aceleración; el tisular permite valorar la velocidad de movimiento del tejido miocárdico; y, finalmente, el doppler color permite establecer la dirección del flujo13, representándose en rojo los flujos que se acercan al transductor, y en azul los que se alejan; en el resto de los estudios, el análisis espectral de la velocidad se muestra en un sistema cartesiano, que representa en el eje de las abscisas el tiempo y en el de las ordenadas la velocidad, en el que los flujos que se acercan al transductor generan una curva positiva por encima de la línea basal, y los que se alejan, una negativa.
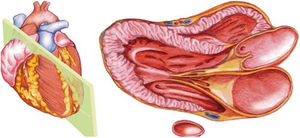
En la ecocardiografía se utilizan sondas sectoriales de baja frecuencia (2 a 5MHz), parecidas a las convex pero con una superficie de contacto con la piel mucho más pequeña, lo que permite evitar la sombra acústica que producen las costillas y mejorar la visión (fig. 1).
El acceso ecográfico al corazón se hace a través de «ventanas» sin interposición de tejido pulmonar (gas) entre su cara anterior y la pared torácica. La estandarización de las imágenes permite comparar los diferentes estudios. Las ecografías regladas requieren la obtención de múltiples planos a través de las 4 ventanas posibles (paraesternal, apical, subcostal y supraclavicular); no obstante, los objetivos diagnósticos de la ecocardioscopia (ecografía clínica no reglada y realizada por no cardiólogos) pueden alcanzarse con un número reducido de planos, siendo recomendable obtener una buena calidad de imagen en al menos 2 de ellos para una correcta valoración del paciente14.
Para acercar la cara anterior del corazón a la pared torácica el paciente ha de colocarse en decúbito lateral izquierdo, con el brazo izquierdo hacia arriba, separado del tórax. Tras terminar los planos paraesternales y apicales, se colocará al paciente en decúbito supino para obtener el plano subcostal o subxifoideo.
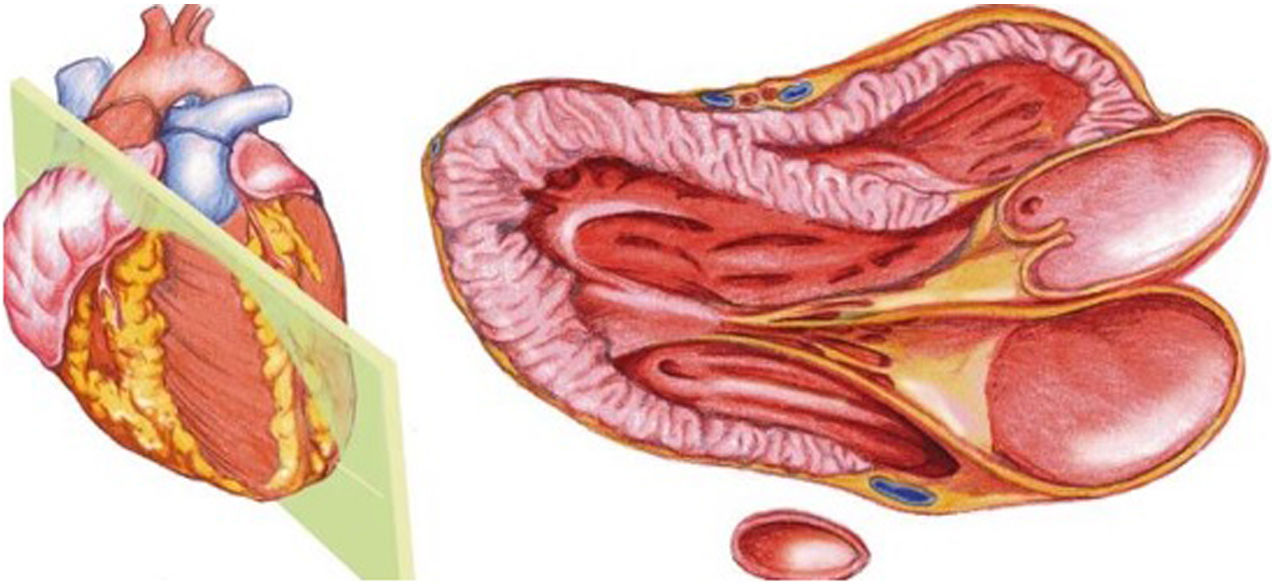
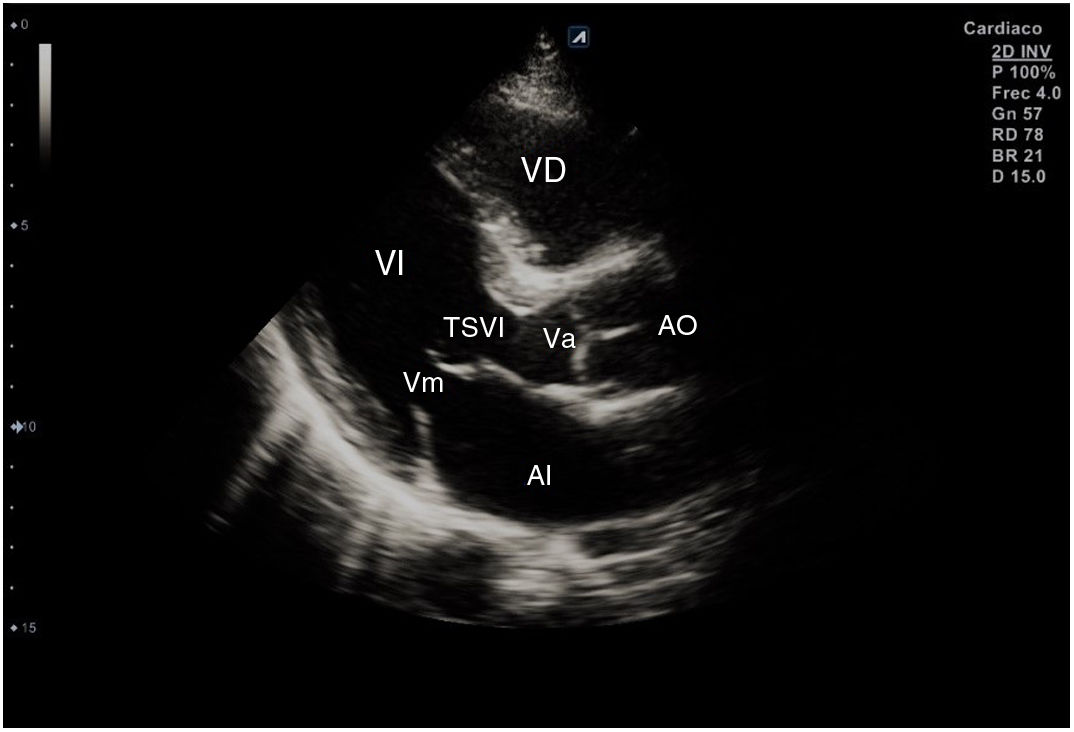
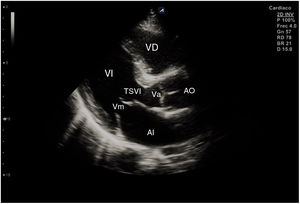
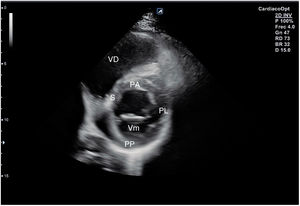
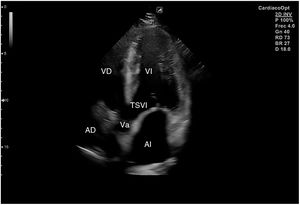
El plano paraesternal de eje largo se obtiene con la sonda sobre el segundo o el tercer espacio intercostal izquierdo, próxima al esternón y perpendicular a la piel, sobre una línea que une el hombro derecho con la cadera izquierda (fig. 2). La zona más próxima al transductor es la pared anterior del ventrículo derecho (VD), siendo también visibles la válvula mitral, la válvula aórtica (valva coronaria derecha y no coronaria), el ventrículo izquierdo (VI), la aurícula izquierda (AI), el tracto de salida del VI con la raíz aórtica, parte de la aorta ascendente y el pericardio. Si el corte es bueno, el septo interventricular anterior y la pared anterior de la aorta deben estar alineadas al mismo nivel y dispuestas de forma perpendicular al plano de estudio. La válvula mitral aparece en el centro de la imagen, de forma que su valva anterior se continúa con la pared posterior de la aorta. La aorta descendente puede verse también por detrás de la AI (fig. 3).
Las medidas a obtener en este plano son: la raíz aórtica (al principio de la sístole ventricular, con las valvas abiertas), la AI (al final de la sístole ventricular), el septo interventricular anterior y la pared posterior (en diástole) y el diámetro diastólico del VI (en telediástole y posición medioventricular, con apertura máxima).
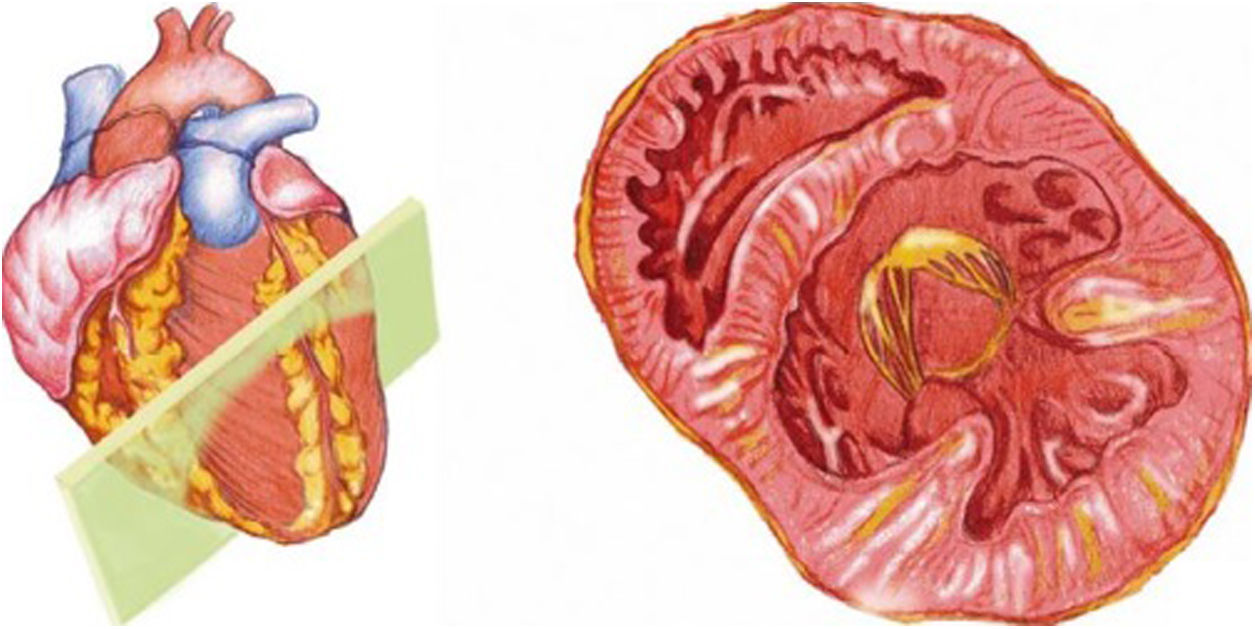
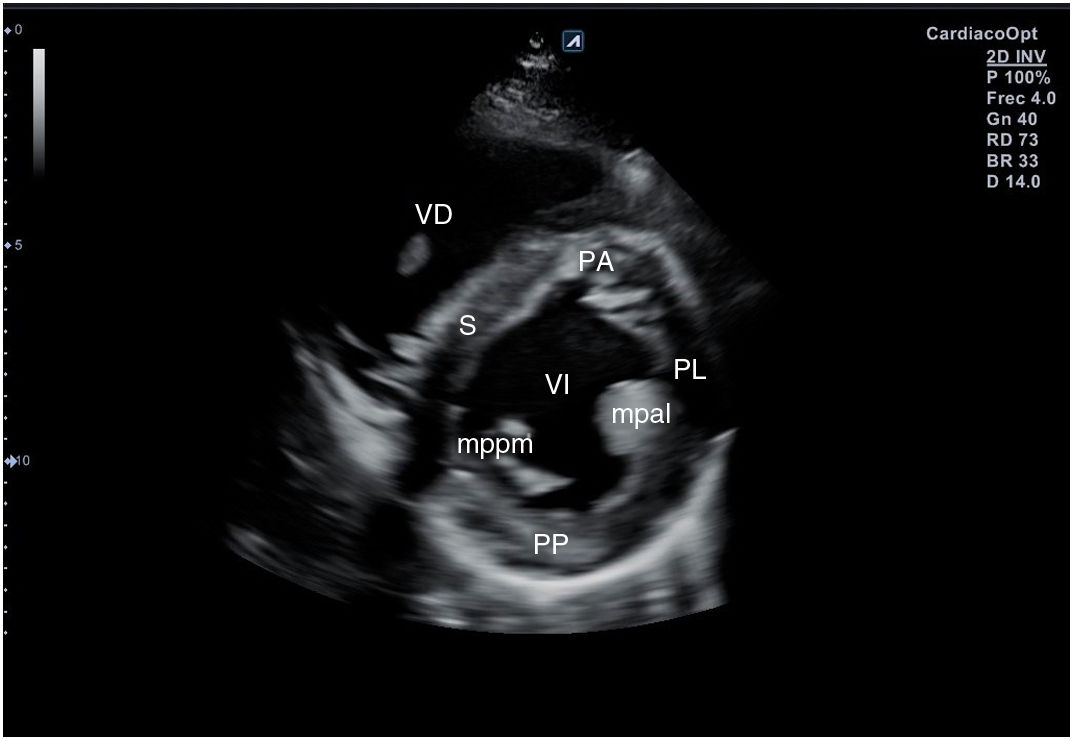
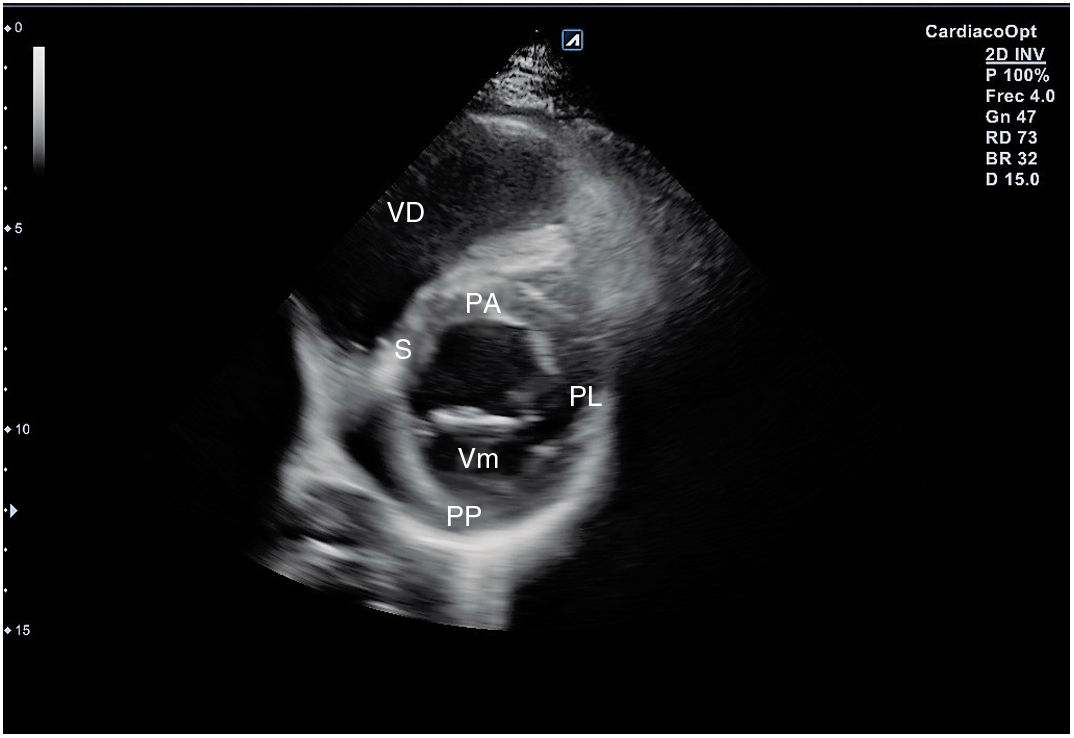
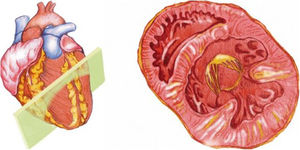
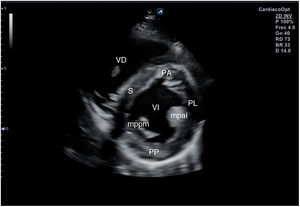
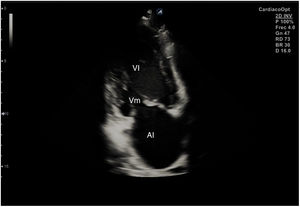
Desde el plano anterior, sin cambiar el apoyo de la sonda, se realiza un giro de 90° en sentido horario, obteniendo el plano paraesternal de eje corto, que es un corte perpendicular al anterior (fig. 4). En este eje, basculando la sonda, se puede cortar de forma transversal el corazón desde el ápex, si se angula hacia la cadera izquierda, pasando por los músculos papilares (fig. 5) hasta la base, donde están la válvula mitral (fig. 6) y aórtica (fig. 7), si se hace hacia el hombro derecho.
En este plano se visualizan todas las paredes del VI. A nivel de la válvula mitral se observa el orificio valvular, sus valvas con las comisuras, el tabique interventricular y las paredes libres de ambos ventrículos.
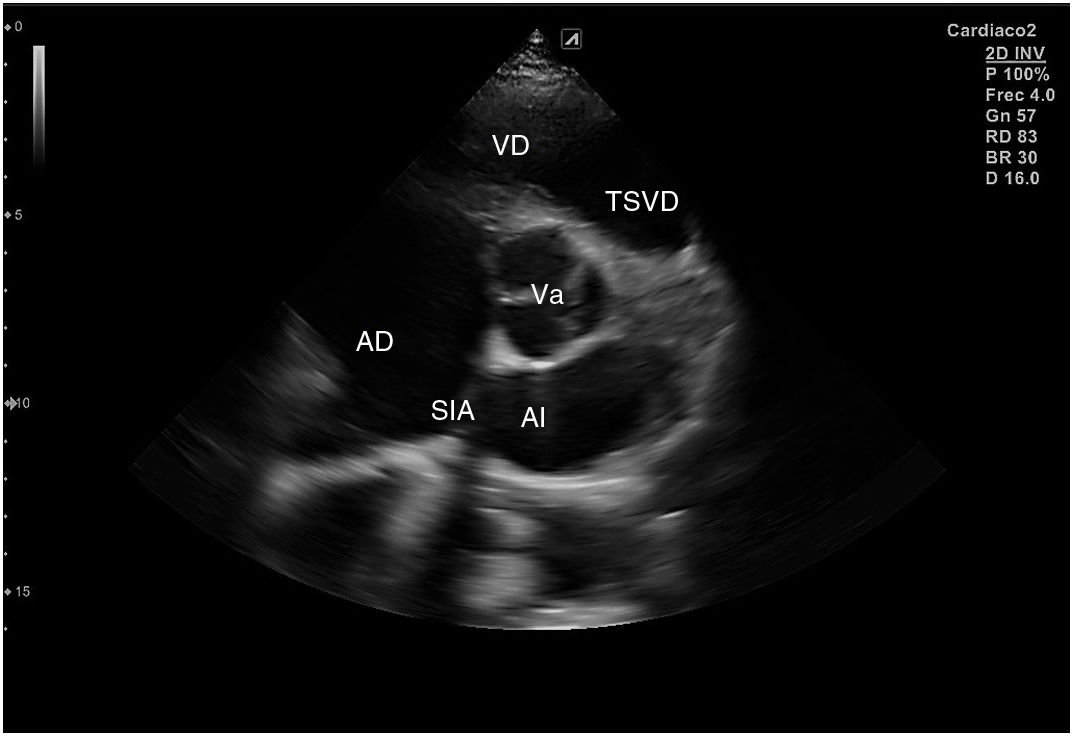
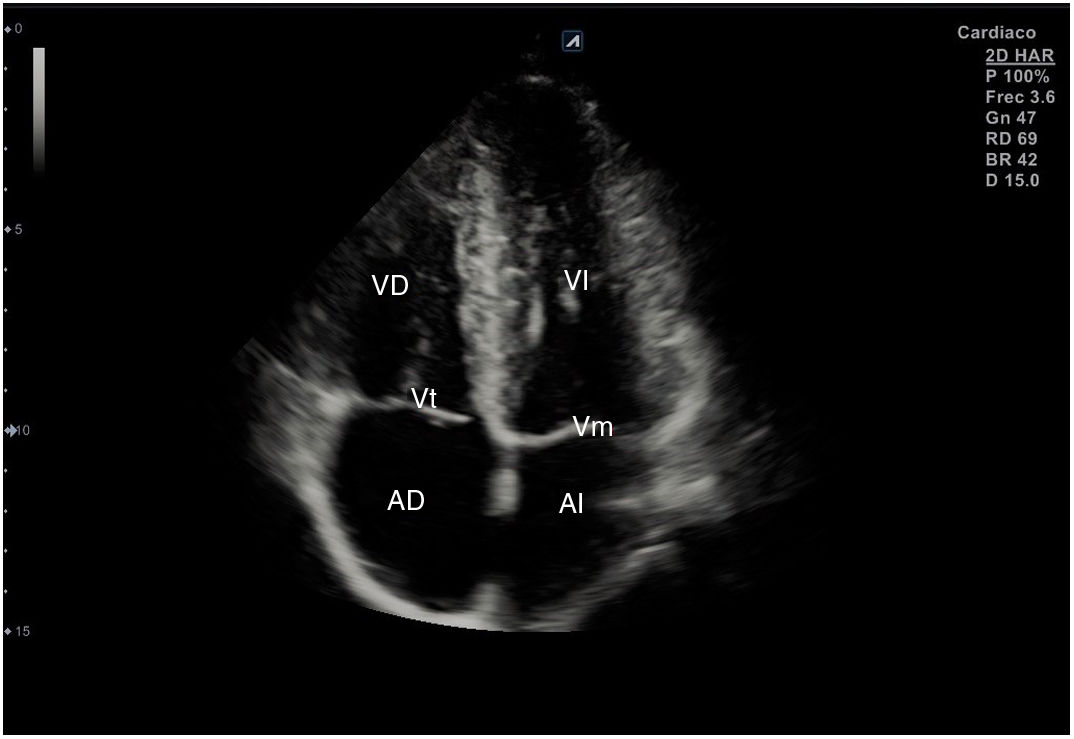
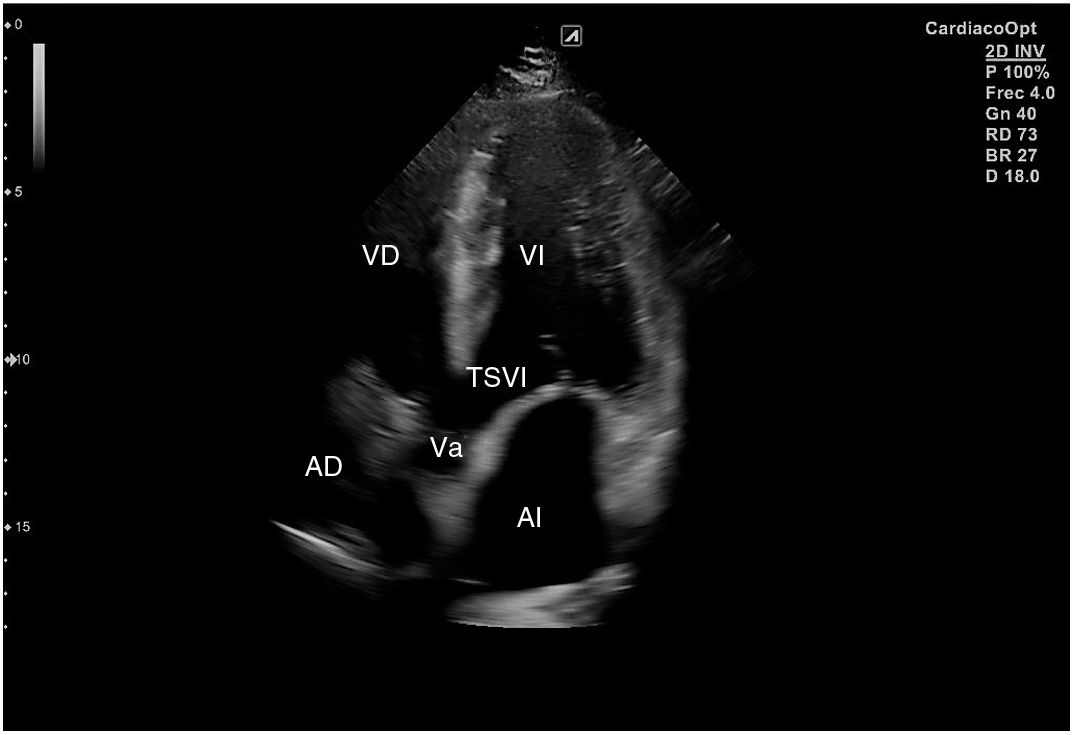
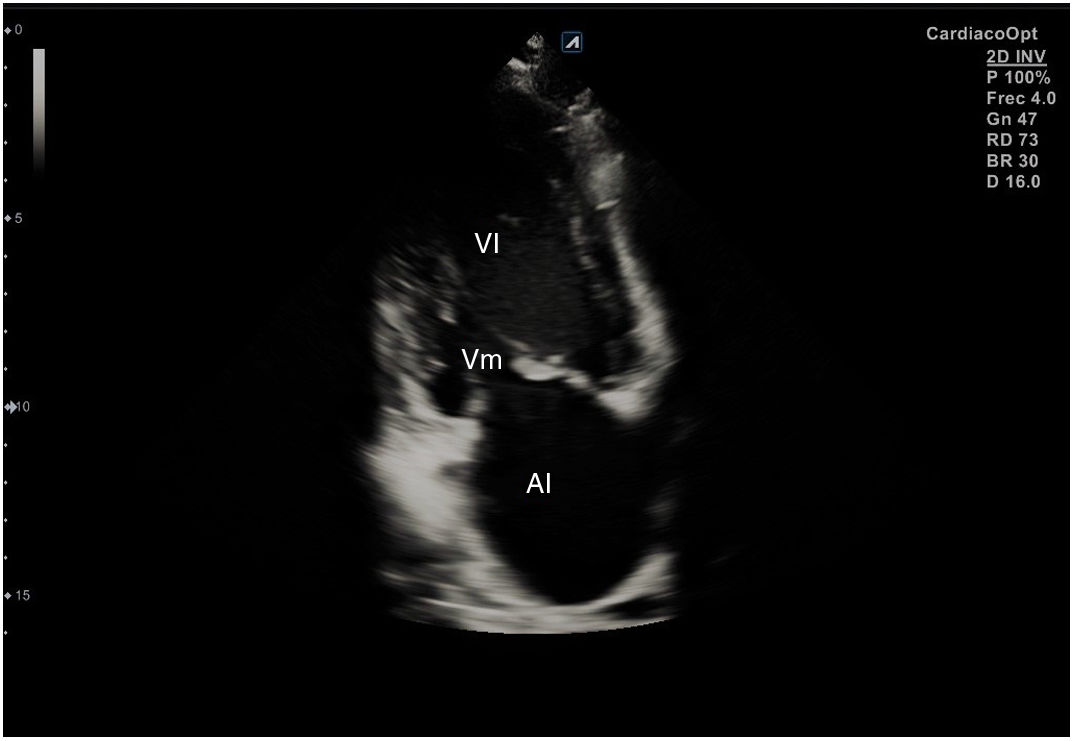
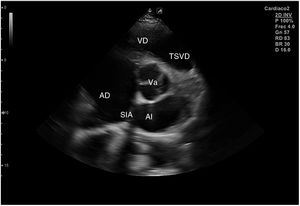
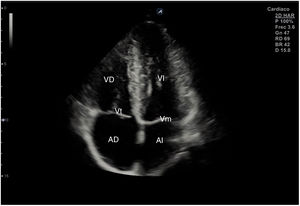
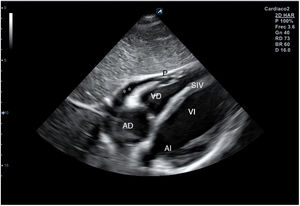
Para obtener los planos apicales la sonda se coloca sobre el latido cardiaco en el ápex, bajo la mamilla izquierda, a la altura del quinto espacio intercostal, con la marca dirigida a la izquierda del paciente y angulado en dirección al hombro derecho. Este plano, apical de 4 cámaras (fig. 8), muestra las 4 cavidades cardiacas y las válvulas auriculoventriculares vistas desde el ápex (fig. 9). En él, el plano del anillo tricuspídeo se sitúa más cerca del ápex que el mitral y el VD se ve más trabeculado. Es la vista de elección para medir la superficie de la AI, comparar el tamaño de ambos ventrículos y descartar la presencia de disfunción y/o dilatación ventricular. Angulando el transductor hacia anterior se obtiene el plano apical de 5 cámaras, que permite observar el tracto de salida del VI y valorar el flujo a través de la válvula aórtica (fig. 10); y al rotarlo 90° en sentido antihorario, el apical de 2 cámaras, que muestra las paredes anterior e inferior del VI (fig. 11).
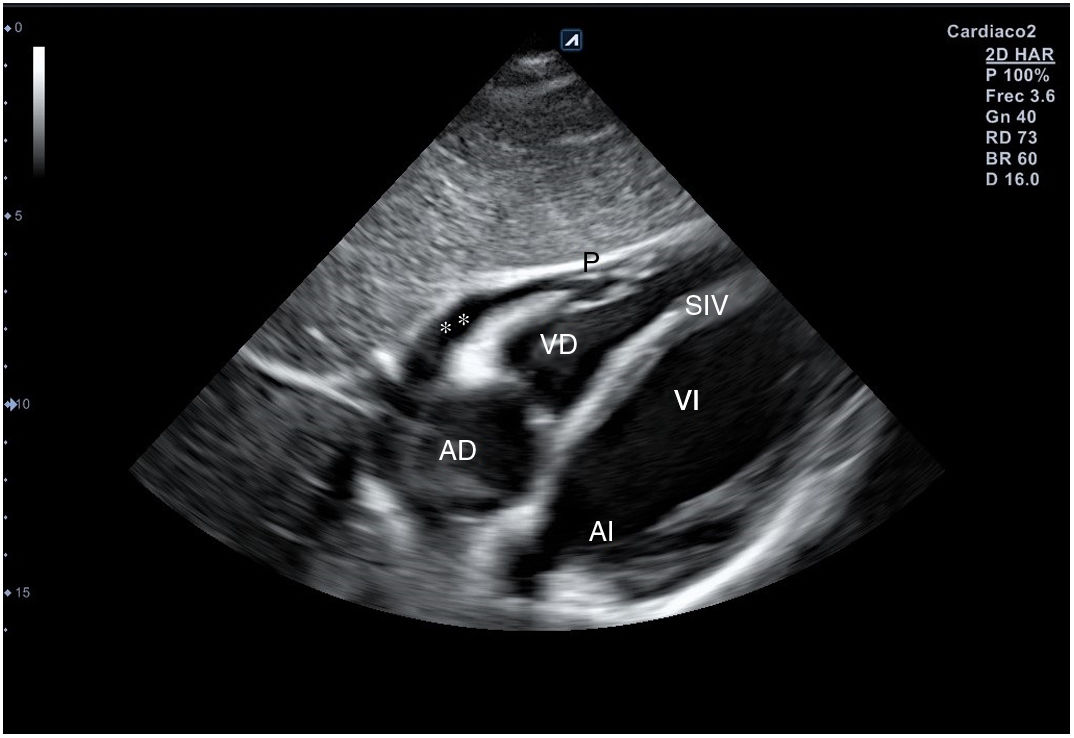
Para obtener el plano subcostal, con el paciente en decúbito supino, se orienta la sonda desde el epigastrio hacia el hombro izquierdo, con una inclinación de unos 15°, utilizando el hígado como ventana acústica. Esta es una ventana muy útil en pacientes con enfermedad pulmonar. En este corte (fig. 12) aparecen las 4 cámaras separadas por sus correspondientes septos; el VD es el más próximo al transductor, por lo que aparece en la parte más superior y próxima en la pantalla.
Objetivos de la ecocardioscopia: escenarios clínicos de aplicación en Atención PrimariaNos referiremos a los objetivos diagnósticos de utilidad clínica, que presentan una elevada concordancia con los estudios reglados y que requieren una curva de aprendizaje corta15.
Valoración de la función sistólica del VI: se recomienda estimarla de forma global y subjetiva en normal y moderada o severamente deprimida, ya que diversos estudios de validación han mostrado un alto nivel de concordancia con los métodos cuantitativos16. La valoración objetiva mediante los métodos Teicholz y Simpson queda fuera de los objetivos de la ecocardiografía clínica; no obstante, en situaciones de función sistólica moderadamente deprimida, puede ser útil evaluar la fracción de eyección del VI mediante la excursión sistólica del plano del anillo mitral17,18, o la medición de la separación entre la válvula anterior de la mitral y el septo interventricular (punto E)19.
Las alteraciones cardiacas estructurales, como la dilatación/hipertrofia del VI o la dilatación de la AI, son sencillas de identificar y aportan información significativa sobre la situación cardiaca20.
La evaluación de la función del VD también se puede hacer de forma subjetiva. La detección de un VD dilatado (diámetro telediastólico del VD mayor que el del VI en el plano apical de 4 cámaras, siempre que el VI no esté dilatado) implica una disfunción del VD; además, la medición de la excursión sistólica del plano del anillo tricuspídeo es un método sencillo para cuantificar la disfunción sistólica del VD que aporta información pronóstica adicional en determinados escenarios clínicos (la insuficiencia cardiaca, el embolismo pulmonar21).
La ecografía es el método de elección para el diagnóstico del derrame pericárdico y la evaluación del taponamiento cardiaco. Numerosos estudios han demostrado la alta capacidad diagnóstica de los «no cardiólogos» en la detección del derrame pericárdico y en la evaluación del taponamiento mediante el colapso de las cavidades derechas22, aunque el diagnóstico de taponamiento es un diagnóstico clínico que no debe basarse solo en criterios ecográficos.
También se ha verificado la capacidad de los «no cardiólogos» para evaluar la volemia e inferir de forma indirecta la presión venosa central mediante la estimación del diámetro y la colapsabilidad de la vena cava inferior23. Esta medida es muy útil para identificar a los pacientes que precisan reposición de volumen cuando su diámetro está disminuido y el índice de colapsabilidad es alto; y, por el contrario, una vena cava inferior dilatada y no colapsable en pacientes con cardiopatía estructural es un signo indirecto de hipertensión pulmonar y un marcador de mal pronóstico en los pacientes con insuficiencia cardiaca. Su evaluación permite, por tanto, establecer balances hídricos sin necesidad de recurrir a la canalización de vías centrales para la monitorización de la presión venosa central en pacientes no críticos.
La detección de alteraciones valvulares significativas (apertura limitada, regurgitaciones, alteraciones anatómicas) ha demostrado una alta fiabilidad como método de despistaje cuando es realizada por médicos con un entrenamiento limitado24; no obstante, la cuantificación de la gravedad de las distintas valvulopatías está fuera de los objetivos de la ecocardiografía clínica.
La ecocardiografía clínica también permite detectar las alteraciones segmentarias de la contractilidad, la existencia de masas, trombos o vegetaciones intracardiacas, o la presencia de signos indicativos de disección aórtica, como la presencia de una aorta ascendente dilatada; pero, del mismo modo, todos estos hallazgos requieren confirmación mediante estudios reglados.
Utilidad de la ecocardiografía clínica en Atención PrimariaPor lo general, los escenarios clínicos de la enfermedad cardiovascular en el ámbito de la AP se caracterizan por la mayor ambigüedad de su presentación clínica y por afectar a una población con múltiples factores de riesgo cardiovascular, pero con una baja prevalencia de enfermedad grave. En este contexto, la ecocardiografía clínica permite realizar evaluaciones más precisas y completas, con las que tomar decisiones más adecuadas, ya sea para asumir el manejo de determinados pacientes o para proceder a su derivación con la prioridad necesaria.
En la tabla 1 se resumen los escenarios más frecuentes, la valoración ecográfica que requieren y su posible utilidad en la consulta diaria de AP.
Escenarios clínicos en ecocardiografía clínica en Atención Primaria
| Escenario clínico | Objetivos ecográficos | Utilidad en Atención Primaria |
|---|---|---|
| Paciente con elevado RCVCardiomegalia radiológicaAlteraciones ECG basal | Medir: VI, VD, AI, AD, SIV, AA, VCI | Evaluación precisa del RCVEvaluación cardiopatía hipertensivaPresencia de derrame pericárdico |
| Disnea | DTDVIMAPSEEstimación subjetiva de la FEVIDisfunción diastólica: HVI, tamaño AIVCI: diámetro, colapsabilidad | Descartar origen cardiaco de la disneaEstimación de la volemia |
| Sospecha de EPSospecha de HTP | Cociente VD/VIVCITamaño ADEstimación subjetiva función sistólica VDTAPSE | Evaluación precisa VD |
| Soplo cardiaco | Morfología mitral, aórticaRegurgitaciones valvulares | Despistaje de valvulopatías significativas |
| Dolor torácico | Derrame pericárdicoRepercusión cavidades cardiacas | Diagnóstico/seguimiento pericarditis |
AA: aorta ascendente; AD: aurícula derecha; AI: aurícula izquierda; DTDVI: diámetro telediastólico del ventrículo izquierdo; ECG: electrocardiograma; EP: embolismo pulmonar; FEVI: fracción de eyección del ventrículo izquierdo; HTP: hipertensión pulmonar; HVI: hipertrofia del ventrículo izquierdo; MAPSE: excursión sistólica del plano del anillo mitral; RCV: riesgo cardiovascular; SIV: septo interventricular; TAPSE: excursión sistólica del plano del anillo tricuspídeo; VCI: vena cava inferior; VD: ventrículo derecho; VI: ventrículo izquierdo.
La valoración ecográfica del tamaño de las cavidades cardiacas o la detección de un derrame pericárdico significativo permiten determinar el origen de la cardiomegalia radiológica25.
La evaluación de la disnea se basa en la historia clínica y en la exploración física; no obstante, el diagnóstico de insuficiencia cardiaca puede ser difícil, sobre todo en pacientes ancianos con broncopatía crónica asociada. En estos casos, la detección de lesiones estructurales cardiacas como la disfunción y el aumento del tamaño del VI, la dilatación de la AI o la presencia de hipertrofia del VI pueden ayudar a establecer el origen de la disnea26. En las guías europeas, para el diagnóstico de insuficiencia cardiaca, es obligada la detección de alguna de las lesiones cardiacas anteriormente enumeradas27, que pueden ser identificadas con fiabilidad mediante ecocardiografía clínica, a la espera de confirmación mediante un estudio reglado.
En casos de dolor torácico de probable origen pericárdico pero de diagnóstico incierto, la presencia de derrame pericárdico mediante ecografía confirma el diagnóstico de pericarditis.
Ante la sospecha de un embolismo pulmonar, la sensibilidad de la ecocardiografía para su diagnóstico es de alrededor del 30%, ya que solo los embolismos de cierta entidad provocan disfunción del VD. No obstante, algunos estudios observacionales indican que la evaluación de la presencia de dilatación o disfunción del VD puede tener un valor diagnóstico y pronóstico en pacientes con diagnóstico de embolismo pulmonar no masivo28.
La presencia de soplos constituye uno de los principales motivos de derivación al cardiólogo, de ahí la importancia de una primera aproximación desde la ecocardiografía clínica para confirmar la presencia de válvulas normales o sin lesión significativa29. No obstante, si la sospecha de alteración valvular es alta, se requiere un estudio ecográfico reglado.
Por último, la ecocardiografía clínica mejora la capacidad diagnóstica cuando se añade a la exploración física y al ECG, ya que permite la detección de alteraciones cardiacas significativas, incluso en estadios preclínicos. En este contexto, constituye una herramienta fundamental para la correcta evaluación de los pacientes con elevado riesgo cardiovascular.
Ecografía pulmonarCon el objetivo de estandarizar las áreas de exploración y los criterios diagnósticos de los patrones ecográficos fundamentales, y sintetizar la evidencia científica disponible en ese momento, el consenso internacional de expertos en ecografía pulmonar publicó en 2012 su documento de recomendaciones30, de obligada lectura para quien quiera iniciarse en este campo.
Técnica de exploraciónComo norma general, para el estudio del pulmón puede usarse cualquier sonda ecográfica, teniendo en cuenta las características y limitaciones de cada una. No es necesario un preset específico, pudiendo usarse el predeterminado para cada sonda, pero ajustando la profundidad a las características del paciente y estudio, y colocando el foco a nivel de la línea pleural. Dado que el estudio se basa en la interpretación de artefactos, hay que evitar aplicaciones o software de minimización de los mismos.
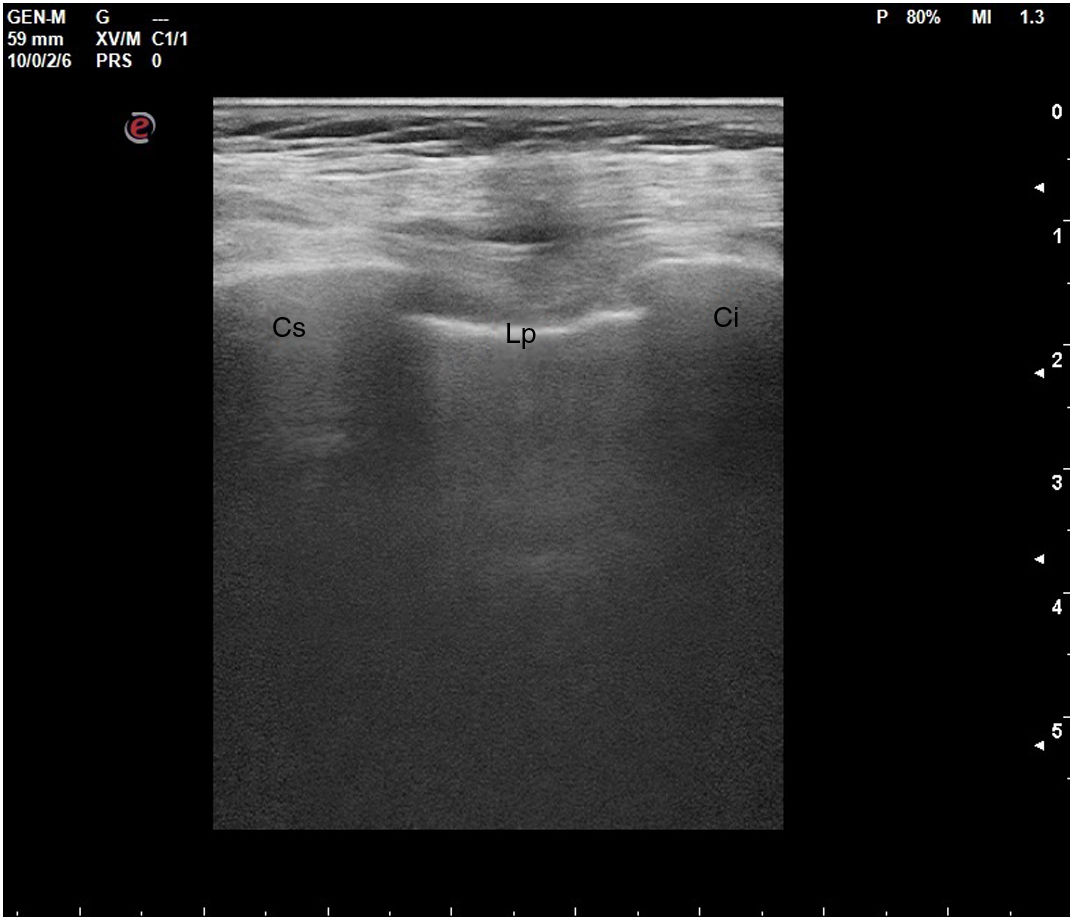
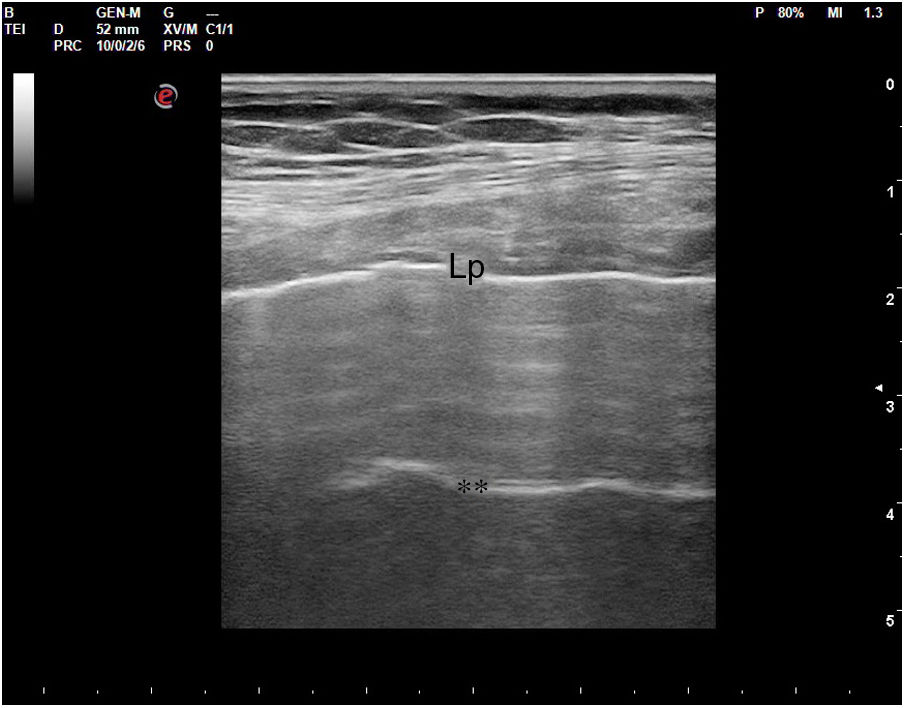
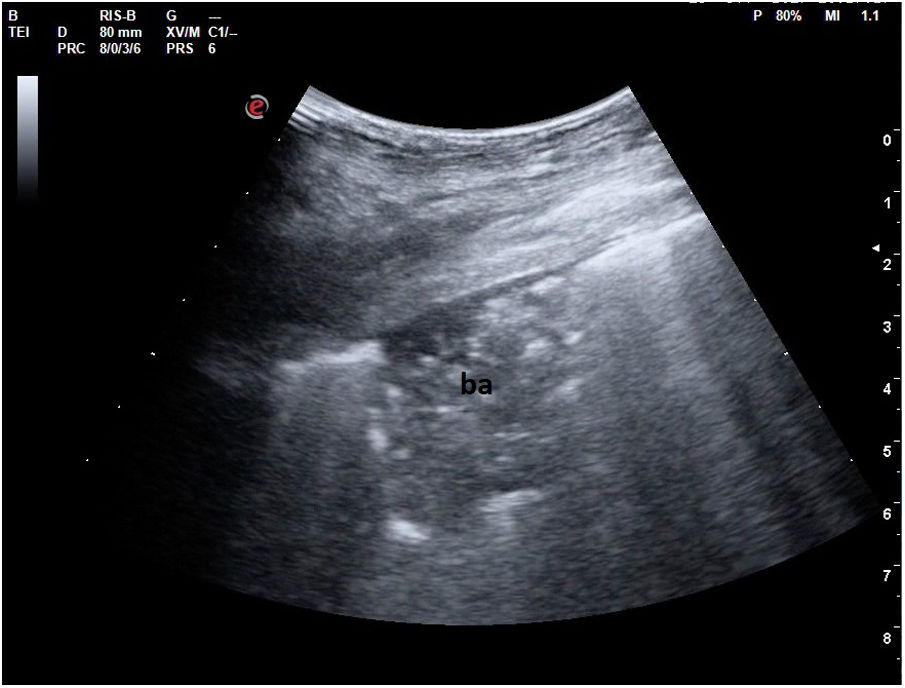
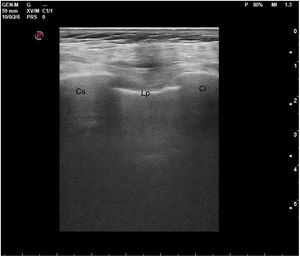
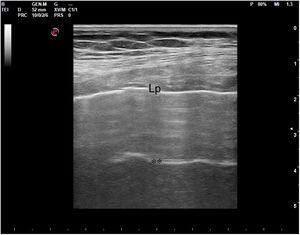
En el pulmón, la ecografía se comporta como un densitómetro. En un pulmón aireado (ya sea normal o con hiperaireación, como ocurre en el enfisema), la gran diferencia de impedancia acústica entre la pared torácica y el aire no permite obtener una imagen anatómica. En este caso, se evidencia la línea pleural, una franja horizontal hiperecogénica altamente reflectante del haz de ultrasonido. En el corte longitudinal (fig. 13), la línea pleural aparece entre 2 costillas sucesivas, en el denominado signo del murciélago: las corticales de las costillas, hiperecogénicas y con sombra posterior, constituirían las alas del murciélago, y la línea pleural, el cuerpo. En el corte oblicuo o intercostal (fig. 14), la línea pleural se presenta en su máxima extensión. Es una estructura dinámica, que se desliza con los movimientos respiratorios en el denominado deslizamiento (o «sliding») pleural. Al tratarse de una superficie altamente reflectante del ultrasonido, genera unos artefactos en profundidad, denominados líneas A. Las líneas A son hiperecogénicas, horizontales y paralelas, siempre a la misma distancia entre ellas (que es la misma distancia que hay entre la línea pleural y la sonda). Su presencia indica que la sonda está colocada perpendicular a la pleura, y no traduce enfermedad.
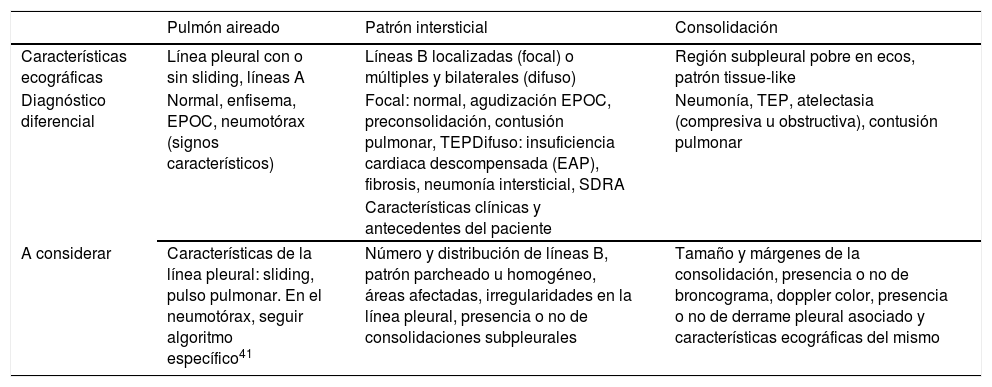
Mediante la ecografía podemos reconocer varios patrones de afectación pulmonar con gran sensibilidad y esecificidad (tabla 2).
Patrones en ecografía pulmonar
| Pulmón aireado | Patrón intersticial | Consolidación | |
|---|---|---|---|
| Características ecográficas | Línea pleural con o sin sliding, líneas A | Líneas B localizadas (focal) o múltiples y bilaterales (difuso) | Región subpleural pobre en ecos, patrón tissue-like |
| Diagnóstico diferencial | Normal, enfisema, EPOC, neumotórax (signos característicos) | Focal: normal, agudización EPOC, preconsolidación, contusión pulmonar, TEPDifuso: insuficiencia cardiaca descompensada (EAP), fibrosis, neumonía intersticial, SDRA | Neumonía, TEP, atelectasia (compresiva u obstructiva), contusión pulmonar |
| Características clínicas y antecedentes del paciente | |||
| A considerar | Características de la línea pleural: sliding, pulso pulmonar. En el neumotórax, seguir algoritmo específico41 | Número y distribución de líneas B, patrón parcheado u homogéneo, áreas afectadas, irregularidades en la línea pleural, presencia o no de consolidaciones subpleurales | Tamaño y márgenes de la consolidación, presencia o no de broncograma, doppler color, presencia o no de derrame pleural asociado y características ecográficas del mismo |
EAP: edema agudo de pulmón; EPOC: enfermedad pulmonar obstructiva crónica; SDRA: síndrome de distrés respiratorio agudo; TEP: tromboembolismo pulmonar.
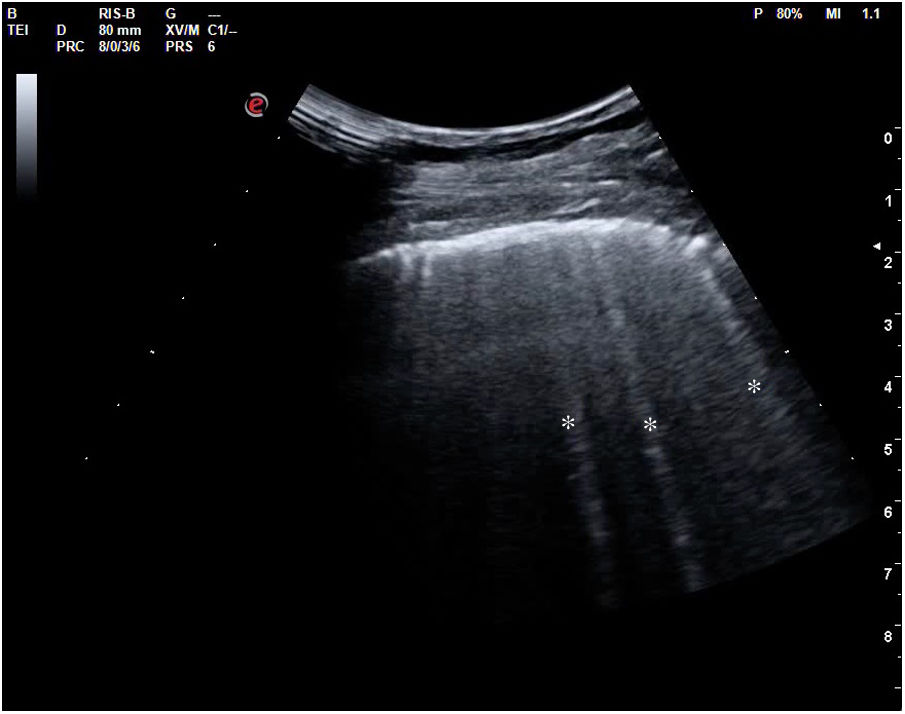
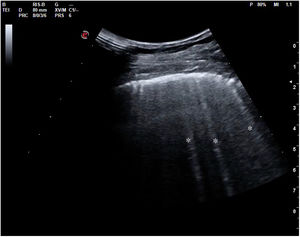
Cuando hay una pérdida parcial de aireación por ocupación del espacio intersticial (ya sea por líquido o por tejido fibroso), aparecen en la ecografía las denominadas líneas B (figs. 15 y 16). Las líneas B son artefactos verticales, también denominados en cola de cometa o láser-like, hiperecogénicos, que nacen de la línea pleural y alcanzan el final de la pantalla sin atenuarse. Se mueven sincrónicamente con el deslizamiento pleural. Pueden hallarse de forma aislada (en el síndrome intersticial focal), o difusa y bilateral.
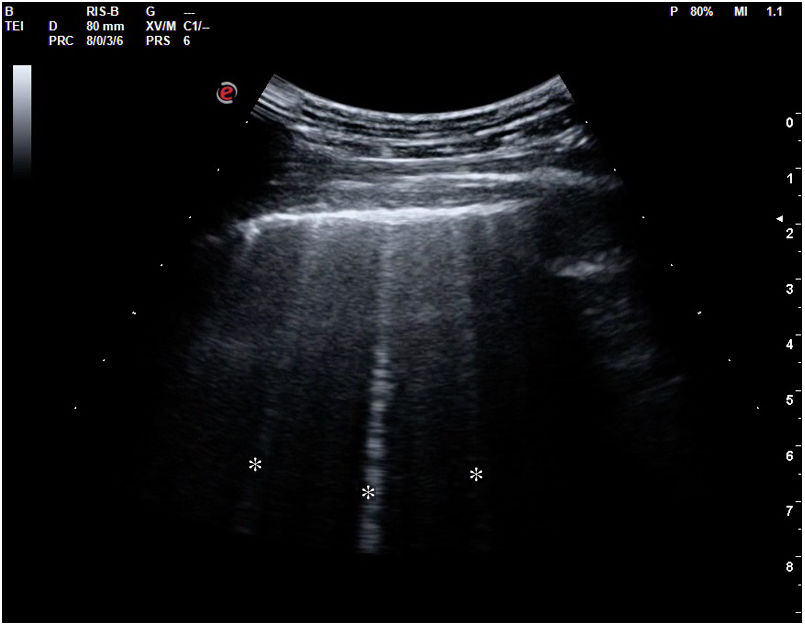
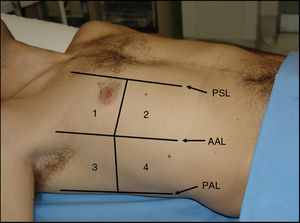
Según el Consenso Internacional30, la presencia de 3 o más líneas B en al menos 2 áreas torácicas (fig. 17) en cada hemitórax traduce síndrome intersticial difuso. Para ello, se establecieron 8 áreas torácicas (4 en cada hemitórax: 2 anteriores y 2 laterales) en el paciente en decúbito supino.
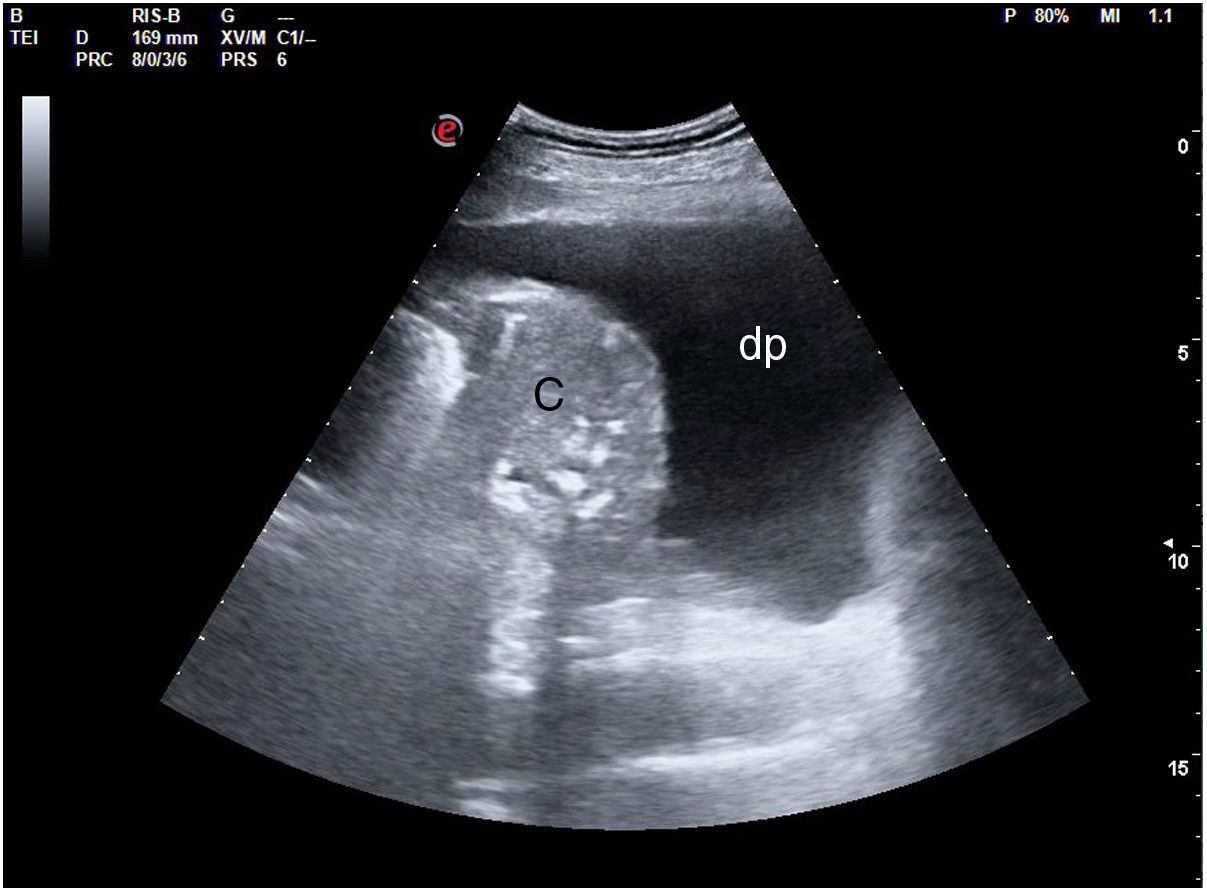
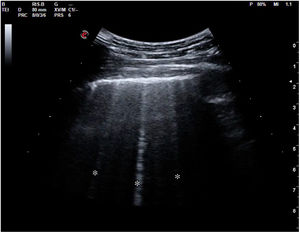
La pérdida total de aireación dará un patrón de consolidación, como sucede por ejemplo en la neumonía o la atelectasia (fig. 18). En el síndrome alveolar, en que el aire ha sido sustituido por inflamación o tejido consolidado, la ecografía obtendrá una imagen anatómica del pulmón. El órgano se mostrará con una apariencia tissue-like, de ecogenicidad similar a la del hígado, pudiendo presentar broncograma aéreo (hiperecogénico) o fluido (anecogénico), y su vascularización podrá ser estudiada mediante doppler color. Algunas consolidaciones pueden presentarse con derrame pleural asociado (fig. 19).
Escenarios clínicos de aplicación y utilidad en Atención Primaria (tabla 3)Dolor pleuríticoEn el diagnóstico diferencial del dolor pleurítico la ecografía puede ser de gran ayuda para determinar el origen del mismo, distinguiendo entre un origen en la pared torácica o causas pleuropulmonares. Permite visualizar discontinuidad cortical en la fractura costal, lesiones ocupantes de espacio en la pared, neumotórax, patrón intersticial focal, consolidación pulmonar o derrame pleural, como principales causas detectables del dolor31.
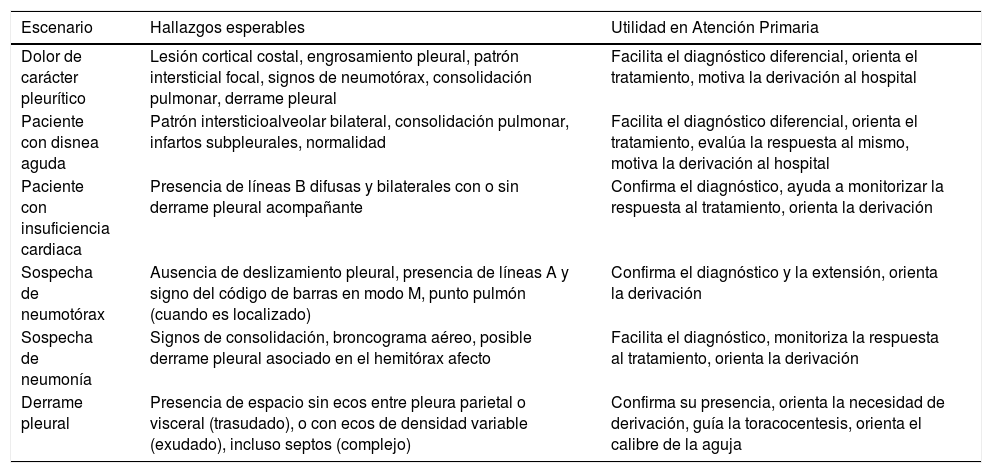
Escenarios clínicos y utilidad de la ecografía pulmonar en Atención Primaria
| Escenario | Hallazgos esperables | Utilidad en Atención Primaria |
|---|---|---|
| Dolor de carácter pleurítico | Lesión cortical costal, engrosamiento pleural, patrón intersticial focal, signos de neumotórax, consolidación pulmonar, derrame pleural | Facilita el diagnóstico diferencial, orienta el tratamiento, motiva la derivación al hospital |
| Paciente con disnea aguda | Patrón intersticioalveolar bilateral, consolidación pulmonar, infartos subpleurales, normalidad | Facilita el diagnóstico diferencial, orienta el tratamiento, evalúa la respuesta al mismo, motiva la derivación al hospital |
| Paciente con insuficiencia cardiaca | Presencia de líneas B difusas y bilaterales con o sin derrame pleural acompañante | Confirma el diagnóstico, ayuda a monitorizar la respuesta al tratamiento, orienta la derivación |
| Sospecha de neumotórax | Ausencia de deslizamiento pleural, presencia de líneas A y signo del código de barras en modo M, punto pulmón (cuando es localizado) | Confirma el diagnóstico y la extensión, orienta la derivación |
| Sospecha de neumonía | Signos de consolidación, broncograma aéreo, posible derrame pleural asociado en el hemitórax afecto | Facilita el diagnóstico, monitoriza la respuesta al tratamiento, orienta la derivación |
| Derrame pleural | Presencia de espacio sin ecos entre pleura parietal o visceral (trasudado), o con ecos de densidad variable (exudado), incluso septos (complejo) | Confirma su presencia, orienta la necesidad de derivación, guía la toracocentesis, orienta el calibre de la aguja |
Uno de los grandes retos a los que se enfrenta el médico de familia en Urgencias y en su consulta diaria es el diagnóstico diferencial de la disnea. La ecografía permite distinguir un origen cardiaco (presencia de líneas B bilaterales y difusas en la insuficiencia cardiaca descompensada) o respiratorio (ecografía generalmente normal en la agudización de la EPOC, consolidación en el tromboembolismo pulmonar o la atelectasia, etc.)32–34.
Insuficiencia cardiacaLa presencia de líneas B bilaterales y difusas caracteriza el patrón ecográfico del síndrome intersticial35. En el paciente con insuficiencia cardiaca traduce congestión pulmonar y es por tanto signo de descompensación. La ecografía ha mostrado tener aplicaciones en el diagnóstico36, en la monitorización y la evaluación de la respuesta al tratamiento37,38, y en el pronóstico39,40 de la insuficiencia cardiaca.
NeumotóraxLos signos ecográficos de neumotórax (falta de sliding, de líneas B y de pulso pulmonar, y la presencia de punto pulmón) han sido claramente descritos, así como los criterios diagnósticos41. La ecografía ha mostrado una sensibilidad muy superior a la radiografía de tórax en la detección de neumotórax, con una similar alta especificidad42. Para la detección de un neumotórax simple se utilizará preferiblemente la sonda lineal, con mejor resolución superficial, y se estudiarán las áreas elevadas del tórax (en el paciente en decúbito supino se corresponderá con las áreas anteroinferiores).
NeumoníaLa ecografía torácica mostrará una imagen de consolidación en la neumonía, con una sensibilidad superior al 85% y una especificidad de alrededor del 90%, con ligeras oscilaciones en las series revisadas, siendo por ello más precisa que la radiografía de tórax43–45. El diagnóstico diferencial de las consolidaciones es complejo y dependerá en gran parte no solo de las características ecográficas, sino también del contexto clínico del paciente. Permitirá, además de establecer el diagnóstico, monitorizar la evolución y la respuesta al tratamiento.
Derrame pleuralSe visualizará como la presencia de líquido entre la pleura parietal y la visceral; anecogénico en los trasudados, pudiendo tener cualquier aspecto en los exudados (desde anecogénico hasta derrames pleurales complejos, tabicados y con contenido ecogénico)46. Se puede estimar la cantidad de derrame47, así como anticipar la complejidad de la toracocentesis (permite prever la necesidad de agujas de mayor calibre en derrames complejos, la dificultad de drenaje en los tabicados o determinar el mejor abordaje). El uso de la ecografía durante la toracocentesis permite guiar la aguja, mejorando la precisión y minimizando el riesgo de complicaciones, por lo que es altamente recomendable48.
Puntos clave- •
La ecografía clínica es una herramienta que complementa la anamnesis y la exploración física, lo que facilita y agiliza la toma de decisiones en cualquier entorno de atención médica.
- •
El médico de familia es el especialista que más se puede beneficiar del empleo de la ecografía porque debe ser competente en todos los terrenos de la enfermedad.
- •
La ecocardiografía clínica y la ecografía pulmonar, por su fiabilidad, seguridad, reproducibilidad y bajo coste, deben estar accesibles para su empleo en Atención Primaria.
- •
Estas 2 técnicas, aplicadas en escenarios concretos y con una técnica de estudio definida, confirman o descartan enfermedad con una elevada fiabilidad y orientan de modo eficaz la conducta del profesional.
- •
Este artículo revisa la fiabilidad y la utilidad de la ecocardiografía clínica y la ecografía pulmonar.
Los autores declaran no tener ningún conflicto de intereses.