Revisar las últimas evidencias publicadas respecto a la vacuna utilizada en nuestro país frente al virus del herpes zóster, desglosadas por eficacia, eficiencia, efectividad y seguridad vacunal. Incluir las recomendaciones vacunales actuales.
DiseñoRevisión secundaria. Revisión cualitativa descriptiva. Revisión con el término de búsqueda de «vacuna herpes zóster» y «vacuna recombinante adyuvada de subunidades HZ/su». Estudio observacional retrospectivo.
Fuentes de datosEmbase, Medline y Google Scholar.
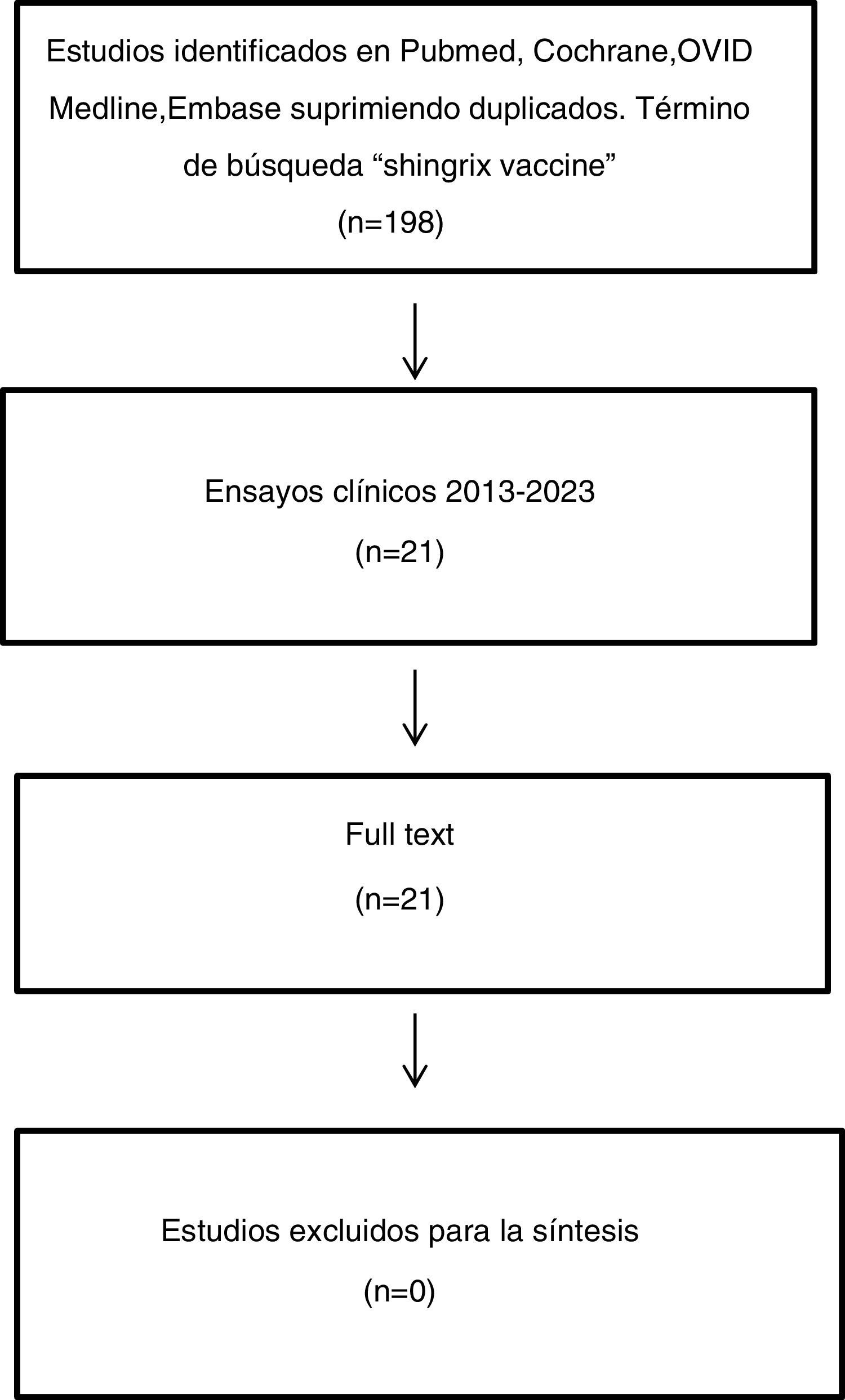
Selección de estudiosCriterio de búsqueda con los términos «Shingrix vaccine» y «Adjuvanted Herpes Zoster Subunit Vaccine». Periodo de búsqueda 2013-2023. Se seleccionaron los estudios tipificados como ensayos clínicos o ensayos clínicos randomizados. Se evaluaron 21 estudios publicados. No hubo exclusiones.
ResultadosLos estudios evaluados se mostraron coherentes y en todos ellos la eficacia en personas adultas tanto para prevenir la reactivación viral como para evitar complicaciones estuvo por encima del 80%. La efectividad vacunal con 2 dosis también se mostró estar por encima del 80%. Los estudios coste/efectividad fueron siempre favorables en personas adultas, pacientes inmunodeprimidos y personas con enfermedad crónica. La seguridad de la vacuna fue evaluada en los estudios pivotales y en los estudios poscomercialización realizados (aún escasos por el corto periodo de tiempo estudiado). El perfil de seguridad de la vacuna es muy alto, y en el caso de los efectos adversos graves su frecuencia fue similar a placebo.
ConclusionesDisponemos de una vacuna efectiva y segura frente al virus del herpes zóster, que nos permite proteger a los grupos de población más vulnerables frente al virus.
To review the latest published evidence on the vaccine used in our country against the herpes zoster virus, breaking down the results according to the efficacy, efficiency, effectiveness and safety of the vaccine. Include the current recommendations for vaccination.
DesignSecondary review. Descriptive qualitative review. Review using the search term “herpes zoster vaccine” and “Adjuvanted recombinant Herpes Zoster subunit vaccine”. Retrospective observational study.
Data sourcesEmbase, Medline and Google Scholar.
Selection of studies Search criterion with the terms “Shingrix vaccine” and “Adjuvanted Herpes Zoster Subunit Vaccine”. Search period 2013-2023. Studies classified as clinical trials or randomized clinical trials were selected. 21 published studies were evaluated. There were no exclusions.
ResultsThe evaluated studies were found to be coherent and in all of them efficacy in adult individuals in preventing viral reactivation and in preventing complications was higher than 80%. The effectiveness of the vaccine after two doses was also higher than 80%. Cost-effectiveness studies were always favourable in adults, immunodepressed patients and individuals with chronic pathology. The safety of the vaccine was evaluated in the pivotal studies and in the post-commercialization studies that were undertaken (although there were few of the latter due to the short period of time studied). The safety profile of the vaccine is very high and in the case of severe adverse effects, their frequency was similar to that of a placebo.
ConclusionsWe have a safe and effective vaccine against the herpes zoster virus that allows us to protect the most vulnerable population groups against this virus.
El herpes zóster (HZ) es una enfermedad que se produce por la reactivación del virus varicela zóster (VVZ). En Europa la incidencia anual del HZ en la población general se sitúa entre 2 y 4,6 cada 1.000 personas/por año, aumentando con la edad, y está asociada a situaciones que afectan a la inmunidad celular, como son enfermedades autoinmunes, neoplasias, tratamientos inmunosupresores o determinadas enfermedades crónicas, como la diabetes mellitus, la enfermedad pulmonar obstructiva crónica (EPOC) o el asma. En España, la incidencia global del HZ se estimó en 351,6 por cada 100.000 habitantes, siendo de 625,5 por cada 100.000 habitantes en personas de 50 años o más hasta alcanzar el máximo en el grupo de 80-84 años, con 877,1 casos por 100.000 habitantes1. Se espera que la incidencia del HZ aumente en un futuro próximo debido al envejecimiento de la población y al creciente número de personas con comorbilidades y con inmunosupresión.
El número de hospitalizaciones por HZ aumenta con la edad. Las hospitalizaciones crecen a partir del grupo de edad de 50-54 años (pasando de 2.018 hospitalizaciones entre los 45-49 años a 2.534 en el grupo de 50-54 años, incremento del 20%). El grupo de edad que registra más hospitalizaciones es el ≥85 años (8.883 hospitalizaciones en el periodo). El 80,2% de las hospitalizaciones se acumulan en personas que tienen 50 o más años y el 63,1% en las que tienen 60 o más años.
Las muertes por HZ ocurren en la población adulta a partir del grupo de edad de 45-64 años, que acumula el 2,8% del total de defunciones; el 33,2% ocurren entre los 65-84 años y el 64,0% en personas de 85 años o más años2.
La primera vacuna frente al HZ autorizada por la Unión Europea llegó en el 2006. Era una vacuna de virus atenuados, lo que conllevaba su contraindicación en grupos que especialmente se podían beneficiar de ella como los inmunodeprimidos3.
En el 2018 la Unión Europea autorizó una nueva vacuna recombinante (HZ/su) y no contraindicada en personas con inmunodeficiencia4. Es la vacuna que actualmente se está administrando en nuestro país.
El presente artículo realiza una revisión de todos los datos relevantes disponibles en la actualidad sobre esta vacuna.
MétodoSe consultaron las bases de datos de Embase, Medline y Google Scholar. Los términos de búsqueda fueron «Shingrix vaccine» y «Adjuvanted Herpes Zoster Subunit Vaccine». El periodo estudiado fue 2013-2023. Se seleccionaron los estudios tipificados como ensayos clínicos o ensayos clínicos randomizados. Se evaluaron 21 estudios publicados. No hubo exclusiones (fig. 1).
ResultadosEficaciaLa eficacia de la vacuna HZ/su se evaluó en pacientes de más de 50 años, con pautas de vacunación en 2 dosis (0-2 meses) en 2 estudios fase III, controlados con placebo 1:1 y realizados en 18 países de Europa, América del Norte, América del Sur, Australia y Asia.
- •
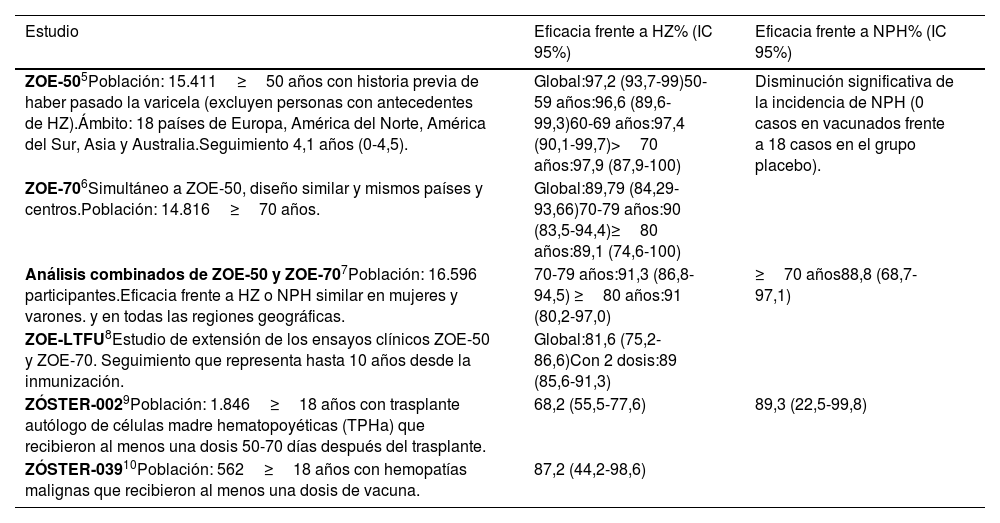
El estudio ZOE-50 (ZÓSTER-006)5 se realizó en una población de 15.411 personas con 50 o más años de edad, y con historia previa de haber pasado la varicela. Se excluyeron a personas con antecedentes de HZ y a pacientes con inmunosupresión, y el seguimiento fue de 4,1 años (0-4,5). La eficacia global de la vacuna frente a la incidencia de HZ en ≥50 años fue de 97,2 (IC 95%: 93,7-99,0). Respecto a la eficacia frente a la neuralgia postherpética (NPH), se observó una disminución significativa de la incidencia de NPH en comparación con placebo (0 casos de NPH frente a 18 casos en el grupo placebo).
- •
El estudio ZOE-70 (ZÓSTER-022)6 se realizó simultáneamente al ZOE-50, pero se seleccionó a pacientes de 70 o más años y participaron un total de 14.816 personas. La eficacia en ≥70 años fue del 89,79% (IC 95%: 84,29-93,66).
En el análisis agrupado de los 2 estudios (ZOE-50 y ZOE-70)7 no se observaron diferencias en la eficacia de la vacuna frente al HZ y la NPH con respecto al género, el origen étnico o la región geográfica. La eficacia frente al HZ en los adultos de 70-79 años fue del 91,3% (IC 95%: 86,0-94,9) y del 91,4% (IC 95%: 80,2-97,0 en ≥80 años de edad. Respecto a la eficacia frente a la NPH en ≥70 años, la eficacia fue del 88,8% (IC 95%: 68,7-97,1). Además de la NPH, se evaluaron otras complicaciones asociadas al HZ como la vasculitis, la enfermedad diseminada, la oftálmica, la neurológica, la enfermedad visceral y el accidente cerebrovascular. Tras el análisis agrupado de ZOE-50 y ZOE-70, la vacuna HZ/su redujo estas complicaciones en un 93,7% (IC 95%: 59,5-99,9) en adultos ≥50 años y en un 91,6% (IC 95%: 43,3-99,8) en adultos ≥70 años, aunque debido al reducido número de casos no se ha podido demostrar eficacia protectora individual para cada una de las diferentes complicaciones.
Para evaluar la durabilidad de la eficacia, la inmunogenicidad, tanto humoral como celular, y la seguridad de la vacuna HZ/su, se realizó el estudio ZOE-LTFU8, estudio de extensión de los ensayos clínicos ZOE-50 y ZOE-70 con un seguimiento de hasta 10 años tras la inmunización en el que se incluyó a 7.277 pacientes. La eficacia frente al HZ desde el inicio de este estudio fue del 84% (IC 95%: 75,9-89,8) y del 90,9% (IC 95%: 88,2-93,2) desde la inmunización en el estudio ZOE-50/70, por lo que se concluyó que los beneficios clínicos tras la vacunación se mantienen, al menos, durante 10 años.
En pacientes de 18 o más años se llevaron a cabo 2 estudios de fase III, controlados con placebo observador/ciego, en pacientes con enfermedades que producían inmunosupresión y que recibieron 2 dosis de vacuna con pauta (0-2 meses):
- •
Zoster-0029 participaron en el estudio 1.846 receptores de trasplantes autólogos de células madre hematopoyéticas (TPHa) que recibieron al menos una dosis de HZ/su en el grupo vacunado 50-70 días después de recibir el trasplante. La eficacia de la vacuna frente a HZ fue del 68,2% (IC 95%: 55,5-77,6) y frente a la NPH fue del 89,3% (IC 95%: 22,5-99,8).
- •
Zoster-03910 participaron 562 personas con hemopatías malignas que recibieron al menos una dosis de vacuna HZ/su durante la terapia antitumoral o tras completar la terapia antitumoral. La eficacia de la vacuna frente a HZ fue del 87,2% (IC 95%: 44,2-98,6). El resumen de los resultados de los estudios de eficacia de la vacuna HZ/su se presentan en la tabla 1.
Tabla 1.Estudios de eficacia de la vacuna recombinante adyuvada
Estudio Eficacia frente a HZ% (IC 95%) Eficacia frente a NPH% (IC 95%) ZOE-505Población: 15.411≥50 años con historia previa de haber pasado la varicela (excluyen personas con antecedentes de HZ).Ámbito: 18 países de Europa, América del Norte, América del Sur, Asia y Australia.Seguimiento 4,1 años (0-4,5). Global:97,2 (93,7-99)50-59 años:96,6 (89,6-99,3)60-69 años:97,4 (90,1-99,7)>70 años:97,9 (87,9-100) Disminución significativa de la incidencia de NPH (0 casos en vacunados frente a 18 casos en el grupo placebo). ZOE-706Simultáneo a ZOE-50, diseño similar y mismos países y centros.Población: 14.816≥70 años. Global:89,79 (84,29-93,66)70-79 años:90 (83,5-94,4)≥80 años:89,1 (74,6-100) Análisis combinados de ZOE-50 y ZOE-707Población: 16.596 participantes.Eficacia frente a HZ o NPH similar en mujeres y varones. y en todas las regiones geográficas. 70-79 años:91,3 (86,8-94,5) ≥80 años:91 (80,2-97,0) ≥70 años88,8 (68,7-97,1) ZOE-LTFU8Estudio de extensión de los ensayos clínicos ZOE-50 y ZOE-70. Seguimiento que representa hasta 10 años desde la inmunización. Global:81,6 (75,2-86,6)Con 2 dosis:89 (85,6-91,3) ZÓSTER-0029Población: 1.846≥18 años con trasplante autólogo de células madre hematopoyéticas (TPHa) que recibieron al menos una dosis 50-70 días después del trasplante. 68,2 (55,5-77,6) 89,3 (22,5-99,8) ZÓSTER-03910Población: 562≥18 años con hemopatías malignas que recibieron al menos una dosis de vacuna. 87,2 (44,2-98,6) IC 95%: intervalo de confianza del 95%; NPH: Neuralgia postherpética; HZ: herpes zóster.
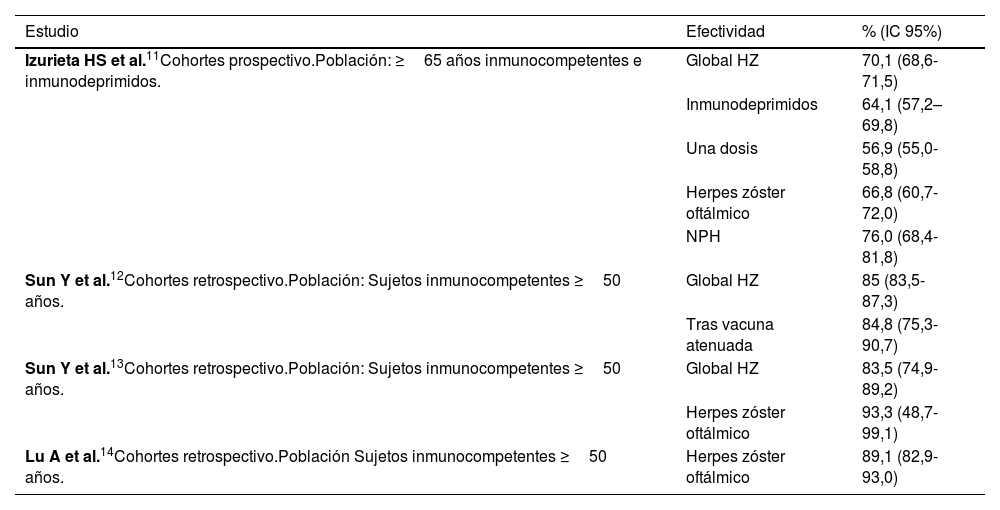
Se han publicado estudios de efectividad de la vacuna HZ/su en la población de EE. UU., datos de resultados en población real, cuyo resumen se presenta en la tabla 2.
Estudios de efectividad de la vacuna recombinante adyuvada
| Estudio | Efectividad | % (IC 95%) |
|---|---|---|
| Izurieta HS et al.11Cohortes prospectivo.Población: ≥65 años inmunocompetentes e inmunodeprimidos. | Global HZ | 70,1 (68,6-71,5) |
| Inmunodeprimidos | 64,1 (57,2–69,8) | |
| Una dosis | 56,9 (55,0-58,8) | |
| Herpes zóster oftálmico | 66,8 (60,7-72,0) | |
| NPH | 76,0 (68,4-81,8) | |
| Sun Y et al.12Cohortes retrospectivo.Población: Sujetos inmunocompetentes ≥50 años. | Global HZ | 85 (83,5-87,3) |
| Tras vacuna atenuada | 84,8 (75,3-90,7) | |
| Sun Y et al.13Cohortes retrospectivo.Población: Sujetos inmunocompetentes ≥50 años. | Global HZ | 83,5 (74,9-89,2) |
| Herpes zóster oftálmico | 93,3 (48,7-99,1) | |
| Lu A et al.14Cohortes retrospectivo.Población Sujetos inmunocompetentes ≥50 años. | Herpes zóster oftálmico | 89,1 (82,9-93,0) |
IC 95%: intervalo de confianza del 95%; NPH: neuralgia postherpética; HZ: herpes zóster.
Se realizó un estudio prospectivo de cohortes en pacientes mayores de 65 años11 en el que se incluyó tanto a pacientes inmunocompetentes como a pacientes con inmunosupresión. Debido a problemas de abastecimiento de la vacuna, la segunda dosis fue administrada muy separada de la primera y la efectividad de una dosis 56,9% (IC 95%: 55,1-58,8) fue muy inferior a la pauta completa de 2 dosis 70,1% (IC 95%: 68,6-71,5), independientemente del intervalo. La efectividad en los pacientes mayores de 80 años y en los pacientes con inmunosupresión fue inferior, pero la diferencia no fue estadísticamente significativa. La efectividad para la prevención de NPH y del herpes oftálmico fue del 76% (IC 95%: 68,4-81,8) y del 66,8% (IC 95%: 60,7-72,0), respectivamente.
En un estudio de cohortes retrospectivo realizado en pacientes inmunocompetentes de 50 años o más12, se observó una efectividad global del 85,5% (IC 95%: 83,5-87,3), también en aquellas previamente vacunadas con la vacuna de virus atenuados.
En estudios llevados a cabo en pacientes mayores de 50 años, inmunocompetentes y sin antecedentes de vacunación previa con la vacuna de virus atenuados13, la efectividad fue del 83,5% (IC 95%; 74,9-89,2) y contra el herpes ocular del 93,3% (IC 95%: 48,7-99,1). En un estudio que evaluaba la efectividad para prevenir el herpes oftálmico14 se observó una efectividad del 89,1% (IC 95%: 82,9-93,0) (tabla 2).
EficienciaLos estudios que evalúan el coste/efectividad de la vacunación con HZ/su presentan resultados homogéneos a favor de su utilización sistemática en la población adulta, siendo la estrategia más favorable la vacunación a los 60-70 años. El estudio de coste/efectividad encargado por el Ministerio de Sanidad en España, publicado en 2018, estimó los 65 años como la edad en la que la estrategia de vacunación con HZ/su era más coste/efectiva, aunque los resultados fueron favorables en todas las edades estudiadas de 50 años o más.
El perfil de coste/efectividad resultó favorable también en poblaciones con enfermedad crónica e inmunodeprimidos.
Se han publicado 2 revisiones sistemáticas de los estudios de coste/efectividad fuera de España y las conclusiones son similares15,16.
Seguridad vacunalLa información disponible sobre los efectos secundarios de la vacuna viene emanada de los estudios pivotales precomercialización y una vez aprobada de los registros «ad hoc» poscomercialización por la recogida de datos a medida que se va implantado la vacuna en los grupos de personas indicadas.
Respecto a la información aportada por los estudios pivotales, los efectos secundarios más frecuentes son las reacciones locales en el lugar de la vacunación (10%): dolor, inflamación y enrojecimiento. Son de carácter transitorio y se resuelven en 2-3 días. Respecto a las reacciones sistémicas son fiebre (12%) y cefalea (8%). La vacuna es más reactógena en el grupo de personas de 50-59 años. Es igual de segura en inmunocompetentes que en inmunocomprometidos. Respecto a los eventos graves no se encontró diferencia entre la vacuna y el placebo.
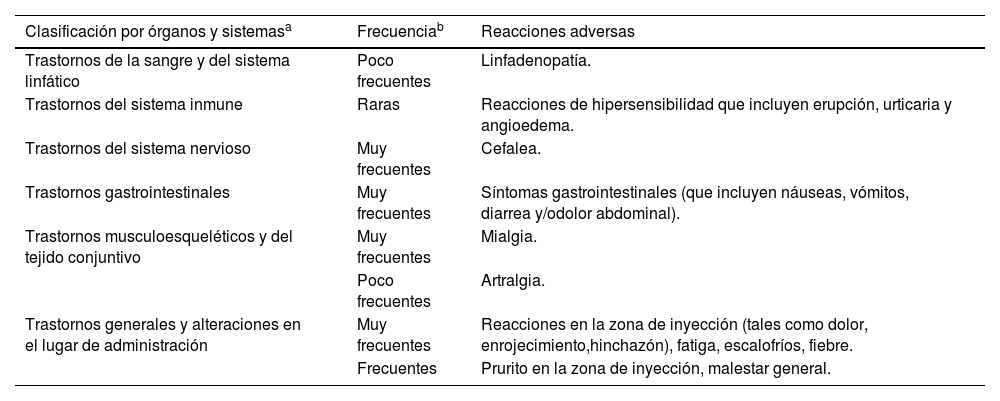
En la ficha técnica vienen explicitados el tipo y frecuencia de reacciones adversas (tabla 3).
Reacciones adversas vacunales
| Clasificación por órganos y sistemasa | Frecuenciab | Reacciones adversas |
|---|---|---|
| Trastornos de la sangre y del sistema linfático | Poco frecuentes | Linfadenopatía. |
| Trastornos del sistema inmune | Raras | Reacciones de hipersensibilidad que incluyen erupción, urticaria y angioedema. |
| Trastornos del sistema nervioso | Muy frecuentes | Cefalea. |
| Trastornos gastrointestinales | Muy frecuentes | Síntomas gastrointestinales (que incluyen náuseas, vómitos, diarrea y/odolor abdominal). |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Muy frecuentes | Mialgia. |
| Poco frecuentes | Artralgia. | |
| Trastornos generales y alteraciones en el lugar de administración | Muy frecuentes | Reacciones en la zona de inyección (tales como dolor, enrojecimiento,hinchazón), fatiga, escalofríos, fiebre. |
| Frecuentes | Prurito en la zona de inyección, malestar general. |
La información declarada y analizada de los efectos secundarios disponibles tras la comercialización es congruente con los descritos en los ensayos clínicos, siendo los efectos más frecuentes los locales (dolor e hinchazón en el lugar de la inyección) y los sistémicos como cefalea, fiebre, escalofríos y fatiga. Los registros no identifican ningún evento de seguridad inesperado.
En un análisis reciente17 de los efectos secundarios de la vacuna se encontró un incremento de riesgo ligeramente mayor de síndrome de Guillain-Barré durante los 42 días posteriores a la vacunación (con aproximadamente 3 casos de síndrome de Guillain-Barré por millón de vacunas). Sin embargo, en otro estudio18 que analizan más de 1 millón de dosis en mayores de 50 años en los 56 días posteriores a la vacunación no encuentran ningún caso de síndrome de Guillain-Barré.
Lógicamente, es muy importante que tanto sanitarios como pacientes declaren cualquier evento que suceda en relación con la vacunación parar monitorizar la seguridad de esta vacuna.
No obstante, con la información actualmente disponible, la relación riesgo/beneficio es favorable a su utilización.
IndicacionesEstá indicada para prevenir el HZ y la NPH en personas mayores de 50 años y en mayores de 18 años inmunocomprometidos (tabla 4).
Indicaciones de la vacuna HZ/su frente al HZ
| Vacunación indicada. | ≥50 años.≥18 años con riesgo incrementado de HZ. |
| Vacunación sistemática financiada por sistema público de salud (SPS). | Personas que cumplen 65 años en el año en curso.Cada CC. AA. implementará ampliar la vacunación a otras cohortes de edad, con posibilidad de captar progresivamente cohortes entre 66 y 80 años, empezando por la población que cumple 80 años. |
| Vacunación en condiciones de riesgo indicada y financiada por el SPS | ≥18 años en las siguientes condiciones:• Trasplante de progenitores hematopoyéticos.• Trasplante de órgano sólido.• Tratamiento con fármacos anti-JAK.• VIH (estables con TAR al menos un año).• Hemopatías malignas.• Tumores sólidos en tratamiento con quimioterapia |
CC. AA.: comunidades autónomas; SPS: sistema público de salud; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
Fuente: elaboración propia.
No se recomienda en el embarazo ni durante la lactancia dado que no se han realizado estudios de seguridad en embarazadas y se desconoce si se excreta en leche materna. Aunque si se administrase a una gestante que aún desconoce su estado, no se prevén riesgos asociados, dado que se trata de una vacuna inactivada. Igualmente, por ser inactivada no estaría contraindicada durante la lactancia si la mujer tiene indicación por padecer patología de riesgo (tabla 4).
ContraindicacionesHipersensibilidad al principio activo o a alguno de los excipientes incluidos. Véase ficha técnica.
Pauta vacunalLa pauta consiste en 2 dosis de 0,5ml cada una: una dosis inicial seguida de una segunda dosis 2 meses después (0-2 meses).
Si se requiere flexibilidad, la segunda dosis se puede administrar entre el segundo y el sexto mes tras la primera dosis. Igualmente, se puede realizar una pauta acelerada en pacientes inmunodeprimidos o que van a serlo en breve tras iniciar algún tratamiento; la segunda dosis se puede poner al mes de la primera.
No se ha establecido la necesidad de administrar dosis de recuerdo.
Se administra por vía intramuscular, preferiblemente en músculo deltoides. Es importante recordar que hay que reconstituir la vacuna que se presenta en 2 viales: uno de polvo seco que contiene el antígeno y el otro vial con solución líquida que contiene el adyuvante.
Inclusión de la vacuna HZ/su en calendarios vacunalesEn el documento publicado en 2018 de «Vacunación en grupos de riesgo de todas las edades y en determinadas situaciones» por parte de la Ponencia de Programa y Registro de Vacunaciones del Ministerio de Sanidad19 se recomendaba vacunar frente a HZ con la vacuna HZ/su a personas inmunocomprometidas en los siguientes casos: trasplante de órgano sólido (TOS) pretrasplante o postrasplante, trasplante de progenitores hematopoyéticos, infección por el VIH, tratamiento con fármacos anti-JAK. La vacunación quedaba condicionada a la disponibilidad de dosis.
En marzo 2021 la ponencia publicó el documento «Recomendaciones de vacunación frente a HZ»20, donde ya se añadían en el grupo de inmunocomprometidos a pacientes con hemopatías malignas y tumores sólidos en tratamiento con quimioterapia. Igualmente se recomendaba incorporar la vacunación sistemática en 2022 en población general en la cohorte que cumplía 65 años en el año 2022, tras confirmación de disponibilidad de dosis. Además, en función de la disponibilidad de dosis se recomendaba captar y vacunar al menos una cohorte por año comenzando por la cohorte que cumple 80 años y descendiendo en edad hasta alcanzar a la primera cohorte que se vacunó a los 65 años.
La vacuna HZ/su está disponible en España desde 2021, priorizando a los pacientes inmunocomprometidos.
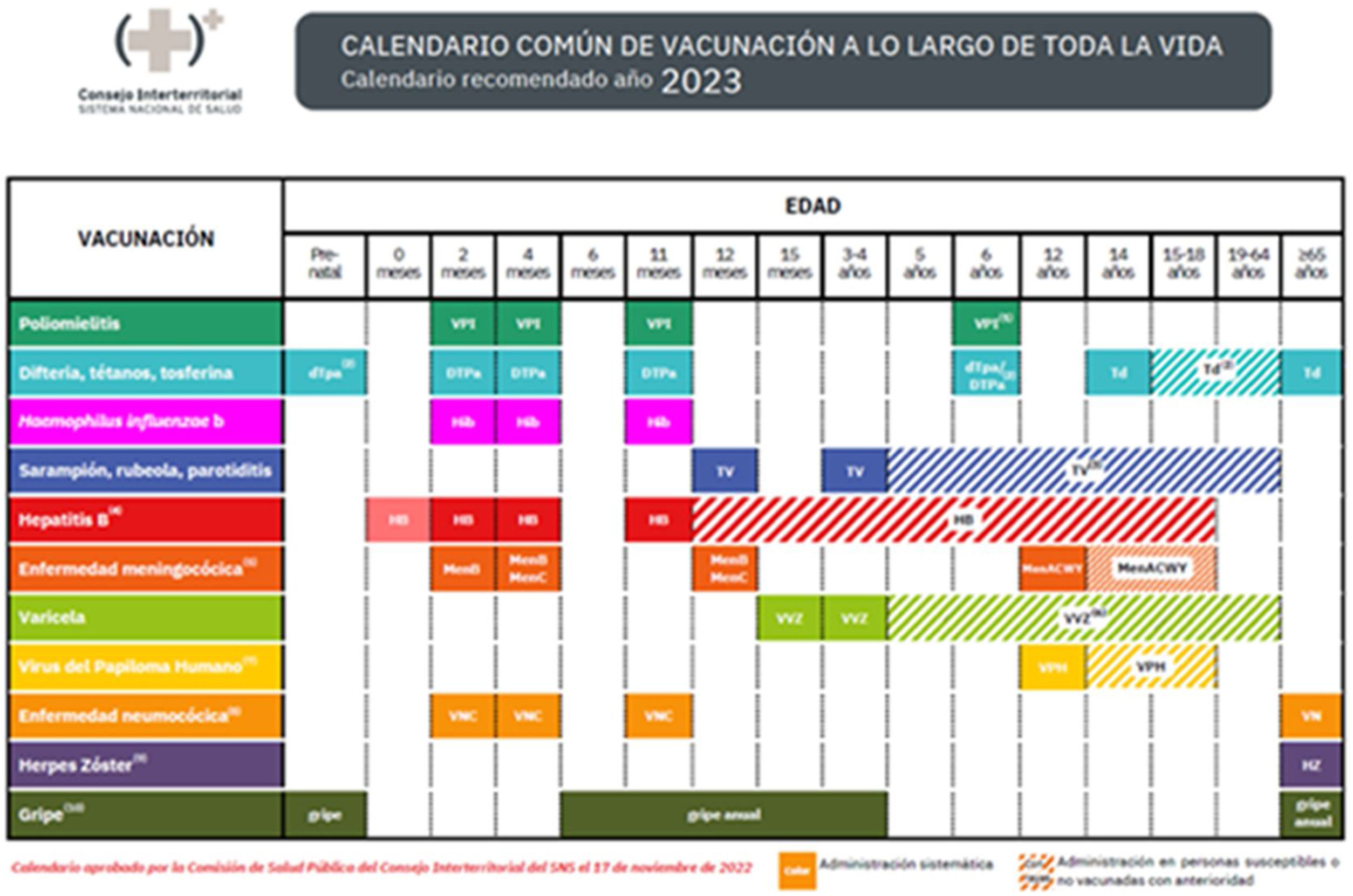
En el calendario común de vacunación a lo largo de toda la vida de 202321, ya se incorpora como vacunación sistemática de las personas que cumplen 65 años en el año en curso (fig. 2). Igualmente se incluye en el Calendario Vacunación Específica en mayores de 18 años con condiciones de riesgo para 202322.
Coadministración con otras vacunasLa información disponible sobre la administración concomitante de la vacuna del VHZ adyuvada con otras vacunas se ha estudiado en ensayos clínicos en fase III con la vacuna antigripal tetravalente inactivada, neumocócica polisacárida 23 valente, la vacuna Tdpa y recientemente la vacuna neumocócica conjugada 13 valente. La fiebre y escalofríos fueron más frecuentes cuando se administró concomitantemente con la vacuna antineumocócica 23 valente. Hay datos intermedios de estudios que avalan la seguridad de la administración concomitante de la vacuna HZ/su con la de RNAm frente al COVID en lugares anatómicos diferentes.
Se aconseja administrarlas en lugares anatómicos diferentes. Si fuese preciso por razones de intendencia utilizar el mismo sitio anatómico, se deben separar al menos 3cm entre ellas23,24.
Hay estudios en marcha para valorar la coadministración con la vacuna de alta carga adyuvada de la gripe estacional y con la vacuna antineumocócica conjugada 20 valente.
No hay datos disponibles respecto a la coadministración con otras vacunas; en este caso se recomienda esperar 7 días entre ambas.
ConclusionesEl HZ es una enfermedad que se produce por la reactivación del virus varicela zóster, es muy prevalente, aumenta la incidencia a partir de los 50 años, va aumentando con la edad y especialmente en situaciones de inmunodepresión. La mortalidad por esta enfermedad es baja, pero las complicaciones que puede presentar con la NPH o las hostilizaciones suponen una merma de la calidad de vida de las personas que lo padecen.
En España la vacuna que se encuentra disponible en este momento es la HZ/su, indicada en personas inmunocompetentes de 50 y más años y en pacientes mayores de 18 años con condiciones de inmunodepresión. Esta vacuna ha demostrado una eficacia alta, tanto para la prevención de HZ como de la NPH en pacientes inmunocompetentes mayores de 50 años, incluido en el grupo de pacientes mayores de 70 años y de forma mantenida en el tiempo, demostrado en estudios de seguimiento de hasta 10 años tras la vacunación. La eficacia en pacientes inmunodeprimidos desciende con respecto a los pacientes inmunocompetentes, pero mantiene una eficacia para la prevención del HZ por encima del 68% y por encima del 89% para la NPH, resultados especialmente importantes en este grupo de población porque son los que más HZ padecen y con ellos sus complicaciones derivadas. Los estudios de efectividad publicados presentan unos resultados de protección frente al HZ entre el 70-89% y del 64,1% en pacientes inmunodeprimidos, y han demostrado también porcentajes altos para la prevención del HZ oftálmico. Los estudios que evalúan el coste/efectividad de la vacunación con HZ/su presentan resultados a favor de su utilización sistemática en la población adulta, siendo la estrategia más favorable la vacunación a los 60-70 años.
La pauta de vacunación recomendada es de 2 dosis con un intervalo de 2 meses entre ellas, está incluida en el calendario de vacunación sistemático del 2023 de España a los 65 años.
Con respecto a la seguridad de la vacuna, se concluye que es una vacuna segura y con la información actualmente disponible, la relación riesgo/beneficio es favorable a su utilización.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesTodos los autores declaran no tener ningún conflicto de intereses.