Valorar la adecuación a las guías clínicas (GOLD/SEPAR) del diagnóstico de los pacientes calificados de Enfermedad Pulmonar Obstructiva Crónica (EPOC).
Material y métodosSe seleccionaron todos los casos de EPOC del registro de pacientes crónicos de 28 cupos de 9 centros de salud de la provincia de Ourense, incluyéndose 382 casos donde se determinó la existencia de un diagnóstico correcto según resultados espirométricos. Se determinaron los factores asociados al diagnóstico correcto mediante regresión logística donde fueron incluidos edad, sexo, residencia (rural/urbana), tabaquismo, gravedad, nivel de seguimiento y tiempo desde el diagnóstico.
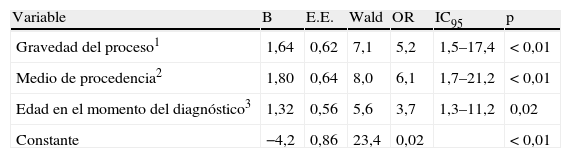
ResultadosEran varones 297 (77,7%) y 172 (45,0%) procedían del medio rural. La media (DE) de edad era 77,0 (±11,0) años, siendo al diagnóstico de 64,9 (±12,0) años y 11,5 (±8,0) años de tiempo de evolución. El 64,9% era o había sido fumador. Se diagnosticaron en atención primaria 26 casos (6,8%). El índice VEF1/CVF estaba registrado en 174 (45,5%) pacientes, siendo menor de 0,7 en 138 casos (36,1%), que se consideraron bien diagnosticados. En estos pacientes figuraba registrado el VEF1 en 125 casos (90,6%). El diagnóstico correcto se asociaba a enfermedad grave o muy grave (OR 5,2; IC95 1,5-17,4), procedencia urbana (OR 6,1; IC95 1,7-21,2) y edad igual o menor de 60 años (OR 3,7; IC95 1,3-11,2).
ConclusiónEn la historia clínica de atención primaria de los pacientes diagnosticados de EPOC existía escaso registro espirométrico y baja adecuación a los criterios diagnósticos aceptados en las guías de uso habitual.
To assess the adequacy to the clinical guides (GOLD/SEPAR) for the diagnosis of the patients classified as COPD.
Material and methodsWe selected all COPD cases in the registry of chronic patients of 28 general practitioners from 9 Health Centres in the province of Ourense (Spain). A total of 382 cases were included. Diagnostic accuracy was determined according to the results of spirometry. We identify factors associated with correct diagnosis by logistic regression which included age, gender, residence (rural/urban), smoking, severity, level of follow up and time since diagnosis.
ResultsOf the total number included, 297 were male (77.7%) and 172 patients (45.0%) came from rural areas. The average age was 77.0 (SD=±11.0) years, with a mean age at diagnosis of 64.9 (±12.0) years and the time from diagnosis was 11.5 (±8.0) years. Less than half (49.1%) patients had been smokers, and 13.1% still smoked. Twenty-six cases (6.8%) were diagnosed in Primary Care. The FEV1/FVC ratio was recorded in 174 (45.5%) patients, with less than 0.7 in 138 cases (36.1%), which were considered as correctly diagnosed. In these patients the FEV1 had been recorded in 125 cases (90.6%). A correct diagnosis was associated with severe or very severe disease (OR 5.2; 95% CI; 1.5-17.4), urban areas (OR 6.1; 95% CI, 1.7-21.2), and younger than 60 years (OR 3.7; 95% CI, 1.3-11.2).
ConclusionThe number of spirometry results recorded in the Primary Care medical records of patients diagnosed with COPD was found to be low, and with little adaptation to the accepted diagnostic criteria in the guidelines that are used routinely.
La enfermedad pulmonar obstructiva crónica (EPOC) es un trastorno que causa gran morbilidad y mortalidad a escala global. Una estimación del Banco Mundial sitúa en 2,7 millones el número de fallecidos en 2000 por esta enfermedad1. Las estimaciones globales de mortalidad se han actualizado recientemente2, y reiteran que la EPOC, que era la quinta causa de muerte en 1990, ya es la cuarta desde 2000 y se prevé que pasará a ser la tercera en 2020. En España, la prevalencia de la EPOC es del 9,1% en edades comprendidas entre los 40 y los 70 años3,4. A nivel mundial, la prevalencia se sitúa entre el 4 y 10%5,6.
La EPOC se caracteriza por la presencia de limitación crónica y poco reversible al flujo aéreo. Esta limitación es, por lo general, progresiva y está asociada a una reacción inflamatoria anómala, principalmente frente al humo del tabaco. La espirometría forzada (EF) es imprescindible para establecer el diagnóstico de EPOC, cuantificar su gravedad, estimar el pronóstico, monitorizar la evolución de la función pulmonar y la respuesta al tratamiento7,8.
Se considera que existe obstrucción al flujo aéreo si el cociente VEF1/CVF después de prueba broncodilatadora (PB) es menor de 0,7. Por su parte, el valor del VEF1 es el mejor indicador de la gravedad de la obstrucción del flujo aéreo7 y se utiliza para clasificar la enfermedad en leve (VEF1>80%), moderada (50%<VEF1<80%) o grave (VEF1<50%).
Existen evidencias de que, con frecuencia, los métodos empleados para determinar la prevalencia de la enfermedad no son todo lo fiables que sería deseable9. Por ello, dos aspectos resultan muy relevantes en el manejo de la EPOC. Por una parte la existencia de un alto grado de infradiagnóstico, como demuestra algún estudio donde más de las tres cuartas partes de los casos confirmados por EF carecían del diagnóstico de EPOC3. Así mismo, menos de la mitad de los pacientes con EPOC grave (VEF1<50%) recibía algún tipo de tratamiento para su enfermedad respiratoria3.
Por otra parte, y enfocado desde el punto de vista de los pacientes clasificados como EPOC sin realmente serlo, el diagnóstico inadecuado supone un doble problema, tanto por la repercusión epidemiológica como por el posible tratamiento incorrecto de estos pacientes, sin contar con la trascendencia que puede tener esta situación para el paciente en particular.
Con este planteamiento, el objetivo del presente estudio fue valorar la adecuación diagnóstica de los pacientes de centros de salud de la provincia de Ourense clasificados como EPOC en las historias clínicas de Atención Primaria a las recomendaciones de las guías clínicas, tomando como referencia las Guías GOLD (2006/revisión 2010)10 y SEPAR (2009)11.
Material y métodosSe realizó un estudio multicéntrico, transversal, observacional, en el ámbito de la atención primaria. Para ello, se seleccionaron la totalidad de los casos que con el diagnóstico de EPOC figuraban incluidos en el registro de crónicos (criterio único de inclusión) de 28 cupos de medicina de familia pertenecientes a 9 centros de salud, rurales y urbanos, de la provincia de Ourense, que cuenta con 89 centros de salud urbanos y rurales y un total de 270 cupos médicos de medicina de familia. La selección de los centros se realizó a partir de criterios de accesibilidad, en concreto la adscripción a los mismos de los médicos residentes de medicina de familia que realizaron la revisión de las historias clínicas, pudiendo considerarse un muestreo de conveniencia. No se prejuzgó el estilo de práctica de los profesionales seleccionados y se solicitó su consentimiento para proceder a la recogida de datos. No hubo negativas para participar. Dicha recogida se realizó en forma de auditorías de la información contenida en las historias clínicas de atención primaria (HCAP), mediante procedimiento previamente acordado, consistente en la revisión de la HCAP del paciente con diagnóstico de EPOC tanto en lo referente a informes de atención especializada de segundo nivel, ambulatoria y hospitalaria, como a las propias hojas de seguimiento que constituyen el cuerpo de la historia clínica. De esta forma se identificaron y registraron a través de un formulario los datos utilizados en el estudio. Dichos datos se recogieron, respetando el anonimato tanto del paciente como del profesional médico, entre los meses de noviembre de 2009 y junio de 2010. Se solicitó y obtuvo la autorización del Comité Ético de Investigación Clínica de Galicia.
Los resultados obtenidos se analizaron considerando los criterios de las guías GOLD 2006 (actualización 2010)10/SEPAR11 2009 como referencia. De esta forma, se consideró que un paciente estaba bien diagnosticado si existía referencia en su HCAP a una espirometría dilatada en la que constara al menos un índice VEF1/CVF menor de 0,7, independientemente de que dicha espirometría hubiera sido realizada en el ámbito de la atención primaria o de segundo nivel. Con este criterio se definió una variable (Diagnóstico correcto) que se consideró variable dependiente en un análisis de regresión logística en el que se incluyeron como variables predictoras la edad en el momento del diagnóstico, clasificada como mayores de 60 años e igual o menor de 60 años, el sexo, el medio de procedencia (rural/urbano) y la gravedad del proceso en forma de variable con dos categorías que agrupaban respectivamente EPOC leve/moderada y EPOC grave/muy grave, así como el nivel de seguimiento del paciente (primer nivel o segundo nivel y compartido), el tabaquismo y el tiempo transcurrido desde el diagnóstico.
Se calculó el tiempo de evolución desde el diagnóstico en función de la realización o no de EF, y se determinó la gravedad del proceso a partir del valor VEF1 según lo recomendado en las guías GOLD10 y SEPAR11.
El análisis de los datos se realizó con ayuda del programa SPSS versión 15.0 (SPSS Inc.). Las variables cuantitativas se describieron como media y desviación estándar (DE) y las cualitativas como porcentajes. Se determinaron los intervalos de confianza del 95% (IC95). Los tiempos de evolución desde el diagnóstico se compararon mediante la prueba t de Student de comparación de medias, al igual que la media de la edad tanto en el momento del diagnóstico como en relación al medio de procedencia. La existencia de un diagnóstico correcto en función del sexo, el medio de procedencia, los antecedentes de tabaquismo, el nivel de seguimiento, la gravedad del proceso (agrupada en leve/moderada y grave/muy grave) y la edad al diagnóstico (considerada como menor o igual a 60 años y mayores de esa edad) se analizó mediante una prueba de χ2 de comparación de proporciones. La regresión logística se realizó mediante el método de pasos hacia atrás, expresando los resultados mediante la transformación en odds del modelo. El grado de significación estadística que se consideró fue un valor de p<0,05.
ResultadosFueron recogidos 412 casos, excluyéndose 30 por imposibilidad de consultar la HCAP. Eran varones 297 (77,7%) y 172 pacientes (45%) procedían del medio rural. La media de edad en el momento de la recogida de los datos era de 77,0 (11,0) años, con una media de edad en el momento en que fue asentado el diagnóstico de EPOC de 64,9 (12,0) años y 11,5 (8,0) años de tiempo de evolución. El 49,1% habían sido fumadores, y lo eran en la actualidad un 13,1%, según constaba en su historia clínica.
El índice VEF1/CVF estaba registrado en 174 (45,5%) casos, siendo este menor de 0,7 en 138 casos (36,1% del total de casos analizados y 79,3% del total de casos con índice registrado). El VEF1 aparecía registrado en 161 pacientes. Si se considera solo los casos en los que existía registro espirométrico con valor del índice VEF1/CVF menor de 0,7, el VEF1 aparecía medido en 125 individuos (90,6%).
Con estos datos, y según los criterios reflejados en Material y Métodos, el 36,1% de los casos incluidos se consideró bien diagnosticado. Respecto a la gravedad de la enfermedad, considerando los casos en los que fue posible determinarla, había 4 casos (3,2%) en estadio i, 50 (40,0%) en estadio ii, 51 (40,8%) en estadio iii y 20 (16,0%) en estadio iv.
Constaban como diagnosticados en atención primaria 26 casos (6,8%). Según la HCAP el seguimiento del paciente se realizaba en el seno de la atención primaria en 211 casos (56,6%), siendo en el segundo nivel o compartido en 162 casos (43,4%).
No se constataron diferencias respecto a la edad en el momento del diagnóstico o la gravedad aunque la media de edad era mayor en los pacientes procedentes del medio rural (diferencia de medias 3,1 años; IC95 1,0-5,3; p=0,005).
Fue posible conocer la fecha de diagnóstico en 246 casos (64,4%). El tiempo de evolución desde el diagnóstico de los pacientes en los que constaba realizada EF era menor que en aquellos diagnósticos sin constancia de la prueba, aunque la diferencia no era significativa (diferencia de medias 1,5 años; IC95: 0,5–3,5).
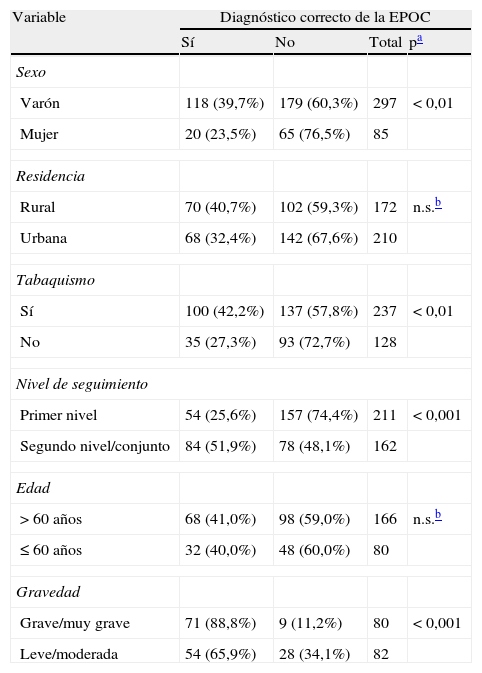
La tabla 1 refleja la adecuación del diagnóstico según los diversos factores considerados, siendo más frecuente encontrar un diagnóstico correcto en varones, en pacientes con antecedentes de tabaquismo, en aquellos casos clasificados como graves y muy graves, y en los que el seguimiento incluía el contacto con el segundo nivel asistencial. El resultado de la regresión logística mostró que la probabilidad de que existiera un diagnóstico correcto de la EPOC se incrementaba en los pacientes que presentaban una enfermedad grave o muy grave (OR 5,2), procedían del medio urbano (OR 6,1) y eran menores de 60 años (OR 3,7) en el momento del diagnóstico (tabla 2).
Factores relacionados con la existencia de un diagnóstico correcto (análisis bivariante)
| Variable | Diagnóstico correcto de la EPOC | |||
| Sí | No | Total | pa | |
| Sexo | ||||
| Varón | 118 (39,7%) | 179 (60,3%) | 297 | <0,01 |
| Mujer | 20 (23,5%) | 65 (76,5%) | 85 | |
| Residencia | ||||
| Rural | 70 (40,7%) | 102 (59,3%) | 172 | n.s.b |
| Urbana | 68 (32,4%) | 142 (67,6%) | 210 | |
| Tabaquismo | ||||
| Sí | 100 (42,2%) | 137 (57,8%) | 237 | <0,01 |
| No | 35 (27,3%) | 93 (72,7%) | 128 | |
| Nivel de seguimiento | ||||
| Primer nivel | 54 (25,6%) | 157 (74,4%) | 211 | <0,001 |
| Segundo nivel/conjunto | 84 (51,9%) | 78 (48,1%) | 162 | |
| Edad | ||||
| >60 años | 68 (41,0%) | 98 (59,0%) | 166 | n.s.b |
| ≤60 años | 32 (40,0%) | 48 (60,0%) | 80 | |
| Gravedad | ||||
| Grave/muy grave | 71 (88,8%) | 9 (11,2%) | 80 | <0,001 |
| Leve/moderada | 54 (65,9%) | 28 (34,1%) | 82 | |
Factores predictores de diagnóstico correcto (resultado de la regresión logística)
| Variable | B | E.E. | Wald | OR | IC95 | p |
| Gravedad del proceso1 | 1,64 | 0,62 | 7,1 | 5,2 | 1,5–17,4 | < 0,01 |
| Medio de procedencia2 | 1,80 | 0,64 | 8,0 | 6,1 | 1,7–21,2 | < 0,01 |
| Edad en el momento del diagnóstico3 | 1,32 | 0,56 | 5,6 | 3,7 | 1,3–11,2 | 0,02 |
| Constante | −4,2 | 0,86 | 23,4 | 0,02 | < 0,01 |
Categorías de referencia: 1: Grave/muy grave. 2: Urbano. 3: ≤60 años.
Desde la aparición de los criterios establecidos por las guías GOLD10/SEPAR11 para la EPOC, se acepta que la obtención en una espirometría posbroncodilatación de los valores aceptados como diagnósticos en dichos consensos es el método adecuado para establecer la existencia de la enfermedad. Sin embargo, muchos pacientes siguen siendo catalogados como tales, y en muchas ocasiones reciben tratamiento de forma crónica, sin que se cumpla tal exigencia12. Los datos obtenidos en el presente estudio parecen señalar que el diagnóstico de EPOC sigue siendo un cajón de sastre en el que se sitúan diversos cuadros relacionados con la patología del aparato respiratorio, pero que no responde con criterios objetivos a la realidad de la enfermedad.
Es probable que muchos de los pacientes a los que se diagnosticó como EPOC lo fueran exclusivamente por síntomas o signos clínicos, actitud que a día de hoy continúa siendo considerada por algunos como un método aceptable de diagnóstico13. Como es sabido, la fiabilidad de tal método es muy baja14 y, en consecuencia, todos los pacientes a los que se les realizó el diagnóstico por este método deberían ser sometidos a una EF dilatada con el fin de confirmar o descartar la presencia de la enfermedad.
Una de las barreras para el diagnóstico de la EPOC es la dificultad para realizar EF en atención primaria15. La existencia de limitaciones en equipamiento, cada día menores, y en tiempo contribuyen al hecho de que los MF no usen habitualmente la EF para detectar la EPOC tal y como recomiendan las guías. Los presentes resultados parecen confirmar que la EF es usada con poca frecuencia para el diagnóstico de la EPOC, sobre todo entre los médicos de atención primaria. A este respecto, una encuesta realizada entre MF estadounidenses y canadienses reveló que, ante un paciente con síntomas sugerentes de padecer EPOC, en menos del 22% de los casos la primera prueba diagnóstica prescrita sería la EF16.
Un reciente estudio sueco17 mostró que, en pacientes diagnosticados de EPOC en los 4 años previos, solo en un 30% figuraba en su HCAP la realización de una EF que cumpliera los criterios establecidos, con una cifra de realización similar a la encontrada por nosotros. Este mismo valor de alrededor de un tercio de los casos es la proporción de pacientes clasificados como EPOC que tienen su diagnóstico confirmado en los estudios de Chavez18 o Mapel19 en EE. UU., Caramoni20 o Cazzola21 en Italia o Buffels22 en Bélgica.
A este respecto, y como demuestran los resultados obtenidos, es importante tener en cuenta que, probablemente, una proporción no despreciable de pacientes diagnosticados como EPOC en nuestro medio lo fueran antes de que la EF posbroncodilatación se constituyera en el método indispensable para alcanzar el diagnóstico y, en consecuencia, el elevado porcentaje de casos sin diagnóstico adecuado responda a casos clasificados previamente como EPOC sin criterio objetivo.
Las formas moderadas y graves de la enfermedad son más frecuentes en pacientes seguidos por MF o especialistas de segundo nivel23–28. En España, Izquierdo25 en 2009 encontró unos porcentajes de estadios moderados y graves similar al obtenido en este estudio y más bajos en el caso de estadios muy graves, aunque sus pacientes presentaban una media de edad 10 años inferior.
En nuestro caso existe una presencia muy baja de casos en estadio i, que entendemos que podría deberse a que sean precisamente los casos más graves los que terminen siendo sometidos a EF, hecho ya referido por algún autor29,30, y que puede explicarse porque los pacientes menos afectados son vistos con menos frecuencia por este motivo en consulta y además se les solicitan menos espirometrías. Además, es necesario considerar la forma de selección de los pacientes en este estudio, a partir de un registro de diagnósticos y no de la realización activa de EF en una población general31. Este hecho justificaría igualmente la mayor probabilidad que demuestra el análisis de regresión de tener un diagnóstico correcto en los pacientes más graves, aunque existen estudios que no encuentran diferencias en este sentido32.
Del mismo modo, hay estudios que coinciden en la utilización más frecuente de la EF en pacientes más jóvenes32–34. El hallazgo de un diagnóstico correcto más frecuente en el medio urbano podría estar en relación con una mayor accesibilidad, tanto al segundo nivel como a centros de atención primaria dotados de espirómetros. No obstante, un estudio de Nacul realizado en el Reino Unido encontró un menor grado de diagnóstico en zonas urbanas35.
A la hora de valorar los resultados obtenidos es necesario considerar que los datos se obtuvieron a partir de un registro en el que cabe la posibilidad de que sea incompleto y no refleje la realidad del diagnóstico. No obstante, la ausencia de datos espirométricos impide asentar un diagnóstico correcto y su ausencia solo puede interpretarse como un manejo inadecuado de la patología analizada. Por otra parte, al ser la espirometría una prueba de cierta complejidad técnica36,37, la presencia de los resultados no significa que siempre haya sido realizada e interpretada correctamente. Otra debilidad del presente análisis depende del hecho de que los cupos seleccionados no lo fueron por azar, lo que puede suponer la aparición de un sesgo que dependa del interés mayor o menor del profesional. Dado que se seleccionaron los cupos en función de un mero criterio de accesibilidad y se consiguió la participación de todos los profesionales seleccionados, creemos que dicho sesgo puede considerarse mínimo.
En resumen, se encuentra una baja utilización de EF para confirmar el diagnóstico de EPOC, lo que ofrece un amplio campo de mejora38,39. Puesto que la EF se considera un estándar de calidad clave en el manejo de la EPOC40, es imprescindible habilitar mecanismos que conduzcan a conseguir, como primera medida, un adecuado diagnóstico de la enfermedad37. La difusión de los resultados a los facultativos responsables podría contribuir a mejorar la adecuación diagnóstica, extremo que merecería ser explorado para confirmar esta posibilidad.
FinanciaciónEstudio financiado por Boehringer Ingelheim España y Pfizer España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.