El entorno de severa contención de costes obligará a buscar de forma activa la sostenibilidad interna en los sistemas sanitarios; la desinversión en todos los servicios que no añaden valor es una de las herramientas a utilizar. En este artículo se aporta una taxonomía práctica para identificar los cuidados inefectivos, inseguros, innecesarios, inútiles, inclementes e insensatos, y se analizan las implicaciones en relación a pacientes ordenados por su gravedad y en función a las ganancias de salud esperables por la intervención. Finalmente se analiza la factibilidad de las políticas de desinversión en relación al ámbito macro-meso o micro de la gestión.
The environment of severe cost containment has led to the active search of “internal sustainability” of health systems; the disinvestment in all non-value added services is one of the tools used. This article provides the taxonomy to identify ineffective, unsafe, unnecessary, unsuccessful, unkind and unwise care practices and discusses their implications in relation to patients ordered according to their severity, as well as the expected health gains of the intervention. Finally, the feasibility of those disinvestment policies is analysed according to macro-,middle, and micro-management scenarios.
Puede ser que los problemas más aparentes que actualmente padece la sanidad pública sean principalmente exógenos, producidos por un brusco corte en la financiación desde 2009. Pero en el ciclo expansivo de la década anterior se habían agravado y acumulado muchos problemas endógenos, que llevaban a un crecimiento poco racional: cada vez se obtenían menos ganancias de salud a un coste exponencialmente mayor de las actividades preventivas, diagnósticas, terapéuticas y de cuidados; es lo que Fuchs llamó flat of the courve medicine1, o medicina de la parte plana de la curva de rendimientos. A esto se añade la irracionalidad de la política de construcción de centros y servicios especializados de muchas Comunidades Autónomas (particularmente entre 2002 y 2009), que, buscando fomentar una mayor accesibilidad, han abocado a una senda no eficiente ni sostenible.
Y la experiencia reciente demuestra la dificultad de gestionar cualquier tipo de «disminución»; solo los incrementos son posibles. Nada nuevo, ya que está clásicamente descrito como uno de los característicos fallos del Estado2 la escasa tensión para el uso eficiente de medios; en época de «vacas gordas» nadie quiere buscarse problemas, y para hacer una cosa nueva no suele dejarse de hacer otra que se venía haciendo de menor o nulo valor conocido; todo crece por aposición; los sedimentos de ineficiencia se van acumulando como estratos de distintas épocas glaciares; y no hay una acción consciente y deliberada por reducir grasa y quitar lastre. Pero, si sabemos hacerlo, la grasa acumulada puede ser la energía de reserva que podríamos y deberíamos movilizar para atravesar esta etapa restrictiva3.
El origen remoto del concepto de desinversión (disinvestment) en los años 80 tiene tintes políticos (campañas de boicot internacional para presionar a través del embargo a Sudáfrica por su política de Apartheid); el término sinónimo «divestment» (no hay traducción diferenciada en castellano) es usado en el mundo empresarial para la externalización de actividades no nucleares o venta de partes de la empresa para buscar financiación. En sanidad aparece con fuerza en la última década ligada al ámbito de la evaluación de las tecnologías4, vehiculizando la necesidad de remover lo ineficiente, y buscando compensar el sesgo clásico que tiene esta disciplina a favor de la evaluación de tecnologías emergentes (más que las existentes). Para Elshaug5 significa retirar parcial o totalmente recursos de tecnologías, medicamentos, procedimientos o prácticas existentes, al aportar escaso o nulo valor en relación al coste que supone.
Pero la popularización del término tiene que ver con la creciente necesidad de controlar los gastos crecientes en sanidad; Canadá, Australia6, Nueva Zelanda, y más cerca de nosotros, el Reino Unido, han incorporado a sus políticas de reembolso o financiación pública, este concepto de desinversión (para una revisión más amplia y detallada, ver Campillo y Bernal)7; en Inglaterra, desde 2006 aparece una recomendación del Chief Medical Officer al Departamento de Salud que fomenta esta política: «…Se solicitará al NICE que elabore guías para la desinversión, que permitan eliminar aquellas intervenciones que no ya son apropiadas, efectivas o que no aportan valor por el dinero gastado»8. La base de datos del NICE de recomendaciones de no realización de intervenciones por falta de evidencia de efectividad tiene en la actualidad un desarrollo amplio con centenares de entradas9.
En el contexto de crisis, la idea de desinversión pasa a ser particularmente atractiva, y ha sido enfatizada en algunos documentos recientes de expertos; en particular el publicado por la Asociación de Economía de la Salud para el Sistema Nacional de Salud (SNS) español10. Es importante plantearse poner en marcha este tipo de políticas con independencia de que nos podamos sentir poco o nada culpables de la actual crisis, o incluso reconociendo que los factores externos (crisis financiera) son más importantes que los internos (imputables a nuestra ineficiencia); y también aceptando la tesis de Jovell, que en contraste con otros servicios del Estado afirma que los problemas de la sanidad configuran una «crisis de éxito» (y no de fracaso como en otros sectores)11. Por razones éticas y por razones de autonomía profesional, nos corresponde a los profesionales sanitarios asumir la desinversión activa en lo que no añade valor, o lo hace de forma muy residual. Y reasignar estos recursos hacia otras funciones, actividades o estrategias que permitan mantener y mejorar la salud de nuestros pacientes y ciudadanos.
Desde luego que el término se presta a polisemias; no toca ahora una revisión de los significados. Quizás «reasignación» fuera más ajustado a lo que cabe hacer en la práctica; porque al ser muy específicos los activos sanitarios (un quirófano, un neurólogo, o un acelerador lineal…) no pueden reconvertirse fácilmente para otras utilidades: los límites a corto plazo suelen ser cambios en el tipo de pacientes, de procedimientos o de tecnologías dentro del mismo marco organizativo; por eso la reasignación puede mejorar la efectividad intraunidades (más valor por los recursos instalados), pero no es muy prometedora como fuente de ahorros relevantes para el sector (al final volveremos a comentar este aspecto).
La ventaja del término desinversión radica en que enfatiza su carácter de política activa (consciente, deliberada y sistemática), en contraste con la lenta caída en desuso de tecnologías obsoletas a la que estamos acostumbrados. Quizás puede ser una desventaja que comparta algo negativo de su uso en el mundo de la empresa: se trata de una política potencialmente conflictiva, ya que todas las desinversiones en el mundo industrial suponen desarraigar activos (de mayor o menor especificidad) e incurren en costes importantes de destrucción, transformación y reasignación. Por eso la bendición política del término ha tenido que esperar a que la crisis ponga más tensión en la necesidad de priorizar y gestionar la escasez.
Con la crisis quedan más en evidencia los costes de oportunidad de una intervención inefectiva; es decir, lo que se podría hacer con los recursos si se emplearan en otra actuación más efectiva y necesaria. Y el balance neto de la desinversión y reinversión tiende a ser más amplio, añadiendo más eficiencia social. De ahí también el mayor rendimiento de esta política de corte asignativo.
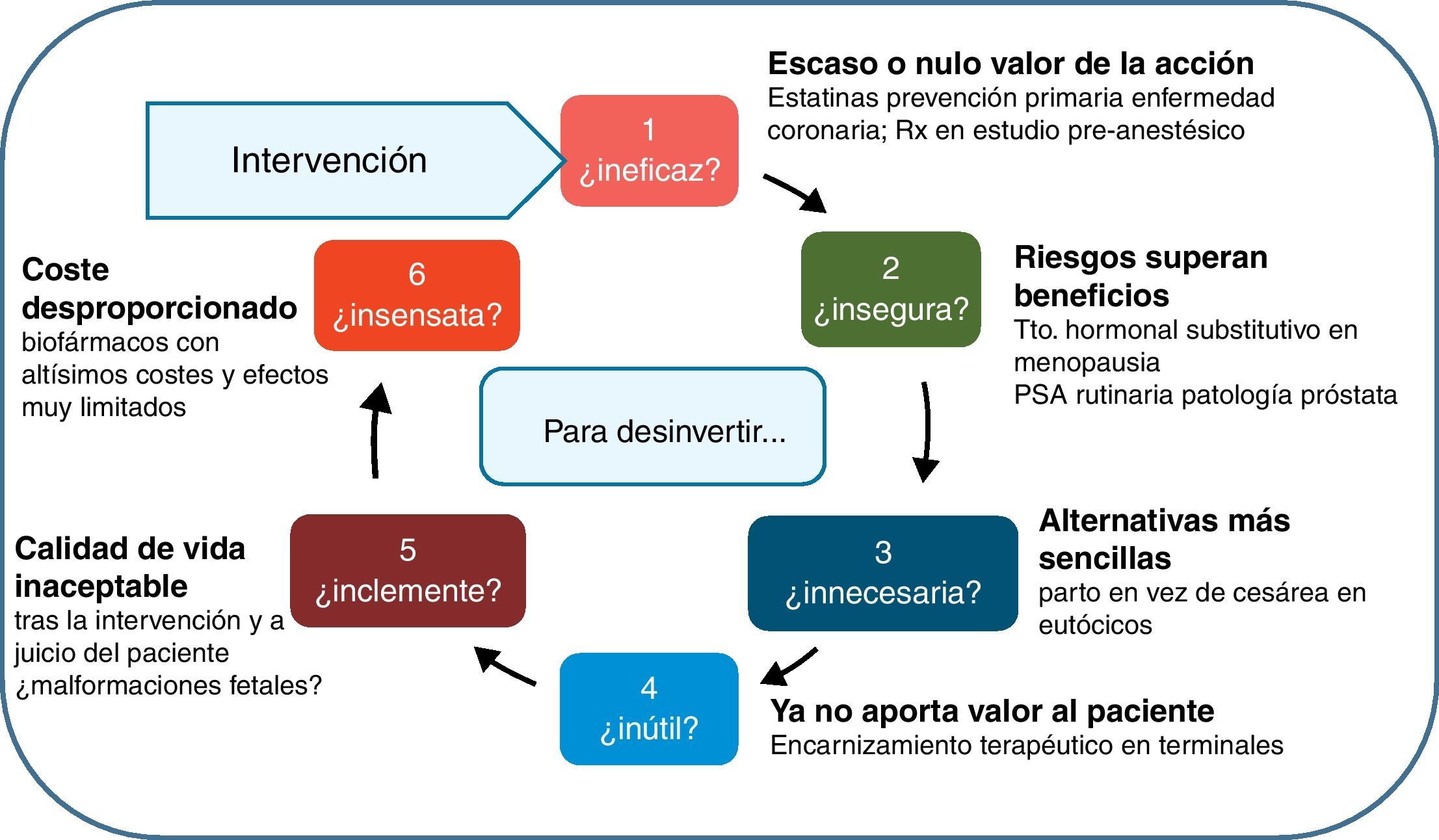
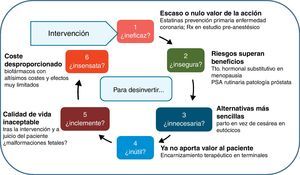
Este trabajo busca facilitar una taxonomía práctica de esta desinversión, identificando nodos de actuación y animando a revisar las prácticas organizativas y clínicas para soltar lastre y ganar altura. Buena parte del enfoque proviene de una breve referencia de Brian Jennett, de una enorme genialidad, publicada en 1984, y donde se preguntaba sobre el uso apropiado de los cuidados intensivos en beneficio de los pacientes12: «No one doubts that intensive care, like many other high technologies, can bring benefit to many patients. But to use this or any other technology inappropriately shows lack of humanity and wastes resources. Such inappropriate deployment may be unnecessary, because the same end could be achieved by simpler means; unsuccessful, because the condition is beyond influence; unsafe, because the risks of complications outweigh the probable benefit; unkind, because the quality of life afterwards is unacceptable; or unwise, because resources are diverted from more useful activities». La traducción más extendida y conocida al castellano, de Pablo Lázaro13, muestra estos criterios de uso inapropiado ordenados así:
- 1)
si es innecesario, es decir que el objetivo deseado se pueda obtener con medios más sencillos;
- 2)
si es inútil, porque el paciente está en una situación demasiado avanzada para responder al tratamiento;
- 3)
si es inseguro, porque sus complicaciones sobrepasan el probable beneficio;
- 4)
si es inclemente, porque la calidad de vida ofrecida no es lo suficientemente buena como para justificar la intervención; y
- 5)
si es insensato, porque consume recursos de otras actividades que podrían ser más beneficiosas.
Sobre esta base, hemos reordenado y modificado levemente el esquema; en la figura 1 se representa un ciclo de preguntas filtro para avanzar en la delimitación de una intervención racional y apropiada; o, visto en negativo, una criba para desinvertir en aquellas cosas que estamos haciendo habitualmente, y que no añaden valor, y en ocasiones, suponen costes y sufrimientos adicionales muy relevantes. En los puntos siguientes iremos abordando cada uno de los nodos de esta figura, para concluir con una reflexión sobre aspectos prácticos en la aplicación de las políticas de desinversión sanitaria.
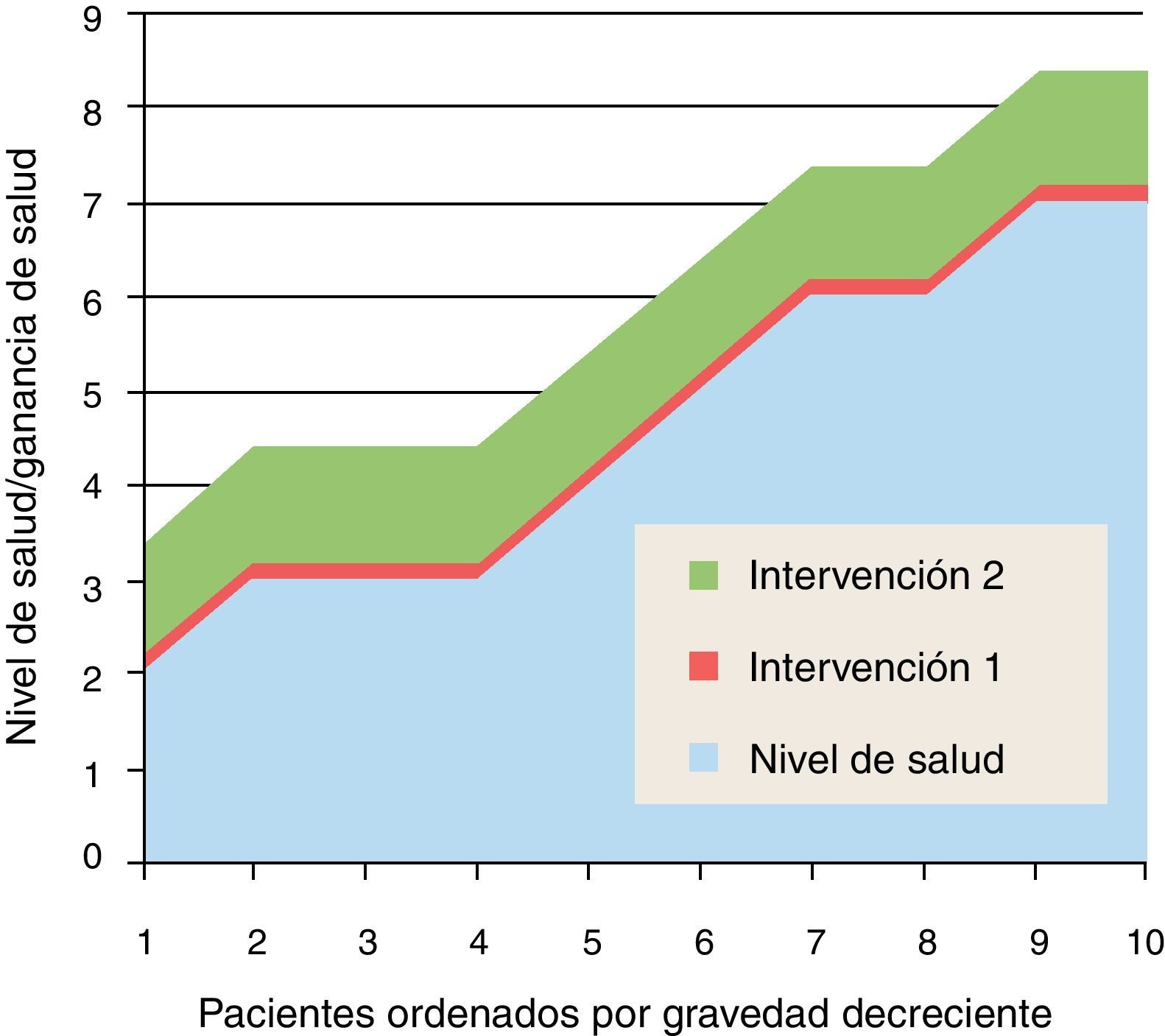
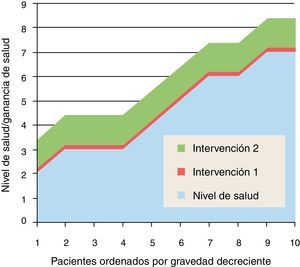
¿Es ineficaz o inefectiva?En las siguientes figuras usamos un modelo muy simplificado para ayudar a la reflexión; representaremos en abscisas los pacientes que pueden beneficiarse de una intervención, ordenados de mayor gravedad (menor calidad de vida o menor nivel de salud) a mayor levedad (mayor calidad de vida o mayor nivel de salud); este orden coincide en general con la preferencia social de tratar primero a aquellos que están peor o que tienen más riesgo de perder la vida; no coincide necesariamente con el criterio de maximización de ganancia de salud, que exigiría tratar en el orden decreciente de ganancia de salud, pero es un razonable compromiso con la priorización práctica; por lo tanto, en el eje de abcisas la prioridad disminuye de izquierda a derecha (siempre que la intervención demuestre que los beneficios compensen los riesgos). En el eje de ordenadas representamos la calidad de vida o nivel de salud del paciente, antes de la intervención y después de la intervención (ganancias).
En la figura 2 se representan 2 intervenciones: la intervención 1 aporta escaso valor, mientras que la 2 genera beneficios clínicamente significativos. La primera pregunta (¿Es ineficaz o inefectiva la intervención?) debería descartar de la financiación y cobertura de los sistemas públicos de salud (quizás también de la buena práctica médica) lo que no genera más efectividad que el propio efecto placebo; y también debería cuestionar aquellas intervenciones de valor clínico dudoso o residual, o aquellas que tienen que ver con el confort (balneoterapia), las preferencias personales (medicamentos de marca frente a genéricos) o acciones «medicalizadas o medicamentalizadas» que pueden ser substituidas por prácticas higiénicas, nutricionales y de autocuidados (tratamiento casero de resfriados, dolores articulares y síntomas menores) con eventual apoyo de consejo sanitario.
El ejemplo del uso de estatinas para la prevención primaria de la enfermedad coronaria es un tema interesante y de actualidad; el hecho de que la gran mayoría de estas moléculas hayan bajado de precio por expirar la patente, ha reavivado el debate sobre su uso generalizado en personas con factores de riesgo cardiovascular; sin embargo, la estrecha efectividad atribuible, y las incertidumbre sobre riegos en muchos años de ingesta, llevan a desaconsejar esta indicación (aunque ahora sean baratas); como dice Schwartz «no tiene nada que ver con el dinero»14.
Otro ejemplo de candidata a desinversión por inefectiva, es la realización rutinaria de una radiografía de tórax en los estudios preoperatorios de pacientes sin datos relevantes en historia y exploración (ver, por ejemplo las recomendaciones actualizadas del Colegio Americano de Radiología)15.
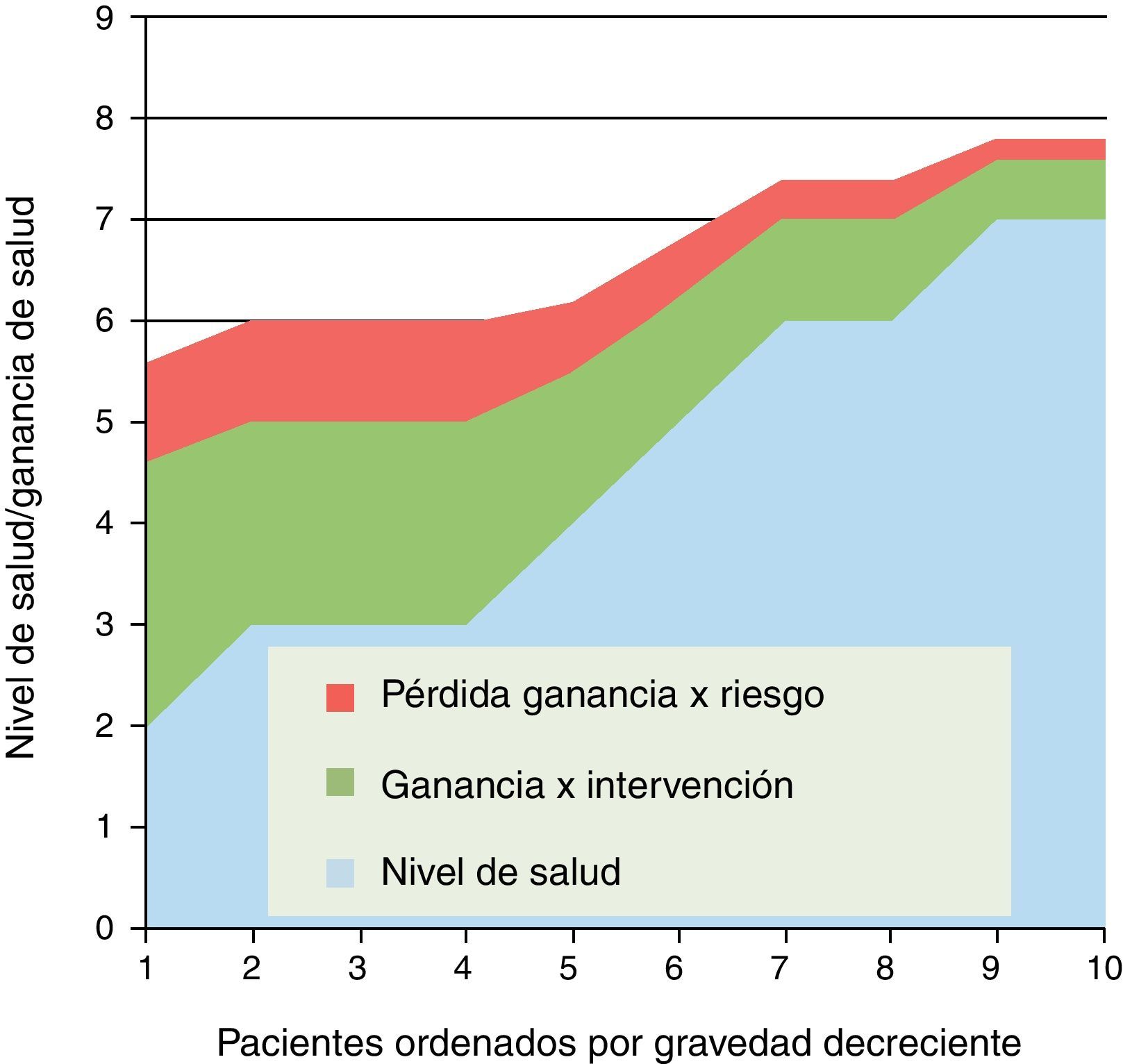
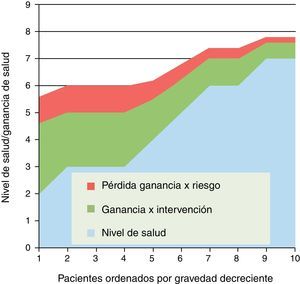
¿Es insegura, en general o para un grupo de pacientes?Debemos partir de la existencia de riesgos en todas las intervenciones sanitarias; incluso las más triviales pueden suponer un daño para la salud (un marcador bioquímico puede convertir a un sano en un enfermo). Una parte de la inseguridad debe evitarse antes de que el medicamento, tecnología o procedimiento se autorice, apruebe o difunda. Pero sabemos que entre eficacia y efectividad hay una enorme brecha; y que los estudios de seguridad poscomercialización o posdifusión deben añadir garantías adicionales (control de pacientes de edades, condiciones o comorbilidades no incluidos en los ensayos clínicos); la limitada ventana temporal donde se evalúa la eficacia, obligaría a que la vigilancia posterior fuera potente y sistemática.
Pero, la seguridad en la práctica clínica implica también un balance entre beneficios y riesgos que ha de juzgarse en cada caso. En la figura 3 representamos el beneficio de una intervención; en este caso la ganancia de salud va disminuyendo según se amplía su indicación a casos menos graves (situación no general pero sí frecuente). Sin embargo este beneficio se merma o erosiona por los riesgos de efectos adversos y complicaciones; y dado que la aparición de estos va ligada a fragilidad, edad y comorbilidad, la zona de riesgos va decreciendo con la gravedad de pacientes (hacia la derecha); pero aunque decrece en términos absolutos, puede no hacerlo proporcionalmente a las ganancias de salud, por lo que a partir de un punto el balance entre riesgos o beneficios se torna dudoso o adverso.
Son frecuentes este tipo de situaciones, en las cuales habría que determinar en qué grupo de pacientes el balance entre beneficios y riesgos esperados determinaría una indicación clínica clara, o cuándo la intervención estaría contraindicada o desaconsejada. Y por supuesto que tanto en los casos claros como en los dudosos, el paciente debería ser el último juez en la decisión informada. Y, cuando hablamos del efecto de expansión del tratamiento, hay que evaluar dicho balance cuando se aplica en enfermos más graves o menos graves que los del grupo donde se ensayó la eficacia.
Sigue este patrón la conocida historia del tratamiento hormonal substitutivo con estrógenos (o combinada con progestágenos) para tratar los síntomas de la menopausia y prevenir fracturas por osteoporosis, que fue generalizado con un muy débil fundamento científico, para evidenciar en estudios posteriores una serie de riesgos que han llevado a limitar el tiempo de aplicación y a situarlo solo como segunda línea de actuación16.
Un caso especial son las intervenciones preventivas (inmunizaciones, cribados, quimioprofilaxis, etc.) en las cuales hay algún tipo de agresión o daño físico vinculado a un beneficio poblacional o individual de reducción del riesgo de enfermar; en estas situaciones el principio bioético de la «no-maleficencia» debería estar reforzado, y el gradiente entre beneficios y riesgos ser extraordinariamente amplio.
El caso de la determinación de la PSA (Antígeno Específico Prostático) en varones asintomáticos para cribar el cáncer de próstata, ya fue desaconsejado por la US Preventive Services Task-Force desde 2008; en 2011 tras una revisión sistemática en octubre de 2011 se afirma que «tras cerca de 10 años el cribado basado en PSA detecta más casos de cáncer de próstata, pero no consigue reducir (o sólo muy poco) la mortalidad específica…»17. El estudio europeo aleatorizado de 182.000 varones entre 50 y 74 años, encuentra una ligera reducción en la mortalidad específica, pero señala también el alto riesgo de sobre-diagnóstico18.
¿Es innecesaria, porque lo mismo se puede conseguir de forma más sencilla, menos agresiva y más económica?La lógica médica no siempre es razonable; y menos aún cuando la corriente de los incentivos estructurales va en sentido contrario a la contención y la austeridad. Cambiar ligeramente la conducta nutricional y de ejercicio físico de un adulto obeso, puede suponer grandes éxitos en el control de diabetes tipo ii, de artrosis de rodilla y de hipertensión; este sorprendente 3×1 supone apartarse de la fascinación tecnológica y el irresistible atractivo de la intervención clínica convencional (aparte de que en las organizaciones no suele haber apoyos para este tipo de tratamientos); otro tanto cabría hablar de la deshabituación tabáquica.
A veces simplemente se trata de una desmesura terapéutica, como en el caso del uso inapropiado de antibióticos; aparte de los riesgos clínicos e económicos concretos, incurrimos en peligros ciertos de provocar resistencias que anulen su efectividad futura19.
La opción de cesárea frente a parto es un buen ejemplo: el 20% de nacimientos en el sector privado en España tienen un 34% de cesáreas, mientras que en la sanidad pública la tasa es del 22%; y no parece probable que las distocias castiguen con tal nivel de severidad a los usuarios de la sanidad privada20.
En el terreno diagnóstico la posibilidad de obtener información significativa para la toma de decisiones con un uso mucho menor de pruebas de laboratorio, de imagen y de consultas de control clínico, marca diferencias enormes en los perfiles de consumo y gasto; Fisher et al. llegaban a demostrar que con similar calidad asistencial, un grupo de hospitales estadounidenses podía llegar a gastar un 72% más de recursos debido fundamentalmente a este tipo de acciones diagnósticas y de control que acompañaban al procedimiento principal21.
La fantasía de reducir a cero la incertidumbre clínica, lleva a la innecesaria pulsión por diagnosticar hasta la saturación. Ponemos barreras de contención cuando la exploración daña (radiología); pero no somos tan considerados cuando solo añadimos incomodidades al enfermo (prácticas intervencionistas), y mucho menos cuando los efectos adversos son los costes económicos al sistema de salud. También los hábitos descuidados llevan a una repetición de pruebas de laboratorio que no añaden información relevante para las decisiones; en un estudio australiano de un departamento de un hospital docente, se estimaba en un 68% los test que no habían contribuido al manejo clínico22; en un estudio amplio con una base de datos de Ontario, se estimó que para el conjunto de Canadá la repetición redundante de pruebas de laboratorio en 8 determinaciones suponía entre 14 y 36 millones de dólares (canadienses) anuales23.
¿Es inútil porque ya no es capaz de aportar ganancia de salud al paciente concreto?Cuando la situación clínica del paciente está determinada por un proceso principal de notable gravedad, el resto de los procesos deben ser reinterpretados en función del principal; y cuando el paciente progresa hacia estadios terminales, la prioridad de aportar confort, analgesia y control de síntomas toma el relevo a las intervenciones clínicas orientadas al problema principal. Esta razonabilidad de las intervenciones de acuerdo a su contribución al paciente concreto en su contexto clínico, está muy ausente en la medicina fragmentada y atolondrada que desarrollamos, y explica esta insólita combinación entre excelentes procedimientos, mediocre calidad clínica, y mala calidad interpersonal y subjetiva24. Son ejemplos de intervenciones inútiles los ingresos en Unidades de Cuidados Intensivos de pacientes terminales (que inspiraron a Jennett para su taxonomía de lo inapropiado), o de cualquier manifestación del encarnizamiento terapéutico cuando se ha sobrepasado la posibilidad de añadir cantidad o calidad de vida.
¿Es inclemente porque la intervención solo puede ofrecer unas condiciones inaceptables de calidad de vida, a juicio experto y del paciente?A veces una intervención no ofrece ventajas, aunque la lógica clínica pueda aconsejarla con carácter general; puede ser que tengamos la posibilidad de sacar adelante un embarazo con un feto que sufre de graves malformaciones; pero la esperanza y calidad de vida resultante puede llegar a ser inaceptable, juzgada por parte de sus progenitores; y de hecho, la sociedad despenaliza y habilita la interrupción voluntaria del embarazo en este tipo de casos (sujeto a una serie de restricciones).
La intervención del adenoma benigno de próstata es otro típico ejemplo de medida donde el beneficio esperable (reducción de la disuria) debe ser balanceado contra los riesgos de incontinencia e impotencia (además de los propios de la cirugía); y las preferencias del paciente son determinantes para la decisión apropiada (ver una guía informativa para los pacientes25 y también existen videos que orientan la elección informada a los pacientes, presentando los pros y contras).
O bien, al final de la vida, serían inclementes aquellas intervenciones invasivas o molestas que no tuvieran como objeto reducir el dolor, aliviar síntomas molestos o conseguir mayor confort. Como dice Marcos Sancho referido a los cuidados paliativos «…Algunos profesionales del Equipo, quizás debido a su menor cualificación, no reciben, a mi juicio, la consideración que merecen. Me refiero a las Auxiliares de Enfermería. Si alguien ha definido los cuidados paliativos como ‘cuidados intensivos de confort’ es fácil adivinar la importancia que tiene el trabajo de estos profesionales auxiliares. Servirá de muy poco un tratamiento médico correctamente instaurado, el asesoramiento de un Psicólogo Asistente Social, si el enfermo tiene la cama con migas de pan, o las sábanas arrugadas, o el pijama mojado…»26.
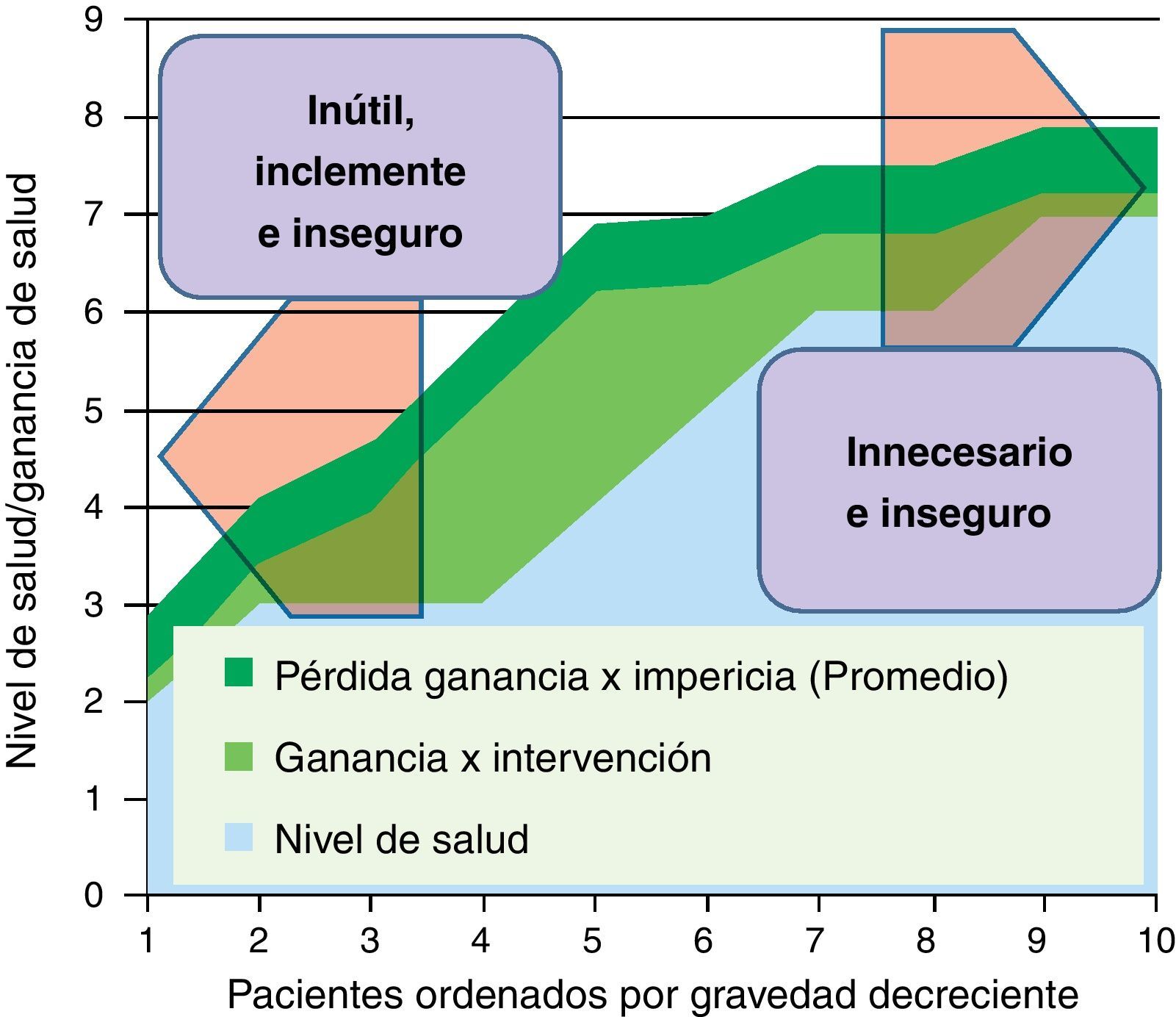
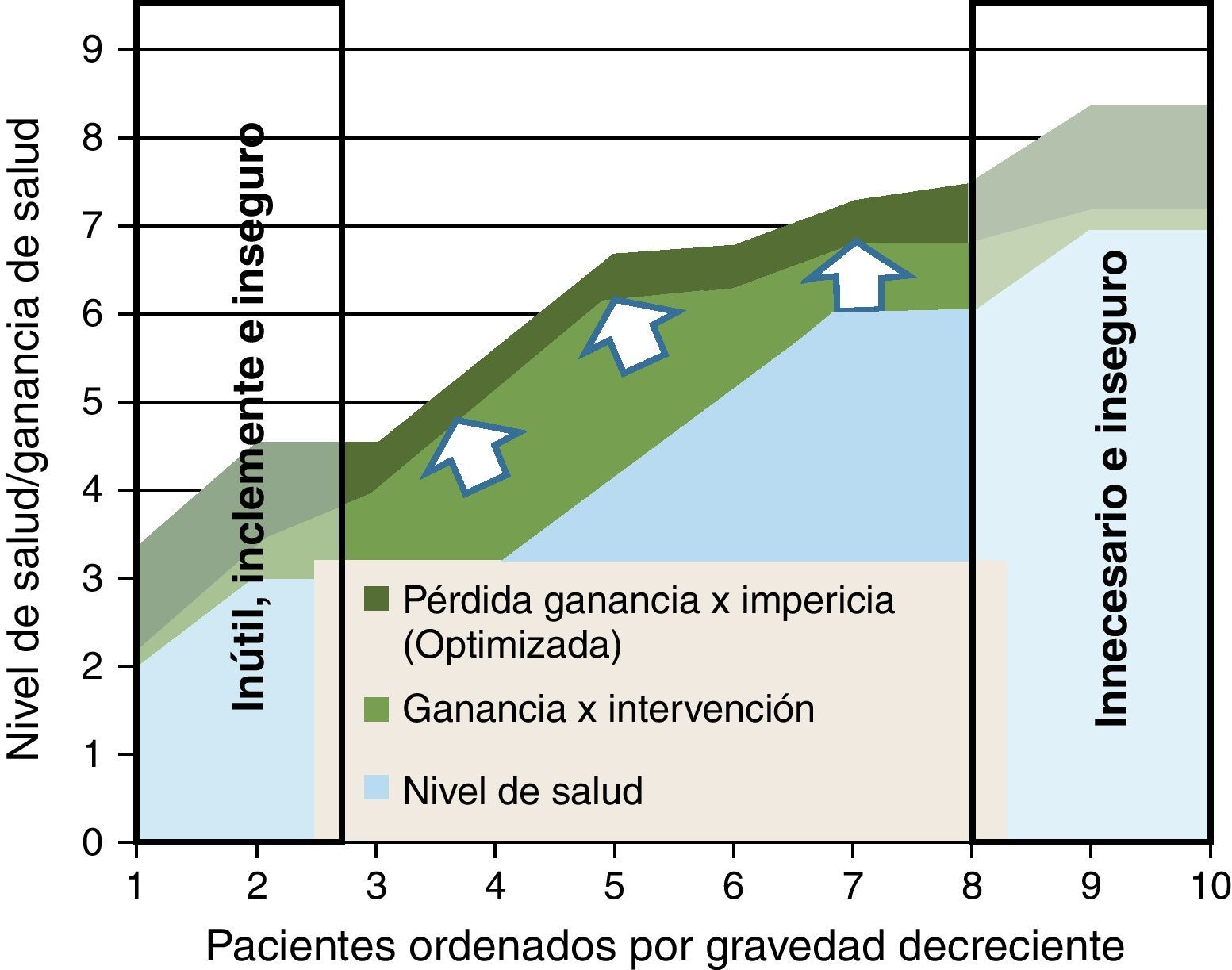
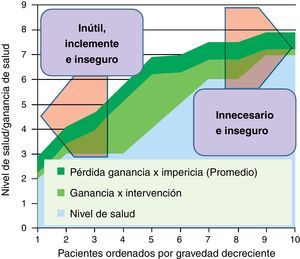
En la figura 4 representamos una situación frecuente. La ganancia de salud de la intervención no se produce por igual en todos los niveles de gravedad; son mayores en personas que no están ni tan graves (donde la comorbilidad reduce el gradiente de beneficios en relación a los riesgos) ni tan leves (indicación cada vez más dudosa por su propio nivel de salud). Además, representamos un tipo de merma de beneficios que tiene que ver con las curvas de experiencia de los médicos en la realización de intervenciones; la «impericia promedio» reduciría una proporción de los potenciales beneficios en toda la línea: una forma de incrementar la efectividad y reducir los efectos adversos es concentrar procedimientos en grupos de profesionales que consolidan su curva de experiencia en los mismos. En la zona derecha de la figura (pacientes menos graves), se concentraría el problema de la inseguridad y las prácticas posiblemente innecesarias. Y en la zona izquierda (pacientes más graves), además de los riesgos (que podrían ser más asumibles vía compasiva por el estado crítico de los pacientes), las intervenciones podrían ser inútiles e inclementes.
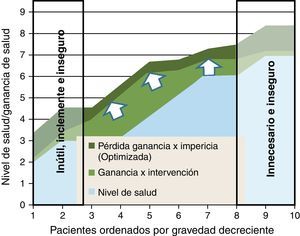
En la figura 5 representamos un doble proceso de racionalización; una desinversión en el segmento donde las intervenciones pueden ser innecesarias, inútiles, inclementes o inseguras; y una focalización de los clínicos más expertos para que sus curvas de experiencia optimicen la asistencia a aquellos casos donde pueden esperarse mayores ganancias de salud (fig. 5).
Es interesante señalar que cuando concentramos estos casos en manos de quienes acumulan más pericia (por ej., microcirugía de sarcomas, transplantes…), además de asegurar un número mínimo de intervenciones que preservan las competencias y habilidades adquiridas, consigo una reducción de costes, ya que puedo trabajar a costes marginales menores respecto a otros modelos basados en la dispersión de la intervención en múltiples y diferentes hospitales.
Sería por tanto una ganancia doble: más efectividad (calidad y seguridad), y menos costes de producción (posibles economías de escala).
¿Es sensato sacrificar un gran volumen de recursos para obtener un resultado insignificante?Este último nodo de decisión es posiblemente el más polémico, puesto que partimos de la tendencia a considerar que todo lo que añada un átomo de eficacia debe ser incorporado a la cobertura y financiación pública, aunque supongan una montaña de costes. El umbral de referencia de 30.000 libras o euros por año de vida ajustado por calidad, formulado como indicativo por encima del cual la predisposición social a pagar puede debilitarse, es escasamente aceptado socialmente cuando se plantea como debate explícito. Los resultados insignificantes, pueden ser muy significativos para un grupo reducido de pacientes. Por otra parte, estos umbrales suelen ser clamorosamente ignorados por los clínicos cuando lo paga la sociedad (aunque cuando lo pagan los pacientes tienden a compadecerse de su dificultad económica vía relación de agencia).
De hecho, en encuestas a oncólogos norteamericanos, la sensibilidad a costes de fármacos parece de difícil activación: «La mayoría de oncólogos académicos manifestaron que su práctica clínica no estaba influenciada por los costes, ni estos deberían limitar el acceso a la asistencia efectiva… Los umbrales de coste-efectividad subían a 300.000 dólares por año de vida ajustado por calidad, un valor muy superior a los 50.000 habitualmente referenciados»27. La aparente intransigencia en no aceptar límites de costes cuando hablamos de la salud de las personas (siempre que la investigación demuestre eficacia), se disipa rápidamente cuando se aprueba la financiación pública: el uso se generaliza más allá de las indicaciones para las cuales se demostró eficacia; así, por ejemplo, en el caso del rituximab, un estudio en Estados Unidos detectaba que el 75% no estaba incluido en las indicaciones autorizadas28; si a eso le llamamos uso compasivo, quizás lo pueda ser para el paciente, pero no para el sistema sanitario ni para el conjunto de la financiación pública.
En un mundo con gran abundancia de recursos, seguramente no tendríamos que entrar en esta engorrosa tarea de priorizar; todos sabemos que no tienen la misma importancia o significado una prótesis aórtica, que una rodilla, otra auditiva y otra de mama; pero entrar a distinguir prioridades supone inmediatamente enfrentarse a colectivos con legítimas expectativas de conseguir mejorar su salud. Una buena gestión de nuestro nivel actual de cobertura y prestaciones podría evitarnos entrar en este tipo de «hard choices» (decisiones dramáticas) que son habituales en países de renta media o baja, o sin sistemas públicos de salud universales y de calidad. Pero esto ni significa que no debamos diferenciar entre aspectos puramente clínicos (patología) de aspectos de expectativas funcionales (fertilización in vitro), y otros de preferencias personales (cirugía estética no reparadora).
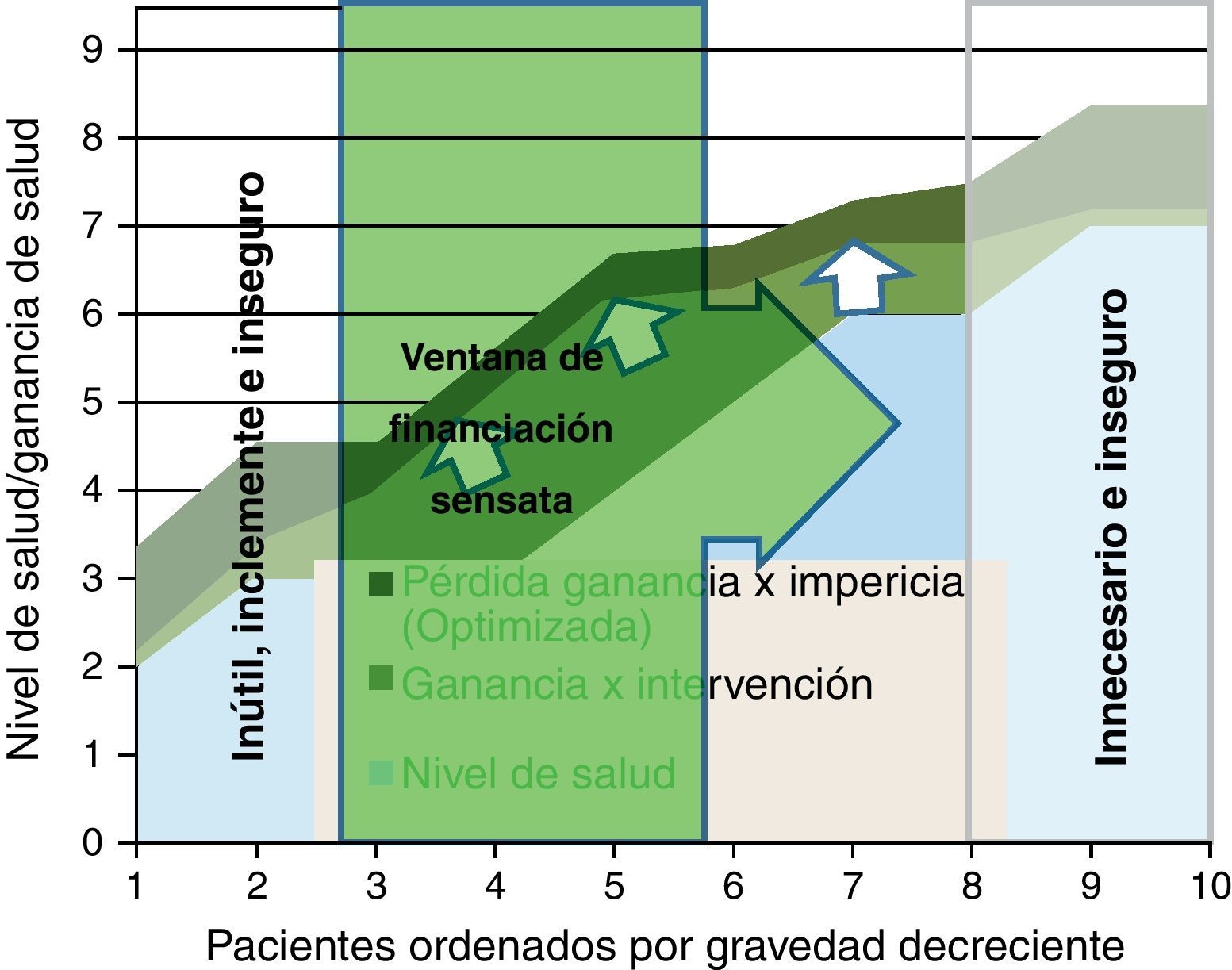
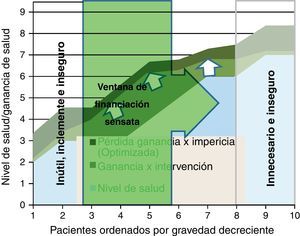
Para representar esta última barrera de racionalidad económica en el modelo de figura que venimos usando, hemos construido una ventana a través de la cual podemos identificar el número de pacientes que sería sensato atender de acuerdo al criterio de coste-efectividad (fig. 6); podemos determinar este nivel de eficiencia asignativa en donde nos parezca apropiado (coste por año de vida ajustado por calidad); y al aplicarlo (por ejemplo 30.000 € por QALY) solo aquella parte de las intervenciones cuyo coste por ganancia neta de salud superara el dintel entrarían en la ventana de coste-efectividad.
Esta ventana lógicamente se sitúa desde los primeros pacientes de mayor gravedad donde se supera el umbral (izquierda), y se extiende hasta los menos graves que cumplen el criterio. Pero la ventana sería móvil: si mejora la efectividad, se extiende la pericia clínica o se disminuyen los costes, la ventana podría ampliarse a más pacientes. En último término, lo que se precisa es incorporar la distinta perspectiva de ganancia de salud que tienen los grupos de pacientes ante una intervención; lamentablemente esta información suele ser poco disponible, y quedar sepultada bajo los ratios de coste-efectividad media.
Además, debemos considerar que esta figura no representa la dimensión financiera: el coste de tratar n pacientes puede requerir una financiación que en el corto plazo sea imposible de recaudar (por ejemplo, porque hay que desinvertir en otras intervenciones o sectores); y tampoco tiene en cuenta que las efectividades de una intervención suelen ser «medias» y enmascaran grupos de pacientes con coste-efectividad muy diferentes; si pudiéramos identificar subgrupos, las estrategias de cobertura serían claramente diferenciadas, y se alcanzarían mejoras de impacto muy notables.
La desinversión en la práctica: posibilidades y limitacionesLa desinversión total (quitar de raíz una intervención) seguramente será una rareza, vinculada más bien a problemas de seguridad identificados tardíamente, o a cambios en las valoración social sobre lo que debe ser financiado (ortodoncia, estética, etc.). El problema que subyace es que nuestra ignorancia nos lleva a medir la «efectividad media», lo que eclipsa a grupos que pueden tener perfiles de ganancia de salud relevantes29.
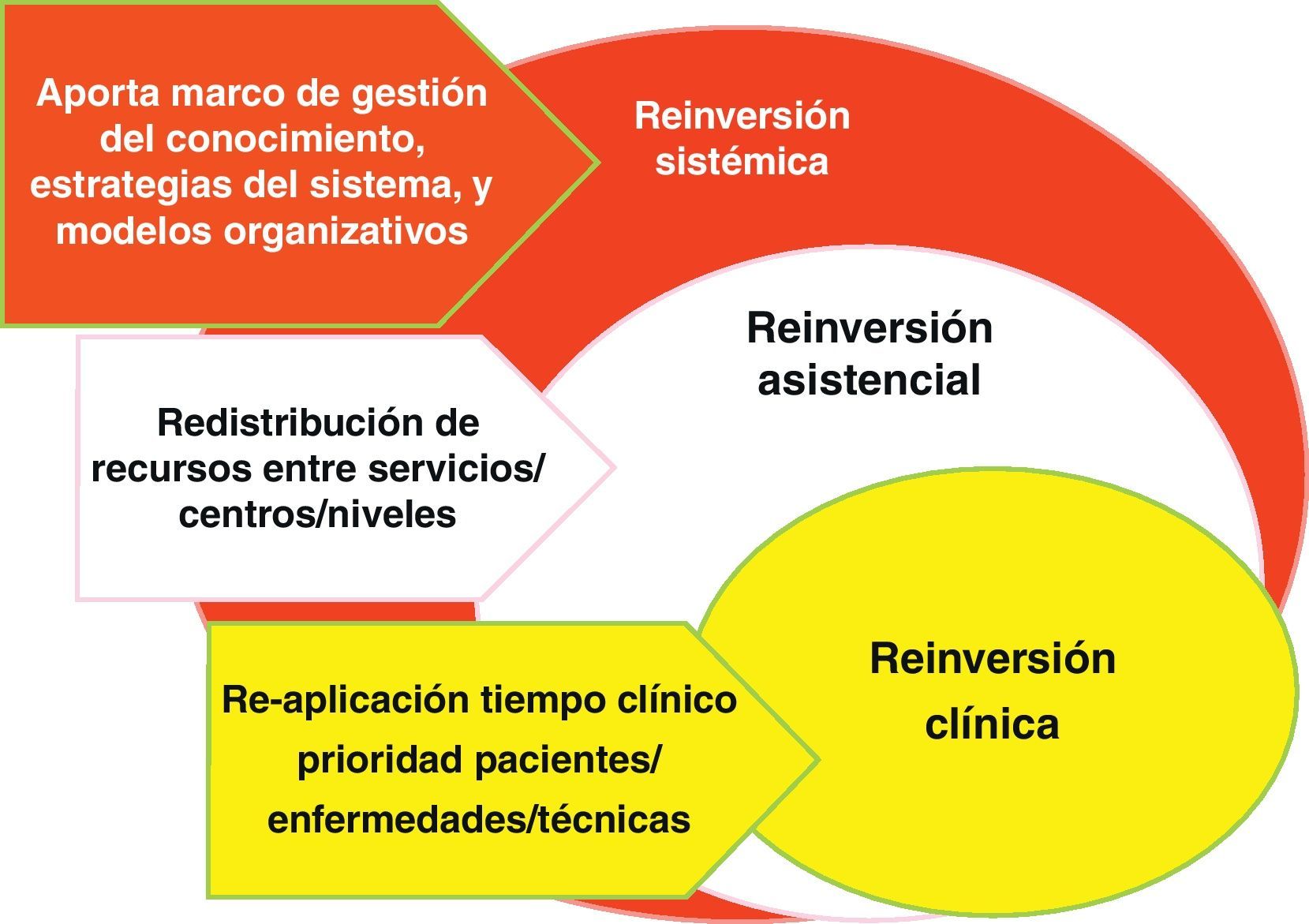
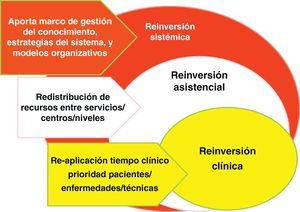
Además, las barreras a la desinversión chocan con la estructura del poder médico y del poder institucional; en la figura 7 se dibujan estas barreras: abajo, las de los servicios de especialidad, donde pueden darse un tipo de desinversión y reinversión clínica dentro de los límites estrictamente «Flexnerianos» (término usado habitualmente para referirse al poder de las especialidades médicas organizadas en servicios, derivado de los cambios en la formación médica promovidos por Flexner en Estados Unidos en 1910); en medio, la organización en los centros sanitarios, donde lo habitual es modular los ritmos de crecimiento de unos servicios, unidades y tecnologías en relación a otros (desinversión y reinversión clínica); y arriba, habría otro tipo más sistémico, donde la macro-gestión de red sanitaria buscaría crear las condiciones de conocimiento (gobierno clínico) o de organización (gobierno de red).
La reinversión clínica es la realizada por los propios profesionales en los microsistemas asistenciales; es posiblemente la que tiene mayor potencial de mejora de la calidad, aunque el menor de ahorros financieros para el sistema, salvo en aquellos bienes y servicios que son incorporados a los centros sanitarios desde el exterior como suministros para incorporar a la atención sanitaria: particularmente los medicamentos, productos sanitarios, y consumibles de tecnologías. Cuando los equipos clínicos dejan de ver pacientes que no necesitan citas tan frecuentes y se abstienen de hacer intervenciones con poco o nulo valor, su tiempo, consultas, quirófanos y camas tienden a llenarse de demanda inhibida que estaba esperando hueco para ser atendida. E incluso los insumos que nos ahorramos dejando de hacer unas cosas, son substituidos por otros que aportan valor, pero no necesariamente reducen la carga financiera final. «Value for Money» no significa menos dinero sino «más valor por el dinero».
En todo caso, hemos de considerar que para conseguir mejorar la efectividad a través de la reinversión clínica se necesita combinar el aporte de información y conocimiento, junto con el avance de los modelos de gobierno y gestión clínica (motivación, incentivos, y marco bioético que enfatice el profesionalismo).
La reinversión asistencial, sería la ejecutada desde la mesogestión; su potencial de mejora de la calidad es bajo, porque su aplicación tiende a ser inespecífica (trabaja negociando cambios de inputs entre departamentos o servicios), aunque su capacidad de ahorro financiero puede ser más apreciable (al menos en el corto plazo). La función directiva también puede incrementar la eficiencia técnica, vía mejoras uso de los inputs (cumplimiento de tiempos contratados, suministros más económicos, menos despilfarro de recursos, etc.); no está claro si estos incrementos en la productividad de los recursos pueden ser clasificables como reinversión; en todo caso, son un componente esencial de las políticas de sostenibilidad.
La viabilidad de las reasignaciones de recursos entre centros, unidades y líneas de producción, como política de «desinversión» de lo inefectivo, dependerá decisivamente de cómo se articule la relación entre mesogestión y microgestión; solo donde existe una relación contractual consolidada, con liderazgo de áreas clínicas o servicios, experiencia en trabajo por procesos y un amplio elenco de valores compartidos, cabrá esperar una razonable alineación en los objetivos de gestores y profesionales (alineación no significa identidad, ni tampoco coincidencia plena y satisfactoria en los acuerdos).
Y, finalmente la reinversión sistémica nos lleva a la macrogestión, y su función radica en crear los recursos de conocimiento (marcos amplios de evaluación de tecnologías, al estilo «NICE»), las estrategias que señalizan los objetivos y valores de la institución (por ejemplo la estrategia de crónicos), y los modelos organizativos que articulan los recursos y actúan como facilitadores de la acción (tanto modelos de gestión, estructura gerencial primaria-especializada, sistemas de pago, gestión contractual, política de personal, etc.). En esta clave es donde se juega la posibilidad de consolidar respuestas coherentes y de largo alcance; y quizás sea este ámbito donde la sostenibilidad de los sistemas públicos de salud se vincule de forma más clara con el intento de desinversión de lo inefectivo y reinversión para la viabilidad del Sistema Público de Salud.
Pero para ello las autoridades sanitarias deben hacer bien su trabajo; la regulación del sistema exige múltiples cambios que deben ponerse en marcha en la línea de lo señalado antes; hacer política sanitaria implica un compromiso reformista y regeneracionista que poco tiene que ver con recortar o con culpar.
Finalmente, caben dudas de si en último término la desinversión produce realmente ahorros, o lo hace en una escala suficiente como para satisfacer a las autoridades económicas que en entorno de la crisis esperan reducciones presupuestarias significativas. En el Reino Unido parece que se duda de esta virtualidad recortadora30. En España tampoco cubrirá la fantasía de contención de costes que pueden albergar los Ministerios de Economía y de Hacienda. Pero conviene no olvidar que el objetivo económico fundamental ha de ser no pagar más de lo que valen las cosas; y la desinversión de lo inefectivo va directamente hacia esta diana (aunque haya que descontar el propio coste de identificar y realizar la desinversión).
En todo caso, aunque solo sea por mantener la calidad asistencial, la dignificación de la buena práctica médica y la cohesión del SNS, bien vale la pena intentarlo.
FinanciaciónNinguna.
Conflictos de interesesEl autor trabaja en una institución de investigación del Sistema Nacional de Salud español.
A Carlos Campillo por sus valiosos comentarios y referencias aportadas.