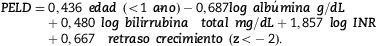El presente documento recoge las conclusiones alcanzadas en la II Reunión de Consenso organizada por la Sociedad Española de Trasplante Hepático (SETH) en noviembre de 2008. En esta reunión se actualizaron los criterios de acceso y prioridad en la lista de espera, se abordó un conjunto de cuestiones clave en los programas de trasplante infantil y se avanzó en la implantación de sistemas de medición de la calidad de los programas de trasplante hepático (TH)1.
1Lista de esperaSistemas de medición de la gravedad de la insuficiencia hepatocelularEl momento de acceso de un receptor de TH a la lista de espera (LE) continúa sometido a una gran variabilidad clínica. La forma más adecuada de homogeneizar este criterio precisa del establecimiento de un sistema de medición de gravedad de la enfermedad hepática que determine una puntuación mínima con la que se tenga la certeza de que el propio trasplante no genera una mortalidad superior a la evolución natural de la enfermedad, y que además aumente claramente la supervivencia tras el TH. Existe un acuerdo unánime sobre la bondad de los sistemas de medición actuales en informarnos sólo sobre mortalidad en LE. Sin embargo, se debe insistir en que estos sistemas de medición informan sobre esta variable, la mortalidad, pero sin aportar información adicional de otros aspectos que clásicamente se han tenido en cuenta para indicar el trasplante, como calidad de vida, repercusiones sociales, etc.
La clasificación de Child-Turcotte-Pugh (CTP), y más recientemente la fórmula MELD (Model End Stage Liver Disease), son referencia para evaluar el pronóstico en los enfermos cirróticos. Mientras la primera está constituida por 3 variables objetivas y 2 de valoración subjetiva, el sistema MELD se encuentra formado por 3 variables objetivas sin un límite superior en su valoración (ausencia de “efecto cielo”)2. Esta última ha supuesto un avance para definir mejor las categorías de enfermos en riesgo y priorizar según el pronóstico a corto plazo, de acuerdo con la política de “primero el más enfermo”. Una desventaja de la fórmula MELD es la pérdida de precisión pronóstica en períodos superiores a 3 meses. La clasificación CTP ofrece “c estadísticos” incluso superiores a la fórmula MELD para períodos más allá de un año3,4. Tanto la clasificación CTP como la fórmula MELD muestran una aceptable exactitud para establecer el pronóstico de un paciente con hepatopatía crónica, y así, en enfermos hospitalizados, el “c estadístico” es de 0,84 y 0,87 respectivamente2. A pesar de ello, las variables que manejan presentan una variación interensayo no despreciable y pueden alterarse por factores extrahepáticos, como el tratamiento diurético, hemólisis o sepsis.
Recientemente se ha sugerido que la incorporación del sodio a la fórmula MELD podría mejorar su exactitud5,6. Sin embargo, esta fórmula se encuentra también sometida a variaciones interensayo, además de la potencial manipulación que inadvertidamente se puede generar por el uso de diuréticos. Se desconoce también si su uso puede generar un aumento de la mortalidad de causa neurológica. Por todo esto, parece prematura su utilización en tanto no se disponga de datos de validación en grupos más amplios y de diferentes cohortes.
- 1.
La clasificación CTP como el sistema MELD son métodos adecuados para medir la gravedad de los enfermos con hepatopatía crónica. No obstante, los sistemas de puntuación utilizados deben evaluarse periódicamente y ser flexibles a futuras incorporaciones de variables que aumenten su precisión.
En un estudio de registro que estudia el trasplante como procedimiento terapéutico con intención de tratar, se pudo identificar un punto de corte en la fórmula MELD, y a partir de éste el trasplante se comporta como protector. Este nivel se estableció entre 15 y 17 puntos7. No obstante, según una reciente comunicación del mismo registro, cuando se clasifica a los enfermos en función de la etiología, los pacientes afectados de enfermedad hepática alcohólica y probablemente alguna otra etiología no asociada a virus C se pueden beneficiar del trasplante con una puntuación MELD por encima de 12 puntos. Parece claro que por debajo de esta puntuación los pacientes que reciben trasplante afrontan más riesgo de muerte que los candidatos8. De forma parecida, estudios de casos y controles han apuntado que el trasplante se comporta como protector con una puntuación CTP por encima de 8 puntos9,10.
- 2.
Se considerarán candidatos a inclusión en LE aquellos pacientes con enfermedad hepática avanzada que muestren una puntuación en la fórmula MELD de 12 puntos o más, o una categoría B-8 o superior de la clasificación CTP.
Existe consenso unánime en que la gestión de la LE se realizará de acuerdo con criterios de gravedad y no sobre la base del tiempo de permanencia en lista. Este criterio temporal sólo se tendrá en cuenta en aquellas excepciones en las que el paso del tiempo influye en la progresión de la enfermedad sin que las fórmulas de medición de la gravedad de la función hepática la reflejen adecuadamente (ver más abajo).
La valoración de la gravedad se realizará de acuerdo con la fórmula MELD. Entre los pacientes que se encuentran en lista de espera, se considerarán candidatos a priorización todos aquéllos con una probabilidad de muerte en lista superior a un 10%. Con el actual sistema de distribución de órganos, existe una variabilidad considerable en el tiempo medio de lista de espera entre los diferentes grupos, factor importante para considerar, dada la estrecha relación entre el tiempo en lista de espera y la mortalidad11. De esta forma, se considera que un riesgo de mortalidad del 10% puede corresponder a una puntuación que oscila entre 15 y 19 puntos en la fórmula MELD, dependiendo de si el tiempo en lista es más o menos prolongado. Debe tenerse en cuenta que la puntuación MELD presenta una mayor variabilidad en función de la gravedad del paciente. Las puntuaciones MELD elevadas pueden presentar más variaciones que las de menor valor en enfermos más estables. Desde este documento de consenso se anima a los diferentes grupos de trasplante a tratar de identificar cuál es el tiempo de espera medio según las diferentes categorías de MELD.
- 3.
La distribución de órganos para TH debería hacerse según criterios de gravedad. Los pacientes con una probabilidad de mortalidad en lista superior al 10% (MELD >15–19) deberían priorizarse. La puntuación deberá de revisarse con una periodicidad mensual para aquellos candidatos priorizados, y trimestralmente para el resto de los enfermos.
Así como la gravedad y la necesidad de trasplante pueden calcularse fácilmente para aquellos enfermos en los que la enfermedad hepática es la causa de muerte, existen, sin embargo, otras enfermedades y comorbilidades asociadas o no a enfermedad hepática que determinan necesidad de trasplante y no pueden evaluarse mediante las fórmulas y sistemas clásicos de medición pronóstica; son las llamadas excepciones. En este documento se consideran 2 aspectos para su correcta evaluación: por una parte, aquellos enfermos que deben considerarse para trasplante y no precisan de priorización, y, en segundo lugar, aquellos enfermos a los que por progresión de la enfermedad o por su riesgo de muerte se los puede excluir de la LE. En su elaboración se han tenido en cuenta la evidencia científica y la práctica establecida, así como las opiniones de expertos.
HepatocarcinomaPuede considerarse el paradigma de las excepciones en las que la insuficiencia hepática no es “per se”, lo que realmente amenaza con acortar la vida, sino la progresión de la enfermedad tumoral hasta un punto donde la curación no sea posible12. Las recomendaciones e indicaciones para trasplante en el hepatocarcinoma deberán de ajustarse a las recomendaciones recogidas en el documento de consenso recientemente elaborado por diferentes sociedades científicas13. En el citado documento, los criterios de Milán son la referencia para inclusión de enfermos en LE. Más complejo resulta priorizar y dar una puntuación a aquellos enfermos que se considera que se encuentran en riesgo de progresión. En esta reunión de consenso se ha coincidido de modo unánime en considerar hepatocarcinomas de alto riesgo, y por tanto candidatos a priorización, a aquéllos con un nódulo único mayor de 3cm o 2–3 nódulos, alfa-feto proteína mayor de 200 y fracaso del tratamiento adyuvante en pacientes con nódulos inferiores a 3cm.
- 4.
La priorización de los enfermos de alto riesgo debería otorgar una puntuación MELD inicial que garantizara una probabilidad de exclusión de lista similar a la probabilidad de exclusión de enfermos sin hepatocarcinoma. Esta puntuación se incrementaría en función de la permanencia en LE.
Desde este documento se anima a los grupos de trasplante a la formación de comités locorregionales en los que se establezcan los criterios de priorización de acuerdo con las guías de consenso. Debido a que determinados grupos incluyen enfermos con hepatocarcinoma con criterios expandidos (más allá de los criterios de Milán), estos enfermos se referirán a los citados comités para su adecuada priorización.
Ascitis y síndrome hepatorrenalEn los enfermos con ascitis refractaria, sin deterioro de la función renal, existe poca evidencia para sustentar una prioridad adicional a la derivada de su puntuación MELD basal12. El síndrome hepatorrenal (SHR) de tipo I es un cuadro clínico que comporta una mortalidad elevada14. Se recomienda priorizar a estos enfermos utilizando para el cálculo de la cifra MELD el valor de creatinina a su ingreso, antes de la intervención terapéutica sobre el SHR.
Síndrome hepatopulmonarSe considera que debe priorizarse “per se”, dado el riesgo de exclusión de lista por deterioro de la función respiratoria. Una pO2mmHg y el shunt documentado deberían ser suficientes criterios para priorizarse15. Debido a su progresividad se debe contemplar el tiempo de permanencia en LE.
Hipertensión portopulmonarNo existen evidencias sólidas de que el trasplante sea el tratamiento más adecuado de la hipertensión portopulmonar, pero se ha observado que puede mejorar en aquellos casos en los que predomina el componente hipervolémico-hiperdinámico. Característicamente, cursa con una presión media de la arteria pulmonar inferior a 45mmHg y con resistencias vasculares pulmonares no elevadas. No se conoce su velocidad de progresión con los tratamientos actuales. La fórmula MELD tampoco mide adecuadamente la gravedad pronóstica asociada a esta entidad. Se asume que una presión pulmonar media > de 35mmHg justificaría la priorización del paciente y la concesión de puntos adicionales por su permanencia en LE. Los pacientes con una presión pulmonar media de >45mmHg no deberían priorizarse debido a su pobre pronóstico16,17.
ColangitisAlgunos pacientes con problemas estructurales de la vía biliar presentan con frecuencia colangitis. Los pacientes con bacteriemias recurrentes pueden presentar complicaciones (endocarditis, osteomielitis) que condicionen su exclusión de lista activa18. Por esta razón, se considera que estos candidatos deben de priorizarse y, además, otorgárseles puntos adicionales en función de su tiempo de permanencia en lista.
OxaluriaLa determinación del defecto enzimático en la biopsia sería suficiente para recibir prioridad, aunque no hay evidencias sólidas para sustentar la magnitud de esta priorización19. El tiempo de permanencia en lista debería determinar la asignación de puntos adicionales. (Ver protocolo actuación en niños).
Fibrosis quísticaLa enfermedad hepática de la fibrosis quística se encuentra razonablemente evaluada por la fórmula MELD. Sin embargo, el deterioro de la función pulmonar evaluado por VEF (volumen espiratorio forzado) aumenta la mortalidad pretrasplante y, por lo tanto, estos pacientes deberían priorizarse20.
Tumores poco frecuentesHemangioendoteliomas primarios de hígado y tumores neuroendocrinos confinados al hígado deberían recibir priorización21. La rareza de éstos invita a que los comités locorregionales examinen caso por caso.
Polineuropatía amiloidótica familiarEn este grupo de pacientes no hay buenos análisis de mortalidad o motivos de exclusión en LE. Debido a la ausencia de daño estructural en el hígado del receptor se recomienda su reutilización en el llamado “trasplante en dominó”. Los datos disponibles en el momento actual indican que el daño potencial derivado de su uso en el futuro receptor parece de escasa relevancia. En esta situación, la priorización del enfermo con polineuropatía amiloidótica familiar se realizaría asignándole la puntuación MELD del receptor de su hígado22.
Small for size syndromeEste síndrome es el resultado de una insuficiente masa hepática; se manifiesta por coagulopatía, hiperbilirrubinemia y ascitis, y se asocia con una considerable mortalidad, por lo que debe priorizarse y recibir preferencia en los comités locorregionales de revisión23.
Enfermedad poliquística hepáticaEl deterioro de la calidad de vida ha sido una causa habitual de indicación de trasplante en este grupo de pacientes. Sin embargo, hay algunas alternativas previas al margen del trasplante (punción percutánea, destechamiento quirúrgico, hepatectomía parcial, etc.). En casos de profunda desnutrición, evaluada con parámetros objetivos, se podría considerar la priorización en análisis individuales por parte de los comités regionales24.
ColangiocarcinomaPacientes que se encuentran en protocolos bien definidos tienen una aceptable supervivencia, siempre y cuando no sobrepasen los 140 días después de incluírselos en LE. Debería ser posible la inclusión en lista y una razonable priorización en casos muy bien seleccionados, dentro de protocolos de estudios clínicos muy bien controlados, diseñados y ampliamente consensuados25.
Síndrome de Budd-ChiariLos enfermos con síndrome de Budd-Chiari (SBC) crónico se encuentran razonablemente priorizados por la fórmula MELD que espontáneamente presentan y no precisarían de puntuación adicional. Se debería tratar a los enfermos con SBC agudo con las políticas de fallo hepático fulminante26.
Otras excepcionesBajo este epígrafe se incluyen otras situaciones donde por falta de marcadores objetivos de cuantificación de la gravedad (encefalopatía)27, por ser entidades que deterioran la calidad de vida pero no aumentan la mortalidad (prurito)29 o porque tengan alternativas a su tratamiento fuera del trasplante (hemorragia digestiva)28 se consideran excepciones, pero no subsidiarias de priorización, por lo que se les asignará su puntuación MELD real. La predicción de mortalidad para la enfermedad de Weber Rendu no puede sustentarse en evidencias, por lo que los pacientes deben evaluarse individualmente.
RetrasplanteAl igual que lo observado en el TH primario, hay una buena correlación entre la puntuación MELD y la mortalidad en LE del paciente en espera de retrasplante. El sistema MELD tiene una correlación peor con la mortalidad después del retrasplante porque en ésta influyen otros factores no presentes en el modelo MELD, como la calidad del injerto, el tiempo de isquemia o la inmunosupresión. A pesar de ello, hay bastantes datos que indican que el retrasplante debería evitarse en pacientes con una puntuación MELD >25 por la elevada mortalidad con que se la asocia (supervivencia al 5.° año<50%). Por otro lado, tal y como se detalló en el documento de consenso previo1, se apoya la inclusión del modelo pronóstico ideado por Rosen30 y se sugiere evitar el retrasplante en los pacientes con una puntuación > 20,5 en el modelo pronóstico propuesto por este autor. La calidad del injerto es uno de los factores más importantes en el éxito del TH en general y del retrasplante en particular. Ante la escasez de estudios que analicen el valor predictivo de los factores del donante, es difícil hacer recomendaciones sobre qué órganos no deben utilizarse. Sin embargo, los siguientes injertos deberían utilizarse con precaución en casos de retrasplante: donantes añosos, con una larga estancia hospitalaria o con un tiempo de isquemia prolongado.
- 5.
Hay una buena correlación entre la puntuación MELD y la mortalidad en LE de retrasplante hepático. Por otro lado, el retrasplante debería evitarse en pacientes con MELD> 25 y una puntuación en el modelo de Rosen > 20,5.
Existe cierta controversia en la literatura médica sobre el momento más adecuado para realizar el trasplante hepatorrenal combinado. Desde la implantación de la fórmula MELD en Estados Unidos el número de trasplantes dobles se ha incrementado de forma significativa. Esto probablemente se encontraba relacionado con el peso que tiene la creatinina en la propia fórmula, unido a la ausencia de directrices claras. Recientemente se ha publicado un documento resultado de un consenso entre diferentes sociedades donde se identifica qué enfermos se benefician del trasplante de hígado y riñón simultáneo:
- 1.
aclaramiento (preferiblemente con método isotópico) inferior a 30ml/min.
- 2.
pacientes con síndrome hepatorrenal o fallo renal agudo que permanecen en diálisis por un tiempo no menor a 6 semanas.
En los pacientes con fallo renal agudo que no se encuentren en diálisis, el trasplante renal simultáneo no se justificaría, ya que la supervivencia es del 81,5% a un año y sólo el 1,5% necesitaría un trasplante renal31.
Emparejamiento donante–receptorEn el momento actual no existe evidencia científica para recomendar un emparejamiento entre la indicación y gravedad del receptor y las características del donante. No obstante, a la luz de algún estudio publicado recientemente, el TH con un emparejamiento entre donantes de alto riesgo o subóptimos y receptores menos graves, potencialmente podría aumentar la mortalidad en estos últimos. Por el contrario, los receptores más graves, con una mayor mortalidad en lista, se beneficiarían de cualquier donante32.
Recomendación finalLos sistemas de evaluación pronóstica deben ser sistemas flexibles y abiertos a incorporaciones de nuevas variables que mejoren su exactitud. Con ello se mejorará la efectividad y eficiencia de los diferentes programas. La variabilidad clínica en la indicación de trasplante y el tratamiento de las excepciones es considerable. Por eso se deben de realizar esfuerzos para reducir la desigualdad existente en el acceso al TH entre las distintas comunidades autónomas y entre los distintos centros de trasplante en la misma comunidad autónoma.
- 6.
Se recomienda la implantación de listas de priorización comunes en áreas geográficas afines para reducir la desigualdad en el acceso al trasplante.
Asimismo, y aludiendo a una recomendación previa1, la implantación de modelos coordinados de gestión de la LE necesitará la colaboración de la administración autonómica a través de las oficinas de coordinación de trasplante. La aplicación de estos programas coordinados implicaría establecer mecanismos de control que permitan supervisar los resultados, revisar los criterios y auditar su cumplimiento.
2Trasplante hepático pediátrico. Priorización en lista de esperaIntroducciónLos objetivos de la inclusión de un paciente pediátrico en LE de trasplante son los siguientes: 1) evitar el fallecimiento; 2) evitar el sufrimiento asociado a un estado avanzado de hepatopatía, y 3) evitar padecimientos y secuelas asociadas al curso prolongado de una hepatopatía para la que no existe tratamiento médico o quirúrgico eficaz (prurito intolerable, retraso intelectual, retraso de crecimiento). Para que pueda aplicarse el TH en el momento adecuado a las peculiaridades de indicación que tienen lugar en los niños, debe aumentar el acceso al trasplante a través de opciones complementarias: promoción de la donación de cadáver, partición de donantes (split) y donación de vivo.
La elección del candidato a trasplante dentro de los pacientes registrados en un centro trasplantador tiene como primera consideración la gravedad clínica. Los niños más enfermos son prioritarios. En los niños se tiene en cuenta la idoneidad de tamaño donante-receptor ante similar gravedad clínica. Dar prioridad a los niños con enfermedad hepática en peor estado clínico permite disminuir su mortalidad. Los análisis de supervivencia postrasplante indican que esta política no tiene repercusión negativa en los resultados del procedimiento, según datos en EE. UU.33 y Bruselas34.
Articular la asignación de donantes a los receptores de un centro no es complejo. Los programas pediátricos más importantes en todo el mundo realizan entre 20 y 40 procedimientos anuales, cifra ésta que permite un buen conocimiento de las características de cada paciente y facilita la elección. Gestionar el reparto de órganos en un país o una región según la gravedad de los receptores precisa de la existencia de una lista general de receptores y un sistema de gradación de urgencia aceptado.
Objetivos del documento de consensoAnalizar las circunstancias asociadas a la mortalidad en lista de espera de trasplante infantil y recomendar nuevos criterios de priorización dirigidos a disminuir esa mortalidad.
AntecedentesIndicación del trasplanteLos buenos resultados de supervivencia postrasplante en niños, superiores al 70% al comienzo de su realización en la década de 1980 y superiores al 90% en la última década, han modificado la actitud ante el tratamiento de la hepatopatía infantil. El riesgo de mortalidad por la hepatopatía no es el determinante de la decisión de trasplante en las hepatopatías crónicas, sino la percepción de una calidad de vida afectada por una enfermedad hepática no susceptible de otro tratamiento más eficaz, suficientemente evolucionada para compensar el riesgo de mortalidad precoz asociado al trasplante.
El riesgo de mortalidad debe estimarse con el objetivo de: a) decidir el momento de trasplante con anterioridad a la aparición de complicaciones graves o extremo deterioro del niño, y b) priorizar a los pacientes en la LE para trasplante.
Priorización de trasplante mediante estimación del riesgo de mortalidad en lista de esperaModelo PELD (Pediatric model End stage Liver Disease) para hepatopatía crónica
En 1999 el Institute of Medicine requirió a los especialistas en trasplante hepático en EE. UU. la elaboración de un sistema de puntuación para evaluar el riesgo de mortalidad de pacientes en la LE de trasplante que permitiera establecer normas para priorizar el acceso al trasplante, basadas en la gravedad de la hepatopatía.
Con ese fin, se recogieron datos clínicos y analíticos de niños (menores de 18 años) acumulados en la base de datos del Studies of Pediatric Liver Transplantation (SPLIT), un consorcio de centros en EE. UU. y Canadá en funcionamiento desde 1995 que dispone de datos a la entrada de los pacientes en LE de trasplante y cada 6 meses desde su inclusión. El análisis se realizó a partir de los datos de pacientes con hepatopatía crónica en espera del primer trasplante. En un primer modelo buscaron predictores de fallecimiento antes de trasplante, a partir de la información de 884 casos de los que 41 fallecieron. Se desarrolló un segundo modelo para predecir el fallecimiento o la necesidad de ingreso en cuidados intensivos antes del trasplante, con datos de 779 niños que al incluirlos en lista no estaban ingresados en UCI, de los que 74 fallecieron o pasaron a UCI35.
Entre las variables predictoras del pronóstico a los 3 meses de la inclusión en lista destacaron la edad y el fallo de crecimiento. Los factores más fuertemente asociados fueron la edad inferior a 1 año y el score Z de peso o de talla inferiores a −2 (2 desviaciones estándares por debajo de la media para la edad y el sexo). El filtrado glomerular calculado a partir de la cifra de creatinina no influyó.
En el modelo para validar con curva ROC (Receiver Operating Characteristic) incluyeron las variables analíticas identificadas con influencia en la mortalidad/ingreso en UCI en el análisis univariado y en el análisis multivariado posterior. En el análisis multivariado resultaron significativos los factores: edad, bilirrubina e INR (de fallecimiento) y bilirrubina, INR (International Normalized Ratio), fallo de crecimiento y albúmina (de fallecimiento o UCI). El sistema de puntuación que mejor predijo el fallecimiento antes de 3 meses (AUC (Area Under Curve) ROC de 0,92) o fallecimiento/UCI (AUC de 0,82) se basó en bilirrubina, albúmina, INR, fallo de crecimiento y edad35. La fórmula es la siguiente:
Los valores de laboratorio inferiores a 1 son convertidos a 1 para el cálculo de PELD. La puntuación de los niños incluidos en lista antes de cumplir 1 año de edad mantiene el valor asignado a edad <1 año hasta que cumplen 24 meses.
El valor de PELD se calcula automáticamente en sitios web relacionados con Hepatología o Trasplante Hepático. A mayor valor, aumenta la probabilidad de fallecimiento del paciente en los siguientes 3 meses. Una vez establecida esa fórmula, la consideración de episodios como ascitis, hemorragia varicosa y encefalopatía no mejoró la capacidad predictora. La interpretación de este hecho es que esas complicaciones determinan mortalidad en función de la gravedad basal de la hepatopatía35. La validación de la capacidad predictiva de la puntuación PELD de fallecimiento en espera de trasplante se realizó mediante su aplicación en un gran centro trasplantador, con un valor de área bajo la curva ROC de 0,8936.
Aplicación de PELD en niños: primera experiencia en EE. UU.
En EE. UU. se empleó desde febrero de 2002 un sistema basado en 2 codificaciones de gravedad con el objetivo de disminuir el riesgo de fallecimiento en espera. Por una parte, existe el grupo de prioridad Status 1 que incluye a pacientes con previsible fallecimiento en un plazo muy corto (7 días), destinado básicamente a pacientes en fallo agudo pero en el que pueden incluirse también hepatopatías crónicas gravemente descompensadas previa solicitud a un comité que analiza cada caso. Los demás candidatos siguen un turno de trasplante según su puntuación PELD al entrar en LE. Un comité decide puntuaciones PELD adicionales para pacientes con hepatopatías cuyo riesgo no está bien catalogado en ese sistema (hepatoblastoma o metabolopatía con riesgo de daño de otro órgano). En EE. UU. el sistema de reparto de donantes no da prioridad de uso pediátrico a los donantes pediátricos. La competencia por órganos con los adultos (grupo muy superior numéricamente, en torno a un niño por cada 17 adultos) puede explicar en parte el porcentaje alto de niños para los que sus médicos solicitan una evaluación para entrar dentro de la categoría Status 1 “de excepción”.
La experiencia del consorcio SPLIT entre 2002 y 2003 demostró una puntuación media PELD significativamente diferente entre los modelos de enfermedad hepática infantil más graves: el fallo fulminante (PELD=24,6), la hepatopatía grave incluida por situación de especial riesgo dentro de la categoría Status 1 (PELD=19,6) y niños en Status 1 “por excepción”, es decir, tras obtener puntuación adicional por un consejo regulador que valoró circunstancias especiales de su enfermedad no reflejadas en PELD (PELD=14)33.
En la lista de niños candidatos a trasplante en EE. UU. el 40,3% de los pacientes espera dentro de la categoría Status 1 (estricto por previsible fallecimiento en un plazo de 7 días, o “por excepción”) y el resto (60%) tiene un PELD <10. El análisis de la puntuación PELD en niños en espera de trasplante, evaluada retrospectivamente en Bélgica, mostró un valor medio de PELD de 13,3. La distribución de valores fue la siguiente: PELD>32,7 en el 5%, PELD de 23,1 a 32,7 en el 11%, PELD de 13,3 a 23 en el 24%, PELD de 3,6 a 13,3 en el 47% y PELD <3,6 en el 13%34.
Revisión de grupos de prioridad para trasplante
El análisis de la experiencia en 2002–2003 en EE. UU. obtuvo como conclusión que en el grupo prioritario Status 1 se incluían niños con diferente riesgo de mortalidad inminente que competían entre sí. Consideraron que había un riesgo equivalente de mortalidad entre niños con fallo hepático agudo y niños con hepatopatía crónica que alcanzaban PELD ≥25. Los niños incluidos en el Status 1 “por excepción” tuvieron una mortalidad equivalente a niños con PELD de 22–26. En los fallecidos en espera hubo un tiempo (mediana) de 4–5 días para los niños con fallo agudo, mientras que en los fallecidos con hepatopatía crónica (incluyendo niños “por excepción”) la mediana fue de 18–24 días37.
Desde 2005 el sistema cambió y se consideraron Status 1 (prioridad) los siguientes pacientes37:
Status 1A: común para adulto y niñoDebe haber fallo hepático fulminante (incluye fallo agudo clásico, enfermedad de Wilson con descompensación aguda, y fallo de injerto previo por trombosis o daño primario) y tiene que estar en UCI con al menos uno de los siguientes criterios:
- a)
ventilación mecánica;
- b)
fallo renal con hemofiltro/hemodiafiltro,
- c)
e INR>2.
Ingreso en UCI con hepatopatía crónica, con PELD >25 y al menos uno de los siguientes criterios:
- a)
ventilación mecánica;
- b)
hemorragia (>30cc/kg trasfundido en 24h previas);
- c)
fallo renal con hemofiltro/hemodiafiltro,
- d)
y puntuación en la escala de Glasgow <10.
En el sistema de asignación de los donantes pediátricos (en EE. UU. son los menores de 18 años) el orden de prioridad es el siguiente:
- 1.
Receptores en Status 1A
- •
local pediátrico.
- •
regional pediátrico.
- •
adulto local.
- •
adulto regional.
- •
- 2.
Receptores en Status 1B
- •
local.
- •
regional.
- •
- 3.
Niños de 0−11 años regionales
- •
orden según PELD.
- •
(1° >15 local, 2°>15 regional)
- •
En España la Organización Nacional de Trasplante (ONT) dispone de la lista de receptores y de un sistema de codificación especial (Urgencia 0) que prioriza a los candidatos a nivel nacional. En Urgencia 0 se acepta exclusivamente a pacientes con fallo hepático agudo y a candidatos a retrasplante urgente (en niños: fallo de injerto dentro de los primeros 30 días desde el trasplante).
Los pacientes fuera de Urgencia 0 siguen el orden de trasplante que establezca el equipo trasplantador a partir de los órganos que le oferta la ONT siguiendo un criterio de turno sucesivo de hospitales de cada comunidad, dando preferencia al empleo del donante para el centro en el que se genera. En España los donantes pediátricos (menores de 15 años) son de empleo preferente en niños, y los niños solamente pueden acceder a donante adulto en caso de Urgencia 0. Con este sistema, en 2007, la mortalidad en espera de trasplante hepático pediátrico en España fue del 7%.
En España hay un concepto de candidato infantil “prioritario” con hepatopatía crónica que puede facilitar el acceso a trasplante a través de un consenso con el hospital al que fuera asignado por turno un donante válido. La principal dificultad con el sistema existente es el acceso rápido a trasplante de niños en un estado muy avanzado de hepatopatía crónica con complicaciones (semejante al establecido en EE. UU. como Status 1B). Otra dificultad existente es el acceso a trasplante de niños con particularidades, como los afectados de tumores (para evitar la extensión-contraindicación y para adecuar el momento de trasplante a las fases sin complicación hematológica de la quimioterapia), los niños afectados de metabolopatías con riesgo de daño neurológico irreversible y los niños que precisan trasplantes combinados de órganos.
Hasta ahora, la optimización del acceso a trasplante se ha centrado en el desarrollo de programas de trasplante de donante vivo. La valoración medicoquirúrgica del donante y el cumplimiento de los requisitos legales hace que el tiempo de espera hasta el trasplante de donante vivo sea aproximadamente de un mes. Es controvertida su potenciación porque con una utilización óptima de los donantes, realizando partición para 2 receptores en donantes idóneos, podría ser innecesaria. Su realización tiene, sin embargo, ventajas reales: permite la programación en pacientes estables y mejora el acceso a donante cadáver de los pacientes que no tienen, no desean o tienen contraindicación técnica para una donación de vivo. La posibilidad de donante vivo sumada a la realización habitual de trasplante split podría anular la mortalidad pretrasplante38.
En el momento actual se considera necesario establecer un sistema de priorización a nivel nacional para acceder a donante cadáver que incluya a niños con hepatopatía crónica con alto riesgo de fallecimiento.
Conclusiones de la reunión de consensoEn España, dado el número de trasplantes de hígado que se realizan y el porcentaje de donación alcanzado, ningún niño incluido en LE para trasplante debería fallecer. Consideramos recomendable poner en marcha las siguientes medidas:
- 1.
Necesidad de igualar la edad del donante a la del receptor: por tanto, considerar como donante pediátrico a todo donante con una edad igual o inferior a 16 años.
- 2.
Implantar y potenciar el trasplante split: de tal forma que todo donante que reúna las características de donante óptimo para split debería ofertarse a los grupos de TH pediátrico para aumentar el pool de injertos hepáticos. Es ampliamente conocido por todos los grupos de TH españoles que los resultados obtenidos con este tipo de trasplante son equiparables a los obtenidos cuando se implanta un órgano completo. El número anual de donantes que reúnan las características para realizar este trasplante no es muy numeroso, pero sí el suficiente para dar solución a la mortalidad que los grupos de TH pediátrico comunican. Por eso sería necesaria la colaboración del resto de grupos de trasplante de adultos y la elaboración de una lista de receptores adultos de bajo peso a los que se les implantaría el lóbulo derecho obtenido tras la realización del split en el donante. Esta lista se enviaría a la ONT y la adjudicación de los injertos derechos sería igual a los completos. Al procedimiento en el donante lo llevarían a cabo los 2 equipos de extracción (pediátrico y de adulto) o el equipo pediátrico enviaría el injerto al centro correspondiente una vez completado el split (similar a cuando se realiza una extracción de hígado-páncreas).
Este modelo ha comenzado a implantarse en la Comunidad Andaluza, gracias a la colaboración de todos los grupos trasplantadores y de la coordinación regional.
- 3.
Implantar el sistema PELD: dada la experiencia obtenida tras la implantación del sistema MELD y los beneficios que de esto se han derivado en la disminución de la mortalidad en la LE, pensamos que debería hacerse lo mismo en la población pediátrica y que todos los grupos de trasplante infantil utilicen este sistema.
- 4.
Priorización en LE: una vez implantado el sistema PELD, la priorización en LE se realizaría según la puntuación PELD y diferenciando los siguientes grupos:
- •
PELD <15: evaluación del orden de trasplante por parte de la unidad de trasplante local.
- •
PELD 15 – 22: LE prioritaria de cada centro.
- •
PELD 22 – 25: inclusión en LE para trasplante con priorización dentro de cada comunidad autónoma.
- •
PELD > 25 con complicación que hace necesario el ingreso en UCI: inclusión en LE con Priorización Nacional Pediátrica durante 7 días; transcurridos éstos, pasarían a considerarse como “Urgencia 0”.
- •
Urgencia 0 (fallo agudo, complicación postrasplante): “priorización nacional”.
- •
Inclusión en LE con priorización local como “casos especiales”:
- a)
metabolopatías con afectación neurológica;
- b)
tumores;
- c)
fibrosis quística;
- d)
receptores de menos de 1 año y menos de 10 kg de peso,
- e)
y receptores de un trasplante combinado.
Si en un mes no fueran trasplantados, pasarían a la lista de Priorización Nacional Pediátrica.
- 5.
Necesidad de una lista común nacional: Al igual de que existe una lista para las Urgencias 0, pensamos que es necesario elaborar una LE de prioridad nacional pediátrica en la que estarían incluidos los receptores con un mayor riesgo de mortalidad en LE.
- 6.
Adjudicación de órganos e injertos: Los donantes pediátricos y adultos que reúnan las características de split se ofertarán en primer lugar a los receptores incluidos en la lista de Preferencia Nacional Pediátrica. En el trasplante split el injerto derecho se adjudicará según los criterios ya existentes.
En el supuesto de que no hubiera ningún receptor infantil incluido en la LE de prioridad nacional, los órganos obtenidos de los donantes pediátricos adjudicados a cada grupo deberán implantarse en los receptores con un PELD más alto a igualdad de peso.
En el supuesto de que el donante sea de un peso adecuado, se considerará la posibilidad del trasplante split para 2 receptores infantiles.
La SETH mantuvo en 2005 una jornada de consenso con la finalidad de mejorar continuamente la calidad y los resultados en las unidades de TH. La jornada estuvo estructurada en grupos de trabajo constituidos por profesionales miembros de esa sociedad, que debatieron sobre diferentes temas de actualidad en la práctica del TH.
Uno de los grupos de trabajo se ocupó del desarrollo de un conjunto de indicadores de calidad que, mediante su monitorización, permitieran medir y evaluar de forma periódica aspectos relevantes del servicio prestado. Este desarrollo consistía en determinar un conjunto de indicadores relevantes para esas unidades, definirlos y estandarizarlos. Se pretendía identificar los aspectos del proceso asistencial que conviene definir y evaluar, y generar un debate abierto entre los profesionales interesados en mejorar la calidad del servicio proporcionado. Estos resultados se publicaron en 2008 en el Documento de Consenso de la SETH1.
En una segunda jornada celebrada en 2008, se seleccionaron aquellos indicadores que tienen las características deseadas de fiabilidad, validez y precisión. Para ello, se sometieron a pilotaje y a un análisis crítico por parte de un grupo de mejora. El presente documento resume la I Reunión de Consenso de la SETH, las tareas realizadas a partir de la definición del conjunto de indicadores, la II Reunión de Consenso y las conclusiones obtenidas, fruto del trabajo en equipo y la colaboración entre profesionales afectados por una misma inquietud: la calidad en el TH.
MetodologíaEl proyecto de diseño y validación de indicadores de calidad del TH se ha desarrollado en 3 etapas:
- a)
I Reunión de Consenso de la SETH;
- b)
Pilotaje y análisis de los resultados obtenidos,
- c)
y II Reunión de Consenso de la SETH.
La Primera Jornada de Consenso de la SETH, celebrada en noviembre de 2005, estuvo estructurada en 4 grupos de trabajo constituidos por miembros de esta sociedad en los que se debatió sobre:
- a)
el acceso a la LE;
- b)
límites en las indicaciones de trasplante;
- c)
priorización de la LE,
- d)
e indicadores de calidad en TH.
El grupo de trabajo que centró su debate en los indicadores de calidad en TH, denominado “Grupo 4. Calidad y acreditación en el trasplante hepático”, estaba formado por los siguientes profesionales miembros de la SETH:
- 1.
Coordinadores
- •
Pardo, Fernando (SETH)
- •
Clemente, Gerardo (SETH)
- •
Pérez Lázaro, Juan José (Escuela Andaluza de Salud Pública)
- •
- 2.
Participantes
- •
Barneo Serra, Luis (Hospital Central de Asturias)
- •
Charco, Ramón (Hospital Clínic Barcelona)
- •
Fraga, Enrique (Reina Sofía)
- •
Lozano, Ricardo (Zaragoza)
- •
Martínez, Jorge (Xeral de Santiago)
- •
Meneu, Juan Carlos (12 de Octubre)
- •
Gómez Fleitas, Manuel (Hospital Valdecilla)
- •
Santoyo, Julio (Carlos Haya)
- •
Soriano, Arturo (Tenerife)
- •
Villar, Jesús (Virgen de las Nieves)
- •
En primer lugar, se abordó la identificación y priorización de los indicadores en TH. Para ello se utilizó la metodologíade un Delphi modificado, consistente en que cada componente del grupo de expertos identificase qué aspectos asistenciales habría que medir en el proceso del TH. Basándose en el anonimato del método, se generó una iteración real y una retroalimentación controlada de las cuestiones por debatir. Cuando se puso en común la información, se realizó una labor de síntesis y selección, obteniéndose un conjunto razonable de posibles indicadores.
Posteriormente, se pidió a los profesionales que realizasen una tarea grupal de priorización de los resultados obtenidos, con la que se obtuvo el grado de acuerdo entre los profesionales en torno a cada indicador.
Los indicadores seleccionados fueron los siguientes:
- a)
mortalidad hospitalaria postrasplante hepático;
- b)
mortalidad perioperatoria;
- c)
tasa de retrasplante hepático;
- d)
tasa de reintervención precoz;
- e)
supervivencia del paciente trasplantado;
- f)
existencia de un protocolo establecido de cribado de neoplasias novo;
- g)
existencia de un protocolo establecido de detección y tratamiento de factores de riesgo cardiovascular;
- h)
consentimiento informado;
- i)
complicaciones del donante vivo de hígado;
- j)
pacientes estudiados en menos de 30 días tras su envío a la Unidad Funcional de Trasplante Hepático (UFTH);
- k)
porcentaje fallo primario de función hepática;
- l)
tasa de hígados no implantados sin causa objetiva justificable,
- m)
y satisfacción del paciente trasplantado.
Para cada uno de este conjunto de indicadores, siguiendo las indicaciones de la Joint Commission on Accreditation of Healthcare Organizations, se diseñó una ficha completa especificando su definición, formulación, explicación de términos, población de estudio, tipo de indicador, fuente de datos, estándar y comentarios, que se publicó en el Documento de Consenso de la SETH1.
Tras esta etapa inicial de identificación, priorización y definición de los indicadores encontrados y para valorar los aspectos de fiabilidad, validez y precisión de cada indicador, se ha desarrollado un pilotaje y análisis de los resultados obtenidos en los distintos centros e instituciones cuyo/s profesional/es participaban activamente en el proyecto.
Esta primera puesta en práctica ha consistido en la recogida de información en estos centros de los indicadores definidos, junto con las dificultades encontradas, y un posterior análisis de los datos obtenidos.
1) Recogida de información
En ella se seleccionaron los datos referidos a cada indicador en los distintos hospitales, con la colaboración de los siguientes profesionales:
- •
Bárcena Marugan, Rafael (Hospital Ramón y Cajal);
- •
Citores Pascual, Miguel Ángel (Hospital Universitario Río Hortega);
- •
Clemente Ricote, Gerardo (Hospital Gregorio Marañón);
- •
Cuervas-Mons Martínez, Valentín (H. U. Puerta de Hierro-Majadahonda);
- •
Fuster Obregón, José y Dr. Calatayud (Hospital Clinic);
- •
Garrote Lara, Daniel y Dr. Granero (H. U. Virgen de las Nieves);
- •
Gómez Bravo, Miguel Ángel (H. U. Virgen del Rocío);
- •
Gómez Gutiérrez, Manuel (Hospital Juan Canalejo);
- •
Miyar, Alberto (H. U. Central de Asturias);
- •
Pardo, Fernando (Clínica Universitaria de Navarra),
- •
y Solórzano Peck, Guillermo y Dr. Montero, José Luis (Hospital Infanta Cristina).
A partir de los documentos proporcionados, además de recogerse la información referente a los indicadores, se han detectado las dificultades en el proceso de recogida de información, la imposibilidad de medición (costosa, imprecisa o complicada) de determinados indicadores, distintas interpretaciones de una misma definición y diferentes formas de medir un mismo indicador.
2) Análisis de los datos obtenidos
Una vez obtenida la información de los hospitales participantes, se ha procedido a realizar un análisis exhaustivo de ésta. Para ello, necesariamente, se han tipificado los datos identificativos de cada centro y de cada indicador.
Principalmente se realizaron 2 tipos de análisis:
Análisis por indicador: nos proporciona la comparativa del indicador entre los centros participantes y con respecto al estándar fijado.
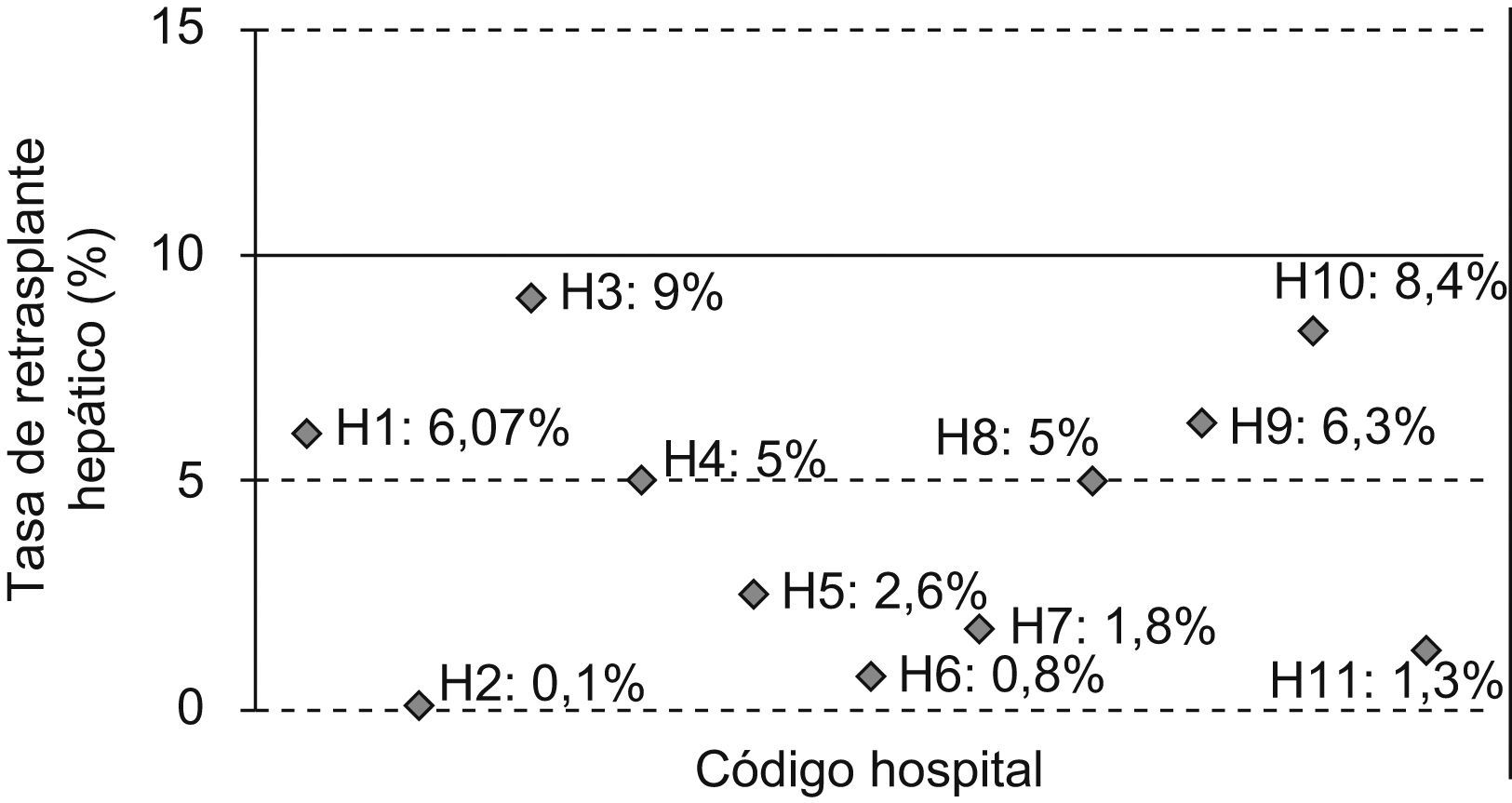
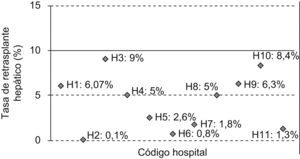
En este caso vemos que todos los hospitales cumplirían el estándar fijado para el indicador I3 —Tasa de retrasplante hepático—, dado que todos tienen una tasa menor al 10%. Sin embargo, se puede apreciar cómo los hospitales H2, H6 y H11 tienen una tasa muy inferior a la de H3 o H10, con una tasa que se aproxima al límite superior fijado por el estándar (fig. 1).
Análisis por hospital: representa un gran valor interno para cada centro, en el que cada uno puede apreciar sus logros y deficiencias. Para ello, se hizo una distinción entre indicadores cuyo estándar fuese no superar un valor determinado e indicadores cuyo estándar fuese superar un cierto valor.
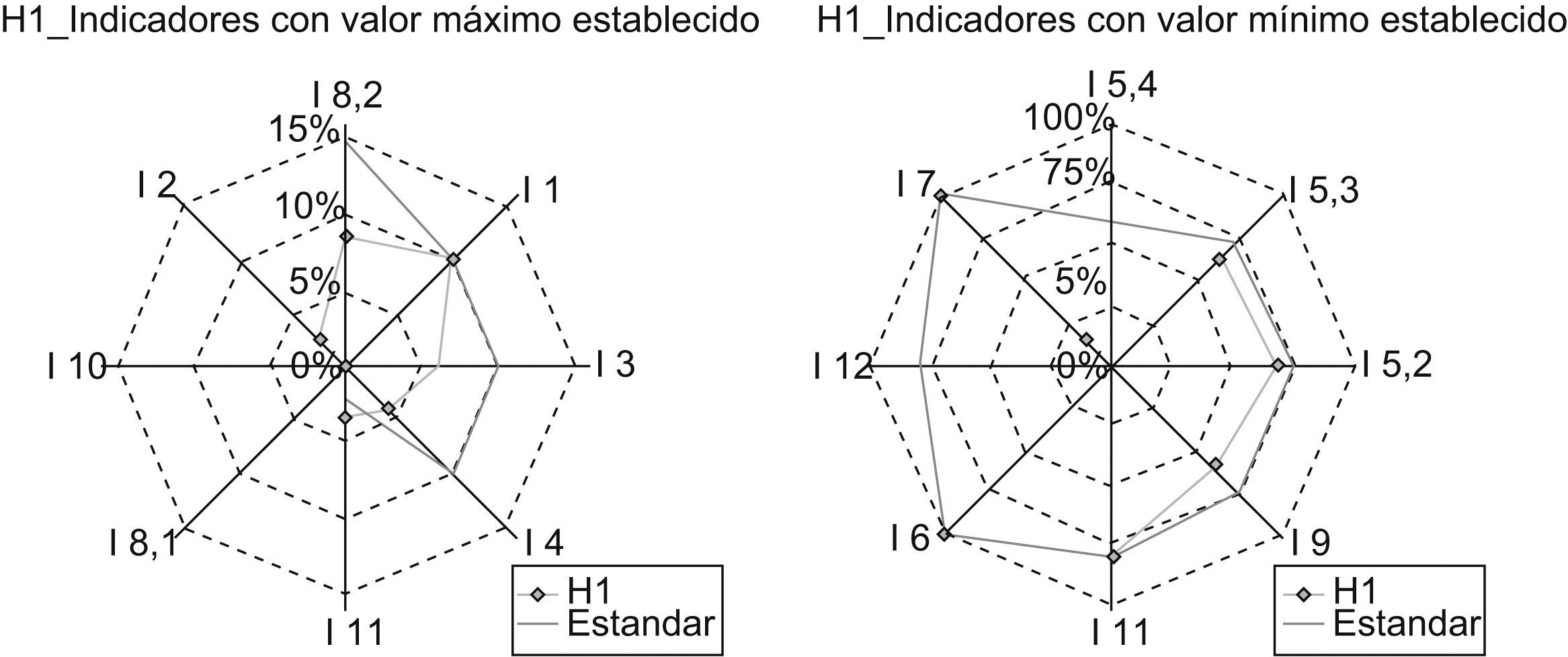
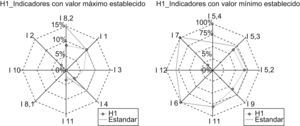
A modo de ejemplo, analicemos los gráficos obtenidos para el hospital H1:
El gráfico de la izquierda nos indica que el hospital H1 satisface al indicador I8,2 —Complicaciones del donante vivo de hígado. Morbilidad— , al I3 —Tasa de retrasplante hepático— y al I4 —Tasa de reintervención precoz—, dado que sus mediciones son menores al valor máximo establecido, y no satisface a los indicadores I1 —Mortalidad hospitalaria— e I11 —Tasa de malfunción primaria—, pues los valores obtenidos en la medición superarían el valor máximo prefijado como estándar (fig. 2).
El gráfico de la derecha nos indica que ese hospital satisface al indicador I7 —Consentimiento informado—, I8.1 —Complicaciones del donante vivo de hígado. Mortalidad— e I5.1—Supervivencia del paciente trasplantado al año—, dado que sus mediciones son iguales al valor mínimo establecido, y no satisface I9 —Porcentaje de pacientes estudiados en menos de 30 días—, I5.2 —Supervivencia del paciente trasplantado a los 3 años— e I5.3 —Supervivencia del paciente trasplantado a los 5 años— por no alcanzar los valores prefijados como estándares, respectivamente.
Del resto de indicadores —I5.4, I10 e I12— no se dispone información y para I2 no se ha establecido un estándar, con lo que no se puede considerar si cumple o no.
La II Reunión de Consenso de TH, celebrada en noviembre de 2008, también estuvo organizada en 4 grupos que, en esta ocasión, trataron sobre:
- a)
LE;
- b)
trasplante pediátrico;
- c)
pacientes de riesgo: VIH,
- d)
y calidad y acreditación.
En esta segunda jornada, el “Grupo 4. Calidad y acreditación en TH” estuvo formado por los siguientes miembros de la SETH:
- 1.
Coordinadores
- •
Clemente Ricote, Gerardo (SETH);
- •
González-Pinto Arrillaga, Ignacio (SETH),
- •
y Pérez Lázaro, Juan José (EASP).
- •
- 2.
Participantes
- •
Bárcena Marugan, Rafael (Hospital U. Ramón y Cajal);
- •
Casanovas Taltavull, Teresa (Hospital Vall d′Hebrón);
- •
Cítores Pascual, Miguel Ángel (Hospital U. Río Hortega);
- •
Cuervas-Mons Martínez, Valentín (Hospital U. Puerta de Hierro-Majadahonda);
- •
De la Rosa, Gloria (ONT);
- •
Fuster Obregón, José (Hospital U. Clínic);
- •
Garrote Lara, Daniel (Hospital U. Virgen de las Nieves);
- •
Miras López, Manuel (Hospital U. Virgen de la Arrixaca);
- •
Ramos Rubio, Emilio (Hospital U. de Bellvitge);
- •
Rufian Peña, Sebastián (Hospital U. Reina Sofía);
- •
Serrano Aullo, Trinidad (Hospital Clínico U. Lozano Blesa);
- •
Solórzano Peck, Guillermo (Hospital U. Infanta Cristina),
- •
y Soriano Benítez de Lugo, Arturo (Hospital U. Ntra. Sra. de la Candelaria)
- •
Su trabajo versó sobre la evaluación y calibración de los indicadores definidos. Para ello se presentaron las fichas de cada indicador y el análisis de la información obtenida.
El debate y consenso generado se realizó en torno a los siguientes temas:
- a)
validez de los datos obtenidos: dificultades encontradas en la recogida de información, la claridad o ambigüedades detectadas en las definiciones de los indicadores, las excepciones que habría que considerar, la calidad de los datos y su repercusión en los resultados, la variabilidad de ciertos indicadores, las posibles modificaciones en los criterios, estándares, fuentes de información, etc.;
- b)
fiabilidad de los resultados: reproductibilidad y variabilidad intraobservador e interobservador, comparabilidad de los datos, evaluación correcta por parte de los indicadores de la característica que se desea medir, etc.;
- c)
representatividad de la muestra de hospitales sobre los que se han realizado el pilotaje y la cobertura que proporcionan a la población de estudio,
- d)
y sensibilidad o especificidad de los indicadores, es decir, si este conjunto de indicadores descubre todos los problemas de calidad o revela aspectos que no son problemas de calidad.
En esta jornada se perfeccionaron las definiciones de ciertos estándares, se perfilaron o determinaron los valores de los estándares basándose en la mejor evidencia científica o, en su defecto, en la realidad observada en esta primera experiencia. Se determinaron los indicadores que no deberían desarrollarse por comprobarse minimizados o correlacionados y se definieron determinados indicadores que se consideraron necesarios para evaluar la calidad directa del proceso del TH, no considerados en el conjunto inicial de indicadores.
Indicadores de calidad en trasplante hepáticoMortalidad precoz postrasplante hepáticoCódigo 02
DefiniciónPorcentaje de pacientes trasplantados que fallecen en el primer mes postrasplante.
JustificaciónIndicador de resultados que monitoriza la mortalidad precoz postrasplante y permite enfocar el análisis de las causas, en relación con el proceso de evaluación del candidato, las características del donante, el procedimiento y la atención postoperatoria reciente.
Fórmula/formatoNúmero de pacientes trasplantados fallecidos en el primer mes postrasplante/número de pacientes trasplantados × 100 del mismo período.
Explicación de términosSe incluyen los pacientes que fallecen desde el inicio del TH (quirófano, UCI y planta de hospital).
PoblaciónTodos los pacientes que reciben TH.
TipoResultado basado en porcentajes.
Fuente de datosDocumentación clínica CMBD (Conjunto Mínimo Básico de Datos).
Aplicación informática del Servicio de Admisión del centro hospitalario.
Comisión de mortalidad e historia clínica para el análisis cualitativo.
EstándarInferior al 10%.
ComentariosLa periodicidad de la medida debería ser trimestral.
Mortalidad perioperatoriaCódigo 03
DefiniciónPorcentaje de pacientes trasplantados que fallecen desde el inicio de la cirugía hasta las primeras 24 h posteriores a la intervención.
JustificaciónConocer la tasa de mortalidad del trasplante en las primeras 24 h. Estudio de las causas. Relación con las complicaciones que presentan los receptores (trombosis portal, hepatocarcinoma incidental y multifocal o con invasión vascular, complicaciones cardiovasculares graves no conocidas antes del trasplante, complicaciones anestésicas y quirúrgicas) en relación con el total de trasplantados.
Fórmula/formatoNúmero de fallecidos durante las primeras 24h del trasplante/número total de trasplantados × 100 del mismo período.
Explicación de términosSe incluyen los pacientes trasplantados que fallecen en el quirófano, reanimación o UCI.
PoblaciónTodos los pacientes que reciben TH.
TipoIndicador de resultados basado en porcentajes.
Fuente de datosRegistros de la unidad de trasplante de cada centro.
EstándarNo establecido (sobre la base de los datos del RETH se podría establecer <5%)
ComentariosEl objetivo es analizar si las muertes se producen en relación con la situación clínica del receptor, como consecuencia de hallazgos imprevistos no detectados en la evaluación pretrasplante o debido a complicaciones intraoperatorias.
La periodicidad será mensual.
Tasa de retrasplante hepático precozCódigo 04
DefiniciónPorcentaje de retrasplantes hepáticos que se indican en los primeros 7 días, en el global de cada serie de trasplante, realizado con donante cadáver.
JustificaciónEvaluar la frecuencia y causas del retrasplante precoz.
Detectar la selección inadecuada de receptores y donantes (cadáver) y de los problemas técnicos que supongan una grave disfunción del injerto.
Fórmula/formatoNúmero de retrasplantes hepáticos indicados en la primera semana post-TH/número total de trasplantes de la serie × 100 de un determinado período.
Explicación de términosPacientes que reciben un segundo TH en la primera semana postrasplante.
PoblaciónToda la serie de pacientes trasplantados. Se excluyen los trasplantes no realizados con donación de cadáver.
TipoResultados basados en porcentajes.
Fuente de datosLos de cada serie de trasplante. Historias clínicas.
EstándarInferior al 8%.
ComentariosPodría ser un indicador de calidad en el postrasplante inmediato.
La periodicidad debería ser semestral.
Tasa de retrasplante hepático tardíoCódigo 04_2
DefiniciónPorcentaje de retrasplantes hepáticos, excluidos los indicados en la primera semana, en el global de cada serie de trasplante.
JustificaciónEvaluar la frecuencia y causas del retrasplante tardío. Detectar las consecuencias a largo plazo de los problemas técnicos y médicos (protocolos inadecuados de inmunosupresión o de profilaxis de recidiva viral).
Fórmula/formatoNúmero de retrasplantes hepáticos indicados después de la primera semana del TH/número total de trasplantes de la serie × 100 de un determinado período.
Explicación de términosPacientes que reciben un segundo TH.
PoblaciónToda la serie de pacientes trasplantados.
TipoResultados basados en porcentajes.
Fuente de datosLos de cada serie de trasplante. Historias Clínicas.
EstándarInferior al 6%.
ComentariosEs un indicador de calidad en el postrasplante y un indicador de actividad a largo plazo.
La periodicidad debería ser semestral.
Tasa de reintervención precozCódigo 05
DefiniciónPorcentaje de pacientes trasplantados que requieren una segunda intervención no programada en los 15 días siguientes, debido a una complicación de la primera intervención.
JustificaciónEvaluación de la frecuencia de problemas técnicos del trasplante y complicaciones quirúrgicas derivadas de éste. Las complicaciones y reintervenciones se pueden producir a pesar de una técnica quirúrgica correcta.
Fórmula/formatoNúmero de pacientes trasplantados a los que se les realiza reintervención en los primeros 15 días/número de pacientes trasplantados × 100 de un determinado período.
Explicación de términosTodo procedimiento quirúrgico (se excluyen las técnicas percutáneas o endoscópicas y los fallecidos que no llegan al período evaluado) realizado bajo anestesia general, por una complicación derivada del TH, aparecida en los primeros 15 días.
PoblaciónTodos los pacientes a los que se les realiza TH.
TipoResultado basado en porcentajes.
Fuente de datosCMBD.
EstándarInferior al 9%.
ComentariosPeriodicidad trimestral.
Supervivencia del paciente trasplantadoCódigo 11
DefiniciónTasa de supervivencia de los pacientes trasplantados de la serie, al cabo de uno, 3, 5 y 10 años postrasplante.
JustificaciónConocer si los resultados de supervivencia al cabo de uno, 3, 5 y 10 años postrasplante se ajustan a los estándares publicados para identificar problemas y poner en marcha soluciones en caso de que fuesen deficientes.
Fórmula/formatoNumerador: número de pacientes trasplantados vivos en el momento de cada corte o análisis (1, 3, 5, 10 años).
Denominador: número de pacientes trasplantados al inicio del período.
Curvas de supervivencia actuarial a uno, 3, 5 y 10 años.
Explicación de términosPacientes trasplantados que siguen vivos al cabo de uno, 3, 5 y 10 años de su intervención. Incluir todos los fallecimientos no relacionados con el proceso.
PoblaciónTodos los pacientes a los que se les realiza TH.
TipoIndicador de resultados basado en índices.
Fuente de datosHistorias clínicas de los pacientes trasplantados. Memorias anuales de los centros de trasplantes. Registro Nacional de TH.
EstándarSupervivencia global del 80% al año, del 75% a los 3 años, del 70% a los 5 años y del 60% a los 10 años.
Detección y tratamiento de factores de riesgo cardiovascularCódigo 17
DefiniciónExistencia en cada centro de trasplante de un protocolo establecido para la detección, tratamiento y seguimiento de los factores de riesgo cardiovascular que pueden aparecer en el postrasplante (obesidad, diabetes, hipercolesterolemia e hipertrigliceridemia, hipertensión arterial [HTA]). A partir del sexto mes post-TH.
Fórmula/formatoExistencia o no de este protocolo mencionado.
Dicotómico: Sí/No
Pacientes obesos, diabéticos, hiperlipidémicos, hipertensos/trasplantados vivos después del sexto mes del TH × 100 de un determinado período.
Explicación de términosSe considera un protocolo a todo plan escrito y detallado de una actuación médica concerniente a evaluaciones de pacientes para la búsqueda activa factores de riesgo cardiovascular. Detección de los pacientes que los presentan.
PoblaciónLos centros de trasplante.
TipoIndicador de estructura.
Fuente de datosLas guías clínicas o el protocolo de trasplante de cada una de las unidades de trasplante.
Pacientes estudiados en menos de 30 días tras su envío a la Unidad Funcional de Trasplante HepáticoCódigo 34
DefiniciónPorcentaje de pacientes que se han evaluado (decidida su inclusión o no en LA, tras realizar una evaluación) por la Unidad de Trasplante Hepático en menos de 30 días desde la solicitud de la cita.
JustificaciónEvaluar la eficiencia del proceso de estudio para tomar la decisión de inclusión o no en la LE. Las demoras en un proceso de evaluación de un paciente son con frecuencia por causas organizativas del servicio o centro sanitario. La disminución de las demoras disminuye la ansiedad de los pacientes y su conocimiento permite mejorar la toma de decisiones.
Fórmula/formatoNúmero de pacientes con estudio completado en menos de 30 días desde la solicitud de la cita para evaluación de trasplante/número de pacientes remitidos para evaluación de trasplante × 100 de un determinado período.
Explicación de términosPacientes citados en la unidad de trasplante como primera visita.
Tiempo transcurrido desde la petición de estudio y la toma de decisión por parte del comité de evaluación de receptores del trasplante.
Número de pacientes que han completado el estudio en los que se toma una decisión en un plazo inferior a 30 días, en relación con el total de pacientes derivados para su evaluación.
PoblaciónTodos los pacientes enviados a la unidad de trasplantes para su evaluación e inclusión en LE.
TipoIndicador de proceso.
Fuente de datosEstudio de los historiales de todos los pacientes en estudio por parte de la UFTH y revisión de los tiempos desde la consulta hasta la decisión de actuación con el paciente.
EstándarProporción de pacientes estudiados en un tiempo menor o igual a 30 días: ≥75%.
Aparición de fallo primario de función hepáticaCódigo 36
DefiniciónPorcentaje de pacientes trasplantados que desarrollan una “no función primaria del injerto”.
JustificaciónConocer la tasa de “no función primaria del injerto” como indicador de la comunicación, coordinación, destreza y experiencia de los equipos, en relación con los tiempos de isquemia fría y caliente, calidad del hígado implantado, factores técnicos, logística, coordinación de los equipos, etc.
Fórmula/formatoPacientes trasplantados que desarrollan una “no función primaria del injerto” causante de retrasplante o muerte/total de pacientes trasplantados × 100 en un determinado período.
PoblaciónPacientes trasplantados.
TipoIndicador de resultados.
Fuente de datosRegistros de la unidad de trasplante, historia clínica.
EstándarInferior al 2%.
ComentariosLa frecuencia de monitorización debería ser trimestral.
Tasa de hígados rechazados sin causa objetiva justificableCódigo 37
DefiniciónPorcentaje de hígados rechazados, tras su aceptación, sin causa objetiva justificable (existencia de histología que demuestre la alteración existente en el hígado donante o alteración que el cirujano responsable del equipo de donación evidencie, presente en la historia clínica), por parte del equipo de trasplante.
JustificaciónEvaluar la adecuación de la tasa de rechazos de hígados ofertados, con arreglo a los criterios de aceptación de donantes en vigor. El objetivo es detectar rechazos injustificados y aumentar las opciones de trasplante para los pacientes en LE.
Fórmula/formatoNúmero de hígados rechazados/número de hígados implantables × 100 en un determinado período.
PoblaciónToda donación completa o parcial con criterios de inclusión para ser implantada.
TipoIndicador de proceso.
Fuente de datosRegistros de la Unidad de Trasplante y de la ONT.
Protocolo de donante. Anatomía patológica en el momento del implante. Documento clínico de las causas por las que se considera no donante, firmado por el cirujano responsable de la extracción. Análisis de causas de rechazo. Evolución de hígados rechazados que ha implantado otro grupo.
EstándarSerá implementado tras los primeros análisis.
Tasa de hígados rechazadosCódigo 37_1
DefiniciónPorcentaje de hígados rechazados, tras la propuesta de un donante, por parte del equipo de trasplante.
JustificaciónEvaluar la tasa de rechazos de hígados ofertados con arreglo a los criterios de aceptación de donantes en vigor. El objetivo es detectar rechazos injustificados y aumentar las opciones de trasplante para los pacientes en LE.
FórmulaNúmero de hígados rechazados/número de hígados implantables × 100 en un determinado período.
PoblaciónTodos los hígados totales ofertados para ser implantados.
TipoIndicador de proceso.
Fuente de datosRegistros de la Unidad de Trasplante y de la ONT.
Protocolo de donante. Análisis de causas de rechazo. Evolución de hígados rechazados que ha implantado otro grupo.
EstándarNo establecido.
Satisfacción del paciente trasplantadoCódigo 40
DefiniciónRealización de encuesta de satisfacción del grupo de pacientes trasplantados.
Grado de satisfacción global de los pacientes trasplantados de hígado.
JustificaciónEvaluar la calidad que percibe el paciente trasplantado sobre la asistencia integral recibida durante el proceso de TH.
Fórmula/formatoMedición global de la satisfacción del usuario después de puntuar cada ítem de la encuesta.
PoblaciónPacientes trasplantados totales.
TipoIndicador de resultados.
Fuente de datosAnálisis de encuestas realizadas a pacientes y familiares.
EstándarRealización de la encuesta.
Porcentaje de satisfecho o muy satisfecho superior al 80%.
ComentariosDebe ser anual.
RecomendacionesEn el proceso de evaluación del conjunto inicial de indicadores definidos se han suprimido algunos de ellos por considerarse que no valoraban la calidad directa del proceso de TH. Sin embargo, debido a las aportaciones de los datos recogidos referentes a éstos y las implicaciones positivas que tendrían se concluye que se recomienda la existencia de:
Protocolo de detección de neoplasias de novoSe considera que debería haber un protocolo consensuado en todos los centros, pero como probablemente esto no existe, podría ser suficiente con que cada uno tuviese al menos su protocolo particular, aunque fuesen diferentes.
Protocolo de detección y tratamiento de factores de riesgo cardiovascularLa actuación en este sentido mejora la calidad y cuantía de supervivencia de estos pacientes.
Consentimiento informadoSe aconseja la existencia de una información escrita de lo que el paciente puede esperar del TH, preferiblemente uniforme y homogénea en las distintas unidades de TH. Esto permite que el paciente conozca su situación, riesgos y futuro.
Para la elaboración de este documento se crea el siguiente grupo de trabajo: Dr. Rafael Barcena, Dra. Teresa Casanovas, Dr. Daniel Garrote y Dr. Ignacio González. Este grupo contará con el asesoramiento de la Escuela Andaluza de Salud Pública.
Complicaciones del donante vivo de hígadoSe trata de analizar la morbilidad en el trasplante realizado con donante vivo (donante y receptor) y poder detectar desviaciones por encima de las complicaciones publicadas.
Dado que la realización de trasplante con donante vivo es una actividad no generalizada, se acuerda que debe considerarse como un proceso diferente del donante cadáver. Todos los criterios que se establecen para el donante cadáver deben evaluarse en el TH con donante vivo.
| Grupo Lista de espera | |
| Coordinadores: | |
| Miguel Navasa Anadón | Hospital U. Clínic de Barcelona, en representación de la AEEH |
| Julio Santoyo Santoyo | Hospital Reg. U. Carlos Haya, en representación de la SETH |
| Santiago Tomé Martínez de Rituerto | Hospital Clínico U. de Santiago, en representación de la SETH |
| Participantes: | |
| Rafael Bañares Cañizares | Hospital Gral. U. Gregorio Marañón |
| Manuel de la Mata García | Hospital U. Reina Sofía |
| Manuel Delgado Blanco | Hospital U. Juan Canalejo |
| Antonio González Rodríguez | Hospital U. Ntra. Sra. de la Candelaria |
| José Ignacio Herrero Santos | Clínica U. de Navarra |
| José Luis Montero Álvarez | Hospital U. Infanta Cristina |
| María Flor Nogueras López | Hospital U. Virgen de las Nieves |
| Juan Miguel Rodrigo López | Hospital Reg. U. Carlos Haya |
| Víctor Sánchez Turrión | Hospital U. Puerta de Hierro-Majadahonda |
| Fernando Sanjuán Rodríguez | Hospital U. La Fe |
| Víctor Vargas Blasco | Hospital U. Vall d’Hebrón |
| Evaristo Varo Pérez | Hospital Clínico U. de Santiago |
| F. Javier Xiol Quingles | Hospital U. de Bellvitge |
| Grupo Trasplante hepático pediátrico | |
| Coordinadores: | |
| Paloma Jara Vega | Hospital U. La Paz, en representación de la SETH |
| Pedro López Cillero | Hospital U. Reina Sofía, en representación de la SETH |
| Participantes: | |
| Francisco Javier Bueno Recio | Hospital U. Vall d’Hebrón |
| Ramón Charco Torra | Hospital U. Vall d’Hebron |
| Loreto Hierro Llanillo | Hospital U. La Paz |
| Jesús Jiménez Gómez | Hospital U. Reina Sofía |
| Javier Manzanares López-Manzanares | Hospital U. 12 de Octubre |
| Carmen Ribes Koninckx | Hospital U. La Fe |
| Juan José Vila Carbó | Hospital U. La Fe |
| Grupo Indicadores de calidad | |
| Coordinadores: | |
| Gerardo Clemente Ricote | Hospital Gral. U. Gregorio Marañón, en representación de la SETH |
| Ignacio González-Pinto Arrillaga | Hospital U. Central de Asturias, en representación de la SETH |
| Juan José Pérez Lázaro | EASP |
| Participantes: | |
| Rafael Bárcena Marugan | Hospital U. Ramón y Cajal |
| Teresa Casanovas Taltavull | Barcelona |
| Miguel Ángel Cítores Pascual | Hospital U. Río Hortega |
| Valentín Cuervas-Mons Martínez | Hospital U. Puerta de Hierro-Majadahonda |
| Gloria De la Rosa | ONT |
| José Fuster Obregón | Hospital Clínic de Barcelona |
| Daniel Garrote Lara | Hospital U. Virgen de las Nieves |
| Manuel Miras López | Hospital U. Virgen de la Arrixaca |
| Emilio Ramos Rubio | Hospital U. de Bellvitge |
| María Trinidad Serrano Aullo | Hospital Clínico U. Lozano Blesa |
| Guillermo Solórzano Peck | Hospital U. Infanta Cristina |
| Arturo Soriano Benítez de Lugo | Hospital U. Ntra. Sra. de la Candelaria |
El listado de participantes en los grupos de trabajo se muestra en el Anexo 1.