La cirugía bariátrica es la opción más eficaz para el tratamiento de los pacientes con alto riesgo de complicaciones por su obesidad. Sin embargo provoca una serie de alteraciones metabólicas sobre el calcio y la vitamina D y un aumento de la resorción que conllevan una pérdida de masa ósea.
ObjetivoEl objetivo del estudio es la comparación de la gastrectomía tubular (GT) con el bypass gástrico en Y de Roux (BGYR) respecto la pérdida de masa ósea medida mediante densitometría y marcadores de remodelado óseo.
Pacientes y métodosSe incluyeron 15 mujeres con obesidad mórbida, 8 en la GT y 7 en el BGYR, de edad media 47,8±9 con un índice de masa corporal 43,3±3,4. Se realizaron mediciones de la masa ósea a nivel de columna, fémur y tercio distal del radio y marcadores de remodelado óseo N-telopéptido (NTx), y fosfatasa alcalina específica ósea (FAO), así como niveles de vitamina D antes y a los 12 meses de la intervención.
ResultadosSe observó una pérdida significativa de masa ósea con la GT y el BGYR, en columna lumbar y cadera mientras que en el radio no se observaron diferencias significativas. El porcentaje de pérdida de masa ósea fue menor en columna y fémur tras la GT que con el BGYR, aunque sin llegar a la significación estadística, 4,6%±4,4 (media±DE) y 6,3%±5,4 (media±DE) respectivamente. A los 12 meses el NTx aumentó para ambos tipos de intervención y las FAO aumentaron solo para la GT.
ConclusiónLa GT provoca una pérdida menor de masa ósea, aunque no significativa, respecto el BGYR.
Bariatric surgery is the most effective option for the treatment of patients with a high risk of complications due to their obesity. However, it brings about a series of changes in calcium and vitamin D metabolism and an increase in resorption which lead to a loss of bone mass.
AimThe objective of this study is to compare sleeve gastrectomy (SG) and Roux-en-Y gastric bypass (RYGB) as regards loss of bone mass using bone densitometry and bone remodelling markers.
Patients and methodsFifteen women with morbid obesity were included, 8 by SG and 7 by RYGB, with a mean age of 47.8±9 and mean body mass index 43.3±3.4. Bone mass measurements were made on the lumbar spine, femur and distal radius, and the bone remodelling markers N-telopeptide (NTx) and bone alkaline phosphatase (BALP), as well as vitamin D levels before and 12 months after surgery.
ResultsA significant bone mass loss was observed was observed with SG and RYGB, in the lumbar spine and hip, whilst no differences were observed in the radial. The percentage bone mass loss was less in the column and femur after SG than with RYGB, although it did not reach statistical significance, 4.6%±4.4 (mean±SD) and 6.3%±5.4 (mean±SD), respectively. At 12 months the Ntx increased for both types of surgery, and the BAP was only increased for SG.
ConclusionSG causes less, although not significant, bone mass loss compared to RYGB.
La cirugía bariátrica es probablemente la opción más eficaz para el tratamiento de los pacientes con alto riesgo de complicaciones por su obesidad. Los criterios para su indicación están bien establecidos así como los efectos de la cirugía a medio y largo plazo. Entre las alteraciones metabólicas que produce la cirugía bariátrica destacan las que afectan al metabolismo del calcio y la vitamina D que provocan un aumento de la resorción ósea y pérdida de masa ósea1,2. El mecanismo por el cual se produce este efecto sobre el metabolismo óseo es complejo y va más allá de la simple restricción calórica tras la cirugía e implica numerosas hormonas y moléculas como estrógenos, leptina, adiponectina, amilina, insulina y otras3.
Actualmente el bypass gástrico en Y de Roux (BGYR) es la técnica quirúrgica que se realiza en más del el 80% de las intervenciones de cirugía bariatrica según la American Society for Metabolic & Bariatric Surgery (ASMBS), sin embargo las alteraciones de malabsorción de nutrientes que produce han hecho que se buscaran alternativas a la misma. Una de las opciones quirúrgicas que se postulan como alternativa para minimizar el efecto sobre el metabolismo óseo es la gastrectomía tubular (GT), conocida habitualmente por el término anglosajón «sleeve gastrectomy», una técnica bariátrica restrictiva en la cual se extirpa la mayor parte del estómago, incluido el fundus y el cuerpo, desde el antro hasta el ángulo de His. Las ventajas de esta técnica son un menor tiempo operatorio, un menor riesgo quirúrgico y a al no realizarse derivación intestinal disminuye el riesgo de carencias vitamínicas, anemia y posiblemente de osteoporosis. Actualmente existen pocos datos sobre los efectos que tienen la GT y la comparación con el BGYR sobre el metabolismo óseo, densidad mineral ósea (DMO) y el riesgo de fracturas.
El objetivo del presente estudio piloto prospectivo, aleatorizado, es comparar la repercusión de las 2 técnicas quirúrgicas sobre el metabolismo mineral y la masa ósea en pacientes sometidos a cirugía bariátrica.
Pacientes y métodosDiseño del estudio
Ensayo clínico, piloto, prospectivo, aleatorizado
Ámbito
Hospital del Mar, Barcelona
Pacientes
Criterios de inclusión
Mujeres con obesidad mórbida, de edad entre 18–55 años. Índice de masa corporal (IMC) mayor de 40 o bien IMC mayor de 35 y co-morbilidad añadida: DM tipo 2, síndrome de apnea del sueño, trastorno de hipoventilación-obesidad, artropatía grave en articulaciones de carga, patología cardiovascular y dislipemia.
Los criterios de exclusión fueron: obesidad secundaria a patología endocrina y alteraciones psiquiátricas u otras patologías que contraindicaran formalmente la cirugía.
El estudio fue aprobado por el Comité de Ética del Hospital del Mar-Instituto Municipal de Investigación Médica. Todos los pacientes firmaron el consentimiento informado tras ser informados con detalle de los riesgos y beneficios de cada tipo de intervención quirúrgica (IQ).
Técnica quirúrgicaTodas las intervenciones fueron realizadas por laparoscopia y por el mismo equipo quirúrgico. En la técnica de la GT se realizó una tubulización longitudinal del estómago desde 5cm proximal al píloro hasta el ángulo de His tutorizado con sonda orogástrica de 36 French colocada a lo largo de la curvatura menor gástrica. La técnica del BGYR consistió en la realización de un reservorio gástrico subcardial de 15–30cc con asa alimentaria en Y de Roux de 150cm antecólica y antegástrica, gastroyeyunostomía circular mecánica de 25mm y exclusión de los primeros 50cm de yeyuno. Todas las pacientes recibieron instrucciones dietéticas y un complejo polivitamínico que contenía colecalciferol 600UI/ml diariamente.
Medición de la masa óseaLa medición de masa ósea se realizó mediante densitometría por absorciometría dual fotónica (DEXA) con fuente de energía de doble haz de rayos X, utilizando un densitómetro HOLOGIC QDR 4500SL con sofware APEX® versión 12,7.3 (Hologic, Walthman, Mass, USA). La DMO se midió en columna lumbar L2-L4 (CL), cuello femoral (CF), cadera total (CT) y extremo distal de radio, en su tercio proximal (1/3 PR) y zona ultradistal (UD). Las mediciones se realizaron dentro de los 3 meses anteriores y a los 12 meses de la IQ. Se siguieron los criterios de la Organización Mundial de la Salud (OMS) para catalogar a los pacientes en: normalidad con una T-score por encima de −1 desviación estándar (DE), osteopenia con una T-score entre −1,0 y −2,5DE y osteoporosis por debajo de una T-score de −2,5DS4.
Para evaluar fracturas vertebrales prevalentes se realizó una radiografía convencional de columna dorsal y lumbar y se consideró la presencia de fractura de la vértebra cuando existía una disminución mayor al 20% de alguna de las alturas anterior, media o posterior respecto la vértebra adyacente, siguiendo los criterios semicuantitativos de Genant5.
Bioquímica y marcadores de remodelado óseoSe realizaron determinaciones analíticas de calcio sérico total (Ca), Fosforo (P), 25 hidroxi-Vitamina D (25-OH Vit D) y parathormona intacta (PTH) dentro de los 3 meses previos y a los 12 meses de la IQ. Ca y P se midieron mediante colorimetría, utilizando un autoanalizador Roche MODULAR® ANALYTICS D/P (CV interserie: <4,6% y <5%, respectivamente), 25-OH Vit D mediante inmunoensayo quimioluminiscente (CLIA) con el autoanalizador DiaSorin LIAISON® (CV interserie <16%) y PTH mediante inmunoensayo quimioluminiscente en fase sólida con el autoanalizador Siemens IMMULITE® 2000 (CV interserie <8%).
Se determinaron los MRO: N-Telopéptido (NTx) y de formación ósea en sangre Fosfatasa alcalina ósea (FAO). Ntx se midió en orina reciente de la mañana, mediante inmunoensayo por Quimioluminiscencia Amplificada® en el autoanalizador VITROS ECi® de Ortho-Clinical-Diagnostics (CV interserie <12%) y FAO mediante inmunoensayo quimioluminiscente con el autoanalizador Beckman Coulter Access® (CV interserie <6%).
Análisis estadísticoSe utilizaron el test de la t de Student y análisis de la varianza (ANOVA) para las variables continuas. Se realizó un análisis de regresión múltiple con los factores edad, peso preoperatorio, pérdida de peso a los 12 meses y tipo de IQ para analizar su influencia sobre los cambios de la variable dependiente DMO.
El estudio se consideró como piloto, con la hipótesis de inicio de observar al menos una diferencia de pérdida de masa ósea entre las 2 técnicas de al menos un 5%, por ello se consideraron que serian suficientes al menos, un total de 12 pacientes sometidos a cada una de las 2 técnicas quirúrgicas (6 sujetos en BGYR y 6 en GT), con la intención de generar un cálculo posterior del tamaño muestral para el estudio prospectivo subsiguiente. La secuencia de asignación de tratamientos fue generada en el módulo de aleatorización del programa estadístico True Epistat. El análisis estadístico se realizó mediante el paquete SPSS 13.0 para Windows. Todas los resultados se presentan con media±DE.
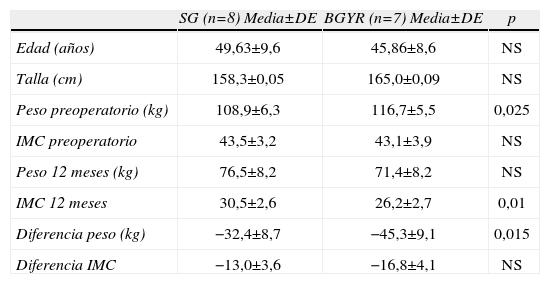
ResultadosPacientesFinalmente y tras el proceso de selección se incluyeron en el estudio 15 paciente, 8 en SG y 7 en BGYR. La edad media fue 47,8±9,0 con un IMC de 43,3±3,4. En la tabla 1 se muestran las características de las pacientes según la técnica de cirugía bariátrica aplicada. Las pacientes incluidas en el BGYR tenían un peso preoperatorio significativamente mayor a las incluidas en la GT, aunque con un IMC sin diferencia significativa, así mismo, también la pérdida de peso a los 12 meses fue mayor en ese grupo (tabla 1).
Características de los pacientes incluidos en cada una de las dos técnicas de cirugía bariátrica
| SG (n=8) Media±DE | BGYR (n=7) Media±DE | p | |
| Edad (años) | 49,63±9,6 | 45,86±8,6 | NS |
| Talla (cm) | 158,3±0,05 | 165,0±0,09 | NS |
| Peso preoperatorio (kg) | 108,9±6,3 | 116,7±5,5 | 0,025 |
| IMC preoperatorio | 43,5±3,2 | 43,1±3,9 | NS |
| Peso 12 meses (kg) | 76,5±8,2 | 71,4±8,2 | NS |
| IMC 12 meses | 30,5±2,6 | 26,2±2,7 | 0,01 |
| Diferencia peso (kg) | −32,4±8,7 | −45,3±9,1 | 0,015 |
| Diferencia IMC | −13,0±3,6 | −16,8±4,1 | NS |
Ninguno de las pacientes presentó complicaciones ni durante ni después de la cirugía.
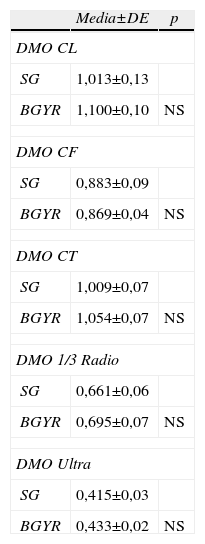
Masa óseaEn la tabla 2 se muestran los resultados de la DMO antes de la IQ. No se observaron diferencias significativas entre los 2 grupos en ninguna de las localizaciones medidas. Siguiendo los criterios de clasificación de la OMS antes de la IQ todos los pacientes cumplían criterios densitométricos de normalidad excepto 2 pacientes del grupo de la GT que tenían osteopenia en CL y uno en CL y CF.
DMO antes de la IQ según cada tipo de IQ*
| Media±DE | p | |
| DMO CL | ||
| SG | 1,013±0,13 | |
| BGYR | 1,100±0,10 | NS |
| DMO CF | ||
| SG | 0,883±0,09 | |
| BGYR | 0,869±0,04 | NS |
| DMO CT | ||
| SG | 1,009±0,07 | |
| BGYR | 1,054±0,07 | NS |
| DMO 1/3 Radio | ||
| SG | 0,661±0,06 | |
| BGYR | 0,695±0,07 | NS |
| DMO Ultra | ||
| SG | 0,415±0,03 | |
| BGYR | 0,433±0,02 | NS |
CF: cuello femoral; CL: columna lumbar L2-L4; CT: cadera total; DMO: densidad mineral ósea; Tercio proximal de radio (1/3 PR); UD: ultradistal de radio.
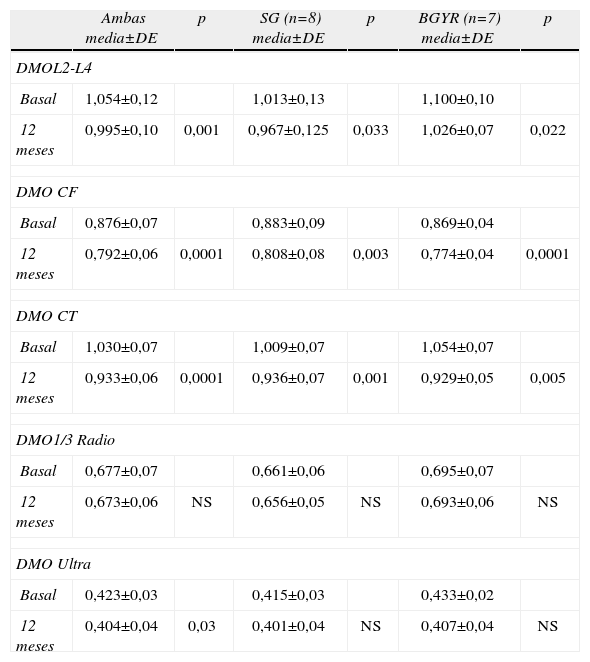
Los resultados pareados entre la medición basal de DMO antes y a los 12 meses de la IQ, considerando ambos grupos en su conjunto, mostraron pérdidas significativas en las localizaciones de CL, CF, CT y UD, mientras que a nivel de 1/3 PR no se observaron diferencias significativas (tabla 3).
DMO antes y a los 12 meses tras IQ en su conjunto y para cada tipo de IQ*
| Ambas media±DE | p | SG (n=8) media±DE | p | BGYR (n=7) media±DE | p | |
| DMOL2-L4 | ||||||
| Basal | 1,054±0,12 | 1,013±0,13 | 1,100±0,10 | |||
| 12 meses | 0,995±0,10 | 0,001 | 0,967±0,125 | 0,033 | 1,026±0,07 | 0,022 |
| DMO CF | ||||||
| Basal | 0,876±0,07 | 0,883±0,09 | 0,869±0,04 | |||
| 12 meses | 0,792±0,06 | 0,0001 | 0,808±0,08 | 0,003 | 0,774±0,04 | 0,0001 |
| DMO CT | ||||||
| Basal | 1,030±0,07 | 1,009±0,07 | 1,054±0,07 | |||
| 12 meses | 0,933±0,06 | 0,0001 | 0,936±0,07 | 0,001 | 0,929±0,05 | 0,005 |
| DMO1/3 Radio | ||||||
| Basal | 0,677±0,07 | 0,661±0,06 | 0,695±0,07 | |||
| 12 meses | 0,673±0,06 | NS | 0,656±0,05 | NS | 0,693±0,06 | NS |
| DMO Ultra | ||||||
| Basal | 0,423±0,03 | 0,415±0,03 | 0,433±0,02 | |||
| 12 meses | 0,404±0,04 | 0,03 | 0,401±0,04 | NS | 0,407±0,04 | NS |
CF: cuello femoral; CL: columna lumbar L2-L4; CT: cadera total; DMO: densidad mineral ósea; tercio proximal de radio (1/3 PR);UD: ultradistal de radio.
Cuando se consideraron de forma separada cada uno de los tipos de IQ también se observó una pérdida significativa de masa ósea con la GT y el BGYR, a nivel de CL, CF y CT mientras que a nivel de radio no se observaron diferencias significativas (tabla 3).
En cuanto al porcentaje de pérdida de masa ósea, en general, se observó una menor pérdida de masa ósea para la GT respecto el BGYR aunque sin llegar a la significación estadística en ninguna de las localizaciones. En la CL el porcentaje de pérdida fue del 4,6%±4,4 y 6,3%±5,4 en la GT y el BGYR respectivamente. En la cadera, el porcentaje de pérdida en CF fue del 8,3%±5,2 y 10,8%±3,8 y en CT del 7,1%±3,7 y 11,1%±6,3 en la GT y en el BGYR respectivamente. En el radio, el porcentaje de perdida de masa ósea fue en el 1/3 PR del 0,2%±9,3 y 0,1%±7,5 y a nivel UD del 3,2%±6,3 y de 5,9±8,2 en la GT y en el BGYR respectivamente.
En el análisis multivariado las variables, edad, peso preoperatorio, porcentaje de peso a los 12 meses y tipo de IQ no mostraron ninguna relación significativa con la pérdida de DMO en ninguna de las localizaciones analizadas.
En las radiografías de columna dorsal y lumbar no se hallaron fracturas vertebrales para ninguna de las pacientes antes ni a los 12 meses de la IQ.
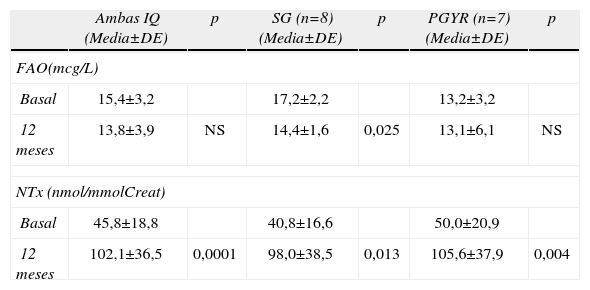
Bioquímica y marcadores de remodelado óseoEn la tabla 4 se muestran los resultados de Ca, P, 25-OH Vit D y PTH antes y a los 12 meses de la IQ. No se observaron diferencias significativas entre los dos grupos en ninguno de los parámetros analizados antes de la IQ. Los valores de Ca, P y PTH se mantuvieron dentro de los rangos de normalidad a los 12 meses de la IQ y no se hallaron diferencias significativas respecto los valores previos a la IQ. Los valores de 25 OH Vit D se incrementaron significativamente a los 12 meses solamente tras la GT. Cuando se compararon los resultados pareados entre los valores basales de MRO antes y a los 12 meses de la IQ, considerando ambos grupos conjuntamente, se observó una aumento significativo a nivel del marcador de resorción NTx mientras que para la FAO los cambios no fueron significativos (tabla 5). Cuando se compararon los MRO antes y a los 12 meses para cada una de los 2 tipos de IQ, se observó un aumento significativo para NTx en ambos tipos de IQ y un descenso significativo en las FAO tan solo para la GT (tabla 5).
Bioquímica y hormonas antes y a los 12 meses de la IQ
| Antes | 12 meses | |
| Ca (mg/dl) | ||
| Sleeve | 9,3±0,3 | 9,4±0,2 |
| By-pass | 9,4±0,4 | 9,4±0,3 |
| P (mg/dl) | ||
| Sleeve | 3,4±0,5 | 3,9±0,2 |
| By-pass | 3,3±0,6 | 3,7±0,5 |
| 25-OH VitD (ng/ml) | ||
| Sleeve | 24,3±16,0 | 37,4±19,5* |
| By-pass | 20,1±12,5 | 24,4±17,8 |
| PTH (pg/ml) | ||
| Sleeve | 50,1±25,3 | 43,8±12,8 |
| By-pass | 46,0±26,1 | 37,0±14,7 |
Ca: calcio; P: fósforo; 25 hidroxi-Vitamina D (25-OH Vit D); PTH: parathormona intacta.
MRO antes y a los 12 meses tras IQ en conjunto y para cada tipo de IQ
| Ambas IQ (Media±DE) | p | SG (n=8) (Media±DE) | p | PGYR (n=7) (Media±DE) | p | |
| FAO(mcg/L) | ||||||
| Basal | 15,4±3,2 | 17,2±2,2 | 13,2±3,2 | |||
| 12 meses | 13,8±3,9 | NS | 14,4±1,6 | 0,025 | 13,1±6,1 | NS |
| NTx (nmol/mmolCreat) | ||||||
| Basal | 45,8±18,8 | 40,8±16,6 | 50,0±20,9 | |||
| 12 meses | 102,1±36,5 | 0,0001 | 98,0±38,5 | 0,013 | 105,6±37,9 | 0,004 |
FAO: fosfatasa alcalina ósea; N-Telopéptido (NTx).
La relación entre el peso, IMC y riesgo de baja masa ósea y de fractura osteoporótica es un dato bien conocido. Ravn et al6 demostraron, en un estudio prospectivo en mujeres postmenopáusicas, la relación entre un IMC bajo y masa ósea, de tal forma que el adelgazamiento se correlacionaba de forma significativa con la pérdida de masa ósea. Además, un meta-análisis reciente de los principales estudios epidemiológicos ha demostrado que un IMC alto se correlacionaba con un menor riesgo de fracturas y por lo tanto con un efecto protector7. Al contrario un IMC bajo se relacionaba con un mayor riesgo de fractura osteoporótica, de tal forma que por ejemplo con un IMC de 35 el riesgo de fractura osteoporótica disminuía en un 26%, mientras que con un IMC de 20 el riesgo aumentaba en un 27%.
Por otro lado son conocidas las alteraciones que las intervenciones de cirugía bariátrica producen sobre el metabolismo óseo8–11. Se considera que durante el primer año se puede llegar a perder hasta un 4,5% en la DMO medida en CL y hasta un 9,27% en CT12. Todos estos datos han motivado que se busquen alternativas a la cirugía bariatrica más intervencionista como es el by-pass e intentar reducir este efecto de pérdida de la masa ósea relacionado con la pérdida de IMC.
Los resultados del presente estudio han demostrado una pérdida significativa de DMO en CL, CF y CT con ambas técnicas IQ evaluadas, el BGYR y la GT, con un porcentaje de pérdida mayor en cadera que en columna, similar a lo observado por otros autores12.
Esta diferencia en el porcentaje de pérdida de DMO en cadera podría explicarse por que esta tiene un mayor componente de hueso cortical que trabecular , sin embargo esta hipótesis no estaría confirmada por los cambios de DMO a nivel del extremo distal del radio, sobre todo en 1/3 PR, que es una región particularmente cortical.
Al comparar las dos técnicas, los resultados han demostrado un porcentaje de pérdida de masa ósea menor con la GT que con el BGYR a nivel de columna lumbar y de cadera, aunque sin significación estadística. Así mismo, en el análisis multivariado se ha demostrado que el ni el tipo de IQ ni la pérdida de peso alcanzada a los 12 meses influía en la pérdida de DMO. En referencia a la longitud del asa en Y de Roux, Gleysteen JJ realizó un estudio en el que comparaba varios tipos de asa, de 41–61cm, 130–160cm y 115–250cm. No halló diferencias en la pérdida de peso producido, ni a corto ni largo plazo, entre los pacientes obesos sometidos a intervención con las asas más largas y si respecto las asas por debajo de 61cm13.
Las ventajas de la GT sobre el BGYR serían un menor tiempo operatorio, menor riesgo quirúrgico al evitar anastomosis, una preservación del píloro evitando así el dumping, una motilidad gastrointestinal no alterada y al no haber bypass intestinal se evitaría el riesgo de carencias vitamínicas, absorción de calcio y se evitaría una excesiva pérdida de DMO.
Sin embargo, los resultados del presente estudio en cuanto a DMO, demuestran que se produce también una pérdida de DMO, aunque con un menor porcentaje de pérdida de masa ósea. Además los hallazgos de los MRO demuestran un aumento en la resorción y disminución de la formación ósea con ambas IQ, aunque la FAO no llega a ser significativa en el BGYR, probablemente por un problema de tamaño de la muestra.
Los resultados de estudios similares sin by pass gástrico, demuestran con la técnica de la gastroplastia vertical anillada, un aumento de los MRO de resorción y así como un descenso de la leptina medida en sangre9. Este dato podría explicar en parte los resultados de nuestro estudio, en el que con ambas técnicas quirúrgicas existiría una pérdida de DMO similar y por lo tanto más relacionada con la pérdida de peso que con los trastornos de absorción y alteración de los parámetros nutricionales y hormonales del metabolismo del calcio11,14. En este sentido, destaca la estrecha relación que sugieren algunos autores entre la materia grasa y el hueso15, con un aumento claro de la actividad osteoclástica incluso en mujeres sanas postmenopáusicas que reducen peso16.
Desde el punto de vista hormonal esta bien establecida la relación entre glucosa, calcitonina y hormona paratiroidea17 todo ello mediado por los cambios que se produce con la glucosa, proteínas y grasa a través de la insulina y otras sustancias como la amilina18. En nuestro estudio los valores de 25 OH Vit D se incrementaron significativamente con el SG y no se modificaron con el BGYR lo que confirma los resultados de otros estudios en los que se relaciona a esta técnica de IQ con una necesidad de suplementación con dosis altas de vitamina D para evitar un hiperparatiroidismo secundario que favorezca la resorción ósea y la pérdida de masa ósea19–21. Valderas et al19 realizaron un estudio retrospectivo en el que revisaron la repercusión a largo plazo, entre 1–5 años, sobre el metabolismo óseo del BGYR. Hallaron una clara correlación entre los niveles del C-telopéptido, un marcador de resorción ósea similar a NTx y los niveles de PTH. Estos datos reflejaban la persistencia de una resorción ósea aumentada, con un hiperparatiroidismo secundario mantenido a largo plazo tras la cirugía bariátrica. Se reafirma así la necesidad de la suplementación con vitamina D o al menos determinación de los niveles de 25 OH Vit D de forma mantenida incluso tras varios años tras la cirugía del BGYR.
Las células adipocíticas son relevantes en todo este proceso y fundamentalmente porque su regulación depende en gran medida de la leptina que tiene la capacidad de codificar ambas células implicadas en el proceso22.
Los mecanismos por los que se produce la pérdida de masa ósea tras la cirugía bariátrica son diversos y no dependen tan solo de la posible mal absorción del calcio y la vitamina D. La disminución de peso produce un descenso en los niveles de leptina23, con la consiguiente disminución de la producción de osteoprotegerina (OPG), y un incremento de la actividad resortiva de los osteoclastos al no producirse el efecto bloqueador de la OPG sobre el RANKL.
La leptina tiene, además de la capacidad de regular el sistema de diferenciación osteoblástica24, receptores de leptina en los propios osteoblastos y también interviene en el sistema de regulación osteoclástica OPG-RANK-RANKL. Recientemente Bruno et al25 han demostrado una disminución de los niveles de leptina que se correlacionaban con la pérdida de DMO y cambios en los MRO en pacientes con BGYR a los 18 meses de la IQ.
Una de las limitaciones del presente estudio piloto es el tamaño muestral, es necesario confirmar los datos obtenidos mediante un estudio con el mismo diseño y con un tamaño muestral mayor para recomendar de manera protocolizada el tratamiento preventivo de la pérdida de masa ósea en los pacientes sometidos a GT. Analizar además los valores de leptina en sangre para confirmar la hipótesis de su correlación con la pérdida de DMO.
En conclusión el presente estudio demuestra que con la GT existe una pérdida de masa ósea menor, no significativa, a la que se produce con la el BGYR, lo que hace preveer la recomendación de una evaluación previa y un seguimiento de la DMO y de los parámetros relacionados con el metabolismo óseo independientemente de la técnica quirúrgica utilizada y valorar la introducción de antiresortivos, a parte de los nutrientes necesarios como la vitamina D.
FinanciaciónEste estudio recibió el soporte de una ayuda del Fondo de Investigaciones Sanitarias del Instituto Carlos III convocatoria para proyectos de Investigacion de Evaluación de Tecnologías Sanitarias (PI 0690639).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.