La cirugía robótica del hígado fue inicialmente descrita en 2002 y no ha logrado ser aún más ampliamente difundida por su alto costo y por la falta de programas de entrenamiento estandarizados. Esta técnica posee el potencial para superar las limitaciones tradicionales de los procedimientos laparoscópicos en intervenciones hepáticas, aunque se considere aún «en desarrollo».
MétodosSe analizaron los resultados postoperatorios de 10 pacientes sometidos a la resección robótica parcial del lóbulo caudado (lóbulo de Spiegel) desde marzo de 2014 hasta mayo de 2016, con el fin de evaluar sus ventajas.
ResultadosEl tiempo medio operatorio fue de 258min (150-522) y la pérdida estimada de sangre, de 137ml (50-359): en ninguno de los casos se requirió transfusión sanguínea. No se realizó la conversión a cirugía abierta en ninguno de los casos; la morbilidad global fue del 20% (2/10) y no se registraron complicaciones (fístulas biliares y derrame pleural) que requirieran revisión quirúrgica. En el examen histológico, el diámetro medio de los tumores fue de 2,63cm, y se logró un índice de resección R0 en el 100% de los casos (10/10). La tasa de mortalidad a 90 días fue nula. Los índices de supervivencia general y libre de enfermedad a un año fueron del 100% y del 80%, respectivamente.
ConclusionesA pesar de las inquietudes en relación con su rentabilidad, la resección robótica del lóbulo caudado es una técnica tanto ventajosa como aplicable, que promete óptimos resultados postoperatorios a corto plazo, con un efectivo perfil riesgo-beneficio.
Firstly described in 2002, the robotic liver surgery has not spread widely due to its high cost and the lack of a standardized training program. Still being considered as a ‘development in progress’ technique, it has however a potential to overcome the traditional limitations of the laparoscopic approach in liver interventions.
MethodsWe analyzed the postoperative outcomes of 10 patients who had undergone robotic partial resection of the caudate lobe (Spiegel lobe) from March 2014 to May 2016 in order to evaluate the advantages of robotic technique in hands of a young surgeon.
ResultsThe mean operative time was 258min (150-522) and the estimated blood loss 137ml (50-359), in none of the cases a blood transfusion was required. No patient underwent a conversion to open surgery; the overall morbidity was 2/10 (20%) and all the complications occurred (biliary fistula and pleural effusion) did not require a surgical revision. At histological examination, the mean tumour size was 2.63cm and we achieved R0-resection rate of 100%. The 90-day mortality rate was null. The 1-year overall and disease free-survival rates were 100% and 80%, respectively.
ConclusionsDespite several concerns regarding the cost-effectiveness, a fully robotic partial resection of caudate lobe is an advantageous, implementable technique providing promising short-term postoperative outcomes with acceptable benefit-risk profile.
Inicialmente descrita en 1992, la introducción a la cirugía mínimamente invasiva (CMI) para resecciones hepáticas ha sido más lenta que en otros campos quirúrgicos. Un relevante metaanálisis, que incluyó 31 publicaciones y 2.473 pacientes1, ha demostrado los superiores resultados del abordaje laparoscópico en procedimientos hepáticos en cuanto a pérdidas estimadas de sangre, índices de transfusión, dolor postoperatorio, menor estancia hospitalaria, así como una mayor rentabilidad en comparación con la cirugía abierta, manteniendo tasas similares de morbimortalidad y mostrando hallazgos también similares a los previamente publicados por otros autores2,3.
Dichas ventajas pueden ser potencialmente beneficiosas en relación con la supervivencia global, asegurando un período postoperatorio más corto, que permita una reincorporación más rápida a la rutina diaria y al inicio más precoz del tratamiento quimioterapéutico adyuvante4,5.
Considerando los retos clínicos y quirúrgicos de los pacientes con carcinoma hepatocelular, las potenciales ventajas técnicas de la CMI en intervenciones hepáticas son aún más significativas por ofrecer la oportunidad de preservar la integridad de la pared abdominal y la función del diafragma. De hecho, la aplicación de este abordaje permite mantener un mejor drenaje venoso colateral, conllevando un menor riesgo de ascitis y de adherencias postoperatorias6,7.
A pesar de no existir desventajas oncológicas significativas entre la CMI y la cirugía abierta en términos de resección del margen de infiltración, recidiva local, supervivencia global a 5 años y mortalidad8,9, la realización de este abordaje se restringe aún a centros altamente especializados.
Sin embargo, mientras que el índice reportado de resecciones laparoscópicas por año se ha incrementado de 1.471 procedimientos en 2009 a 1.908 en 2014, la tasa de hepatectomías complejas realizadas mediante el abordaje mínimamente invasivo se mantiene aún baja.
Vale la pena mencionar que el uso del equipo laparoscópico se encuentra dificultado por varias dificultades técnicas ya conocidos: la destreza comprometida, los limitados grados de movimiento (solo 4) y el efecto del fulcro asociado al temblor fisiológico. Los aspectos anteriormente mencionados son potenciales medidas disuasorias para la adopción generalizada de la cirugía hepática mínimamente invasiva10.
La lobectomía caudal aislada por laparoscopia es un procedimiento considerado particularmente riesgo y difícil, reportado en escasas ocasiones. De hecho, solo algunas series de resección S1 han sido descritas, principalmente en el contexto de series técnicamente no homogéneas11-13.
Las resecciones del lóbulo hepático caudado son procedimientos que constituyen un reto para el cirujano, tanto por la singularidad como por la complejidad de la anatomía del lóbulo (su ubicación profunda y en proximidad a los grandes vasos, por estar ubicada entre las estructuras vasculares principales con el MVI en la parte posterior, la tríada portal en la parte inferior y la confluencia de las venas hepáticas en su parte superior). Asimismo, la variabilidad del flujo portal y arterial, el complejo venoso y el sistema de drenaje biliar obligan al cirujano a desempeñar un meticuloso control vascular.
A pesar de que la resección robótica aislada del segmento hepáticoI ha sido reportada en un contexto de pequeñas series, todavía no se dispone en la literatura de una descripción sistemática sobre las técnicas robóticas del procedimiento, ni del análisis de los resultados postoperatorios.
El objetivo de este estudio es describir nuestra técnica para la resección robótica parcial aislada del lóbulo caudado (resección del lóbulo de Spiegel) mediante el abordaje izquierdo; así como describir nuestra experiencia inicial y las consideraciones técnicas en una serie de pacientes, proporcionando un análisis retrospectivo de los resultados de dichas series a corto plazo, en relación con la cirugía ya descrita.
MétodosEntre marzo de 2014 y mayo de 2016, 10 pacientes consecutivos se sometieron a resección robótica parcial aislada del lóbulo caudado. Un solo cirujano, experto tanto en cirugía abierta como en CMI, realizó todas las intervenciones mediante el abordaje izquierdo y empleando el sistema quirúrgico da Vinci Si (Intuitive Surgical, Inc. Sunnyvale, CA, EE.UU.) en el Hospital General de Palermo (Italia).
Las bases de datos comunes se revisaron de forma retrospectiva para evaluar los resultados a corto plazo y analizar la viabilidad y seguridad de esta intervención.
Todos los casos clínicos se discutieron en una conferencia multidisciplinaria preoperatoria, durante la cual se estudió el abordaje quirúrgico más idóneo para cada caso individual (robótico versus abierto). En uno de estos casos, la incertidumbre diagnóstica con respecto a una lesión asintomática, que parecía aumentar de tamaño en los procedimientos de imagen consecutivos, se consideró una indicación para la cirugía; el siguiente informe histopatológico reveló los signos de hiperplasia nodular focal. Se excluyó de este estudio a todos los pacientes que requerían un procedimiento simultáneo. Las contraindicaciones para la cirugía robótica se describen en la tabla 1. Se informó a los pacientes sobre la naturaleza innovadora del procedimiento y se obtuvo el consentimiento por escrito antes de la cirugía.
Contraindicaciones a la lobectomía caudada robotizada
| Absolutas |
| Tamaño del tumor >3cm |
| Metástasis ganglionar |
| Afectacion vascular |
| Marcadores ASA>3 |
| Child Pugh B o C |
| IMC >35kg/m2 |
| Contraindicaciones al neumoperitoneo |
| Función cardiopulmonar inestable |
| Relativas |
| Cirugía previas de importancia en el cuadrante abdominal superior |
ASA: American Society of Anaesthesiologists; IMC: índice de masa corporal.
El estudio preoperatorio incluyó una tomografía computarizada reforzada por contraste, imágenes de resonancia magnética optimizadas con ácido gadoxético hepático, evaluación de marcadores tumorales (EE.UU.) (AFP, CEA, Ca-19.9) y examen de sangre de rutina. El panel de hepatitis se solicitó en el caso de sospecha, mientras que en el caso de sospechar la presencia de un quiste hidatídico, el paciente debió someterse a pruebas serológicas para la equinococosis. Se llevó a cabo una evaluación preoperatoria de la función hepática para evaluar la tasa de retención del verde de indocianina a los 15min de su administración.
Se diagnosticó una fuga biliar en el caso de que la concentración de bilirrubina en el líquido de drenaje fuera al menos 3 veces mayor que la del suero.
Se definió un margen de resección positivo ante la presencia de células tumorales en la línea de transección por la afectación microscópica del tumor principal, la permeabilidad venosa o los nódulos microsatelitales.
Todos los pacientes fueron seguidos mensualmente durante el primer año posterior a la operación, y luego trimestralmente con una tomografía computarizada o una ecografía abdominal; en caso de sospecha de recidiva, se realizó una resonancia magnética o biopsia.
Descripción técnicaBajo anestesia general, el paciente se coloca en posición supina, Trendelenburg inverso a 25° con los brazos situados a los lados y las piernas separadas; con la mesa ligeramente inclinada hacia el lado derecho, donde se encuentra el sistema de ultrasonido.
El personal de enfermería se ubica en el lado izquierdo del paciente, mientras que el cirujano asistente se debe colocar entre las piernas del paciente.
El neumoperitoneo se induce insertando una aguja de Veress en el punto de Palmer, y el abdomen se insufla con gas. La presión intraabdominal se mantiene en 12mmHg. La presión venosa central se mantiene baja (5cm H2O) para disminuir el riesgo de pérdida de sangre durante la transección hepática.
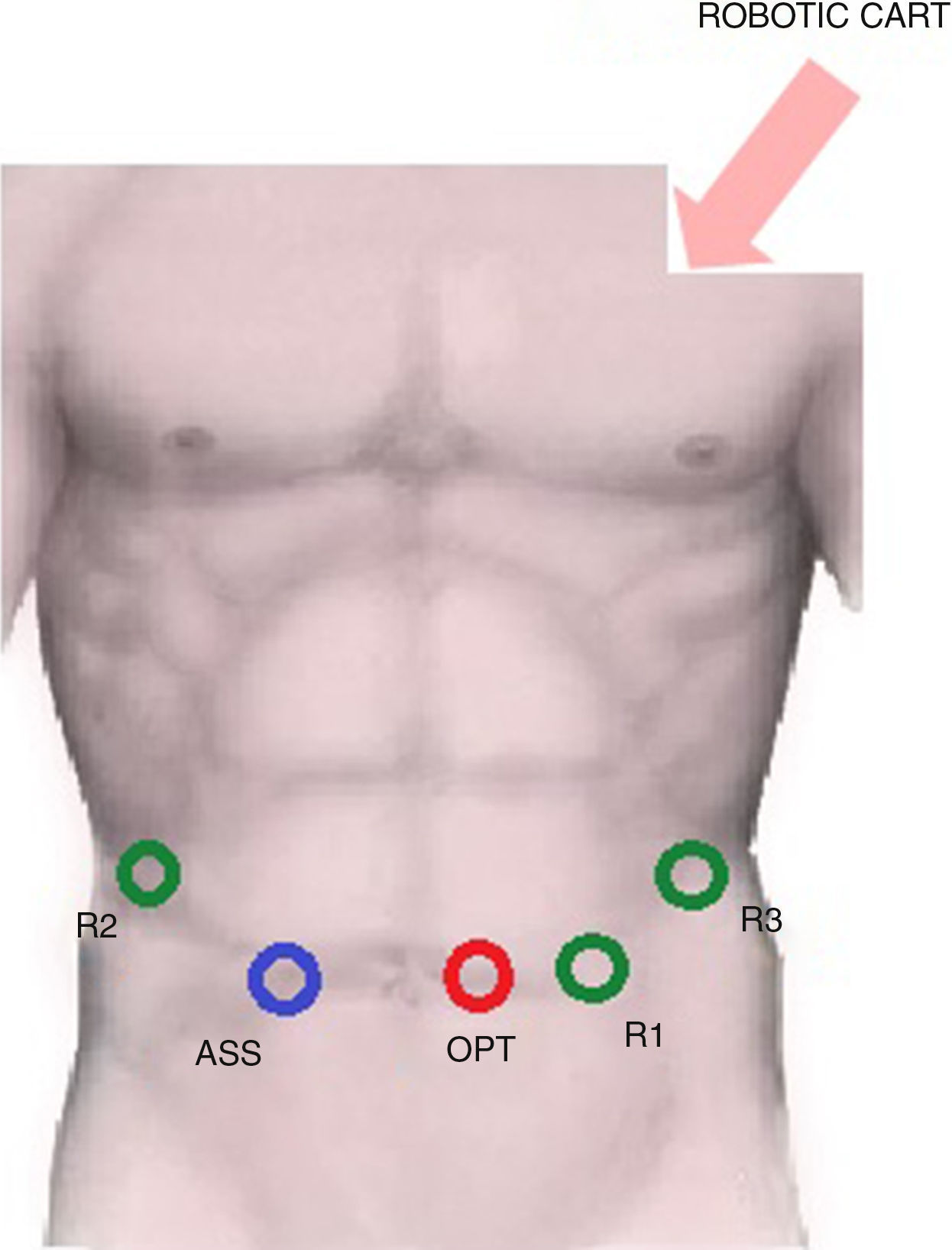
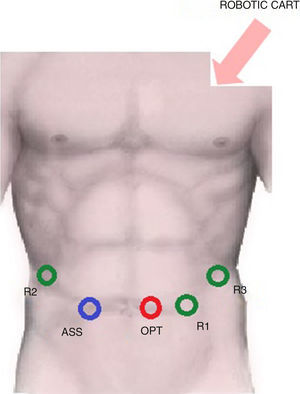
La colocacion de los trócares se muestra en la figura 1.
- -
R1: trocar de 8mm en el epigastrio, 4cm a la izquierda de la línea xifoumbilical.
- -
R2: trocar de 8mm en el hipocondrio derecho.
- -
R3: trocar de 8mm en el hipocondrio izquierdo.
- -
Puerto óptico: trocar de 12mm en el área periumbilical.
- -
Asistente: trocar laparoscópico de 12mm en el área pararrectal derecha.
La unidad robótica del paciente se coloca entre la cabeza del paciente y su hombro izquierdo para la fase de acoplamiento.
Se emplea un laparoscopio de 30 grados en el puerto óptico; las tijeras monopolares en el brazo #1, mientras que en el brazo #2 insertamos las pinzas bipolares, y finalmente, se usa el brazo #3 para el fórceps Prograsp, como retractor hepático estable.
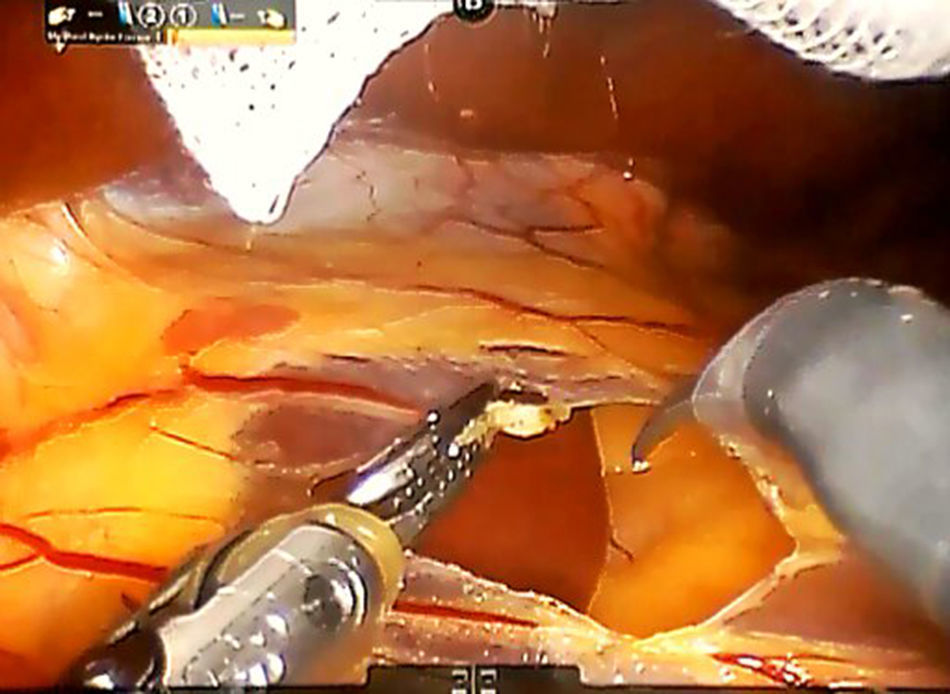
Paso 1. Se disecan los ligamentos redondos y falciformes del hígado y se realiza una ecografía intraoperatoria para confirmar la presencia del tumor y su relación con las principales estructuras vasculares. Después de la división de los ligamentos triangulares y coronarios izquierdos, se realiza la movilización del lóbulo hepático izquierdo para lograr una exposición más efectiva. El pasrs flaccida del epiplón menor debe ser incidido, mientras que el tercer brazo retrae el lóbulo izquierdo hacia arriba, exponiendo el lóbulo caudado (fig. 2).
Se inserta una cinta umbilical alrededor del hilio hepático para permitir su retracción, ya que la maniobra de Pringle no se realiza rutinariamente.
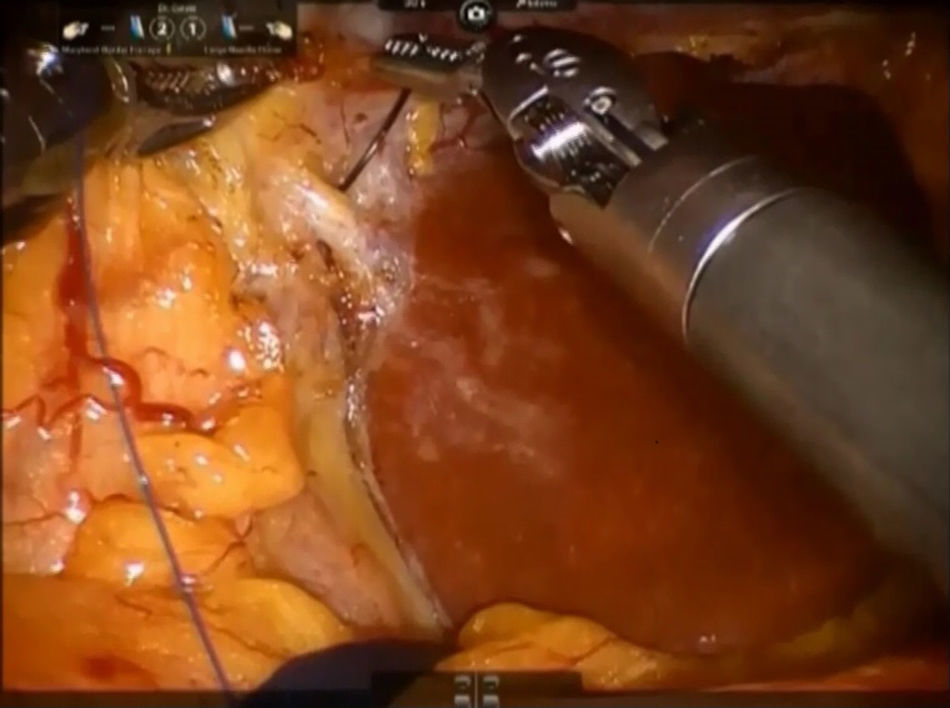
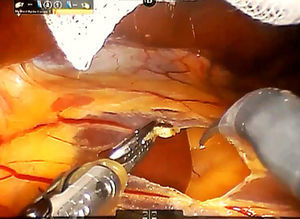
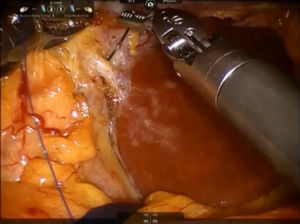
Paso 2. El lóbulo caudado se retrae hacia el lado izquierdo y las ramas caudales de la vena porta izquierda se suturan y dividen mediante puntadas o clips metálicos (fig. 3). El ligamento de Arantius (que representa el límite izquierdo del lóbulo caudado) se diseca en dirección craneal y a la derecha, con el fin de exponer la parte superior del lóbulo caudado y el pedículo posterior de Glissonean.
Se coloca una sutura de sujeción en el lóbulo de Spiegel y se retrae ventralmente por el tercer brazo.
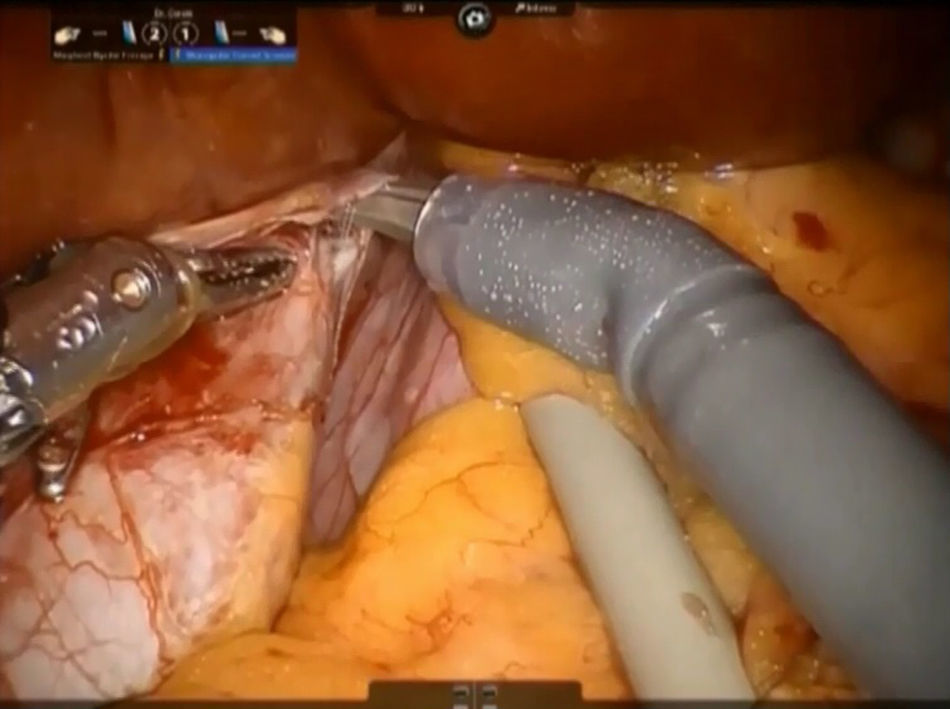
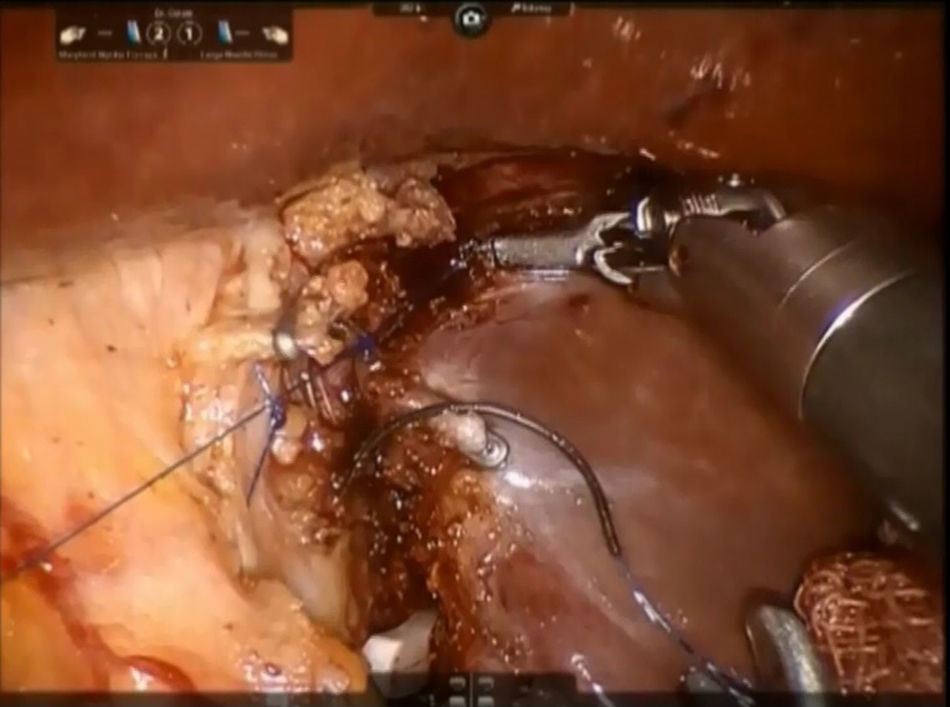
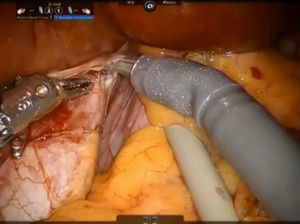
El ligamento cavo izquierdo debajo del lóbulo caudado se abre y las venas hepáticas accesorias cortas se disecan con pinzas Maryland y tijeras, se suturan con polipropileno 4-0 (o también se pueden controlar con clips metálicos) y se dividen a continuación, liberando completamente la superficie anterior de la vena cava inferior (VCI) del lóbulo de Spiegel (fig. 4). Este paso debe realizarse del lado izquierdo hacia el derecho y en dirección caudocraneal.
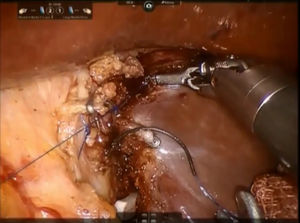
Paso 3. El parénquima de la porción pericaval se secciona mediante pinzas bipolares o tijeras monopolares y división de todas las ramas glissonianas cortas mediante puntadas simples o clips de Hem-o-lock® (TFX Medical Ltd, RTP, Durham, NC, EE.UU.) (fig. 5). Todas las estructuras biliares están recortadas son clipadas metálicos laparoscópicos. Durante este paso, el proceso de caudado se mantiene en el lado derecho mientras que el lóbulo caudado se separa hacia la izquierda. Se controla la fuga biliar y se efectua la hemostasia de la superficie de resección mediante el uso de una sutura de 3/0 de monofilamento de polipropileno. Se coloca pegamento de fibrina en el margen de resección y se inserta un tubo de drenaje en el foramen de Winslow. La muestra se coloca dentro de una bolsa de plástico y la extracción se realiza a través del sitio del trocar del asistente o la incisión Pfannenstiel.
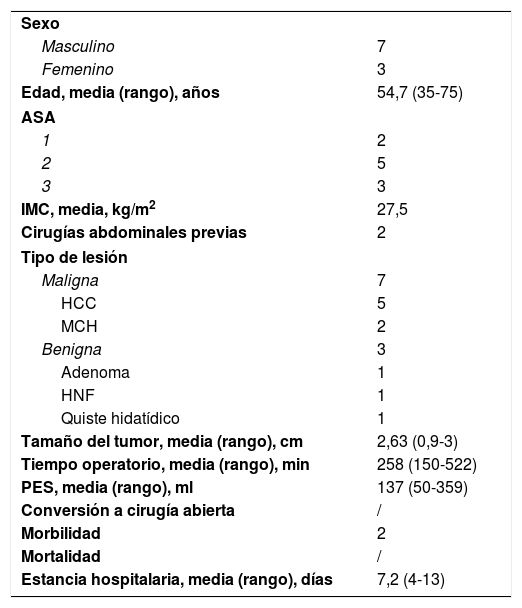
ResultadosEl estudio histopatologico confirmaron 7 afecciones malignas (incluyendo 5 casos de carcinomas hepatocelulares, 2 casos de cáncer de colon metastásico) y 3 afecciones benignas. Los aspectos demográficos y los resultados perioperatorios se resumen en la tabla 2.
Características demográficas y resultados perioperatorios del grupo de caudectomía robótica parcial (n=10 pacientes)
| Sexo | |
| Masculino | 7 |
| Femenino | 3 |
| Edad, media (rango), años | 54,7 (35-75) |
| ASA | |
| 1 | 2 |
| 2 | 5 |
| 3 | 3 |
| IMC, media, kg/m2 | 27,5 |
| Cirugías abdominales previas | 2 |
| Tipo de lesión | |
| Maligna | 7 |
| HCC | 5 |
| MCH | 2 |
| Benigna | 3 |
| Adenoma | 1 |
| HNF | 1 |
| Quiste hidatídico | 1 |
| Tamaño del tumor, media (rango), cm | 2,63 (0,9-3) |
| Tiempo operatorio, media (rango), min | 258 (150-522) |
| PES, media (rango), ml | 137 (50-359) |
| Conversión a cirugía abierta | / |
| Morbilidad | 2 |
| Mortalidad | / |
| Estancia hospitalaria, media (rango), días | 7,2 (4-13) |
ASA: American Society of Anaesthesiologists; HCC: hepatocarcinoma; HNF: hiperplasia nodular focal; IMC: índice de masa corporal; MCH: metástasis colorrectal hepática; PES: pérdida estimada de sangre.
El tiempo operatorio varió de 180 a 522min, y el tiempo medio fue de 258min. En cuanto a la pérdida estimada de sangre, varió de 50 a 359ml con un valor promedio de 136,7ml. No fue necesario realizar transfusiones de sangre en ninguno de los casos. El diámetro tumoral medio fue de 2,63cm y la duración media de la estancia hospitalaria fue de 7,2 días.
Ninguno de los pacientes fue convertido a laparotomía, y solo en 2 pacientes se presentaron complicaciones (20%). A uno de ellos se le diagnosticó una fuga biliar en el séptimo día postoperatorio y se decidió colocarle un drenaje percutáneo. El otro paciente desarrolló un derrame pleural con inicio rápido de fiebre, que se manejó exitosamente con antibióticos. La tasa de mortalidad en la serie de casos presentada fue nula.
El seguimiento medio fue de 23 meses (rango 18-36 meses). Dos pacientes (20%) presentaron recidivas. En el primer caso, se encontró una nueva metástasis de cáncer colorrectal en el segmento 8 a los 12 meses de haberse realizado la cirugía, por lo que el paciente se sometió a una nueva intervención quirúrgica. A otro paciente también se le diagnosticó una lesión metastásica recurrente en el segmento 7, a 9 meses de haberse operado. Esta fue tratada con ablación por radiofrecuencia. Ambos pacientes están todavía vivos. Las tasas globales de supervivencia global y de supervivencia libre de enfermedad a un año fueron del 100% y 80%, respectivamente.
DiscusiónLa cirugía hepática laparoscópica permite disminuir la pérdida de sangre, el trauma quirúrgico durante la operación, y se asocia también con una menor morbilidad y una menor estancia hospitalaria; sin embargo, este enfoque requiere una alta destreza del cirujano y su aplicabilidad es solo generalizable para un reducido tipo de procedimientos de resección hepática. Las cirugías largas y complejas obligan a los cirujanos a trabajar en malas condiciones ergonómicas a través de muchos de los pasos cruciales de la operación, aumentando así su dificultad.
El uso de instrumentos laparoscópicos rígidos obliga a realizar resecciones hepáticas mayores en línea recta incluso para nódulos pequeños y descuidar el concepto de «cirugía conservadora de parénquima», aumentando las dificultades encontradas durante la operación, el miedo a no poder manejar una hemorragia importante y a comprometer una buena cantidad de estructuras profundas11. La cirugía robótica es una tecnología interesante, que supera los límites tradicionales de la laparoscopia y permite realizar resecciones hepáticas más complejas, especialmente en el caso de lesiones localizadas en la proximidad de estructuras hiliares y vasos sanguíneos grandes, proporcionando una gran ergonomía y ofreciendo una posibilidad de resecciones no anatómicas de «forma curva».
Desde su primera descripción en 2003 por Giulianotti et al.14, la cirugía robótica ha presentado algunos beneficios prometedores (instrumentación EndoWrist® con 7 grados de libertad, una plataforma estable de alta definición para cámara 3-D y una ergonomía mejorada) que pueden superar las limitaciones tradicionales de la cirugía laparoscópica. Sin embargo, hasta ahora, la resección hepática robótica todavía se considera una técnica «en desarrollo» debido a los escasos datos disponibles y a la falta de disponibilidad de los equipos de cirugía robótica hepática necesarios.
Es así como la difusión de la cirugía robótica hepática se ha visto condicionada durante mucho tiempo por su alto costo, las dificultades asociadas con las variaciones anatómicas del hígado, la ausencia de programas de capacitación estandarizados y las preocupaciones relacionadas con la ausencia de la experiencia táctil. Sin embargo, aunque el enfoque robótico no demostró una superioridad significativa con otras técnicas de CMI, permitió aumentar la tasa de hepatectomías importantes y complejas (segmentos posteriores superiores) que pueden realizarse de forma mínimamente invasiva, siguiendo el principio de preservación parenquimatosa y promoviendo la indicación de resecciones hepáticas mediante la CMI en el futuro cercano.
Nueve series que comparan la cirugía hepática robótica y la laparoscópica han demostrado que el abordaje robótico es una opción viable y segura en pacientes bien seleccionados, proporcionando resultados similares en términos de resultados perioperatorios y oncológicos a corto plazo sin aumento de complicaciones ni tasa de mortalidad; sin embargo, el uso de brazos robóticos reporta un incremento del tiempo operatorio así como de sus costos15.
El lóbulo caudado representa uno de los segmentos de mayor desafío en una intervención quirúrgica debido a su anatomía única y variable y a su estrecha relación con estructuras vasculares relevantes. La caudectomía aislada requiere de la ejecución altamente cualificada inclusive ante el abordaje abierto tradicional por su anatomía intrínseca. De igual modo, presenta varias dificultades: la complejidad de la resección del lóbulo radical, la difícil exposición y la ausencia de límites claros. De acuerdo con la clasificación de Kumon, el lóbulo caudado consta de 3 secciones: el lóbulo de Spiegel (segmentoI de Couinaud), la porción paracava (segmentoIX de Couinaud) y el proceso caudado16. La primera parte está cubierta por la pars fláccida del epiplón menor y se encuentra a la izquierda del ligamento de Arantius, a lo largo de la parte izquierda de la VCI. La porción paracava se encuentra a la derecha del lóbulo de Spiegel, frente a la porción intrahepática de la VCI. La última porción es la más pequeña que se encuentra entre la VCI y la vena porta a la derecha de las estructuras anteriores.
La lobectomía caudada se clasifica en resecciones parcial y completa, y también como aislada o combinada.
Con respecto a la escasez de datos, ahora es imposible extraer conclusiones definitivas sobre la seguridad y la eficacia oncológica del procedimiento realizado mediante el uso del instrumento robótico. Datos iniciales reportados por varios autores sugieren la viabilidad técnica de la caudectomía robótica y muestran resultados alentadores en términos de tasa de morbilidad y adecuación oncológica17,18.
Di Benedetto et al. proporcionaron un informe de un caso de resección totalmente robótica del lóbulo caudado para la hidatidosis que muestra las ventajas, la seguridad y la efectividad de esta técnica, también en este desafiante escenario19.
En nuestra serie, los hallazgos (137ml de promedio estimado de pérdida sanguínea, sin conversión y tasa de mortalidad nula) son comparables con otros informes19,20 y los resultados alentadores confirman la potencialidad de la técnica robótica para superar los límites que plantea el abordaje laparoscópico. El relativamente largo promedio de tiempo quirúrgico en nuestro estudio se asoció con la gran magnitud de las lesiones y con la necesidad de realizar una minuciosa resección R0. El tiempo de estancia hospitalaria se estableció de acuerdo con la estrategia específica establecida por nuestro equipo para el manejo del paciente, cuando durante días adicionales se llevó a cabo una observación destinada a excluir el desarrollo de complicaciones relacionadas con la cirugía.
La instrumentación EndoWrist® nos permitió realizar una delicada y precisa disección alrededor de las estructuras vasculares importantes. Del mismo modo, la visión ampliada HD-3D fue crucial para realizar una hemostasia meticulosa. La sutura sencilla y la oportunidad de manejar estructuras finas de forma segura nos permitieron lograr el control de sutura a mano en estructuras vasculares delicadas, reduciendo el número de aplicaciones de clips y, por lo tanto, el riesgo de deslizamiento del clip postoperatorio.
La modulación en la magnitud del movimiento en el uso del instrumento robótico es esencial para una disección segura y meticulosa en el caso de una anatomía compleja.
Aunque esta serie retrospectiva es relativamente pequeña, en este documento describimos la serie de casos más amplia de resección parcial aislada completamente robótica del lóbulo caudado que se haya reportado en la literatura.
La cirugía robótica hepato-pancreato-biliar (HPB) es un campo prometedor, que ofrece resultados interesantes, como mostramos anteriormente21,22, abarcando los complejos campos del trasplante y la reconstrucción vascular. Esta ofrece resultados no tan solo no inferiores a otros enfoques para las resecciones hepáticas menores, sino de relevancia para intervenciones hepáticas más complejas. Creemos necesaria la correcta selección de pacientes por parte de los cirujanos, así como que se trabaje en un entorno multidisciplinario fiel al principio de la cooperación y especialmente provisto de la adecuada capacitación específica que permita enfrentar las potenciales dificultades y la resolución de problemas relacionados con el sistema de cirugía robótica, para así lograr aumentar la tasa de casos abordados con esta técnica en resecciones hepáticas importantes23.
Esta tecnología representa una nueva perspectiva, que puede integrarse fácilmente con la cirugía asistida por imágenes y la fluorescencia, las cuales son verdaderamente esenciales en el caso de una anatomía poco clara o compleja, principalmente en la fase inicial de la curva de aprendizaje.
En conclusión, la caudectomía robótica parcial es una técnica ventajosa y aplicable que proporciona resultados postoperatorios prometedores a corto plazo y con un perfil aceptable en cuanto a riesgos-beneficios. Nuestros resultados demuestran las evidentes ventajas del empleo del sistema robótico en términos de resultados perioperatorios, sugiriendo la posibilidad de ampliar las indicaciones para la cirugía hepática mínimamente invasiva, incluso en áreas anatómicas difícilmente accesibles.
AutoríaMarino MV: diseño del estudio y realización del documento;
Glagolieva A: manejo de datos y análisis de resultados;
Guarrasi D: revisión crítica y aprobación de la versión final del documento.
Conflicto de interesesLos autores no declaran ningún conflicto de interés.