Las lesiones cervicales traumáticas suponen un 5-10% del total de las lesiones traumáticas y acarrean una alta tasa de morbimortalidad, debido a que varias estructuras vitales pueden resultar dañadas. En la actualidad existen varias corrientes de tratamiento, basadas en el manejo inicial por zonas, manejo inicial no basado en zonas y el manejo conservador de pacientes seleccionados. El objetivo de esta revisión sistemática es describir el tratamiento de las lesiones cervicales traumáticas.
Trauma injuries to the neck account for 5-10% of all trauma injuries and carry a high rate of morbidity and mortality, as several vital structures can be damaged. Currently, there are several treatment approaches based on initial management by zones, initial management not based on zones and conservative management of selected patients. The objective of this systematic review is to describe the management of neck trauma.
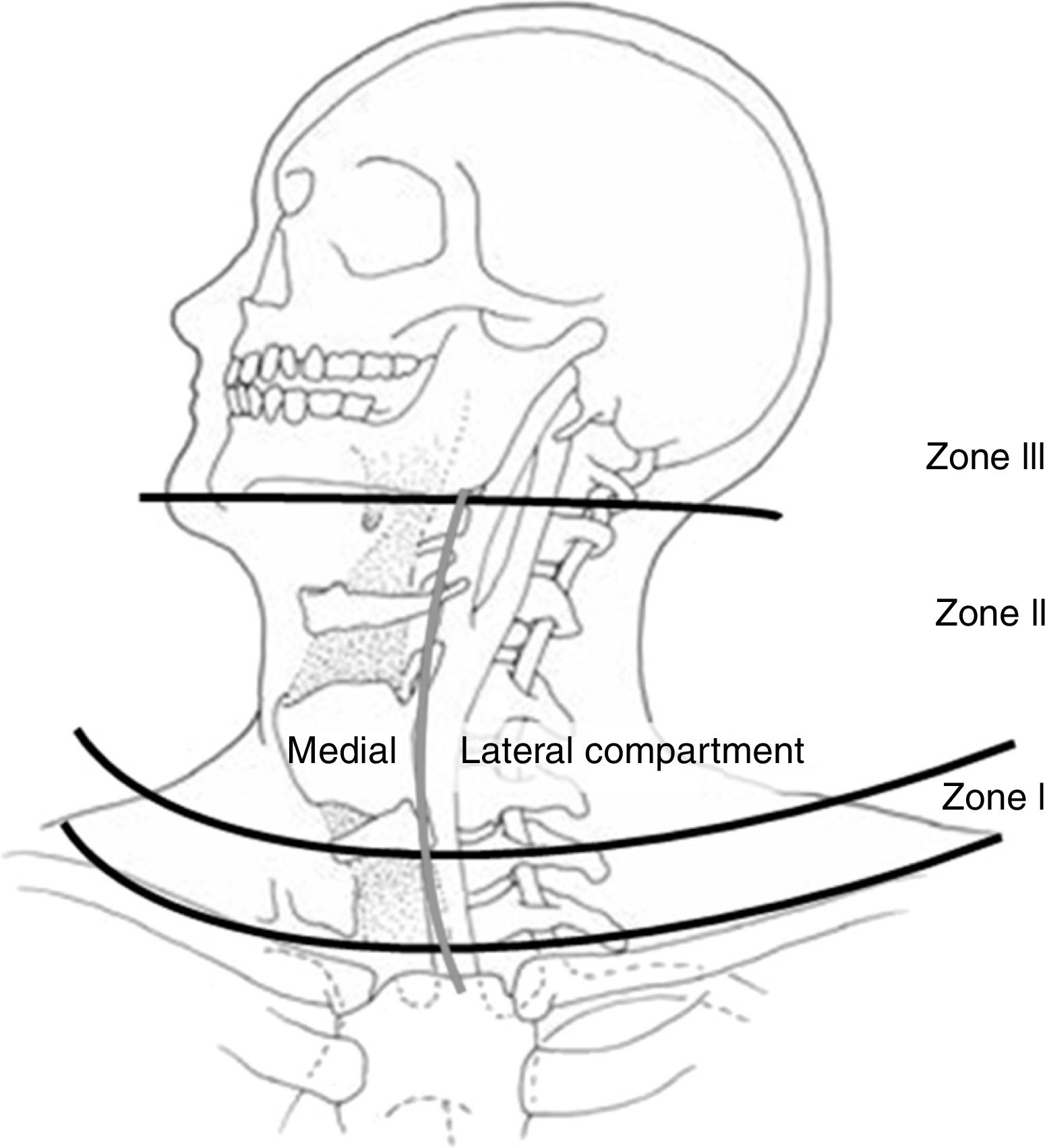
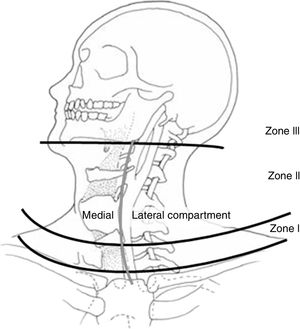
Las lesiones de cuello en pacientes que han sufrido un trauma tanto contuso como penetrante no son frecuentes, aunque su morbimortalidad es alta1,2. El manejo de estas lesiones ha evolucionado a lo largo de la historia, mejorando su supervivencia y su morbilidad. Desde que en 1522 Ambrose Paré describe la ligadura de arteria carótida como procedimiento quirúrgico para el control de una hemorragia cervical producida por la herida de una espada, a pesar de su alta morbimortalidad, esta técnica fue la de elección, incluso durante la I Guerra Mundial3,4. No fue hasta la II Guerra Mundial cuando se instauró la reparación de la arteria carótida como tratamiento5. Además, se comprobó cómo la actitud expectante había hecho que pasaran inadvertidas muchas lesiones vasculares y neurológicas, por lo que la exploración quirúrgica se convirtió en el tratamiento de elección hasta los años 90, donde empezaron a poner en entredicho este manejo ya que muchas exploraciones no evidenciaban lesiones6. También se instauró el manejo de las lesiones cervicales por zonas (fig. 1 y tabla 1)7,8, y actualmente está en discusión tanto el manejo conservador en pacientes seleccionados9, como el manejo «sin zonas»10,11. El objetivo de este trabajo fue realizar una revisión de la literatura sobre el manejo de las lesiones traumáticas de cuello, con excepción de las lesiones medulares y óseas.
Zonas anatómicas del cuello. Fuente: Monson et al.69.
Zonas del cuello
| Zona | Límites anatómicos | Estructuras |
|---|---|---|
| I | Clavículas y esternón --> Cartílago cricoides | Carótida proximal, arterias vertebrales y subclavia, venas, innominada y yugular, médula espinal, nervio laríngeo recurrente y X par creaneal, tráquea, esófago, y conducto torácico |
| II | Cartílago cricoides --> Ángulo de la mandíbula | Arterias carótidas y vertebrales, venas yugulares, médula espinal, nervio laríngeo recurrente y X par craneal, hipofaringe y esófago |
| III | Ángulo mandíbula --> Base del cráneo | Arterias carótidas y vertebrales, venas yugulares, médula espinal, IX-XII pares craneales y tronco simpático |
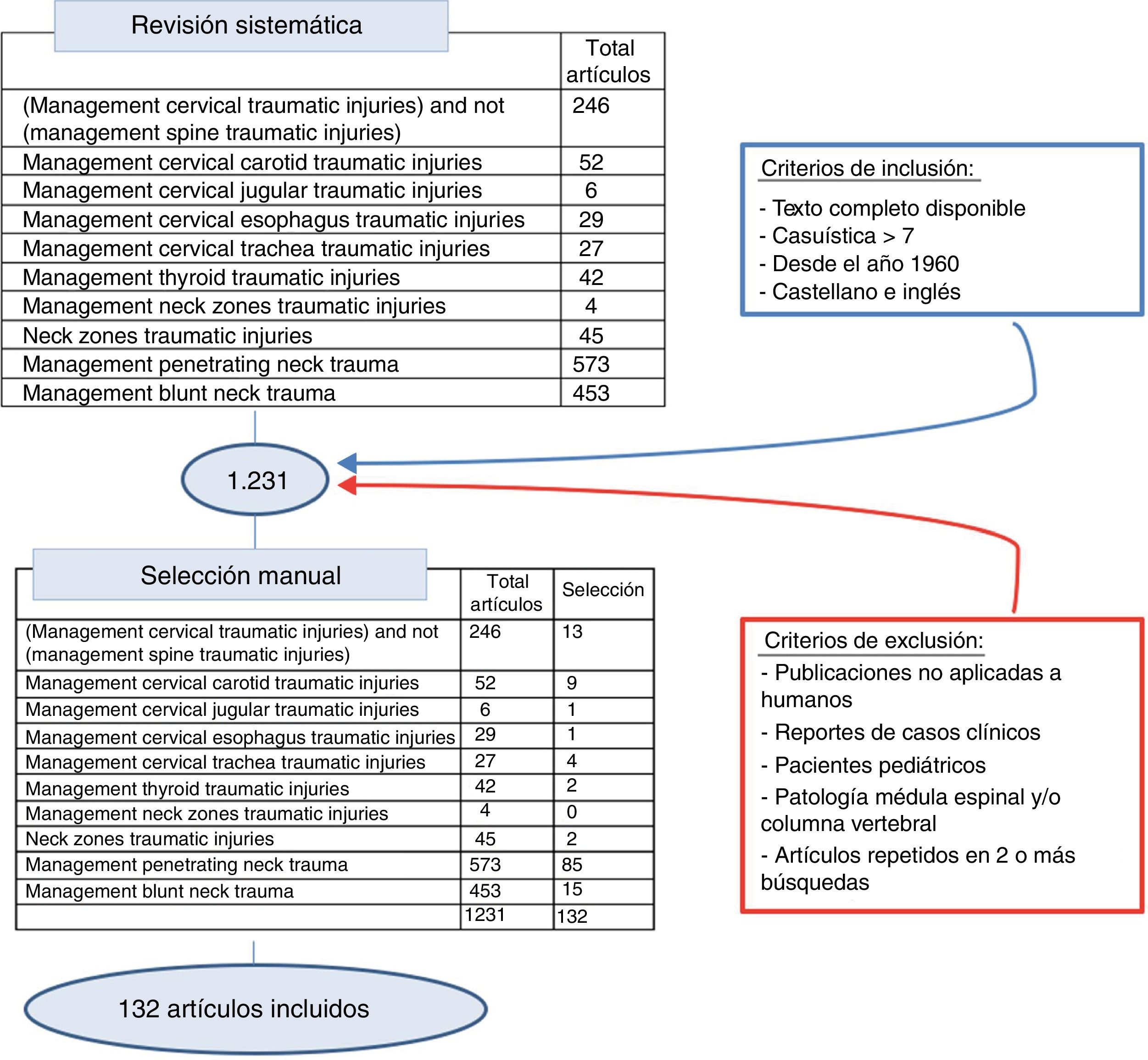
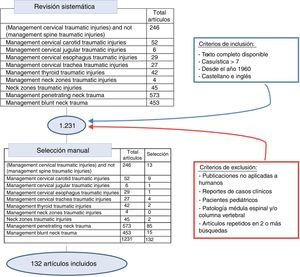
Se ha realizado una revisión sistemática de la literatura empleando la base de datos SCOPUS bajo los criterios que establecen sus revisores, realizando búsquedas tanto generalizadas como por órgano. Para ello se han utilizado las siguientes palabras clave: neck zones traumatic injuries, penetrating neck trauma, blunt neck trauma, thyroid, cervical trachea, cervical esophagus, cervical jugular, cervical carotid, combinado con management traumatic injuries. Posteriormente se realizó una revisión manual excluyendo las publicaciones no aplicadas a humanos, reportes de casos clínicos, revisiones de la literatura, pacientes en edad pediátrica, y aquellas publicaciones en idiomas diferentes al inglés y el español, realizando una revisión minuciosa desde 1960 hasta 2018 inclusive (fig. 2).
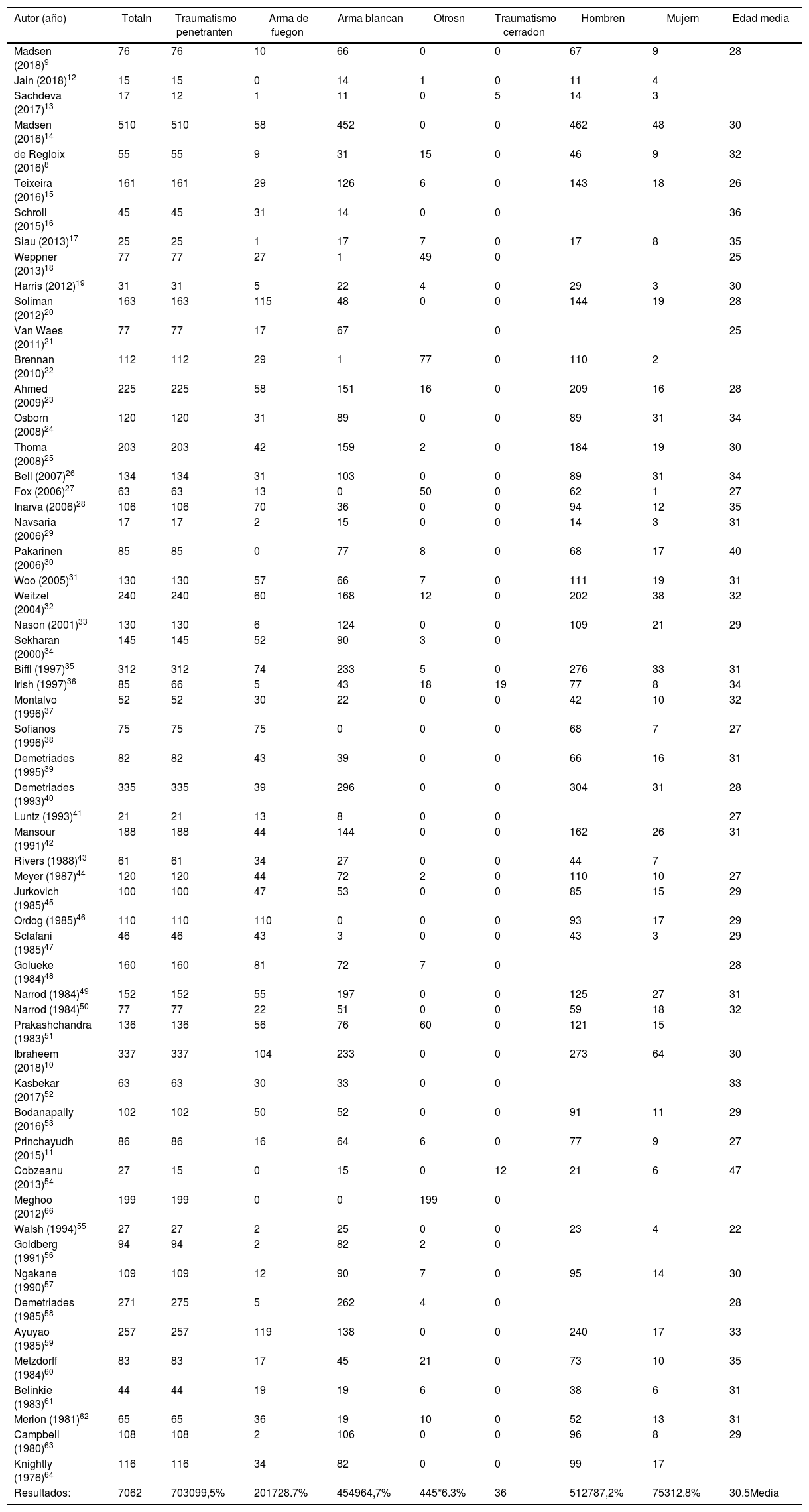
DemografíaLa incidencia de las lesiones traumáticas en el cuello varía según la población estudiada y según la región en la que se realice el estudio. En nuestra revisión la incidencia fue más elevada en los hombres con una media de 30,5 años de edad (tabla 2).
Demografía y mecanismo de acción
| Autor (año) | Totaln | Traumatismo penetranten | Arma de fuegon | Arma blancan | Otrosn | Traumatismo cerradon | Hombren | Mujern | Edad media |
|---|---|---|---|---|---|---|---|---|---|
| Madsen (2018)9 | 76 | 76 | 10 | 66 | 0 | 0 | 67 | 9 | 28 |
| Jain (2018)12 | 15 | 15 | 0 | 14 | 1 | 0 | 11 | 4 | |
| Sachdeva (2017)13 | 17 | 12 | 1 | 11 | 0 | 5 | 14 | 3 | |
| Madsen (2016)14 | 510 | 510 | 58 | 452 | 0 | 0 | 462 | 48 | 30 |
| de Regloix (2016)8 | 55 | 55 | 9 | 31 | 15 | 0 | 46 | 9 | 32 |
| Teixeira (2016)15 | 161 | 161 | 29 | 126 | 6 | 0 | 143 | 18 | 26 |
| Schroll (2015)16 | 45 | 45 | 31 | 14 | 0 | 0 | 36 | ||
| Siau (2013)17 | 25 | 25 | 1 | 17 | 7 | 0 | 17 | 8 | 35 |
| Weppner (2013)18 | 77 | 77 | 27 | 1 | 49 | 0 | 25 | ||
| Harris (2012)19 | 31 | 31 | 5 | 22 | 4 | 0 | 29 | 3 | 30 |
| Soliman (2012)20 | 163 | 163 | 115 | 48 | 0 | 0 | 144 | 19 | 28 |
| Van Waes (2011)21 | 77 | 77 | 17 | 67 | 0 | 25 | |||
| Brennan (2010)22 | 112 | 112 | 29 | 1 | 77 | 0 | 110 | 2 | |
| Ahmed (2009)23 | 225 | 225 | 58 | 151 | 16 | 0 | 209 | 16 | 28 |
| Osborn (2008)24 | 120 | 120 | 31 | 89 | 0 | 0 | 89 | 31 | 34 |
| Thoma (2008)25 | 203 | 203 | 42 | 159 | 2 | 0 | 184 | 19 | 30 |
| Bell (2007)26 | 134 | 134 | 31 | 103 | 0 | 0 | 89 | 31 | 34 |
| Fox (2006)27 | 63 | 63 | 13 | 0 | 50 | 0 | 62 | 1 | 27 |
| Inarva (2006)28 | 106 | 106 | 70 | 36 | 0 | 0 | 94 | 12 | 35 |
| Navsaria (2006)29 | 17 | 17 | 2 | 15 | 0 | 0 | 14 | 3 | 31 |
| Pakarinen (2006)30 | 85 | 85 | 0 | 77 | 8 | 0 | 68 | 17 | 40 |
| Woo (2005)31 | 130 | 130 | 57 | 66 | 7 | 0 | 111 | 19 | 31 |
| Weitzel (2004)32 | 240 | 240 | 60 | 168 | 12 | 0 | 202 | 38 | 32 |
| Nason (2001)33 | 130 | 130 | 6 | 124 | 0 | 0 | 109 | 21 | 29 |
| Sekharan (2000)34 | 145 | 145 | 52 | 90 | 3 | 0 | |||
| Biffl (1997)35 | 312 | 312 | 74 | 233 | 5 | 0 | 276 | 33 | 31 |
| Irish (1997)36 | 85 | 66 | 5 | 43 | 18 | 19 | 77 | 8 | 34 |
| Montalvo (1996)37 | 52 | 52 | 30 | 22 | 0 | 0 | 42 | 10 | 32 |
| Sofianos (1996)38 | 75 | 75 | 75 | 0 | 0 | 0 | 68 | 7 | 27 |
| Demetriades (1995)39 | 82 | 82 | 43 | 39 | 0 | 0 | 66 | 16 | 31 |
| Demetriades (1993)40 | 335 | 335 | 39 | 296 | 0 | 0 | 304 | 31 | 28 |
| Luntz (1993)41 | 21 | 21 | 13 | 8 | 0 | 0 | 27 | ||
| Mansour (1991)42 | 188 | 188 | 44 | 144 | 0 | 0 | 162 | 26 | 31 |
| Rivers (1988)43 | 61 | 61 | 34 | 27 | 0 | 0 | 44 | 7 | |
| Meyer (1987)44 | 120 | 120 | 44 | 72 | 2 | 0 | 110 | 10 | 27 |
| Jurkovich (1985)45 | 100 | 100 | 47 | 53 | 0 | 0 | 85 | 15 | 29 |
| Ordog (1985)46 | 110 | 110 | 110 | 0 | 0 | 0 | 93 | 17 | 29 |
| Sclafani (1985)47 | 46 | 46 | 43 | 3 | 0 | 0 | 43 | 3 | 29 |
| Golueke (1984)48 | 160 | 160 | 81 | 72 | 7 | 0 | 28 | ||
| Narrod (1984)49 | 152 | 152 | 55 | 197 | 0 | 0 | 125 | 27 | 31 |
| Narrod (1984)50 | 77 | 77 | 22 | 51 | 0 | 0 | 59 | 18 | 32 |
| Prakashchandra (1983)51 | 136 | 136 | 56 | 76 | 60 | 0 | 121 | 15 | |
| Ibraheem (2018)10 | 337 | 337 | 104 | 233 | 0 | 0 | 273 | 64 | 30 |
| Kasbekar (2017)52 | 63 | 63 | 30 | 33 | 0 | 0 | 33 | ||
| Bodanapally (2016)53 | 102 | 102 | 50 | 52 | 0 | 0 | 91 | 11 | 29 |
| Princhayudh (2015)11 | 86 | 86 | 16 | 64 | 6 | 0 | 77 | 9 | 27 |
| Cobzeanu (2013)54 | 27 | 15 | 0 | 15 | 0 | 12 | 21 | 6 | 47 |
| Meghoo (2012)66 | 199 | 199 | 0 | 0 | 199 | 0 | |||
| Walsh (1994)55 | 27 | 27 | 2 | 25 | 0 | 0 | 23 | 4 | 22 |
| Goldberg (1991)56 | 94 | 94 | 2 | 82 | 2 | 0 | |||
| Ngakane (1990)57 | 109 | 109 | 12 | 90 | 7 | 0 | 95 | 14 | 30 |
| Demetriades (1985)58 | 271 | 275 | 5 | 262 | 4 | 0 | 28 | ||
| Ayuyao (1985)59 | 257 | 257 | 119 | 138 | 0 | 0 | 240 | 17 | 33 |
| Metzdorff (1984)60 | 83 | 83 | 17 | 45 | 21 | 0 | 73 | 10 | 35 |
| Belinkie (1983)61 | 44 | 44 | 19 | 19 | 6 | 0 | 38 | 6 | 31 |
| Merion (1981)62 | 65 | 65 | 36 | 19 | 10 | 0 | 52 | 13 | 31 |
| Campbell (1980)63 | 108 | 108 | 2 | 106 | 0 | 0 | 96 | 8 | 29 |
| Knightly (1976)64 | 116 | 116 | 34 | 82 | 0 | 0 | 99 | 17 | |
| Resultados: | 7062 | 703099,5% | 201728.7% | 454964,7% | 445*6.3% | 36 | 512787,2% | 75312.8% | 30.5Media |
Por otro lado, la incidencia en la población militar durante un conflicto armado varía entre 5% y 30%, aunque esta cifra varía debido probablemente a la mejora de las protecciones del resto del cuerpo y al uso de nuevos explosivos8,65,66. La incidencia descrita en poblaciones civiles de Europa y Estados Unidos varía entre el 1% y el 10%1,20,32,52. En estudios realizados en el Sur de África, no se especifica el porcentaje de lesiones en el cuello respecto a otras zonas. Sin embargo, sus estudios cuentan con un número elevado de pacientes, por lo que probablemente su incidencia sea mayor14,67.
Mecanismo de lesiónLa mayoría de los artículos analizados hacen referencia al mecanismo penetrante, dividiendo este en heridas por arma de fuego y heridas por arma blanca. Las heridas por arma blanca son más frecuentes, y las heridas por arma de fuego tienden a ser más graves y a acompañarse de lesiones asociadas. Las explosiones son otro mecanismo de lesión penetrante descrito en estudios de poblaciones que se encuentran en conflictos armados.
Pocos estudios hacen referencia al traumatismo cerrado36, siendo el producido por estrangulamiento68 y por accidentes de tráfico36 los más frecuentes. Estos producen menos lesiones y tienen menos complicaciones que los traumatismos penetrantes36 (tabla 2).
ManejoLas zonas anatómicas del cuello para el manejo de las lesiones traumáticas fueron descritas por Monson en 196969 (fig. 1) y en la actualidad se continúan usando para clasificar las lesiones traumáticas de cuello8 (tabla 1).
Tras los resultados obtenidos en la II Guerra Mundial con la actitud expectante, algunos estudios abogaban por realizar exploración quirúrgica en todos aquellos pacientes que presentaran lesiones traumáticas cervicales51,55,64. Sin embargo el porcentaje de exploraciones negativas era elevado (40-89%)25,30,33,42,44,45,48,52,59–62, y posteriormente se ha demostrado que el manejo conservador en pacientes seleccionados no aumenta la morbimortalidad43,45,48,49.
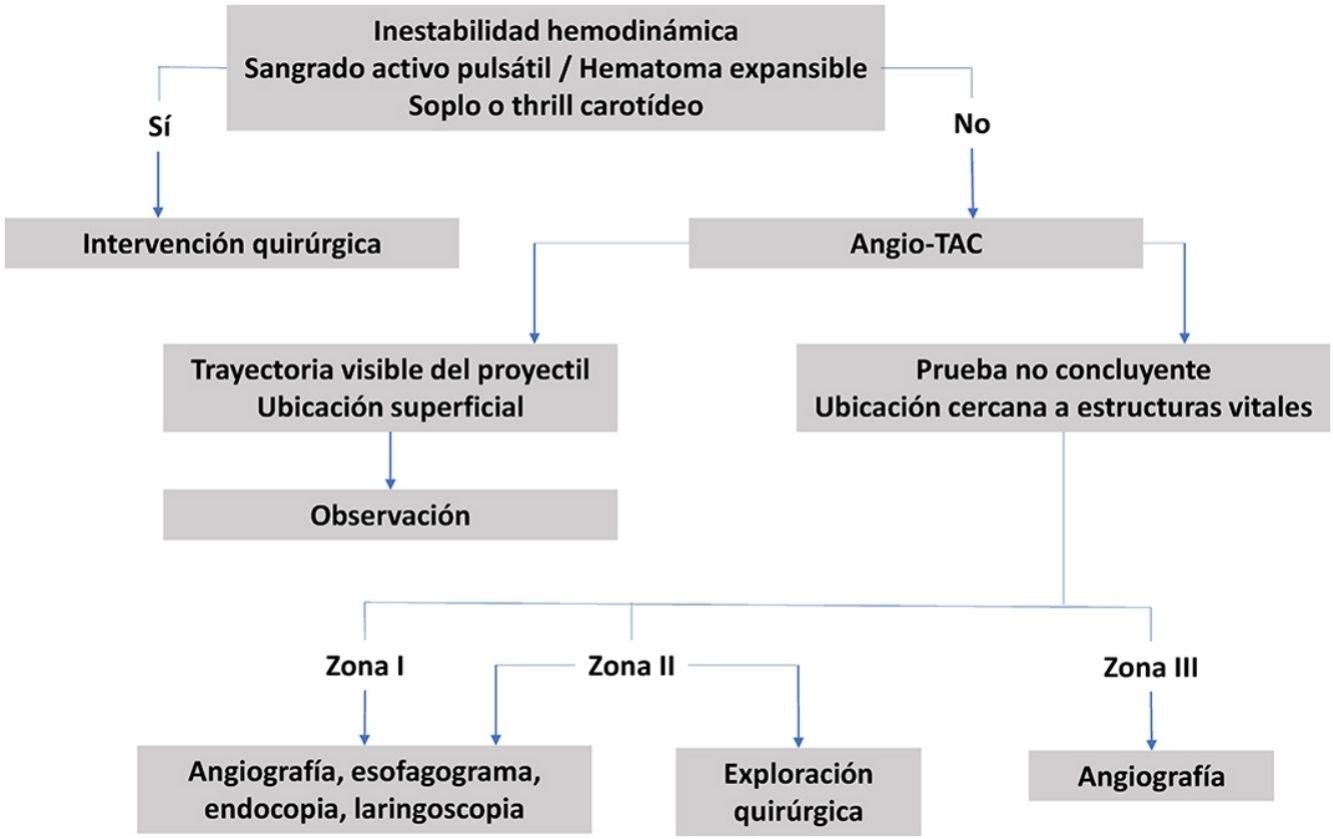
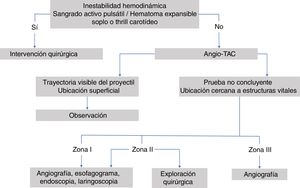
El manejo de las lesiones cervicales traumáticas es diferente dependiendo de la zona del cuello de que se trate, de la estabilidad hemodinámica del paciente y de los signos clínicos que presente, ya sea los denominados signos duros (sangrado activo pulsátil, hematoma expansible, ausencia de pulso carotídeo, soplo o thrill vascular, isquemia cerebral), o bien los signos blandos (historia de sangrado en la escena, trauma en territorio vascular, hematoma pequeño no pulsátil).
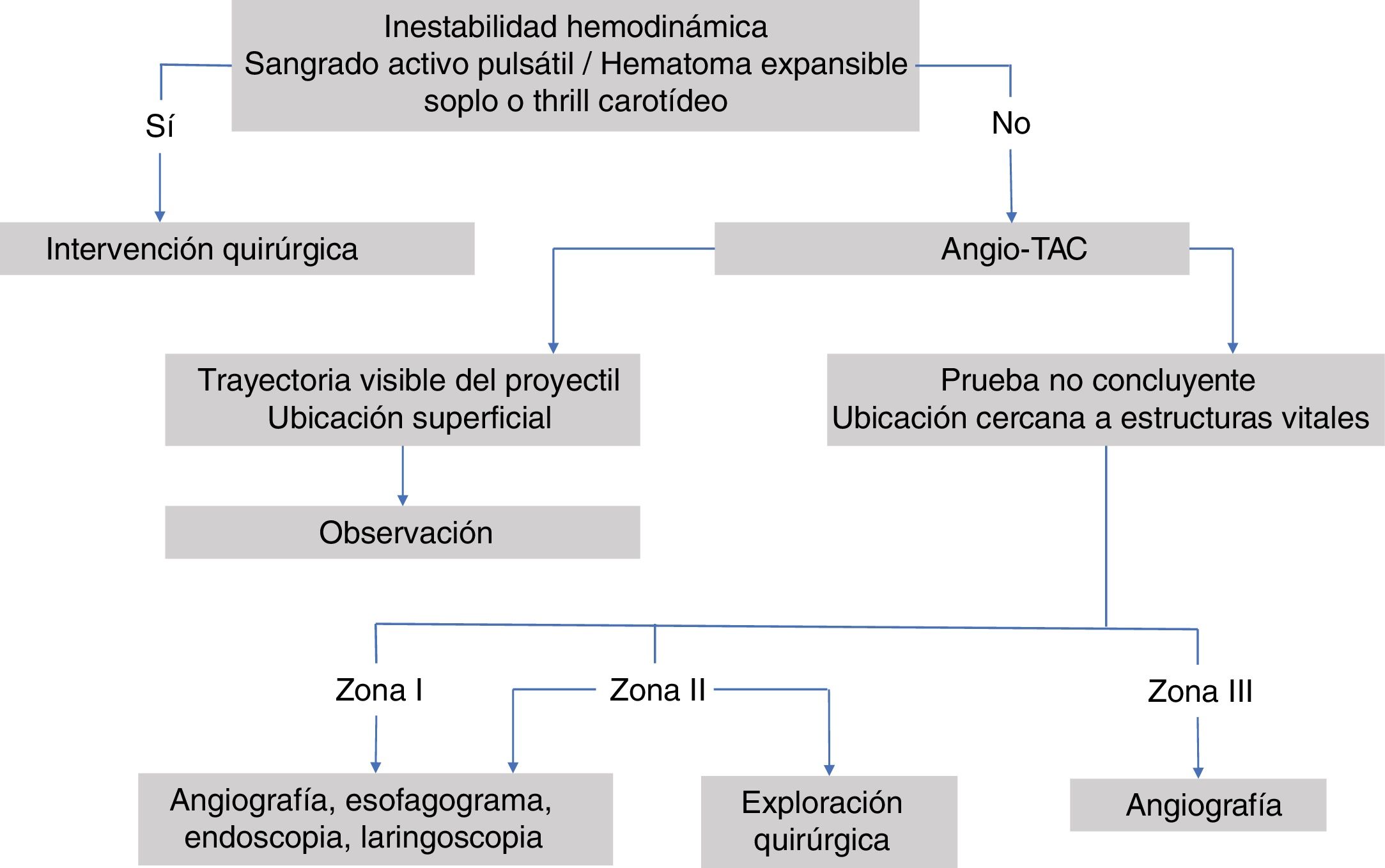
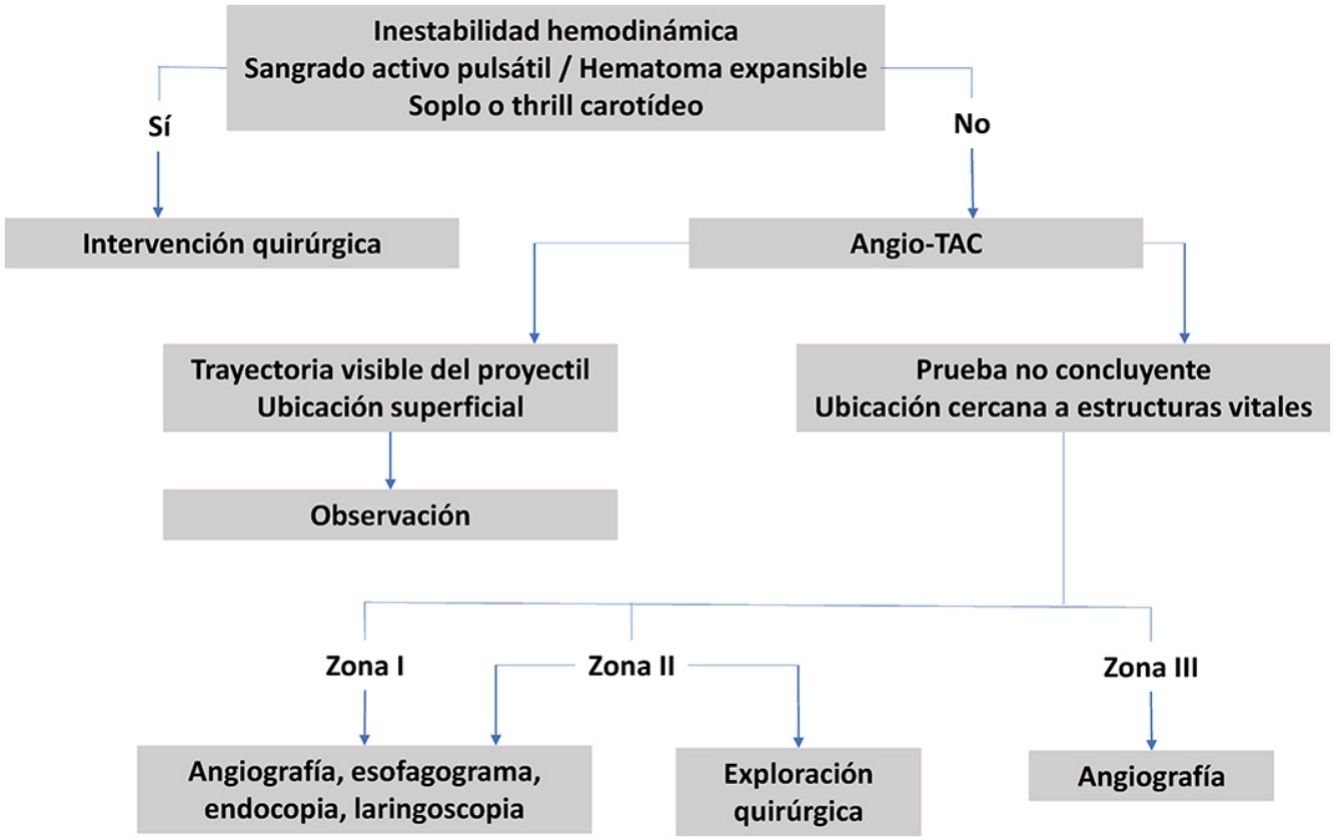
Su manejo inicial se realiza según el protocolo del Advanced Trauma Life Support (ATLS®) del American College of Surgeons14,19,25,26,54,55, asegurando la vía aérea y taponando las heridas con hemorragias activas12,23,35,41,42, así como también siguiendo el protocolo del Definitive Surgical Trauma Care (DSTC®), en cuyo Manual se establecen las pautas actuales de valoración y tratamiento de estos pacientes. Varios de los estudios revisados hacen referencia al manejo dependiendo de la zona anatómica en la que se encuentre la lesión. La figura 3 muestra un algoritmo de manejo para este tipo de lesiones.
Zona ILas lesiones en esta zona presentan una alta mortalidad (12%)36,51, ya que pueden afectar al mediastino, grandes vasos intratorácicos y el árbol traqueobronquial. Estas pueden pasar desapercibidas durante la exploración del paciente, por lo que es importante el uso de pruebas complementarias para su diagnóstico40,44,45, como la angiografía23,36,39,48–50 en caso de que el paciente esté hemodinámicamente estable. Ya que es una prueba complementaria invasiva, se propone el uso de la ecografía doppler (ED) para descartar lesiones vasculares, y realizar una angiografía solo en caso de hallazgos positivos en la ED37. Es una zona de difícil acceso quirúrgico, por lo que en caso de lesiones vasculares se aconseja el uso de Radiología Intervencionista cuando se encuentre disponible17,19,38. En caso de requerir tratamiento quirúrgico, suele combinarse el abordaje torácico y cervical26: esternotomía media, toracotomía anterior, resección clavicular o resección de la primera costilla35,42,44,46,51. Se recomienda la presencia de un cirujano cardiotorácico17.
En pacientes asintomáticos sin evidencia de lesión, está indicado el manejo conservador38 que consiste en observación durante 24-48h, sutura de heridas si fuera necesario, considerar cobertura antibiótica y vacuna antitetánica.
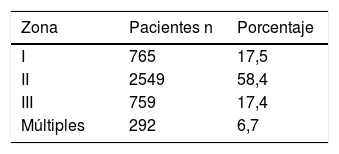
Zona IIEs la zona anatómica más frecuentemente afectada tanto en ámbitos civiles como en áreas de conflicto armado (tabla 3). Debido a que esta zona tiene fácil acceso, se recomienda su exploración quirúrgica en todos los pacientes sintomáticos, sin necesidad de realizar pruebas complementarias, excepto si se acompañan de lesiones en otras zonas o lesiones múltiples35,49. También se propone la ED como primera prueba diagnóstica en pacientes estables, previo al uso de la angiografía37.
Posteriormente, dado que esta zona está expuesta, se propone que en aquellos pacientes asintomáticos no es necesaria la realización de pruebas complementarias, ya que las lesiones ocultas en esta zona son infrecuentes (0,9%), indicando un manejo conservador selectivo34,35,38,45,49,50.
En pacientes inestables, o sintomáticos con exploración y/o pruebas diagnósticas positivas, está indicada la exploración quirúrgica abordando esta zona mediante cervicotomía paralela al borde anterior del músculo esternocleidomastoideo26,30,38,42,44,46,49.
Zona IIILa exposición quirúrgica de esta zona es complicada y puede conllevar lesiones iatrogénicas que pasen inadvertidas. Las lesiones en esta zona pueden causar secuelas neurológicas centrales como coma, hemiparesia, afasia y lesiones de los pares craneales47.
En pacientes estables se aconseja realizar una angiografía23,35,39,45,47–49 para determinar si hay una lesión vascular y en caso de confirmarse, identificar su localización y planificar la intervención quirúrgica36,47. En caso de que la angiografía sea negativa, se desaconseja realizar exploración quirúrgica47. Las lesiones diagnosticadas a veces no son abordables quirúrgicamente, pero son tratables mediante Radiología Intervencionista17,19,35,47,48.
Los pacientes inestables o sintomáticos con evidencia de lesiones que requieran tratamiento quirúrgico, a veces necesitan abordajes agresivos para una buena exposición: incisión horizontal para exponer la base del cráneo, resección mandibular, dislocación mandibular e incluso craneotomía26,44. En pacientes asintomáticos se aconseja observación durante 24-48h, sutura de heridas si es necesario y considerar cobertura antibiótica y vacuna antitetánica17.
Manejo conservadorConforme se va demostrando que el manejo conservador selectivo es seguro, aunque las lesiones cervicales continúan clasificándose por zonas, su manejo deja de serlo, pasándose a elaborar protocolos de actuación dependiendo de los criterios de gravedad de los signos y los hallazgos de las pruebas complementarias.
El manejo continúa siendo quirúrgico en aquellos pacientes inestables y en los que presentan signos graves como sangrado activo, hematoma pulsátil o en expansión, síntomas neurológicos, hematemesis, o fuga de aire a través de la herida, sin importar la zona afectada por la lesión5,9,11,19,20,23-26,28.
Se propone manejo conservador inicial en pacientes estables, que puede variar desde la mera observación hasta la necesidad de realizar pruebas complementarias invasivas como la endoscopia y la angiografía17,19,33,41,45,46.
En los pacientes asintomáticos se propone observación únicamente, ya que muy bajo porcentaje va a necesitar posteriormente una intervención quirúrgica (0-1%)19,21,23,35,40,42,44 y la mortalidad reportada es del 0-1,6%19,21,23,25,28,30,35,38,39,44,58. Los pacientes operados con exploraciones negativas, tienen una estancia postoperatoria significativamente más larga que aquellos que han sido observados19,30,35,39,87. Aun con el manejo conservador selectivo, un 19-38% de las exploraciones cervicales fueron negativas10,19,20,28.
Pruebas diagnósticasLa angiografía comenzó siendo el gold standard para el diagnóstico de las lesiones vasculares, manteniéndose hasta 200824. Sin embargo se desestimó como método de cribado ya que muchas suelen ser negativas, tienen un alto coste económico, y presenta complicaciones como hematomas, vasoespasmo, émbolos de placas de ateroma, trombosis y disección arterial26. Posteriormente se ha instaurado la angiotomografía axial computarizada (angio-TAC) como prueba diagnóstica inicial. Tiene la ventaja de estar disponible en la mayoría de los centros, se puede realizar en 2-3 minutos, y permite explorar tanto los vasos como los tejidos blandos y los huesos. Presenta una sensibilidad y especificidad para las lesiones vasculares del 90-100%21,22,24,26 y tiene una sensibilidad del 83-100% y una especificidad del 98,6-100% para determinar qué pacientes sintomáticos necesitan una exploración quirúrgica11,16. La angio-TAC ha sustituido a la angiografía como primera prueba diagnóstica en muchos centros11,15,16,18,19,21,22,24,26.
Con el uso creciente de la angio-TAC, la necesidad de realizar pruebas complementarias invasivas disminuye de forma significativa, así como el número de exploraciones cervicales, y de estas, el número de exploraciones cervicales negativas8,19,21,24–26,28,31.
Existen algunos estudios de pacientes a los que se les había realizado una angio-TAC previa decisión de realizar exploración quirúrgica. En este grupo ninguna exploración fue negativa. Sin embargo, en el grupo restante 36-40% de las exploraciones cervicales fueron negativas16,22.
Tratamiento quirúrgicoConforme van mejorando los protocolos de actuación para realizar un manejo conservador selectivo, el porcentaje de pacientes que no requieren exploración quirúrgica aumenta (74-78%)19,25.
La exploración física junto con la realización de pruebas complementarias parece suficiente para decidir si realizar intervención quirúrgica u observación23. Los síntomas clínicos graves como predictores de una lesión grave, tienen una sensibilidad del 96-97,2% y una especificidad del 87,4-97,2%22,23,66. Los síntomas graves junto con los hallazgos de las pruebas complementarias tienen una sensibilidad del 100%, y su ausencia tienen un valor predictivo negativo del 100%19. La angio-TAC tiene sensibilidad y especificidad para diagnosticar lesiones aereodigestivas del 76 y 97%, respectivamente53.
En aquellos pacientes que presentan sangrado activo, es útil el uso de un catéter Foley para la estabilización inicial del paciente, y así poder realizar pruebas complementarias y determinar si es necesario o no realizar una intervención quirúrgica urgente21,25,29. Aquellos pacientes en los que se controla el sangrado, y no se evidencia lesión arterial en la arteriografía, o angio-TAC, se da por supuesto que la lesión es venosa, evitándose una intervención quirúrgica urgente, y retirando el catéter a las 48-72h en quirófano9,21,25,29. Comparando los resultados del uso de catéter Foley con la presión externa junto con fármacos procoagulantes, no se encontraron diferencias estadísticamente significativas entre el número de hemorragias controladas inicialmente. Sin embargo, el porcentaje de resangrado es significativamente mayor en aquellos pacientes en los que se ejerció presión externa (7% Foley vs. 26% presión externa)18.
Tratamiento por órganosLesiones en vía aéreaPara asegurar la vía aérea, se aconseja intubación orotraqueal de ser necesario, y si no fuera posible, una cricotiroidotomía urgente25, siendo más segura la técnica quirúrgica que la percutánea70. La secuencia rápida de intubación orotraqueal es la más usada tanto en al ámbito prehospitalario (69-77%)24,26,71 como hospitalario (81%)72–74, siendo considerada como una técnica segura (88-100%)73–75. Sin embargo, no se han encontrado diferencias estadísticamente significativas entre las distintas técnicas para asegurar la vía aérea76. La intubación nasotraqueal a ciegas prehospitalaria también es una opción segura32.
Las lesiones laringotraqueales son infrecuentes y son causadas principalmente por traumatismos cerrados77–84. Las lesiones de la faringe y laringe suelen ser fácilmente diagnosticadas durante la exploración. La ausencia de signos clínicos (sangre en la boca, odinofagia, disfagia, herida transcervical), tiene un valor predictivo negativo del 91 al 95%25. Evolucionan satisfactoriamente con manejo conservador (sonda nasogástrica, nutrición enteral y antibioterapia)21,25,53,83,85–89.
La fractura del cartílago tiroides es una de las lesiones más frecuentes encontradas en las exploraciones quirúrgicas tras traumatismo cerrado90. Se aconseja tratamiento quirúrgico en aquellas que presentan desplazamiento77. La glándula tiroides se daña con frecuencia; sin embargo, su lesión no pone en riesgo la vida el paciente91,92.
La mayoría de las lesiones traqueales tienen indicación de manejo quirúrgico79,80,82,93–95. Solo en las lesiones iatrogénicas y en aquellas que cumplen criterios estrictos, se justifica el manejo conservador96,97.
Lesiones esofágicasLa ausencia de disfagia y saliva en la herida, junto con resultados negativos de las pruebas complementarias (esofagograma y endoscopia) tienen un valor predictivo de 98%25. La endoscopia flexible tiene una sensibilidad del 100% y una especificidad del 94% para el diagnóstico de lesiones esofágicas tras un traumatismo98 aunque no siempre se puede realizar en estos pacientes99. Respecto a la angio-TAC, se han reportado rangos muy amplios de sensibilidad para el diagnóstico de lesiones esofágicas cervicales (50-100%)28,53.
La mayoría de los autores abogan por el tratamiento quirúrgico de estas
lesiones22,25,99–104 en menos de 24h, ya que una mayor demora acarrea un aumento de la morbimortalidad de forma significativa105–108.
Lesiones vascularesLa mayoría de los pacientes que requieren una intervención quirúrgica se debe a afectación vascular20,22,24–26,58,61. Para descartar lesiones vasculares mayores, es suficiente la exploración física25,34,40.
Las lesiones penetrantes de la carótida interna se deben intentar reparar en los pacientes no comatosos, a menos que el paciente esté inestable109–111 ya que su ligadura produce déficits neurológicos y muerte111,112. Sin embargo, las lesiones de la carótida externa o sus ramas, se pueden tratar mediante ligadura26.
Las lesiones de arterias vertebrales requieren exploración quirúrgica en pacientes inestables. Estas arterias pueden ser bien visualizadas mediante angio-TAC113–115. En caso de evidenciarse una lesión, se aconseja realizar una angiografía ya que evita exploraciones quirúrgicas innecesarias y permiten el tratamiento endovascular (morbilidad 0,5%, mortalidad 0%)116.
Las lesiones venosas de grandes vasos aisladas (vena subclavia y yugular interna) pueden ser manejadas con observación en aquellos pacientes estables9,28,66, y con control del sangrado con catéter Foley en aquellos inestables, retirándolo a las 48-72 horas9. En caso de no lograr controlar el sangrado con Foley, o presentar lesiones arteriales o del tracto aerodigestivo acompañantes, requerirán una intervención quirúrgica urgente53. Aunque la ligadura de las venas inicialmente pueda producir edema, esta condición se resuelve a lo largo de los días110,117.
La trombosis arterial de los vasos cervicales tras un traumatismo cerrado es una entidad conocida aunque con baja incidencia (carótida 0,1-3%)115,118–121. La incidencia en arterias vertebrales es menor y es también menos frecuente que tengan repercusión clínica118,119,122. Se sospecha en aquellos pacientes lúcidos con hemiparesia, hemiplejia, síndrome de Horner, soplo carotídeo, con TAC cerebral normal que no explique sus déficits neurológicos, y la presencia de fracturas de cráneo y cara que afecten al territorio de la arteria carótida interna123. El dolor cervical no suele ser un síntoma relacionado con esta patología118–119. Tanto la angio-TAC como la ED pueden no mostrar alteraciones en las arterias dañadas durante las primeras 12 horas118,119,123. La resonancia magnética (RM) es capaz de diagnosticar estas lesiones de forma más precoz118. Sin embargo, la angiografía continúa siendo el gold standard118,119 debido a su sensibilidad121. La anticoagulación y/o antiagregación parece ser la terapia más beneficiosa119,120,124.
En 1999, Biffl125 propone la siguiente clasificación de lesiones vasculares tras traumatismo cerrado para su pronóstico y tratamiento:
- -
Grado I: 2/3 afectación íntima.
- -
Grado II: disección o hematoma con estenosis luminal.
- -
Grado III: pseudoaneurisma.
- -
Grado IV: oclusión completa.
- -
Grado V: sección.
En el caso de las lesiones carotídeas, se propone manejo conservador para aquellas de grado I y quirúrgico para las restantes. En las lesiones inaccesibles grados II, III y IV, se recomienda tratamiento con anticoagulación. En las lesiones grados II y III con reducción de la luz, el tratamiento endovascular mediante stents es seguro126,127. Las técnicas endovasculares pueden ser un recurso en caso de lesiones grado V115,125.
Las lesiones vertebrales grados I y II evolucionan satisfactoriamente sin tratamiento128. Mientras que en las lesiones de grados III y IV es necesario el tratamiento con antiagregantes y/o anticoagulantes ya que presentan una mayor tasa de accidentes cerebrovasculares (ACV)129.
Tras un traumatismo cerrado en el que sospechamos que la aorta torácica pueda estar afectada, es importante extender el estudio de angiografía a las carótidas, ya que su lesión se asocia con frecuencia y puede pasar inadvertida130.
MorbimortalidadLa mortalidad global descrita en estos pacientes se ubica entre 3-13%8,9,20,22,32,35,131. Las lesiones laringotraqueales pueden llevar a la muerte de los pacientes y a complicaciones graves como fístulas traqueoesofágicas con aspiración84,93, inmovilización de las cuerdas vocales, estenosis traqueales, disfonía y disfagia prolongada78,79,83,93,131–134.
El diagnóstico tardío de las lesiones esofágicas aumenta la morbimortalidad, provocando complicaciones infecciosas como mediastinitis, abscesos faringoesofágicos, empiemas, fístulas y sepsis73,99,102,105,135.
Aquellos pacientes con lesiones vasculares, pueden morir por exanguinación117. Si una lesión venosa requiere ligadura, pueden desarrollarse edemas en las extremidades superiores siendo más evidente al ligar la vena subclavia117. Si la lesión está en la vena cava superior, se describen edemas en brazos, cuello y cabeza, a pesar de su reparación117. El daño de la arteria carótida interna, puede llevar a lesiones neurológicas permanentes112 ya que producen accidentes cerebrovasculares (embólicos, isquémicos y hemorrágicos)136, siendo más alta la morbimortalidad en aquellos traumatismos penetrantes que en los cerrados112. Las lesiones distales de carótida interna tienen más morbimortalidad que aquellas lesiones de la carótida común112. La oclusión completa de las 2 arterias vertebrales resulta en infarto cerebeloso aunque si una arteria vertebral mantiene su flujo, es raro que esto suceda115,116.
Consideraciones especialesAunque la mayoría de los autores abogan por realizar exploración quirúrgica urgente tanto en pacientes inestables como en aquellos con signos graves, Madsen9 y Schroll16 dan un paso más, demostrando que realizar una angio-TAC en aquellos pacientes con signos graves, también disminuye la necesidad de exploraciones quirúrgicas, y en caso de requerirla, facilita su planificación.
Dicho esto, es importante tener en cuenta tanto los recursos del centro donde se atiendan estos pacientes, como su volumen y experiencia. En aquellos centros con bajo volumen, se justifica que el porcentaje de exploraciones cervicales sea más elevado (60%), así como también el de exploraciones negativas (65%). Sería deseable que cada hospital dependiendo de sus recursos y su incidencia, tuviera un protocolo de actuación para este tipo de lesiones y así minimizar las intervenciones quirúrgicas innecesarias30.
Otro escenario diferente para tener en cuenta son las áreas de conflicto armado, con sus peculiaridades, como el tiempo de evacuación de los pacientes a un hospital terciario28. Abogan por el manejo selectivo conservador de estos pacientes, presentando un porcentaje de exploraciones cervicales en torno al 30%, pero hay que tener en cuenta que muchos de estos pacientes requieren intervención quirúrgica urgente por inestabilidad por otras lesiones, y no se les puede realizar angio-TAC previamente22. Proponen el mismo uso de la angio-TAC que en los hospitales civiles28; sin embargo, hay que tener en cuenta que pueden presentar artefactos por fragmentos metálicos22,27. En este caso se propone el uso de ED en zona II y angiografía en pacientes con afectación de la zona I y III, o ED anormal27.
Un comentario especial merecen las lesiones por asta de toro y demás animales astados. Existen diferentes clasificaciones de estas lesiones, dependiendo del mecanismo lesional o de la gravedad de las mismas137. La región cervicofacial es una de las menos afectadas por este mecanismo. Chambres et al.138 lo ubicaron en la tercera localización (16% frente al 64% del miembro inferior). Las heridas son incisivas y contusas, por lo que tienen características especiales tales como: la apertura de entrada suele ser pequeña y rodeada por una zona de erosión; uno o más tractos profundos pueden estar presentes, usualmente con importante destrucción muscular; estas heridas están contaminadas, y múltiples cuerpos extraños pueden ser encontrados en la parte inferior de la trayectoria de la herida, incluyendo fragmentos de tela, suciedad y astas de cuerno. La profundidad dependerá de la fuerza de penetración del asta en el cuerpo como resultado del peso y la velocidad del animal. Existe una fuerza adicional debido al efecto de los fuertes músculos del cuello del animal cuando al levantar sus cuernos causa desgarros de arterias, venas y nervios en ángulo recto con relación al suelo139. Las lesiones por asta de toro son una entidad propia sin equivalente a otras etiologías traumáticas, por lo que en todos los casos deben ser considerados como pacientes politraumatizados.
Conclusiones- -
El manejo inicial de estos pacientes se establece según criterios de ATLS.
- -
La exploración quirúrgica urgente está indicada en pacientes inestables y pacientes que presenten signos graves, teniendo en cuenta que estos últimos pueden beneficiarse de realizar una angio-TAC previamente.
- -
Si la inestabilidad hemodinámica es causada por una hemorragia, el taponamiento mediante sonda Foley puede ayudar a la estabilización inicial del paciente, otorgando el tiempo necesario para realizar una angio-TAC y diagnosticar el tipo de lesión a la que nos enfrentamos.
- -
Se aconseja realizar angio-TAC a todos los pacientes sintomáticos, ya que disminuye la necesidad de exploraciones quirúrgicas, así como sus complicaciones, y también en aquellos pacientes asintomáticos con mecanismo de lesión de alta velocidad.
- -
La observación es segura en el resto de los pacientes asintomáticos, y en aquellos en que la angio-TAC es negativa, no requieren tratamiento.
- -
La angiografía y la Radiología Intervencionista puede ser una herramienta tanto diagnóstica como terapéutica en pacientes con lesiones vasculares, evitando intervenciones quirúrgicas innecesarias.
Los autores declaran no tener ningún conflicto de intereses.