Las verrugas vulgares son las lesiones epiteliales más comunes causadas por papilomavirus (HPV). En los pacientes inmunodeprimidos, la eficacia de los tratamientos convencionales es escasa, y se observa en ellos una diseminación extensa de las verrugas relacionada con el descenso de la inmunidad celular. A continuación, describimos el caso de una paciente inmunodeprimida con verrugas vulgares, tratada con gel de cidofovir al 1% tras fracasar los tratamientos convencionales disponibles.
Descripción del caso: mujer de 20 años en tratamiento inmunosupresor desde la infancia por una anemia hemolítica congénita. Presenta lesiones verrugosas por HPV en las falanges distales de ambas manos, de 10 años de evolución y refractarias a tratamiento convencional y a la utilización de otras alternativas, como imiquimod, cimetidina, crioterapia, interferón gamma y tratamiento fotodinámico. Por esto, se decidió iniciar tratamiento con cidofovir gel al 1% bajo la indicación de uso compasivo. La elaboración del gel se realizó siguiendo una formulación bien referenciada1.
El tratamiento se programó basándose en la bibliografía disponible2, en ciclos de 2 semanas, con aplicación nocturna del gel sobre las verrugas durante los 5 primeros días de cada ciclo y con descanso los 9 posteriores. La paciente recibió 24 ciclos de tratamiento con buena tolerancia, a excepción de la aparición de dolor durante el primer ciclo que se trató con paracetamol.
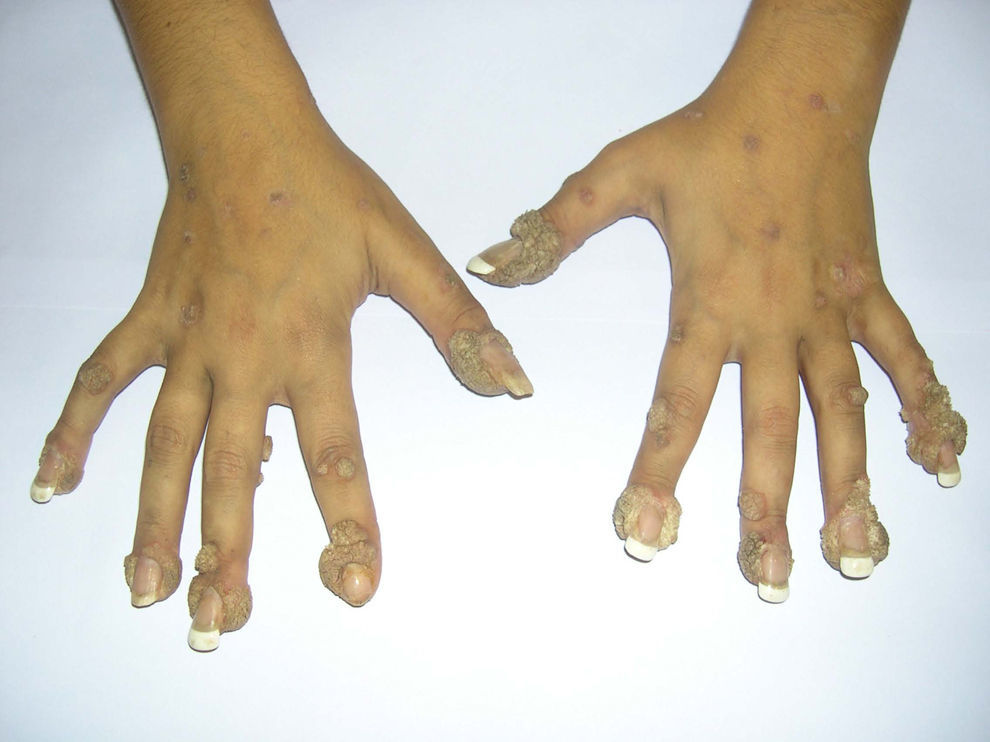
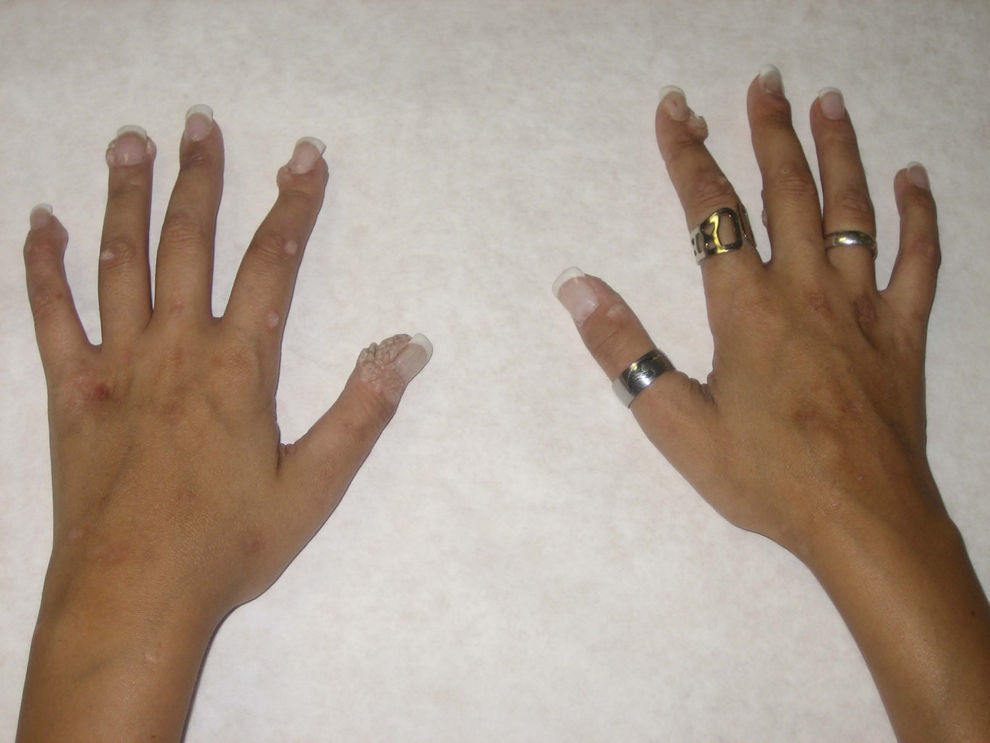
Para la evaluación de la eficacia del tratamiento se midió el área relativa de las lesiones. Al inicio, la paciente presentaba afectado un 8,5% del área de ambas manos (fig. 1). Tras 12 ciclos de tratamiento, las lesiones se redujeron a un 4,7% en la mano izquierda y a un 1,6% en la mano derecha. A los 24 ciclos, las lesiones ocupaban un 3,3 y un 1,5%, respectivamente (fig. 2). A los 2 meses del fin del tratamiento, las lesiones ocupaban aproximadamente la misma área relativa que en la última revisión (el 3,4 y el 1,7%).
DiscusiónLa mayor parte de la evidencia publicada sobre el tratamiento tópico con cidofovir se limita a una serie de casos o de casos aislados3–7, a excepción de un estudio en fase II doble ciego controlado por placebo en pacientes diagnosticados de condilomas acuminados, publicado por Snoeck et al, donde se demostró la eficacia del cidofovir en lesiones producidas por HPV2. El problema de este estudio es que uno de los criterios de exclusión era la existencia de algún tipo de inmunosupresión. Nektarios et al describieron en 2008 un caso parecido al nuestro de una paciente inmunodeprimida por fármacos tras un trasplante renal, en la que la localización, el aspecto, la extensión y la evolución de las lesiones, a pesar de los tratamientos convencionales, fue similar8. Sin embargo, el uso de cidofovir tópico en verrugas vulgares de esta localización no se había reportado antes. A diferencia de lo publicado, en nuestro caso, aunque la respuesta fue buena, la remisión de las lesiones no llegó a ser completa, lo que podría atribuirse a una peor penetración del gel debido a la idiosincrasia de la epidermis palmar y a la hiperqueratosis asociada a las verrugas. A este respecto, sería interesante estudiar cómo podrían repercutir los promotores de la penetración dermatológica, como el uso de queratolíticos o una formulación del principio activo en microesferas en la respuesta; actualmente existen casos publicados con buenos resultados al respecto9,10. A pesar de que es improbable que la mejoría clínica en un caso tan refractario pueda deberse a un efecto placebo, los resultados obtenidos habrían tenido mayor repercusión si se hubiera tratado sólo una mano con cidofovir al 1% y se hubiera comparado con los resultados obtenidos con placebo en la otra mano. A pesar de que durante el tratamiento no se comunicaron reacciones adversas graves, no se conoce la toxicidad del preparado a largo plazo, pero a la vista de los resultados obtenidos y encontrados en la bibliografía, el uso de cidofovir tópico parece constituir una alternativa terapéutica eficaz para la erradicación de lesiones por HPV en pacientes inmunodeprimidos refractarios a otros tratamientos, con un perfil de toxicidad aceptable.