Las infecciones relacionadas con la asistencia sanitaria son una causa importante de mortalidad y morbilidad entre los pacientes. Una de las más frecuentes es la infección de localización quirúrgica (ILQ). Los objetivos del estudio eran conocer las tasas de ILQ y valorar la aplicación de los protocolos de preparación prequirúrgica y profilaxis antibiótica preoperatoria establecidos en 14 hospitales públicos de la Comunidad de Madrid.
Material y métodosEstudio prospectivo observacional multicéntrico que incluye a todos los pacientes intervenidos quirúrgicamente en los servicios sometidos a vigilancia e ingresados durante más de 48h, entre el 1 de enero y el 31 de diciembre de 2009. Fueron vigilados desde el ingreso hasta el alta.
ResultadosLa ILQ fue la infección nosocomial más frecuente (superficial=1,7%, profunda=2%; órgano-espacio=1,7%). Se muestran las tasas de ILQ por procedimiento quirúrgico e índice de riesgo National Nosocomial Infection Surveillance System, así como otros indicadores de calidad, como estancia hospitalaria, profilaxis antibiótica, mortalidad, reingresos por infección o complicación y tasa de reintervenciones quirúrgicas.
DiscusiónLos resultados obtenidos en este estudio multicéntrico no sólo pueden servir como referencia a otros hospitales públicos, sino que también son comparables con otros sistemas de vigilancia internacionales. La vigilancia y el control de las infecciones asociadas a la asistencia sanitaria deben ser un aspecto clave en los programas de calidad asistencial y seguridad del paciente.
Health care-associated infections (HAIs) occur frequently in hospitals and have severe consequences, with surgical site infection (SSI) being one of the most commonly reported. The aim of this study was to determine SSI rates and to asses the application of presurgical preparation and antimicrobial prophylaxis protocols in 14 public hospitals of the region of Madrid.
Material and methodsMulti-centre prospective surveillance study. All patients who underwent a surgical procedure from January 1 2009, to December 31, 2009 with a hospital stay of more than 48hours, were monitored from the time of surgery until hospital discharge.
ResultsSSI was the most frequent HAI (superficial incisional SSI=1.7%; deep incisional SSI=2%; organ-space SSI=1.7%). SSI rates are provided by operative procedure and NNIS risk index category. Further quality indicators reported are surgical complications, length of stay, antimicrobial prophylaxis, mortality, readmission due to infection or other complications and revision surgery.
ConclusionsThe results obtained in this multicentre study can be used as a reference for other public hospitals, and allow comparisons with other international surveillance systems. Surveillance and control of HAIs must be a key aspect in patient safety and quality healthcare programs.
Las infecciones relacionadas con la asistencia sanitaria son una causa importante de mortalidad y morbilidad entre los pacientes. Entre ellas, una de las más frecuentes es la infección de localización quirúrgica (ILQ). Los pacientes que desarrollan una ILQ tienen un 60% más de probabilidad de ingresar en una unidad de cuidados intensivos, 5 veces más de reingresar en el hospital y el doble de posibilidades de fallecer que los pacientes sin ILQ1. Además, el desarrollo de una ILQ prolonga la hospitalización, eleva de forma considerable los gastos sanitarios, y supone un gran coste emocional para el paciente y su familia1-3. Se considera que en muchos hospitales podrían prevenirse un tercio o más de las infecciones4. Muchas de las actividades de prevención no son costosas y, generalmente, son menos costosas de lo que supone el cuidado de un paciente con infección5. Una de las medidas de probada efectividad es la vigilancia prospectiva y continuada de la infección hospitalaria6-9. El primer sistema de vigilancia de la infección hospitalaria, el National Nosocomial Infection Surveillance System (NNIS), se estableció en EE. UU. en los años setenta10. En los últimos años, se han desarrollado múltiples estrategias de vigilancia y control de la infección hospitalaria en distintos países, demostrándose que no sólo son eficaces en la reducción de las infecciones sino que son coste-efectivas11-15. En España se puso en marcha en 1997 el programa de vigilancia continuada de la infección hospitalaria VICONOS, que posteriormente cambió su nombre por el de INCLIMECC (Indicadores de mejora Continua de la Calidad)16,17.
Este artículo describe los datos obtenidos en un estudio de vigilancia de la infección hospitalaria, centrado en la ILQ, que se llevó a cabo en 14 hospitales públicos de la Comunidad de Madrid, entre el 1 de enero y el 31 de diciembre del año 2009. Los objetivos del estudio fueron los siguientes:
- –
Conocer las tasas de ILQ en los servicios y procedimientos sometidos a vigilancia.
- –
Valorar la correcta aplicación de la preparación prequirúrgica de los pacientes sometidos a intervención quirúrgica en los servicios sometidos a vigilancia.
- –
Valorar la correcta aplicación de los protocolos de profilaxis antibiótica preoperatorio establecidos en los hospitales y servicios sometidos a vigilancia.
Se realizó un estudio prospectivo observacional que incluyó a todos los pacientes intervenidos quirúrgicamente en los servicios sometidos a vigilancia que permanecieron ingresados ≥ 48h del 1 de enero al 31 de diciembre de 2009 en los hospitales participantes. Fueron vigilados desde el ingreso hasta el alta hospitalaria. La vigilancia de los posibles reingresos por infección se mantuvo hasta el 31 de enero del 2010. En el estudio tomaron parte 14 de los 27 hospitales públicos de agudos de la Comunidad de Madrid, que aglutinan un total de 6.806 camas, más del 50% de las ofertadas en toda la región.
La recogida de datos fue llevada a cabo por personal de enfermería perteneciente a los servicios de medicina preventiva, con formación específica para ello, supervisada y validada por los médicos especialistas en medicina preventiva. Las fuentes de información fueron las historias clínicas, notas de enfermería, registros clínicos, técnicas de diagnóstico y resultados microbiológicos, así como el contacto directo con el equipo médico y asistencial de las áreas vigiladas. Se vigilaron las intervenciones de apendicectomía, cirugía de mama, cirugía cardíaca (prótesis valvulares), cesárea, colecistectomía, herniorrafia, cirugía gástrica, cirugía de colon, cirugía de recto, reducción de fracturas abiertas, prótesis de cadera, prótesis de rodilla y prostatectomía.
Para la recogida de datos se utilizó un formato prediseñado por el programa de vigilancia INCLIMECC, que incluye variables demográficas, factores de riesgo intrínsecos y extrínsecos, intervenciones quirúrgicas según la Clasificación Internacional de Enfermedades 9.ª Revisión Modificación Clínica (CIE-9-MC), riesgo ASA, si la cirugía es urgente o programada, si es o no laparoscópica, profilaxis antibiótica, grado de contaminación de la cirugía, preparación prequirúrgica, e infecciones diagnosticadas16,17.
Se considera reingreso por reintervención/complicación a cualquier nuevo ingreso hospitalario de un paciente intervenido quirúrgicamente durante el periodo de estudio, debido a una complicación relacionada con la primera cirugía. Igualmente, se considera reintervención a cualquier nueva intervención quirúrgica relacionada con la patología que requirió la primera cirugía.
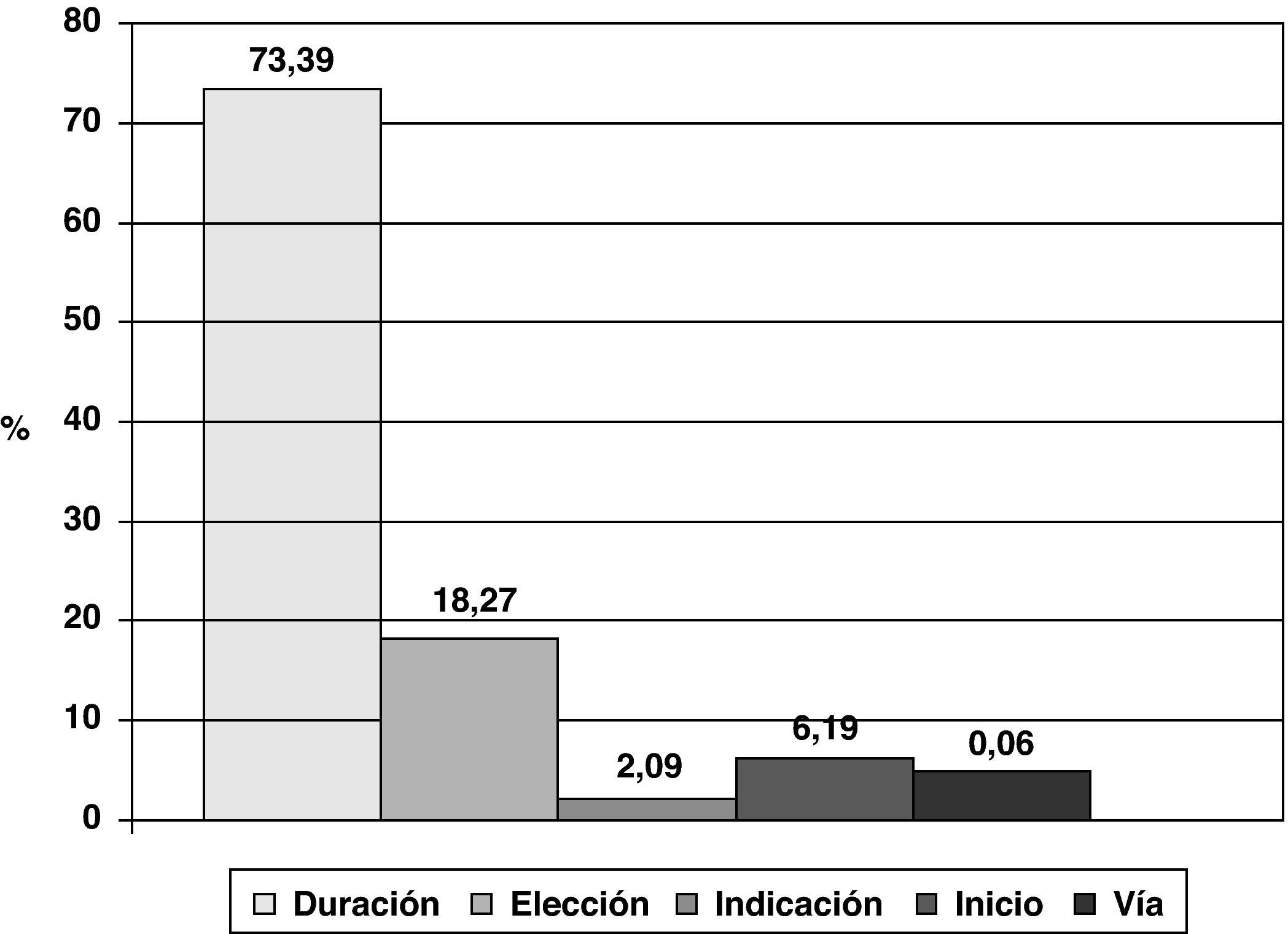
La profilaxis antibiótica prequirúrgica se clasifica como adecuada o inadecuada según la política de antimicrobianos de los centros, establecida por las comisiones de infección hospitalaria y antimicrobianos. Puede ser inadecuada por elección (cuando el antimicrobiano utilizado no es el recomendado en las guías del centro), por inicio (cuando se administra más de 60min antes de la cirugía, o después de la misma), por duración (cuando se prolonga más de 24h después de la cirugía) o por vía de administración.
La preparación prequirúrgica se calificaba como correcta si cumplía todos los pasos del protocolo vigente en cada hospital, incorrecta si no se había cumplido en su totalidad (p. ej., no lavado con jabón antiséptico, no enjuague con antiséptico, rasurado de la piel con cuchilla, etc.), si no se había cumplido ningún paso se clasificaba como «no preparado», y si no aparecía ningún dato en la historia clínica ni el parte quirúrgico se recogía como «no consta».
Los criterios de definición de ILQ y la estratificación por índices de riesgo son los establecidos por el Centers for Disease Control and Prevention (CDC) y el NNIS18,19. Las intervenciones se agruparon para el análisis según los procedimientos establecidos por el National Healthcare Safety Network (NHSN)20.
Para los cálculos de estancias y variables demográficas se utilizó el programa SPSS 15.0. Se calcularon tasas de incidencia de infección, tasas crudas, específicas por procedimiento quirúrgico, y tasas ajustadas por índice de riesgo NNIS19.
ResultadosLas características de los 14 hospitales que participaron en el estudio se muestran en la tabla 1. Todos ellos son hospitales públicos de agudos de la Comunidad de Madrid.
Se estudió a 15.368 pacientes; el 55,7% fueron mujeres y el 44,3% varones, siendo la edad media de 61 años±20 (mediana 65 años).
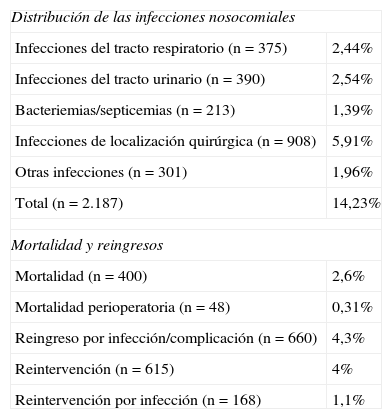
De todos los pacientes estudiados, el 2,6% falleció durante el ingreso y la mortalidad perioperatoria fue del 0,31%. Durante el periodo de estudio, hubo un 4,3% de reingresos debidos a complicaciones y/o infecciones y un 4% de los pacientes fueron reintervenidos, siendo la causa de la segunda intervención una ILQ en el 28% de los casos (tabla 2).
Distribución de las infecciones nosocomiales, mortalidad y reingresos.
| Distribución de las infecciones nosocomiales | |
| Infecciones del tracto respiratorio (n=375) | 2,44% |
| Infecciones del tracto urinario (n=390) | 2,54% |
| Bacteriemias/septicemias (n=213) | 1,39% |
| Infecciones de localización quirúrgica (n=908) | 5,91% |
| Otras infecciones (n=301) | 1,96% |
| Total (n=2.187) | 14,23% |
| Mortalidad y reingresos | |
| Mortalidad (n=400) | 2,6% |
| Mortalidad perioperatoria (n=48) | 0,31% |
| Reingreso por infección/complicación (n=660) | 4,3% |
| Reintervención (n=615) | 4% |
| Reintervención por infección (n=168) | 1,1% |
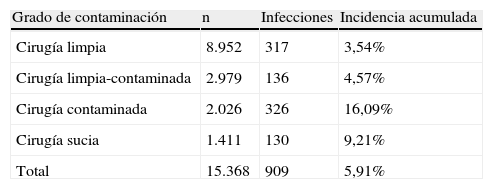
Las incidencias de las distintas localizaciones de infección nosocomial se muestran en la tabla 2. La ILQ fue la localización más frecuente de las infecciones nosocomiales (5,91%). Su incidencia según la profundidad de la infección ha sido la siguiente: 1,7% infecciones superficiales, 2% infecciones profundas y 1,7% infecciones de órgano o espacio. Las tasas de ILQ según el grado de contaminación de la cirugía se muestran en la tabla 3.
Tasa de infección de herida quirúrgica según grado de contaminación de la cirugía.
| Grado de contaminación | n | Infecciones | Incidencia acumulada |
| Cirugía limpia | 8.952 | 317 | 3,54% |
| Cirugía limpia-contaminada | 2.979 | 136 | 4,57% |
| Cirugía contaminada | 2.026 | 326 | 16,09% |
| Cirugía sucia | 1.411 | 130 | 9,21% |
| Total | 15.368 | 909 | 5,91% |
La estancia media hospitalaria fue de 14 días, con una diferencia de 26 días entre los que desarrollaron una infección quirúrgica y los que no (p<0,001) (tabla 4).
Estancias medias.
| Estancia media sin infección de herida quirúrgica=13±14 días |
| Estancia media con infección de herida quirúrgica=41±39 días |
| Estancia media con infección superficial de herida quirúrgica=31±22 días |
| Estancia media con infección profunda de herida quirúrgica=36±29 días |
| Estancia media con infección quirúrgica de órgano/espacio=52±43 días |
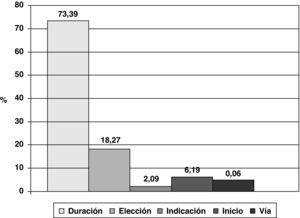
El 2,3% de los pacientes intervenidos no recibieron profilaxis estando indicada. El porcentaje de profilaxis quirúrgicas adecuadas en la indicación, elección del antibiótico, inicio, vía y duración, respecto a todos aquellos pacientes que la recibieron fue del 72,5%. La causa más frecuente de inadecuación de la profilaxis fue su duración (fig. 1).
El porcentaje de pacientes correctamente preparados fue del 54%; el 3,3% no llegó preparado a la cirugía; el 1,7% fue incorrectamente preparado y en el 41% no constaba en la historia clínica la preparación recibida. La proporción de pacientes con una adecuada preparación en aquellos sometidos a cirugía limpia fue el mayor, con el 69%; el menor porcentaje fue el correspondiente a la cirugía contaminada, con el 40,9% de preparación correcta. El porcentaje de preparación prequirúrgica correcta fue del 65,6% en cirugía limpia-contaminada y del 50,4% en cirugía sucia.
Las tasas de ILQ para cada procedimiento quirúrgico por índice de riesgo NNIS se muestran en la tabla 5.
Tasa de Infección de herida quirúrgica por procedimiento e índice de riesgo NNIS.
| Apendicectomía (n=797) | |
| Tasa de infección=3,14% | |
| NNIS 0E (n=75) | 1,33% |
| NNIS 0 (n=270) | 1,48% |
| NNIS 1 (n=300) | 3,67% |
| NNIS 2,3 (n=152) | 6,58% |
| Cirugía de mama (n=592) | |
| Tasa de infección=3,89% | |
| NNIS 0 (n=376) | 2,65% |
| NNIS 1 (n=196) | 5,61% |
| NNIS 2,3(n=20) | 10% |
| Cirugía cardíaca (n=466) | |
| Tasa de infección=3,65% | |
| NNIS 0,1 (n=365) | 3,83% |
| NNIS 2,3 (n=101) | 2,97% |
| Cirugía de vesícula biliar (n=1.103) | |
| Tasa de infección=2,63% | |
| NNIS M (n=358) | 0,84% |
| NNIS 0 (n=172) | 5,78% |
| NNIS 1 (n=356) | 3,08% |
| NNIS 2,3 (n=217) | 3,23% |
| Cirugía de colon (n=1.480) | |
| Tasa de infección=17,1% | |
| NNIS M,0 (n=16) | 6,25% |
| NNIS 1 (n=205) | 19,51% |
| NNIS 2 (n=762) | 15,62% |
| NNIS 3 (n=497) | 18,71% |
| Cesárea (n=324) | |
| Tasa de infección=3,4% | |
| NNIS 0 (n=269) | 2,97% |
| NNIS 1 (n=52) | 5,77% |
| NNIS 2,3 (n=3) | 0% |
| Reducción abierta de fractura (n=846) | |
| Tasa de infección=2,84% | |
| NNIS 0 (n=477) | 1,89% |
| NNIS 1 (n=329) | 3,65% |
| NNIS 2,3 (n=40) | 7,50% |
| Cirugía gástrica (n=282) | |
| Tasa de infección=9,93% | |
| NNIS 0E (n=25) | 0% |
| NNIS 0 (n=64) | 6,25% |
| NNIS 1 (n=138) | 8,69% |
| NNIS 2,3 (n=55) | 27,27% |
| Herniorrafias (n=770) | |
| Tasa de infección=1,95 | |
| NNIS 0E (n=12) | 0% |
| NNIS 0 (n=347) | 1,46% |
| NNIS 1 (n=301) | 1,99% |
| NNIS 2,3 (n=110) | 3,63% |
| Prótesis de cadera (n=1.754) | |
| Tasa de infección=4,16% | |
| NNIS 0 (n=593) | 2,19% |
| NNIS 1 (n=858) | 4,66% |
| NNIS 2,3 (n=303) | 6,60% |
| Prótesis de rodilla (n=2.088) | |
| Tasa de Infección=2,06% | |
| NNIS 0 (n=983) | 1,93% |
| NNIS 1 (n=848) | 2,00% |
| NNIS 2,3 (n=257) | 2,72% |
| Cirugía prostática (n=315) | |
| Tasa de infección=2,86% | |
| NNIS 0 (n=143) | 2,1% |
| NNIS 1 (n=131) | 3,82% |
| NNIS 2,3 (n=41) | 2,44% |
| Cirugía de recto (n=412) | |
| Tasa de infección=21,36% | |
| NNIS 0 (n=6) | 0% |
| NNIS 1 (n=128) | 14,84% |
| NNIS 2,3 (n=278) | 25,18% |
El control de la infección es un estándar de calidad y es esencial para el bienestar y la seguridad de los pacientes. La existencia de un programa de control de la infección es una pieza clave en la asistencia y refleja el estándar de los cuidados ofrecidos en un centro21.
La infección quirúrgica es la localización más frecuente en el conjunto de los servicios quirúrgicos de los hospitales que han trabajado en este proyecto. Esta infección triplica la estancia hospitalaria, por lo que cualquier medida que contribuya a disminuir su incidencia, contribuirá también a disminuir la estancia media y, por lo tanto, los costes asociados.
La profilaxis antibiótica es una medida de eficacia demostrada para disminuir la frecuencia de las infecciones bacterianas posquirúrgicas22,23. Tan importante como el control de la aplicación de la profilaxis es el control de la no administración cuando está indicada y de los errores de utilización de ésta, que pueden derivarse de su elección incorrecta (indicación del antibiótico administrado), del momento de administración y la duración. La profilaxis quirúrgica adecuada, y en especial su administración durante los 60min previos a la incisión quirúrgica, es uno de los objetivos propuestos por diversas organizaciones, como los Centres for Medicare and Medicaid Services y los CDC, así como la Organización Mundial de la Salud en su iniciativa «La cirugía segura salva vidas», en el marco de su Alianza Mundial para la Seguridad del Paciente24,25. En nuestro estudio, el 2,3% de los pacientes en los que estaba indicada la profilaxis antibiótica no la recibieron, cifra inferior a la de Azzam et al26, que encontraban un 16,26%, y Lallemand et al27, con un 9%, y muy similar a la de Hermsen et al28, con un 2,5%. El conjunto de los hospitales participantes presentan una tasa de adecuación de profilaxis antibiótica del 72,5%; los estudios encontrados en la literatura hallan una cifra global de adecuación entre el 25 y el 42%, muy por debajo de nuestro estudio, exceptuando el trabajo de Takahashi et al, en el que un 83,8% de las profilaxis eran adecuadas en todos los aspectos estudiados26-32. Está ampliamente demostrado en la literatura científica que su utilización tras el cierre de la incisión quirúrgica es innecesaria y no reporta ningún beneficio23,33,34. Es más, la prolongación de la profilaxis antibiótica se ha asociado con la emergencia de resistencias bacterianas35-37. En nuestro estudio es precisamente la prolongación de la profilaxis la causa más importante de inadecuación de ésta, algo ya constatado en otros trabajos31,32,38-40.
La preparación prequirúrgica del enfermo es un conjunto de medidas que se vienen practicando de forma rutinaria siguiendo los protocolos establecidos en las normas de cada hospital. Las distintas medidas incluyen la ducha o baño del pacientes con jabón antiséptico y la preparación de la piel de éste con solución antiséptica con el fin de reducir al mínimo posible la cantidad de bacterias residentes y transitorias, y así disminuir el riesgo de contaminación e infección de la herida. Es comparable al lavado de manos por parte del equipo quirúrgico. Sólo consta una preparación adecuada en aproximadamente la mitad de los pacientes estudiados; posiblemente esta cifra sería mayor si se hubiera registrado correctamente este procedimiento en la historia clínica. La mayoría de los estudios publicados se centran en la profilaxis antibiótica, habiéndose investigado poco el cumplimiento de los protocolos de preparación prequirúrgica del paciente, tan sólo hemos encontrado dos trabajo que lo evalúan, ambos realizados en Italia41,42. En dichos estudios se observó que aún continúa utilizándose en gran medida el rasurado con cuchillas, especialmente en pacientes de sexo masculino. En el trabajo de Castella et al41, en el 75% de los casos se rasuraba al paciente antes de la cirugía. En ese mismo estudio, el paciente recibía una ducha antes de la intervención en el 78% de los casos, aunque sólo utilizaban una solución antiséptica en el 20%. El trabajo de Pan et al42 encontró que sólo en el 41% de las intervenciones analizadas la piel del paciente se preparaba con solución antiséptica aplicada en círculos concéntricos del centro a la periferia.
Una de las limitaciones de este estudio es la ausencia de vigilancia activa post-alta, ya que no era factible utilizar un método homogéneo en todos los centros debido a sus características particulares. Opinamos que utilizar una metodología diferente en los hospitales participantes, adaptada a sus características particulares y las de su área de salud, proporcionaría datos muy distintos y difíciles de agregar, especialmente si se considera la opinión subjetiva del paciente, lo cual se ha demostrado poco válido43,44. Debido a ello, y ante la ausencia de un método robusto y estandarizado de vigilancia post-alta, decidimos no realizarla45-48. Este hecho puede subestimar las tasas de infección, especialmente tras procedimientos laparoscópicos para los que la hospitalización es más corta. Las infecciones que por su gravedad produjeron un reingreso están incluidas, por lo que sólo se habrían perdido aquellas de escasa gravedad, que serían supuestamente infecciones superficiales. En cuanto a las infecciones en cirugías con implantes, no se pueden considerar los resultados totalmente definitivos, ya que en gran parte de ellas no se ha completado un año de vigilancia. Decidimos publicar estos resultados preliminares de igual forma que realiza el NHSN, e incorporar los cambios, si los hubiera, en posteriores publicaciones49,50.
El valor fundamental de este estudio de incidencia es que se ha realizado con una metodología estandarizada, que abarca a la mayoría de los hospitales públicos de la Comunidad de Madrid y que permite la comparación con los datos de otros sistemas de vigilancia, tanto internacionales (NHSN [EE. UU.], KISS [Alemania], etc.), como nacionales (grupo INCLIMECC). El índice de riesgo NNIS es el método más idóneo para estratificar y establecer comparaciones entre las cifras de infección quirúrgica en cada uno de los procedimientos quirúrgicos, ya que combina conocidos y demostrados factores de riesgo de la infección quirúrgica, como son el grado de contaminación de la cirugía practicada, con la puntuación ASA de riesgo anestésico y la duración de la intervención quirúrgica19. Así, los pacientes se estratifican en cuatro niveles de riesgo de infección y se calcula su incidencia de infección quirúrgica en cada grupo.
El número de centros, cada vez mayor, que pertenecen a la red INCLIMECC, tanto en la Comunidad de Madrid como en el resto de España, permite establecer criterios comunes de actuación y líneas de trabajo conjuntas, y definir patrones propios de comparación, de cara a una mejora en la calidad de la asistencia sanitaria.
Es imprescindible continuar la vigilancia de la infección hospitalaria para poder analizar su tendencia y evaluar el impacto de las posibles acciones de mejora que se lleven a cabo. La vigilancia y el control de las infecciones asociadas a la asistencia sanitaria aportan indicadores que deben tenerse en cuenta en los programas de calidad asistencial y seguridad del paciente.
FinanciaciónProyecto financiado por la Consejería de Sanidad de la Comunidad de Madrid, dentro de las subvenciones a las Comunidades Autónomas para la implementación de las estrategias del Sistema Nacional de Salud en Seguridad del Paciente del Ministerio de Sanidad y Política Social, en el año 2009 (RD 16/06/2009).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Grupo de Trabajo INCLIMECC de la Comunidad de Madrid: Hospital de la Cruz Roja San José y Santa Adela: González Solana I, González Davicce E, Martínez Huedo MA, Rosales Statkus ME. Hospital Universitario Fundación Alcorcón: Rodríguez Caravaca G, Guillén Sierra MC, Arredondo Provecho AB. Hospital Infanta Leonor: De Juan García S, De la Hoz González C, Muñoz Sanz V, Zazo Morais L. Hospital Universitario de Fuenlabrada: García Puente E, De Arriba Guisande I. Hospital Universitario de Getafe: Sayalero Martín MT, Moreno Gomila C, Carrión Gil M, Fernández Vizoso MR, Guerrero Carmona J. Hospital Infanta Sofía: García Fernández C, Saa Requejo CM, Rodríguez Rodríguez V. Hospital Universitario de Móstoles: Vicente Pérez A, Valencia Martín J, Galindo Olmos C, García Contreras M, Martín López AM, Muñoz Rey E. Hospital Universitario 12 de Octubre: Jaén Herreros F, Alonso Fernández C, Calzada Mezquita F, Gil Martínez MP, Rabadán Doreste A, Torres Rodríguez JL, Sanz M. Hospital Universitario Príncipe de Asturias: Díez Pérez R, Rodríguez Navas ML. Hospital del Niño Jesús: Pérez Gorricho B, Soler Francés MV. Hospital Universitario La Princesa: Figuerola Tejerina A, Gálvez Parejo A, Gimeno Maestro J. Hospital Universitario Severo Ochoa: Martínez Mondéjar B, Motilla Martínez E, Fragoso de Castro P, Yepes Díaz MT. Hospital Universitario Ramón y Cajal: Monge Jodra V, Díaz-Agero Pérez C, Pita López MJ, Robustillo Rodela A, Gil Recamal A, Gómez Pizarroso P, Palancar Cabrera A, Valdeón García MA, Valencia Monreal H. Hospital del Sureste: Sainz de los Terreros Soler L, Saquete París RM.
Los componentes del grupo están relacionados en el Anexo 1.