El estudio describe las características clinicoepidemiológicas y la etiología de la meningitis aséptica aguda (MAA) y analiza el impacto de un resultado microbiológico en el manejo clínico del paciente.
Pacientes y métodosSe incluyeron prospectivamente en el estudio los pacientes mayores de 14 años inmunocompetentes con un cuadro clínico compatible con MAA entre 2007 y 2010. Se investigó la presencia de enterovirus y herpesvirus en líquido cefalorraquídeo por técnicas de amplificación genómica. Se recogieron retrospectivamente los datos clinicoepidemiológicos.
ResultadosSe incluyeron 94 pacientes, de los que 84 se diagnosticaron de meningitis vírica (MV). La incidencia anual de MV varió desde 2,4 a 15,3 casos por 100.000 habitantes. En el 76,2% de los casos se diagnosticó un agente etiológico; 55 enterovirus, 4 VHS tipo 2, 3 VVZ, un VHS tipo 1 y un VEB. Un 45,2% de los pacientes ingresaron y el 65,8% de ellos recibieron tratamiento antibiótico. El 80% de los pacientes ingresados recibió el alta al informar de un resultado positivo y en el 94,1% se retiró el tratamiento antibiótico. El tiempo medio de hospitalización en estos pacientes fue de 2,8±2,9 días. Todos los pacientes sin resultado positivo durante el ingreso completaron el tratamiento antibiótico, y el tiempo medio de hospitalización fue de 11,6±4,6 días.
ConclusionesLa incidencia anual de la MAA es variable. Los enterovirus fueron los principales agentes etiológicos. Las pruebas moleculares permitieron el diagnóstico en el 76,2% de los casos. El 45,2% de los pacientes ingresaron y un resultado positivo permitió el alta en la mayoría de los casos, así como la retirada del tratamiento antibiótico.
This study describes the epidemiological, clinical and microbiological features of acute aseptic meningitis (AAM) in an adult population, and evaluates the impact of microbiological results on the clinical management of patients.
Patients and methodsCases of AAM were prospectively collected between 2007 and 2010 among immunocompetent patients over 14 years-old. Enteroviruses and herpes viruses were determined using nucleic acids detection in CSF. Demographic and clinical data were retrospectively collected from medical records.
ResultsA total of 94 patients were included, of whom 84 were diagnosed with viral meningitis (VM). The annual incidence of VM ranged from 2.4 to 15.3 cases per 100,000 inhabitants. An aetiological diagnosis was obtained in 76.2% of the patients with VM, 55 enterovirus, 4 HSV-2, 3 VZV, one HSV-1, and one EBV. Forty five per cent of patients were admitted to hospital and 65.8% of them received antibiotic treatment. A positive result prompted immediate discharge of 80% of inpatients and discontinuation of antibiotic therapy in 94.1% of them. The median duration of admission to hospital in these patients was 2.8±2.9 days. Patients without available results during admission completed the antibiotic treatment, and the median hospital stay was 11.6±4.6 days.
ConclusionsThe annual incidence of AAM is variable. Enteroviruses were the main aetiological agent. Molecular tests revealed the aetiology in 76.2% of cases. Almost half of the patients required hospitalisation, and in these cases a positive result can lead to the immediate discharge of patients, and the diagnostic and therapeutic interventions can be reduced.
La meningitis aséptica aguda (MAA) está causada principalmente por virus. La meningitis vírica (MV) suele tener una evolución benigna; sin embargo, en algunos pacientes produce una morbilidad que ocasiona el ingreso hospitalario y la instauración de un tratamiento antibiótico1–3.
La historia natural de este cuadro clínico en la población adulta es menos conocida que en la pediátrica, ya que la mayoría de los estudios se han realizado en niños, y en algunos de los estudios que se han llevado a cabo en adultos no se diferencia el síndrome de meningitis del de la meningoencefalitis o encefalitis2,4. En la actualidad, los enterovirus, los herpesvirus y los arbovirus se han descrito como los principales agentes etiológicos5, sin embargo, su distribución es muy variable y no del todo conocida ya que la mayoría de las publicaciones de MV en la población adulta se han realizado en base a brotes epidémicos por enterovirus3,6,7.
Las técnicas de amplificación genómica, desarrolladas principalmente para enterovirus y herpesvirus, han proporcionado una alta rentabilidad diagnóstica, con gran especificidad y rapidez8. El diagnóstico etiológico rápido es importante, ya que permite informar al paciente de su pronóstico y contribuye a un mejor manejo, evitando el uso de tratamientos antibióticos y de pruebas innecesarias, disminuyendo el tiempo de estancia hospitalaria y, por tanto, reduciendo costes9.
El objetivo de nuestro estudio fue conocer la etiología y las características clinicoepidemiológicas de la MV en la población adulta que acude al hospital y evaluar la utilidad de las pruebas de diagnóstico microbiológico molecular en el manejo clínico del paciente. Además, se analizó si un resultado rápido ahorraba costes sanitarios.
Pacientes y métodosPacientesSe incluyeron en el estudio de forma prospectiva los 94 pacientes inmunocompetentes, mayores de 14 años, que acudieron con un cuadro clínico compatible con MAA a un hospital de referencia de Gran Canaria que atiende a una población de 339.483 habitantes mayores de 14 años, desde enero de 2007 hasta diciembre de 2010. La MAA se definió por la presencia de fiebre y cefalea, acompañada o no de signos meníngeos, con características licuorales bioquímicas y celulares (pleocitosis ≥5 leucocitos/mm3) compatibles y cultivos bacteriológicos negativos después de 48 horas. La MV se definió como el cuadro de MAA en que se diagnosticó un virus y/o cuando se descartó otra etiología.
MétodosEl diagnóstico microbiológico incluyó la investigación de enterovirus y/o herpesvirus (virus herpes simple (VHS) tipos 1 y 2, virus varicela-zoster [VVZ], citomegalovirus, virus de Epstein-Barr [VEB] y virus herpes humano tipo 6) por técnicas de amplificación genómica y el cultivo bacteriológico convencional. En 74 (88,1%) muestras se realizó cultivo celular en fibroblastos (MRC-5), línea Vero y/o rabdomiosarcoma. Para la detección molecular de enterovirus se utilizó el sistema NucliSens EasyQ® Enterovirus reagent (Biomerieux) y para la detección de herpesvirus el sistema Herplex® (Genomica) y/o LightCycler® HSV ½ Qual Kit (Roche), siguiendo las instrucciones del fabricante. Estas pruebas se realizaron en nuestro laboratorio los días lectivos de lunes a viernes. Normalmente, las muestras recibidas antes de las 13:00 horas se procesaron el mismo día y las recibidas después de esta hora se congelaron a −80°C hasta su procesamiento al siguiente día lectivo. Durante el período de estudio, en el tercer trimestre del año 2008, hubo un problema de stock con los reactivos de diagnóstico molecular, coincidiendo con un brote de meningitis por enterovirus, que afectó principalmente a la población pediátrica y que originó un retraso en el tiempo de resultados. Los resultados positivos se informaron telefónicamente al médico responsable del paciente. Durante el año 2008 las muestras de LCR sin diagnóstico etiológico se remitieron al laboratorio de diagnóstico virológico del Centro Nacional de Microbiología (CNM) para la investigación de otros agentes etiológicos (adenovirus, virus de la parotiditis, virus de la rabia, Phlebovirus, arenavirus y Orthobunyavirus).
Cuando se detectó un enterovirus, las muestras y/o los cultivos se remitieron al laboratorio de referencia de enterovirus del CNM en donde fueron serotipados utilizando métodos clásicos de microneutralización con antisueros de Lim Benyesh-Melnick y/o genotipados mediante amplificación parcial y posterior secuenciación de la región VP110.
Se revisaron retrospectivamente las historias clínicas de todos los pacientes, y se recogieron datos demográficos, clínicos y de laboratorio, el tiempo desde el inicio de los síntomas y la recogida de la muestra, el diagnóstico al alta, el tiempo de hospitalización, el tiempo de un resultado positivo, el tratamiento y la evolución.
Se analizó retrospectivamente si la información de un resultado positivo reducía la estancia hospitalaria y el uso de tratamientos antibióticos innecesarios y, por tanto, si ahorraba costes sanitarios en los pacientes que ingresaban.
Para el estudio de costes, se consideró únicamente el coste medio por día de hospitalización (coste de ocupación de una cama y del personal de enfermería encargado de la misma, sin tener en cuenta ni el coste del tratamiento pautado ni las pruebas diagnósticas). En el servicio de Neurología de nuestro hospital el coste es de 252€ por día, según los datos de nuestra institución y en nuestro estudio el coste medio de las técnicas de diagnóstico molecular por paciente fue de 55€.
Para el análisis estadístico de los resultados se utilizó el sistema SPSS 15.0. Para analizar las variables cualitativas se empleó la prueba de Chi-cuadrado y para comparar medias la prueba de ANOVA. Se consideró significación estadística una p<0,05.
ResultadosDe los 94 pacientes que acudieron a nuestro hospital con un síndrome de MAA, el diagnóstico clínico al alta fue en 84 casos de MV, en 3 de meningitis bacteriana decapitada, en 3 de migraña con pleocitosis, en 2 de meningitis de origen farmacológico, un caso de linfoma cerebral primario y otro de síndrome de Vogt-Koyanagi-Harada.
La incidencia anual de MV en el año 2007 fue de 5,0 casos/100.000 habitantes; en 2008 de 15,3; en 2009 de 2,4 y en 2010 de 2,4.
De los 84 pacientes con MV, 52 (61,9%) fueron varones, con una edad media de 29,6±11,4 años (rango: 14-64) y una mediana de 29,0 años.
En 64 (76,2%) casos se detectó algún agente etiológico, 55 (85,9%) casos de enterovirus y 9 (14,1%) casos producidos por herpesvirus, de los que 4 fueron por VHS tipo 2, 3 por VVZ, uno por VHS tipo 1 y uno por VEB. Las pruebas moleculares fueron positivas en todos los casos en que se detectó un agente etiológico y el cultivo celular fue positivo en un 60,4% de los casos (35 de 58 casos en el que este se realizó). De los 12 casos diagnosticados de MV en el año 2008 en que no se detectó ningún agente etiológico, en 6 en que había muestra suficiente se realizó la investigación completa de otros virus en el centro de referencia nacional, siendo negativa en todos los casos. El tiempo medio de emisión de resultados fue de 2,4±3,5 días (rango: 0-21). El tiempo transcurrido desde el inicio de los síntomas hasta la extracción de la muestra de LCR fue mayor en los pacientes con un resultado negativo (5,9±3,5 días) que en los que tenían un resultado positivo (3,4±3,5 días) (p<0,01).
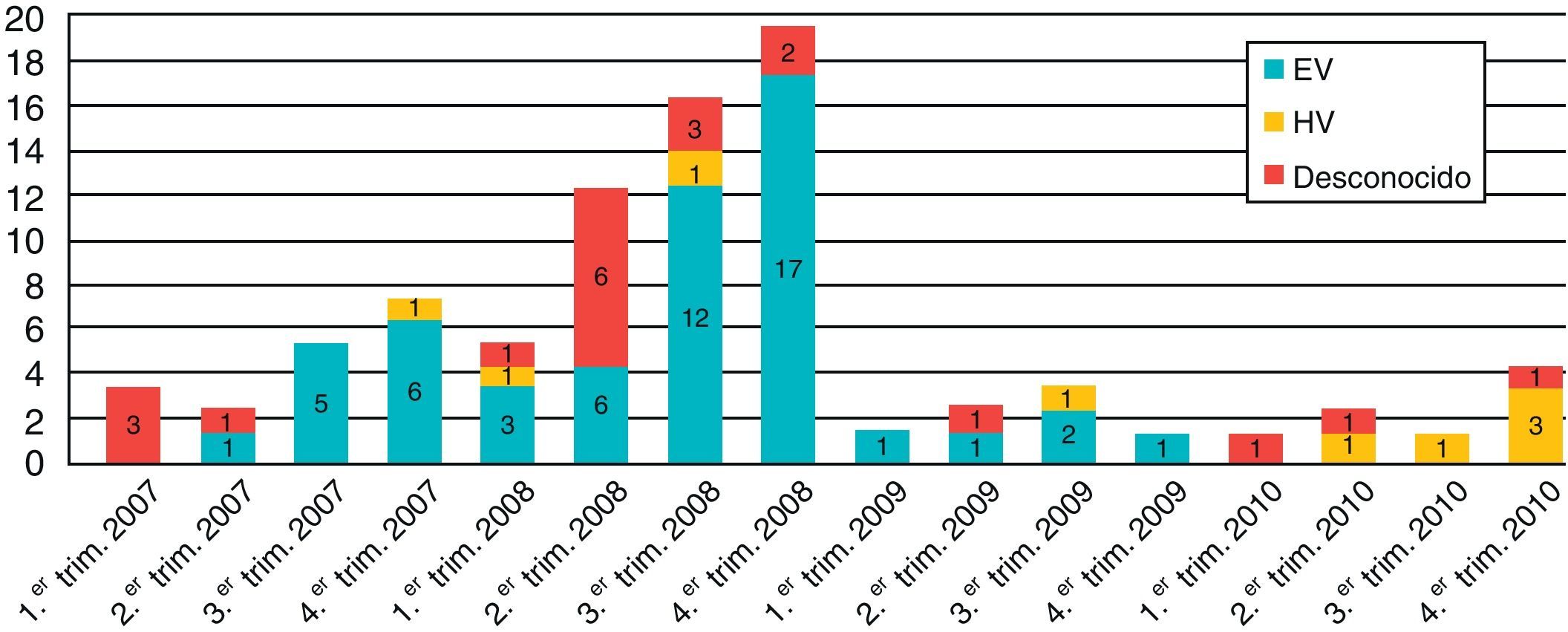
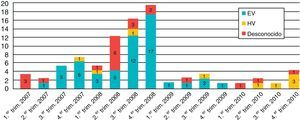
La distribución estacional de los 84 casos de MV con relación al agente etiológico se muestra en la figura 1. El mayor número de casos se produjo en el año 2008 (61,9%). El 60% de los casos de MV sin diagnóstico etiológico (12 casos) se produjeron coincidiendo con el mayor pico de incidencia de meningitis por enterovirus en el año 2008.
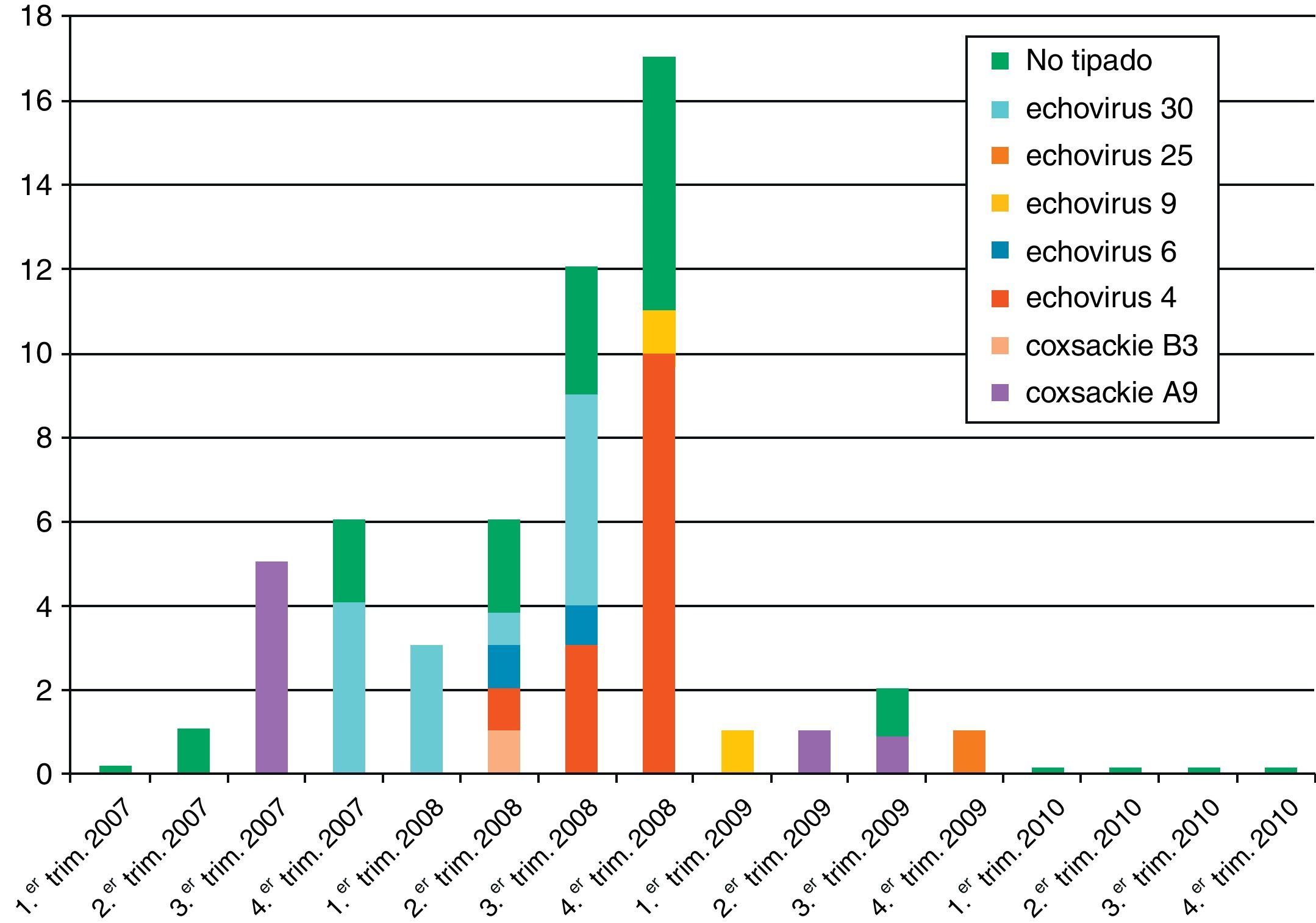
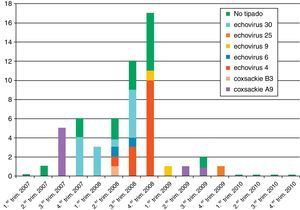
De los 55 enterovirus detectados, 40 fueron tipados (14 Echovirus 4, 13 Echovirus 30, 7 Coxsackievirus A9, 2 Echovirus 6, 2 Echovirus 9, un Echovirus 25 y un Coxsackievirus B3). En la figura 2 se muestra la distribución estacional de los enterovirus. Se observó la presencia de un brote en el otoño del año 2007 por Cosxackievirus A9 y otro que se inició en la primavera-verano de 2008 producido por Echovirus 4. Asimismo detectamos un aumento en el número de casos producidos por Echovirus 30 desde el otoño de 2007 hasta el otoño de 2008. En el año 2010 no hubo ningún caso diagnosticado de meningitis por enterovirus.
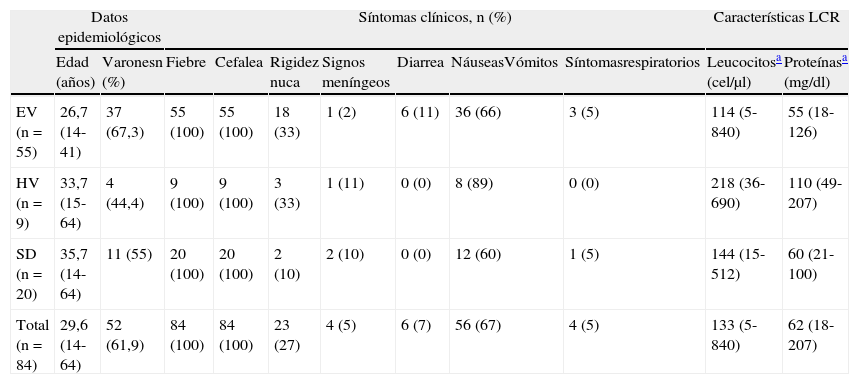
En la tabla 1 se muestran las manifestaciones clínicas y las características licuorales de los pacientes según el agente etiológico detectado. Al ingreso, a todos los pacientes se les realizó un TAC craneal, pero en ningún caso se observaron anomalías.
Características clínicoepidemiológicas de los 84 casos de meningitis aséptica aguda de etiología vírica
| Datos epidemiológicos | Síntomas clínicos, n (%) | Características LCR | |||||||||
| Edad (años) | Varonesn (%) | Fiebre | Cefalea | Rigidez nuca | Signos meníngeos | Diarrea | NáuseasVómitos | Síntomasrespiratorios | Leucocitosa (cel/μl) | Proteínasa (mg/dl) | |
| EV (n=55) | 26,7 (14-41) | 37 (67,3) | 55 (100) | 55 (100) | 18 (33) | 1 (2) | 6 (11) | 36 (66) | 3 (5) | 114 (5-840) | 55 (18-126) |
| HV (n=9) | 33,7 (15-64) | 4 (44,4) | 9 (100) | 9 (100) | 3 (33) | 1 (11) | 0 (0) | 8 (89) | 0 (0) | 218 (36-690) | 110 (49-207) |
| SD (n=20) | 35,7 (14-64) | 11 (55) | 20 (100) | 20 (100) | 2 (10) | 2 (10) | 0 (0) | 12 (60) | 1 (5) | 144 (15-512) | 60 (21-100) |
| Total (n=84) | 29,6 (14-64) | 52 (61,9) | 84 (100) | 84 (100) | 23 (27) | 4 (5) | 6 (7) | 56 (67) | 4 (5) | 133 (5-840) | 62 (18-207) |
EV: enterovirus; HV: herpesvirus; LCR: líquido cefalorraquídeo; SD: sin diagnóstico etiológico.
De los 84 pacientes con MV, 38 (45,2%) ingresaron, y a 46 (54,8%) se les dio el alta desde el servicio de urgencias. De los 38 pacientes ingresados, en 25 (65,8%) se obtuvo un resultado positivo durante el ingreso y en 13 (38,2%) no.
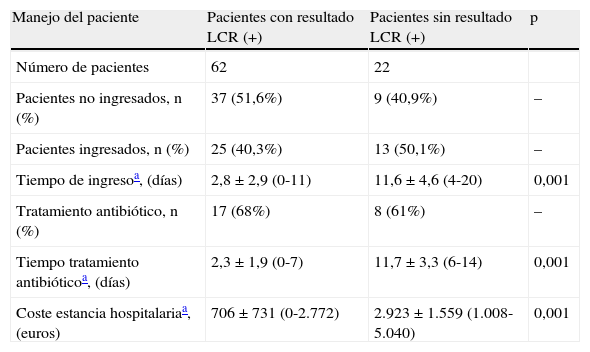
En la tabla 2 se muestran las diferencias en el manejo del paciente ingresado y en el gasto sanitario dependiendo de la obtención o no de un resultado positivo. Las diferencias en el tiempo medio de ingreso, en el tiempo medio de tratamiento antibiótico y en el coste medio de la estancia hospitalaria fueron estadísticamente significativas (p<0,01).
Diferencias en el manejo del paciente y en el coste del proceso en función de la obtención de un resultado positivo o no durante el ingreso
| Manejo del paciente | Pacientes con resultado LCR (+) | Pacientes sin resultado LCR (+) | p |
| Número de pacientes | 62 | 22 | |
| Pacientes no ingresados, n (%) | 37 (51,6%) | 9 (40,9%) | – |
| Pacientes ingresados, n (%) | 25 (40,3%) | 13 (50,1%) | – |
| Tiempo de ingresoa, (días) | 2,8±2,9 (0-11) | 11,6±4,6 (4-20) | 0,001 |
| Tratamiento antibiótico, n (%) | 17 (68%) | 8 (61%) | – |
| Tiempo tratamiento antibióticoa, (días) | 2,3±1,9 (0-7) | 11,7±3,3 (6-14) | 0,001 |
| Coste estancia hospitalariaa, (euros) | 706±731 (0-2.772) | 2.923±1.559 (1.008-5.040) | 0,001 |
De los 25 pacientes que ingresaron, y que tuvieron un resultado positivo durante el ingreso, 20 (80%) recibieron el alta hospitalaria y 5 permanecieron ingresados tras informar el resultado, 4 de ellos para recibir un tratamiento antivírico con aciclovir por el diagnóstico de meningitis herpética (2 producidos por VHS tipo 2, uno por VHS tipo 1 y uno por VVZ). En los pacientes con meningitis por enterovirus el tiempo medio de ingreso hospitalario fue de 2,0±2,2 días (rango: 0-9) y en las meningitis por herpesvirus de 6,00±3,6 días (rango: 1-11). De los 13 pacientes en los que no se obtuvo un resultado positivo durante el ingreso, en 2 se logró un resultado positivo para enterovirus después del alta.
De los 38 pacientes ingresados, 25 (65,8%) recibieron tratamiento antibiótico con una cefalosporina de tercera generación asociada a vancomicina en 12 pacientes, a ampicilina en uno y a ampicilina y gentamicina en otro. En el 94,1% de los pacientes con resultado positivo se retiró el tratamiento antibiótico cuando se informó el resultado. Solo un paciente continuó el tratamiento antibiótico durante 7 días. Todos los pacientes con resultado negativo durante el ingreso completaron 14 días de tratamiento, excepto 2, que suspendieron a los 6 y 8 días respectivamente.
DiscusiónLa MAA es una entidad clínica que en muchos casos requiere hospitalización y tratamiento antibiótico, a pesar de estar producida principalmente por virus. En este estudio evaluamos la etiología, la clínica y el manejo del paciente adulto con MV seleccionando a los pacientes en base a los datos clínicos. Lo consideramos de interés debido al escaso número de estudios similares, ya que se seleccionaron solo pacientes con meningitis, excluyendo las meningoencefalitis y encefalitis que son cuadros producidos en muchos casos por los mismos virus, pero en los que el manejo y la evolución es diferente. Además, en todos los casos se siguió la misma metodología diagnóstica, utilizando técnicas de amplificación genómica para la detección de enterovirus y herpesvirus. Asimismo, consideramos que el período de estudio de 4 años fue suficiente para reducir los efectos de variaciones estacionales y de brotes epidémicos, permitiéndonos calcular con mayor exactitud la incidencia de estas infecciones en la población adulta que acude al hospital.
Aunque no existen muchos estudios en los que se haya calculado la incidencia anual de MAA en la población adulta, se sabe que es variable y en algunos casos se ha estimado que no supera los 10-20 casos/100.000 habitantes11,12. En nuestro estudio la incidencia anual de MV osciló entre 2,4 y 15,3 casos/100.000 habitantes. En un estudio similar al nuestro de 5 años realizado en Suecia la incidencia media anual fue de 7,4 casos/100.000 habitantes4.
Los enterovirus han sido los principales virus detectados en los cuadros de MV, como ocurre en la población pediátrica, aunque el porcentaje relativo de casos varía ampliamente. En nuestro estudio el enterovirus fue el responsable del 86% de las MV en que se detectó un agente etiológico, porcentaje similar al descrito en la población infantil y superior al descrito en población adulta en Suecia (27%), Grecia (22%), Finlandia (26%) y Francia (48%)4,13–15. Las diferencias en el porcentaje de enterovirus detectados están claramente condicionadas por la aparición de brotes, que suelen ser frecuentes. Así, en nuestro estudio, en el año 2008 detectamos un alto número de casos y al menos 2 brotes epidémicos uno por Echovirus 4 y otro por Echovirus 30, mientras que en el año 2010 no detectamos ningún caso de enterovirus. El Echovirus 30ha sido el serotipo más frecuente en los últimos años en nuestro país, siendo el serotipo dominante en los años epidémicos 1998, 2000, 2002, 2006 y 200710. Por ello, es importante diseñar estudios que abarquen varios años para conocer mejor la etiología y la epidemiología de este cuadro y evitar variaciones, no solo estacionales, sino también condicionadas por la aparición de brotes.
Los virus de la familia Herpesviridae causan infecciones neurológicas con frecuencia. En pacientes inmunocompetentes, el VHS tipo 2 es una de las causas más frecuentes de meningitis en la población adulta joven, después de los enterovirus16, mientras que el VHS tipo 1 es el principal agente etiológico de encefalitis esporádica en todo el mundo17. Asimismo, en los últimos años se ha implicado cada vez con mayor frecuencia el VVZ como agente productor de meningitis y, sobre todo, meningoencefalitis, asociado o no a enfermedad exantemática18. Otros herpesvirus (VHS tipo 1, VEB, CMV y VHH tipo 6) se han descrito como agentes de MV de forma esporádica19–21.
En nuestro estudio los herpesvirus representaron el 14% de todos los casos de MV con diagnóstico etiológico, siendo el más frecuente el VHS tipo 2, seguido de VVZ. A pesar de ser un agente que raramente se diagnostica como causa de MV, el VHS tipo 1 se detectó en un caso. Destacar asimismo, la presencia de un caso de MV por VEB en un paciente, sin datos de mononucleosis y sin ninguna otra afección asociada.
En nuestra área no se han detectado otros agentes etiológicos, como los arbovirus que pueden ser frecuentes en otras localizaciones, como en el centro o norte de Europa, en donde suponen en algunos casos hasta un 21% de las meningitis o meningoencefalitis víricas leves4. En España se han detectado casos de meningitis por arbovirus, principalmente por virus Toscana, en Andalucía, costa de Levante y Madrid22. A pesar de que no se han investigado exhaustivamente (solo en el 30% de los pacientes sin diagnóstico etiológico), creemos que no han sido responsables de los cuadros de MV en nuestra área durante el período de estudio, ya que el número de casos sin diagnóstico etiológico ha sido bajo.
Las pruebas moleculares permitieron en nuestro estudio conocer el agente etiológico en el 76,2% de los casos, porcentaje superior a otros en que se utilizan técnicas de diagnóstico similares. Los mejores porcentajes de diagnóstico en los estudios publicados han alcanzado el 66%4,13,14. Las diferencias en la rentabilidad diagnóstica pueden deberse a varios factores. Entre ellos están la selección de pacientes, que en algunos estudios no diferencian meningitis de meningoencefalitis4, las pruebas de amplificación genómica utilizada, debido a que no siempre se han utilizado técnicas de uso diagnóstico en tiempo real13, el tiempo entre el inicio de los síntomas clínicos y la recogida de la muestra, ya que cuanto mayor sea éste, la sensibilidad disminuye23 y la distribución de agentes etiológicos en el área geográfica de estudio. La rentabilidad en el diagnóstico de virus suele estar condicionada por la aparición de brotes, principalmente de enterovirus, aunque también se han descrito brotes de parotiditis, sobre todo cuando hay un fallo en la vacunación, y por la circulación, en algunas zonas, de diferentes tipos de arbovirus.
Hay que destacar, que el mayor número de casos sin diagnóstico etiológico en nuestro estudio coincide con el pico de mayor incidencia de enterovirus. Esto sugiere que algunos de estos casos podrían estar causados por enterovirus y no haber sido detectados por falta de sensibilidad. Asimismo, observamos que en los pacientes sin diagnóstico etiológico el tiempo medio desde el inicio de los síntomas y la toma de la muestra fue significativamente más largo, lo que según se ha observado en otros estudios puede hacer variar la rentabilidad de la técnicas moleculares24. Todo esto nos hace pensar que en nuestra área geográfica, la mayoría de los casos actualmente están producidos por estas dos familias de virus.
En relación con el manejo del cuadro clínico, el 45% de los pacientes con MV fueron hospitalizados, bien para recibir un tratamiento antibiótico empírico (65,8%) o para la realización de pruebas diagnósticas que excluyeran otras afecciones. Un resultado microbiológico positivo rápido permitió reducir la estancia hospitalaria, así como la retirada de antibióticos en un número significativo de casos. Estimamos que un resultado positivo en un paciente que ingresa reduce el coste de la hospitalización en más de un 70% en nuestra institución. Algunos autores previamente han analizado el ahorro de los costes de hospitalización, principalmente en brotes de meningitis por enterovirus25. A pesar de que la incidencia de MV en la población adulta no es tan alta como en los niños, el ahorro del coste es evidente, sobre todo en casos de brotes epidémicos.
Aunque el estudio tiene como limitación el que no se ha realizado un análisis económico detallado, las conclusiones sobre ahorro de los costes pueden deducirse a partir de los parámetros analizados (reducción de la estancia hospitalaria y retirada del tratamiento antibiótico), ya que al ser un estudio retrospectivo, no se ha influido en el manejo del paciente y se observa una relación entre un resultado positivo con un diferente manejo del cuadro clínico.
Cuatro de los pacientes con meningitis por herpesvirus se trataron con aciclovir, a pesar de que no existen recomendaciones de tratamiento, al no haber datos que demuestren una mejor evolución de los pacientes26. La evolución del cuadro clínico fue benigna en todos los casos, independientemente de si recibieron o no tratamiento antivírico.
En conclusión, la incidencia anual de MV es variable. Los enterovirus y herpervirus son los principales agentes etiológicos de la MV en la población adulta en nuestra área geográfica, ya que supusieron al menos el 76% de los casos. Su incidencia depende principalmente de la aparición de brotes epidémicos. El obtener un resultado positivo rápido es importante para el manejo del paciente y en este estudio se observa que disminuye el uso de tratamientos antibióticos y de algunos servicios, y por tanto reduce el gasto hospitalario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.AgradecimientosEste trabajo ha sido parcialmente financiado por el Fondo de Investigación Sanitaria, Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación (PI07/90154).