Distintos estudios ya han señalado la prevalencia importante de disfunción tiroidea inducida por sunitinib. No obstante, se desconoce el mecanismo de acción subyacente y el beneficio del tratamiento sustitutivo. Con el objeto de evaluar la función tiroidea en los pacientes con carcinoma de células renales avanzado tratados con sunitinib, se realizó el estudio descriptivo presentado.
Material y métodosSe incluyeron 24 pacientes tratados entre 2006 y 2008 en el Hospital Clínico San Carlos. Los datos recogidos de forma retrospectiva se analizaron con el paquete estadístico SPSS 15.0.
ResultadosLa duración del tratamiento fue de 30 (18–42) semanas (mediana [RIQ]). Cinco pacientes (20,8%) desarrollaron hipotiroidismo subclínico, y 3 (12,5%) hipotiroidismo clínico. El número de semanas necesarias para observar elevación de TSH fue 15 (6–20) (mediana [RIQ]). Cinco pacientes (20,8%) presentaron TSH disminuida previa al tratamiento o durante el mismo, sin poder establecer el diagnóstico de hipertiroidismo subclínico dados los factores intercurrentes. Catorce pacientes (58,3%) presentaron toxicidad, sin encontrarse una asociación con el desarrollo de hipotiroidismo (p=0,388).
ConclusionesLa elevada prevalencia de hipotiroidismo inducido por sunitinib hace necesario un seguimiento sistemático de la función tiroidea en estos pacientes. No obstante, dicho estudio puede estar interferido por distintos factores fisiopatológicos y farmacológicos, por lo que podría ser útil determinar no solo TSH y T4 libre, sino también T3 libre e, idealmente, T3 reversa. A día de hoy carecemos de recomendaciones para el manejo del hipotiroidismo en el paciente oncológico basadas en la evidencia.
Several studies have reported the substantial prevalence of sunitinib-induced thyroid dysfunction. However, the underlying mechanism and the benefit of thyroid hormone replacement therapy remain to be determined. To evaluate the effect of sunitinib on thyroid function, we carried out a descriptive study in patients with advanced renal cell carcinoma.
Patients and methodsA total of 24 patients treated by sunitinib between 2006 and 2008 at Hospital Clínico San Carlos were included. The data were collected retrospectively and analyzed with SPSS 15.0.
ResultsTreatment duration was 30 weeks (18–42) [median (IQR)]. Five patients (20.8%) developed subclinical hypothyroidism and three (12.5%) developed overt hypothyroidism. The number of weeks needed to observe an increase in thyroid-stimulating hormone (TSH) values in these patients was 15 (6–20) [median (IQR)]. TSH levels were below the normal range in five patients (20.8%) before or during the treatment period, but the diagnosis of subclinical hyperthyroidism could not be established because of concomitant factors. Fourteen patients (58.3%) showed sunitinib adverse events, but these were not related to the development of hypothyroidism (p=0.388).
ConclusionsBecause of the high prevalence of sunitinib-induced hypothyroidism, thyroid function should be systematically monitored in patients with renal cell carcinoma treated with this drug. However, several pathophysiological and pharmacological factors may interfere with monitoring. Consequently, it might be useful to determine not only TSH and free T4 but also free T3 and, ideally, reverse T3. Evidence-based recommendations to manage hypothyroidism in oncology patients are not available at present.
Desde el año 2005 se han descrito casos de disfunción tiroidea en relación con distintos inhibidores de las tirosina cinasas (ITK). Sunitinib es un ITK aprobado como tratamiento de primera línea del carcinoma de células renales avanzado o metastático y de los tumores estromales gastrointestinales (GIST) resistentes o con mala tolerancia a imatinib. Actúa sobre múltiples receptores tirosina cinasa, incluidos los receptores del factor de crecimiento endotelial vascular (VEGFR) y del factor de crecimiento derivado de las plaquetas (PDGFR), el receptor del factor de células madre (KIT) y el receptor del factor neurotrófico derivado de células gliales (RET). Se administra una dosis oral diaria de 50mg, en un esquema de 4 semanas de tratamiento seguido por 2 semanas de descanso para constituir un ciclo completo de 6 semanas1. El seguimiento de la función tiroidea en estos pacientes está justificado por la prevalencia de hipotiroidismo inducido por sunitinib (32–85%)2–7 y la dificultad de su diagnóstico clínico, debida a la superposición con la sintomatología derivada de la toxicidad del tratamiento o de la propia enfermedad neoplásica.
Desde las primeras observaciones sobre hipotiroidismo inducido por sunitinib en 20062 se han planteado distintas hipótesis patogénicas. Se ha sugerido que podría ser secundario a una tiroiditis no autoinmunitaria, y por ello estaría precedido en ocasiones de una fase de tirotoxicosis2,6,7. La inhibición de VEGFR en ratones induce la regresión del 68% del lecho capilar tiroideo, el cual se regenera 2 semanas tras la retirada del inhibidor8. Por otro lado, se ha demostrado que sunitinib tiene actividad antiperoxidasa in vitro con una potencia equivalente a un 25–30% de la de propiltiouracilo3. También se ha sugerido un posible bloqueo del trasportador de yodo (NIS) en base a estudios gammagráficos con I1235. Por último, se ha descrito la necesidad de incrementar la dosis habitual de levotiroxina en pacientes tiroidectomizados en tratamiento con sunitinib3,9, apuntando quizás a un efecto a nivel periférico, como ya ha sido descrito para imatinib10.
El caso índice del estudio presentado fue remitido a nuestras consultas para valoración de un hipotiroidismo subclínico en el contexto de un tratamiento con sunitinib (6.° ciclo) como primera línea terapéutica de un carcinoma de células renales en estadio IV. La concentración de tirotropina (TSH), normal al inicio de la terapia (4,2μU/ml para unos límites de 0,34–5,6), había alcanzado 36,29μU/ml en el momento de la valoración, con T4 libre (T4L) de 7,72pg/ml (5,8–16,4). Tras la instauración de tratamiento con levotiroxina llegó a presentar TSH de 172μU/ml (T4L 5,06pg/ml), requiriendo hasta 200μg diarios para su control.
El objetivo principal de este trabajo es el estudio descriptivo de la disfunción tiroidea en los pacientes con carcinoma de células renales avanzado en tratamiento con sunitinib, remarcando la importancia de los factores clínicos y farmacológicos intercurrentes, y de la estrategia diagnóstica y terapéutica llevada a cabo en dicho grupo de pacientes. Secundariamente, se analiza la posible relación entre la toxicidad por sunitinib y la inducción de hipotiroidismo y se discute con fines prácticos la influencia de la función tiroidea en el pronóstico de la enfermedad neoplásica.
Material y métodosSe ha realizado un estudio descriptivo retrospectivo de los pacientes con carcinoma de células renales avanzado tratados con sunitinib en nuestro centro entre enero del 2006 y diciembre del 2008, ya sea como primera o sucesivas líneas de tratamiento. El seguimiento abarcó hasta el último ciclo de tratamiento, o bien concluyó en abril del 2009 si el tratamiento seguía en curso en dicha fecha. Se excluyeron los pacientes en tratamiento con levotiroxina previo al inicio de la terapia, los que no cumplieron un ciclo completo, y aquellos que carecían de estudio de la función tiroidea durante el seguimiento. Se recogieron los valores de las determinaciones hormonales realizadas antes (función tiroidea basal), durante y después del tratamiento con sunitinib. La determinación cuantitativa de las concentraciones de TSH, T4L y triyodotironina libre (T3L) se realizó mediante inmunoensayos de quimioluminiscencia de partículas paramagnéticas (Access HYPERsensitive hTSH, Access Free T4 y Access Free T3 de Beckman Coulter®). Los límites de referencia en base a los que se establecieron los diagnósticos de disfunción tiroidea son los siguientes: TSH 0,34–5,6μU/ml, T3L 2,5–3,9pg/ml y T4L 5,8–16,4pg/ml. Los anticuerpos antiperoxidasa tiroidea (anti-TPO) y antitiroglobulina se titularon mediante radioinmunoensayo (SELco® anti-TPO y TgAb RIA CT de IDS® respectivamente). En relación al tratamiento con sunitinib, se registró la duración del mismo y los ajustes necesarios por toxicidad (reducción de dosis a 37,5mg, 25mg o suspensión). Se recogieron los tratamientos antineoplásicos previos o posteriores a la terapia con sunitinib, y la existencia de tratamiento esteroideo concomitante (en aquellos que presentaron TSH disminuida). Se registró la indicación de levotiroxina y dosis prescrita. El análisis estadístico se realizó mediante el paquete estadístico SPSS versión 15.0.
ResultadosSe incluyeron un total de 24 pacientes tras la exclusión de 5 de los 29 recogidos inicialmente: una paciente había sido hemitiroidectomizada por un quiste coloide y recibía tratamiento con levotiroxina, 2 pacientes no llegaron a cumplir un ciclo completo de sunitinib y 2 pacientes carecían de determinaciones de la función tiroidea durante su seguimiento. Ningún paciente incluido tenía antecedentes conocidos de disfunción tiroidea. Dieciocho (75%) pacientes eran hombres y 6 (25%) mujeres, con una edad de 63,9 años (DE 7,8).
Tratamiento con sunitinib: la duración del tratamiento con sunitinib fue de 30 semanas (18–42) (mediana [rango intercuartil {RIQ}]). Sunitinib fue el primer tratamiento administrado a 18 de los 24 pacientes incluidos (75%) (pacientes naive). En 8 pacientes (33,3%) se sustituyó sunitinib por una segunda línea de tratamiento: en 1 por toxicidad y en 7 por progresión de la enfermedad. En 3 pacientes (12,5%) se precisó una tercera línea de tratamiento.
Seguimiento de la función tiroidea: En su seguimiento se realizaron 0,62 (0,33–1,00) (mediana [RIQ]) determinaciones de la función tiroidea por ciclo de tratamiento. Generalmente se realizó al concluir las 2 semanas de descanso, coincidiendo con la valoración clínica del paciente y la instauración del siguiente ciclo en función del grado de toxicidad presentado. En los 85 estudios de función tiroidea realizados se solicitó la concentración de TSH y T4L y en 27 de ellos (31,8%) la T3L. En ningún paciente se determinó la concentración de T3 reversa. Se titularon los anticuerpos antitiroideos en 2 pacientes (8,3%) que habían desarrollado hipotiroidismo clínico: uno (caso índice) presentó anticuerpos anti-TPO positivos (481UI/ml para un límite superior de 40UI/ml) y antitiroglobulina negativos, y el otro ambos negativos.
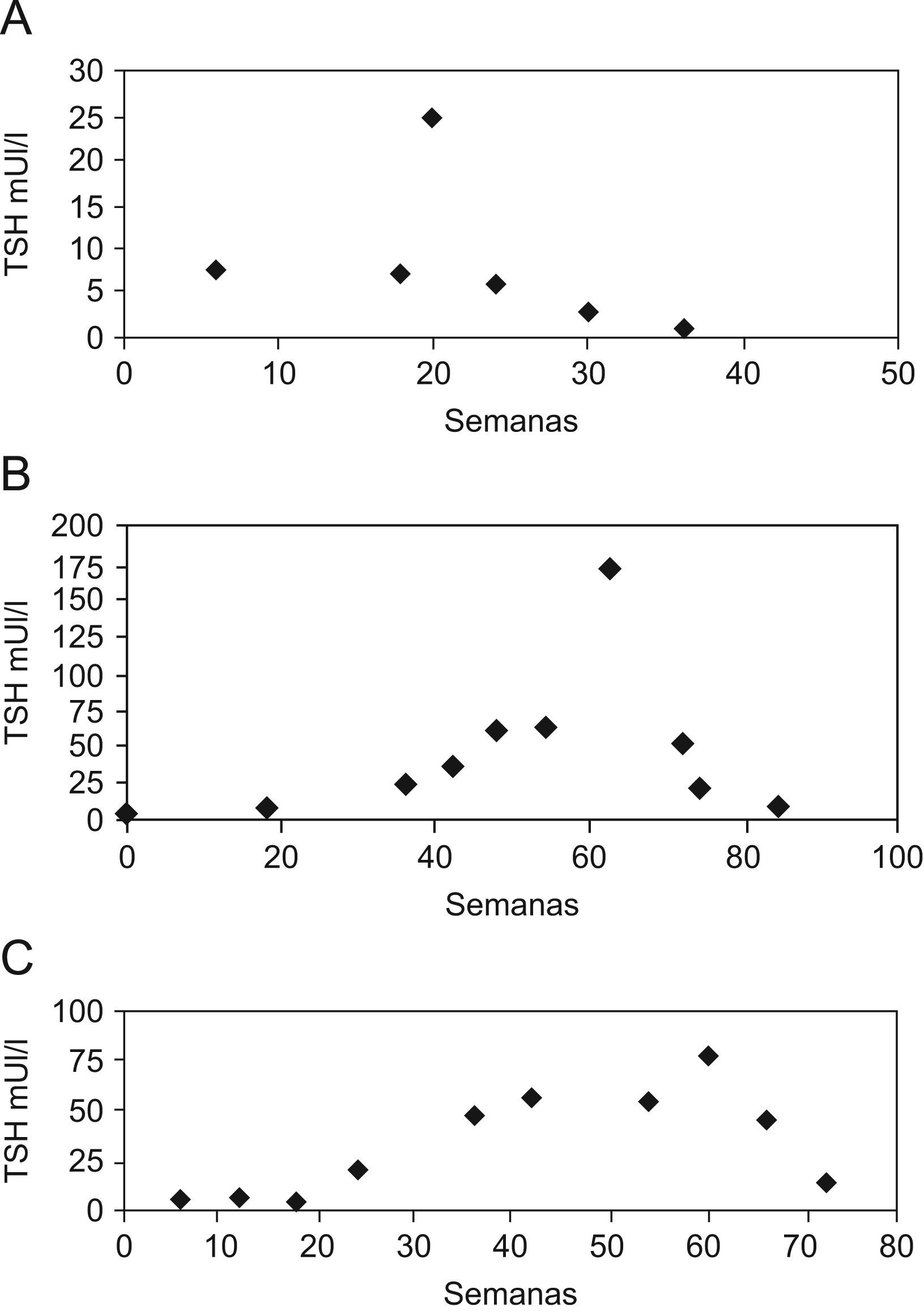
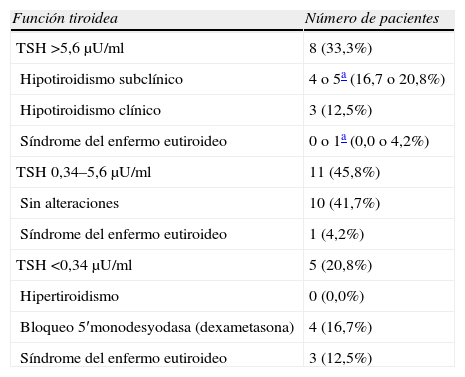
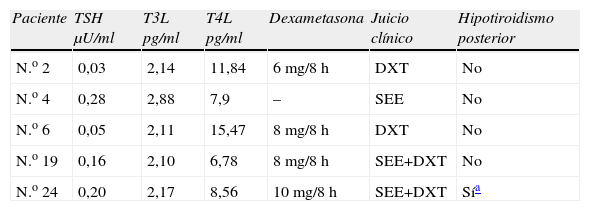
Disfunción tiroidea: únicamente 10 pacientes (41,7%) mantuvieron una concentración de TSH y T4L dentro de los límites de normalidad en todas las determinaciones. La TSH basal, determinada en 8 pacientes (33%), tuvo un valor de 1,29μU/ml (0,18–2,46) (mediana [RIQ]). En 4 de las 8 determinaciones basales realizadas (50%) se obtuvo una concentración de TSH inferior al límite de normalidad (<0,34μU/ml), y ninguna por encima de este. La tabla 1 expone la prevalencia de las distintas alteraciones de la función tiroidea en los 24 pacientes. Cinco pacientes (20,8%) desarrollaron hipotiroidismo subclínico y 3 pacientes (12,5%) hipotiroidismo clínico. En 4 de estos 8 pacientes (50%) se indicó tratamiento con levotiroxina. La concentración máxima de TSH alcanzada fue 172,74μU/ml (caso índice). El número de semanas necesarias para observar una elevación de TSH entre los pacientes que desarrollaron hipotiroidismo fue 15 (6–20) (mediana [RIQ]). En la figura 1 se muestra la relación entre la evolución de la TSH y los ciclos de sunitinib de los 3 pacientes que desarrollaron hipotiroidismo clínico. Cinco pacientes (20,8%) presentaron concentraciones de TSH inferiores al límite de normalidad (tabla 2): 4 en la determinación basal y 1 en el seguimiento. Los 2 pacientes con TSH suprimidas (<0,10μU/ml) tenían una T3L baja con una T4L en la mitad superior del límite de normalidad; ambos recibían tratamiento concomitante con dexametasona por metástasis vertebrales. Los 3 pacientes con TSH moderadamente disminuidas (0,10–0,34μU/ml) tenían T3L baja o normal con una T4L en la mitad inferior del límite de normalidad; 2 de ellos estaban en tratamiento con dexametasona por metástasis vertebrales o cerebrales. Uno de ellos (n.o 24) presentó semanas después TSH de 9,66μU/ml con hormonas tiroideas dentro del límite de normalidad. El paciente n.o 13 al final del último ciclo (18 semanas) presentó una TSH de 2,0μU/ml con hormonas periféricas disminuidas (T3L 1,95pg/ml y T4L 5,78pg/ml).
Función tiroidea en los 24 pacientes incluidos
| Función tiroidea | Número de pacientes |
| TSH >5,6μU/ml | 8 (33,3%) |
| Hipotiroidismo subclínico | 4 o 5a (16,7 o 20,8%) |
| Hipotiroidismo clínico | 3 (12,5%) |
| Síndrome del enfermo eutiroideo | 0 o 1a (0,0 o 4,2%) |
| TSH 0,34–5,6μU/ml | 11 (45,8%) |
| Sin alteraciones | 10 (41,7%) |
| Síndrome del enfermo eutiroideo | 1 (4,2%) |
| TSH <0,34μU/ml | 5 (20,8%) |
| Hipertiroidismo | 0 (0,0%) |
| Bloqueo 5′monodesyodasa (dexametasona) | 4 (16,7%) |
| Síndrome del enfermo eutiroideo | 3 (12,5%) |
TSH: tirotropina.
Evolución de la TSH en los 3 pacientes que desarrollaron hipotiroidismo clínico: A) Se indicó levotiroxina 50μg/día en la semana 20. B) Se indicó levotiroxina 50μg/día en la semana 42, aumentando hasta 200μg/día en la semana 74. C) Se indicó levotiroxina 50μg/día en la semana 36, aumentando hasta 125μg/día en la semana 72.
Detalle de los 5 pacientes que presentaron una concentración de tirotropina inferior a la normalidad 0,34–5,6μU/ml.
| Paciente | TSH μU/ml | T3L pg/ml | T4L pg/ml | Dexametasona | Juicio clínico | Hipotiroidismo posterior |
| N.o 2 | 0,03 | 2,14 | 11,84 | 6mg/8h | DXT | No |
| N.o 4 | 0,28 | 2,88 | 7,9 | – | SEE | No |
| N.o 6 | 0,05 | 2,11 | 15,47 | 8mg/8h | DXT | No |
| N.o 19 | 0,16 | 2,10 | 6,78 | 8mg/8h | SEE+DXT | No |
| N.o 24 | 0,20 | 2,17 | 8,56 | 10mg/8h | SEE+DXT | Sía |
DXT: dexametasona; SEE: síndrome del enfermo eutiroideo; TSH: tirotropina; T3: tiroxina 3; T4: tiroxina 4.
Límites de normalidad: TSH: 0,34–5,60μU/ml, T3L: 2,50–3,10pg/ml, T4L: 5,80–16,40pg/ml.
Relación entre toxicidad e hipotiroidismo: 14 pacientes (58,3%) presentaron un grado de toxicidad que motivó la reducción de dosis (12 pacientes) o la suspensión del tratamiento (2 pacientes). Se observó que desarrollaron hipotiroidismo 6 de estos 14 pacientes (42,8%), frente a únicamente 2 de los 10 pacientes (20%) que no precisaron ajuste de dosis. De los 8 pacientes que desarrollaron hipotiroidismo, 6 (75%) habían precisado una modificación del tratamiento por toxicidad. No se ha encontrado asociación estadística entre la presencia de toxicidad y el desarrollo de hipotiroidismo (p=0,388).
DiscusiónLa prevalencia de hipotiroidismo obtenida (33,3%) es inferior a la descrita en la mayoría de estudios previos 2–7. El carácter cíclico de la disfunción tiroidea6 secundaria a sunitinib puede explicar una prevalencia inferior a la real en el contexto de un estudio retrospectivo: un número reducido de determinaciones (0,62 determinaciones/ciclo) puede disminuir la sensibilidad diagnóstica, especialmente si estas se llevan a cabo en el día uno del ciclo de sunitinib dado que la función tiroidea puede recuperarse durante el periodo de descanso. Por otro lado, la determinación en este momento podría evitar el sobretratamiento con levotiroxina en la práctica clínica. En cualquier caso se muestra imprescindible un seguimiento sistemático de la función tiroidea en este grupo de pacientes.
En trabajos previos los hallazgos de concentraciones de TSH inferiores a la normalidad se han interpretado como episodios de tirotoxicosis, sin embargo, no en todos ellos se especifican las concentraciones de T3L y T4L ni la administración concomitante de fármacos. En nuestra serie de pacientes, 2 de los 5 que presentaron una concentración de TSH disminuida (n.o 2 y 6) presentan un patrón hormonal probablemente relacionado con la administración de dexametasona. Los glucocorticoides inhiben la liberación de TSH y la conversión periférica de T4 a T3 mediante la inhibición de la 5′monodesyodasa, lo que podría explicar las concentraciones de TSH suprimidas con T3L bajas y T4L en la mitad superior del límite de normalidad (tabla 2). Las alteraciones observadas en los otros 3 pacientes (n.o 4, 19 y 24, tabla 2) podrían explicarse por el contexto de una enfermedad sistémica grave, el denominado clásicamente «síndrome del enfermo eutiroideo». Se trata de una disfunción generalmente reversible en el eje hipotalámo-hipofiso-tiroideo, las proteínas transportadoras de hormonas tiroideas, la captación tisular y el metabolismo periférico de las hormonas tiroideas (inhibición de la 5′monodesyodasa con la consiguiente elevación de la T3 reversa). Existen evidencias de que se trata de un hipotiroidismo central adquirido, inherente a la situación de gravedad clínica, que puede ser potenciado por ciertos fármacos como son los glucocorticoides. Es frecuente por tanto hallar una concentración de TSH infranormal, si bien menos del 7% de los pacientes tienen concentraciones inferiores a 0,10μU/ml (generalmente aquellos en tratamiento con dopamina o glucocorticoides). En la fase de recuperación se puede observar un aumento moderado de la concentración de TSH en el 12% de los pacientes, e incluso cifras superiores a 20μU/ml en el 3%. Esto supone un riesgo de sobreestimación de la prevalencia de hipotiroidismo11. De hecho, el paciente n.o 24 presentó semanas después TSH de 9,66μU/ml con hormonas tiroideas normales, lo que se interpretó como un hipotiroidismo subclínico por el que se indicaron 25μg de levotiroxina diarios que el paciente debió suspender por mala tolerancia. Probablemente la evolución de la TSH y la intolerancia al tratamiento apuntan hacia un síndrome del enfermo eutiroideo en fase de recuperación. Un dato de utilidad hubiera sido la determinación de T3 reversa: su elevación en presencia de una TSH superior a 10μU/ml sería un dato en contra del diagnóstico de hipotiroidismo11. El diagnóstico diferencial entre hipotiroidismo primario, síndrome del enfermo eutiroideo y alteraciones secundarias al tratamiento esteroideo es fundamental ya que de él deriva una aproximación terapéutica adecuada. El tratamiento sustitutivo del enfermo eutiroideo parece aportar un beneficio escaso y no está exento de riesgos12. Las alteraciones derivadas del tratamiento con dexametasona no deben ser tratadas. Por último, el tratamiento sustitutivo en los pacientes con hipotiroidismo inducido por sunitinib se discute más adelante. La dificultad es todavía mayor si tenemos en cuenta que estas entidades no son excluyentes entre sí: los pacientes n.o 19 y 24 presentaban el perfil hormonal característico del enfermo eutiroideo, y quizás el tratamiento con dexametasona explique que sus concentraciones de TSH y de T3L sean discretamente inferiores a las del paciente n.o 4. Otro factor intercurrente en las concentraciones de TSH y hormonas tiroideas es la administración de radiocontrastes yodados. Estos agentes disminuyen la captación hepática de T4 y la acción de la 5′monodesyodasa, produciendo un incremento de las concentraciones de T4L y total. Además, pueden precipitar un hipertiroidismo en los pacientes portadores de nódulos autónomos debido a un fenómeno de Jod-Basedow. En el seguimiento de los pacientes con carcinoma de células renales, la tomografía computarizada con contraste yodado es la prueba de referencia en el estudio de progresión. La mayoría de los pacientes han sido sometidos a varias exploraciones, sin haber sido posible estudiar la interferencia de estas técnicas en la función tiroidea. En conclusión, las concentraciones de TSH y hormonas tiroideas en el paciente oncológico pueden alterarse por múltiples factores fisiopatológicos y farmacológicos, por lo que un estudio óptimo debería incluir la determinación no solo de la TSH y la T4L, sino también la T3L, e idealmente la T3 reversa. Dada la gravedad de la situación clínica y la elevada frecuencia con la que este grupo de pacientes es sometido a tratamientos con dexametasona y pruebas diagnósticas con contrastes yodados, deberíamos ser cautos a la hora de interpretar los valores de TSH: una TSH disminuida no es sinónimo de hipertiroidismo y una TSH moderadamente elevada no implica necesariamente un hipotiroidismo subclínico.
En la literatura existen datos contradictorios sobre la reversibilidad del hipotiroidismo tras la retirada definitiva de sunitinib2,7. Los distintos esquemas de tratamiento y la propia evolución de la enfermedad impiden aportar nuevos datos al respecto: de los 5 pacientes que presentaron hipotiroidismo subclínico, 2 continúan el tratamiento en la actualidad, 2 lo suspendieron por progresión falleciendo poco después, y uno inició tratamiento con sorafenib en segunda línea, otro ITK inductor de hipotiroidismo. De los 3 pacientes que desarrollaron hipotiroidismo franco, uno continúa en tratamiento con sunitinib, uno falleció durante el tratamiento, y uno inició tratamiento con sorafenib y posteriormente con bevacizumab e interferón-α (también inductor de disfunción tiroidea).
La inmunoterapia con interferón-α e interleucina-2 ha sido el tratamiento de primera línea del carcinoma de células renales avanzado hasta la llegada de sunitinib, aprobado como fármaco de elección en enero del 2006. Como se mencionó previamente, 6 (25%) de los pacientes habían recibido otras líneas de tratamiento previas a sunitinib. 2 de estos desarrollaron hipotiroidismo durante el tratamiento con sunitinib, y al desconocer su función tiroidea basal no podemos descartar una influencia del tratamiento previo con sorafenib. Un paciente precisó suspender sunitinib por toxicidad tras el 6.° ciclo e iniciar sorafenib en segunda línea, tras lo que presentó TSH de 25,64μU/ml a las 5 semanas, sin poder descartarse la influencia del tratamiento previo con sunitinib.
El análisis de la asociación entre la presencia de toxicidad y el desarrollo de hipotiroidismo no ha permitido establecer una relación entre ambas variables. Sería interesante estudiar dicha relación con un mayor número de pacientes para descartar que este resultado se deba a un tamaño muestral insuficiente.
En base a evidencias epidemiológicas, clínicas y experimentales, se ha planteado que las hormonas tiroideas podrían actuar como factor permisivo en el crecimiento tumoral en pacientes con enfermedad neoplásica activa o en remisión13–15. No obstante, se han publicado experiencias preclínicas que apuntan hacia un efecto antiproliferativo del receptor de hormona tiroidea β1 (TR β1)16,17. Un estudio ha descrito una correlación positiva entre el hipotiroidismo por sunitinib y el tiempo libre de progresión y la supervivencia total en pacientes con carcinoma de células renales avanzado18. Sería necesario el estudio de esta relación considerando las posibles variables de confusión. Nuestro estudio presenta varias limitaciones para ello, como son tamaño muestral reducido y la heterogeneidad de los factores pronósticos al diagnóstico y de las líneas de tratamiento administradas (pacientes naive frente a pacientes tratados con sunitinib como segunda o tercera línea). El diseño de trabajos que permitan estudiar dicha relación permitiría establecer unas directrices de tratamiento del hipotiroidismo secundario a ITK basadas en la evidencia, de las que carecemos en el momento actual.
La elevada prevalencia de hipotiroidismo inducido por sunitinib hace necesario un seguimiento sistemático de la función tiroidea en estos pacientes.
Diversos factores fisiopatológicos y farmacológicos pueden alterar las concentraciones de TSH y hormonas tiroideas por distintos mecanismos en los pacientes oncológicos. Esto dificulta el estudio de la disfunción tiroidea inducida por sunitinib, y obliga a ser cautos en la elaboración de conclusiones. En su valoración podría ser útil junto a la determinación de TSH y T4L, la T3L e, idealmente, la T3 reversa.
Es necesaria la elaboración de estudios que aporten luz sobre la posible influencia de las hormonas tiroideas en el crecimiento tumoral, con el fin de elaborar unas recomendaciones para el manejo del hipotiroidismo en el paciente oncológico basadas en la evidencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses,
Agradecemos al servicio de oncología médica su colaboración facilitándonos el registro de pacientes con carcinoma de células renales y la obtención de datos, así como el interés mostrado.