Los pacientes ingresados en las unidades de cuidados intensivos (UCI) con hiperglucemia presentan mayor morbi-mortalidad que los pacientes normoglucémicos. Habitualmente, la monitorización de la glucemia de los pacientes en las unidades de cuidados intensivos es realizado por medio de glucómetros. El objetivo del estudio fue evaluar un glucómetro (StatStrip, Nova Biomedical) para determinar su grado de acuerdo con el método habitual de determinación de la glucemia en el laboratorio.
Material y métodosSe recogieron 89 muestras de diferentes pacientes (76,4% hombres y 23,6% mujeres) ingresados en una UCI durante los meses de septiembre a diciembre del 2010. En cada extracción, se recogió un tubo de heparina litio y otro tubo de EDTA. La alícuota de sangre total era utilizada para la determinación de glucemia mediante el glucómetro. El tubo de heparina litio era procesado a la misma vez para la determinación de la glucemia plasmática (Analizador Cobas 6000, Roche Diagnostic, SA). Para evaluar el grado de acuerdo entre los dos métodos, seguimos el procedimiento indicado en la guía EP-9-A2 del Clinical and Laboratory Standards Institute (CLSI).
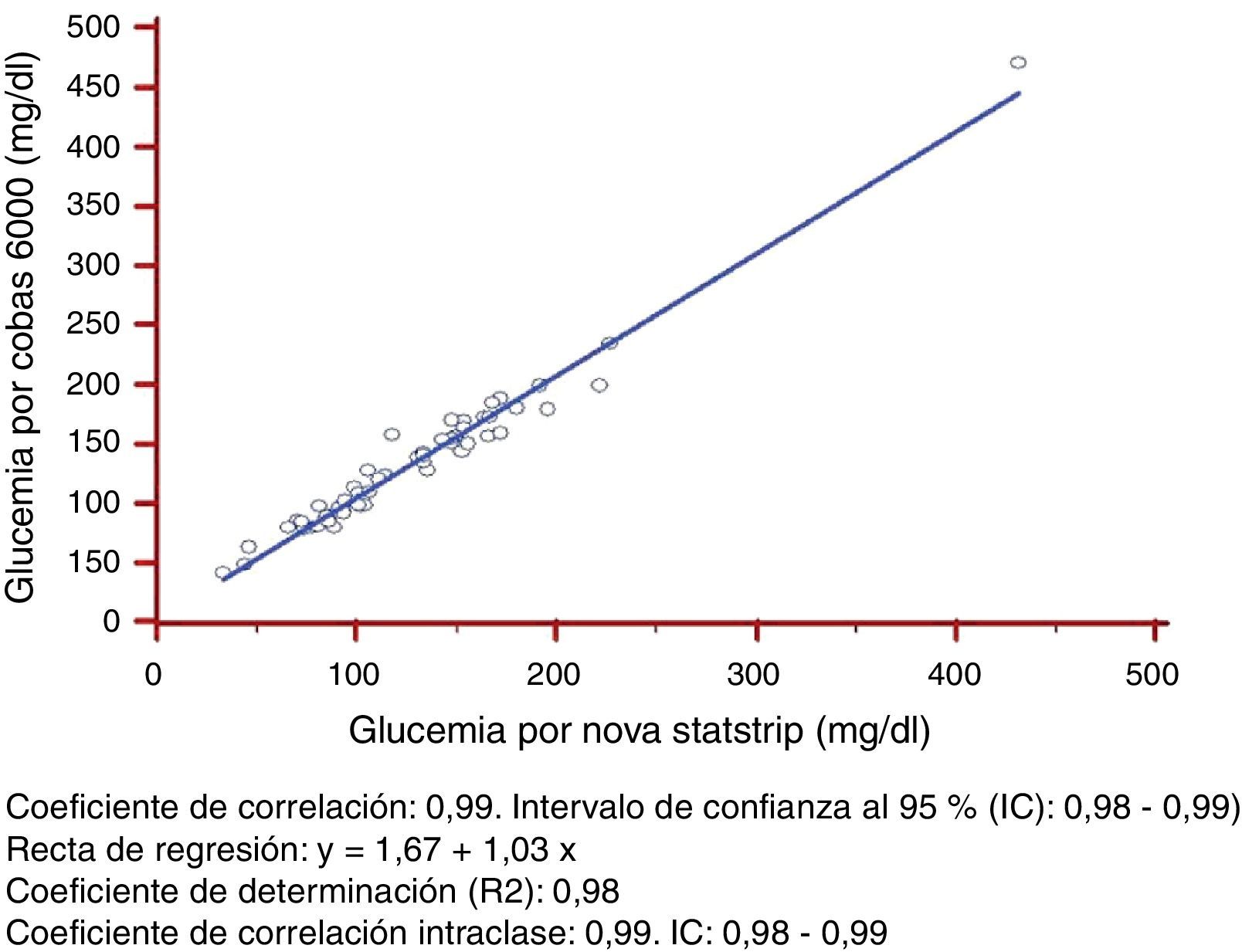
ResultadoLa glucemia en sangre total medida por el glucómetro presentaba un valor medio de 126,53±49,28mg/dL con un rango de 33,5 a 431mg/dL y la glucemia plasmática del método de laboratorio reflejaba un valor medio de 138,13±78,6mg/dL con un rango de 43-451mg/dL. El coeficiente de correlación entre ambos métodos fue de 0,99 con un intervalo de confianza al 95% (IC) de 0,98 a 0,99; el coeficiente de determinación (R2) fue de 0,97 y el coeficiente de correlación intraclase fue 0,99 con un IC de 0,98 a 0,99.
ConclusionesEl glucosímetro evaluado (StatStrip) presenta una buena asociación lineal, precisión y exactitud, cuando es comparado con el método de referencia del laboratorio clínico. Es un dispositivo adecuado para la monitorización de la glucosa.
Hyperglycemic patients admitted to Intensive care units (ICUs) have higher morbidity and mortality than normoglycemic patients. Blood glucose levels of ICU patients are usually measured with a glucose meter. The aim of this study was to evaluate a glucose meter (StatStrip, Nova Biomedical) to assess its agreement with the standard laboratory method for testing glucose.
Material and methodsEighty-nine different samples were collected from patients (76.4% men and 23.6% women) admitted to an ICU from September to December 2010. Each blood sample was collected into two tubes, a lithium heparin tube and an EDTA tube. The total blood aliquot was used to measure glycemia using the glucose meter. The lithium heparin tube was processed at the same time for measuring plasma glucose (Cobas 6000 Analyzer, Roche Diagnostics, SA). Agreement between the two methods was assessed according to the EP-9-A2 Clinical Laboratory Standards Institute guideline.
ResultsMean whole blood glucose level measured by the glucose meter was 126.53+49.28mg/dL (range, 33.5-431mg/dL), while mean plasma glucose value measured by the laboratory reference method was 138.13+78.6mg/dL (range, 43-451mg/dL). Correlation coefficient was 0.99, with a 95% confidence interval of 0.98 to 0.99. Coefficient of determination (R2) was 0.97, and intraclass correlation coefficient was 0.99 with a 95% CI of 0.98 to 0.99.
ConclusionsThe tested glucose meter (StatStrip) shows a good linear association, precision, and accuracy when compared to the laboratory reference method. This device is adequate for glucose monitoring.
Entre las alteraciones metabólicas, las de la glucemia están entre las más frecuentes en los pacientes hospitalizados, tanto en sujetos diabéticos como en no diabéticos. Los pacientes ingresados en las unidades de cuidados intensivos (UCI) presentan requerimientos de insulina aumentados debido a circunstancias como dolor, traumatismo, cirugía, sepsis, hipoxia, quemaduras, alteraciones cardiovasculares, estrés psíquico, fármacos, administración de soluciones glucosadas, etc.1. En estos pacientes se originan una serie de cambios metabólicos y circulatorios definidos como síndrome de respuesta inflamatoria sistémica (SRIS). Este síndrome produce la activación de una serie de mediadores neuroendocrinos e inflamatorios (cortisol, glucagón, hormona del crecimiento, catecolaminas, glucocorticoides y citoquinas como la interleuquina-1, interleuquina-6 y el factor de necrosis tumoral alfa) que dan lugar a un aumento de la gluconeogénesis hepática y de la resistencia periférica a la insulina, produciendo la hiperglucemia que se conoce como hiperglucemia de estrés.
Hasta hace poco se pensaba que la hiperglucemia de estrés proporcionaba una concentración adecuada de glucosa para el cerebro, músculo esquelético, miocardio y otros órganos vitales en situaciones donde la demanda de glucosa estaba aumentada, pero se ha observado que provoca un aumento de las infecciones y de la morbi-mortalidad debido al aumento del daño oxidativo y a la potenciación de la respuesta pro-inflamatoria entre otras acciones2.
Se sabe que la hiperglucemia puede producir graves consecuencias: incrementa la isquemia cerebral, retrasa la cicatrización de heridas, aumenta la frecuencia de infecciones y empeora el pronóstico de la enfermedad primaria3,4. Además, la hiperglucemia transitoria puede causar alteraciones hidroelectrolíticas, deshidratación (diuresis osmótica), acidosis láctica, disminuir el flujo cerebral, alterar del estado mental, retrasar la cicatrización de heridas, retrasar el vaciamiento gástrico, disminuir el aclaramiento de fármacos (sobre todo, narcóticos), deteriorar la función leucocitaria, aumentar la frecuencia de bacteriemia y fungemia, y reducir la implantación de injertos de piel en quemados5–8.
Los pacientes ingresados en UCI no normoglucémicos presentan mayor mortalidad que los pacientes normoglucémicos9. Todos los estudios recomiendan el tratamiento de la hiperglucemia (glucemia>140mg/dL), aunque no existe acuerdo en los criterios y en el tipo de control que hay que realizar en estos pacientes. Hoy día, la mayoría considera la hipoglucemia más grave que la hiperglucemia.
Van den Berghe et al. demostraron que el control estricto reducía la tasa de morbi-mortalidad en pacientes ingresados en la UCI10,11. En estas unidades es una práctica habitual la monitorización de la glucemia. Sin embargo, últimamente han aparecido estudios que afirman que este control produce un aumento significativo del riesgo de hipoglucemia con aumento de la morbilidad y mortalidad12–14. Habitualmente, la determinación de la glucemia en las unidades de cuidados intensivos y otras unidades hospitalarias se realiza por medio de glucómetros. Son muy utilizados ya que aportan rapidez, evitan las extracciones repetidas de muestras sanguíneas y necesitan volúmenes muy pequeños de muestra.
Los glucómetros pueden presentar errores analíticos debido a distintas interferencias descritas (fármacos, maltosa, galactosa, hematocrito, ácido ascórbico, xilosa, ácido úrico, oxígeno, bilirrubina, entre otras)15–18, circunstancias que suelen darse en pacientes en las UCI. Por este motivo, se hace necesaria la evaluación de la exactitud y la precisión analítica de los glucómetros de las distintas unidades del hospital. Además, es recomendable que sean comparados sus resultados con el método de rutina del laboratorio.
La guía de consenso EP-9-A2 del Clinical and Laboratory Standards Institute (CLSI) permite la evaluación y la comparación de dos métodos que midan el mismo analito utilizando muestras de pacientes, siempre que uno de los dos métodos sea el método de referencia o el método habitual del laboratorio19. El objetivo del presente estudio fue evaluar el glucómetro StatStrip (Nova Biomedical, Boston, Estados Unidos) para determinar su grado de asociación con el método habitual de determinación de la glucemia en el laboratorio de nuestro hospital mediante la guía de consenso EP-9-A2 del CLSI.
Material y métodosSe recogieron 89 muestras de diferentes pacientes (77,6% hombres y 22,4% mujeres) ingresados en la UCI del Hospital Juan Ramón Jiménez durante los meses de septiembre a diciembre del año 2010. En cada extracción se recogió un tubo de heparina litio y otro tubo de EDTA. La determinación del hematocrito fue realizada en el tubo de EDTA mediante un contador hematológico Sysmex (Roche Diagnostic, Mannheim, Alemania).
El glucómetro StatStrip emplea un procedimiento basado en una tira compuesta por cuatro capas con diferentes cometidos: una primera aislante que garantiza la conservación de las capas inferiores; una segunda que distribuye por capilaridad la muestra (50 microlitros) a la tercera capa; una tercera capa con cuatro pocillos (12 microlitros entre todos) en los que se hace en el primer pocillo una medida total de glucosa, en el segundo se mide lo atribuible a las interferencias (para restar), en el tercero se mide el hematocrito para reajustar y en el cuarto se realiza el control de volumen de muestra suficiente. La última capa es la que se utiliza para controlar y calibrar el glucómetro. Está compuesto por una capa de oro que le confiere estabilidad en todo tipo de condiciones ambientales.
La glucemia fue determinada en el tubo con heparina litio de acuerdo al siguiente protocolo. Una vez recibida la muestra, era separada una alícuota de 1mL que era identificada con el mismo número que tenía la muestra. Se volvía a cerrar el tubo y era centrifugado a 3.500rpm durante 10 minutos. La alícuota con sangre total era utilizada para la determinación de glucemia (por duplicado) mediante el glucómetro.
La medición de la glucemia en sangre total (alícuota) con el glucómetro, y la medición de la glucemia plasmática mediante un analizador Cobas 6000 (Roche Diagnostic) por el método de glucosa hexoquinasa (por duplicado) se realizaban al mismo tiempo. El método considerado como referencia fue la determinación de glucosa mediante el método de glucosa hexoquinasa que es el habitual de determinación de la glucemia en nuestro centro.
Se siguió el procedimiento indicado en la guía EP-9-A2 para el análisis estadístico de los resultados, según se especifica a continuación de manera esquemática:
- 1.
Comprobación de la normalidad de los parámetros estudiados. Para ello, se utilizó el test estadístico de Kolmogorov-Smirnow.
- 2.
Detección de valores extremos (outliers). Se compararon las diferencias absolutas entre los duplicados de cada método. Estas diferencias no deben superar el valor de 4 veces la media de las diferencias absolutas. En este trabajo, no encontramos valores extremos.
- 3.
Gráficos para comprobar la relación lineal entre valores de ambos métodos. Se emplearon 4 diagramas de dispersión empleando escalas iguales:
- a.
Entre valores medios de ambos métodos
- b.
Entre valores individuales de Y frente a los medios de X.
- c.
Entre las diferencias entre la media de Y y la media de X para cada método frente a la suma de los valores medios de Y y de X dividida por 2.
- d.
Entre la diferencia entre cada valor individual de Y y de X frente a la suma de los valores medios de Y y X dividida por 2.
- a.
- 4.
Estos gráficos permiten comprobar si existe o no relación lineal, y comprobar la existencia de error sistemático o aleatorio entre los dos métodos estudiados.
- 5.
Coeficiente de correlación. Se calcula r, y si es mayor o igual a 0,975 o el coeficiente de determinación es mayor o igual a 0,95, se considera aceptable la variabilidad de X y que el posible error de medida de X está compensado por el amplio rango de valores de X.
- 6.
Realización de gráficos de Bland-Altman. Estos gráficos permiten ver si existen diferencias significativas entre las 2 técnicas de medición estudiadas y ver si existe una dispersión constante. Si se observa que existe una dispersión constante se puede realizar un análisis de regresión para comparar las 2 técnicas.
- 7.
Estimación del error sistemático predicho y sus intervalos de confianza (IC).
- 8.
Coeficiente de correlación intraclase. Se considera una muy buena concordancia cuando este coeficiente es mayor de 0,9020.
Para el análisis estadístico se empleó el paquete estadístico MedCalc 11.4 de Medcalc software.
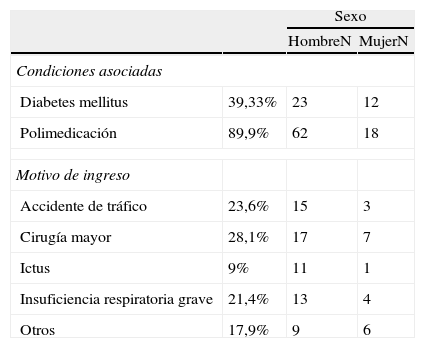
ResultadosSe incluyeron un total de 89 pacientes, con una edad media de 57,4±14,8 años (media y desviación estándar). Otras características de la población de estudio se muestran en la tabla 1. La mayoría de los ingresos se debieron a cirugía mayor (28,4%). Un 38,8% de los pacientes tenían una diabetes mellitus y un 89,5% estaba polimedicado.
Características de los pacientes estudiados
| Sexo | |||
| HombreN | MujerN | ||
| Condiciones asociadas | |||
| Diabetes mellitus | 39,33% | 23 | 12 |
| Polimedicación | 89,9% | 62 | 18 |
| Motivo de ingreso | |||
| Accidente de tráfico | 23,6% | 15 | 3 |
| Cirugía mayor | 28,1% | 17 | 7 |
| Ictus | 9% | 11 | 1 |
| Insuficiencia respiratoria grave | 21,4% | 13 | 4 |
| Otros | 17,9% | 9 | 6 |
DS: desviación estándar.
El hematocrito en la mayoría de los pacientes era bajo (media±desviación estándar: 33,13±6,56%; rango 18 -55). La glucemia (media±desviación estándar) en sangre total medida por el glucómetro fue de 126,5±49,28mg/dL (rango: 33,5 a 431mg/dL) y la glucemia de laboratorio (Cobas 6000) 138,13±49,28mg/dl (rango: 43-451). El glucómetro presentó un coeficiente de variación (CV) de 3,57% mientras que el CV del método Cobas 6000 fue de 1,59%. En los parámetros estudiados de glucemia en sangre total en el caso del glucómetro y glucemia plasmática en el método de referencia no se encontraron valores outliers
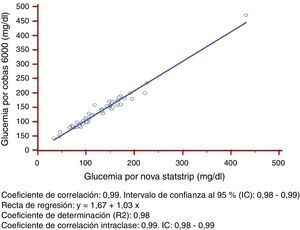
Respecto a la linealidad y dispersión constante, los dos métodos de medida seguían una relación lineal, ya que presentaba un coeficiente de correlación de Pearson>0,975. Este coeficiente de determinación es superior a 0,95 con dispersión constante, por lo que se puede utilizar la regresión lineal para comprobar la linealidad de las técnicas de medición estudiadas (fig. 1).
Los variables estudiadas, glucemia en sangre total por el glucómetro y glucemia plasmática por el Cobas 6000, seguían una distribución normal (p=0,310 y p=0,167, respectivamente).
Se calcularon los siguientes parámetros estadísticos: 1) Coeficiente de correlación: 0,99 (intervalo de confianza del 95% (IC): 0,98-0,99); 2) recta de regresión: glucemia Cobas 6000 (y)=1,67+1,03*glucemia Cobas b221 (X); 3) Coeficiente de determinación (R2): 0,97, y 4) coeficiente de correlación intraclase: 0,99 (IC: 0,98-0,99).
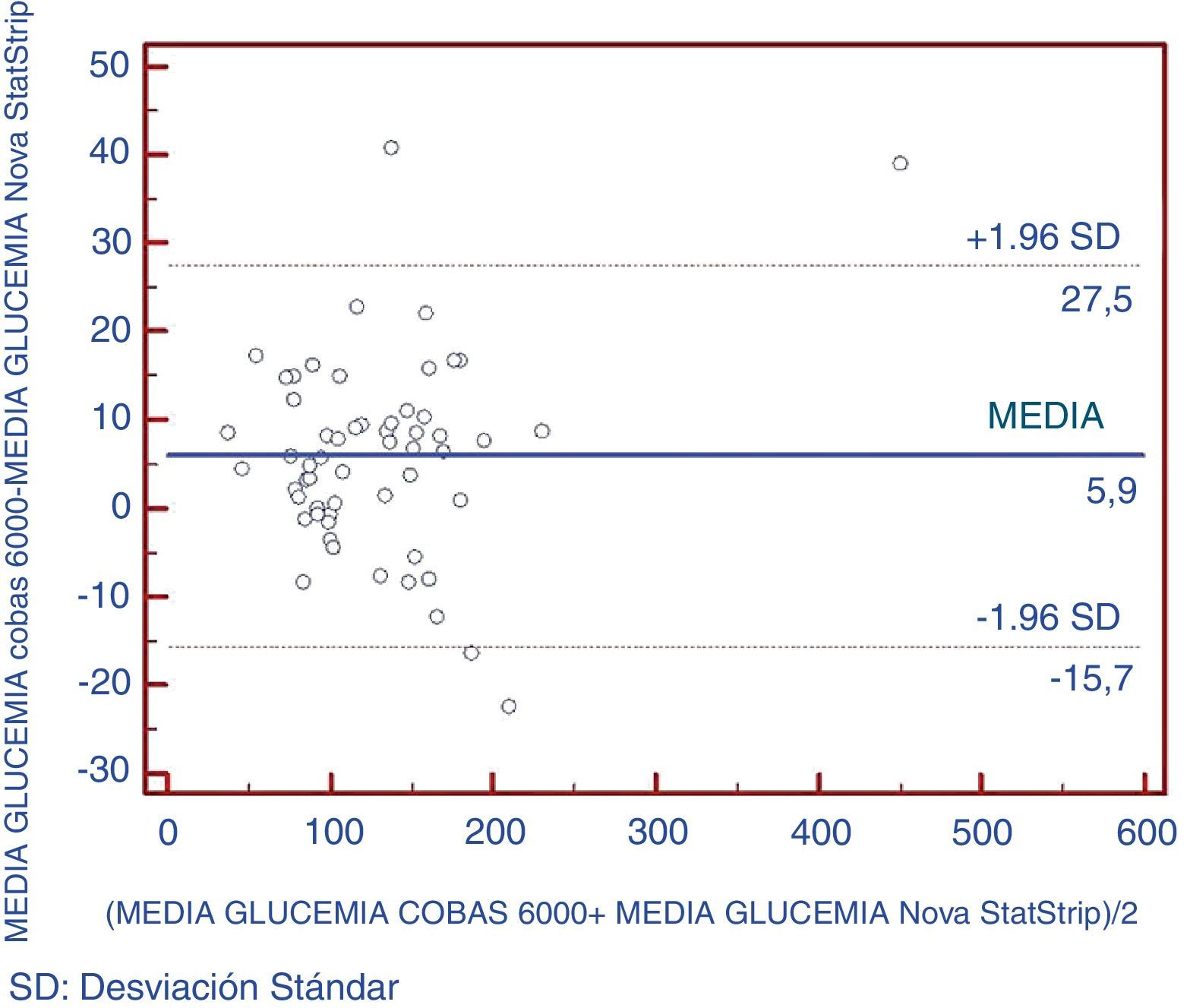
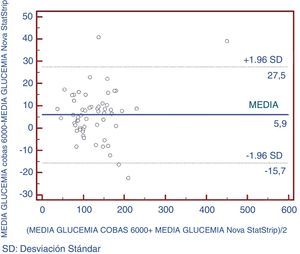
Asimismo, se realizó un análisis mediante gráficos tipo Bland-Altman para verificar que no existían diferencias significativas entre pares de puntos entre los 2 equipos comparados (fig. 2). Se pudo comprobar que un 5,2% de los datos excedían las 2 desviaciones típicas.
En la tabla 2 se exponen las especificaciones de calidad de distintos organismos internacionales. En la tabla 3, se presentan los resultados obtenidos con el glucómetro en función de los objetivos de calidad establecidos por estos organismos internacionales.
Objetivos de calidad según distintos organismos internacionales
| CLIA | Los valores obtenidos±10% o 5,4mg/dL respecto a los valores del método habitual |
| CLSI | 100% Valores±14,7mg/dL para valores inferiores a 75mg/dL |
| 100% Valores+15% para valores≥75mg/dL | |
| ISO 15197 | 95% Valores±15% para valores inferiores a 75mg/dL |
| 100% Valores+20% para valores≥75mg/dL | |
| ADA | 100% valores±5% respecto al valor del método de referencia |
ADA: American Diabetes Association; CLIA: Clinical Laboratory Improvement Amendments; CLSI: Clinical and Laboratory Standards Institute; ISO: International Organization for Standardization.
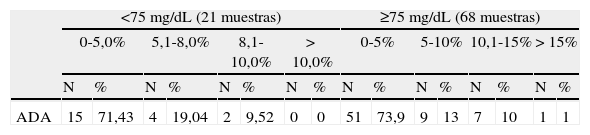
Valores obtenidos del glucómetro estudiado en función de los objetivos de calidad de distintos organismos internacionales
| <75mg/dL (21 muestras) | ≥75mg/dL (68 muestras) | |||||||||||||||
| 0-5,0% | 5,1-8,0% | 8,1-10,0% | >10,0% | 0-5% | 5-10% | 10,1-15% | >15% | |||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | % | |
| ADA | 15 | 71,43 | 4 | 19,04 | 2 | 9,52 | 0 | 0 | 51 | 73,9 | 9 | 13 | 7 | 10 | 1 | 1 |
| <5,40mg/dL | 5,40-10,85 | 10,86-14,7 | >14,7mg/dL | <5% | 5,1-10% | 10,1-15% | >15% | |||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | % | |
| CLSI | 15 | 71,43 | 4 | 19,04 | 2 | 9,52 | 0 | 0 | 51 | 73,9 | 9 | 13 | 7 | 10 | 1 | 1 |
| 0-5% | 5,1-15% | 15,1-20% | >20% | 0-10% | 10,1-20% | 20-30% | >30% | |||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | N | % | N | % | |
| ISO | 15 | 71,43 | 6 | 28,57 | 0 | 0 | 0 | 0 | 60 | 88,2 | 7 | 10 | 1 | 1,5 | 0 | 0 |
| 0-5,4mg/dL | > 5,4mg/dL | 0-5% | 5,1-10% | >10% | ||||||
| N | % | N | % | N | % | N | % | N | % | |
| CLIA | 63 | 70,79 | 26 | 29,21 | 66 | 74,2 | 15 | 16,9 | 8 | 8,99 |
ADA: American Diabetes Association; CLIA: Clinical Laboratory Improvement Amendments; CLSI: Clinical and Laboratory Standards Institute; ISO International Organization for Standardization; N: número de muestras.
Del contenido de las tablas 2 y 3, se destacan los resultados que a continuación se comentan. Empleando el criterio CLSI, el 100% de los valores obtenidos por el glucómetro estaban dentro de±14,7mg/dL respecto a los valores obtenidos por el método de referencia para valores de glucemia inferiores a 75mg/dL y el 96,01% estaban dentro del 15% de los valores del método de referencia para concentraciones superiores o iguales a 75mg/dL. Solamente una muestra era un 21,2% más alta en el glucómetro que en el método de referencia. Utilizando el criterio de la norma 15197 de la International Organization for Standardization (ISO), comprobamos que el 100% de los valores obtenidos por el glucómetro estaban dentro del±15% para valores inferiores a 75mg/dL y el 100% estaba dentro del±20% para valores superiores o iguales a 75mg. Para los criterios de la American Diabetes Association (ADA), hallamos que solamente el 60,6% de los valores del glucómetro cumplían con el objetivo de±5% con respecto a los valores de referencia obtenidos por el método de referencia. Finalmente, utilizando el criterio de la Clinical Laboratory Improvement Amendments (CLIA), encontramos que 91,01% de los valores cumplían con el objetivo de±5,4mg/dL o 10% con respecto a los valores obtenidos por el método de referencia.
DiscusiónEl empleo de glucómetros para la determinación de la glucemia en pacientes diabéticos en los hospitales es muy frecuente. Los principales problemas que presentan son la exactitud, y las interferencias por hematocrito, concentraciones de proteínas muy elevadas y por el uso de determinados fármacos. El uso de los glucómetros en las distintas unidades requiere el estudio de la concordancia con el método de rutina del laboratorio. Distintos autores han evaluado la fiabilidad de distintos glucómetros y los han comparado con los métodos de rutina de los laboratorios16,21.
Para la validación de métodos hemos empleado la guía EP-9-A2. Su empleo puede parecer complicado, pero cuando se usa es fácil de estandarizar. Los procedimientos que emplea esta guía no se corresponden con los métodos clásicos estadísticos de validación de métodos, pero debido a su efectividad como método de validación ha sido propuesta como herramienta de validación tanto de laboratorios acreditados con alcance flexible como para validación de métodos de laboratorios que aspiran a acreditarse22.
En este estudio, el glucómetro Nova StatStrip presentó una buena linealidad dentro del rango estudiado y presentó un coeficiente de variación del 3,57%. Skeie et al. recomiendan como máximo un coeficiente de variación del 5%16. La comparación del glucómetro StatStrip y el método de laboratorio de referencia (Cobas 6000) presentó una muy alta correlación con una pendiente cercana a 1 y una ordenada en el origen cercana al 0.
El mejor parámetro para valorar la concordancia de una variable cuantitativa mediante 2 instrumentos distintos es el coeficiente de correlación intraclase (CCI). Se considera una muy buena concordancia cuando el CCI es>0,9020. En este estudio, el glucómetro presentó una muy buena concordancia con respecto al método de referencia (CCI=0,99). El glucómetro presentó resultados de glucosa ligeramente inferiores a los que mostraba el método de referencia de laboratorio, con una media de diferencia de 5,9mg/dL, siendo esta diferencia similar a la encontrada por otros autores16,24,25. Esta diferencia se puede explicar por las muestras empleadas, ya que la concentración de glucosa en sangre total era en torno a 10-15% inferior a la concentración de glucemia en plasma24.
De todas formas, es necesario comprobar que los glucómetros cumplen con las recomendaciones de calidad establecidas. Con respecto a los criterios del CLSI e ISO 15197:200322,23, los resultados del estudio actual mostraban que el 100% de las lecturas del glucómetro estaban dentro del rango±14,7mg/dL respecto a los obtenidos con el método de referencia para valores inferiores a 75mg/dL. El 96,01% estaba dentro del 15% de los valores del Cobas 6000 para concentraciones superiores a 75mg/dL. Solamente una muestra era un 21,2% más alta en el StatStrip que en el Cobas 6000. Por tanto, el glucómetro evaluado cumple con los criterios establecidos por el CLSI e ISO.
Otro criterio para evaluación de la precisión fue propuesto por la ADA, que recomendó que el 100% de las lecturas del medidor debía estar dentro del±5% del método de referencia16. Sin embargo, no hay actualmente glucómetros que hayan conseguido esta meta16,25,26. El porcentaje de medidas que cumplían este requisito fue del 60,5, que es inferior a algunos trabajos y superior a otros16,21,25,26. Ello sugiere que el método StatStrip es un sistema mejorado pero no cumple con los requisitos establecidos por la ADA.
El CLIA recomienda que los resultados deben estar dentro del 10% de los resultados del método de referencia o±5,4mg/dL. En nuestro estudio el 91,01% estaban dentro de ese límite.
Poirier et al.27 clasifican los glucómetros en buenos, aceptables e inaceptables para su uso clínico. Un glucómetro es definido como bueno cuando tiene el 60% de los resultados dentro del intervalo±10% de los valores del método de referencia. De esta forma, el glucómetro evaluado en el presente estudio puede ser clasificado como un buen glucómetro.
Existe una variedad de sustancias que producen interferencias a los glucómetros16,28–31. Los principales interferentes son paracetamol, ácido ascórbico, y la maltosa. Otros autores han encontrado que las variaciones de los niveles del hematocrito pueden afectar a las mediciones de los glucómetros30,32. Esta interferencia se presenta en algunos glucómetros, incluso atendiendo las recomendaciones del fabricante33. Distintos estudios han comunicado que el glucómetro StatStrip no presenta interferencia con estos interferentes, pero la mayoría de estos estudios fueron realizados in vitro. Aunque en nuestro estudio no se ha realizado un estudio de interferencias, se puede comprobar la aparición de interferencia, sobre todo las más habituales16,28,30, ya que las características de los pacientes ingresados en UCI (polimedicados, con hematocrito bajo, con enfermedades graves, sometidos a distintos tratamiento, etc.) pueden hacer que se presente la interferencia. En el presente estudio, no hemos encontrado ninguna interferencia notable y ninguna pérdida de exactitud.
El glucómetro evaluado (Nova StatStrip) presenta una buena linealidad, precisión y correlación cuando es comparado con el método de referencia del laboratorio clínico. Dicho glucómetro cumple con los requisitos de calidad exigidos por los distintos organismos internacionales, salvo los establecidos por la ADA. Actualmente, no hay ningún glucómetro que cumpla con los requisitos establecidos por este organismo internacional. Por ello, se puede concluir que dicho glucómetro es un dispositivo adecuado para la monitorización de la glucemia en pacientes ingresados en UCI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.