La incidencia de cáncer de tiroides está aumentando en España y en todo el mundo. La supervivencia global, no obstante, es muy alta y se han desarrollado sistemas de estratificación para identificar adecuadamente a los pacientes con peor pronóstico. Sin embargo, en la práctica clínica se observan grandes diferencias en el tratamiento del cáncer de tiroides de bajo riesgo entre los diferentes especialistas responsables de su atención. Casi la mitad de los carcinomas papilares son microcarcinomas y el 90% son tumores menores de 2cm que tienen un excelente pronóstico. A pesar de ello, en general son tratados de forma más agresiva de lo deseable, sin justificación científica que lo respalde hoy en día. El tratamiento quirúrgico sigue siendo la piedra angular en el tratamiento de estos tumores. Sin embargo, en la mayoría de los casos la hemitiroidectomía puede ser suficiente, sin necesidad de realizar tiroidectomía total. Del mismo modo, generalmente no es necesaria la disección profiláctica de los ganglios del compartimento central. Esta actitud más conservadora evita complicaciones postoperatorias como el hipoparatiroidismo o la lesión al nervio laríngeo recurrente. El tratamiento ablativo posterior con yodo radiactivo seguido por una terapia de supresión estricta de tirotropina, aunque es eficaz para las formas más agresivas de cáncer de tiroides, no ha demostrado ser beneficioso en el tratamiento de estas lesiones y puede empeorar la calidad de vida de estos pacientes. Esta guía clínica proporciona recomendaciones del grupo de trabajo de cáncer de tiroides de la Sociedad Española de Endocrinología y Nutrición orientadas al enfoque y gestión razonable y apropiada de los pacientes con cáncer de tiroides de bajo riesgo.
Incidence of thyroid cancer is increasing in Spain and worldwide. Overall thyroid cancer survival is very high, and stratification systems to reliably identify patients with worse prognosis have been developed. However, marked differences exist between the different specialists in clinical management of low-risk patients with thyroid carcinoma. Almost half of all papillary thyroid carcinomas are microcarcinomas, and 90% are tumors < 2cm that have a particularly good prognosis. However, they are usually treated more aggressively than needed, despite the lack of adequate scientific support. Surgery remains the gold standard treatment for these tumors. However, lobectomy may be adequate in most patients, without the need for total thyroidectomy. Similarly, prophylactic lymph node dissection of the central compartment is not required in most cases. This more conservative approach prevents postoperative complications such as hypoparathyroidism or recurrent laryngeal nerve injury. Postoperative radioiodine remnant ablation and strict suppression of serum thyrotropin, although effective for the more aggressive forms of thyroid cancer, have not been shown to be beneficial for the treatment of low risk patients, and may impair their quality of life. This guideline provides recommendations from the task force on thyroid cancer of the Spanish Society of Endocrinology and Nutrition for adequate management of patients with low-risk thyroid cancer.
El carcinoma diferenciado de tiroides (CDT) constituye un problema de salud pública ya que representa el 1-5% de todos los cánceres1,2, y su incidencia anual está en aumento en las últimas décadas3–5. En España llega a valores de 5-6,6 por 100.000 en mujeres y 1,9-2,3 por 100.000 en hombres5–7. Las razones del aumento se deben fundamentalmente a la detección de tumores pequeños por la mayor sensibilidad de las técnicas diagnósticas8–10. Casi la mitad de los carcinomas papilares son iguales o menores de 1cm y cerca del 90% son tumores menores de 2 cm11. Sin embargo, se detecta también un aumento de los cánceres de mayor tamaño por causas todavía no aclaradas: se han involucrado la irradiación natural y artificial, los carcinógenos ambientales, cambios en la dieta e incluso cambios metabólicos12–14. A pesar de estos datos, la tasa de mortalidad ajustada por edad apenas se ha modificado en las últimas décadas, situándose actualmente entre 0,2 y 0,4 por 100.00 en hombres y entre 0,2 y 0,6 por 100.000 en mujeres en la mayoría de los países de nuestro entorno15,16.
Las guías clínicas más recientes17–19 definen con claridad los pacientes de bajo riesgo (tabla 1). Existe un acuerdo general sobre la necesidad de una menor agresividad terapéutica en estos pacientes y los datos más novedosos refuerzan esta recomendación. No obstante, persisten áreas de debate como la extensión de la tiroidectomía, la disección ganglionar, la necesidad de suprimir la tirotropina (TSH), el empleo de radioyodo (RI) y los protocolos de seguimiento. Es necesario, por tanto, definir directrices donde prime una baja agresividad terapéutica y una estrategia de coste sostenible para los sistemas sanitaros.
Definición de pacientes de bajo riesgo de mortalidad según la clasificación TNM de la AJCC/UICC
| Estadio | < 45 años | ≥ 45 años |
|---|---|---|
| I | T1 a 4, N0 a 1, M0 | T1N0M0 |
| II | T1 a 4, No a 1, M1 | T2N0M0 |
AJCC/UICC: American Joint Commitee on Cancer/Union Internationale Contre le Cancer; M0: sin metástasis a distancia; M1:, metástasis a distancia; N0: sin metástasis en ganglios linfáticos; N1a: metástasis en ganglios linfáticos cervicales centrales (nivel VI); N1b: metástasis en otros ganglios linfáticos (niveles I a V o VII); T1: tumor ≤ 2cm; T2: tumor > 2cm a 4cm; T3: tumor > 4cm o mínima invasión extratiroidea; T4a: invasión extratiroidea macroscópica; T4b: invasión macroscópica de fascia o vasos prevertebrales;
Fuente: Resumido y adaptado de American Joint Committee on Cancer20.
Con el fin de ayudar a los equipos clínicos a integrar estos factores en el diseño del plan terapéutico de estos pacientes y a propuesta del Grupo de trabajo de Cáncer de Tiroides se ha elaborado esta Guía de cáncer de tiroides de bajo riesgo. Este documento debe considerarse como una guía general, no como un estándar de atención médica. Las recomendaciones incluidas se basan en una revisión exhaustiva de la evidencia científica publicada en los más recientes ensayos clínicos y metaanálisis. No obstante, en los casos en que no se dispone de estos, las recomendaciones se fundamentan en la evaluación de las series de casos más relevantes publicados en las principales revistas médicas internacionales y consensos de expertos.
Estratificación del riesgoRiesgo inicial de mortalidadLa clasificación inicial de los pacientes con CDT se realiza generalmente tras el tratamiento quirúrgico y teniendo en cuenta factores clínicos y patológicos. Actualmente disponemos de sistemas de clasificación tanto del riesgo de mortalidad específica de la enfermedad como del riesgo de recidiva. Para la mortalidad, el más empleado es el sistema de estadificación TNM de la American Joint Committee on Cancer/Union Internationale Contre le Cancer (AJCC/UICC)20 que tiene en cuenta la edad, tamaño tumoral, invasión y la presencia de metástasis ganglionares y a distancia. Este sistema distribuye a los pacientes en 4 estadios. En el estadio I se incluye a los pacientes de < 45 años sin metástasis a distancia (con independencia del tamaño tumoral y de la presencia de metástasis linfáticas, es decir cualquier T, cualquier N, M0) y los pacientes de ≥ 45 años con tumores ≤ 2cm sin metástasis ganglionares ni a distancia (T1N0M0) (tabla 1).
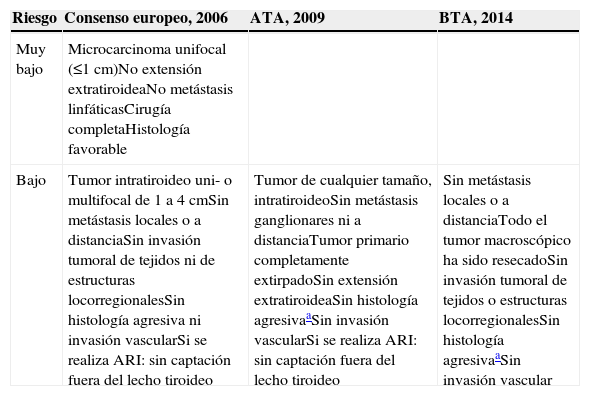
Riesgo inicial de recidivaPara la estimación del riesgo de persistencia o recidiva de la enfermedad se utilizan otros parámetros17–19 (tabla 2). El consenso europeo define al paciente de muy bajo riesgo como aquel que presenta un microcarcinoma unifocal (tamaño ≤1cm), con histología favorable y cirugía completa, sin extensión fuera de la cápsula tiroidea y sin metástasis en ganglios linfáticos17,21. Estos tumores presentan buen pronóstico y su tasa de recidiva a largo plazo es menor del 2%. El mismo consenso define los pacientes de bajo riesgo como los pacientes con T1 de más de 1cm, con N0 y M0, o bien los T2N0M0, o bien los T1 multifocales21. Según la guía de la American Thyroid Association (ATA) los pacientes de bajo riesgo son los que cumplen las características que figuran en la tabla 218. La reciente guía de la British Thyroid Association (BTA)19 adopta unos criterios muy similares.
Definición de pacientes con riesgo de recidiva o persistencia bajo o muy bajo según diferentes consensos
| Riesgo | Consenso europeo, 2006 | ATA, 2009 | BTA, 2014 |
|---|---|---|---|
| Muy bajo | Microcarcinoma unifocal (≤1cm)No extensión extratiroideaNo metástasis linfáticasCirugía completaHistología favorable | ||
| Bajo | Tumor intratiroideo uni- o multifocal de 1 a 4cmSin metástasis locales o a distanciaSin invasión tumoral de tejidos ni de estructuras locorregionalesSin histología agresiva ni invasión vascularSi se realiza ARI: sin captación fuera del lecho tiroideo | Tumor de cualquier tamaño, intratiroideoSin metástasis ganglionares ni a distanciaTumor primario completamente extirpadoSin extensión extratiroideaSin histología agresivaaSin invasión vascularSi se realiza ARI: sin captación fuera del lecho tiroideo | Sin metástasis locales o a distanciaTodo el tumor macroscópico ha sido resecadoSin invasión tumoral de tejidos o estructuras locorregionalesSin histología agresivaaSin invasión vascular |
Una limitación de estos sistemas de estratificación del riesgo de recidiva es que no consideran la respuesta al tratamiento inicial que, lógicamente, puede afectar de forma significativa la tasa de recidiva y la mortalidad. Para soslayar este inconveniente se han ideado sistemas de valoración dinámica del riesgo22,23 con los datos obtenidos en el seguimiento. Algunos estudios han mostrado que, con independencia del riesgo inicial, la probabilidad de recidiva en pacientes que no presentan datos de persistencia de enfermedad al cabo de 1-2 años de seguimiento es muy baja, entre 3,4 y 4%22,23. Además, entre el 3022 y el 50%23 de los pacientes previamente clasificados como de riesgo intermedio o alto según la ATA pueden ser reclasificados como de bajo riesgo al cabo de 1-2 años de seguimiento.
La estratificación dinámica del riesgo debe realizarse durante los 2 primeros años del seguimiento, si bien puede realizarse en cualquier momento. Este sistema permite reclasificar a los pacientes en 4 grupos (tabla 3): respuesta excelente, indeterminada, bioquímica incompleta y estructural incompleta. Los pacientes que se incluyan en los 2 primeros grupos presentan un riesgo de mortalidad y recidiva más reducido.
Definición de las respuestas al tratamiento inicial en la estratificación dinámica del riesgo
| Respuesta | Definición |
|---|---|
| Excelente | Ausencia de evidencia de enfermedad clínica, bioquímica o estructural |
| Indeterminada | Hallazgos estructurales o bioquímicos que no pueden ser clasificados con seguridad como benignos o malignos |
| Bioquímica incompleta | Tg anormalmente elevada (o anti-Tg en aumento) en ausencia de enfermedad localizable |
| Estructural incompleta | Enfermedad persistente o metástasis locorregionales o a distancia persistentes o nuevas (con o sin Tg o anti-Tg anormales) |
Debemos distinguir entre pacientes con bajo riesgo de mortalidad y pacientes con bajo riesgo de recidiva o persistencia. Se considerarán pacientes de bajo riesgo de mortalidad los incluidos en los estadios I y II de la clasificación de la AJCC/UICC20 en ausencia de metástasis a distancia. Estos pacientes presentan a los 5 años una supervivencia de prácticamente el 100% y, a los 10 años, superior al 98%24,25.
Se considerarán pacientes de bajo riesgo de persistencia y recidiva los que cumplan todos los criterios siguientes: ausencia de metástasis locales o a distancia, resección completa macroscópica de todos los tumores, ausencia de invasión tumoral de estructuras o tejidos locorregionales, ausencia de histología agresiva (carcinoma papilar de células altas, columnares o variante esclerosante difusa, o elementos pobremente diferenciados) o de invasión vascular y, en el caso de que se haya administrado RI, ausencia de captación de RI fuera del lecho tiroideo en el primer rastreo corporal total después del tratamiento. Esta categorización de los pacientes es útil desde el punto de vista clínico, ya que en aquellos incluidos en la categoría de riesgo bajo de recidiva la enfermedad reaparece en el 3%, mientras que este riesgo es del 21 y del 68% para los pacientes de riesgo intermedio o elevado, respectivamente22.
Para la estratificación dinámica del riesgo se considerará como pacientes de bajo riesgo a aquellos que cumplan los criterios de respuesta excelente al tratamiento, si bien muchos de los pacientes que cumplen los criterios de respuesta indeterminada presentarán una evolución favorable. En concreto, los pacientes con respuesta excelente presentan un riesgo de recidiva de solo 1-4% a 10 años26,27. De los pacientes con respuesta indeterminada solo un 15-20% evolucionan hacia una respuesta bioquímica o estructural incompleta26,27.
Recomendaciones- 1.
Para la estimación del riesgo de mortalidad recomendamos utilizar la clasificación TNM (7.ª edición) de la AJCC/UICC20 (tabla 1).
- 2.
Para la estimación del riesgo de recidiva recomendamos utilizar los criterios de la ATA y la BTA (tabla 2).
- 3.
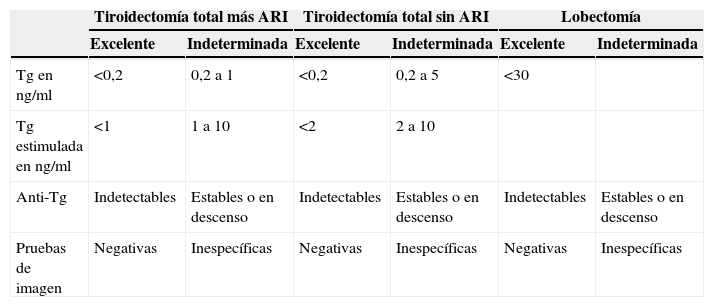
Recomendamos también una estratificación dinámica del riesgo que valore la respuesta al tratamiento dentro de los 2 primeros años tras la cirugía inicial (tabla 3). Dado que muchos de los pacientes inicialmente clasificados como de bajo riesgo no serán tratados mediante una ablación con RI (ARI) ni con tiroidectomía total, recomendamos utilizar los criterios que figuran en la tabla 422,26,28,29 para pacientes tratados con tiroidectomía total (con y sin ARI) o con hemitiroidectomía.
Tabla 4.Criterios de clasificación en respuesta al tratamiento excelente o indeterminada en pacientes con carcinoma diferenciado de tiroides tratados mediante tiroidectomía total (con o sin ablación con radiodoyo) y lobectomía
Tiroidectomía total más ARI Tiroidectomía total sin ARI Lobectomía Excelente Indeterminada Excelente Indeterminada Excelente Indeterminada Tg en ng/ml <0,2 0,2 a 1 <0,2 0,2 a 5 <30 Tg estimulada en ng/ml <1 1 a 10 <2 2 a 10 Anti-Tg Indetectables Estables o en descenso Indetectables Estables o en descenso Indetectables Estables o en descenso Pruebas de imagen Negativas Inespecíficas Negativas Inespecíficas Negativas Inespecíficas
Incluso los tumores de menor riesgo como los microcarcinomas papilares (MCPT) pueden presentar algunas características que ensombrezcan el pronóstico y aumenten la probabilidad de persistencia o recidiva30–33, por lo que se hace preciso considerar también algunos de estos factores modificantes del riesgo inicial, tales como edad, sexo, tamaño tumoral, multifocalidad, afectación ganglionar, algunas mutaciones somáticas y la concentración de tiroglobulina (Tg) posquirúrgica. Un metaanálisis de más de 4.000 pacientes con carcinoma papilar de tiroides (CPT) de ≤ 1cm indicó que el 28% de estos tumores tenían metástasis ganglionares, el 0,6% tenían metástasis a distancia, el 3,3% experimentó recidiva de la enfermedad y la mortalidad relacionada con el tumor fue de un 0,3%34. Estos datos indican que la mayoría de los CDT clasificados como de riesgo bajo son inocuos y que solo unos pocos pueden tener un comportamiento agresivo.
En la tabla 518,26,31,33,35–40 aparece una descripción de los principales factores modificantes del riesgo inicial que deben tenerse en cuenta a la hora de tomar una decisión terapéutica individualizada. Cabe destacar que en los últimos años se han realizado grandes progresos en el conocimiento de los mecanismos moleculares del CDT, especialmente en lo que se refiere a la implicación de las vías MAPK y PI3KCA/AKT. Ello ha proporcionado una excelente oportunidad para la identificación de nuevos marcadores moleculares, tales como las mutaciones de los genes RAS, PI3KCA, PTEN, P53, ALK y BRAF, que resultan útiles para establecer el pronóstico de un paciente individual41. En concreto, la mutación BRAFV600E es un marcador que podría mejorar la estratificación pronóstica en pacientes con CPT. Algunos estudios39,40, aunque no todos42,43 han asociado la presencia de la mutación BRAFV600E con metástasis linfáticas, extensión extratiroidea y recidiva de la enfermedad; en suma, con un comportamiento biológico más agresivo, incluso en pacientes de bajo riesgo. Esta mutación se ha asociado también a pérdida de la afinidad por el RI en el CPT recidivado, lo que implica refractariedad al tratamiento con RI. Sin embargo, la mutación BRAFV600E se ha descrito en un 24-63% de pacientes con MCPT y es improbable que todos ellos tengan un comportamiento agresivo, por lo que la presencia de esta mutación no es un predictor absoluto, sino que debe evaluarse en conjunción con otras características histopatológicas y clínicas para la estratificación del riesgo44. Un reciente estudio ha mostrado que los pacientes con carcinoma papilar en los que coexiste la mutación BRAFV600E junto con la recientemente identificada mutación C228T del promotor TERT presentan peores características clinicopatológicas, junto con una tasa de recidivas significativamente mayor45. Sin embargo, no se han corroborado todavía estos datos en pacientes con microcarcinomas45,46.
Factores modificantes del riesgo de recidiva en pacientes con microcarcinoma pilar de tiroides
| Factor | Descripción | Referencia |
|---|---|---|
| Edad | Los pacientes<45 años tienen MCPT de mayor tamaño, más extensión extratiroidea y metástasis linfáticas y mayor probabilidad de recidiva | Malandrino et al., 201333Pedrazzini et al., 201235 |
| Sexo | Los varones tienen mayor probabilidad de metástasis linfáticas y recidiva tumoral | Kim et al., 200836Zhang et al., 201237 |
| Tamaño tumoral | 7-10mm: mayor probabilidad de metástasis centrales, extensión extratiroidea y multifocalidad | Lee et al., 201138Mercante et al., 200931Malandrino et al., 201333Zhang et al., 201237 |
| Multifocalidad | No se considera FRR si todos los focos son <10mm | Cooper et al., 200918 |
| Metástasis linfáticas | Se relaciona con la recidiva tumoral | Mercante et al., 200931Pedrazzini et al., 201235 |
| Mutación BRAFV600E | Algunos estudios la asocian a metástasis linfáticas, extensión extratiroidea y recidiva (especialmente la coexistencia de mutación BRAFV600E con la mutación TERTC228T) | Xing et al., 201339Elisei et al., 201240Xing et al., 201445 |
| Tg estimulada posquirúrgica | La concentración de Tg estimulada posquirúrgica, antes de ARI, <2, de 2 a 10 y >10ng/ml se acompañan de un riesgo de recidiva del 1-3, 2-8 y >20%, respectivamente | Momesso y Tuttle, 201426 |
ARI: ablación posquirúrgica con radioyodo; FRR: factor de riesgo de recidiva; MCPT: microcarcinoma papilar de tiroides; Tg: tiroglobulina.
El manejo del MCPT puede suponer un dilema, ya que es prioritario evitar tratamientos agresivos y costes innecesarios y, por otro lado, hay que reconocer los tumores con mayor riesgo de recidiva o metástasis. La baja agresividad de estas neoplasias quedó patente en un estudio de 230 pacientes con MCPT en el que se siguió su evolución durante 5 años sin realizar tratamiento quirúrgico de ningún tipo. Al cabo de este tiempo se detectó crecimiento solo en un 7,3% y aparición de adenopatías en un 1,3% de los pacientes47. En otro estudio, los porcentajes de crecimiento a los 5 y 10 años fueron del 6,4 y 15,9%, respectivamente, y los de aparición de adenopatías de 1,4 y 3,4%, respectivamente48.
Es importante conocer las diferentes situaciones en las que puede aparecer el MCPT19: 1) con tiroides presente, la punción-aspiración con aguja fina (PAAF) de una lesión < 1cm se informa como diagnóstica de CPT; 2) tras una hemitiroidectomía realizada por otro motivo (por ejemplo un nódulo con citología de proliferación folicular) se observan uno o más focos de MCPT; y 3) tras realizar una tiroidectomía total o casi total por otro motivo (enfermedad de Graves, bocio multinodular) se encuentran uno o más focos de MCPT.
También es imprescindible valorar los factores de riesgo de recidiva19, tales como la presentación no incidental o el hallazgo en tomografía de emisión de positrones realizada por otro motivo. En cuanto a las características histológicas se consideran como factores de riesgo las siguientes: 1) mayor tamaño (6-10mm); 2) CPT multifocal o bilateral; 3) extensión extratiroidea; 4) componente de carcinoma pobremente diferenciado; y (5) fibrosis desmoplástica o patrón infiltrativo.
La presencia de anticuerpos antitiroglobulina (anti-Tg) interfiere con la determinación de Tg y su tendencia durante el seguimiento podría utilizarse como marcador subrogado de Tg49. El manejo y estudio de los pacientes en los que los anticuerpos anti-Tg son positivos puede suponer todo un reto, ya que a menudo no se puede conocer con certeza el estado de la enfermedad18. Probablemente su presencia es un parámetro a tener en cuenta a la hora de tomar decisiones en el seguimiento.
Tratamiento quirúrgicoLas recomendaciones acerca del tipo de tratamiento quirúrgico en los pacientes con MPTC han variado a lo largo del tiempo. Según un metaanálisis de 44 estudios, que incluyó a 9.259 pacientes, se realizó tiroidectomía total o casi total en el 72%, tiroidectomía subtotal en el 11% y lobectomía en el 17% de los casos50. La disección ganglionar terapéutica se realizó en el 9,8% de los casos, mientras que la disección profiláctica se llevó a cabo en el 55,7% de los pacientes50. Aunque la guía de la ATA18 recomienda tiroidectomía total en tumores > 1cm, no especifica la actitud en MCPT. En la decisión quirúrgica deben tenerse en cuenta los factores modificantes del riesgo ya mencionados (tabla 5), así como la presencia de antecedentes familiares de carcinoma tiroideo o de irradiación cervical en la infancia. En la guía de la BTA no se especifica si el antecedente de irradiación cervical cambia la amplitud de la cirugía en el MCPT unifocal. Sin embargo, la guía del National Comprehensive Cancer Network (NCCN) afirma que la lobectomía estaría indicada en pacientes sin historia de irradiación cervical y en ausencia de otros factores de riesgo51, con lo que recomendarían tiroidectomía total si hubiese dicho antecedente.
Recomendaciones- 1.
En un paciente que carece de factores de riesgo, como el antecedente de radioterapia cervical, en el que se encuentra un MCPT unifocal, debería realizarse lobectomía. No existe recomendación específica para los pacientes con MCPT que tengan antecedentes de radioterapia cervical. Probablemente la mayor frecuencia de multifocalidad y el antecedente en sí mismo hagan conveniente la tiroidectomía total en estos casos.
- 2.
Se realizará tiroidectomía total en casos de multifocalidad y en pacientes con antecedente familiar de carcinoma tiroideo no medular.
- 3.
En todos los demás casos se tomará la decisión de la amplitud de la cirugía en función de los factores de riesgo existentes.
- 4.
Cuando existan adenopatías en el momento del diagnóstico se realizará tiroidectomía total y linfadenectomía del compartimento afecto.
- 5.
En pacientes con MCPT multifocal podría plantearse la disección profiláctica del compartimento central. Sin embargo, ya que no se reduce la probabilidad de recidiva a corto plazo, y teniendo en cuenta las posibles complicaciones, debería valorarse estrechamente la relación riesgo beneficio y tomarse una decisión individualizada.
- 6.
Tras una hemitiroidectomía realizada por otro motivo (por ejemplo un nódulo con citología de proliferación folicular) si se observara un MCPT multifocal sería conveniente ampliar la tiroidectomía. La no visualización de nódulos en el resto tiroideo por ecografía no excluye la presencia de focos de pequeño tamaño.
- 7.
Si se encontrasen uno o más focos tras realizar una tiroidectomía total o casi total por otro motivo (enfermedad de Graves, bocio multinodular), sería necesario valorar la indicación o no de ARI.
En las guías de la BTA no se recomienda ARI en pacientes con T1, en los que se incluirían todos los MCPT salvo aquellos que tuvieran mínima extensión extratiroidea (T3). En cuanto a estos últimos, recomiendan un uso selectivo de RI considerando que existe insuficiente evidencia para recomendarlo o desaconsejarlo19. En el MCPT se ha utilizado tratamiento con RI de forma variable. En el metaanálisis de Roti et al.50 se encontró que habían sido tratados con RI un 17% de los pacientes.
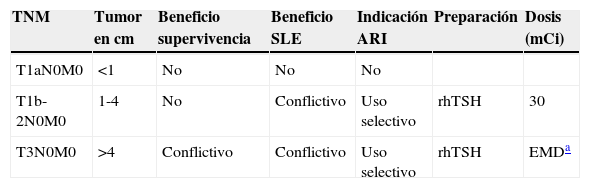
En MCPT sin evidencia de metástasis a distancia, la preparación para la ARI debiera realizarse con TSH humana recombinante (rhTSH). Esta preparación se recomienda en pacientes con T1-T3, N0, Nx o N1 y M019. El metaanálisis de Cheng et al.52 concluyó que una dosis de 30 mCi es suficiente para la ablación tiroidea en comparación con la dosis de 100 mCi, con similar calidad de vida, menos efectos secundarios y una estancia más corta en la unidad de radioprotección. Por tanto, esta dosis debiera recomendarse en todos los pacientes sin evidencia de metástasis. Un resumen de las recomendaciones generales para la ARI en pacientes de bajo riesgo aparece en la tabla 617,53,54.
Recomendaciones generales para la ablación posquirúrgica con radioyodo en pacientes con carcinoma diferenciado de tiroides de bajo riesgo
| TNM | Tumor en cm | Beneficio supervivencia | Beneficio SLE | Indicación ARI | Preparación | Dosis (mCi) |
|---|---|---|---|---|---|---|
| T1aN0M0 | <1 | No | No | No | ||
| T1b-2N0M0 | 1-4 | No | Conflictivo | Uso selectivo | rhTSH | 30 |
| T3N0M0 | >4 | Conflictivo | Conflictivo | Uso selectivo | rhTSH | EMDa |
- 1.
La ARI en MCPT no estaría indicada en T1. En los MCPT con mínima extensión extratiroidea (T3) sería conveniente realizar una decisión personalizada. Se recomienda ARI en los casos con afectación ganglionar o metástasis a distancia.
- 2.
Como preparación para la ARI se recomienda rhTSH en todos los casos en los que no existan metástasis a distancia.
- 3.
La dosis de 30 mCi es suficiente para la ablación tiroidea en pacientes con MCPT.
En pacientes a los que no se ha administrado ARI no es necesaria la supresión de TSH19. En estos casos se recomienda mantener el nivel de TSH entre 0,3 y 2 mU/l. En los casos con tiroidectomía total más ARI debería mantenerse la TSH por debajo de 0,1 mU/l hasta a la evaluación de la respuesta a los 9-12 meses. En este tiempo debe reevaluarse la posibilidad de recidiva de acuerdo con los criterios de la estratificación dinámica del riesgo (tabla 3) y ajustar el nivel de TSH en función de los resultados. En pacientes con respuesta incompleta debería mantenerse la TSH suprimida por debajo de 0,1 mU/l indefinidamente, salvo contraindicación. En pacientes con respuesta indeterminada se recomienda mantener la TSH entre 0,1 y 0,5 mU/l durante 5-10 años, en que debería valorarse reducir la supresión de TSH en función de datos clínicos, bioquímicos y radiológicas de respuesta. En pacientes con respuesta completa, un valor entre 0,3 y 2 mU/l es adecuado. En pacientes históricos en los que no se hubiera realizado evaluación de la respuesta se mantendrá la supresión entre 5 y 10 años. El grado de supresión deberá ajustarse según la respuesta clínica, bioquímica y radiológica19.
En un grupo de 51 pacientes no tratados mediante cirugía en los que se utilizó tratamiento supresor de TSH solo se observó progresión en uno de ellos48. Sin embargo, en otro estudio los niveles de TSH no se correlacionaron con la progresión del MCPT55. Si el mantenimiento de los niveles de TSH en el límite bajo de la normalidad evita la progresión en los pacientes en los que se realiza seguimiento únicamente mediante observación, es una pregunta sin respuesta por el momento56.
Recomendaciones- 1.
El tratamiento supresor de TSH no está indicado en pacientes en los que no se ha realizado ARI. En estos casos, y también en los que se haya decidido no realizar tratamiento quirúrgico y mantener una actitud expectante, se recomienda mantener un valor de TSH entre 0,3 y 2 mU/l.
- 2.
En pacientes tratados mediante ARI se mantendrán inicialmente valores de TSH por debajo de 0,1 mU/l. A los 9-12 meses del tratamiento debe evaluarse la respuesta según los criterios de la estratificación dinámica de riesgo. En pacientes con respuesta completa se mantendrán valores de TSH entre 0,3 y 2 mU/l. Si la respuesta fuera incompleta se mantendrán valores de TSH suprimidos por debajo de 0,1 mU/ml indefinidamente. Si existiera una resepuesta indeterminada se mantendrá la TSH entre 0,1 y 0,5 mU/l, y se evaluará a los 5-10 años si es preciso disminuir el grado de supresión en función de la respuesta.
Los pacientes con MCPT unifocal tratados mediante lobectomía tienen un riesgo de recidiva < 2,5% y un riesgo de metástasis a distancia < 0,4%19. El riesgo de hipotiroidismo tras lobectomía puede ser superior al 15%, por lo que debe evaluarse la función tiroidea anualmente. Estos pacientes no requieren seguimiento especializado y pueden enviarse para revisiones por su médico de Atención Primaria19. En pacientes con MCPT y factores de riesgo adicionales, el seguimiento viene condicionado por la evaluación del tipo de respuesta al tratamiento.
Recomendaciones- 1.
En pacientes con MCPT unifocal a los que se ha realizado hemitiroidectomía se recomienda evaluar anualmente la función tiroidea y realizar exploración física cervical.
- 2.
En pacientes con MCPT y factores de riesgo adicionales el seguimiento viene condicionado por la evaluación del tipo de respuesta, siguiendo los criterios de la estratificación dinámica de riesgo.
- 3.
La presencia de mutación BRAFV600E, no es un predictor absoluto de comportamiento más agresivo del tumor, sino que debe evaluarse en conjunción con otras características histopatológicas y clínicas para la estratificación del riesgo. Por el momento, no existen recomendaciones para el estudio sistemático de la presencia de esta mutación en todos los casos.
Se consideran tumores de bajo riesgo los CPT intratiroideos con tamaño de 1,1 a 4cm, sin invasión microscópica en los tejidos peritiroideos, sin histología agresiva y sin datos de afectación ganglionar ni metástasis a distancia.
Tratamiento quirúrgicoLa tiroidectomía total es recomendable en todos los tumores mayores de 1 cm18. Sin embargo, es preciso considerar la morbilidad asociada a la tiroidectomía y el bajo riesgo de recidiva de estos tumores. En un estudio de 465 pacientes menores de 45 años, con carcinomas de bajo riesgo, no se encontraron diferencias entre los tratados mediante tiroidectomía total y los tratados con lobectomía durante un seguimiento de 20 años57. En otro estudio de 1.656 pacientes de bajo riesgo, con un seguimiento medio de 16 años, la supervivencia fue similar con ambos tipos de tratamiento. Sin embargo, se halló una tasa mayor de recidiva en los tratados mediante lobectomía58.
Los datos del National Cancer Data Base (NCDB) y del Surveillance, Epidemiology, and End Results (SEER) no mostraron diferencias en la supervivencia de 26.371 pacientes menores de 45 años, con tumores papilares de 1,1-4cm, sin factores de riesgo, tratados mediante tiroidectomía total y 3.151 pacientes tratados mediante lobectomía entre 1998 y 200659. En la guía de la BTA ya se considera que está poco clara la posible ventaja de la tiroidectomía frente a la hemitiroidectomía en pacientes menores de 45 años con tumores unifocales mayores de 1cm y menores de 4, sin extensión extratiroidea ni otros factores de riesgo. En estos casos recomiendan una decisión personalizada19.
Ablación con radioyodoDiversas guías recomiendan un uso selectivo de ARI en pacientes con tumores de 1,1 a 4cm. La presencia de adenopatías documentadas o de otros factores de riesgo, tales como la edad, tamaño tumoral o histología agresiva, predicen un riesgo más elevado de recidiva o de mortalidad, por lo que inclinan la decisión hacia la administración de ARI18. En la reciente guía de la BTA se recomienda un uso selectivo del RI en tumores de 1 a 4cm intratiroideos, ya que existen datos discordantes o inadecuados que puedan definir a favor o en contra de su uso19.
Recomendaciones- 1.
En carcinomas papilares intratiroideos de 1,1 a 4,0cm debe individualizarse la realización de lobectomía o tiroidectomía total.
- 2.
En carcinomas intratiroideos de 1,1 a 4,0cm no existe una recomendación absoluta de ARI y debiera realizarse un uso selectivo.
- 3.
En los casos en los que se realice ARI por la presencia de factores de riesgo se recomienda decidir dosis en un equipo multidisciplinar.
- 4.
En los casos en los que se realice ARI, las recomendaciones para tratamiento supresor y seguimiento son las mismas que en el MCPT.
El carcinoma folicular de tiroides (CFT) se define como un tumor maligno de estirpe epitelial que muestra diferenciación folicular sin las características nucleares clásicas del CPT60. Su malignidad está relacionada con la invasión capsular y vascular. El CFT está considerado en general como más agresivo que el CPT, aunque diversos estudios muestran que ambos tienen un pronóstico similar61,62. Los CFT se clasifican en: a) mínimamente invasivos sin invasión vascular, b) mínimamente invasivos con angioinvasión y c) ampliamente invasivos. La constatación de un único foco inequívoco de invasión vascular confirma el diagnóstico de angioinvasión63. El carcinoma folicular mínimamente invasivo (CFTMI) sin angioinvasión es un tumor que aparece completamente encapsulado y que se caracteriza histológicamente por la penetración microscópica de la cápsula del tumor, pero sin invasión vascular18,64–67. Su tasa de mortalidad específica varía del 0 al 11%68–72 y las recidivas y metástasis a distancia se presentan en un porcentaje bajo de pacientes70.
La edad al diagnóstico menor de 45 años es un factor predictor de buena respuesta al tratamiento, menor riesgo de metástasis y mejor supervivencia68,70,73,74. Los diferentes estudios no muestran diferencias significativas en cuanto al sexo75. La supervivencia causa-específica y la supervivencia libre de metástasis son peores en pacientes con tamaño tumoral ≥ 4 cm68,70,73,74,76. La tasa de mortalidad específica a 10 años en tumores foliculares con invasión capsular únicamente fue del 0%, mientras que ascendió a un 28% en pacientes con invasión vascular64. Esta diferencia ha sido corroborada por otros autores77,78. El compromiso de los ganglios linfáticos es poco frecuente en pacientes con CFT (3-15%) y no afecta al pronóstico del CFTMI75. La presencia de metástasis a distancia, infrecuente en pacientes con CFTMI, es el más importante predictor de mortalidad y se relaciona con invasión vascular70,74.
Tratamiento quirúrgicoAlgunos autores proponen que la lobectomía más istmectomía puede ser suficiente en pacientes con CFTMI, mientras que otros aconsejan la realización de tiroidectomía total. En un estudio observacional de 1.200 pacientes con CFTMI entre 2000 y 2009, solo 6 (0,5%) desarrollaron metástasis a distancia, lo que demuestra un bajo potencial de malignidad. No se encontraron diferencias significativas en la supervivencia entre pacientes a los que se les realizó tiroidectomía total o parcial como primera línea de tratamiento. El tratamiento con RI tampoco tuvo impacto en la supervivencia72. Los pacientes con tumores < 4cm, en ausencia de otros factores de riesgo (edad > 45 años, ampliamente invasivo, metástasis linfáticas o a distancia, angioinvasión), parecen presentar un pronóstico excelente70,72 y podrían ser tratados con lobectomía más itsmectomía. Sin embargo, Asari74 recomienda la realización de tiroidectomía total en pacientes con CFTMI debido a la presencia de metástasis a distancia al diagnóstico en el 14% de los casos. En un estudio reciente de 324 pacientes con CFTMI diagnosticados entre 1989 y 2010 se compara la evolución de los pacientes tratados mediante tiroidectomía total y los tratados mediante lobectomía. Aunque no hubo diferencias en el pronóstico, ningún paciente tratado con tiroidectomía total falleció a causa del tumor79.
El diagnóstico de CFTMI se obtiene en la mayoría de las ocasiones tras la lobectomía realizada en pacientes con citología indeterminada18. La tiroidectomía total está indicada en pacientes con tumores de más de 4cm o atipias acusadas en la citología, pacientes con antecedentes personales de radiación o antecedentes familiares de cáncer de tiroides. En caso de enfermedad nodular bilateral, o en pacientes que prefieren evitar una segunda cirugía, también estaría indicada la tiroidectomía total18.
Las guías de la BTA19, en un apartado específico para CFT, realizan similares recomendaciones con la diferencia de que a los pacientes con tumores menores de 4cm en ausencia de otros factores de riesgo (edad > 45 años, ampliamente invasivo, metástasis linfáticas o a distancia, angioinvasión, extensión extratiroidea), se les puede realizar una lobectomía más istmectomía, con una decisión personalizada. Dado que las metástasis linfáticas son infrecuentes, no se recomienda linfadenectomía central profiláctica.
Recomendaciones- 1.
El diagnóstico histológico de CFTMI debe confirmarse de forma inequívoca, ya que las características histológicas son predictoras del pronóstico. La invasión vascular confiere un pronóstico desfavorable.
- 2.
En los pacientes con CFTMI con invasión capsular exclusivamente, menores de 45 años, con tumores de menos de 4cm, y sin afectación ganglionar cervical o metástasis a distancia, puede no completarse la tiroidectomía, aunque la evidencia científica no apoya de forma contundente esta actitud y conlleva dificultad de seguimiento posterior mediante determinación de Tg.
- 3.
En los pacientes que reúnan alguna de las siguientes características: edad ≥ 45 años, con tumores ≥ 4cm, invasión vascular, afectación ganglionar o metástasis a distancia, debe realizarse tiroidectomía total.
- 4.
No se recomienda realizar linfadenectomía central profiláctica de forma rutinaria.
Los resultados de 2 estudios aleatorizados han mostrado similar eficacia de la ARI con dosis de 30 o de 100 mCi en pacientes de bajo riesgo80,81. Sin embargo, algunos autores destacan que las recidivas del CDT pueden ocurrir muchos años después del tratamiento inicial y que la mayoría de los estudios publicados tienen un periodo de seguimiento insuficiente para valorar el pronóstico a largo plazo de los pacientes de bajo riesgo tratados sin ARI o con bajas dosis de RI82.
La ARI es recomendable en los pacientes con tumores de más de 4cm, con extensión extratiroidea independientemente del tamaño o con metástasis a distancia18. La indicación es selectiva para pacientes con tumores entre 1 y 4cm, intratiroideos, en los que se ha documentado la existencia de afectación ganglionar u otras características de alto riesgo (edad, ampliamente invasivos o histología desfavorable). La preparación mediante rhTSH es adecuada en estos casos19. No se recomienda ARI para pacientes con tumores < 1cm, sin otras características de riesgo (tabla 6).
Recomendaciones- 1.
No debe realizarse ARI en pacientes tratados mediante lobectomía más istmectomía.
- 2.
No se recomienda ARI en pacientes con CTFMI < 1cm, intratiroideos, sin invasión vascular.
- 3.
La ARI está indicada en pacientes ≥ 45 años, con tumores ≥ 4cm, existencia de invasión vascular, afectación ganglionar o metástasis a distancia. Si sobreviene la recidiva en el seguimiento, está indicado el tratamiento con RI.
- 4.
En los pacientes con CFTMI, con tumores entre 1 y 4cm se recomienda el uso selectivo de ARI según los factores de riesgo asociados.
Para el tratamiento supresor de TSH en pacientes con CFTMI son válidas las mismas recomendaciones que se recogen en el apartado de MCPT. La supresión de la TSH no es necesaria en pacientes que no han recibido ARI. Cuando se administra ARI se mantendrá inicialmente una TSH < 0,1 mU/l durante 9-12 meses. Si el paciente alcanza una respuesta completa, se mantendrá la TSH entre 0,3 y 2 mU/l, mientras que si la respuesta es incompleta, se mantendrá TSH<0,1 mU/l indefinidamente. En los casos de respuesta indeterminada se mantendrá la TSH entre 0,1 y 0,5 mU/l durante los primeros 5-10 años, con reevaluación posterior de la respuesta18,19,22,83.
SeguimientoEl seguimiento de los pacientes tratados con tiroidectomía total más ARI debe basarse en la determinación de Tg bajo tratamiento con tiroxina, anticuerpos anti-Tg y en la realización de ecografías cervicales. La determinación de Tg estimulada con rhTSH, debe realizarse a los 9-12 meses del tratamiento inicial para valorar la respuesta y constituye un excelente predictor de remisión18,19. En pacientes con respuesta excelente (tabla 4) y, por tanto, libres de enfermedad, la necesidad de realizar posteriores determinaciones de Tg estimulada no está establecida. Sin embargo, una nueva determinación a los 3-5 años puede asegurar la remisión84. La cuantificación de Tg de alta sensibilidad (sensibilidad funcional de 0,1ng/ml) puede reducir la necesidad de medir la Tg estimulada como se comenta más adelante85. Hay datos convincentes en la literatura de que una Tg estimulada > 2ng/ml es altamente sensible para identificar a los pacientes con tumor persistente86. Una concentración de Tg basal o estimulada en ascenso o la positivización de los anticuerpos anti-Tg previamente negativos son indicativas de presencia de enfermedad.
La ecografía cervical es muy sensible para detectar recidiva o metástasis ganglionares en pacientes con CDT. Para pacientes de bajo riesgo, la European Thyroid Association recomienda la realización de una ecografía al año del tratamiento inicial. Si esta es normal y la Tg estimulada es indetectable, no es necesario realizar ecografías anuales, aunque es recomendable una ecografía a los 5-7 años del tratamiento inicial87. La BTA19 señala que los pacientes de bajo riesgo y libres de enfermedad no precisan seguimiento por unidades multidisciplinares de cáncer de tiroides a partir de los 5 años, y que pueden continuar el control en Atención Primaria con un protocolo bien definido.
Recomendaciones- 1.
En pacientes con CFTMI tratados mediante tiroidectomía total más ARI debe realizarse una determinación de Tg estimulada, junto con anticuerpos anti-Tg más ecografía cervical a los 9-12 meses del tratamiento inicial.
- 2.
En pacientes sin enfermedad recomendamos realizar determinación de Tg bajo tratamiento con tiroxina anualmente. La ecografía puede realizarse cada 2-3 años.
- 3.
No se recomienda la realización de rastreos corporales con RI sistemáticos, en ausencia de enfermedad, en pacientes con un rastreo corporal total negativo después de haber recibido ARI.
Todos los tumores foliculares diferentes del CFTMI son considerados de alto riesgo. El carcinoma folicular ampliamente invasivo se caracteriza por invasión capsular y vascular intensa, e invasión de los tejidos extratiroideo, necrosis o mitosis66. Suele tener mayor tamaño que el CFTMI, la edad de los pacientes al diagnóstico suele ser mayor, el estadio más avanzado, con mayor afectación ganglionar cervical y mayor porcentaje de pacientes con metástasis a distancia. La tasa de mortalidad específica a los 10 años varía entre el 30 y el 50%68,73,74,76.
El carcinoma folicular variante oncocítica (células de Hürthle) supone el 2-5% de los cánceres tiroideos. Es un tumor más agresivo, con frecuencia refractario a RI y con mayor riesgo de recidiva y metástasis88. Si el resultado de una PAAF es compatible con un tumor de células de Hürthle se debe realizar una lobectomía e istmectomía. Si el resultado final indica un carcinoma de células de Hürthle, se debe completar la tiroidectomía y realizar ARI.
Recomendaciones- 1.
En pacientes con diagnóstico de CFT distinto de CFTMI se recomienda tiroidectomía total más ARI y estrecha vigilancia por presentar un pronóstico más desfavorable.
Aunque la mayor parte de los CDT metastatizan en primer lugar en los ganglios linfáticos del cuello89, el impacto real de la afectación ganglionar sobre la mortalidad está en constante debate. No existen datos concluyentes que demuestren el beneficio de una disección cervical central para la enfermedad subclínica, es decir, cuando no es evidente la afectación ganglionar a la palpación ni por medios ecográficos, aunque existan micrometástasis y una eventual disección quirúrgica la demostrara posteriormente. Tampoco está claro que el tratamiento con RI reduzca la posibilidad de metástasis ganglionares. Cuando estas no se detectan pre- ni postoperatoriamente, clasificamos la enfermedad como N0.
Varios estudios recientes han mostrado el impacto de la ecografía preoperatoria en pacientes con carcinoma de tiroides clínicamente N0. En un análisis retrospectivo de 702 pacientes con ecografía preoperatoria se detectaron 231 (32,9%) casos con metástasis ganglionares no identificadas por palpación90, lo que alteró el procedimiento quirúrgico realizado. Otro estudio de 465 pacientes comparó los resultados de pacientes con y sin evaluación ecográfica preoperatoria. En el primero de los grupos se realizaron más linfadenectomías cervicales laterales (13,2 vs. 0,9%) y los resultados fueron más favorables en lo que se refiere a respuesta al tratamiento, con menor probabilidad de recidiva, de respuesta incompleta y con menor número de reintervenciones91.
Recomendaciones- 1.
Debe realizarse una evaluación ecográfica preoperatoria en todos los pacientes diagnosticados de cáncer tiroideo o de nódulos sospechosos con la finalidad de conocer si existe extensión extratiroidea local o ganglionar y determinar el tipo y extensión de la cirugía.
- 2.
Cuando se sospeche afectación del compartimento central o mediastínico puede realizarse una tomografía computarizada o una resonancia magnética (RM).
La ecografía no puede detectar bien las adenopatías en el compartimento central, y la decisión de realizar una linfadenectomía profiláctica continúa en debate. En un intento de mejorar la toma de decisiones en estos pacientes se han utilizado diversos marcadores moleculares40,92–94 con resultados contradictorios. Elisei et al.40 encontraron la mutación BRAFV600E en 106 pacientes de un grupo de 319 con CPT de bajo riesgo (T1-T2, N0, M0) y este hallazgo se correlacionó con la multifocalidad, agresividad histológica, infiltración capsular, mayor dosis de RI y persistencia de la enfermedad en estos pacientes tras 5 años de seguimiento40. Resultados similares fueron obtenidos por Pelizzo et al.94 en una serie de 226 carcinomas papilares intratiroideos entre los que 104 fueron BRAFV600E positivos en el estudio citológico previo a la cirugía. Como se comentó previamente, no todos los estudios apoyan el valor de la mutación BRAFV600E y varios estudios ponen en duda sus ventajas como factor pronóstico único. A medida que las pruebas moleculares sean validadas en la práctica clínica, los endocrinólogos deberán tenerlas en cuenta, ya que se espera que el uso creciente de estas técnicas sea beneficioso en la estadificación y elaboración de plan terapéutico de los pacientes con cáncer de tiroides de bajo riesgo.
Recomendaciones- 1.
A pesar de los resultados prometedores de los nuevos marcadores moleculares, todavía las decisiones clínicas deben basarse en parámetros clínicos y en los sistemas actuales de estadificación de riesgo de mortalidad y recidiva.
En la mayoría de los estudios no se han demostrado ventajas de la disección profiláctica del compartimento central sobre la tasa de recidivas o mortalidad en el paciente clínica y ecográficamente N095–97. Se ha propuesto que metástasis no visibles (la mayoría micrometástasis) podrían ser responsables de la recidiva ganglionar en algunos de estos pacientes98–100, lo que sucede en un porcentaje muy bajo de ellos, en torno al 2-4%101,102.
Un metaanálisis que incluyó a 1.264 pacientes no evidenció diferencias en el riesgo de recidiva en pacientes con tiroidectomía total o con tiroidectomía total más vaciamiento profiláctico central95. Otro estudio reciente, que incluyó a 916 pacientes clínicamente N0, detectó metástasis ocultas en el compartimento central en el 52% de los casos y encontró asociación significativa de esta afectación con el tamaño (>1,5cm), invasión capsular, edad < 35 años y localización tumoral en la mitad superior del tiroides103. En general, la presencia de extensión extracapsular, edad < 45 años y un tamaño tumoral>1,5-2cm se consideran factores de riesgo de metástasis ganglionares centrales73,104–107. No obstante, no se ha demostrado que la exéresis profiláctica del compartimento central tenga impacto sobre la supervivencia, pero sí se ha asociado a un mayor número de complicaciones, especialmente en el caso de cirujanos con bajo número de intervenciones tiroideas108,109.
Recomendaciones- 1.
En los pacientes que no pertenezcan a grupos de riesgo, sin evidencia de afectación linfática clínica ni ecográfica, no se recomienda el vaciamiento linfático profiláctico del compartimento central, salvo que existan hallazgos intraoperatorios que lo aconsejen.
- 2.
Esta recomendación es especialmente válida para aquellos tumores T1 y puede ser discutida con el paciente en el caso de los T2, en aquellas unidades que cuenten con un cirujano experto.
Uno de los objetivos de la ARI es permitir la realización de rastreos diagnósticos postablación para detectar enfermedad locorregional y a distancia y aumentar la sensibilidad de la Tg sérica en el seguimiento. Estas ventajas se pierden en los pacientes no tratados mediante ARI. Sin embargo, los pacientes de riesgo bajo pueden seguirse con determinaciones seriadas de Tg durante el tratamiento con tiroxina y con ecografía tiroidea, ya que la mayoría de ellos no desarrollará complicaciones28.
Durante et al.110 estudiaron un grupo de 290 pacientes de bajo riesgo que no recibieron ARI. Al cabo de 5 años el 95% presentaba una Tg indetectable. En un subgrupo de 78 pacientes en los que se determinó la Tg de forma seriada con un análisis de alta sensibilidad se demostró que el 60% presentaba Tg indetectable (<0,2ng/ml) a los 6-12 meses, mientras que a los 5 años este porcentaje ascendió al 79%. Solo uno de los 290 pacientes experimentó recidiva y esta se asoció a un incremento gradual de los niveles de Tg110. Otros autores encontraron recidiva de la enfermedad en el 12,5% de los pacientes con CDT de bajo riesgo cuando la Tg no estimulada era superior a 0,15ng/ml, mientras que cuando este valor era inferior a 0,15ng/ml el riesgo de recidiva era mínimo111.
La vida media plasmática de la Tg oscila entre 1 y 6 días, pero sus niveles más bajos tras la cirugía no se alcanzan hasta pasadas unas 4 semanas112,113. La especificidad de la Tg en pacientes sin ARI se ve reducida durante el primer año, pero su valor se incrementa a medida que se progresa en el seguimiento. Las células residuales normales tienden a estabilizar o reducir su producción de Tg, mientras que esto no ocurre con las células neoplásicas. Por lo tanto, la tendencia ascendente o descendente de sus niveles adquiere un valor primordial. Un tiempo de duplicación de Tg inferior a un año se ha correlacionado con la supervivencia y la recidiva114.
El valor predictivo de la cuantificación de Tg de alta sensibilidad es muy elevado. Según un reciente metaanálisis85,115 un valor < 0,1ng/ml presenta un valor predictivo negativo de 97 a 99% para valores de Tg estimulada > 1 y > 2ng/ml, respectivamente. Sin embargo, el valor predictivo positivo es bajo, de 32 y 70%, respectivamente, para los valores mencionados. Por lo tanto los pacientes que presenten valores de Tg no estimulada indetectables, empleando ensayos de alta sensibilidad, no precisan la determinación de Tg estimulada, mientras que los pacientes con valores de Tg no estimulada detectables aunque bajos (entre 0,1 y 1ng/ml) precisan la determinación de Tg estimulada con rhTSH o tras la retirada de T4.
Recomendaciones- 1.
Los pacientes de bajo riesgo pueden seguirse con determinaciones seriadas de Tg durante el tratamiento con levotiroxina y con ecografías cervicales. La Tg de alta sensibilidad puede emplearse en el seguimiento de los pacientes con CDT tratados con tiroidectomía total sin ARI, ya que casi todos los pacientes sin persistencia ni recidiva de la enfermedad tendrán niveles bajos de Tg, con estabilidad o tendencia descendente.
- 2.
No es adecuado medir Tg antes de que pasen 6 semanas de la cirugía o 3 meses de un tratamiento con RI.
- 3.
Los pacientes con CDT de bajo riesgo con Tg no estimulada indetectable, medida mediante ensayo de alta sensibilidad, no precisan cuantificación de Tg estimulada. Los pacientes con un valor de Tg no estimulada entre 0,1 y 1ng/ml requieren al menos una determinación de Tg estimulada para valorar su situación.
- 4.
El valor diagnóstico de la Tg no estimulada aumenta en el seguimiento a largo plazo, ya que permite apreciar las tendencias en su producción. Por lo tanto, en fases tardías de seguimiento deben continuar vigilándose los niveles de Tg.
La ecografía tiroidea tiene el mismo valor en pacientes con o sin ARI, no requiere elevación de TSH y proporciona una información valiosa sobre la localización de la enfermedad. Varios estudios han demostrado que la ecografía es más sensible para la detección de metástasis linfáticas que la Tg estimulada o el rastreo con RI116,117. Estos estudios muestran que una ecografía negativa durante los primeros meses indica una probabilidad muy elevada de resultado favorable a largo plazo, incluso sin considerar los valores de Tg118.
El elevado valor predictivo negativo de la ecografía la hace especialmente útil en los pacientes de bajo riesgo que no han recibido ARI, sobre todo durante los primeros meses de seguimiento, ya que es entonces cuando los resultados de la Tg sérica son más difíciles de interpretar. Una ecografía negativa durante los primeros meses indica probabilidad cercana al 100% de resultado favorable a largo plazo, con independencia de la Tg sérica119. La sensibilidad de esta prueba puede aumentarse mediante la realización de citología por PAAF de los nódulos ecográficamente sospechosos116 y la cuantificación de la Tg en el líquido del lavado de la aguja18.
Recomendaciones- 1.
La ecografía es recomendable en pacientes que no han recibido ARI especialmente durante los primeros 1-2 años de seguimiento, cuando las cifras de Tg pueden tener menos valor y son más difíciles de interpretar. En los pacientes con ecografía negativa y Tg estimulada negativa durante los primeros 1-2 años de seguimiento no es necesaria la repetición rutinaria de ecografía. El seguimiento puede realizarse con cuantificación de Tg sérica.
- 2.
Si la ecografía detecta nódulos morfológicamente sospechosos, debe realizarse PAAF y análisis de Tg en el líquido del lavado.
La presencia de anti-Tg en el suero, incluso a bajas concentraciones, supone una interferencia analítica en la cuantificación de la concentración de Tg sérica, por lo que el valor de esta última como marcador tumoral se ve limitado. El título de anti-Tg debe cuantificarse en todas las determinaciones de Tg en los pacientes con CDT, empleando para ello el mismo espécimen de suero. En pacientes con anti-Tg el descenso del título de anticuerpos se considera indicador de curación de la enfermedad120. El rastreo corporal total diagnóstico puede emplearse para el seguimiento en estos pacientes. Como es lógico, el rastreo es más sensible en pacientes que han recibido ARI. Sin embargo, tras una tiroidectomía realizada por cirujanos expertos la captación en el lecho tiroideo suele ser baja (<2%) y este nivel de captación no suele impedir la visualización de metástasis a distancia en el caso de que se realice un rastreo diagnóstico121.
Recomendaciones- 1.
Si los pacientes presentan un título de anticuerpos anti-Tg positivos, recomendamos realizar el seguimiento mediante ecografías cervicales y rastreos diagnósticos. No obstante, puede emplearse la seriación del título de anticuerpos, como marcador subrogado de restos tiroideos o tumorales.
La incidencia anual del CDT se ha incrementado de forma evidente en las últimas décadas. Este aumento se debe al menos en parte a la mayor detección de tumores de bajo riesgo. En su manejo es imprescindible estimar el riesgo de mortalidad, de recidiva y utilizar la estratificación dinámica del riesgo para valorar la respuesta al tratamiento. En tumores de bajo riesgo es necesario diseñar protocolos de seguimiento y tratamiento en los que prime una baja agresividad terapéutica para el paciente y una estrategia de coste sostenible para los sistemas sanitarios. Sin embargo, es importante tener en cuenta que incluso los tumores de menor riesgo como los MCPT pueden presentar algunas características que ensombrezcan el pronóstico y aumenten la probabilidad de persistencia o recidiva de la enfermedad. Son necesarios más estudios que permitan conocer nuevos factores modificantes del riesgo y, sobre todo, marcadores moleculares, en células tumorales o circulantes, que pudieran determinar una mayor o menor amplitud del tratamiento quirúrgico, la necesidad o no de tratamiento con RI, la dosis a utilizar en su caso, así como disponer de herramientas con capacidad para anticipar fielmente el pronóstico individual de cada CDT que catalogamos como de bajo riesgo. También son necesarios más estudios que ayuden a determinar cómo realizar el seguimiento de CDT de bajo riesgo, evitando pruebas innecesarias sin disminuir la sensibilidad para detectar recidivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.