El cáncer de tiroides supone la primera causa de neoplasias del sistema endocrino. Recientemente hemos asistido a grandes avances en el conocimiento de sus causas y de la biología molecular que los hace crecer y proliferar, así como al perfeccionamiento de las técnicas diagnósticas y a una mayor disponibilidad de tratamientos eficaces, locales y sistémicos. Todo ello convierte a este tumor en un paradigma de cómo diversas especialidades deben trabajar de manera conjunta para conseguir el mayor beneficio para el paciente. La coordinación de los procedimientos y flujos que el paciente debe seguir a lo largo de su diagnóstico, tratamiento y seguimiento es fundamental para una optimización de recursos y tiempos. El presente artículo se ha redactado, a propuesta del Grupo de Trabajo de Cáncer de Tiroides de la Sociedad Española de Endocrinología y Nutrición, con la intención de presentar un documento de consenso sobre definición, composición, requisitos, estructura y funcionamiento de un equipo multidisciplinar para la atención integral de pacientes con cáncer de tiroides. Para ello se ha contado con las aportaciones de varios profesionales de distintas especialidades con experiencia en el tratamiento del cáncer de tiroides en centros donde los equipos multidisciplinares llevan años implantados con la voluntad de elaborar un consenso práctico y aplicable a la práctica médica asistencial.
Thyroid cancer is the leading endocrine system tumor. Great advances have recently been made in understanding of the origin of these tumors and the molecular biology that makes them grow and proliferate, which have been associated to improvements in diagnostic procedures and increased availability of effective local and systemic treatments. All of the above makes thyroid cancer a paradigm of how different specialties should work together to achieve the greatest benefit for the patients. Coordination of all the procedures and patient flows should continue throughout diagnosis, treatment, and follow-up, and is essential for further optimization of resources and time. This manuscript was prepared at the request of the Working Group on Thyroid Cancer of the Spanish Society of Endocrinology and Nutrition, and is aimed to provide a consensus document on the definition, composition, requirements, structure, and operation of a multidisciplinary team for the comprehensive care of patients with thyroid cancer. For this purpose, we have included contributions by several professionals from different specialties with experience in thyroid cancer treatment at centers where multidisciplinary teams have been working for years, with the aim of developing a practical consensus applicable in clinical practice.
Los tumores tiroideos abarcan un amplio espectro de enfermedades neoplásicas, desde los microcarcinomas papilares de bajo riesgo, generalmente con escaso impacto sobre la supervivencia, hasta tumores de gran agresividad con invasión local y metástasis a distancia, que requieren procedimientos diagnósticos y terapéuticos complejos. Se trata, por tanto, de un grupo heterogéneo de tumores malignos cuyo manejo requiere el concurso de múltiples especialistas, así como diferentes estrategias diagnósticas y terapéuticas.
Cabe destacar 2 características recientes del cáncer de tiroides. Una de ellas es el aumento en su incidencia, observado en estudios epidemiológicos tanto nacionales1,2 como internacionales3. La segunda ha sido la aceptación general de que el cáncer de tiroides debe ser tratado y seguido por equipos multidisciplinares (EMD) en el seno de unidades especializadas que sigan las recomendaciones internacionales basadas en la evidencia4.
Aunque la importancia y conveniencia de EMD en el abordaje del cáncer de tiroides está fuera de toda duda4,5, hasta donde llega nuestro conocimiento no existe en la literatura una clara definición de este concepto, así como de su composición, objetivos, funciones específicas, responsabilidades y plan operativo.
Los autores del presente artículo somos conscientes de que deben establecerse EMD en centros especializados para canalizar los pacientes a grupos con experiencia y asegurar así la mejor asistencia sanitaria y los mejores resultados a los pacientes con cáncer de tiroides6. Dado que los EMD se están convirtiendo en una práctica habitual en el tratamiento de pacientes con diversos tipos de tumores7-9, el presente artículo se ha redactado, a propuesta del Grupo de Trabajo de Cáncer de Tiroides de la Sociedad Española de Endocrinología y Nutrición, con el objetivo de ofrecer a los especialistas implicados un documento de consenso sobre definición, composición, requisitos, estructura y funcionamiento de un EMD para la atención integral de pacientes con cáncer de tiroides, todo ello con una visión holística de la enfermedad y un planteamiento realista y de aplicación en la práctica clínica de nuestro medio.
Razón de ser del equipo multidisciplinar en cáncer de tiroidesSi preguntásemos a cualquier paciente cómo le gustaría ser atendido, la respuesta sería diáfana: del mejor modo posible. Es por tanto deseable que cualquier enfermo reciba una atención de máxima calidad humana y técnica. Desgraciadamente, la información sobre lo que supone una atención de calidad en endocrinología no abunda10. Sin embargo, varias de las recientes guías de cáncer de tiroides señalan con precisión cómo se debe manejar el enfermo con neoplasias tiroideas4,11-13.
La razón de ser de los EMD no es otra que aportar una asistencia de calidad desde el diagnóstico hasta la erradicación de la enfermedad. El equipo debe ser capaz de aplicar la mejor intervención reduciendo al mínimo la morbilidad y la iatrogenia. En ocasiones se primará la intervención, pero muchas otras veces lo más adecuado será abstenerse y adoptar una vigilancia activa14. Tan importante será analizar bien los elementos que aconsejan incluir a un paciente con mal pronóstico en un ensayo clínico experimental como ser muy preciso a la hora de ahorrar medidas terapéuticas excesivas para casos de microcarcinomas papilares4.
Concepto de atención multidisciplinarPor atención multidisciplinar se entiende la provisión de servicios sanitarios de forma coordinada por un grupo de profesionales de especialidades diferentes, centrada en el paciente y con la elaboración de un plan que incluya recomendaciones consensuadas por todos9.
Un EMD en cáncer de tiroides puede definirse como un grupo de especialistas, con formación específica en cáncer de tiroides dentro de su especialidad, con experiencia en el diagnóstico, el tratamiento y la rehabilitación de los pacientes, pero también con una visión integral de la enfermedad. El EMD debe tener disponibilidad para el trabajo de equipo y ofrecer su experiencia en las decisiones conjuntas y desarrollar su capacidad para adaptarse a las decisiones consensuadas, todo ello con una visión centrada en el paciente y enfocada a conseguir la mejor atención sanitaria posible en el marco de una medicina basada en la evidencia.
El fundamento racional para la implantación de EMD es que a medida que el manejo de la enfermedad se vuelve más complejo es necesario involucrar a los profesionales clave en la toma de decisiones clínicas para los pacientes individuales6. El concepto de enfoque multidisciplinar para los pacientes con cáncer se ha propuesto en diversos centros médicos especializados, especialmente para los tumores más frecuentes, tales como los de mama15, pulmón16, colorrectal17 y genitourinario18. Se pretende ofrecer un programa multimodal comprensivo que proporcione servicios de diagnóstico y consulta minimizando las visitas al hospital, evaluando de forma multifocal al paciente. Los miembros del equipo deben reunir una serie de características mínimas, entre las que se cuentan: especial dedicación al cáncer de tiroides en su actividad clínica habitual, decisión para trabajar adaptándose a las guías basadas en la evidencia y recomendaciones nacionales e internacionales, capacidad para acudir a reuniones formales con la periodicidad que el equipo determine, y disponibilidad para actividad auditora e informe de sus resultados con intervalos regulares.
Necesidad de atención multidisciplinarLa creciente complejidad en la atención del cáncer hace que la organización en la que se toman las decisiones clínicas sea uno de los elementos claves para un tratamiento de alta calidad. Esto plantea la cuestión de cómo puede lograrse una buena cooperación profesional en la práctica clínica. La estructura hospitalaria debe aportar un servicio al paciente con cáncer y no una organización por servicios. Este proceso modifica la forma en que los profesionales interactúan y se coordinan. Los principales aspectos que definen un enfoque multidisciplinar en la organización de la atención del cáncer son: especialización profesional por enfermedad, estandarización de procesos y criterios basados en guías clínicas, evitando la variabilidad en la práctica clínica, redistribución de las tareas en un equipo, e identificación y asignación de recursos específicos19.
El desarrollo de la atención oncológica en España ha estado determinado por la dificultad de articular, en la estructura organizativa tradicional de los servicios hospitalarios, la nueva concepción multidisciplinar, en razón de las necesidades del proceso diagnóstico y terapéutico del paciente. La Estrategia en Cáncer del Sistema Nacional de Salud20 propuso la atención multidisciplinar como parámetro de calidad y como eje del modelo organizativo de la atención oncológica.
Los pacientes diagnosticados de cáncer deben tratarse, por tanto, en el marco de un EMD integrado preferentemente en un comité de tumores, y con un profesional que actúe como referente para el paciente. El comité de tumores debe evaluar las decisiones de forma previa al tratamiento y establecer un plan global de tratamiento. Por tanto, todo paciente diagnosticado de cáncer debería disponer de un plan terapéutico global y personalizado. Este plan terapéutico debería: a)haberse efectuado previamente al inicio de cualquier tratamiento; b)haber sido consensuado con la participación de los especialistas implicados, en el marco de un comité de tumores; c)estar de acuerdo con las guías clínicas basadas en la evidencia científica, y d)constar en la historia clínica.
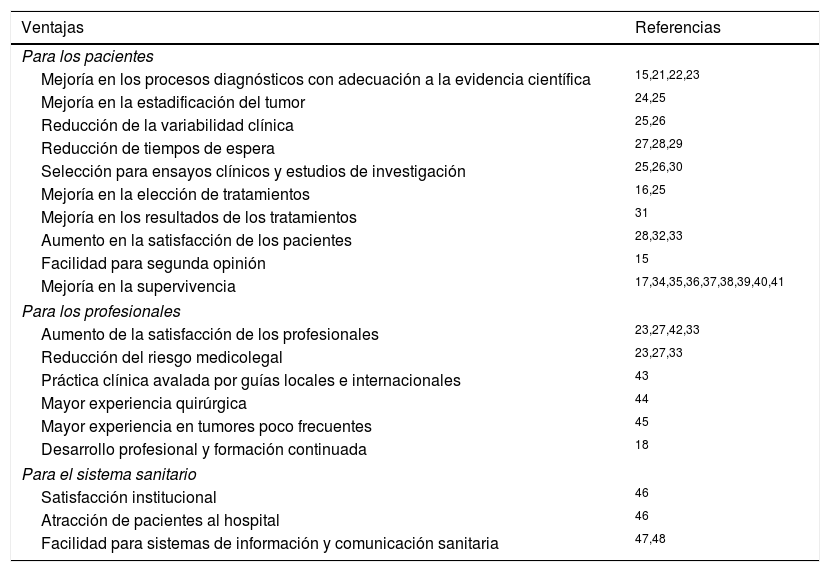
Ventajas de la atención multidisciplinar en cáncer de tiroidesDiferentes estudios en diversas enfermedades neoplásicas han mostrado que los EMD pueden proporcionar un programa de evaluación integrado con ventajas para el paciente, los profesionales y el sistema sanitario (tabla 1)15-18,21-48. La mejoría en la elección de pruebas diagnósticas, con adecuación a la evidencia científica15,21, se acompaña de una menor variabilidad clínica25,26, un mayor rendimiento quirúrgico22 y una mejor estadificación inicial posquirúrgica y durante el seguimiento.
Ventajas de la asistencia sanitaria mediante equipos multidisciplinares en cáncer de tiroides
| Ventajas | Referencias |
|---|---|
| Para los pacientes | |
| Mejoría en los procesos diagnósticos con adecuación a la evidencia científica | 15,21,22,23 |
| Mejoría en la estadificación del tumor | 24,25 |
| Reducción de la variabilidad clínica | 25,26 |
| Reducción de tiempos de espera | 27,28,29 |
| Selección para ensayos clínicos y estudios de investigación | 25,26,30 |
| Mejoría en la elección de tratamientos | 16,25 |
| Mejoría en los resultados de los tratamientos | 31 |
| Aumento en la satisfacción de los pacientes | 28,32,33 |
| Facilidad para segunda opinión | 15 |
| Mejoría en la supervivencia | 17,34,35,36,37,38,39,40,41 |
| Para los profesionales | |
| Aumento de la satisfacción de los profesionales | 23,27,42,33 |
| Reducción del riesgo medicolegal | 23,27,33 |
| Práctica clínica avalada por guías locales e internacionales | 43 |
| Mayor experiencia quirúrgica | 44 |
| Mayor experiencia en tumores poco frecuentes | 45 |
| Desarrollo profesional y formación continuada | 18 |
| Para el sistema sanitario | |
| Satisfacción institucional | 46 |
| Atracción de pacientes al hospital | 46 |
| Facilidad para sistemas de información y comunicación sanitaria | 47,48 |
Las guías internacionales recomiendan unos tiempos de espera máximos desde el diagnóstico hasta el tratamiento para pacientes con cáncer de tiroides4. Los EMD han demostrado tener impacto sobre los tiempos de espera en ensayos realizados en pacientes con cáncer de pulmón28,29. En el caso de pacientes con cáncer de tiroides avanzado o metastásico el abordaje multidisciplinar adquiere connotaciones especiales45. La inclusión en registros30, en estudios prospectivos y en ensayos clínicos25,26, así como la solicitud de segunda opinión15, también pueden considerarse ventajas de los EMD para los pacientes.
La elección de los tratamientos25 y sus resultados31 también mejora con los EMD. Algunos estudios han mostrado que la introducción de EMD se traduce en cambios en las pautas de tratamiento habituales en la práctica clínica16. Otros estudios indican que los pacientes atendidos en centros con EMD presentan una supervivencia más elevada que los atendidos en centros generales39. La labor de los EMD se ha asociado a una mejora en la supervivencia a 541 y a 7años36 en cáncer de mama, a 5años en cáncer colorrectal17 y esofágico38, y a 2años en cáncer de cabeza y cuello35. La mejora en la supervivencia se ha observado de forma particular en pacientes con cáncer avanzado40, tumores inoperables37 y pacientes ancianos34.
Aunque no disponemos de estudios concretos en cáncer de tiroides, es un hecho patente que la mortalidad de estos pacientes no se ha incrementado de forma paralela al aumento de la incidencia49,50. Ello podría ser debido, al menos en parte, a la atención de los pacientes en centros especializados, con profesionales con experiencia y en algunos casos por EMD51-53.
La satisfacción por la atención recibida también parece superior en los EMD, especialmente por la organización de las exploraciones y la experiencia personal28, lo que se traduce en un menor número de visitas y una información más consistente, con mayor seguridad y calidad de vida para el paciente32.
Los profesionales sanitarios que participan en un EMD realizan una práctica clínica más cercana a la avalada por guías y protocolos locales o internacionales, con planes terapéuticos conocidos desde el principio43, lo que implica un aumento de la satisfacción profesional y una reducción del riesgo medicolegal23,27,33,42,44,45. Los EMD constituyen una oportunidad para el desarrollo profesional y un marco adecuado para llevar a cabo acciones de formación continuada de sus miembros y profesionales interesados18.
La satisfacción de la institución y sus gestores se ve favorecida por la implantación de EMD, ya que estos suponen una atracción de pacientes al hospital46. Los registros electrónicos para pacientes con cáncer de tiroides desarrollados por EMD en algunos centros48 proporcionan un método efectivo para el almacenamiento y la transmisión de la información del paciente entre profesionales. La comunicación de datos clínicos entre especialistas y centros sanitarios ha sido recientemente reconocida como una necesidad en el cáncer de tiroides47. La recogida de información de datos clínicos, pre y postoperatorios, de una forma estandarizada, segura y completa solo se concibe en el seno de un EMD.
Modelos de configuración y factores críticosLos EMD pueden adaptar diferentes modelos de configuración54. El comité consultivo está formado por un grupo de profesionales, de diferentes especialidades, que se reúne regularmente sobre una base informal para discutir casos considerados clínicamente complejos. Dado que los pacientes ya han recibido algún tratamiento (por lo general la cirugía), la reunión multidisciplinar está orientada para referir a los pacientes a otros profesionales o para recibir un tratamiento adicional.
En el modelo de co-adaptación formal el consenso tiene un papel clave debido al alto grado de interacción entre los profesionales implicados. Los profesionales comparten sus puntos de vista sobre el diagnóstico, tratamiento y seguimiento de un tipo específico de cáncer. La reunión está abierta a todos los profesionales implicados en el manejo del paciente. La toma de decisiones conjunta precede a la aplicación de cualquier tratamiento y todos los casos son presentados a la reunión multidisciplinar. Ambos aspectos se ven obstaculizados por la inercia de la estructura hospitalaria por servicios en el manejo de la enfermedad.
Los equipos que trabajan bajo el modelo de proceso asistencial integrado comparten el manejo del paciente, incluyendo la coordinación de la investigación clínica y la evaluación económica del tratamiento. Este modelo proporciona acceso rápido de los pacientes al equipo, por lo que sus preferencias, junto con el conocimiento de sus comorbilidades y el contexto psicosocial, se incorporan al debate. Se establece un seguimiento sistemático de los pacientes durante todo el proceso de la enfermedad.
De los varios factores críticos para el desarrollo de los EMD destaca la existencia de diferentes puertas de entrada para el mismo perfil de paciente, lo que origina una gran variabilidad en la práctica clínica, según el servicio por el que el paciente accede al hospital. El establecimiento de una puerta de entrada común para pacientes similares proporciona un acceso precoz a la asistencia y reduce la sensación de los pacientes de ser propiedad de un médico o departamento.
Otro factor crítico es la variabilidad en el desarrollo y uso de protocolos clínicos y guías. Hay una falta de evaluación sistemática de los niveles de adherencia a los protocolos. El cambio del plan de tratamiento de un paciente remitido desde un hospital de nivel inferior a un equipo de un hospital dedicado al cáncer puede crear confusión y falta de confianza en el paciente.
Debe existir un apoyo específico de la dirección del hospital a los EMD. La dirección del hospital debe proteger las reuniones y el tiempo de trabajo, y promover nuevos roles profesionales, como enfermera gestora de casos, y el apoyo administrativo.
Un factor destacado es la evaluación de resultados. El objetivo principal de cualquier EMD es mejorar la efectividad en el diagnóstico y el tratamiento. Sus resultados deben evaluarse a través de un mínimo de indicadores centrados en los procesos clínicos. El registro y documentación de las decisiones clínicas es otro aspecto clave que debe reflejar el resultado del consenso alcanzado y generar una percepción positiva de todo el entorno hospitalario. El registro en la historia del paciente del tratamiento planificado es de gran utilidad cuando se quieren evaluar las decisiones tomadas ante casos similares o ante una auditoría al EMD.
Indicadores de calidad en cirugía del cáncer de tiroidesLa morbilidad de la cirugía tiroidea se circunscribe básicamente a la presentación de hemorragia y hematoma sofocante, lesión de los nervios laríngeos recurrentes e hipoparatiroidismo permanente, constituyéndose estos ítems en los indicadores de calidad que, idealmente, en una unidad acreditada deberían situarse en el rango más bajo de su prevalencia55,56. Estas complicaciones se han descrito habitualmente con una frecuencia baja, y su presentación se ha relacionado con factores como la extensión de la cirugía, la cirugía del cáncer, las reintervenciones y la inexperiencia del cirujano57.
Experiencia del cirujanoDiversos estudios han demostrado que los cirujanos con mayor número de tiroidectomías logran menos complicaciones, estancias más cortas y menor coste por procedimiento. Sosa et al.57 concluyeron que es el número de tiroidectomías por cirujano, independientemente de las que se realicen en el centro, lo que se asocia a mejores resultados y a menor estancia hospitalaria. Posteriormente, Stavrakis et al.58 mostraron que los cirujanos con alto número de intervenciones tiroideas tenían menos probabilidad de hemorragia postoperatoria.
Sin embargo, no queda claro cuál es el umbral que define el mínimo de intervenciones/año que determina el ser un cirujano de alta o baja actividad y que asegura una diferencia significativa en la calidad de los resultados. Se han barajado cifras de 23, 30, 50 e incluso 100 tiroidectomías/año59. Para otros autores, el criterio de alta actividad no se basa tanto en el número total de tiroidectomías realizadas sino en el porcentaje de cirugía endocrina realizada dentro de la actividad quirúrgica60. La mayoría de los procedimientos quirúrgicos por patología tiroidea benigna pueden realizarse de forma segura por cirujanos de baja actividad y residentes bajo supervisión adecuada61. De hecho, la mayoría de las tiroidectomías están realizadas por cirujanos de baja actividad62 y con buenos resultados. Los factores de riesgo que se han asociado a lesión permanente del nervio laríngeo recurrente son las reintervenciones en patología benigna y la cirugía del cáncer63.
Nuevos indicadoresUna cirugía adecuada, desde el punto de vista de la extensión, se asocia a menor tasa de recidiva y mortalidad y, además, desde el punto de vista técnico o de actividad, a menor tasa de complicaciones. La tendencia actual de realizar tratamiento con radioyodo a bajas dosis prioriza aún más la importancia de realizar una tiroidectomía total o con mínimo remanente como factor determinante.
La captación de radioyodo por el remanente ha demostrado ser un indicador de calidad que se correlaciona con los niveles de tiroglobulina en pacientes con anticuerpos negativos, predice el riesgo de recidiva y da una idea de cuán completa ha sido la cirugía64. En este sentido, un estudio reciente59 ha puesto de manifiesto que los cirujanos con un número de casos superior a 30 al año realizan de entrada más tiroidectomías totales, con extensión más adecuada y con menos complicaciones. Además, los pacientes presentan menor captación de radioyodo, menor concentración de tiroglobulina en ausencia de anticuerpos anti-tiroglobulina y necesitan menos dosis terapéuticas de radioyodo59. Sin embargo, en pacientes con enfermedad localmente avanzada se necesitan cirujanos con actividad aún más alta (50-100 tiroidectomías/año) para aumentar la probabilidad de obtener niveles de tiroglobulina mínimos o indetectables.
Por otra parte, a pesar de que algunos estudios destacan que la importancia del número de tiroidectomías está asociada al cirujano pero no a la institución, es también cierto que las unidades con EMD y alto número de intervenciones hacen posible que el paciente llegue al cirujano mejor estudiado, con un diagnóstico y estadificación más correctos, de modo que el primer tratamiento sea más adecuado, más eficiente y con indicadores de calidad probablemente mejores, minimizando además el número de reintervenciones para completar tiroidectomía o tratar persistencias57,59. Las unidades acreditadas y con alto número de cirugías de cáncer de tiroides tienen, además, la oportunidad y la obligación de involucrarse en estudios multicéntricos. La producción científica constituye un indicador de calidad objetiva de estas unidades.
Requisitos de las unidades multidisciplinares en cáncer de tiroidesLos requisitos que deben reunir los EMD han de ser aquellos que permitan al equipo alcanzar su misión, es decir, poder ofrecer al paciente con cáncer de tiroides la mejor calidad asistencial posible. El EMD debe, por tanto, estar impregnado de una alta profesionalidad. Existen indicadores objetivos que reflejan la calidad profesional, y se resumen en la tabla 2.
Indicadores de profesionalidad
| Aspecto | Características |
|---|---|
| Altruismo | Disponibilidad para someter los intereses personales a los intereses del paciente y del equipo |
| Empatía | Demostrar sensibilidad hacia el bienestar físico, psicológico y social del paciente Desarrollar habilidades de comunicación tanto para transmitir como para recibir información Adquirir sensibilidad para identificar las preocupaciones emocionales en los pacientes y familiares |
| Trabajo en equipo | Capacidad para tomar decisiones en el seno de un equipo de trabajo y asumir las opiniones de los demás Fomentar el talante dialogante Mostrar respeto por los criterios que difieren de los propios Amoldarse a las decisiones de la mayoría Flexibilidad para disponer del propio tiempo según las necesidades del conjunto del equipo Espíritu colaborador |
| Competencia científica | Magnanimidad para abordar o colaborar en proyectos científicos complejos Esfuerzo por adquirir los conocimientos técnicos y mantenerlos actualizados |
| Capacidad de aprendizaje | Estar abierto a las nuevas evidencias científicas Búsqueda permanente de información que mejore la actuación del equipo |
| Capacidad de autocrítica | Ejercer una continua autoevaluación del propio actuar profesional con intención de mejorar el ejercicio y corregir errores o deficiencias Conocer los propios límites Aceptar los consejos de los demás |
La constitución, la composición y los cargos del EMD deben estar avalados por la dirección del centro hospitalario donde desempeña su función. Sería de desear que la designación de estos cargos estuviera también avalada por las correspondientes sociedades científicas a las que están adscritos los diferentes especialistas. Esto supone que las sociedades establezcan las correspondientes disposiciones que garanticen la solvencia profesional de los especialistas que pueden asumir estos cargos.
Existen 3 categorías de miembros del EMD que hacen referencia a su protagonismo en el seno del equipo y que son: principal, secundario y terciario65-67. La dedicación de los diferentes miembros al EMD hace referencia al grado de esfuerzo y tiempo que invierten. La dedicación puede ser permanente, preferente u ocasional.
Según el número y la variedad de los miembros que lo componen, el EMD puede ser catalogado como completo o incompleto. Se denomina EMD completo aquel que está compuesto por todos los miembros principales y secundarios con dedicación preferente. La actividad del EMD completo se ve reforzada, cuando sea necesario, por los miembros secundarios que prestan una dedicación ocasional o ejercen una labor como colaboradores o de asesoramiento. Un EMD incompleto es el que no reúne estas características.
A cada miembro se le asigna una misión, que hace referencia al trabajo que le corresponde desempeñar dentro del EMD. La misión está marcada por el trabajo como especialista y se debe adecuar a las recomendaciones de las guías.
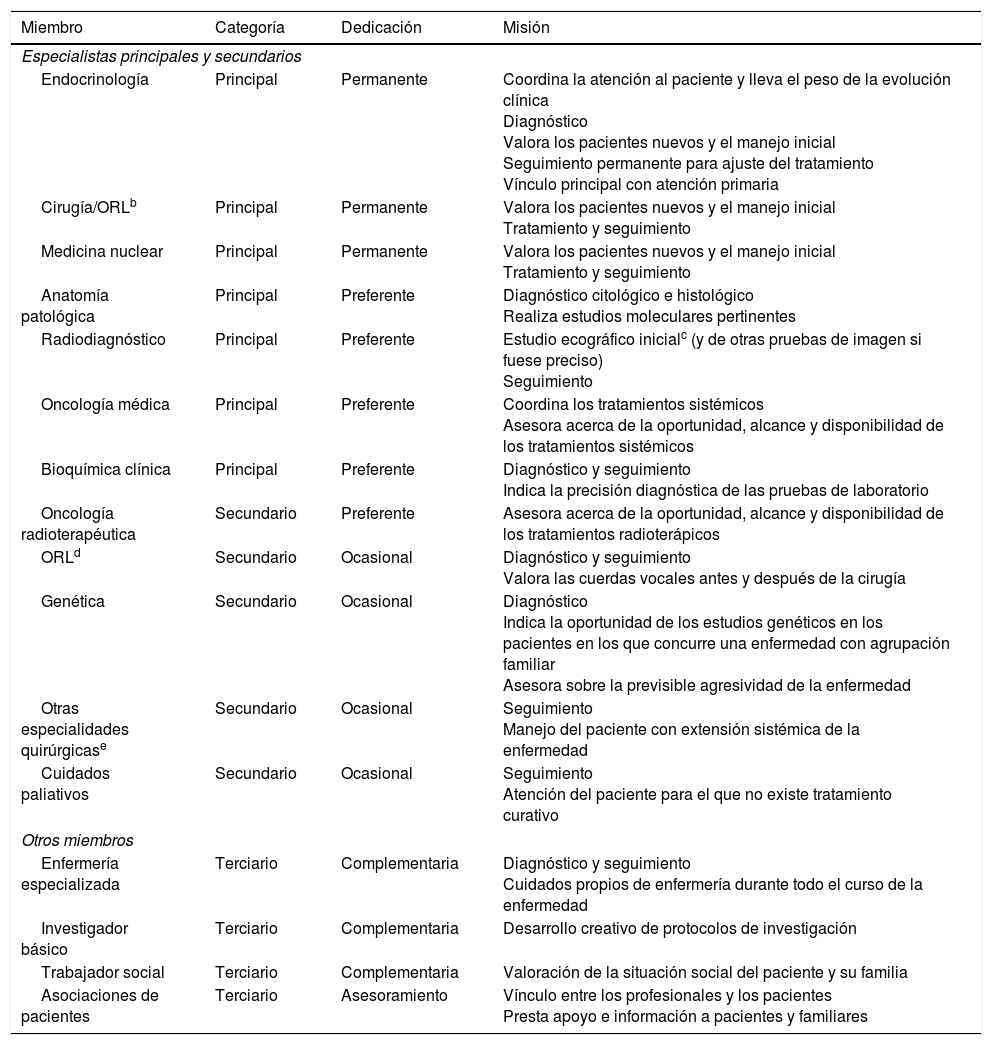
Estructura y plan operativo del equipo multidisciplinar en cáncer de tiroidesEstructuraLa estructura del EMD en cáncer de tiroides debe estar constituida por los 3 grupos de componentes indicados anteriormente65-67.
Los miembros principales son especialistas con dedicación específica y preferente al cáncer de tiroides4. Su presencia en el EMD es insoslayable. Este grupo está formado por miembros de las 7 especialidades siguientes: endocrinología, cirugía general u otorrinolaringología (ORL), medicina nuclear, anatomía patológica, oncología médica, radiodiagnóstico y bioquímica clínica. El coordinador del EMD debe nombrarse entre los miembros principales, preferentemente entre los que forman el núcleo central en el tratamiento del cáncer de tiroides (endocrinología, cirugía/ORL y medicina nuclear) y debe tener una dedicación permanente. El coordinador asume la responsabilidad en la dinámica del equipo, la formalización de la decisión terapéutica y la gestión funcional de la trazabilidad terapéutica consensuada68.
Dentro del núcleo principal es necesario que exista un secretario que colabore en las tareas de cohesión del grupo y relaciones con la dirección y con otros servicios9. Aunque el número de componentes no sea cerrado, los equipos muy numerosos resultan más difíciles de coordinar, por lo que puede dar lugar a un peor cumplimiento de las tareas69.
Los miembros secundarios son cualesquiera otros especialistas o profesionales sanitarios que colaboren con el EMD. Las especialidades implicadas serían ORL (en los centros en que esta especialidad no forme parte del núcleo principal), cirugía maxilofacial, oncología radioterápica, genética y cuidados paliativos4.
Los miembros terciarios son aquellos que no tienen una especial dedicación al cáncer de tiroides o que no trabajan directamente en centros sanitarios, pero que pueden asesorar al EMD en aspectos concretos.
Cada miembro del EMD tiene las funciones específicas propias de su especialidad en cuanto a decisiones diagnósticas y terapéuticas. El EMD debe disponer de un registro permanente de las consultas realizadas a lo largo del proceso del paciente. En la tabla 3 se exponen las categorías, la dedicación y la misión de los diferentes miembros del EMD.
Categorías, dedicación y misión de los diferentes miembros del equipo multidisciplinar en cáncer de tiroidesa
| Miembro | Categoría | Dedicación | Misión |
|---|---|---|---|
| Especialistas principales y secundarios | |||
| Endocrinología | Principal | Permanente | Coordina la atención al paciente y lleva el peso de la evolución clínica Diagnóstico Valora los pacientes nuevos y el manejo inicial Seguimiento permanente para ajuste del tratamiento Vínculo principal con atención primaria |
| Cirugía/ORLb | Principal | Permanente | Valora los pacientes nuevos y el manejo inicial Tratamiento y seguimiento |
| Medicina nuclear | Principal | Permanente | Valora los pacientes nuevos y el manejo inicial Tratamiento y seguimiento |
| Anatomía patológica | Principal | Preferente | Diagnóstico citológico e histológico Realiza estudios moleculares pertinentes |
| Radiodiagnóstico | Principal | Preferente | Estudio ecográfico inicialc (y de otras pruebas de imagen si fuese preciso) Seguimiento |
| Oncología médica | Principal | Preferente | Coordina los tratamientos sistémicos Asesora acerca de la oportunidad, alcance y disponibilidad de los tratamientos sistémicos |
| Bioquímica clínica | Principal | Preferente | Diagnóstico y seguimiento Indica la precisión diagnóstica de las pruebas de laboratorio |
| Oncología radioterapéutica | Secundario | Preferente | Asesora acerca de la oportunidad, alcance y disponibilidad de los tratamientos radioterápicos |
| ORLd | Secundario | Ocasional | Diagnóstico y seguimiento Valora las cuerdas vocales antes y después de la cirugía |
| Genética | Secundario | Ocasional | Diagnóstico Indica la oportunidad de los estudios genéticos en los pacientes en los que concurre una enfermedad con agrupación familiar Asesora sobre la previsible agresividad de la enfermedad |
| Otras especialidades quirúrgicase | Secundario | Ocasional | Seguimiento Manejo del paciente con extensión sistémica de la enfermedad |
| Cuidados paliativos | Secundario | Ocasional | Seguimiento Atención del paciente para el que no existe tratamiento curativo |
| Otros miembros | |||
| Enfermería especializada | Terciario | Complementaria | Diagnóstico y seguimiento Cuidados propios de enfermería durante todo el curso de la enfermedad |
| Investigador básico | Terciario | Complementaria | Desarrollo creativo de protocolos de investigación |
| Trabajador social | Terciario | Complementaria | Valoración de la situación social del paciente y su familia |
| Asociaciones de pacientes | Terciario | Asesoramiento | Vínculo entre los profesionales y los pacientes Presta apoyo e información a pacientes y familiares |
La categoría hace referencia al protagonismo de cada miembro, la dedicación, el grado de esfuerzo y el tiempo que se invierte en el EMD y la misión a la tarea que le corresponde desempeñar (ver texto).
Los 3 miembros con dedicación permanente deben reunirse con la periodicidad necesaria para valorar colegiadamente los casos nuevos y decidir la mejor estrategia inicial para cada uno de ellos. Es deseable que el tratamiento quirúrgico se realice dentro de los 30días siguientes a la presentación del caso en el EMD4.
El EMD completo (miembros principales y secundarios con dedicación preferente) debe reunirse periódicamente. Las reuniones serán convocadas por el coordinador a través del secretario. El coordinador indicará si es necesario convocar también a otros miembros con dedicación ocasional o complementaria o a los asesores. La periodicidad de las reuniones estará marcada por el volumen asistencial del centro, y generalmente oscila entre semanal y mensual. No se recomienda espaciar las reuniones más de un mes.
Contenido de las reunionesContenido asistencialEl contenido principal de las reuniones ha de ser siempre el asistencial. Los diferentes miembros del EMD presentarán pacientes cuyo abordaje será evaluado conjuntamente. En la planificación y desarrollo de las reuniones recomendamos tener en cuenta los siguientes aspectos:
- •
Todos los miembros del EMD deben conocer de antemano los casos que se van a presentar. Para ello, con la suficiente antelación, se debe elaborar una lista de los pacientes de los que se va a discutir e informar a todos los miembros (la comunicación por correo electrónico, salvaguardando la identidad del paciente, ha resultado un medio útil y eficaz para este cometido).
- •
La presentación de los casos debe ser breve y bien documentada, incluyendo las imágenes necesarias.
- •
La sala de reunión debe estar dotada de los recursos informáticos necesarios.
- •
Se debe registrar la asistencia de los miembros del equipo.
- •
Se debe disponer de un procedimiento escrito que establezca la forma de manejar las derivaciones que requieren una decisión de planificación del tratamiento antes de la próxima reunión (por ejemplo, correo electrónico o llamadas telefónicas entre algunos miembros y discusión retrospectiva en la próxima reunión programada). En los hospitales que no dispongan de todos los especialistas necesarios se pueden establecer vínculos a través de tele o videoconferencias, de modo que todos los componentes del EMD puedan reunirse de forma virtual.
- •
Para mantener la confidencialidad y evitar sesgos en los procedimientos, no deben asistir a las reuniones ni los representantes de la industria farmacéutica ni el público en general42.
- •
Los acuerdos del equipo, especialmente la estadificación y el plan terapéutico acordado, han de constar en la historia clínica del paciente. Es necesario asegurarse de que para cada paciente se establecen los procedimientos diagnósticos y se discuten las opciones terapéuticas más apropiadas.
- •
El EMD debe seguir una política que garantice que el médico de atención primaria responsable del paciente es informado del diagnóstico en un periodo cercano.
- •
Todos los componentes del EMD deben mantener la confidencialidad de los asuntos tratados en cada reunión.
- •
Se ha de fomentar la contribución de todos los miembros a las discusiones69.
En cada reunión se deben presentar los casos de nuevo diagnóstico cuya complejidad aconseje que sean evaluados inicialmente por el EMD completo70 de forma que se decida el tratamiento quirúrgico más conveniente según la situación clínica del paciente, la comorbilidad, el tipo histológico y la agresividad y la extensión de la enfermedad en ese momento65. Se presentarán los casos ya intervenidos quirúrgicamente cuya histología o agresividad aconseje una evaluación multidisciplinar. Asimismo, en los casos de cáncer diferenciado de tiroides se establecerá la conveniencia o no de la ablación con radioyodo y la actividad que se debe administrar4,11,13. En cuanto al abordaje de otros tumores tiroideos, como el cáncer medular de tiroides o el anaplásico, se discutirán las opciones terapéuticas más adecuadas (radioterapia, quimioterapia, tratamientos dirigidos).
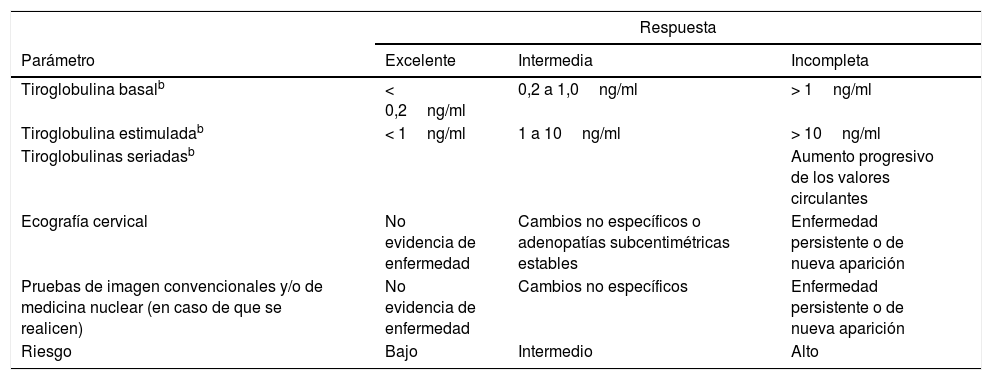
En cada paciente se debe establecer el riesgo de mortalidad según la estadificación TNM71, el riesgo de recidiva después del tratamiento inicial11 (tabla 4) y el pronóstico de acuerdo con la respuesta al tratamiento y la estratificación dinámica del riesgo72 (tabla 5). También se indicará el objetivo de supresión de TSH.
Riesgo de recidiva posquirúrgicaa
| Riesgo | Características |
|---|---|
| Bajo | Ausencia de metástasis locales o a distancia |
| Resección macroscópica completa del tumor (R0 o R1) | |
| Ausencia de invasión tumoral de los tejidos o estructuras locorregionales | |
| Histología no agresivab | |
| Intermedio | Invasión microscópica en los tejidos peritiroideos (T3) en la cirugía inicial |
| Metástasis en los ganglios cervicales (N1a o N1b) | |
| Histología agresivab | |
| Alto | Invasión extratiroidea |
| Resección macroscópica incompleta del tumor (R2) | |
| Presencia de metástasis a distancia (M1) |
R0: resección completa; R1: presencia de enfermedad microscópica del tumor primario; R2: presencia de enfermedad macroscópica del tumor primario.
Resumen de criterios de la American Thyroid Association11. Se evalúa tras la intervención quirúrgica con la información que proporciona el informe de la anatomía patológica y las pruebas que estiman la presencia de enfermedad estructural (metástasis locales o a distancia): rastreo tras la dosis de radioyodo o imágenes radiológicas (ecografía, etc.).
Estratificación dinámica del carcinoma diferenciado de tiroides según respuesta al tratamiento iniciala
| Respuesta | |||
|---|---|---|---|
| Parámetro | Excelente | Intermedia | Incompleta |
| Tiroglobulina basalb | < 0,2ng/ml | 0,2 a 1,0ng/ml | > 1ng/ml |
| Tiroglobulina estimuladab | < 1ng/ml | 1 a 10ng/ml | > 10ng/ml |
| Tiroglobulinas seriadasb | Aumento progresivo de los valores circulantes | ||
| Ecografía cervical | No evidencia de enfermedad | Cambios no específicos o adenopatías subcentimétricas estables | Enfermedad persistente o de nueva aparición |
| Pruebas de imagen convencionales y/o de medicina nuclear (en caso de que se realicen) | No evidencia de enfermedad | Cambios no específicos | Enfermedad persistente o de nueva aparición |
| Riesgo | Bajo | Intermedio | Alto |
Fuente: adaptado de Tuttle et al.72.
Otro enfoque importante en estas reuniones es la discusión de pacientes con enfermedad en progresión o con complicaciones derivadas de la cirugía o el tratamiento con radioyodo. En este momento se discutirán las pautas a seguir en cuanto al diagnóstico de extensión de la enfermedad y la conveniencia de realizar pruebas diagnósticas de localización. Del resultado de estos procedimientos derivará la actitud terapéutica, que de igual forma deberá ser consensuada en las reuniones del EMD. Para estas reuniones puede ser preciso convocar a alguno de los especialistas con dedicación ocasional, ya que puede ser necesaria su actuación en este momento.
Contenido docenteCon ayuda de todos los miembros del EMD, el coordinador establecerá un calendario de sesiones y otras actividades de formación continuada que favorezcan la actualización y el mantenimiento de los conocimientos de los miembros del equipo. Es deseable que periódicamente se organicen cursos o jornadas breves (de uno o 2 días de duración) en donde se revisen las actualizaciones de las diferentes especialidades que forman parte del EMD. Con la periodicidad adecuada será oportuno que se organicen cursos dirigidos al personal técnico o de apoyo que colabora con el EMD, tales como médicos de atención primaria, enfermeras especializadas o asociaciones de pacientes. El secretario deberá registrar estas actividades docentes, que serán incluidas en el informe anual que debe enviarse a la dirección del hospital.
Indicadores de calidad y acreditaciónCorresponde a las sociedades científicas establecer cuáles son los indicadores de calidad referentes al manejo del cáncer de tiroides por parte de los diferentes especialistas. Es muy oportuno que se evalúen estos indicadores mediante auditorías periódicas que garanticen la calidad y la competencia del EMD. Con objeto de otorgar una validez oficial a estas auditorías es de desear que se emita un certificado público que indique si la unidad multidisciplinar cumple con los requisitos adecuados para manejar pacientes con cáncer de tiroides.
Los documentos que conviene evaluar durante la auditoría son los siguientes:
- 1.
El informe anual, donde se refleja la relación de miembros y su participación en el EMD, el volumen asistencial y la actividad docente. En este documento se indicará la información que proporcionan los diversos especialistas que participan en el EMD: características de los datos recogidos en la historia clínica, de los informes de medicina nuclear, radiología y anatomía patológica. De modo particular se hará mención al número de tiroidectomías anuales llevadas a cabo por cada uno de los cirujanos miembros del EMD4,73 (tabla 6).
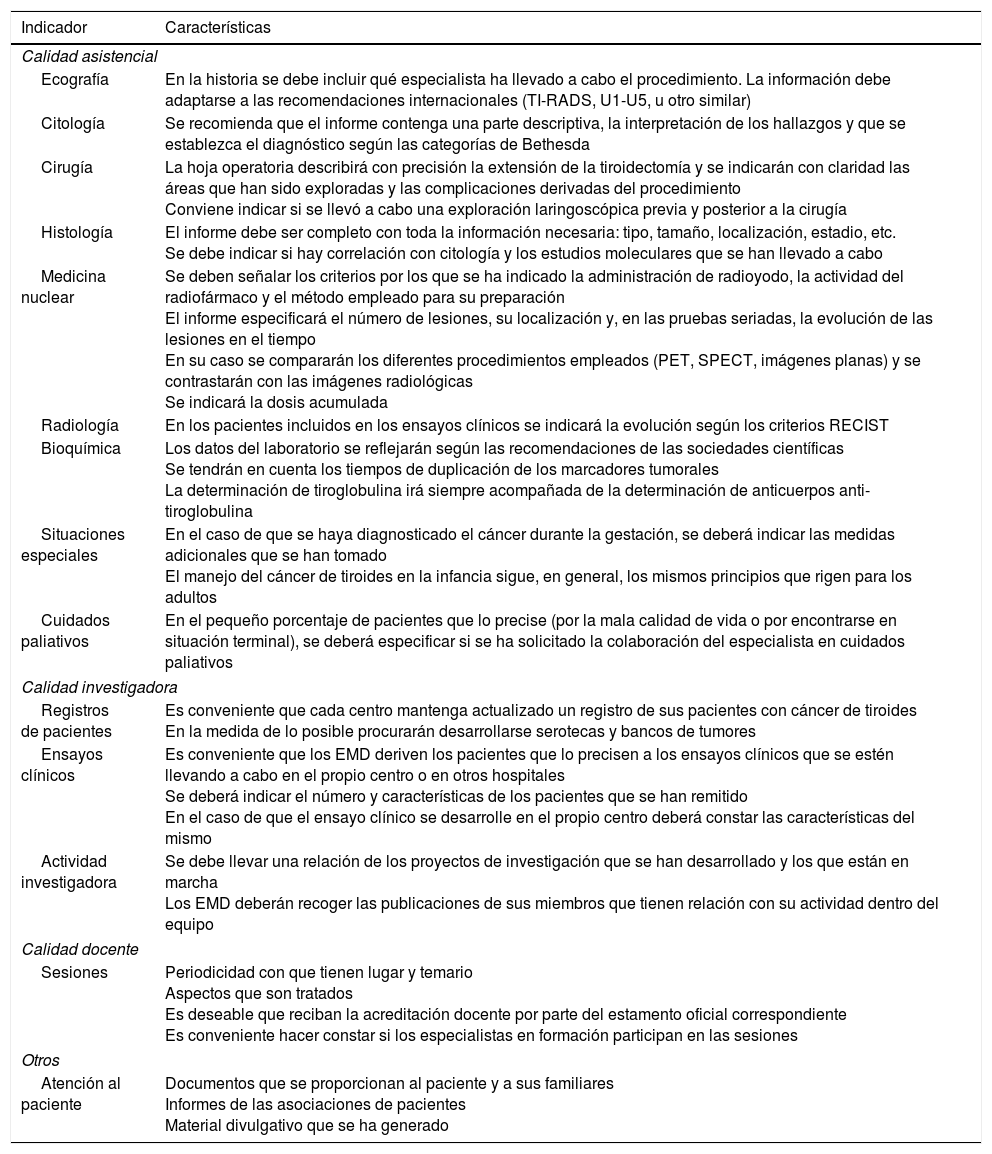
Tabla 6.Indicadores de calidad
Indicador Características Calidad asistencial Ecografía En la historia se debe incluir qué especialista ha llevado a cabo el procedimiento. La información debe adaptarse a las recomendaciones internacionales (TI-RADS, U1-U5, u otro similar) Citología Se recomienda que el informe contenga una parte descriptiva, la interpretación de los hallazgos y que se establezca el diagnóstico según las categorías de Bethesda Cirugía La hoja operatoria describirá con precisión la extensión de la tiroidectomía y se indicarán con claridad las áreas que han sido exploradas y las complicaciones derivadas del procedimiento
Conviene indicar si se llevó a cabo una exploración laringoscópica previa y posterior a la cirugíaHistología El informe debe ser completo con toda la información necesaria: tipo, tamaño, localización, estadio, etc.
Se debe indicar si hay correlación con citología y los estudios moleculares que se han llevado a caboMedicina nuclear Se deben señalar los criterios por los que se ha indicado la administración de radioyodo, la actividad del radiofármaco y el método empleado para su preparación
El informe especificará el número de lesiones, su localización y, en las pruebas seriadas, la evolución de las lesiones en el tiempo
En su caso se compararán los diferentes procedimientos empleados (PET, SPECT, imágenes planas) y se contrastarán con las imágenes radiológicas
Se indicará la dosis acumuladaRadiología En los pacientes incluidos en los ensayos clínicos se indicará la evolución según los criterios RECIST Bioquímica Los datos del laboratorio se reflejarán según las recomendaciones de las sociedades científicas
Se tendrán en cuenta los tiempos de duplicación de los marcadores tumorales
La determinación de tiroglobulina irá siempre acompañada de la determinación de anticuerpos anti-tiroglobulinaSituaciones especiales En el caso de que se haya diagnosticado el cáncer durante la gestación, se deberá indicar las medidas adicionales que se han tomado
El manejo del cáncer de tiroides en la infancia sigue, en general, los mismos principios que rigen para los adultosCuidados paliativos En el pequeño porcentaje de pacientes que lo precise (por la mala calidad de vida o por encontrarse en situación terminal), se deberá especificar si se ha solicitado la colaboración del especialista en cuidados paliativos Calidad investigadora Registros de pacientes Es conveniente que cada centro mantenga actualizado un registro de sus pacientes con cáncer de tiroides
En la medida de lo posible procurarán desarrollarse serotecas y bancos de tumoresEnsayos clínicos Es conveniente que los EMD deriven los pacientes que lo precisen a los ensayos clínicos que se estén llevando a cabo en el propio centro o en otros hospitales
Se deberá indicar el número y características de los pacientes que se han remitido
En el caso de que el ensayo clínico se desarrolle en el propio centro deberá constar las características del mismoActividad investigadora Se debe llevar una relación de los proyectos de investigación que se han desarrollado y los que están en marcha
Los EMD deberán recoger las publicaciones de sus miembros que tienen relación con su actividad dentro del equipoCalidad docente Sesiones Periodicidad con que tienen lugar y temario
Aspectos que son tratados
Es deseable que reciban la acreditación docente por parte del estamento oficial correspondiente
Es conveniente hacer constar si los especialistas en formación participan en las sesionesOtros Atención al paciente Documentos que se proporcionan al paciente y a sus familiares
Informes de las asociaciones de pacientes
Material divulgativo que se ha generadoPET: tomografía de emisión de positrones; RECIST: Response Evaluation Criteria In Solid Tumors; SPECT: single-photon emission tomography (tomografía por emisión de fotón único); TI-RADS: Thyroid Imaging Reporting and Data System73; U1-U5: sistema de clasificación ecográfica de la British Thyroid Association4.
- 2.
Una selección, tomada al azar, de los informes médicos con la documentación adicional que informe de la actuación de todos los especialistas que participan en la atención de los pacientes, así como otros indicadores de calidad que reflejen la actividad investigadora o docente. Se evaluará si los informes médicos han seguido las recomendaciones de las guías referentes al diagnóstico, tratamiento y seguimiento de estos pacientes. Es importante comprobar que se han cumplido los plazos mínimos entre procedimientos y que se ha trazado un plan personalizado para el seguimiento de cada paciente. Se evaluará la documentación que se incluye en la historia clínica (tabla 7).
Tabla 7.Información que conviene incluir en la historia clínica
Aspecto Contenido Antecedentes personales Se detallarán los posibles factores de riesgo y antecedentes oncológicos, de enfermedades endocrinológicas o autoinmunes Antecedentes familiares Síndromes asociados a cáncer de tiroides o enfermedades oncológicas Cirugía Fecha de la intervención, nombre del cirujano y extensión de la misma
Complicaciones postoperatoriasExtensión de la enfermedad Local: número, tamaño y localización de los ganglios afectados
Sistémica: órganos afectados, número y tamaño de las metástasis con sus característicasAnatomía patológica Informe de la PAAF y estudios realizados sobre el material citológico
Informe histológico detallado de las características del tumor
Estadificación según TNM
Estudios moleculares (cuando los hubiere)Intención del tratamiento Curativo o paliativo Medicina nuclear Fecha y actividad del radiofármaco administrado
Dosis acumulada
Efectos secundarios
Hallazgos en pruebas de imagenSeguimiento Plan de seguimiento
Objetivo de concentración de TSH
Valor de tiroglobulina, presencia de anticuerpos anti-tiroglobulina
Riesgo de recidiva
Estratificación dinámica del riesgo (respuesta al tratamiento)PAAF: punción-aspiración con aguja fina.
Tras el examen de la documentación, las sociedades científicas otorgarán (o renovarán) la acreditación correspondiente, indicando el tipo de EMD (completo o incompleto) y el grado de excelencia que alcancen. Conviene que la acreditación especifique la calidad del EMD en la asistencia, la docencia y la investigación.
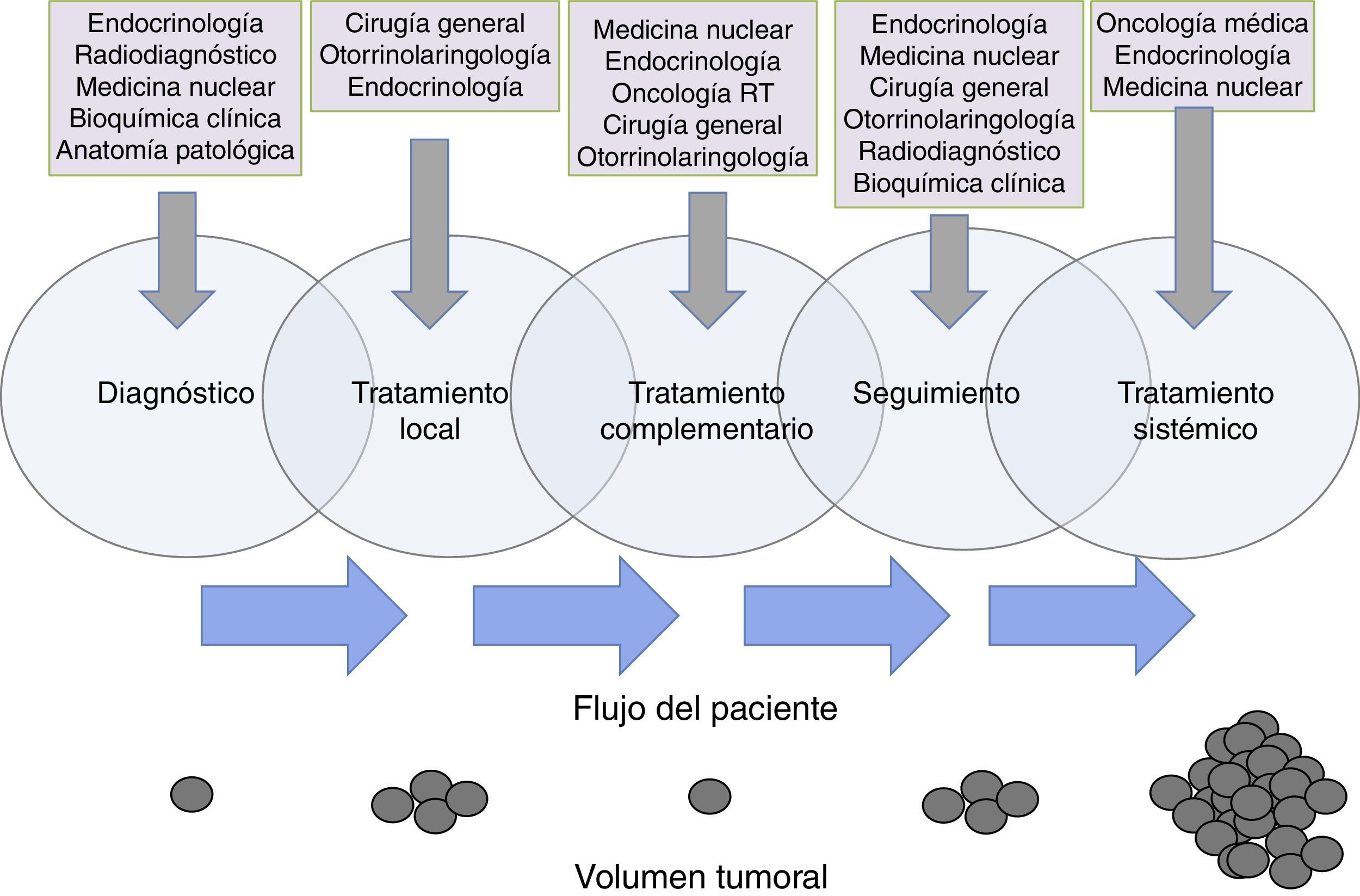
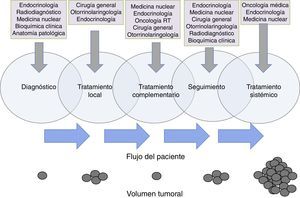
Funciones específicas y responsabilidadesCuando se habla de roles y responsabilidades de los miembros del EMD no se trata de definir departamentos estancos donde un miembro se debe circunscribir en exclusiva, sino de áreas confluentes en las que cada especialidad aporte lo mejor de su conocimiento al servicio del paciente74. Existe un solapamiento en las funciones de los miembros del equipo que exige de la mayor coordinación para que la transición de un especialista a otro se lleve a cabo de una manera fluida69. Tras una exhaustiva revisión de la literatura disponible no hemos encontrado un documento oficial en el que se establezcan claramente los roles y las responsabilidades de cada uno de los miembros del EMD en cáncer de tiroides, por lo que definimos unas áreas en las que a nuestro entender debería existir una implicación especial de cada una de las especialidades (fig. 1).
Flujo de pacientes de cáncer de tiroides entre los distintos componentes del equipo multidisciplinar a lo largo de la evolución de la enfermedad. Se pone de manifiesto la existencia de un solapamiento de responsabilidades y cuidados del paciente entre las distintas especialidades implicadas, siendo la clave la atención continuada del paciente a lo largo de su enfermedad. Los círculos de la parte inferior de la figura son una representación esquemática de un hipotético cambio en el volumen tumoral del paciente a lo largo de la evolución de la enfermedad.
El endocrinólogo debe asumir el reto de coordinar el proceso asistencial del paciente con cáncer de tiroides de una manera global, incluyendo el diagnóstico, el seguimiento y la armonización de tratamientos y pruebas complementarias. Las especialidades quirúrgicas (cirugía general, ORL), representadas por profesionales con formación y experiencia acreditada en este campo75, desempeñan un papel protagonista en el tratamiento inicial del cáncer de tiroides, pero también en el seguimiento y el tratamiento de recidivas locales (fig. 1). En casos particulares pueden ser necesarias otras especialidades quirúrgicas, como la neurocirugía, la traumatología o la cirugía torácica, para tratamiento local de enfermedad metastásica.
La participación de la medicina nuclear es clave en el tratamiento complementario con radioyodo. La indicación de este tratamiento debe realizarse de manera conjunta entre endocrinología y medicina nuclear. El correcto ajuste del tratamiento hormonal, o la utilización de TSH humana recombinante o retirada de tiroxina, son aspectos que deben llevarse a cabo con la mayor coordinación76.
Para el seguimiento es esencial el papel de la bioquímica clínica, la radiología, la medicina nuclear con sus diferentes técnicas especializadas77,78, pero también el de la endocrinología y la cirugía para la valoración clínica de los resultados de las pruebas complementarias.
El especialista en anatomía patológica desempeña un papel clave dentro del EMD. Debe estar implicado no solo en el análisis citológico e histológico de las muestras, sino también en su correcta caracterización molecular (alteraciones genómicas en BRAF y TERT), aspecto que cada vez cobra una mayor relevancia desde el punto de vista pronóstico y terapéutico79,80.
En reducidas ocasiones se hace necesaria la adición de radioterapia sobre lecho quirúrgico o regiones adyacentes. El oncólogo radioterápico debe estar implicado en la decisión terapéutica del tratamiento adyuvante de consolidación tras una cirugía, así como coordinar la intervención con medicina nuclear en caso de que fuese necesario administrar tratamiento con radioyodo. El especialista en oncología radioterápica intervendrá en aquellas ocasiones en que la enfermedad sistémica dé lugar a presencia de metástasis en cerebro, huesos con fractura o riesgo para la misma o dolor incontrolable por otros medios81.
Aproximadamente un 10% de los casos de cáncer diferenciado de tiroides, un tercio de los carcinomas medulares y la mayoría de los anaplásicos generan metástasis a distancia y serán, por tanto, candidatos a recibir tratamientos sistémicos82. Este es el momento en que interviene el especialista en oncología médica en coordinación con endocrinología, especialidades quirúrgicas y medicina nuclear, ya que se debe definir cuándo un paciente se considera refractario al radioyodo y cuándo es el mejor momento para comenzar el tratamiento sistémico. Esta terapia será manejada por el oncólogo médico en coordinación constante con el endocrinólogo de referencia que deberá continuar con el seguimiento al paciente en todo momento9. Con ello se pretende conseguir que el paciente reciba el mejor seguimiento y tratamiento a lo largo de toda la evolución de su enfermedad y por el miembro del EMD que mayor conocimiento posee en cada área.
Perspectivas futurasLos EMD se enfrentan a 3 retos importantes en un futuro inmediato. El primero es lograr un cambio de mentalidad que puede encontrar resistencias en algunos profesionales. La base del método de funcionamiento del EMD es el trabajo en grupo. Se debe asumir que el manejo del enfermo pertenece al equipo, lo que supone ceder el protagonismo propio en beneficio del paciente.
El segundo reto es el logro de un manejo personalizado de los pacientes. Los EMD deben tener capacidad para entrar en el emergente mundo de la medicina de precisión. El cáncer de tiroides es un diagnóstico genérico cuya expresión particular en cada individuo es singular, única. Cada cáncer de tiroides emerge en una persona con una edad y un sexo concreto, tiene unas características macroscópicas y microscópicas propias. Además el ambiente (familiar, laboral, social) también es particular y contribuye a la expresión de la enfermedad. Pero, sobre todo, cada tumor tiene una firma molecular única, específica. La medicina molecular nos está enseñando a poner importantes matices en el diagnóstico del cáncer de tiroides. La definición del panorama genómico es ya una incipiente realidad83. A corto plazo el diagnóstico genético obligará a reordenar los cánceres de tiroides en variantes moleculares que mejorarán la actual clasificación anatomopatológica. En este sentido los EMD deberán esforzarse para adaptar su actividad a los conocimientos más novedosos a la par que tendrán que hacer un esfuerzo adicional para potenciar su capacidad investigadora. El EMD deberá ser un protagonista de este progreso.
Por último, los EMD deberán amoldarse a los cambios sociales. De forma gradual el paciente desea tener mayor protagonismo en la toma de decisiones acerca del manejo de su enfermedad. Para ello se irán desarrollando métodos para mejorar la información que se proporciona a los enfermos. Al mismo tiempo se estrecharán las relaciones con las asociaciones de pacientes.
Finalmente, el espectacular desarrollo de las herramientas informáticas hará posible un intercambio de información mucho más rápido y eficaz. Como consecuencia no solo se beneficiarán los miembros del EMD, sino que también se acortarán las distancias entre diferentes EMD situados en distintos centros o regiones. Lo mismo ocurrirá con la comunicación entre el EMD y los pacientes. Todo ello facilitará una atención médica más rigurosa, personalizada y de mayor calidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.