Evaluación retrospectiva de la prevalencia y las características clínicas y analíticas de la anemia entre los pacientes con enfermedad inflamatoria intestinal (EII).
MétodosEstudio observacional, descriptivo y retrospectivo en pacientes con EII en seguimiento entre los años 2002 y 2004 en este centro.
ResultadosSe incluyeron 253 pacientes. La edad media fue de 46 años, el 54% eran varones. El 53% tenía enfermedad de Crohn (EC) y el 47%, colitis ulcerosa (CU). Se identificó anemia en el 30% de los pacientes, de los que un 67% presentaba criterios de ferropenia asociada. La presencia de anemia se asoció a una mayor actividad de la EII, al empleo de esteroides, a la necesidad de ingreso hospitalario y al aumento de reactantes de fase aguda. La respuesta al hierro oral en los pacientes con anemia ferropénica fue óptima en el 61% de los casos.
ConclusiónLa anemia es frecuente en los pacientes con EII, con una mayor prevalencia en la EC que en la CU. La presencia de anemia se asoció a una mayor actividad de la EII. La respuesta adecuada a la ferroterapia oral en el presente estudio retrospectivo fue similar a la descrita en estudios previos.
To retrospectively evaluate the prevalence and clinical and laboratory characteristics of anemia in patients with inflammatory bowel disease (IBD).
MethodsWe performed an observational, descriptive, retrospective study in patients with IBD followed-up between 2002 and 2004 in our center.
ResultsA total of 253 patients were included. The mean age was 46 years and 54% were male. Crohn's disease was present in 53% and ulcerative colitis in 47%. Anemia was found in 30% of the patients, of whom 67% showed associated iron-deficiency anemia. The presence of anemia was associated with greater IBD activity, steroid use, need for hospital admission and an increase in acute phase reactants. Response to oral iron intake in patients with iron-deficiency anemia was optimal in 61%.
ConclusionAnemia is common in patients with IBD, with a greater prevalence in Crohn's disease than in ulcerative colitis. The presence of anemia is associated with greater IBD activity. Adequate response to oral iron therapy in the present study was similar to that described in previous studies.
La enfermedad inflamatoria intestinal (EII) se caracteriza por la afección del aparato digestivo y, frecuentemente, de otros órganos y sistemas. Por este motivo, se puede dividir el espectro sintomático de tal entidad en 2 grandes grupos: la enfermedad propiamente digestiva y las manifestaciones extraintestinales, dentro de las que se incluye la anemia.
Comparada con otras complicaciones, la anemia ha recibido históricamente una escasa atención por parte de los gastroenterólogos1–3. El insuficiente control de los pacientes con esta complicación ha conllevado un empeoramiento de su calidad de vida4,5. Además, la falta de estrategias adecuadas en el tratamiento de la anemia ha tenido como consecuencia un aumento de la morbilidad asociada a esta entidad6,7. Todos estos hechos pueden traducirse en un aumento de los requerimientos transfusionales de los pacientes, del tiempo medio de ingreso o de la necesidad de éste.
En la EII, la anemia ha cobrado un protagonismo muy relevante en los últimos 10 años, y de la creencia de que es un proceso inherente a la propia enfermedad ha pasado a considerarse una entidad con rasgos propios, bien definida y parcialmente dependiente de su proceso de base8. El mejor conocimiento de los mecanismos productores de la anemia ha permitido diseñar estrategias específicas para su tratamiento9.
La prevalencia de anemia en pacientes con EII no se conoce con exactitud, pero se considera una de las complicaciones más comunes6,10. El objetivo del presente estudio es analizar retrospectivamente la prevalencia y las características clínicas y analíticas de la anemia entre los pacientes con EII.
Pacientes y métodosPacientesSe recogieron de forma retrospectiva los datos clínicos y analíticos de los pacientes en seguimiento por EII en esta área sanitaria, que comprendía una población de 500.000 habitantes. El diagnóstico de enfermedad de Crohn (EC) o de colitis ulcerosa (CU) se estableció en cada paciente según los criterios habituales clínicos, radiológicos, histológicos y endoscópicos11. La clasificación de Montreal se utilizó para definir la localización y la extensión de la enfermedad. De esta forma, los pacientes con EC se clasificaron en L1 (íleon distal), L2 (colon), L3 (ileocólica) y L4 (tracto digestivo superior), y los afectados de CU en proctitis, formas izquierdas (distales al ángulo esplénico) o formas extensas (proximales a la flexura esplénica).
Se registraron durante 24 meses las determinaciones clínicas (sexo, hábito tabáquico, edad, necesidad de ciclos de corticoides en el tratamiento, requerimiento de ingreso hospitalario) y analíticas (hemograma, orosomucoide, velocidad de sedimentación globular, proteína C reactiva, vitamina B12, ácido fólico y perfil férrico) de cada paciente en las revisiones semestrales establecidas en este centro como protocolo de seguimiento, entre los años 2002 y 2004.
La condición de anemia se definió como una cifra de hemoglobina (Hb) inferior a 13g/dl en varones o a 12g/dl en mujeres en alguna de las determinaciones analíticas realizadas durante el seguimiento12. Además, la condición de anemia de perfil ferropénico se definió si, de forma concomitante, el paciente presentaba al menos una de las siguientes características: a) hierro sérico disminuido (<59μg/dl); b) ferritina baja (<30μg/l); c) disminución de la saturación de transferrina (<12%), o d) cifras de transferrina elevadas (>400mg/dl).
Se consideraron los siguientes criterios de exclusión: a) diagnóstico realizado durante el período de estudio o 6 meses previo al inicio de éste (en este subgrupo de pacientes podría esperarse una mayor prevalencia de anemia al no estar previamente diagnosticados de su enfermedad de base); b) enfermedad hepática, renal, hematológica o neoplásica; c) embarazo; d) colectomía total en pacientes con CU; e) anemia hemolítica o perniciosa previamente diagnosticada; f) seguimiento inadecuado (menos de 4 revisiones en 2 años con determinación analítica en cada una de ellas); g) pérdida de seguimiento del paciente durante el período de estudio, y h) diagnóstico de colitis indeterminada.
Actividad de la enfermedadLa actividad de la enfermedad se analizó, por limitaciones inherentes al diseño retrospectivo del estudio, en los pacientes ambulantes mediante el registro de las determinaciones indirectas, como el número de ciclos de corticoides orales (se emplearon dosis a razón de 1mg/kg de prednisona al día o equivalente, con descenso paulatino), la necesidad de ingreso hospitalario y las cifras de orosomucoide, proteína C reactiva y velocidad de sedimentación globular. De forma adicional, la actividad en pacientes que requirieron ingreso se completó con índices estandarizados como el Truelove-Witts modificado para pacientes con CU (incluidas las siguientes variables: número de deposiciones, sangre en las heces, cifra de Hb, albúmina, fiebre, frecuencia cardíaca, velocidad de sedimentación globular, recuento leucocítico y cifra de potasio; se los consideró inactivos por debajo de 11 puntos)13 y el Van Hess para la EC (incluidas las siguientes variables: albúmina, detección de masa abdominal en la exploración, sexo, temperatura, consistencia de las heces, presencia de resección previa, existencia de manifestaciones extraintestinales, peso y altura; se los consideró inactivos por debajo de 100 puntos)14. Este último índice se escogió entre los disponibles al poderse calcular de forma sencilla con los datos recogidos retrospectivamente, al contrario que otros índices de uso más habitual, como el CDAI.
Parámetros de laboratorioSe registraron las siguientes determinaciones analíticas con periodicidad semestral: cifras de Hb, volumen corpuscular medio, velocidad de sedimentación globular, glucoproteína α1 (orosomucoide), proteína C reactiva, vitamina B12 (cianocobalamina), ácido fólico, hierro sérico, ferritina, saturación de transferrina y transferrina. De igual forma, se recogieron las mismas determinaciones antes y después del ingreso hospitalario con el fin de apreciar las posibles variaciones de estos parámetros secundarias a éste.
Tratamiento con hierroEl tratamiento con hierro oral se prescribió mediante sales de sulfato ferroso (Fero-gradumet®) en dosis única diaria de 525mg (equivalente a 106mg de hierro elemental). Por otro lado, el tratamiento con hierro intravenoso se realizó mediante la administración de hierro-sacarosa (Venofer®) a razón de 200mg por infusión 2 veces a la semana. Las infusiones de hierro se realizaron diluidas en 100cc de solución salina isotónica en perfusión continua durante 30min. La dosis total para la reposición completa de los depósitos se calculó mediante la fórmula de Ganzoni15: déficit de hierro total (mg)=[peso (kg)×(objetivo de Hb −Hb actual g/dl)×0,24] + 500. La indicación para la administración de hierro intravenoso se estableció según los siguientes criterios: a) pacientes con anemia grave (Hb <10g/dl)16; b) ausencia de respuesta al tratamiento con hierro oral17, y c) intolerancia a la ferroterapia por vía oral18. Se definió como «respuesta completa» al tratamiento la elevación de la cifra de Hb mayor a 2g/dl respecto a la previa, como «respuesta parcial» la elevación entre 1 y 1,9g/dl, y como «ausencia de respuesta» la elevación inferior a 1g/dl o el descenso de ésta1.
En el caso del tratamiento oral se registró el número de meses que el paciente recibió tratamiento y en el tratamiento intravenoso, el número de infusiones de 200mg de hierro elemental que se administraron.
Análisis estadísticoPara las variables continuas se calcularon la media y la desviación estándar. Para las variables categóricas se calcularon los porcentajes y los intervalos de confianza (IC) del 95%. Los datos categóricos se compararon según el test de la χ2, mientras que para la comparación entre variables cuantitativas se empleó el test de la t de Student. Un valor de p<0,05 se consideró estadísticamente significativo. La asociación entre la condición de anemia y las variables independientes, como el sexo, la edad, el tipo de EII, las cifras de orosomucoide, la velocidad de sedimentación globular, la proteína C reactiva, la necesidad de ingreso hospitalario y el tratamiento esteroideo, se evaluó mediante el análisis de regresión logística múltiple.
ResultadosSe incluyeron de forma retrospectiva 262 pacientes, de los que se excluyeron 9 según los criterios previamente descritos. De los 253 pacientes restantes, 136 (53,7%) recibían seguimiento en este centro por EC y 117 (46,2%) lo hacían por CU. La edad media de los pacientes era de 46±14 años, el 64,4% eran fumadores y el 54,5% eran varones. La distribución para la localización de la enfermedad según la clasificación de Montreal en estos pacientes fue en la EC: L1 en el 25,7%; L2 en el 29,4%; L3 en el 42,6% y L4 en el 1,4%; y en la CU: proctitis en el 22,2%; colitis izquierda en el 48,7% y colitis extensa en el 29,1%.
La prevalencia global de anemia se situó en el 29,6% (IC del 95%: del 23,8 al 25,5%); fue ferropénica en el 67,1% de los casos. La condición de anemia se consideró si en cualquier determinación analítica realizada durante el período de seguimiento el paciente presentaba valores de Hb por debajo de los valores normales para su sexo. Las características clínicas y analíticas generales quedan reflejadas en la tabla 1. El análisis univariante entre pacientes afectados de EC y los pacientes afectados de CU (tabla 2) demostró una mayor prevalencia de anemia (el 39 frente al 19,7%) entre los pacientes con EC y una media de edad más elevada (49 frente 43 años) entre los pacientes afectados de CU. Se encontraron mayores cifras de Hb (14,6 frente a 13,7g/dl), hierro sérico (87,8 frente a 73,3μg/dl) y saturación de transferrina (28,5 frente al 23,3%) en los pacientes con CU, y una mayor elevación de reactantes de fase aguda en el subgrupo de pacientes con EC. La proteína C reactiva (1,32 frente a 0,58mg/dl), el orosomucoide (115,6 frente a 95,8mg/dl) y la velocidad de sedimentación globular (20,1 frente a 14,3mm/h) tuvieron valores significativamente más elevados en los pacientes con EC que en los pacientes con CU. No se han encontrado diferencias estadísticamente significativas entre los valores de vitamina B12 y la localización de la EC.
Características generales de la población en estudio
| n | 253 |
| Edad, años | 46,4±14 |
| Sexo masculino, % | 54,5 |
| Enfermedad de Crohn, n | 136 |
| L1 (ileal), % | 25,7 (18–33,4) |
| L2 (colon), % | 29,4 (21,4–37,4) |
| L3 (ileocólica), % | 42,6 (33,9–51,3) |
| L4 (tracto digestivo superior), % | 1,4 (0,1–5,2) |
| Colitis ulcerosa, n | 117 |
| Proctitis, % | 22,2 (14,2–30,2) |
| Colitis izquierda, % | 48,7 (39,2–58,2) |
| Colitis extensa, % | 29,1 (20,4–37,7) |
| Fumador, % | 64,4 |
| Anemia, %* | 29,6 (23,8–35,5) |
| Anemia de perfil ferropénico respecto al total, % | 67,1 (55,9–78,3) |
| Tratamiento con hierro oral, % | 21,7 (16,4–27) |
| Tratamiento con hierro parenteral, % | 3,1 (0,8–5,5) |
| Pacientes con necesidad de ingreso, % | 11,8 (7,7–16) |
| Enfermedad Crohn, % | 60 (40,8–79,2) |
| Colitis ulcerosa, % | 40 (20,8–59,2) |
| Hierro sérico, μg/dl | 80±31 |
| Ferritina, ng/ml | 98,6±116,9 |
| Transferrina, mg/dl | 261,8±42,6 |
| Índice de saturación de transferrina, % | 25,6±13,7 |
| Volumen corpuscular medio, μm3 | 89,6±6,7 |
| Cianocobalamina, pg/ml | 414,3±180,8 |
| Ácido fólico, ng/ml | 8,9±12 |
| Velocidad de sedimentación globular, mm/h | 16,9±12,3 |
| Proteína C reactiva, mg/dl | 0,98±1,82 |
| Orosomucoide, mg/dl | 106,3±35,3 |
| Hemoglobina, g/dl | 14±1,4 |
Los resultados corresponden a los valores medios de las determinaciones analíticas.
Los valores mostrados entre paréntesis corresponden al intervalo de confianza del 95%.
Características comparativas entre los pacientes afectados de enfermedad de Crohn y los pacientes afectados de colitis ulcerosa
| Enfermedad de Crohn | Colitis ulcerosa | p | |
| n | 136 | 117 | |
| Edad, años | 43,6±13,3 | 49,8±14,1 | <0,01 |
| Sexo masculino, % | 50,7 (41,9–59,5) | 59 (49,6–68,3) | ns |
| Fumadores, % | 50,7 (41,9–59,5) | 79,5 (71,7–87,2) | <0,01 |
| Anemia presente*, % | 39 (30,4–47,5) | 19,7 (12–27,3) | <0,01 |
| Anemia de perfil ferropénico, % | 69,2 (55,7–30,8) | 69,6 (47,1–86,8) | n.s. |
| Tratamiento con hierro oral, % | 26,5 (18,7–34,3) | 15,4 (8,4–22,3) | n.s. |
| Tiempo del tratamiento con hierro oral, meses | 6,6±4,9 | 5,1±3,4 | n.s. |
| Tratamiento con hierro intravenoso, % | 4,4 (0,6–8,2) | 1,7 (0,2–6) | n.s. |
| Numero de infusiones de hierro intravenoso | 4±1,1 | 5±1,4 | n.s. |
| Tratamiento corticoideo, % | 44,8 (36,1–53,6) | 31,6 (22,8–40,5) | n.s. |
| Número de ciclos de corticoides | 2±1,1 | 1,9±1,3 | n.s. |
| Necesidad de ingreso, % | 11,1 (5–17,2) | 13,2 (7,2–19,3) | n.s. |
| Promedio de ingresos por paciente ingresado | 1,7±0,8 | 1,1±0,3 | n.s. |
| Índice de actividad al ingreso (Van Hess/Truelove-Witts) | 171±38 | 13±3 | |
| Hierro sérico, μg/dl | 73,3±29,4 | 87,8±31,1 | <0,01 |
| Ferritina, ng/ml | 105,1±130,1 | 84,9±100,3 | n.s. |
| Transferrina, mg/dl | 258,7±42,7 | 265,6±42,5 | n.s. |
| Saturación de transferrina, % | 23,3±10,2 | 28,5±16,6 | <0,05 |
| Hemoglobina, g/dl | 13,7±1,5 | 14,6±2,9 | <0,05 |
| Volumen corpuscular medio, μm3 | 89,5±7,9 | 89,7±5,1 | n.s. |
| Cianocobalamina, pg/ml | 376,8±163,1 | 475,7±194,9 | n.s. |
| Ácido fólico, ng/ml | 10,1±14,8 | 6,9±3,5 | n.s. |
| Orosomucoide, mg/dl | 115,6±38 | 95,8±28,2 | <0,01 |
| Proteína C reactiva, mg/dl | 1,32±2,34 | 0,58±0,76 | <0,05 |
| Velocidad de sedimentación globular, mm/h | 20,1±13,2 | 14,3±11,2 | <0,01 |
n.s.: no significativo.
Los valores mostrados entre paréntesis corresponden al intervalo de confianza del 95%.
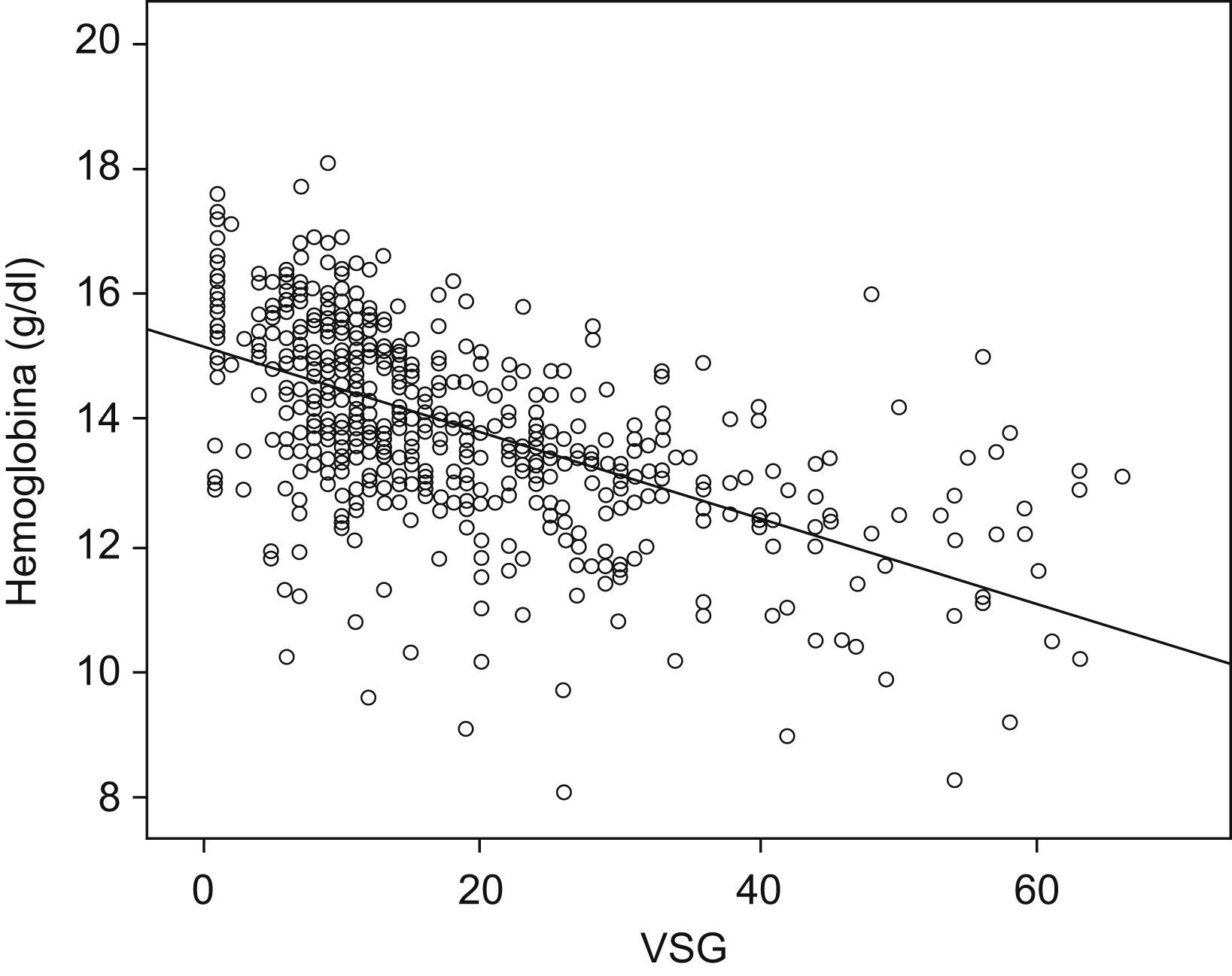
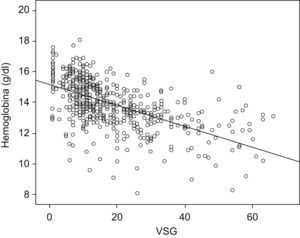
Entre los pacientes con anemia los valores analíticos medios fueron Hb de 11,1±1,4g/dl; volumen corpuscular medio de 84,5 ± 10μm3; cianocobalamina de 361,3±186,6pg/ml; ácido fólico de 7,3±5,5ng/dl; velocidad de sedimentación globular de 30,7±18,8mm/h; orosomucoide de 129,4±39,2mg/dl; proteína C reactiva de 1,4±1,5mg/dl; hierro sérico de 46,5±30,5μg/dl; ferritina de 64,3±93,6ng/ml; transferrina de 258,5±69,1mg/dl, e índice de saturación de transferrina del 14,8±11,6%. Se encontraron diferencias estadísticamente significativas respecto al grupo sin anemia en las cifras de hierro sérico, índice de saturación de transferrina, volumen corpuscular medio y velocidad de sedimentación globular (tabla 3). En el análisis de regresión logística múltiple, las variables que se asociaron significativamente a la presencia de anemia fueron el tener EC (odds ratio [OR] de 2,2; IC del 95%: 1,4 a 3,4), la necesidad de ingreso hospitalario (OR de 3; IC del 95%: 1,6 a 5,5), la necesidad de uso de corticoides en el tratamiento (OR de 3,9; IC del 95%: 2,5 a 6,0) y la elevación de las cifras de velocidad de sedimentación globular (OR de 1,04; IC del 95%: 1,03 a 1,06). En la figura 1 se representa gráficamente la correlación entre las cifras de Hb y la velocidad de sedimentación globular.
Relación entre la anemia y las variables clínicas y analíticas
| Anemia presente* | Anemia ausente | p | |
| n | 76 | 177 | |
| Edad, años | 46±15,4 | 46,6±13,4 | n.s. |
| Sexo masculino, % | 29,7 (21,7–37,7) | 70,3 (62,3–78,3) | n.s. |
| Pacientes con enfermedad de Crohn, % | 38,9 (30,4–47,5) | 61 (52,5–69,6) | 0,01 |
| Fumadores, % | 32,9 (22,8–43,2) | 67 (56,8–77,2) | n.s. |
| Tratamiento corticoideo, % | 53,1 (42,7–63,5) | 15,5 (9,5–21,5) | <0,01 |
| Necesidad de ingreso, % | 27,6 (16,9–38,3) | 6,2 (2,4–10,1) | <0,01 |
| Hierro sérico, μg/dl | 46,5±30,5 | 89,2±27,8 | <0,01 |
| Ferritina, ng/ml | 64,3±93,6 | 111,2±137 | n.s. |
| Transferrina, mg/dl | 258,9±69,1 | 261,1±39,5 | n.s. |
| Índice de saturación de transferrina, % | 14,8±11,6 | 27,8±10,9 | <0,01 |
| Hemoglobina, g/dl | 11,1±1,4 | 14,7±2,4 | <0,01 |
| Volumen corpuscular medio, μm3 | 84,5±10 | 90,7±4,8 | <0,05 |
| Cianocobalamina, pg/ml | 361,3±186,6 | 415,4±168,7 | n.s. |
| Ácido fólico, ng/ml | 7,3±5,5 | 9,5±14,9 | n.s. |
| Velocidad de sedimentación globular, mm/h | 30,7±18,8 | 14,7±11,6 | <0,01 |
| Orosomucoide, mg/dl | 129,4±39,2 | 98,8±28,6 | n.s. |
| Proteína C reactiva, mg/dl | 1,4±1,5 | 0,8±1,9 | n.s. |
n.s.: no significativo.
Los valores mostrados entre paréntesis corresponden al intervalo de confianza del 95%.
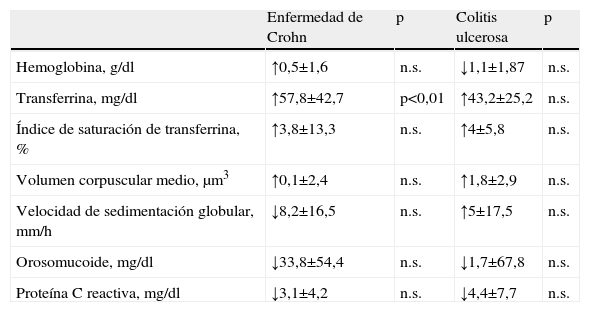
En los pacientes ingresados se analizaron las modificaciones en los parámetros analíticos que presentaron al inicio y al término de éste, se estudió de forma separada a los pacientes con EC y a los pacientes con CU. La proporción de anemia en los pacientes ingresados ascendió al 65,6% (IC del 95%: 47,6 a 83,6). El grado de actividad de estas enfermedades fue compatible con brotes de intensidad moderada. No se encontraron diferencias estadísticamente significativas en los parámetros analíticos pre y postingreso, salvo en el subgrupo de pacientes con EC, en los que se produjo un ascenso de la concentración transferrina tras el ingreso hospitalario (incremento medio de 57,8±42,7mg/dl). Por último, se analizaron las alteraciones analíticas dentro de cada grupo por medio de su estratificación en función de la intensidad del brote; tampoco alcanzaron significación estadística (tabla 4).
Modificación de los parámetros ferrocinéticos y de la actividad bioquímica tras el ingreso hospitalario
| Enfermedad de Crohn | p | Colitis ulcerosa | p | |
| Hemoglobina, g/dl | ↑0,5±1,6 | n.s. | ↓1,1±1,87 | n.s. |
| Transferrina, mg/dl | ↑57,8±42,7 | p<0,01 | ↑43,2±25,2 | n.s. |
| Índice de saturación de transferrina, % | ↑3,8±13,3 | n.s. | ↑4±5,8 | n.s. |
| Volumen corpuscular medio, μm3 | ↑0,1±2,4 | n.s. | ↑1,8±2,9 | n.s. |
| Velocidad de sedimentación globular, mm/h | ↓8,2±16,5 | n.s. | ↑5±17,5 | n.s. |
| Orosomucoide, mg/dl | ↓33,8±54,4 | n.s. | ↓1,7±67,8 | n.s. |
| Proteína C reactiva, mg/dl | ↓3,1±4,2 | n.s. | ↓4,4±7,7 | n.s. |
↑: aumento del valor en unidades expresadas tras el alta hospitalaria; ↓: descenso del valor en unidades expresadas tras el alta hospitalaria; n.s.: no significativo.
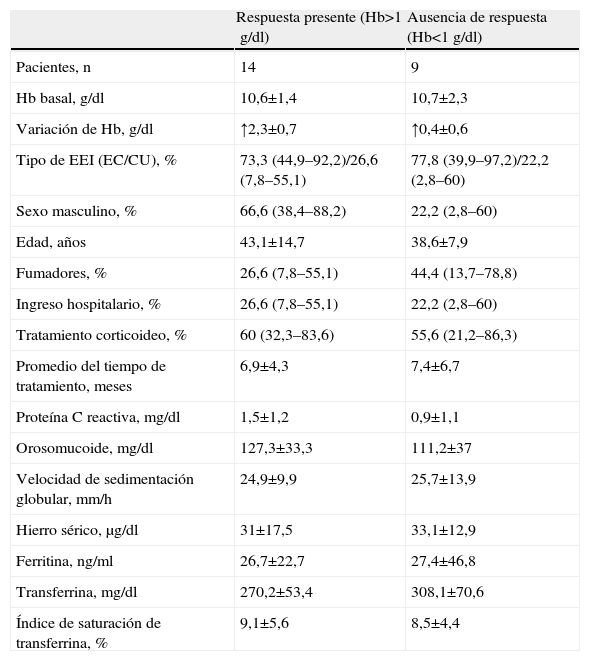
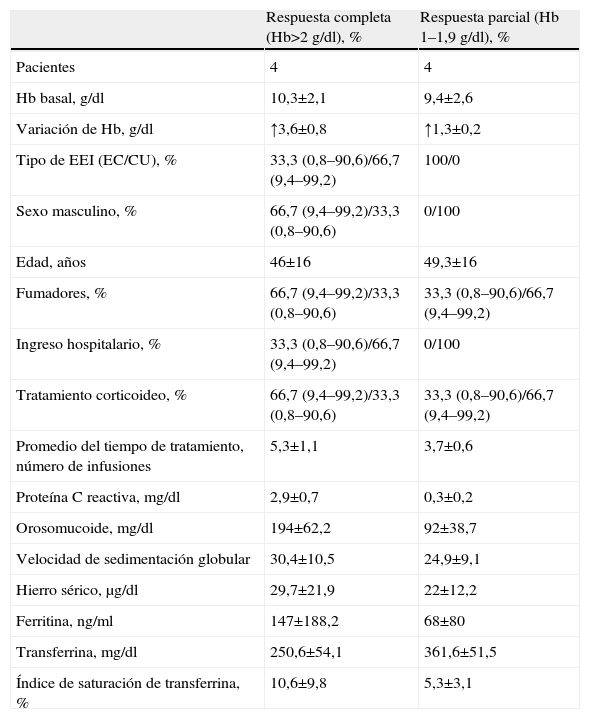
Se analizó la respuesta a las distintas formulaciones con ferroterapia oral o intravenosa. Los pacientes con anemia de tipo ferropénico recibieron tratamiento con sales ferrosas en el 60,4% de los casos (IC del 95%: del 45,5 al 75,2%) y hierro intravenoso en el 10,4% (IC del 95%: del 3,4 al 22,6%). No recibió tratamiento específico el 35,4% de los enfermos (IC del 95%: del 20,8 al 49,9%). Debido al reducido tamaño muestral del grupo de tratamiento con hierro oral (tabla 5), se agrupó a los pacientes con respuesta parcial y completa como «respuesta presente» (definida como aquélla con elevación de Hb mayor a 1g/dl) y «ausencia de respuesta» (aquélla menor a 1g/dl). Del mismo modo, en el grupo de respuesta al tratamiento intravenoso (tabla 6) no se registraron pacientes «sin respuesta», por lo que la comparación se realizó entre pacientes con «respuesta parcial» (aumento de Hb de 1 a 2g/dl) y «completa» (aumento de Hb mayor a 2g/dl). La respuesta global al tratamiento con hierro oral se situó en el 60,9% (IC del 95%: del 38,7 al 82,9%). La respuesta al tratamiento con hierro oral fue mayor entre los varones (81,8%; IC del 95%: 48,2 al 97,7%) que entre las mujeres (41,7%; IC del 95%: del 15,1 al 72,3%). Por su parte, en los pacientes que recibieron tratamiento con hierro intravenoso se evidenciaron unas mayores cifras basales de proteína C reactiva (2,9±0,7 frente a 0,3±0,2mg/dl) y del número de infusiones de hierro intravenoso (5,3±1,1 frente a 3,7±0,6) en el grupo con «respuesta presente» frente a los pacientes con «respuesta parcial».
Respuesta al tratamiento con ferroterapia oral
| Respuesta presente (Hb>1g/dl) | Ausencia de respuesta (Hb<1g/dl) | |
| Pacientes, n | 14 | 9 |
| Hb basal, g/dl | 10,6±1,4 | 10,7±2,3 |
| Variación de Hb, g/dl | ↑2,3±0,7 | ↑0,4±0,6 |
| Tipo de EEI (EC/CU), % | 73,3 (44,9–92,2)/26,6 (7,8–55,1) | 77,8 (39,9–97,2)/22,2 (2,8–60) |
| Sexo masculino, % | 66,6 (38,4–88,2) | 22,2 (2,8–60) |
| Edad, años | 43,1±14,7 | 38,6±7,9 |
| Fumadores, % | 26,6 (7,8–55,1) | 44,4 (13,7–78,8) |
| Ingreso hospitalario, % | 26,6 (7,8–55,1) | 22,2 (2,8–60) |
| Tratamiento corticoideo, % | 60 (32,3–83,6) | 55,6 (21,2–86,3) |
| Promedio del tiempo de tratamiento, meses | 6,9±4,3 | 7,4±6,7 |
| Proteína C reactiva, mg/dl | 1,5±1,2 | 0,9±1,1 |
| Orosomucoide, mg/dl | 127,3±33,3 | 111,2±37 |
| Velocidad de sedimentación globular, mm/h | 24,9±9,9 | 25,7±13,9 |
| Hierro sérico, μg/dl | 31±17,5 | 33,1±12,9 |
| Ferritina, ng/ml | 26,7±22,7 | 27,4±46,8 |
| Transferrina, mg/dl | 270,2±53,4 | 308,1±70,6 |
| Índice de saturación de transferrina, % | 9,1±5,6 | 8,5±4,4 |
Los valores mostrados entre paréntesis corresponden al intervalo de confianza del 95%.
↑: aumento del valor en unidades expresadas tras el alta hospitalaria; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; Hb: hemoglobina.
Respuesta al tratamiento con ferroterapia parenteral
| Respuesta completa (Hb>2g/dl), % | Respuesta parcial (Hb 1–1,9g/dl), % | |
| Pacientes | 4 | 4 |
| Hb basal, g/dl | 10,3±2,1 | 9,4±2,6 |
| Variación de Hb, g/dl | ↑3,6±0,8 | ↑1,3±0,2 |
| Tipo de EEI (EC/CU), % | 33,3 (0,8–90,6)/66,7 (9,4–99,2) | 100/0 |
| Sexo masculino, % | 66,7 (9,4–99,2)/33,3 (0,8–90,6) | 0/100 |
| Edad, años | 46±16 | 49,3±16 |
| Fumadores, % | 66,7 (9,4–99,2)/33,3 (0,8–90,6) | 33,3 (0,8–90,6)/66,7 (9,4–99,2) |
| Ingreso hospitalario, % | 33,3 (0,8–90,6)/66,7 (9,4–99,2) | 0/100 |
| Tratamiento corticoideo, % | 66,7 (9,4–99,2)/33,3 (0,8–90,6) | 33,3 (0,8–90,6)/66,7 (9,4–99,2) |
| Promedio del tiempo de tratamiento, número de infusiones | 5,3±1,1 | 3,7±0,6 |
| Proteína C reactiva, mg/dl | 2,9±0,7 | 0,3±0,2 |
| Orosomucoide, mg/dl | 194±62,2 | 92±38,7 |
| Velocidad de sedimentación globular | 30,4±10,5 | 24,9±9,1 |
| Hierro sérico, μg/dl | 29,7±21,9 | 22±12,2 |
| Ferritina, ng/ml | 147±188,2 | 68±80 |
| Transferrina, mg/dl | 250,6±54,1 | 361,6±51,5 |
| Índice de saturación de transferrina, % | 10,6±9,8 | 5,3±3,1 |
Los valores mostrados entre paréntesis corresponden al intervalo de confianza del 95%.
↑: aumento del valor en unidades expresadas tras el alta hospitalaria; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; Hb: hemoglobina.
Por último, no se encontraron diferencias estadísticamente significativas en los valores de ferritina, índice de saturación de transferrina y transferrina entre los grupos con «respuesta presente» o «ausente».
DiscusiónLa prevalencia de anemia en pacientes con EII no se conoce con exactitud, pero se considera una de las complicaciones más comunes19. Wilson et al10 estiman que entre el 10 y el 73% de los pacientes ambulantes y el 30 y el 70% de los hospitalizados con EC tienen anemia. En la misma revisión, en pacientes con CU la prevalencia osciló en los pacientes ambulantes entre el 9 y el 37% y en los ingresados ascendió hasta el 54%. En ambas entidades, hasta el 31% de los enfermos presentaba cifras de Hb por las que se clasificaría a la anemia como «grave» (Hb<10g/dl). En una revisión sistemática más reciente, la prevalencia de anemia de forma global se situó en el 17% y se elevó hasta el 68% en los pacientes hospitalizados3.
Este estudio sobre 253 pacientes ambulantes demostró una prevalencia de anemia del 29,6%, que aumentó hasta el 39% en los pacientes con EC. Por otro lado, los pacientes con CU en este estudio presentaron una prevalencia menor de anemia, que se situó en el 19,7%. En los pacientes ingresados, la proporción se elevó hasta cifras del 65,6%. Estos datos son, por tanto, congruentes con los estudios previos.
Se puede considerar que la anemia en los pacientes con EII tiene en la mayoría de los casos un carácter multifactorial3,20. En este grupo de pacientes, la anemia presentó datos compatibles con ferropenia en el 67% de los casos; el 33% restante fue el resultado de una posible influencia de factores como la anemia de trastornos crónicos21, de malabsorción o de etiologías toxicomedicamentosas22–24.
La mayor proporción de pacientes con anemia en el grupo con EC puede justificarse por una mayor actividad inflamatoria de la enfermedad. El aumento de reactantes de fase aguda, la mayor necesidad de tratamiento esteroideo o la necesidad más frecuente de ingreso observada en los pacientes con EC respecto a los pacientes con CU orientan hacia una mayor actividad inflamatoria en el primer grupo. Diversas citocinas, como la interleucina 6, la interleucina 1, el factor de necrosis tumoral alfa y el interferón Χ, pueden afectar de forma importante a la eritropoyesis y al metabolismo del hierro21,25–31.
El tratamiento con hierro oral y parenteral demostró en este estudio una mejoría de la anemia similar a la descrita en observaciones previas. A modo de ejemplo, De Silva et al realizaron un estudio retrospectivo sobre 277 pacientes con EII y describieron una respuesta en los pacientes con anemia de tipo ferropénico del 59%32. No obstante, estos datos han de considerarse con cautela por 3 limitaciones importantes. En primer lugar, el carácter retrospectivo de este estudio hace que el tratamiento con las distintas formulaciones de hierro no esté ajustado a ningún protocolo. En segundo término, hay que considerar la heterogeneidad en cuanto al estado proinflamatorio de los individuos incluidos en los tratamientos con ferroterapia; así, es previsible una peor respuesta en pacientes con necesidad continuada de ciclos de esteroides o elevación persistente de los reactantes de fase aguda que en otros sin tales datos33. Por último, es relevante la ausencia de tratamiento con hierro en el 35% de los pacientes con anemia de tipo ferropénico; este hecho recalca una vez más cómo la anemia ha recibido una escasa atención en la práctica clínica diaria1,2.
En un intento por definir los parámetros bioquímicos que pudieran predecir una adecuada respuesta al hierro parenteral, Gasche et al34 realizaron un estudio prospectivo en 103 pacientes con EII y anemia grave. Al analizar las características analíticas basales de los respondedores al tratamiento, se observó que los pacientes con cifras de eritropoyetina mayores de 166U/l, del receptor soluble de la transferrina mayores de 75nmol/l y de transferrina mayores de 3,83g/l presentaban una mayor probabilidad de respuesta a la ferroterapia por vía intravenosa. Estos datos no permiten establecer a ninguno de estos parámetros ferrocinéticos y, tampoco, adicionales, como la cifra de eritropoyetina analizada por el estudio de Gasche, como predictores de una respuesta adecuada al tratamiento con hierro oral o intravenoso35–37, pero el reducido tamaño muestral obliga a interpretar con cautela estos hallazgos.
En resumen, las conclusiones principales de este estudio son que la anemia es frecuente en los pacientes con EII, y que no reciben tratamiento, en un porcentaje considerable de los casos. La minusvaloración de la condición del paciente con anemia y la repercusión sobre la calidad de vida de los pacientes ante la demora de la administración del tratamiento adecuado son factores importantes en los pacientes con EII38. La anemia es más frecuente en los pacientes con EC que en aquéllos con CU; la actividad inflamatoria detectada entre los primeros puede justificar este hecho. Y, por último, la respuesta al tratamiento con hierro es adecuada en una relativamente elevada proporción de pacientes. No obstante, son necesarios más estudios que permitan seleccionar la opción de tratamiento más adecuada en función de las características de cada paciente de forma individualizada3,39.