El cáncer colorrectal (CCR) es el tumor maligno más frecuente en España, si se consideran ambos sexos, y la segunda causa de fallecimiento por cáncer. Cada semana se diagnostican en España más de 500 casos de CCR y fallecen casi 260 personas por la enfermedad. Las estimaciones epidemiológicas para los próximos años son que se incrementará notablemente el número absoluto de casos anuales. El CCR es un tumor perfectamente prevenible y curable en el 90% de los casos si se detecta en fases iniciales, y en el que se ha demostrado que la implantación de programas de cribado poblacionales reduce la incidencia y mortalidad. En España, si no se instauran medidas de detección precoz, se estima que, en los próximos años, 1 de cada 20 hombres y una de cada 30 mujeres presentarán un CCR antes de los 75 años.
La Alianza para la Prevención del Cáncer de Colon en España es una entidad independiente y sin ánimo de lucro, creada en el año 2008, y que integra asociaciones de pacientes, organizaciones altruistas no gubernamentales y sociedades científicas. Su objetivo fundamental es dar a conocer y difundir la importancia sanitaria y social del CCR en nuestro país, y promover las medidas de cribado, detección precoz y prevención. Es necesario concienciar a los profesionales sanitarios, sociedades científicas, instituciones sanitarias y a la propia sociedad civil sobre un problema de salud muy relevante y que requiere la participación de todos. La detección precoz del CCR es una cuestión que afecta a toda la sociedad y, por tanto, es imprescindible aunar todas las voluntades posibles y conseguir la colaboración de todos.
Colorectal cancer (CRC) is the most common malignant tumor in Spain, when men and women are considered together, and the second leading cause of cancer death. Every week in Spain over 500 cases of CRC are diagnosed, and nearly 260 people die from the disease. Epidemiologic estimations for the coming years show a significant increase in the number of annual cases. CRC is a perfectly preventable tumor and can be cured in 90% of cases if detected in the early stages. Population-based screening programs have been shown to reduce the incidence of CRC and mortality from the disease. Unless early detection programs are established in Spain, it is estimated that in the coming years, 1 out of 20 men and 1 out of 30 women will develop CRC before the age of 75. The Alliance for the Prevention of Colorectal Cancer in Spain is an independent and non-profit organization created in 2008 that integrates patients’ associations, altruistic non-governmental organizations and scientific societies. Its main objective is to raise awareness and disseminate information on the social and healthcare importance of CRC in Spain and to promote screening measures, early detection and prevention programs. Health professionals, scientific societies, healthcare institutions and civil society should be sensitized to this highly important health problem that requires the participation of all sectors of society. The early detection of CRC is an issue that affects the whole of society and therefore it is imperative for all sectors to work together.
«La conciencia cívica y la cooperación entre las personas son las bases éticas de la sociedad y constituyen una cuestión que nos implica a todos.» Michel Winock, El siglo de los intelectuales, 2010.
Según los datos del Instituto Nacional de Estadística, en el año 2009 fallecieron en España 14.238 personas de cáncer colorrectal (CCR), lo que representa alrededor de 260 muertes semanales1. En números absolutos, y según la misma fuente2, dicha cifra supone un aumento del 2,93% con respecto al año 2008 y del 22% si se compara con la publicada en 1999 (11.300 fallecimientos)3. El CCR es la segunda causa de muerte por tumores en España y en los países de la Unión Europea, tras el cáncer de pulmón4–6. Se considera que el CCR representa la séptima causa global de fallecimiento en España1. Las comunidades autónomas (CC.AA.) con mayor índice de mortalidad son Asturias, País Vasco, Galicia, Castilla-León, La Rioja y Cataluña; en el extremo opuesto están Ceuta, Melilla y Castilla-La Mancha7.
En la actualidad, el CCR es el tumor más frecuente en la población española si se consideran ambos sexos en conjunto, con un patrón de incidencia anual ascendente que alcanza el 2,5% en los hombres8. La incidencia anual ajustada, según la edad, del CCR en España es de 60,4/100.000 en los hombres y 34,10/100.000 en las mujeres, con tasas similares a la media de los países de la Unión Europea2,7 que son 60,5 y 37,2, respectivamente4,8.
En el año 2002 la incidencia estimada de CCR en España fue de 21.964 casos nuevos7, mientras que 5 años después, en 2007, la cifra alcanzaba casi los 26.000 casos nuevos de la enfermedad. Las estimaciones epidemiológicas para el año 2012 son que se superarán los 33.0009. Ello supone que en España casi 600 personas serán diagnosticadas de CCR todas las semanas, lo que equivale a 85 casos diarios. Después del CCR se calcula que los tumores más frecuentes serán el cáncer de próstata (29.990 casos), el cáncer de mama (27.700 casos) y el cáncer de pulmón (25.300 casos)9.
En cuanto a los datos de prevalencia, también el CCR es el segundo tumor más frecuente en España, con más de 65.000 casos a los 5 años, solo por detrás del cáncer de mama (69.993 casos)7. Además, si se analizan las causas de ingresos hospitalarios en nuestro país por enfermedades oncológicas, el CCR es el tumor que provoca el mayor número de altas y de estancias hospitalarias. En el año 2009, se produjeron 43.379 altas hospitalarias por CCR con un número de estancias de 622.630. Estas cifras son muy superiores a las de otros tumores como el cáncer de pulmón, 32.319 altas y 347.494 estancias hospitalarias, y el cáncer de mama, con 32.034 y 161.067, respectivamente10. Todo ello implica un elevado consumo de recursos sanitarios.
Si se analiza la situación en los países europeos, los datos con respecto al CCR son similares a España4–6. En Europa se diagnosticaron, en el año 2008, 3.200.000 casos nuevos de cáncer y fallecieron 1.700.000 personas por la enfermedad. En conjunto, el tumor más frecuente fue el CCR con 436.000 casos, lo que representa el 13,6% de todos los tumores, seguido del cáncer de mama (13,1%), cáncer de pulmón (12,2%) y cáncer de próstata (11,9%). Con respecto a la mortalidad, el CCR es la segunda causa de muerte por cáncer en Europa (212.000 casos), por detrás del cáncer de pulmón (342.000 casos), y muy por delante del cáncer de mama (129.000) y cáncer gástrico (117.000)4–6.
El CCR es el tercer tumor más frecuente en el mundo y la cuarta causa de fallecimiento por cáncer11. Las áreas geográficas con mayor incidencia son Australia, Nueva Zelanda, Estados Unidos (EE.UU.), Canadá y Europa, cuyas cifras prácticamente duplican las observadas en países asiáticos, excepto Japón y América del Sur. En el año 2008 se diagnosticaron en el mundo 1.200.000 casos nuevos de CCR (9,7% del total de tumores malignos), y fallecieron más de 600.000 personas. En los próximos decenios se estima que la incidencia aumentará un 80%, hasta superar los 2.200.000 casos anuales, con un incremento subsecuente de mortalidad11,12. EE.UU. es el único país en el que la aplicación de medidas de detección precoz ha contribuido a la disminución de la incidencia y mortalidad por CCR en las últimas décadas13–15. Sin embargo, el beneficio obtenido no es uniforme en todos los segmentos de la sociedad, y se constatan menores reducciones en los grupos de población con nivel socioeconómico más bajo15.
La mayoría de los casos de CCR (70%) se consideran esporádicos, ya que se producen en individuos mayores de 50 años, sin antecedentes personales ni familiares de la enfermedad, y se definen como población de riesgo medio. Este grupo de población es subsidiario de incluirse en programas de cribado poblacional entre los 50 y 70/74 años16. En alrededor del 20-25% de los pacientes con CCR existen antecedentes familiares de la enfermedad, sin un patrón de herencia definido, y se denominan formas familiares17. Por último, aproximadamente el 5% de los CCR acaecen en familias con síndromes hereditarios en los que se han identificado los genes relacionados, de baja frecuencia pero gran penetrancia, lo que conlleva un riesgo elevado de presentar la enfermedad18. Las formas familiares y hereditarias se engloban como población de alto riesgo, y en ellas es obligado implantar programas de cribado y vigilancia primordialmente mediante técnicas endoscópicas19.
El término cribar deriva del latín y significa seleccionar rigurosamente20. El concepto de cribado referido a la salud consiste en aplicar pruebas diagnósticas en una persona asintomática con objeto de detectar precozmente una enfermedad21–23. Los primeros datos que confirman el beneficio de dicha estrategia sanitaria datan de los años 1940 y se refieren al diagnóstico precoz de enfermedades infecciosas. Cuando la estrategia de cribado se aplica a una determinada población, se denomina cribado poblacional24.
Con respecto a las enfermedades oncológicas, la detección precoz ha supuesto un verdadero reto sanitario desde las primeras décadas del siglo pasado. Así, en el año 1937 se crea en Nueva York la primera clínica dedicada a detectar las enfermedades oncológicas en fases iniciales25. En 1947, en una conferencia de consenso en EE.UU. se preconiza la implantación de medidas de detección precoz en las enfermedades crónicas, y entre ellas el cáncer21. En 1951, la Comisión Federal de Enfermedades Crónicas de EE.UU. define el concepto de cribado26, y en 1957 se incluye el cáncer de recto dentro de los tumores susceptibles de cribado, junto al cáncer de mama, cuello uterino y piel27. Los primeros resultados de un estudio prospectivo observacional que avala la aplicación de la citología como método de cribado poblacional del cáncer de cuello uterino se publican en 195528, y un decenio después el estudio de Shapiro et al.29 constata la utilidad de la mamografía como método de cribado del cáncer de mama.
Cuando en la actualidad se plantea la necesidad de adoptar medidas de cribado del CCR puede parecer que se trata de una cuestión o un problema reciente, pero no es así. Las iniciativas de diagnóstico precoz del CCR datan de los años 1930-1940 en EE.UU., mediante la aplicación de las pruebas de sangre oculta en heces (SOH), el enema opaco y la sigmoidoscopia25,30–32. Esta última técnica alcanzó notable auge en las décadas de 1940-197033–35 hasta la aparición de la colonoscopia a mediados de los años 196036. En 1967 Greegor publica un estudio prospectivo en población asintomática en el que reseña la utilidad de la prueba de SOH y la sigmoidoscopia para descubrir lesiones colorrectales37.
En el transcurso de los años 1960 son numerosas las publicaciones científicas, sobre todo en EE.UU., Canadá y Reino Unido, que abordan el problema del diagnóstico precoz del CCR y recomiendan aplicar medidas de cribado38–45. En 1968, Wilson y Junger23, con el patrocinio de la Organización Mundial de la Salud (OMS), recopilan la información precedente y publican un texto que define los criterios que deben regir el cribado poblacional de las enfermedades, y que supone una referencia ineludible hasta la actualidad. El CCR es una enfermedad que cumple todos los criterios propuestos y que, por tanto, debe ser incluido en los programas de cribado: a) constituye un importante problema de salud; b) se conoce la historia natural de la enfermedad, con una fase latente que permite el diagnóstico precoz; c) se dispone de los procedimientos diagnósticos adecuados, y aceptados por la población; d) su tratamiento es más efectivo cuando se diagnostica en un estadio precoz y su coste puede asumirse económicamente. Una premisa importante es que el cribado poblacional debe considerarse siempre un proceso continuo en el tiempo. Estos criterios son corroborados en 1975 por Frame y Carlson46.
En 1971 se crea en EE.UU. el Plan Nacional Contra el Cáncer, lo que supone un paso trascendental en la prevención de los tumores más prevalentes47. Durante los años siguientes varias instituciones y sociedades científicas de Canadá y EE.UU. avalan las estrategias de cribado del CCR en la población, propugnan la financiación económica e introducen el concepto de coste-efectividad48–53. En aquella época, el rango de edad estimado para incluir a la población en programas de cribado del CCR se establece entre los 40 y los 59 años. En 1980, la comisión estadounidense sobre el cáncer constata los beneficios indudables del diagnóstico precoz y preconiza los métodos de cribado del CCR54–57. A partir de este punto se inicia un camino irreversible en el cribado del CCR en el que la evidencia científica es cada vez mayor. Treinta años después, la OMS, en su plan de acción 2008-2013, considera prioritaria la aplicación de medidas de prevención secundaria en las enfermedades crónicas más prevalentes, entre ellas el cáncer58.
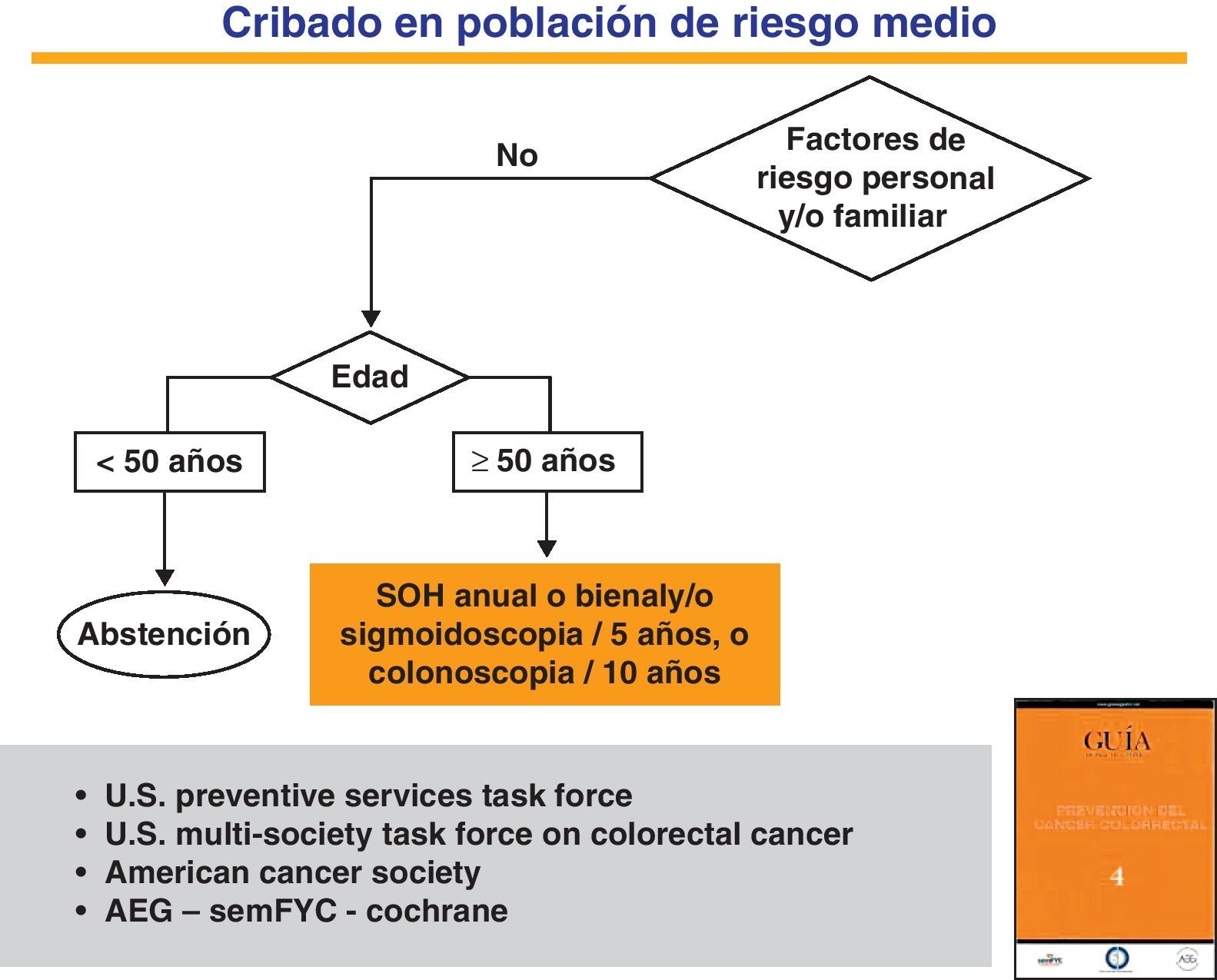
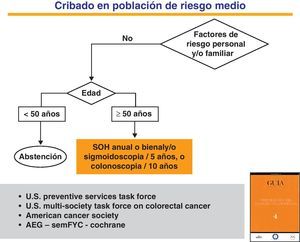
Cribado en la población de riesgo medio. Métodos de detección precozEl CCR es una enfermedad que cumple todos los requisitos necesarios para ser incluido en programas de cribado poblacional dirigidos a la población de riesgo medio16,59,60. Las principales técnicas diagnósticas empleadas en la actualidad son las pruebas de detección de SOH, la sigmoidoscopia y la colonoscopia61 (fig. 1). Aunque existen otros procedimientos, ninguno de ellos está avalado por la evidencia científica. Solo con la prueba de SOH química (guayaco) y la sigmoidoscopia se han publicado ensayos clínicos aleatorizados que confirman la disminución de la incidencia y mortalidad de la enfermedad61–63.
Estrategias para el cribado del cáncer colorrectal en la población de riesgo medio.
Adaptada de la Guía de Práctica Clínica de Prevención del Cáncer Colorrectal. Programa de Elaboración de Guías de Práctica Clínica en Enfermedades Digestivas, desde la Atención Primaria a la Especializada: 4. Asociación Española de Gastroenterología (AEG), Sociedad Española de Medicina de Familia y Comunitaria (SemFYC), y Centro Cochrane Iberoamericana, Barcelona, 2009. Gastroenterol Hepatol. 2009;32:717.e1-717.e58. Disponible en: www.guiasgastro.net
La determinación de SOH con métodos químicos, como medida de detección precoz de lesiones colorrectales, se conoce desde hace más de un siglo. En las décadas de 1940-1960 se publican estudios que recomiendan su utilización en personas asintomáticas22,25,30,32,39,64. En 1969 los trabajos de Greegor confirman que la aplicación de la prueba química de guayaco en la población asintomática permite detectar lesiones en fases precoces43,44, y un año después se comercializa en EE.UU. la primera prueba basada en el método del guayaco, lo que permite su utilización poblacional65. En los años siguientes se confirma su utilidad66–70 y se inician varios ensayos clínicos aleatorizados que se publican en los años 1980-199071–74. Estos estudios, realizados en Europa (Dinamarca, Suecia y Reino Unido) y Estados Unidos, confirman la utilidad del método y demuestran una reducción de la mortalidad por CCR en la población incluida75–79. Posteriormente un estudio francés confirma los mismos resultados80. Los criterios científicos de los estudios avalan de manera incuestionable la implantación de programas de cribado de CCR en la población de riesgo medio81–83.
A comienzos de los años 1980 se inicia la utilización de un método de análisis inmunológico para detectar sangre oculta en heces84,85 y, en 1990, en Japón, se aplica en un programa de cribado poblacional de CCR. La prueba de sangre oculta en heces inmunológica (SOHi) se basa en la reacción de anticuerpos específicos contra la hemoglobina humana, y no precisa restricciones ni dietéticas ni farmacológicas. En Europa, el método inmunológico se instaura en Italia en los años 199088, mientras que en España se publica el primer estudio varios años después89. La implantación de este método y las mejoras técnicas actuales han supuesto un notable avance, de manera que ha sustituido a la prueba de guayaco. Aunque todavía no se ha publicado ningún ensayo clínico aleatorizado que confirme la disminución de la incidencia y la mortalidad del CCR con el test de SOHi, sí existen evidencias científicas indirectas suficientes que recomiendan su uso en este campo90,91.
La sigmoidoscopia es una técnica que permite explorar los 50-60cm distales del intestino grueso, sin sedación y en un tiempo reducido92. La justificación de su empleo en el cribado de CCR es que el mayor porcentaje de tumores aparece en el colon distal y sigma. Es un procedimiento con muy pocas complicaciones, que se lleva utilizando desde los años 1930 en la detección precoz del CCR de recto-sigma, y que alcanzó un auge notable en décadas posteriores25,33,34. En los años 1990 se publican varios estudios de casos y controles que confirman la utilidad de la técnica y la disminución de la mortalidad por CCR93,94. En todos los estudios cuando se detecta una lesión avanzada en la sigmoidoscopia es obligado efectuar una colonoscopia completa para descartar lesiones sincrónicas proximales. En 2010 se han conocido los resultados de un ensayo clínico aleatorizado en Reino Unido que, tras 11 años de seguimiento, confirma una disminución significativa en la incidencia y mortalidad por CCR63. En 2011 se ha publicado un ensayo clínico italiano en población de riesgo medio en el que se constata que una única sigmoidoscopia, realizada entre los 55 y 65 años de edad, se asocia con una reducción en la incidencia y mortalidad por CCR95. La principal limitación de la sigmoidoscopia es que no se ha demostrado que prevenga la aparición del CCR proximal96.
Aunque la colonoscopia óptica es el método que mejor explora el colon97–99, todavía no se disponen de ensayos clínicos que evalúen su eficacia en el cribado del CCR en cuanto a la reducción de la mortalidad. Sí existe evidencia contrastada, desde comienzos de los años 1990, de que la extirpación de adenomas durante la colonoscopia disminuye claramente la incidencia de la enfermedad100–103. Así mismo, estudios posteriores constatan que la colonoscopia de cribado detecta neoplasias avanzadas en el colon derecho, en personas asintomáticas, que no se habrían visualizado solo con sigmoidoscopia104. A pesar de la utilidad de la técnica, existe controversia sobre la fiabilidad de la colonoscopia para prevenir el CCR de localización derecha105–107. Actualmente, se llevan a cabo varios ensayos clínicos que comparan la colonoscopia con respecto a la prueba de SOH inmunológico en el cribado poblacional del CCR. Cuando la colonoscopia óptica de cribado es incompleta, por diversos motivos, se puede utilizar la colonoscopia virtual o colonografía mediante escáner que tiene una elevada sensibilidad para identificar lesiones mayores de 10mm13.
Alianza para la prevención del cáncer de colon en España. Antecedentes y constituciónLa principal causa de muerte entre los mayores de 65 años en España son las enfermedades del aparato circulatorio (109.027 fallecimientos). El cáncer es la segunda causa de muerte con 77.788 fallecidos, de los cuales más de 14.000 se deben al CCR1,7. La edad media de presentación del CCR en nuestro país es alrededor de los 70 años, con un predominio del sexo masculino en proporción de 1,5/1. Aproximadamente el 27% de los tumores tiene una localización proximal al ángulo hepático, y entre el 42 y el 46% de los casos se diagnostican en fases avanzadas (regional y diseminada)108–110.
La supervivencia media del CCR en España es similar a la de los países europeos de nuestro entorno y se estima que a los 5 años del diagnóstico sobreviven el 54,7% de los pacientes con cáncer de colon y el 50,2% de los que sufren cáncer de recto111–114. La alta cualificación de los profesionales de la sanidad española en el tratamiento de la enfermedad ha conseguido que la supervivencia del CCR en España haya mejorado en los últimos decenios y se sitúe al mismo nivel que la de los países más avanzados.
En los últimos 30 años la evidencia científica ha demostrado de manera irrefutable que el cribado poblacional del CCR disminuye su incidencia y mortalidad. Puede afirmarse que es el tumor que mejor se puede detectar en fases precoces y que la aplicación del cribado en la población de riesgo medio es una prioridad sanitaria115,116. A pesar de ello, la implantación en España, por diversos motivos y circunstancias, está lejos de considerarse adecuada116,117. Esta situación ha motivado que en los últimos años exista un notable interés y preocupación en diversos ámbitos científicos y sociales, y que se planteen iniciativas consensuadas que ayuden a solucionar un problema sanitario importante que nos afecta a todos. Este punto ha sido el motivo y el nexo de unión que ha permitido la creación de una iniciativa pionera en España, probablemente sin parangón, y que se denomina «Alianza para la Prevención del Cáncer de Colon»118.
A finales del año 1999, promovido desde la Asociación Española de Gastroenterología (AEG), se inicia un proyecto de cooperación denominado Epicolon y en el que han participado más de 25 hospitales españoles. Dicho proyecto ha permitido obtener una información científica muy relevante sobre las formas familiares y hereditarias del CCR en la población española119. Desde su comienzo, uno de los principales objetivos del grupo ha sido establecer y diseñar líneas de trabajo multidisciplinarias y transversales que integren a todos los profesionales implicados120. Así, en el año 2004, se edita la primera Guía de Práctica Clínica de Prevención del Cáncer Colorrectal redactada de forma conjunta por la Sociedad Española de Medicina de Familia y Comunitaria (SemFYC), la AEG y el Centro Cochrane Iberoamericano16,108. A mediados del año 2006 desde la AEG se diseña el estudio Colonprev dirigido a la población de riesgo medio, prospectivo, en el ámbito de 8 comunidades autónomas, y cuyo objetivo primordial es comparar la utilidad de las 2 pruebas más utilizadas en el cribado del CCR en dicha población: SOHi y colonoscopia. Dicho estudio ha podido llevarse a cabo gracias a la financiación de sendas ayudas de la Asociación Española contra el Cáncer (AECC) y el Instituto de Salud Carlos III, y participan en él miembros de otras sociedades científicas.
La idea de crear una asociación que aúne a todas las entidades científicas y sociales implicadas en la prevención y diagnóstico precoz del CCR surge en el año 2007, a partir del nexo de trabajo creado entre la AECC, SemFYC y AEG, y al que se integra desde su inicio la Sociedad Española de Oncología Médica (SEOM). Así, en el mes de noviembre de 2007 se celebra en Madrid el primer curso sobre clínicas de alto riesgo en el que participan representantes de todas las entidades relacionadas con el cribado121. A partir de este punto, se inicia un proyecto altruista, compartido, inédito en nuestro entorno, cuyo único objetivo es prevenir el CCR en España, y que constituye la «Alianza para la Prevención del Cáncer de Colon». En el transcurso de los primeros meses de 2008 se define la iniciativa, se celebra la primera reunión de trabajo y se integran en el proyecto una asociación de pacientes, Europacolon, así como la Sociedad Española de Epidemiología (SEE) y la Sociedad Española de Oncología Radioterápica (SEOR).
Los meses siguientes son un periodo de tiempo con una actividad y dedicación incesante y numerosas reuniones de trabajo, en el que se plasma y consolida la «Alianza para la Prevención del Cáncer de Colon en España» con el fin de promover y divulgar la relevancia del CCR y la necesidad de implantar medidas de cribado y detección precoz. Posteriormente se integran otras sociedades científicas y fundaciones que le proporcionan mayor valor: la Federación Española de Ostomizados (FEDAO), la Sociedad Española de Endoscopia Digestiva (SEED), la Asociación Española de Especialistas de Medicina del Trabajo (AEEMT), la Sociedad Española de Diagnóstico por la Imagen del Abdomen (SEDIA), la Sociedad Española de Patología Digestiva (SEPD), la Sociedad Española de Anatomía patológica (SEAP), la Fundación Cofares y la Fundación Tejerina. En la actualidad la Alianza está constituida por 15 entidades (tabla 1).
Alianza para la Prevención del Cáncer de Colon en España
| Entidades que integran la Alianza en 2011 (por orden alfabético): |
▪ Asociación Española Contra el Cáncer (aecc) |
▪ Asociación Española de Especialistas en Medicina del Trabajo (AEEMT) |
▪ Asociación Española de Gastroenterología (AEG) |
▪ EuropaColon España |
▪ Federación Española de Asociaciones de Ostomizados (FEDAO) |
▪ Fundación Cofares |
▪ Fundación Tejerina |
▪ Sociedad Española de Anatomía Patológica (SEAP-IAP) |
▪ Sociedad Española de Diagnóstico por Imagen del Abdomen (SEDIA) |
▪ Sociedad Española de Endoscopia Digestiva (SEED) |
▪ Sociedad Española de Epidemiología (SEE) |
▪ Sociedad Española de Medicina de Familia y Comunitaria (semFYC) |
▪ Sociedad Española de Oncología Médica (SEOM) |
▪ Sociedad Española de Oncología Radioterápica (SEOR) |
▪ Sociedad Española de Patología Digestiva (SEPD) |
Durante este tiempo, desde la Alianza se han establecido lazos y relaciones de trabajo con otras entidades y sociedades relacionadas con la atención al CCR como han sido: la Asociación Española de Cirujanos (AEC), la Fundación Olga Torres, otras sociedades de Atención Primaria, la Asociación Española de Coloproctología, la Asociación Española de Genética, Sociedades de Enfermería, Colegios provinciales de Enfermería, Organización Médica Colegial (OMC), Consejo General de Colegios Oficiales de Farmacéuticos y Consejo General de Colegios Oficiales de Enfermería. Igualmente, ha sido prioritario colaborar con las instituciones sanitarias y políticas de las comunidades autónomas y del Estado. De manera especial desde la Alianza se estima imprescindible contar con la colaboración y ayuda de los responsable y miembros de la «Estrategia en Cáncer» del Sistema Nacional de Salud en España122–124 y de las comunidades autónomas, así como de la Red de Programas de Cribado del Cáncer113 que integra a los responsables técnicos de los programas poblacionales de cribado de los servicios de salud de las comunidades autónomas125.
En el transcurso de estos años, todas las entidades que constituyen la Alianza han mostrado un encomiable grado de generosidad y compromiso con los ciudadanos, anteponiendo en todo momento sus legítimos intereses en favor del bien común. Sin duda ninguna, la Alianza representa un hito en la integración de la sociedad científica y civil de nuestro país, en pos de un objetivo común y real como es evitar la aparición de un tumor, el CCR, perfectamente prevenible y curable si se detecta precozmente.
Objetivos, finalidad y estructura de la AlianzaAunque en la mayoría de los países occidentales, especialmente en EE.UU., existen asociaciones, públicas y privadas126–133, que promueven las medidas de prevención del CCR, así como instituciones internacionales134,135, la iniciativa de la Alianza en España es pionera, ya que integra y representa a la mayoría de las sociedades científicas implicadas, asociaciones de pacientes y entidades no gubernamentales con una estructura organizativa totalmente independiente.
De manera global los principales objetivos de la Alianza son: a) informar y sensibilizar a la población, profesionales de la salud e instituciones sanitarias de la relevancia del CCR y, sobre todo, de la posibilidad de detectarlo precozmente; b) promover la realización de programas de cribado poblacionales de detección precoz de CCR en la población de riesgo medio entre 50 y 69 años, mediante prueba de SOHi, y c) garantizar la adecuada atención sanitaria a la población de alto riesgo de presentar la enfermedad (tabla 2). Además, también es prioritario establecer circuitos preferentes para pacientes sintomáticos y definir medidas de prevención primaria.
Principales objetivos de la Alianza
| 1. Sensibilizar a la población, a los profesionales de la salud y a las instituciones sanitarias de la importancia de la prevención del cáncer de colon |
| 2. Promover la realización de programas poblacionales de detección precoz de cáncer de colon en personas de riesgo medio (hombres y mujeres de 50-69 años) |
| 3. Garantizar la correcta atención de las personas de alto riesgo para el desarrollo de cáncer de colon |
Las propuestas de la Alianza se han dirigido a todo el ámbito social, científico e institucional del país relacionado con la prevención y el cribado del CCR: administraciones públicas y responsables políticos y sanitarios estatales y de las comunidades autónomas; profesionales sanitarios, médicos, diplomados de enfermería y farmacéuticos; compañías aseguradoras y departamentos de salud de las empresas; medios de comunicación, de todos los ámbitos (prensa, radio, televisión y a través de la red), estatales y, de manera especial, a la población general subsidiaria del cribado. En este sentido, las actividades divulgativas y de difusión de la Alianza han sido más relevantes, sobre todo, durante cada mes de marzo ya que se considera el mes del CCR en Europa.
Las actividades que se llevan a cabo son muy diversas e incluyen campañas publicitarias en medios de comunicación generales y especializados, reuniones científicas y/o divulgativas en colegios de médicos, farmacéuticos y de enfermería, universidades, hospitales, centros de salud; entidades públicas o privadas implicadas en la prevención, y reuniones formativas dirigidas a profesionales de todas las especialidades relacionadas con el cribado.
Aspectos demográficos y sociológicos de la población española relacionados con el cribado del cáncer colorrectalLa medicina del siglo xx ha tenido fundamentalmente un fin curativo, y se ha caracterizado, sobre todo, por un gran auge de la investigación básica, el diagnóstico y el tratamiento. Ello ha ido en muchos casos en detrimento de las medidas de detección precoz o cribado de las enfermedades más prevalentes58,136–139. En este sentido, la sanidad española se ajusta por completo a dicho perfil. El coste de esta opción es cada día mayor y supone un elevado consumo de recursos con un aumento importante del gasto farmacéutico hospitalario140,141. Estos datos, así como la longevidad de la población, hacen inexcusable adoptar medidas de prevención y detección precoz del CCR115.
En la actualidad, el conjunto de la población española supera los 47.000.000 de personas, de las cuales alrededor de 8.000.000 tienen más de 65 años; ello representa el 17,2% del total142,143. Las comunidades autónomas con mayor número de personas en este rango de edad son Andalucía, Cataluña y Madrid. Las proyecciones estadísticas para el año 2041 son que los mayores de 65 años superarán los 14.000.000 de personas y supondrán más del 29% de toda la población. En el año 2001 se produjo un punto de inflexión en la demografía española y, por primera vez, el porcentaje de personas mayores de 65 años superó a la población infantil de 0 a 14 años144.
Un aspecto demográfico relevante y que debe tenerse en cuenta a la hora de diseñar las futuras estrategias sanitarias, -sobre todo en medidas de salud pública, prevención y detección precoz de las enfermedades, en concreto del CCR,- es que alrededor del año 2020 iniciará la edad de jubilación la generación de españoles nacidos en los años del desarrollo 1957-1977144. Ello representa casi 14 millones de personas, lo que incidirá de forma evidente en la disponibilidad y distribución de los recursos de los sistemas de protección sanitario y social. Es evidente que la población española envejece y lo seguirá haciendo en las próximas décadas. Según la proyección del INE, en 2049 habrá más de 15 millones de personas mayores de 65 años de edad (31,9% del total)145.
La esperanza de vida de la sociedad española se ha incrementado de manera relevante en el siglo xx. Así, se ha pasado de una esperanza de vida media de 34,8 años en 1900 a 81,6 en los años actuales. Las mujeres españolas tienen una esperanza de vida de 84,6 años, y los varones de 78,5 años, cifras que se encuentran entre las más elevadas de la Unión Europea. Alemania, Italia, Francia, Reino Unido y España son los países europeos con una cifra más alta de personas mayores146. A la hora de planificar medidas de detección precoz y estrategias de cribado poblacional también es obligado tener en cuenta que alrededor de 6.000.000 de personas residen en el medio rural, en municipios con menos de 5.000 habitantes142.
El nivel socioeconómico es uno de los factores individuales más influyentes en la participación en los programas de prevención, independientemente del modelo de sistema sanitario, llegándose a diferencias de participación del 30% entre individuos con alto y bajo nivel socioeconómico113,118,147–150. En España, la tasa de riesgo de pobreza en la población mayor de 65 años es del 24,6% y supera en 4 puntos a la media del país. Además, el 27% de las mujeres y el 10,4% de los hombres mayores de 65 años viven solos151.
Los datos descritos tienen una repercusión evidente en varios órdenes de cosas, pero, de manera especial, en la salud de la población y en la distribución de los recursos sociosanitarios. Es necesario un cambio de actitud en el que se dé prioridad a las medidas de prevención y detección precoz, ya que a medio plazo ello va a suponer, entre otras cosas, un ahorro evidente del gasto sanitario108. Se calcula que en España, si no se implantan medidas de detección precoz, uno de cada 20 hombres y una de cada 30 mujeres presentarán un CCR antes de los 75 años.
Primer objetivo: sensibilizar a la población, a los profesionales de la salud y a las instituciones sanitarias de la importancia de la prevención y diagnóstico precoz del cáncer de colonEn la sociedad actual existe una profusión de mensajes e información, incluidas las noticias médicas, a través de los diversos medios de comunicación, que induce con frecuencia a difuminar los problemas reales152. En el ámbito de la salud es frecuente que la reiteración de los datos estadísticos y la abstracción de las cifras hagan que los ciudadanos, e incluso los profesionales sanitarios, vean las actividades de prevención como algo lejano y sin clara implicación para ellos; es lo que ocurre con el cribado del CCR en España. No es inusual que la información sanitaria que se transmite a la sociedad no diferencie entre lo intrascendente y anecdótico de lo que realmente aporta datos de interés.
El estigma asociado al cáncer durante muchos años153, la escasa cultura de salud pública y la poca relevancia en los planes de estudios en España, así como las connotaciones peyorativas asociadas a la localización anatómica del tumor, han motivado la escasa preocupación de la población general, y de los propios profesionales sanitarios, por la detección precoz del CCR. El conocimiento de la población general sobre las medidas de detección precoz del CCR es bajo en España154. Un reciente estudio llevado a cabo por el observatorio del cáncer de la AECC acerca de la percepción y el conocimiento del CCR en la población española155 destaca que el 61% de los encuestados desconoce qué tipo de pruebas se utilizan en el diagnóstico precoz. Además, más del 50% de la población apenas conoce los aspectos relacionados con el tumor y solo el 25% lo considera un problema de salud relevante. Estos datos confirman el desconocimiento que existe sobre la enfermedad y la necesidad de información adecuada sobre las medidas de prevención y detección precoz.
Actividades de la Alianza dirigidas a la población generalUno de los principales objetivos de la Alianza es informar y concienciar a la población general de la relevancia del CCR y de las medidas necesarias para su prevención y detección precoz156. Para ello se vienen realizando desde el año 2009 campañas divulgativas, durante el mes de marzo, coincidiendo con la celebración del Mes Europeo del Cáncer de Colon, y que culminan el 31 de marzo, que es el «Día de la prevención del cáncer de colon» en España.
Durante dicho mes se lleva a cabo una campaña publicitaria en medios de comunicación generales y especializados, tanto en prensa como radio, televisión y a través de la red; ruedas de prensa de ámbito nacional y en las CC.AA. y provinciales; distribución de comunicados de prensa; entrevistas en medios de comunicación; instalación de un «colon gigante» con actividades formativas en diferentes ciudades; mesas informativas en diversas zonas de las ciudades y en los principales centros hospitalarios con distribución de material informativo; publicidad en medios de transporte y estática en numerosas ciudades en estrecha colaboración con las autoridades municipales; entrega de octavillas y dípticos en oficinas de farmacia de todo el país gracias a la generosa colaboración de la Fundación Cofares. Igualmente, la creación de una página web permite la divulgación e interrelación con la población118.
En todo el material informativo se hace también especial hincapié en las medidas de prevención primaria –dirigidas a disminuir el riesgo de desarrollar la enfermedad–, y secundaria o de cribado. Cada vez existe mayor evidencia de la relación existente entre la obesidad, el consumo de alcohol, el tabaquismo y la inactividad física y el riesgo de presentar una neoplasia colorrectal157–160. La modificación del estilo de vida de las sociedades occidentales puede ser un punto crucial en la prevención del CCR161.
En la campaña divulgativa que se celebra durante el mes de marzo colaboran de manera desinteresada diferentes entidades, instituciones y patrocinadores de todos los ámbitos sociales, públicos y privados. Dicha campaña, así como otras cuestiones, serían inviables, sin la aportación de la AECC, tanto en recursos materiales como en otros aspectos. De manera especial, cabe destacar la dedicación de sus juntas provinciales, lo que ha permitido que las iniciativas de la Alianza lleguen a toda España. Igualmente, las asociaciones de pacientes integradas en la Alianza, Europacolon y FEDAO, contribuyen de manera notoria a divulgar la relevancia de la enfermedad, tanto en el entorno nacional como europeo.
Segundo objetivo: promover la realización de programas poblacionales de detección precoz del cáncer de colon en personas de riesgo medio (hombres y mujeres de 50-69 años)Cribado poblacional del CCR. Resumen histórico y directrices institucionalesDesde los años 1950 el aumento progresivo de la incidencia y mortalidad por CCR ha supuesto un problema sanitario creciente en los países occidentales. Por dicho motivo, a partir de dicha década, se viene preconizando la implantación de medidas de detección precoz del CCR en la población asintomática de riesgo medio162–172.
En Europa, las instituciones de la Unión Europea han asumido la necesidad de adoptar medidas de prevención contra el cáncer desde hace varias décadas. Así, en el año 1985, el Consejo de Europa en la reunión de Milán solicita una acción europea coordinada, que se corrobora los años siguientes mediante un plan de acción en el marco del programa «Europa contra el cáncer»173,174. Posteriormente, en 1994, dicho Consejo publica una serie de criterios que deben aplicarse para el cribado de las enfermedades crónicas175, incluido el cáncer, y en Reino Unido se crea en 1996 el Comité Nacional del Cribado (NSC). En 1999 se celebra en Viena una reunión científica de consenso, promovida por la Comisión Europea, en la que se constata la evidencia científica de las estrategias de cribado poblacional176–178. La magnitud del problema sanitario del CCR y la evidencia científica hacen que el Consejo de la Unión Europea, en mayo de 2003, presente una propuesta en la que insta a los países miembros a implantar programas de cribado poblacional para la detección precoz del CCR, mediante análisis de SOH, para hombres y mujeres de 50 a 74 años179. Dicha propuesta se acepta y edita en diciembre del mismo año180.
Posteriormente, las instituciones europeas reflejan el interés creciente en el cribado del CCR con varias iniciativas parlamentarias que han contado con el respaldo de la Alianza, tanto en la población de medio como de alto riesgo181–183. Así mismo, en 2010 se ha editado la Guía Europea de Calidad del Cribado del CCR que analiza todo el proceso de cribado, y que ha contado con la participación de miembros de sociedades científicas integradas en la Alianza184.
En España, durante la década de 1990 surgen algunas iniciativas aisladas que propugnan el cribado del CCR185–187, pero hasta el año 2000 no se establece el primer programa piloto institucional en Cataluña, en el municipio de L’Hospitalet de Llobregat, dirigido a la población de entre 50 y 69 años, mediante la prueba de SOH de guayaco188. En diciembre de 2005 comienza un estudio piloto en la comunidad Valenciana189, y unos meses más tarde en la comunidad de Murcia190, ambos incluidos en sus respectivos planes oncológicos. Según los datos del informe Descric191, a finales del año 2006 solo 128.074 personas estaban incluidas en España en programas piloto de cribado del CCR, lo que suponía alrededor del 1,35% de la población diana de entre 50 y 69 años.
Así mismo, en el año 2006, el proyecto de «Estrategia en cáncer» del Sistema Nacional de Salud (SNS) del Ministerio de Sanidad propugna como uno de sus objetivos principales la realización de estudios piloto mediante SOH en población de riesgo medio192,193. En febrero de 2007 se celebra en Murcia una reunión de expertos que define una serie de recomendaciones científicas para los programas poblacionales194. En mayo de 2008 se aprueba el cribado poblacional en el País Vasco195,196, en diciembre de 2008 en la comunidad autónoma de Cantabria197 y en 2009 en Canarias198. En los años siguientes se añaden estudios piloto en Castilla y León y La Rioja, y se amplía en Cataluña en 2 áreas de Barcelona199.
En el año 2009 se actualiza el proyecto de «Estrategia del cáncer» que plantea como objetivos prioritarios la puesta en marcha de programas poblacionales, con una cobertura del 50% de la población diana para el año 2015200. Así mismo, recientemente se ha publicado un documento marco sobre el cribado poblacional que establece criterios para la aplicación de estrategias de cribado poblacional en España, con el consenso de todas las comunidades autónomas dentro del Consejo Interterritorial del Sistema Nacional de Salud201. Según los datos de la Red de Programas de Cribado del Cáncer202 en el año 2010, el 11% de la población general española de 50-69 años estaba incluida en programas de cribado poblacional de cáncer de colon, lo que representa alrededor de 1.100.000 personas202. Todos los programas de las comunidades autónomas siguen las recomendaciones y cuentan con el aval de las instituciones sanitarias estatales e internacionales203,204 (tabla 3).
Condiciones necesarias para aplicar el cribado poblacional del cáncer colorrectal
| • Existe una población diana definida e identificable |
| • Hay un sistema de invitaciones para participar en el cribado, efectuar la prueba y analizar su resultado |
| • Existe acuerdo sobre el intervalo de repetición de las pruebas y los grupos de edad en que se debe realizar el cribado |
| • Se dispone de la capacidad de diagnóstico suficiente para confirmar la sospecha después de un resultado positivo en la prueba de cribado, así como capacidad terapéutica suficiente para tratar a estos pacientes de forma efectiva y rápida |
| • El cribado puede evaluarse mediante un sistema de información que incluya los aspectos diagnósticos y terapéuticos |
| • Hay un sistema de control de calidad que permite su mejora continua |
Adaptada de Borràs et al.117
En España, el precedente organizativo del cribado en cáncer de mama ha supuesto una notable ayuda para instaurar el programa del CCR. El cribado del cáncer de mama se inicia en el año 1990 en la comunidad de Navarra y se consigue una cobertura nacional del 100% en el año 2006125,203,205. Esta experiencia se ha trasladado al cribado del CCR, lo que ha permitido que desde sus inicios en el año 2000 en Cataluña exista una estrecha coordinación y consenso entre las comunidades autónomas, y también entre todos los profesionales sanitarios implicados. Es inexcusable la colaboración interprofesional, con unos protocolos compartidos.
En síntesis, se puede establecer que, tanto las directrices del Consejo de la Unión Europea, como de la Estrategia en Cáncer de España y los Planes de Salud Oncológicos de las comunidades autónomas, recomiendan el cribado poblacional de CCR en la población general entre 50-69/74 años, mediante análisis de SOH, que en la actualidad en España debe ser inmunológico, según un amplio consenso técnico e institucional. Si la prueba es positiva, se aconseja una colonoscopia óptica con sedación, que debe cumplir criterios estrictos de calidad. Los programas poblacionales de cribado del CCR son beneficiosos si se aplican de manera sistemática, mantienen la equidad, incluyen a toda la población diana y cumplen los máximos criterios técnicos y de calidad108 (tabla 4).
Indicadores de evaluación del programa de cribado de cáncer colorrectal
| Indicadores a corto plazo |
| • Población que acepta participar |
| • Población que completa el proceso de cribado |
| • Tasa de detección de cáncer y adenoma de alto riesgo |
| • Estadio de los cánceres diagnosticados |
| Indicadores a medio plazo (es necesario disponer de registro poblacional de tumores) |
| • Distribución de los casos de cáncer en la población, según invitación/participación en el cribado |
| • Distribución de los estadios de los cánceres diagnosticados en el programa |
| • Incidencia de cánceres en estadios avanzados |
| • Cánceres del intervalo |
| • Costes del programa |
Tomada de Borràs et al.117
En el año 2010 estaban registrados en España 469.000 profesionales sanitarios, sin contabilizar a los psicólogos clínicos: 192.707 médicos, 216.238 diplomados de enfermería y 55.615 farmacéuticos206. El grado de confianza de la población en la labor de estos profesionales es elevado. Además, según los datos del Barómetro de Salud del año 2010 el 71% de la población visita, al menos una vez al año, a su médico de atención primaria, y el 46% realiza alguna consulta ambulatoria de atención especializada207.
A pesar de la elevada cualificación de los profesionales sanitarios, la escasa formación en salud pública de los planes de estudios hace que el conocimiento sobre las medidas de prevención y detección precoz no sean suficientes. En este sentido, una de las prioridades de la Alianza ha sido facilitar e impulsar el conocimiento del cribado del CCR en todos los ámbitos profesionales relacionados con la salud. Así, se han celebrado jornadas científicas estatales y en las comunidades autónomas dirigidas a todos los profesionales sanitarios; sesiones clínicas hospitalarias, en atención primaria, enfermería y medicina del trabajo; reuniones interdisciplinarias; distribución de dípticos; editoriales en las revistas de las sociedades científicas que integran la Alianza; Organización Médica Colegial, Colegios de Enfermería, Consejo Nacional de Enfermería y Colegios Médicos provinciales.
También con un objetivo docente y divulgativo, anualmente se celebra el día 30 de marzo la jornada científica central de la Alianza que intenta exponer los últimos resultados y avances del cribado, tanto en España como en el ámbito internacional. En dichas jornadas participan ponentes de todas las especialidades relacionadas con el cribado, y cuenta con la especial colaboración de los representantes de la «Estrategia en cáncer» de España y de la Red de Programas de Cribado. Posteriormente se editan todas las ponencias199,208.
Otro aspecto divulgativo ha sido la publicación en el año 2009 de un libro sobre la prevención del CCR en España con la participación multidisciplinaria de expertos209. Así mismo, se ha hecho coincidir dentro de las actividades formativas de la campaña de la Alianza, la publicación de la actualización de 2009 de la Guía de Práctica Clínica de Prevención del Cáncer de Colon, elaborada por la AEG, semFYC y el Centro Cochrane Iberoamericano. Dicha guía está dirigida a los profesionales sanitarios, recoge la evidencia científica y una serie de recomendaciones sobre la prevención del cáncer de colon, y constituye una referencia internacional en castellano108.
Así mismo, desde la Alianza se ha facilitado la celebración de una reunión de trabajo en el año 2011 entre los representantes de 2 sociedades integradas en la Alianza, como son los médicos del trabajo (AEEMT) y los epidemiólogos (SEE) con experiencia en cribado de cáncer, que también forman parte de la red de cribado. El objetivo ha sido facilitar el diálogo e intercambiar información entre 2 colectivos profesionales implicados en la salud pública y en la salud laboral.
Actividades de la Alianza dirigidas a las instituciones políticas y administraciones sanitariasLa aplicación de programas de cribado poblacional del CCR es responsabilidad de las autoridades sanitarias, ya que requiere diseñar y coordinar las actividades en los ámbitos implicados, y disponer de recursos para el tratamiento y vigilancia de las lesiones detectadas. Igualmente, es imprescindible ofrecer continuidad al programa, ya que es la única manera de conseguir el objetivo principal del cribado que es reducir la probabilidad de fallecer por la enfermedad117,123–125,203. En este sentido, España adolece de una escasa cultura de prevención, y de proyectos a largo plazo cuyos resultados no son inmediatos, pero que sí pueden ayudar a conocer y modificar la historia natural de la enfermedad. Así, los registros de tumores poblacionales se iniciaron en el año 1960 en Zaragoza, seguidos por Navarra en 1970 y después en otras comunidades autónomas. En la actualidad, solo el 26,5% de la población está incluida en dichos registros210,211.
Desde la Alianza, se considera imprescindible colaborar, facilitar y apoyar las medidas promovidas por las administraciones sanitarias, así como concienciar e informar de los aspectos técnicos del cribado. Por ello, nos hemos dirigido a todos los gestores y responsables sanitarios y políticos estatales y de las comunidades autónomas implicados en los programas de prevención, partidos políticos, organismos sindicales y otras asociaciones públicas y privadas.
El 25 de marzo de 2009 el Congreso de los Diputados recibió a una representación de la Alianza, a través del presidente de la Comisión de Sanidad y Consumo y del presidente del Congreso, y se firmó una carta de apoyo y adhesión a las iniciativas de la Alianza. Igualmente, se han llevado a cabo reuniones con los responsables de las consejerías de Sanidad para informarles sobre el propósito de la Alianza. Además, en el año 2010 desde la Alianza se ha elaborado un manifiesto en el que se solicitaba a las autoridades sanitarias nacionales y autonómicas su compromiso para llevar a cabo diversas acciones con el fin último de disminuir la mortalidad y la incidencia del CCR en España. Los consejeros de Sanidad de 9 comunidades autónomas han firmado el documento propuesto, y los restantes apoyan de manera tácita su enunciado.
Un año más tarde, el 28 de abril de 2010, el Pleno del Senado, a iniciativa de su comisión de Sanidad, y recogiendo una propuesta de la Alianza, aprobó en el Pleno una moción conjunta de todos los grupos parlamentarios instando al Gobierno para que proponga a las comunidades autónomas que adopten las medidas adecuadas para implantar programas de cribado. Dicha propuesta debe plasmarse en el Consejo Interterritorial. También desde la Alianza se ha instado a todos los partidos políticos con representación parlamentaria para que apoyen y difundan las medidas de prevención del CCR.
Estudio ColonprevComo ya se ha comentado en un apartado anterior, en la actualidad se llevan a cabo varios estudios que comparan la colonoscopia con respecto a la prueba de SOHi en el cribado poblacional del CCR. Uno de ellos es el estudio Colonprev que se está realizando en 8 comunidades autónomas españolas, con un diseño multicéntrico, prospectivo y aleatorizado, y promovido y diseñado desde la AEG, con la colaboración de la Fundación Científica de la Asociación Española Contra el Cáncer y el Instituto de Salud Carlos III. Dicho estudio es un exponente más de las actividades científicas de los miembros de la Alianza, y sus resultados preliminares pueden esclarecer algunos de los interrogantes sobre la elección del método de cribado del CCR en población de riesgo medio.
Guía de práctica clínica de calidad de la colonoscopia de cribado del cáncer colorrectalEn el año 2011 se ha editado la primera guía clínica de calidad de la colonoscopia de cribado del CCR, diseñada y realizada por el grupo de trabajo de la AEG y la SEED, y que ha contado con la colaboración de otras entidades integradas en la Alianza212. La publicación de dicha guía supone una referencia en castellano, y viene a completar un aspecto básico en el cribado poblacional del CCR como es la calidad técnica de la colonoscopia213. Esta técnica es el procedimiento diagnóstico y terapéutico fundamental en los programas de cribado. Es necesario implementar un programa consensuado que garantice la máxima calidad científico-técnica, así como la seguridad de la exploración, la satisfacción del paciente y la accesibilidad, entre otras cuestiones.
Situación del cribado del cáncer colorrectal en los países con mayor incidenciaLa situación del cribado poblacional del CCR es muy heterogénea en los países de mayor incidencia, y son pocos los sistemas sanitarios públicos que tienen programas poblacionales bien establecidos y que incluyan a toda la población214. EE.UU. es el único país en el que se ha constatado que la aplicación y avances en los métodos de cribado y tratamiento han permitido disminuir la mortalidad por CCR en un 30% en el periodo 1990-200613,61. Se estima que en 2010 más del 60% de la población de entre 50 y 75 años, y que dispone de seguro médico, se ha realizado algún método de cribado de la enfermedad215,216. También se aprecian diferencias notables de implantación según el nivel socioeconómico de la población. Por dicho motivo en el año 2009 los Centros para el Control y la Prevención de Enfermedades (CDC) inician un programa de cribado institucional dirigido a la población con ingresos bajos y que no disponen seguro sanitario, o bien es insuficiente. El programa se lleva a cabo en 22 estados y 4 poblaciones autóctonas y está dirigido a la población de 50-64 años217,218.
En Canadá se están realizando varios estudios piloto desde el año 2007219. En Australia, durante los años 2002-2004 se desarrollan programas pilotos mediante la prueba de SOHi y en el año 2006 comienza un cribado poblacional que se inicia en la población de entre 55 y 65 años, y en 2008 se amplía desde los 50 a los 65 años220. Japón inicia un programa de cribado mediante SOHi en el año 1992 con una participación inicial baja, del 17%; en el año 2005 se modifica la estrategia institucional, observando un aumento de la tasa de participación86,87. También la República de Corea del Sur ha establecido el cribado mediante SOHi en los últimos años. Según datos del año 2008, Nueva Zelanda no cuenta todavía con programas poblacionales de CCR219
De acuerdo con la información obtenida en 2008, los países de la Unión Europea con mayor incidencia de CCR son Hungría, República Checa y Eslovaquia. Por el contrario, Grecia es el país con menor incidencia. España ocupa un lugar intermedio con cifras ligeramente inferiores a Dinamarca, Irlanda, Italia, Bélgica y Alemania, similares a Portugal, y algo mayores que Francia, Reino Unido y Suiza4. La población europea subsidiaria de las estrategias de cribado de CCR es de alrededor de 136 millones de personas, de las cuales, en 2007, solo 11.639.000 se había realizado pruebas diagnósticas221,222. En 2008 la Unión Europea publica el primer informe sobre la implantación del cribado poblacional de CCR con resultados heterogéneos221–223. Se constata que 19 de los 27 estados miembros asumen la organización de programas poblacionales; 12, entre ellos España, mediante prueba de SOH; 6 (Austria, Chipre, Alemania, Grecia, Italia y Eslovaquia) compaginan los métodos de SOH y endoscópicos, y Polonia opta directamente por la colonoscopia. En dicho año, solo 5 estados disponían de programas nacionales: Francia, Finlandia y Reino Unido mediante SOH; Italia (SOH y sigmoidoscopia) y Polonia (colonoscopia). En el año 2009, 14 estados referían programas poblacionales, más o menos desarrollados, 7 disponían de alguna actividad y 6 no incluían ninguna medida224–226.
Reino Unido inicia el cribado poblacional en 2006 en Gales e Inglaterra, con test de SOH químico, después de realizar varios estudios piloto en las décadas anteriores. La reciente publicación de un estudio a largo plazo mediante sigmoidoscopia, con resultados muy favorables, ha hecho que se incluya dicha técnica como una estrategia de cribado poblacional227,228. Los Países Bajos también inician un programa poblacional en el año 2009 mediante SOHi229,230. Francia desarrolla varios estudios piloto a partir de 2002, mediante SOH químico, que amplía en 2006. En la actualidad existe un programa poblacional dirigido a personas de 50-74 años, y se ha introducido también la prueba de SOHi. Los resultados iniciales constatan unos índices de participación muy variable entre regiones, que oscila entre el 23,5% en La Reunión y el 52,4% en el área de Borgoña231–235. Italia ha sido uno de los primeros países de Europa en la utilización de la prueba de SOHi, así como la aplicación de la sigmoidoscopia. A partir de 2005-2006 existen 2 estrategias de cribado poblacional, según las regiones: SOHi bienal entre 50-69/74 años, o bien sigmoidoscopia una vez alrededor de los 60 años de edad95,236,237.
Alemania mantiene una larga experiencia en el cribado del CCR que se remonta a los años 1970 mediante la prueba del guayaco, y posteriormente SOHi. A partir de 1990 se preconiza el cribado oportunista con SOH con reembolso económico, hasta el año 2002 en que inicia el programa de cribado del CCR mediante colonoscopia. Entre los años 2003-2007 se han realizado más de 2,8 millones de exploraciones, cuyo coste asumen las instituciones sanitarias y las compañías de seguro238,239. Polonia comienza en 2005 un programa de detección precoz de CCR mediante colonoscopia en todo el país240. En Portugal no existe un programa nacional, pero sí estudios piloto mediante SOH, así como una iniciativa de la Sociedad de Endoscopia que realiza sigmoidoscopia241. Hungría también está desarrollando estudios piloto mediante prueba de SOHi242.
Actividades de la Alianza en el ámbito europeoLa Alianza ha participado en la Declaración del Parlamento Europeo, 0068/2010, de 20 de septiembre, promovida por diversas sociedades científicas europeas, en la que se insta a los Estados miembros a que pongan en marcha programas de prevención y cribado del CCR243. A través de la Alianza, dicho documento ha contado con la anuencia de los miembros españoles en dicho Parlamento. El cribado del CCR constituye una notable preocupación para los responsables sanitarios europeos.
Tercer objetivo: garantizar la correcta atención de las personas con alto riesgo de presentar cáncer colorrectalSegún se ha referido, y desde un punto de vista práctico, el riesgo individual de presentar un CCR se clasifica en riesgo medio (individuos ≥ 50 años sin antecedentes de riesgo adicionales) y riesgo alto (correspondiente a las personas con antecedentes personales o familiares de CCR), o bien portadores de una mutación genética que induce un síndrome hereditario17,18,108,109,244. Se estima que alrededor del 25% de los casos de CCR ocurren en personas con antecedentes familiares de CCR y, por ello, se denominan formas familiares. En este grupo de población el riesgo de sufrir un CCR es mayor que la población general y, por tanto, resulta importante identificarlas y establecer medidas de cribado, fundamentalmente mediante colonoscopia17,108,244,245.
Aunque se desconoce el número de personas incluidas en el grupo de riesgo familiar, se calcula que alrededor del 2% de la población europea de entre 45 y 70 años tienen antecedentes familiares de CCR, lo que supone aproximadamente 3 millones de personas asintomáticas y que son subsidiarias de medidas de detección precoz de una manera organizada y multidisciplinaria108,244,246. En este sentido, uno de los principales objetivos de la Alianza es dar a conocer esta situación; promover las medidas de formación de los profesionales implicados, y facilitar la comunicación y coordinación entre ellos. Si existe algún punto en el que son imprescindibles los protocolos de detección y actuación conjuntos, este sería la prevención del CCR en las personas de alto riesgo. Además, comporta aplicar unas pautas de vigilancia que deben cumplir los criterios científicos y de calidad de la colonoscopia, y adecuados a unos recursos sanitarios limitados108,244,247,248.
Actividades de la AlianzaDentro del ámbito internacional, la Alianza se ha adherido a diversos documentos de consenso que propugnan la atención a las personas de alto riesgo, definidos en la Declaración Transatlántica de Nueva York en 2009, y de Barcelona en 2010249,250. Ambos textos están promovidos por sociedades científicas europeas y estadounidenses y recogen una declaración de intenciones.
Así mismo, desde la Alianza se ha promovido la creación de un foro de debate a través de la red sobre la atención a la población con riesgo elevado de presentar un CCR en España. Dicho grupo tiene una composición multidisciplinaria y está constituido por profesionales dedicados a la prevención, diagnóstico, tratamiento del CCR, así como a la atención de la población de alto riesgo. La creación de este foro de debate en el seno de la Alianza supone un un notorio avance en este problema, porque pone de manifiesto que numerosos profesionales de gran experiencia, sociedades científicas, de pacientes y no gubernamentales, son capaces de colaborar al unísono y de forma consensuada con el único objetivo de proporcionar una mejor atención sanitaria. El reflejo del trabajo realizado es un documento de consenso que recoge las iniciativas propuestas y asume la imperiosa necesidad de coordinar y compartir criterios de actuación. Dicho estudio está pendiente de publicación en los próximos meses251.
Estudios de coste-efectividadEl CCR es una enfermedad que se cura en más del 90% de los casos si se detecta precozmente y, de hecho, es bien sabido y se ha reiterado en este texto que los programas poblacionales de cribado mediante análisis de SOH reducen notablemente la mortalidad por la enfermedad. En la actualidad, en la mayoría de los países europeos, incluida España, la pauta recomendada es el análisis de SOHi con una periodicidad bienal, en la población general de entre 50 y 69 años. Si la prueba es positiva, se recomienda realizar una colonoscopia. En el año 2008 se ha publicado un estudio252 en nuestro país que analiza, mediante un modelo matemático de Markov, los requerimientos de colonoscopias en un programa de cribado poblacional de CCR en la población de riesgo medio. Dicho estudio concluye que la disponibilidad de las unidades endoscópicas parece suficiente para realizar un programa de cribado poblacional mediante detección de SOHi anual o bienal, mientras que otras estrategias requerirían de un incremento significativo de los actuales recursos endoscópicos inviables actualmente.
Uno de los principales objetivos de la Alianza es sensibilizar a la población253, ayudar y colaborar estrechamente con los gestores e instituciones sanitarias. En este sentido, una cuestión trascendente en la actualidad es conseguir la máxima eficiencia y la adecuada utilización y financiación de los recursos del sistema sanitario, lo que comporta la estricta evaluación de las estrategias y requerimientos necesarios para iniciar un programa de cribado poblacional de CCR. Para definir el coste que conlleva cualquier actuación médica es necesario aplicar análisis de coste-efectividad. Dichos métodos analizan si determinado procedimiento sanitario se puede asumir desde el punto de vista económico, y cómo se relaciona con los beneficios clínicos esperados. Numerosos estudios confirman que el cribado poblacional del CCR, mediante cualquier método, es el procedimiento más coste-efectivo, con amplia diferencia, con respecto a otros cánceres que se pueden prevenir254–259. Así mismo, hay evidencia científica en ese sentido que avala la utilización de la colonoscopia en personas de alto riesgo260.
El gasto sanitario público en España se distribuye de la siguiente forma: el 54% corresponde a la atención especializada (hospitalaria y ambulatoria); el 16%, a la atención primaria; el 19,8%, al gasto farmacéutico, y solo el 1,4% se dedica a salud pública y prevención261. Cuando el CCR se diagnostica en fases avanzadas, lo que sucede en más del 40% de los casos, el coste medio del diagnóstico y tratamiento del CCR es elevado.
Dado el interés e importancia de la utilización de los recursos sanitarios, desde la Alianza se ha promovido una jornada científica en el año 2011, con objeto de analizar de manera pormenorizada todos los aspectos sobre coste-eficacia del cribado del cáncer de colon en España. Se puede concluir que la implantación de un programa de cribado poblacional es coste-efectivo. Ello supone a medio y largo plazo un ahorro importante de recursos para el sistema sanitario, sin tener en cuenta el valor intangible del sufrimiento y la vida humana. Como corolario de dicha jornada se ha editado un texto que recoge todas las ponencias presentadas262.
ConclusiónEl CCR es el tumor maligno más frecuente en España, si consideramos ambos sexos en conjunto, y la segunda causa de fallecimientos por tumores. Cada semana se diagnostican en España más de 500 casos de CCR y fallecen casi 260 personas de la enfermedad. Se estima que en los próximos años la incidencia seguirá incrementándose de forma notable y que uno de cada 20 hombres y una de cada 30 mujeres presentarán un CCR antes de los 74 años en nuestro país. Existen distintos motivos que pueden explicar este aumento en el número de casos de CCR. Tanto los hábitos dietéticos y el tabaquismo como el estilo de vida sedentario pueden desempeñar un papel importante en el incremento progresivo en su incidencia de esta enfermedad. Asimismo, la mayor longevidad de la población y el reciente desarrollo de mejores técnicas diagnósticas son otros factores relacionados.
El CCR es un tumor perfectamente prevenible y en el que se ha demostrado que la implantación de programas de cribado poblacionales reduce la incidencia y mortalidad. Por ello, constituye una prioridad asistencial y de salud pública instaurar dichos programas. En la situación actual, para poder dar una respuesta adecuada al problema es necesario contar con la estrecha colaboración de todos los agentes implicados: las sociedades científicas, la sociedad civil y las instituciones sanitarias. En la mayoría de los países europeos, incluida España, la pauta recomendada en la población general de entre 50 y 69 años es el análisis de SOHi con una periodicidad bienal
La creación de la Alianza para la Prevención del Cáncer de Colon en España ha supuesto un hito y representa un nexo de unión entre las sociedades científicas y civiles con el único objetivo de prevenir una enfermedad que constituye un grave problema sanitario en nuestro país. La Alianza ha adquirido un profundo compromiso cívico con la sociedad española y constituye un foro abierto y de integración. Es imprescindible contar con la colaboración de todos. No existe, ni se entiende en la actualidad, otra manera de plantear un problema sanitario y social de tal magnitud como no sea con la estrecha participación y colaboración de todos los responsables implicados.
Aunque somos conscientes de lo complejo y difícil que es el camino que queda por recorrer, merece la pena cualquier esfuerzo que se pueda invertir y dedicar porque, sin duda, ello redunda en beneficio de todos. La detección precoz del CCR es un problema que afecta a la sociedad española y, por tanto, es imprescindible aunar todas las voluntades posibles y la ayuda de todos. Desde la Alianza se propugna la necesidad de racionalizar y priorizar el gasto y favorecer las medidas de prevención y detección precoz que van a redundar, cierto es que a medio plazo, en un beneficio importante para toda la sociedad. En este punto, reiterar el profundo compromiso con la sociedad de todos los miembros de la Alianza, para intentar solucionar en los próximos años un problema que nos afecta a todos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los integrantes de la Alianza y de manera especial a los coordinadores autonómicos por su inestimable colaboración: Enrique Aranda (Andalucía); Juan Jesús Cruz (Castilla y León): Jesús García-Fonsillas (Navarra); Jaime Aguiló (Baleares); Juan Cabrera y Enrique Quintero (Canarias); Vicent Hernández (Galicia); Laureano López-Rivas (Asturias); Ángel Lanas (Aragón); Montserrat Andréu (Cataluña); Fernando Rivera (Cantabria); Andrés Sánchez (Castilla-La Mancha); Rodrigo Jover (Comunidad Valenciana); Luis Bujanda (País Vasco); Francisco Buitrago (Extremadura); Fernando Carballo y Agustín Navarrete (Murcia); Ramiro Carreño (La Rioja). Igualmente, a todas las personas y entidades que han aportado su ayuda de manera desinteresada.
La Alianza para la Prevención del Cáncer de Colon en España está constituida por las siguientes entidades (orden alfabético): Asociación Española Contra el Cáncer (aecc); Asociación Española de Especialistas en Medicina del Trabajo (AEEMT); Asociación Española de Gastroenterología (AEG); EuropaColon España; Federación Española de Asociaciones de Ostomizados (FEDAO); Fundación Cofares; Fundación Tejerina; Sociedad Española de Anatomía Patológica(SEAP-IAP); Sociedad Española de Diagnóstico por la Imagen del Abdomen (SEDIA); Sociedad Española de Endoscopia Digestiva (SEED); Sociedad Española de Epidemiología (SEE); Sociedad Española de Medicina de Familia y Comunitaria (semFYC); Sociedad Española de Oncología Médica (SEOM); Sociedad Española de Oncología Radioterápica (SEOR); Sociedad Española de Patología Digestiva (SEPD).
El listado de los grupos integrantes de la Alianza para la Prevención del Cáncer de Colon en España se encuentra en el Anexo 1 al final del artículo.