La tuberculosis (TBC) es una enfermedad con alta prevalencia a nivel mundial, que está en aumento en países desarrollados en relación con la inmigración y el mayor uso de inmunosupresores. La TBC abdominal es una de las formas extrapulmonares más frecuentes; sin embargo, la afectación del páncreas es poco habitual y se presenta con manifestaciones inespecíficas que hacen de su diagnóstico un reto en una enfermedad curable con tratamiento farmacológico. Su diagnóstico precoz podría evitar intervenciones invasivas innecesarias, como la laparotomía, al poder simular otros procesos como pueden ser los de origen neoplásico.
Varón caucásico de 27años de edad que comienza en 2009 con un cuadro de dolor abdominal agudo con hiperamilasemia, por lo que se inicia estudio etiológico ambulatorio de pancreatitis aguda, descartándose litiasis, alcohol o tóxicos como causas más habituales, así como causas metabólicas, e incluso estudio genético de los genes SPINK1 y PRSS1. Con la realización de una tomografía computarizada (TC) como estudio de imagen, se objetiva un engrosamiento focal de la cabeza pancreática sin formación de clara masa, asociando cavernomatosis portal que parece estar en relación con una complicación del proceso agudo pancreático.
En el estudio de autoinmunidad destaca una determinación aislada de IgG4 de 14.793UI/ml que en mediciones sucesivas resulta negativa, siendo sugestiva de un error de laboratorio. Sin embargo, ante la sospecha de una posible pancreatitis autoinmune se decide el inicio de un ciclo de corticoides, sin obtenerse franca respuesta clínica.
Con la realización de 2 ecoendoscopias se objetiva un engrosamiento de la cabeza pancreática sugestiva de origen inflamatorio, sin poder obtenerse material suficiente para su análisis histológico en ninguna de las ocasiones. Se realizó inmunohistoquímica de una muestra de mucosa de papila, siendo esta negativa para la determinación de IgG4.
Tras completar 2 ciclos de tratamiento esteroideo, el paciente presenta un empeoramiento del estado general, con mayor astenia, anorexia y pérdida de peso como síntomas constitucionales, así como el desarrollo de ascitis y febrícula persistente.
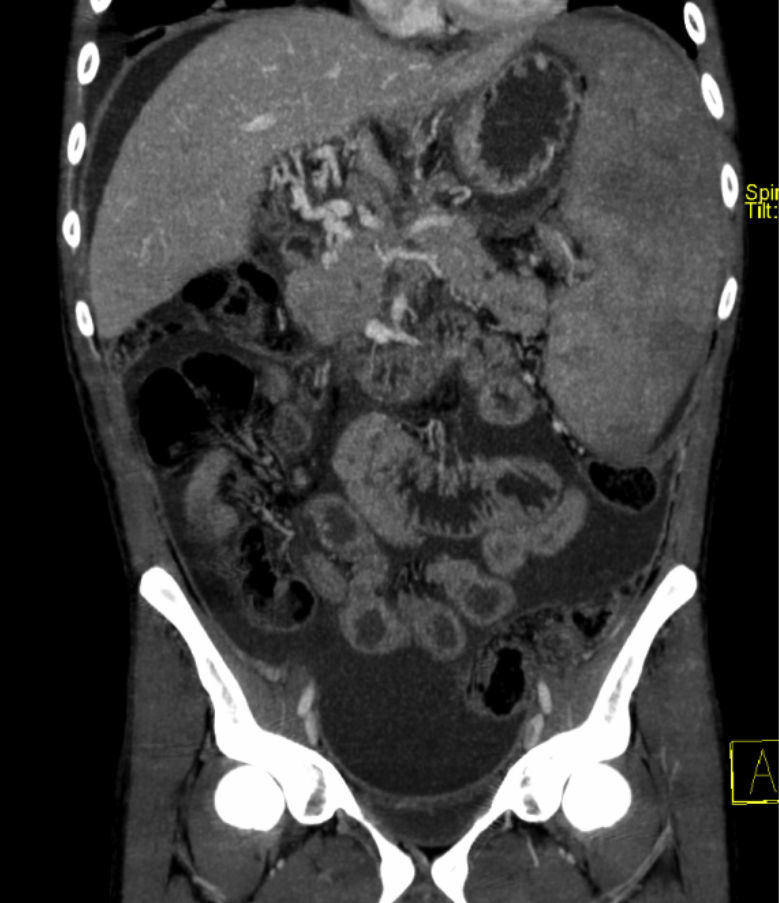
En esta situación acude a nuestro centro para continuar el estudio, donde se realizan nuevas pruebas de imagen (fig. 1) y ecoendoscopia, sin obtenerse información adicional acerca del engrosamiento focal de la cabeza pancreática o la cavernomatosis portal, salvo un engrosamiento y realce peritoneal en la resonancia magnética abdominal que, junto con el desarrollo de síndrome constitucional, ascitis y fiebre, hacían de la TBC peritoneal la causa más probable. Analíticamente presentaba un hemograma y bioquímica con función hepática, renal e iones normales, a destacar una elevación de los reactantes de fase aguda (PCR: 11mg/dl; fibrinógeno: 679mg/dl) e hipoalbuminemia (albúmina: 2,9g/dl) e hipocolesterolemia (colesterol total: 121mg/dl), como datos de desnutrición. El estudio de fiebre, que incluye radiografía de tórax, hemocultivos y urocultivos, resultó negativo. El análisis de líquido ascítico arrojó los siguientes resultados: leucocitos: 137/μl; glucosa: 64mg/dl; lactato deshidrogenasa (LDH): 214U/l (sérica: 180U/l); proteínas: 2,9g/dl; SAAG (gradiente de albúmina seroascítico): >1,1; adenosina deaminasa (ADA): 38UI/ml.
Se decidió completar el estudio para descartar otras causas de hipertensión portal que pudieran justificar el desarrollo de ascitis, puesto que esta no debería estar solo explicada por la cavernomatosis portal previamente conocida. El estudio analítico de hepatopatía resultó negativo (autoinmunidad, vírica, metabólicas). En el estudio endoscópico se describen varices de mediano tamaño, por lo que se inicia betabloqueo como profilaxis primaria de hemorragia digestiva. Se realiza un estudio hemodinámico que informa de un gradiente de presión venosa hepático de 3mmHg con toma de biopsia transyugular en el mismo procedimiento, sin hallazgos patológicos en la anatomía patológica, por lo que no se encuentran datos de enfermedad hepática ni hipertensión portal sinusoidal que justifique la ascitis.
Ante la sospecha clínica de TBC se amplía el estudio, obteniéndose cultivos para micobacterias en sangre, líquido ascítico y orina, así como reacción en cadena de la polimerasa (PCR) y Quantiferon®, que fueron negativa y positiva, respectivamente. En espera de la confirmación microbiológica se avisa, desde el centro en el que había ingresado inicialmente, del crecimiento de una micobacteria en el cultivo de líquido ascítico, por lo que se decide el inicio de terapia antituberculosa en régimen de cuádruple terapia con isoniazida, rifampicina, etambutol y pirazinamida. Se reinterroga al paciente, el cual refiere haber estado meses antes en un evento multitudinario tras el cual se evidenciaron varios casos de TBC bacilífera.
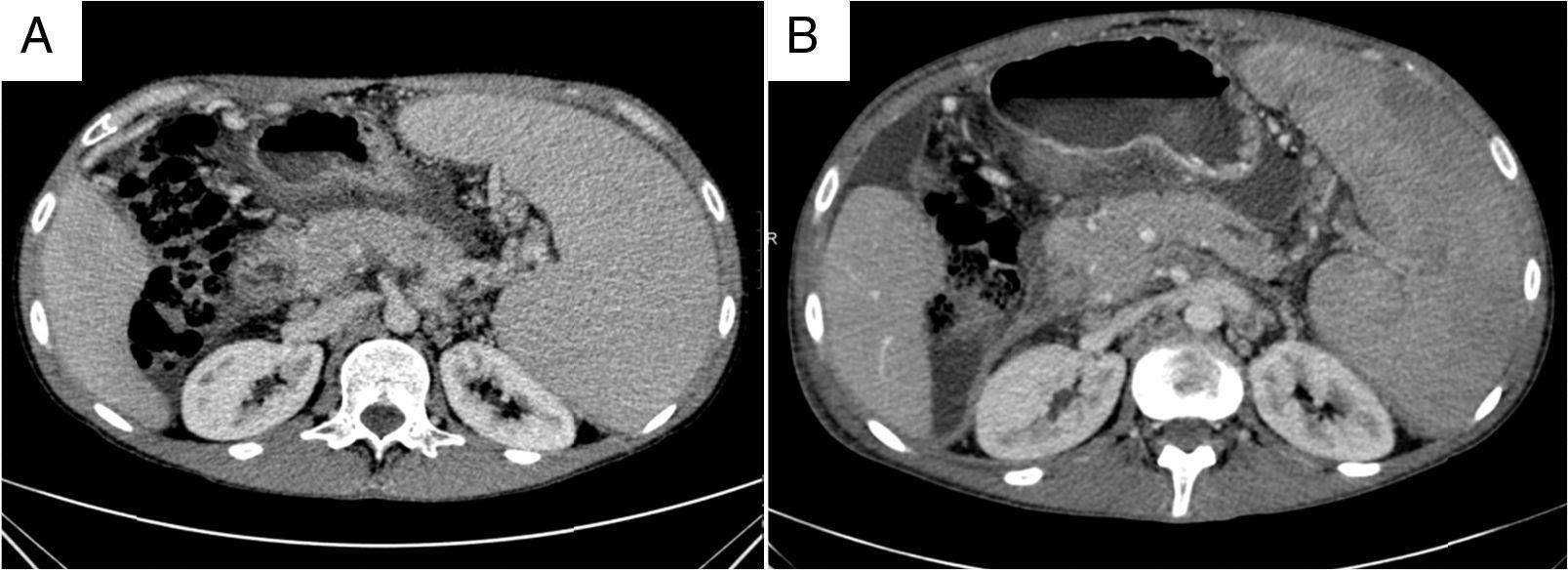
En revisiones sucesivas ambulatorias el paciente refiere aumento de peso y apetito, disminución de temperatura hasta permanecer afebril y mejor control de la ascitis con el tratamiento diurético. Analíticamente destaca disminución de los reactantes de fase aguda y la aparición de trombo-leucopenia progresiva en probable relación con esplenomegalia por hipertensión portal y/o toxicidad farmacológica. En una nueva TC realizada a los 6meses del inicio del tratamiento tuberculostático presenta disminución del tamaño de la cabeza pancreática que tiene aspecto homogéneo, aunque con persistencia del engrosamiento descrito (fig. 2), que ya no se objetiva en el último control por TC realizado tras completar 9meses de terapia, describiéndose una glándula pancreática sin alteraciones en su morfología y con ascitis en descenso, aunque persistiendo los cambios de cavernomatosis portal e hipertensión portal conocidos.
Cortes axiales de abdomen superior con contraste intravenoso en fase portal: Se aprecia una disminución en el tamaño de la cabeza pancreática del estudio previo al diagnóstico (A) respecto al realizado tras 9meses de tratamiento (B). También se identifica un restablecimiento del calibre del conducto de Wirsung, que inicialmente medía 7mm, pasando a 3mm en el estudio control. Se visualiza también en ambas imágenes esplenomegalia y líquido libre intraperitoneal con disminución de su cuantía.
La TBC es una enfermedad prevalente no solo en países en vías de desarrollo, sino también en países desarrollados, en los que se ha evidenciado un aumento importante en los últimos años en relación con la inmigración, con la epidemia del VIH y con el uso extendido de fármacos inmunosupresores.
La TBC abdominal puede afectar a varias estructuras, incluyendo por orden de frecuencia a la unión ileocecal, los ganglios, el peritoneo y los órganos sólidos. La TBC peritoneal es relativamente frecuente, puesto que supone el 5% de los casos de TBC extrapulmonar. Esto la sitúa en la sexta posición entre las formas extrapulmonares de la TBC en Estados Unidos1. El origen suele ser desde un foco pulmonar primario por diseminación linfática o hematógena durante la primoinfección, de modo que se produce el implante intraabdominal del bacilo reactivándose al cabo de años en estados de inmunosupresión. Otras opciones que se han postulado son la extensión desde órganos adyacentes afectos (como trompas de Falopio o adenopatías) o por ingesta del bacilo que contamina leche no pasteurizada o por ingesta del propio esputo en pacientes bacilíferos con enfermedad pulmonar activa.
Entre los factores de riesgo para la aparición de TBC peritoneal encontramos algunos comunes a otras formas de TBC, como el bajo nivel socioeconómico, el hacinamiento, la baja higiene o los estados de inmunosupresión. Cabe destacar la mayor prevalencia de afectación peritoneal en pacientes sometidos a diálisis peritoneal ambulatoria por insuficiencia renal crónica, y en pacientes cirróticos, y más específicamente de etiología alcohólica, parece que por un mecanismo combinado de disfunción inmunológica (común a otras formas de cirrosis) y malnutrición, que es más frecuente en pacientes alcohólicos. El alcohol era la causa subyacente en el 90% de los pacientes con cirrosis que desarrollaron TBC peritoneal en el estudio de Shakil et al.2.
La afectación primaria pancreática aislada es excepcional (menos de 100casos publicados en la literatura), encontrándose con más frecuencia en el contexto de una TBC abdominal con implicación de varios órganos3, habiéndose realizado el diagnóstico en la mayoría de casos de manera incidental tras la resección quirúrgica por sospecha de neoplasia maligna. Incluso en formas de TBC miliar se ha descrito una baja tasa de afectación pancreática de entre el 2,1-4,7% en series de autopsias4. Se ha postulado que el páncreas está biológicamente protegido de ser infectado por Mycobacterium tuberculosis, probablemente por la presencia de enzimas pancreáticas que interfieren en la inoculación del bacilo, lo cual explicaría esta baja tasa de afectación pancreática5.
La TBC pancreática presenta síntomas inespecíficos como fiebre, dolor abdominal, pérdida de peso o anorexia. Asimismo se han descrito otras manifestaciones como ictericia obstructiva, sangrado gastrointestinal, pancreatitis aguda o crónica, masa pancreática simulando malignidad, hipertensión portal por trombosis portal e incluso perforación colónica6.
El diagnóstico de TBC pancreática es complicado por lo inespecífico de su clínica y de los hallazgos radiológicos, que la pueden hacer indistinguible de una neoplasia maligna. Para evitar cirugías innecesarias se requiere un diagnóstico correcto y basado en alta sospecha y confirmación microbiológica o histológica. En cuanto a las pruebas radiológicas, se han descrito diferentes patrones, desde una o varias lesiones hipoecoicas focales hasta un aumento difuso del páncreas. Es frecuente la presencia de ganglios hipodensos con captación en anillo. A pesar del aumento del tamaño pancreático, el conducto pancreático no suele verse estenosado, a diferencia de lo que ocurre con el adenocarcinoma7. Junto con la afectación pancreática se puede encontrar afectación de otros órganos abdominales, como engrosamiento de la válvula ileocecal, del peritoneo o de otros órganos sólidos.
La piedra angular para el diagnóstico es la obtención de suficiente material de la lesión pancreática, ya sea guiado por TC o ecoendoscopia. La ecoendoscopia se ha descrito como superior que la ecografía o la TC para la detección de lesiones pancreáticas con más precisión para las de pequeño tamaño o lesiones peripancreáticas, y la punción-aspiración con aguja fina guiada por ecoendoscopia (EUS-PAAF) se ha usado para diferenciar lesiones inflamatorias de lesiones neoplásicas. Se describe una rentabilidad del 50-76% para el diagnóstico de TBC pancreática por EUS-PAAF8, de modo que se si observan los granulomas caseificantes típicos o se obtiene crecimiento del bacilo en los métodos de cultivo, se tiene un diagnóstico de certeza. Sin embargo, como característica común con otras formas de TBC extrapulmonar, la pancreática también se caracteriza por ser paucibacilar, por lo que estas técnicas encuentran bajo rendimiento (positividad del 10-50% para la tinción de ácido-alcohol resistencia [BAAR] y del 40-75% para el cultivo)3. Como métodos de apoyo diagnóstico aunque no definitivos, podemos hacer uso de otras técnicas como la PCR, el ADA o el Quantiferón®. A pesar de las técnicas disponibles, con cierta frecuencia la única forma de obtener el diagnóstico definitivo es mediante la resección quirúrgica y análisis posterior, en caso de no poder descartarse que se trate de una neoplasia maligna.
Con los datos disponibles hasta el día de hoy, parece que una terapia basada en los mismos regímenes farmacológicos que en la TBC pulmonar, es efectiva para el tratamiento de las formas abdominales, incluyendo por tanto la peritoneal y la pancreática. La mayoría de los casos descritos obtuvieron buena respuesta con ciclos de 6-9meses. No hay evidencia que apoye la recomendación de tratamiento más allá de 6meses. Sin embargo, los casos descritos mantuvieron la terapia hasta la evidencia de normalización radiológica y la desaparición de la sintomatología, con periodos variables de entre 6 y hasta 18meses1.
El caso de nuestro paciente se manifiesta con afectación tanto peritoneal como pancreática, con el desarrollo de cavernomatosis portal como complicación del proceso pancreático, y de ascitis por la afectación del peritoneo, así como manifestaciones constitucionales propios de la TBC. La confirmación diagnóstica se obtuvo con el aislamiento del bacilo en el líquido ascítico en una de sus determinaciones, lo cual se apoya por la mejoría clínica, analítica y radiológica obtenida desde el inicio del tratamiento tuberculostático.
En resumen, la TBC pancreática es una entidad poco frecuente incluso en casos de TBC diseminada, pero que suele aparecer en el contexto de una afectación abdominal, manifestándose con síntomas y expresión radiológica inespecífica que en conjunto, con la baja rentabilidad de las pruebas complementarias, puede llevar a requerir laparotomías innecesarias para descartar procesos malignos. La clave diagnóstica se encuentra en la sospecha clínica, que puede llevar a evitar morbimortalidad e iatrogenia sobre una patología con buena respuesta al tratamiento farmacológico.