Evaluar la comorbilidad, los medicamentos concomitantes, el uso de los recursos y los costes sanitarios asociados a los pacientes portadores del virus de la hepatitis C crónica en población española.
Pacientes y métodosEstudio retrospectivo, observacional, no intervencionista. Se incluyeron pacientes≥18 años, que demandaron atención durante los años 2010-2013. Se dividieron en 2 grupos en función de la presencia/ausencia de cirrosis hepática. El período de seguimiento fue de 12 meses. Las principales mediciones fueron: comorbilidad general (banda de utilización de recursos) y específica, medicamentos concomitantes, uso de recursos y costes sanitarios. El análisis estadístico fue realizado utilizando modelos de regresión y ANCOVA, p<0,05.
ResultadosSe seleccionaron 1.055 pacientes con una edad media de 57,9 años, y el 55,5% eran varones. El 43,5% de los pacientes presentaron un grado de comorbilidad moderado (banda de utilización de recursos). El tiempo medio desde el diagnóstico fue de 18,1 años y el 7,5% de los pacientes fallecieron durante el período de seguimiento. Las comorbilidades más frecuentes fueron: dislipidemia (40,3%), hipertensión (40,1%) y dolor generalizado (38,1%). La cirrosis se asoció con los eventos cardiovasculares (OR 3,8), los fallos orgánicos (OR 2,2), el alcoholismo (OR 2,1), la diabetes (OR 1,2) y la edad (OR 1,2); p<0,05. Los medicamentos más utilizados fueron antiinfecciosos (67,8%) y fármacos para el sistema nervioso (66,8%). El coste total medio por paciente fue de 3.198€ (71,5% costes sanitarios, 28,5% costes indirectos/no sanitarios). En el modelo corregido, el coste total por paciente-año fue de 2.211€ sin cirrosis y de 7.641€ con cirrosis; p<0,001.
ConclusionesLos pacientes con virus de la hepatitis C crónica se asocian a una elevada comorbilidad y uso de medicación concomitante, especialmente en los sujetos con cirrosis hepática. La infección por virus de la hepatitis C crónica supone una importante carga económica para el Sistema Nacional de Salud.
To assess the comorbidity, concomitant medications, healthcare resource use and healthcare costs of chronic hepatitis C virus patients in the Spanish population.
Patients and methodsRetrospective, observational, non-interventional study. Patients included were≥18 years of age who accessed medical care between 2010-2013. Patients were divided into 2 groups based on the presence or absence of liver cirrhosis. The follow-up period was 12 months. Main assessment criteria included general comorbidity level (determined by the resource utilisation band score) and prevalence of specific comorbidities, concomitant medications, healthcare resource use and healthcare costs. Statistical analysis was performed using regression models and ANCOVA, P<.05.
ResultsOne thousand fifty-five patients were enrolled, the mean age was 57.9 years and 55.5% were male. A percentage of 43.5 of patients had a moderate level of comorbidity according to the resource utilisation band score. The mean time from diagnosis was 18.1 years and 7.5% of the patients died during the follow-up period. The most common comorbidities were dyslipidaemia (40.3%), hypertension (40.1%) and generalised pain (38.1%). Cirrhosis was associated with cardiovascular events (OR 3.8), organ failures (OR 2.2), alcoholism (OR 2.1), diabetes (OR 1.2) and age (OR 1.2); P<.05. The most commonly used medications were anti-infectives (67.8%) and nervous system medications (66.8%). The mean total cost per patient was 3,198€ (71.5% healthcare costs, 28.5% indirect/non-healthcare costs). In the corrected model, the total costs per patient-year were 2,211€ for those without cirrhosis and 7,641€ for patients with cirrhosis; P<.001.
ConclusionsChronic hepatitis C virus patients are associated with a high level of comorbidity and the use of concomitant medications, especially in patients with liver cirrhosis. Chronic hepatitis C virus infection represents a substantial economic burden on the Spanish National Health System.
La hepatitis C es una enfermedad hepática causada por el virus de la hepatitis C1. El virus se transmite por vía parenteral, siendo sus principales vías de contagio los productos de transfusión sanguínea y el uso compartido de agujas para el consumo de drogas intravenosas1,2. Es un problema de salud global que afecta a más de 170 millones de personas en todo el mundo. La prevalencia en Europa varía según el país, y oscila entre el 2-3% de la población total2–4.
Siguiendo la evolución natural de la enfermedad se sabe que entre el 60-90% de los pacientes infectados desarrollarán una hepatitis C crónica (HCC), y de estos, el 20% desarrollarán una cirrosis1,3. La descompensación de la cirrosis puede causar insuficiencia hepática o carcinoma hepatocelular (3-5% a los 5 años). Por lo tanto, la detección temprana y el tratamiento son muy importantes para la prevención1,2,5–7. Se ha estimado que la HCC es responsable de aproximadamente un millón de muertes por año en todo el mundo3.
El objetivo de la terapia actual (HCC) es lograr una respuesta viral sostenida, definida como la ausencia de ARN-virus de la hapatitis C (VHC) en el suero, generalmente 12 semanas después de la finalización del tratamiento8. El procedimiento estándar para los sujetos con HCC está cambiando rápidamente; hasta hace poco, el tratamiento se basaba en interferón y ribavirina, que ofrecía una tasa de curación del 50%, aunque en ocasiones causaba frecuentes reacciones adversas. En estos últimos años se han desarrollado nuevos e innovadores medicamentos antivirales de acción directa, que son mucho más eficaces y seguros y se toleran mejor que los tratamientos antiguos, y permiten la administración oral. El tratamiento con antivirales de acción directa por vía oral puede curar a la mayoría de los pacientes infectados por el VCC. Por lo tanto, el nuevo arsenal terapéutico disponible contra esta enfermedad nos obliga a identificar a los pacientes para que puedan beneficiarse de la mejor estrategia terapéutica disponible8–10.
La carga social y económica de la infección por el virus de la hepatitis C (VHC)20. es considerable y ha llevado a la Organización Mundial de la Salud a recomendar estudios locales para definir el alcance del problema y dar prioridad a las medidas preventivas10–15. Según un estudio naturalista llevado a cabo en Italia, la enfermedad hepática se tradujo en un coste medio mensual de 645€ por paciente, siendo el 50% el coste de la hospitalización11. En España, a pesar de disponer de guías clínicas que apoyan el manejo adecuado de estos pacientes16, nos falta información sobre la verdadera carga económica de la infección por el VHC, que comprende tanto los costes directos en el uso de los servicios de salud como los costes indirectos para la sociedad (pérdidas de productividad laboral). Aunque se prevé una disminución en el número de casos nuevos de hepatitis C en los próximos años2, es probable que aumente el número total de casos de hepatopatías crónicas atendidas en España. Esto se debe, en parte, a las estrategias de selección para identificar casos de hepatitis crónica asintomática, y en parte, a la descompensación de casos de cirrosis latente aún no diagnosticados (morbilidad hepática), circunstancia que aumenta el coste de la enfermedad1,2,14. El objeto de este estudio fue evaluar las comorbilidades, los medicamentos concomitantes, el uso de los recursos y los costes sanitarios asociados a los pacientes con HCC en la población española.
Pacientes y métodosDiseño y población del estudioSe realizó un estudio observacional retrospectivo elaborado a partir de los registros médicos (bases de datos informatizadas con datos anónimos) de pacientes atendidos en 8 centros de Atención Primaria (AP; La Roca del Vallés y Girona; Barcelona). La población asignada a estos centros fue mayoritaria urbana, de clase social media-baja y de predominio industrial.
Criterio de inclusión/exclusiónSe identificaron los pacientes con diagnóstico de HCC según la Clasificación Internacional de Atención Primaria (D72)17 y/o la Clasificación Internacional de Enfermedades, novena revisión, modificación clínica (070.4, 070.5), que demandaron atención entre el 01/01/2010 y el 31/12/2013 (fecha índice). Debían de cumplir los siguientes criterios: a) edad≥18 años; b) estar diagnosticados de HCC al menos 12 meses antes del inicio del estudio (pacientes activos en la base de datos); c) estar en el programa de prescripciones crónicas (con registro de la dosis diaria, el intervalo de tiempo y la duración de cada tratamiento, ≥2 recetas durante el período de seguimiento), y d) que se pudiera garantizar el seguimiento regular de los pacientes durante el período de estudio (≥2 registros sanitarios en el sistema informático). Fueron excluidos del estudio los pacientes trasladados a otros centros, los desplazados y/o fuera de zona.
Grupos de estudio y seguimientoLos pacientes se clasificaron en 2 grupos, en función de la presencia o ausencia de cirrosis hepática previa (D97). El seguimiento de los pacientes, a partir del primer contacto ambulatorio (visita médica en AP o especialista) fue de 12 meses.
Diagnóstico de hepatitis C crónica y cirrosisEl diagnóstico de la HCC se obtuvo a partir de la Clasificación Internacional de Atención Primaria17 (D72), y la codificación de las altas y urgencias hospitalarias, según la Clasificación Internacional de Enfermedades, novena revisión, modificación clínica (070.4, 070.5). En todos los pacientes incluidos en el estudio se detectó la presencia de anticuerpos específicos anti-VHC, y se realizó la prueba de ARN-VHC para confirmar la infección crónica. El diagnóstico de cirrosis hepática se obtuvo a partir de la codificación diagnóstica17. El diagnóstico clínico se determinó en todos los casos por ecografía hepática, y en algunos, mediante punción hepática o fibroscan.
Variables sociodemográficas y de comorbilidadLas variables fueron: edad (continua y por rangos: 18-44, 45-64, 65-74 y más de 74), sexo, índice de masa corporal (kg/m2) y tiempo desde el diagnóstico de la enfermedad (hepatitis C), así como los siguientes antecedentes personales17: hipertensión arterial (K86, K87); diabetes (T90); dislipidemia (T93); obesidad (T82); fumador activo (P17); alcoholismo (P15, P16); todos los tipos de insuficiencia orgánica (cardiaca, hepática); enfermedad coronaria (códigos K74, K76, K75); accidente cerebrovascular (K90, K91, K93); enfermedad pulmonar obstructiva crónica (R95, obstrucción crónica del flujo aéreo); asma bronquial (R96); demencia o deterioro cognitivo (P70, P20); enfermedades neurológicas: enfermedad de Parkinson (N87) epilepsia (N88), esclerosis múltiple (N86) y otras enfermedades neurológicas (N99); síndrome depresivo (P76); trastorno de ansiedad generalizada (P74); psicosis (P72, esquizofrenia); neoplasias malignas (A79, B72-75, D74-78, F75, H75, K72, L71, L97, N74-76, R84-86, T71-73, U75-79, W72-73, X75-81, Y77-79); VIH (B90); anemia (todos los tipos); insuficiencia renal crónica (U99); dolor generalizado (A01); tuberculosis pulmonar (A70). Como variable resumen de la comorbilidad general para cada paciente se utilizó: a) el índice de comorbilidad de Charlson18 como indicador de la gravedad, y b) el índice de casuística individual, obtenido de los grupos clínicos ajustados, que es un sistema de clasificación de pacientes por isoconsumo de recursos19. La aplicación de los grupos clínicos ajustados proporciona las bandas de utilización de recursos (BUR), donde cada paciente, con base en su morbilidad general, queda agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos o morbilidad muy baja; 2: morbilidad baja; 3: morbilidad moderada; 4: morbilidad alta; 5: morbilidad muy alta).
Medicamentos concomitantesDebido a la naturaleza retrospectiva y no intervencionista del diseño del estudio, la asignación de un paciente a una estrategia de tratamiento específica se determinó mediante la práctica clínica habitual (a criterio clínico). Se obtuvo información de los siguientes grupos terapéuticos según la Anatomical Therapeutic Chemical Classification System20: Grupo A (Aparato digestivo y metabolismo), Grupo B (Sangre y órganos hematopoyéticos), Grupo C (Sistema cardiovascular), Grupo D (Dermatológico), Grupo G (Sistema genitourinario y hormonas sexuales), Grupo H (Preparaciones hormonales sistémicas, excluidas hormonas sexuales e insulinas), Grupo J (Antiinfecciosos para uso sistémico), Grupo L (Antineoplásicos e inmunomoduladores), Grupo M (Sistema musculoesquelético, Grupo N (Sistema nervioso), Grupo R (Sistema respiratorio) y Grupo S (Órganos sensoriales). Fue dividido en más detalle en subgrupos principales de la Anatomical Therapeutic Chemical Classification System, tales como antibióticos, anticonvulsivos, antiasmáticos, agentes hipolipidemiantes, etc. La información se obtuvo de la dispensación farmacéutica a partir de las recetas retiradas de la oficina de farmacia, según el aplicativo de seguimiento de la prescripción farmacéutica del CatSalut.
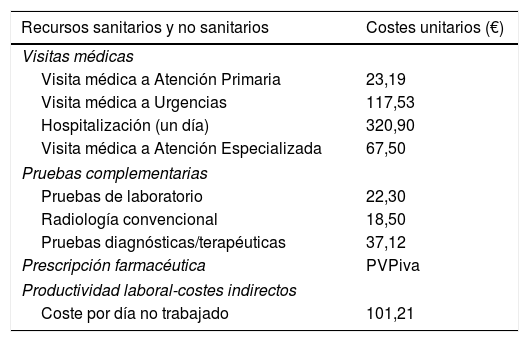
Uso de los recursos y costesSe consideraron los costes sanitarios relacionados con la actividad asistencial (visitas médicas, días de hospitalización, urgencias, solicitudes diagnósticas o terapéuticas y medicación) efectuada por los profesionales, y los no sanitarios (indirectos), relativos a las pérdidas de productividad laboral (días de incapacidad/baja laboral; fuente: historia clínica informatizada). El coste fue expresado en coste medio por paciente (coste/unitario anual). Los diferentes conceptos de estudio y su valoración económica se detallan en la tabla 1 (correspondientes al año 2014). Las diferentes tarifas se obtuvieron de la contabilidad analítica de los centros, excepto la medicación y los días de baja laboral. Las prescripciones (recetas médicas agudas, crónicas y/o a demanda) se cuantificaron según el precio de venta al público por envase en el momento de la prescripción. Se incluyó el coste de las tiras reactivas para determinar los valores de glucosa capilar. Los días de incapacidad laboral o pérdidas de productividad se cuantificaron según el salario medio interprofesional (fuente: INE)21. Los pacientes en incapacidad temporal o permanente se cuantificaron en función de los días de baja laboral. En este estudio no se contempló el cómputo de los costes directos no sanitarios, es decir, los que se consideran «costes de bolsillo» o pagados por el propio paciente/familia, al no estar registrados en la base de datos. Del análisis de los costes se excluyó la medicación retroviral administrada a los pacientes.
Detalle de los costes unitarios y la pérdida de productividad laboral (año 2014)
| Recursos sanitarios y no sanitarios | Costes unitarios (€) |
|---|---|
| Visitas médicas | |
| Visita médica a Atención Primaria | 23,19 |
| Visita médica a Urgencias | 117,53 |
| Hospitalización (un día) | 320,90 |
| Visita médica a Atención Especializada | 67,50 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 22,30 |
| Radiología convencional | 18,50 |
| Pruebas diagnósticas/terapéuticas | 37,12 |
| Prescripción farmacéutica | PVPiva |
| Productividad laboral-costes indirectos | |
| Coste por día no trabajado | 101,21 |
PVPiva: precio de venta al público con el impuesto del valor añadido.
Fuente de los recursos sanitarios: contabilidad analítica propia e Instituto Nacional de Estadística.
La confidencialidad de los registros (anonimizados y disociados) se mantuvo conforme a la Ley Orgánica de Protección de Datos (Ley Orgánica 15/1999, de 13 de diciembre). El estudio fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios (EPA-OD) y posteriormente aprobado por el Comité Ético de Investigación Clínica de la Unió Catalana d’Hospitals de Barcelona.
Análisis estadísticoSe realizó un análisis estadístico descriptivo univariado para las variables de interés. Para los datos cualitativos, se calculó la frecuencia absoluta y relativa. Las proporciones y los intervalos de confianza (IC) del 95% se basaron en el número total de sujetos sin valores faltantes. Para los datos cuantitativos se utilizaron la media y la desviación estándar. El ajuste a la distribución normal se evaluó mediante la prueba de Kolmogorov-Smirnov. El análisis de la varianza, la prueba chi-cuadrado y la correlación lineal de Pearson se utilizaron en el análisis bivariado. Se realizó un análisis de regresión logística para obtener las variables asociadas a los perfiles de pacientes con cirrosis (variable dependiente), utilizando el procedimiento Enter (estadística: Wald). Los costes fueron comparados según las recomendaciones de Thompson y Barber22, mediante el análisis de la covarianza (modelo lineal generalizado: ANCOVA), con el sexo, la edad, las BUR, el índice de comorbilidad de Charlson y el tiempo transcurrido desde el diagnóstico como covariables. Se utilizó el programa SPSSWIN, versión 18, estableciendo significación estadística para valores de p<0,05.
ResultadosDe una población inicial de 87.830 sujetos≥18 años, fueron atendidos 82.645 pacientes durante los años 2010-2013. De estos, 1.571 estaban diagnosticados como portadores del VHC (prevalencia 1,9%; IC del 95% 1,2-2,6). Finalmente se analizaron 1.055 pacientes portadores del VHC que cumplían con los criterios de inclusión/exclusión y pudieron seguirse durante el período de estudio (fig. 1).
Diagrama general del estudio. Se efectuó un diseño observacional de carácter retrospectivo, realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos disociados) de pacientes seguidos en régimen ambulatorio y hospitalario que demandaron atención durante los años 2010-2013.
VHC: virus de la hepatitis C crónica.
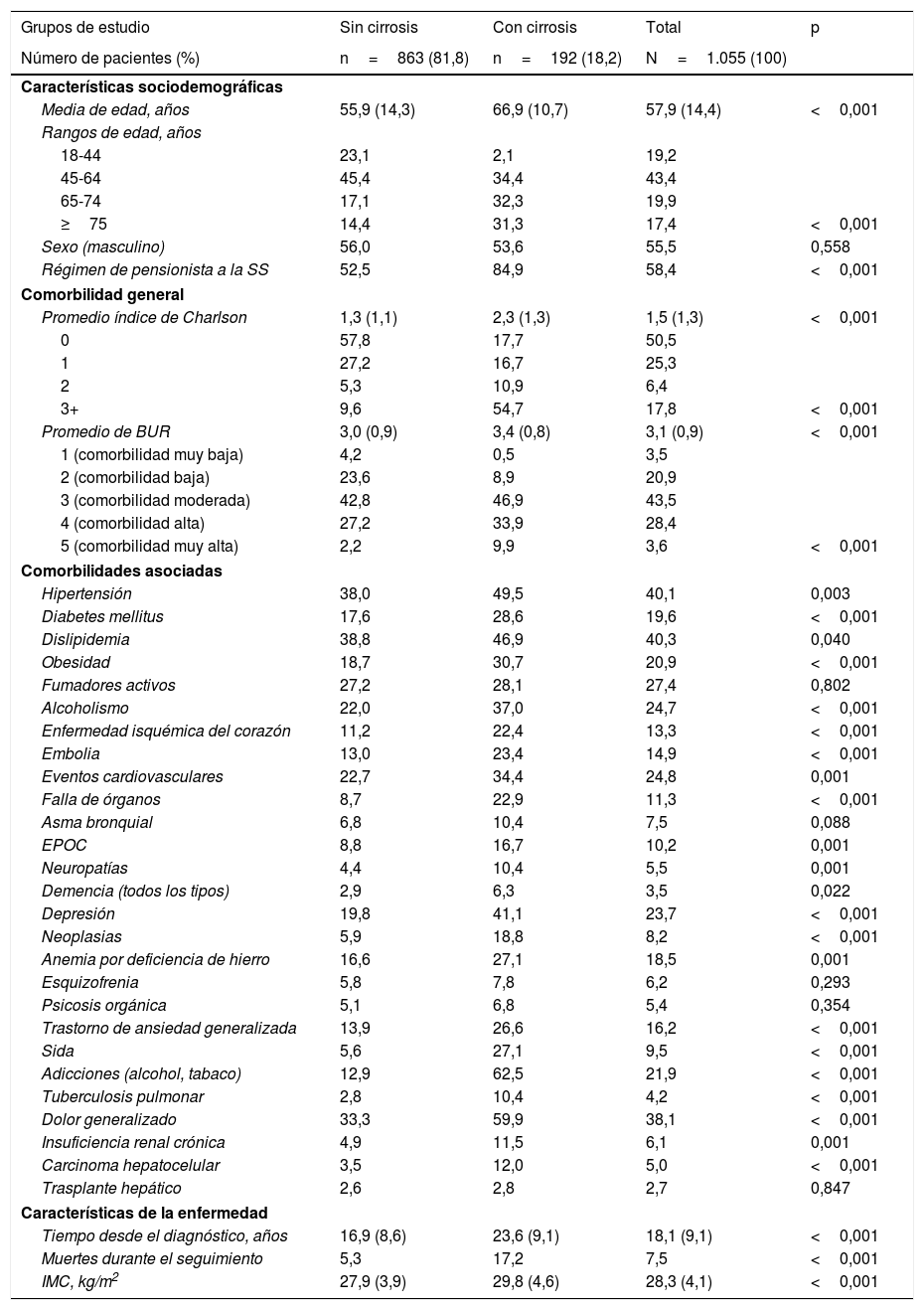
La tabla 2 muestra las características basales del grupo de pacientes estudiados con base en la presencia/ausencia de cirrosis. La edad media fue de 57,9 años (43,4% de los pacientes tenían entre 45-64 años), el 55,5% eran varones y la media de la puntuación BUR fue de 3,1 puntos por paciente (comorbilidad moderada, 43,5%). La dislipidemia (40,3%), la hipertensión (40,1%) y el dolor generalizado (38,1%) fueron las comorbilidades más frecuentes. Las enfermedades cardiovasculares y mentales también fueron antecedentes personales prevalentes. El tiempo medio desde el diagnóstico fue de 18,1 años y el 7,5% de los pacientes fallecieron durante el período de seguimiento. De los 1.055 pacientes incluidos en el estudio, 192 (18,2%) presentaban cirrosis hepática. La mayoría de las variables estudiadas (características demográficas, comorbilidades generales/específicas y relacionadas con la enfermedad) fueron mayores con la presencia de cirrosis. En el modelo de regresión logística, la cirrosis se asoció principalmente a los eventos cardiovasculares (OR 3,8; IC del 95% 2,5-6,8), las insuficiencias orgánicas (OR 2,2; IC del 95% 1,3-3,2), el alcoholismo (OR 2,1; IC del 95% 1,3-3,3), la diabetes (OR 1,2; IC del 95% 1,1-1,5) y la edad (OR 1,2; IC del 95% 1,1-1,3).
Características basales de la serie estudiada
| Grupos de estudio | Sin cirrosis | Con cirrosis | Total | p |
|---|---|---|---|---|
| Número de pacientes (%) | n=863 (81,8) | n=192 (18,2) | N=1.055 (100) | |
| Características sociodemográficas | ||||
| Media de edad, años | 55,9 (14,3) | 66,9 (10,7) | 57,9 (14,4) | <0,001 |
| Rangos de edad, años | ||||
| 18-44 | 23,1 | 2,1 | 19,2 | |
| 45-64 | 45,4 | 34,4 | 43,4 | |
| 65-74 | 17,1 | 32,3 | 19,9 | |
| ≥75 | 14,4 | 31,3 | 17,4 | <0,001 |
| Sexo (masculino) | 56,0 | 53,6 | 55,5 | 0,558 |
| Régimen de pensionista a la SS | 52,5 | 84,9 | 58,4 | <0,001 |
| Comorbilidad general | ||||
| Promedio índice de Charlson | 1,3 (1,1) | 2,3 (1,3) | 1,5 (1,3) | <0,001 |
| 0 | 57,8 | 17,7 | 50,5 | |
| 1 | 27,2 | 16,7 | 25,3 | |
| 2 | 5,3 | 10,9 | 6,4 | |
| 3+ | 9,6 | 54,7 | 17,8 | <0,001 |
| Promedio de BUR | 3,0 (0,9) | 3,4 (0,8) | 3,1 (0,9) | <0,001 |
| 1 (comorbilidad muy baja) | 4,2 | 0,5 | 3,5 | |
| 2 (comorbilidad baja) | 23,6 | 8,9 | 20,9 | |
| 3 (comorbilidad moderada) | 42,8 | 46,9 | 43,5 | |
| 4 (comorbilidad alta) | 27,2 | 33,9 | 28,4 | |
| 5 (comorbilidad muy alta) | 2,2 | 9,9 | 3,6 | <0,001 |
| Comorbilidades asociadas | ||||
| Hipertensión | 38,0 | 49,5 | 40,1 | 0,003 |
| Diabetes mellitus | 17,6 | 28,6 | 19,6 | <0,001 |
| Dislipidemia | 38,8 | 46,9 | 40,3 | 0,040 |
| Obesidad | 18,7 | 30,7 | 20,9 | <0,001 |
| Fumadores activos | 27,2 | 28,1 | 27,4 | 0,802 |
| Alcoholismo | 22,0 | 37,0 | 24,7 | <0,001 |
| Enfermedad isquémica del corazón | 11,2 | 22,4 | 13,3 | <0,001 |
| Embolia | 13,0 | 23,4 | 14,9 | <0,001 |
| Eventos cardiovasculares | 22,7 | 34,4 | 24,8 | 0,001 |
| Falla de órganos | 8,7 | 22,9 | 11,3 | <0,001 |
| Asma bronquial | 6,8 | 10,4 | 7,5 | 0,088 |
| EPOC | 8,8 | 16,7 | 10,2 | 0,001 |
| Neuropatías | 4,4 | 10,4 | 5,5 | 0,001 |
| Demencia (todos los tipos) | 2,9 | 6,3 | 3,5 | 0,022 |
| Depresión | 19,8 | 41,1 | 23,7 | <0,001 |
| Neoplasias | 5,9 | 18,8 | 8,2 | <0,001 |
| Anemia por deficiencia de hierro | 16,6 | 27,1 | 18,5 | 0,001 |
| Esquizofrenia | 5,8 | 7,8 | 6,2 | 0,293 |
| Psicosis orgánica | 5,1 | 6,8 | 5,4 | 0,354 |
| Trastorno de ansiedad generalizada | 13,9 | 26,6 | 16,2 | <0,001 |
| Sida | 5,6 | 27,1 | 9,5 | <0,001 |
| Adicciones (alcohol, tabaco) | 12,9 | 62,5 | 21,9 | <0,001 |
| Tuberculosis pulmonar | 2,8 | 10,4 | 4,2 | <0,001 |
| Dolor generalizado | 33,3 | 59,9 | 38,1 | <0,001 |
| Insuficiencia renal crónica | 4,9 | 11,5 | 6,1 | 0,001 |
| Carcinoma hepatocelular | 3,5 | 12,0 | 5,0 | <0,001 |
| Trasplante hepático | 2,6 | 2,8 | 2,7 | 0,847 |
| Características de la enfermedad | ||||
| Tiempo desde el diagnóstico, años | 16,9 (8,6) | 23,6 (9,1) | 18,1 (9,1) | <0,001 |
| Muertes durante el seguimiento | 5,3 | 17,2 | 7,5 | <0,001 |
| IMC, kg/m2 | 27,9 (3,9) | 29,8 (4,6) | 28,3 (4,1) | <0,001 |
BUR: bandas de utilización de recursos; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; SS: Seguridad Social.
Valores expresados en porcentaje o media (desviación estándar).
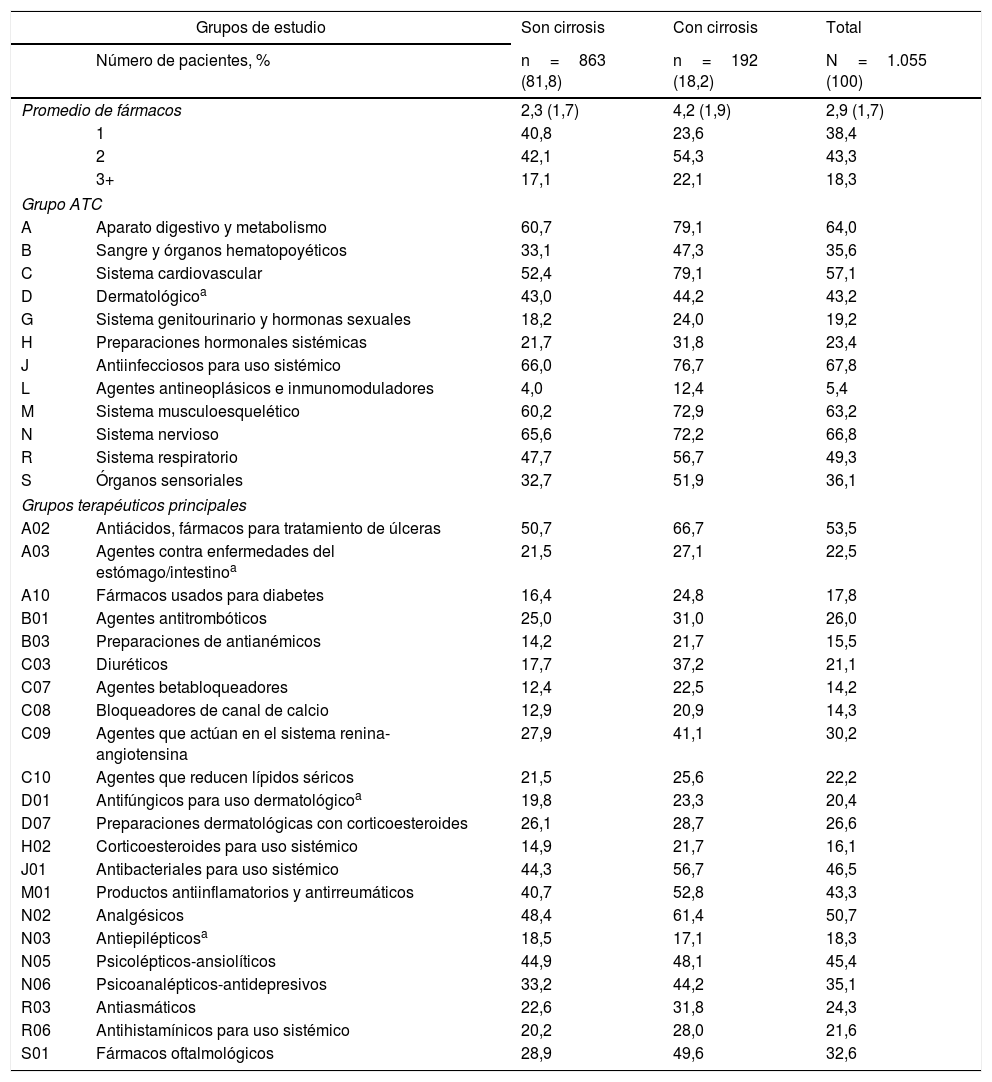
Los medicamentos concomitantes administrados a los pacientes durante el período de seguimiento se muestran en la tabla 3. El número medio de fármacos administrados fue de 2,9 (DE 1,7) por paciente-año. En general, las categorías del Anatomical Therapeutic Chemical Classification System más utilizadas fueron: Antiinfecciosos para uso sistémico (67,8%), Sistema nervioso (66,8%), Sistema digestivo y metabolismo (64,0%), Sistema musculoesquelético (63,2%) y Sistema cardiovascular (57,1%). Los grupos terapéuticos principales fueron: A02-Antiácidos (53,5%), N02-Analgésicos (50,7%), J01-Antibacterianos (46,5%), N05-Ansiolíticos (45,4%) y M01-Antiinflamatorios (43,3%). En la mayoría de los grupos estudiados, los pacientes con cirrosis tendieron a utilizar un mayor número de medicamentos que aquellos sin cirrosis, con una media general de 4,2 frente a 2,3 medicamentos por paciente-año, respectivamente (p<0,001).
Medicación concomitante administrada durante el período de seguimiento
| Grupos de estudio | Son cirrosis | Con cirrosis | Total | |
|---|---|---|---|---|
| Número de pacientes, % | n=863 (81,8) | n=192 (18,2) | N=1.055 (100) | |
| Promedio de fármacos | 2,3 (1,7) | 4,2 (1,9) | 2,9 (1,7) | |
| 1 | 40,8 | 23,6 | 38,4 | |
| 2 | 42,1 | 54,3 | 43,3 | |
| 3+ | 17,1 | 22,1 | 18,3 | |
| Grupo ATC | ||||
| A | Aparato digestivo y metabolismo | 60,7 | 79,1 | 64,0 |
| B | Sangre y órganos hematopoyéticos | 33,1 | 47,3 | 35,6 |
| C | Sistema cardiovascular | 52,4 | 79,1 | 57,1 |
| D | Dermatológicoa | 43,0 | 44,2 | 43,2 |
| G | Sistema genitourinario y hormonas sexuales | 18,2 | 24,0 | 19,2 |
| H | Preparaciones hormonales sistémicas | 21,7 | 31,8 | 23,4 |
| J | Antiinfecciosos para uso sistémico | 66,0 | 76,7 | 67,8 |
| L | Agentes antineoplásicos e inmunomoduladores | 4,0 | 12,4 | 5,4 |
| M | Sistema musculoesquelético | 60,2 | 72,9 | 63,2 |
| N | Sistema nervioso | 65,6 | 72,2 | 66,8 |
| R | Sistema respiratorio | 47,7 | 56,7 | 49,3 |
| S | Órganos sensoriales | 32,7 | 51,9 | 36,1 |
| Grupos terapéuticos principales | ||||
| A02 | Antiácidos, fármacos para tratamiento de úlceras | 50,7 | 66,7 | 53,5 |
| A03 | Agentes contra enfermedades del estómago/intestinoa | 21,5 | 27,1 | 22,5 |
| A10 | Fármacos usados para diabetes | 16,4 | 24,8 | 17,8 |
| B01 | Agentes antitrombóticos | 25,0 | 31,0 | 26,0 |
| B03 | Preparaciones de antianémicos | 14,2 | 21,7 | 15,5 |
| C03 | Diuréticos | 17,7 | 37,2 | 21,1 |
| C07 | Agentes betabloqueadores | 12,4 | 22,5 | 14,2 |
| C08 | Bloqueadores de canal de calcio | 12,9 | 20,9 | 14,3 |
| C09 | Agentes que actúan en el sistema renina-angiotensina | 27,9 | 41,1 | 30,2 |
| C10 | Agentes que reducen lípidos séricos | 21,5 | 25,6 | 22,2 |
| D01 | Antifúngicos para uso dermatológicoa | 19,8 | 23,3 | 20,4 |
| D07 | Preparaciones dermatológicas con corticoesteroides | 26,1 | 28,7 | 26,6 |
| H02 | Corticoesteroides para uso sistémico | 14,9 | 21,7 | 16,1 |
| J01 | Antibacteriales para uso sistémico | 44,3 | 56,7 | 46,5 |
| M01 | Productos antiinflamatorios y antirreumáticos | 40,7 | 52,8 | 43,3 |
| N02 | Analgésicos | 48,4 | 61,4 | 50,7 |
| N03 | Antiepilépticosa | 18,5 | 17,1 | 18,3 |
| N05 | Psicolépticos-ansiolíticos | 44,9 | 48,1 | 45,4 |
| N06 | Psicoanalépticos-antidepresivos | 33,2 | 44,2 | 35,1 |
| R03 | Antiasmáticos | 22,6 | 31,8 | 24,3 |
| R06 | Antihistamínicos para uso sistémico | 20,2 | 28,0 | 21,6 |
| S01 | Fármacos oftalmológicos | 28,9 | 49,6 | 32,6 |
ATC: Anatomical Therapeutic Chemical Classification System.
Valores expresados en porcentaje o media (desviación estándar).
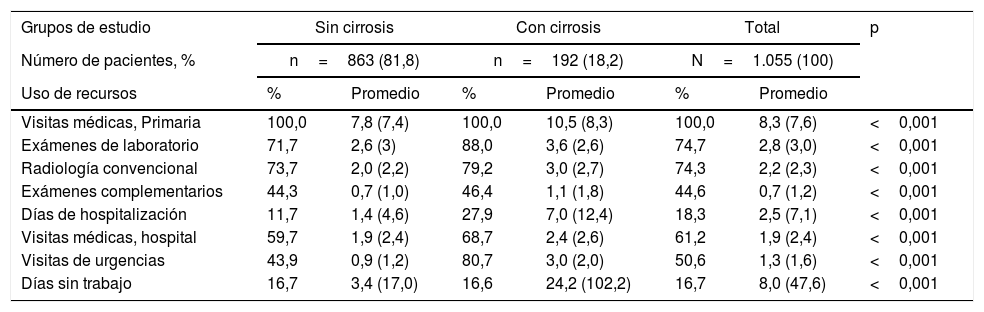
Los pacientes con cirrosis, en comparación con los pacientes sin cirrosis, tuvieron una media más elevada de visitas médicas en AP (10,5 frente a 7,8; p<0,001), días de hospitalización (7,0 frente a 1,4; p<0,001), visitas de Atención Especializada (2,4 frente a 1,9; p<0,001) y visitas de urgencias hospitalarias (3,0 frente a 0,9; p<0,001) (tabla 4). Además, hubo diferencias en los días de incapacidad laboral (34,2 frente a 3,4; p<0,001). Un total de 21 pacientes estaban con incapacidad temporal permanente.
Uso de recursos por grupos de estudio
| Grupos de estudio | Sin cirrosis | Con cirrosis | Total | p | |||
|---|---|---|---|---|---|---|---|
| Número de pacientes, % | n=863 (81,8) | n=192 (18,2) | N=1.055 (100) | ||||
| Uso de recursos | % | Promedio | % | Promedio | % | Promedio | |
| Visitas médicas, Primaria | 100,0 | 7,8 (7,4) | 100,0 | 10,5 (8,3) | 100,0 | 8,3 (7,6) | <0,001 |
| Exámenes de laboratorio | 71,7 | 2,6 (3) | 88,0 | 3,6 (2,6) | 74,7 | 2,8 (3,0) | <0,001 |
| Radiología convencional | 73,7 | 2,0 (2,2) | 79,2 | 3,0 (2,7) | 74,3 | 2,2 (2,3) | <0,001 |
| Exámenes complementarios | 44,3 | 0,7 (1,0) | 46,4 | 1,1 (1,8) | 44,6 | 0,7 (1,2) | <0,001 |
| Días de hospitalización | 11,7 | 1,4 (4,6) | 27,9 | 7,0 (12,4) | 18,3 | 2,5 (7,1) | <0,001 |
| Visitas médicas, hospital | 59,7 | 1,9 (2,4) | 68,7 | 2,4 (2,6) | 61,2 | 1,9 (2,4) | <0,001 |
| Visitas de urgencias | 43,9 | 0,9 (1,2) | 80,7 | 3,0 (2,0) | 50,6 | 1,3 (1,6) | <0,001 |
| Días sin trabajo | 16,7 | 3,4 (17,0) | 16,6 | 24,2 (102,2) | 16,7 | 8,0 (47,6) | <0,001 |
Valores expresados en porcentaje o media (desviación estándar).
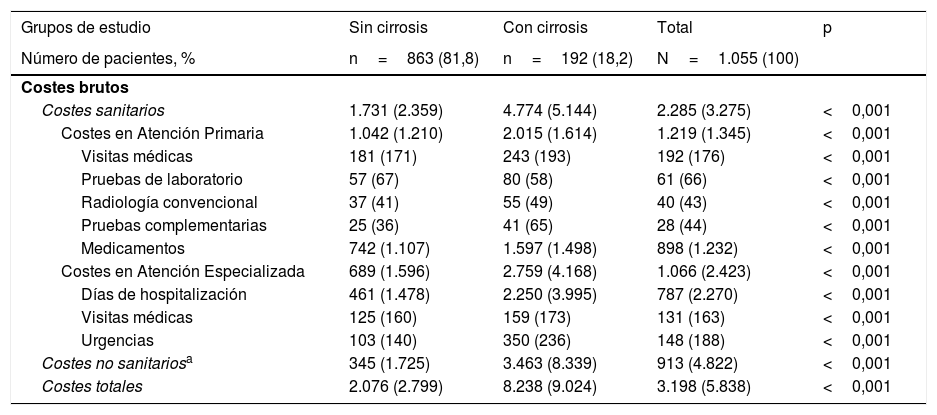
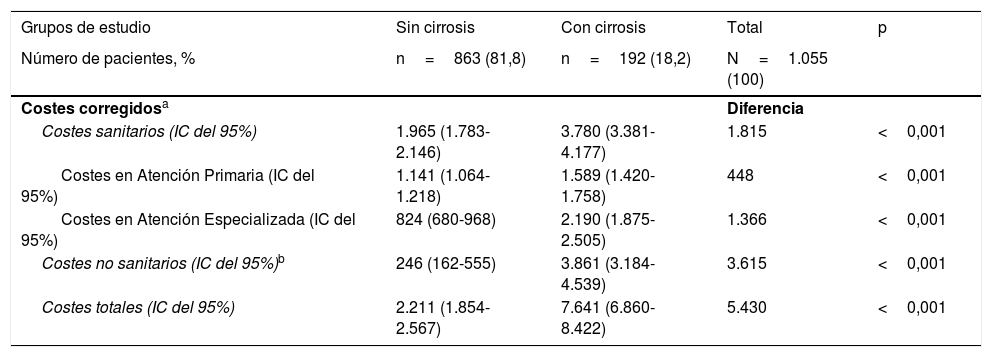
En la tabla 5 se detalla la distribución de los costes directos (sanitarios) y los costes indirectos según la presencia o ausencia de cirrosis. El coste bruto total de todos los pacientes atendidos fue de 3,3 millones de euros, de los cuales el 71,5% correspondieron a costes directos (sanitarios) y el 28,5% a costes indirectos. En los costes sanitarios, el 38,1% fueron costes de AP (medicación 28,1%, visitas médicas 6,0%) y el 33,3% costes de Atención Especializada. El coste total medio por paciente con VHC (incluidos los costes directos e indirectos) fue de 3.198€. Los costes de los sujetos sin cirrosis en comparación con aquellos con cirrosis fueron inferiores (2.076 frente a 8.238€, p<0,001). Los diferentes componentes del coste también disminuyeron proporcionalmente. En el modelo corregido (ANCOVA, tabla 6) se mantuvieron estas diferencias, siendo los costes de 2.211€ (IC del 95% 1.854-2.567) frente a 7.641€ (IC del 95% 6.860-8.422), con p<0,001 (diferencia de 5.430€ por paciente), respectivamente.
Distribución de costes directos (sanitarios) y costes indirectos por grupos de estudio (en euros)
| Grupos de estudio | Sin cirrosis | Con cirrosis | Total | p |
|---|---|---|---|---|
| Número de pacientes, % | n=863 (81,8) | n=192 (18,2) | N=1.055 (100) | |
| Costes brutos | ||||
| Costes sanitarios | 1.731 (2.359) | 4.774 (5.144) | 2.285 (3.275) | <0,001 |
| Costes en Atención Primaria | 1.042 (1.210) | 2.015 (1.614) | 1.219 (1.345) | <0,001 |
| Visitas médicas | 181 (171) | 243 (193) | 192 (176) | <0,001 |
| Pruebas de laboratorio | 57 (67) | 80 (58) | 61 (66) | <0,001 |
| Radiología convencional | 37 (41) | 55 (49) | 40 (43) | <0,001 |
| Pruebas complementarias | 25 (36) | 41 (65) | 28 (44) | <0,001 |
| Medicamentos | 742 (1.107) | 1.597 (1.498) | 898 (1.232) | <0,001 |
| Costes en Atención Especializada | 689 (1.596) | 2.759 (4.168) | 1.066 (2.423) | <0,001 |
| Días de hospitalización | 461 (1.478) | 2.250 (3.995) | 787 (2.270) | <0,001 |
| Visitas médicas | 125 (160) | 159 (173) | 131 (163) | <0,001 |
| Urgencias | 103 (140) | 350 (236) | 148 (188) | <0,001 |
| Costes no sanitariosa | 345 (1.725) | 3.463 (8.339) | 913 (4.822) | <0,001 |
| Costes totales | 2.076 (2.799) | 8.238 (9.024) | 3.198 (5.838) | <0,001 |
Valores expresados en media (desviación estándar).
Distribución de los costes corregidos directos (sanitarios) e indirectos por grupo de estudio (en euros)
| Grupos de estudio | Sin cirrosis | Con cirrosis | Total | p |
|---|---|---|---|---|
| Número de pacientes, % | n=863 (81,8) | n=192 (18,2) | N=1.055 (100) | |
| Costes corregidosa | Diferencia | |||
| Costes sanitarios (IC del 95%) | 1.965 (1.783-2.146) | 3.780 (3.381-4.177) | 1.815 | <0,001 |
| Costes en Atención Primaria (IC del 95%) | 1.141 (1.064-1.218) | 1.589 (1.420-1.758) | 448 | <0,001 |
| Costes en Atención Especializada (IC del 95%) | 824 (680-968) | 2.190 (1.875-2.505) | 1.366 | <0,001 |
| Costes no sanitarios (IC del 95%)b | 246 (162-555) | 3.861 (3.184-4.539) | 3.615 | <0,001 |
| Costes totales (IC del 95%) | 2.211 (1.854-2.567) | 7.641 (6.860-8.422) | 5.430 | <0,001 |
IC: intervalo de confianza.
Valores expresados en media (desviación estándar).
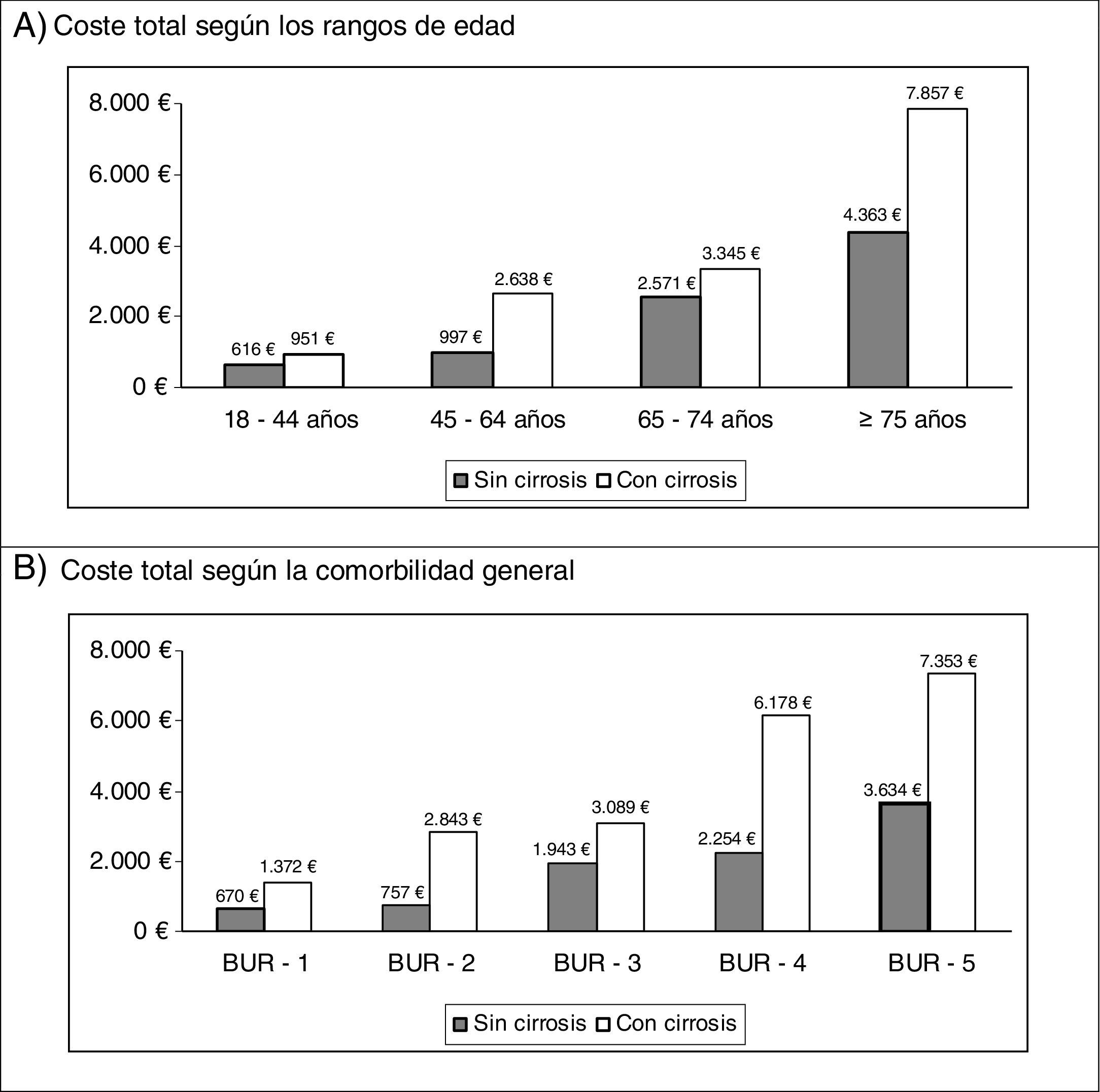
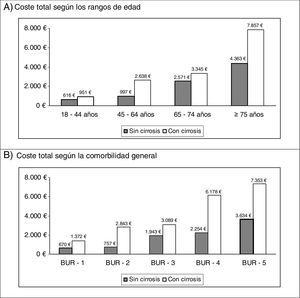
En las correlaciones binarias, la edad tuvo una asociación directa con la comorbilidad general (BUR, r=0,465; p<0,001), mientras que los costes (sanitarios) directos se asociaron con la cirrosis (r=0,407; p<0,001), la insuficiencia renal (r=0,418, p<0,001) y la comorbilidad general (r=0,300, p<0,001). La distribución del coste total de la serie estudiada por grupos de edad y la comorbilidad general, en ambos grupos de estudio (en ausencia/presencia de cirrosis) se muestran en la figura 2. Cabe señalar que se observó un coste más elevado en los pacientes con cirrosis en todas las comparaciones.
Distribución del coste total según rangos de edad y comorbilidad por grupos de estudio. Valores expresados en euros (promedio por paciente/año). Comparaciones por pares: diferencias estadísticamente significativas en todos casos (p<0,01).
BUR: bandas de utilización de recursos (comorbilidad general).
Los datos de nuestra cohorte de pacientes muestran que la prevalencia de HCC fue del 1,9%, y que el 18,2% de los pacientes tenían cirrosis. El tiempo medio desde el diagnóstico de la HCC hasta la inclusión en el estudio fue de 18,1 años. Estos resultados parecen ser consistentes con la literatura disponible2–4. En nuestro estudio, la edad media del paciente fue ligeramente superior a la reportada en la bibliografía. Esta observación puede ser coincidente, o también puede ser debida a que nuestros datos son más recientes, lo que refleja el envejecimiento progresivo de la población con infección por el VHC. Los resultados del estudio muestran que los pacientes con infección por el VHC, y especialmente los pacientes con cirrosis, se asocian con la comorbilidad y el uso de medicamentos concomitantes, circunstancia que ocasiona un elevado uso de recursos y costes para el Sistema Nacional de Salud. Existen pocos estudios observacionales que detallen estas variables en condiciones de vida real, circunstancia que repercute en la comparación de los resultados de la literatura. Sin embargo, una fortaleza del estudio puede ser que se trata de un estudio observacional, no intervencionista, basado en los resultados obtenidos en la práctica clínica habitual y, por lo tanto, proporciona información relevante sobre los aspectos epidemiológicos, clínicos y económicos de este grupo de pacientes. No obstante, cabe destacar que sin una adecuada estandarización de las metodologías en cuanto a la medida de las variables estudiadas, los resultados obtenidos deben interpretarse con prudencia, obligándonos a ser cautelosos en cuanto a la validez externa de los resultados.
En nuestro estudio la carga de morbilidad general (índice de Charlson, BUR) relacionada con los pacientes portadores de HCC fue elevada. Las enfermedades cardiovasculares, metabólicas, mentales y osteomusculares fueron las más prevalentes, especialmente en los pacientes con cirrosis hepática; estos resultados también son consistentes con la bibliografía consultada23–27. A modo de ejemplo, el VHC está asociado con una tendencia a la obesidad. Chen et al.28 detectaron un 28,8% de obesos en una cohorte de 1.118 pacientes con HCC; los factores independientes asociados con la obesidad fueron la edad y la carga viral. En una cohorte aleatorizada de 1.627 pacientes españoles (estudio SEEDO’97)29 se constató una mayor prevalencia de obesidad en mujeres con HCC, aunque la predisposición a la obesidad en estos pacientes también puede estar relacionada con los cambios en el estilo de vida inducidos por la infección. En 2 estudios publicados, McKibben et al.30 y Serres et al.31 concluyen que el VHC puede aumentar el riesgo de enfermedad cardiovascular, aunque se debería determinar si la duración de la infección o el tratamiento administrado pueden influir en el desarrollo de la placa de ateroma. En este aspecto, la cirrosis provoca resistencia a la insulina y a la diabetes tipo 2, pero está asociada a una mayor comorbilidad (abuso de alcohol, enfermedades médicas y enfermedades mentales). Además, en pacientes con genotipo 1 la esteatosis hepática está asociada a factores relacionados con el individuo, como el índice de masa corporal, la grasa corporal y la obesidad visceral, mientras que en pacientes con genotipo 3 se relaciona con la carga viral. Nuestros resultados son similares a los reportados en la bibliografía consultada32,33, aunque cabe destacar que en nuestro estudio no se cuantificó el genotipo ni el tratamiento retroviral de estos pacientes, por lo que se debe interpretar como una limitación de este.
Los medicamentos más consumidos fueron: antiinfecciosos, sistema nervioso, metabolismo, sistema musculoesquelético y cardiovascular. Estos resultados están en consonancia con la carga de morbilidad de estos pacientes, especialmente en los sujetos con cirrosis hepática. Lauffenburger et al.34, en un estudio retrospectivo realizado entre los años 2006-2010, ponen de manifiesto la elevada medicación a que están expuestos estos pacientes, circunstancia que puede repercutir en que casi la mitad de ellos manifiesten efectos secundarios y/o reacciones adversas a la medicación. Los datos aportados por Mohammad et al.35 y otros autores6,8,9,36 siguen la misma línea argumental que los nuestros.
El coste total de los pacientes con HCC fue elevado. El coste sanitario tuvo una asociación independiente con los años de evolución del diagnóstico, la cirrosis hepática, la edad, la comorbilidad general y la diabetes. Es importante destacar que los escasos estudios de costes de la enfermedad y su variabilidad dificultan la comparación de los resultados obtenidos. La variación se debió principalmente a la metodología utilizada, a las tarifas aplicadas y a los protocolos específicos seguidos en cada país. En la bibliografía se observan unos rangos del coste de la HCC comprendidos entre 12.000-25.000$. El Khoury et al.12 realizaron una revisión sistemática de la literatura para identificar el coste de la HCC, identificando solo 45 estudios relacionados. Los autores concluyen que la hepatitis C supone una alta carga económica a nivel mundial, siendo importante diferenciar la carga de morbilidad de los pacientes (ascitis refractaria 16.740$, cirrosis descompensada 4.660$, ascitis sensible a diuréticos 3.400$). Davis et al.37 evaluaron el coste en medicamentos y servicios médicos en Estados Unidos durante un período de 12 meses después del diagnóstico. Se analizaron 20.662 pacientes (edad media 49 años; hombres 61%) y obtuvo un coste de 20.961$ por paciente-año (4 veces mayor que en la población general). La tasa de hospitalizaciones fue del 24%. Las conclusiones del estudio fueron que el coste de los pacientes con HCC es elevado para las organizaciones sanitarias, y que hay que mejorar los esfuerzos en la detección precoz y el tratamiento de la HCC, sobre todo antes de la progresión a cirrosis hepática. Sapra et al.38 (N=3.795, edad 50,2 años; mujeres 36,2%) también realzan la elevada comorbilidad (anemia 29,2%, depresión 11,5%) y coste medio de estos pacientes (6.377$), sin incluir los días de incapacidad temporal. Tandon et al.39 detallan la elevada carga económica de la enfermedad, que está relacionada con la comorbilidad asociada a estos pacientes. Razavi et al.40, en un interesante estudio, detallan los elevados costes asociados a la HCC. Pero además, manifiestan que la prevalencia de HCC está en declive (menor incidencia). No obstante, la enfermedad hepática seguirá aumentando, así como los costes de su atención. Nuestros resultados son poco comparables, pero en general son consistentes con estos estudios, destacando la asociación entre la comorbilidad (cirrosis) y el coste. El coste indirecto de los pacientes de nuestro estudio podría ser más alto si se hubieran seguido los criterios de medida de las pérdidas de productividad laboral facilitadas por el Eurostat (21€/h) o el Eurofund (7,7h/día no trabajado). Aunque, a nuestro entender, quedan compensados con los menores salarios españoles, que están en consonancia con la fuente consultada21.
En el artículo se muestran las limitaciones propias de los estudios retrospectivos, como, por ejemplo, el infrarregistro de la enfermedad o la posible variabilidad de los profesionales y pacientes, al ser un diseño observacional. Cabe destacar que este tipo de diseños no está exento de sesgos (factores no tenidos en cuenta), como el nivel económico-social, cultural o de escolarización, las dosis farmacológicas consumidas, la duración del tratamiento, la adecuación terapéutica, el no tener diferenciados los diferentes genotipos de los pacientes, el tratamiento retroviral administrado, los posibles efectos secundarios o la clasificación de la cirrosis (compensada y descompensada), que se deberían minimizar. La principal objeción al estudio es su indudable sesgo de selección por parte del médico responsable a la hora de administrar unos u otros fármacos, y la validez externa, por lo que la interpretación de los resultados debe hacerse con prudencia. Además, cabe destacar que los datos del estudio se obtuvieron antes de la llegada de los nuevos antivirales de acción directa, por lo que esta circunstancia podría modificar algunos de los resultados del estudio (rápida evolución de nuevas moléculas y su utilización).
En conclusión, en este estudio observacional de cohortes se encontró que la infección por el VHC se asocia con una alta prevalencia de comorbilidades y uso de medicamentos concomitantes, especialmente en pacientes con cirrosis hepática, circunstancia que repercute en un mayor uso de recursos y costes para el Sistema Nacional de Salud español. Teniendo en cuenta estos hallazgos, los esfuerzos para identificar a los pacientes con infección por el VHC a través de un cribado adecuado (programas de detección precoz) e iniciar un tratamiento antiviral eficaz se muestran como prioridades relevantes. Se espera que el éxito de estas iniciativas minimice el riesgo de secuelas a largo plazo en pacientes con HCC.
AutoríaLa concepción y el diseño del manuscrito fueron realizados por A. Sicras y R. Navarro; la recogida de datos y el análisis estadístico fueron realizados por A. Sicras; y las tareas de interpretación de datos, redacción, revisión y aprobación del manuscrito presentado fueron realizadas por todos los autores.
Conflicto de interesesEl estudio fue patrocinado por Gilead Sciences. A. Sicras es un consultor independiente que participa en el desarrollo de este manuscrito. Los otros autores declaran que no tienen ningún conflicto de intereses.