El objetivo de este estudio fue investigar el rol y pronóstico de los biomarcadores de enfermedad de Alzheimer en pacientes con diagnóstico clínico de deterioro cognitivo leve (DCL) en una clínica de memoria de Latinoamérica.
MétodoOchenta y nueve pacientes con DCL, 43 con demencia tipo Alzheimer y 18 controles normales apareados por edad, sexo y escolaridad fueron estudiados con un extenso protocolo demográfico, neurológico y neuropsicológico en la clínica de memoria del Instituto FLENI de Buenos Aires. Todos completaron una RM cerebral, una PET con FDG, una PET con estudios amiloideo (PIB), genotipificación de APOE y estudio de Aβ1-42, tau and f-tau de líquido cefalorraquídeo. Basado en la presencia/ausencia de patología amiloidea y neurodegeneración los pacientes fueron categorizados como A+/A− y N+/N− respectivamente.
ResultadosEn el estudio de líquido cefalorraquídeo el 18% de los controles, el 64% de los DCL y el 92% de las demencia tipo Alzheimer tenían patología amiloidea; y un 11% de los controles, el 6% de los DCL y el 8% de las DTA eran sospechosos de fisiopatología no Alzheimer. En el seguimiento a los 30 meses el 45% de los DCL con amiloide positivo y el 20% de los que presentaron amiloide negativo progresaron a demencia.
ConclusionesEste estudio muestra el pronóstico de los DCL basado en los biomarcadores, y respalda su importancia en la toma de decisiones en la práctica diaria.
This study aimed to investigate the role and prognosis of Alzheimer disease biomarkers in patients with mild cognitive impairment (MCI) at a memory clinic in Latin America.
MethodsWe studied 89 patients with MCI, 43 with Alzheimer-type dementia, and 18 healthy controls (matched for age, sex, and educational level) at our memory clinic (Instituto FLENI) in Buenos Aires, Argentina. Patients and controls underwent an extensive demographic, neurological, and neuropsychological assessment. All subjects underwent a brain MRI scan; FDG-PET scan; amyloid PET scan; apolipoprotein E genotyping; and cerebrospinal fluid concentrations of Aβ1-42, tau, and phosphorylated tau. Patients were categorised as positive or negative for the presence of amyloid pathology and neurodegeneration.
ResultsAmyloid pathology was observed in cerebrospinal fluid results in 18% of controls, 64% of patients with MCI, and 92% of patients with Alzheimer-type dementia. Suspected non–Alzheimer disease pathophysiology was found in 11% of controls, 6% of patients with MCI, and 8% of patients with Alzheimer-type dementia. At 30 months of follow-up, 45% of amyloid-positive patients with MCI and 20% of amyloid-negative patients with MCI showed progression to dementia.
ConclusionsThis study demonstrates biomarker-based MCI prognosis and supports its role in clinical decision-making in daily practice.
La agregación extracelular de la proteína β amiloidea y la tau hiperfosforilada en la degeneración neurofibrilar en las neuronas son las alteraciones neuropatológicas características de la enfermedad de Alzheimer (EA), las cuales pueden identificarse directamente en los pacientes a través de la marcación amiloidea de una PET cerebral1,2 o indirectamente con la reducción del nivel de la Aβ1-42, y el aumento de la tau total y la tau fosforilada en líquido cefalorraquídeo (LCR)3. Basados en el uso de estos biomarcadores en el National Institute of Aging and Alzheimer's Association (Instituto Nacional de Envejecimiento y la Asociación de Alzheimer [NIA-AA]) generaron recomendaciones para el diagnóstico de deterioro cognitivo leve (DCL) debido a EA4 y Alzheimer presintomático5. En los pacientes estudiados se encontraron sujetos con ambos biomarcadores negativos (amiloide negativo A−, y neurodegeneración negativa N−), con ambos biomarcadores positivos (A+/N+) llamados de perfil Alzheimer, con amiloide positivo (A+/N−) y solo con neurodegeneración (A−/N+) llamados «suspected non-Alzheimer disease pathophysiology» («sospechados de patofisiología no Alzheimer» [SNAP])6. El marco de la estadificación NIA-AA para el Alzheimer preclínico está basado en la combinación de los biomarcadores y en la cognición: estadio 1 es amiloidosis sin neurodegeneración (A+/N−), estadio 2 amiloidosis más neurodegeneración (A+/N+) y estadio 3 amiloidosis más neurodegeneración y sutiles cambios cognitivos (A+/N+/c+)5.
Los pacientes con DCL fueron considerados clásicamente de alto riesgo de demencia, si tienen depósito amiloideo es debido a EA y la ausencia del mismo es considerada un posible proceso neurodegenerativo no Alzheimer.
El objetivo de este trabajo fue describir los resultados del estudio con los biomarcadores de EA en pacientes con DCL en una clínica de memoria de Latinoamérica y su implicancia en el pronóstico evolutivo de una cohorte argentina del Alzheimer's Disease Neuroimaging Initiative (ADNI).
Pacientes y métodoCiento cincuenta pacientes de la Clínica de Memoria del Instituto Neurológico Raúl Carrea (FLENI), en Buenos Aires, Argentina, fueron incluidos en este análisis. Cuarenta pacientes pertenecen a la cohorte argentina del ADNI1 y 110 a la base de pacientes con biomarcadores de FLENI. Fueron seleccionados 89 pacientes con DCL, 43 con demencia tipo Alzheimer (DTA) y 18 controles normales apareados por edad y nivel educacional. Todos los sujetos fueron evaluados en la Clínica de Memoria de FLENI por un neurólogo cognitivo experimentado (PCM, MJR, JC y RFA). El chequeo inicial de los pacientes incluyo una entrevista estructurada a los pacientes y familiares, laboratorio, neuroimágenes estructuradas y moleculares. El procedimiento diagnóstico estandarizado fue descripto previamente1. Después de completar la evaluación, los miembros del equipo revisaban y consensuaban el diagnóstico de cada caso. El diagnóstico de DCL se hizo de acuerdo a los criterios de Petersen7 y el de DTA basado en los criterios de McKhann8,9 y el criterio de demencia del DSM IV10. Esto último permite clasificar a los pacientes dementes como clínicamente Alzheimer probables.
Este estudio fue aprobado por el comité de ética del Instituto FLENI, cumple las reglas locales de buenas prácticas clínicas y la Declaración de Helsinki. El consentimiento informado fue obtenido de todos los participantes y/o sus representantes de acuerdo a los requerimientos legales locales.
Seguimiento a 30 mesesSe realizó un análisis suplementario con la cohorte argentina de ADNI (n=40), donde los pacientes con DCL fueron seguidos longitudinalmente y reevaluados a los 6, 12 y 30 meses. Se completó un análisis de supervivencia en el cual el resultado fue definido como la transición de DCL a demencia en el seguimiento (resultado dicotómico). El tiempo en el análisis fue el tiempo de seguimiento de 30 meses.
Batería neuropsicológicaLos sujetos fueron evaluados con el Mini Mental State Examination de Folstein et al. 197511 (test del estado mental mínimo de Folstein [MMSE]), la escala de memoria lógica de Wechsler12, el Rey Auditory Verbal Learning Test13 (test de aprendizaje verbal [RAVLT]), el Boston naming test14 (test de denominación de Boston [BNT]), la fluencia verbal semántica y fonológica15, el Trail Making Test16 (test del trazo A y B [TMT], la Clinical Dementia Rating17 (escala clínica de demencia [CDR]), el Neuropsychiatric Inventory18 (inventario neuropsiquiátrico [NPI]), la Geriatric Depression Scale19 (escala geriátrica de depresión [GDS]) y el cuestionario de evaluación funcional20.
Resonancia magnética cerebralTodos los sujetos completaron una resonancia magnética cerebral de 3 teslas incluyendo los tiempos T1, T2, fluid attenuated inversion recovery (FLAIR), eco-gradiente y difusión. Las imágenes fueron guardadas en el sistema Kodak Carestream. La reconstrucción y la segmentación volumétrica del hipocampo fue realizada con el sistema de análisis FreeSurfer v 4.3 image analysis suite, libre y disponible online (http://surfer.nmr. mgh.harvard.edu/).
Genotipificación de APOEEn línea con los estudios ADNI se realizó la genotipificación de APOE a todos los participantes1. La presencia de al menos un alelo ɛ4 fue considerada como portador positivo (ɛ4+).
Biomarcadores en líquido cefalorraquídeoEl LCR fue recolectado por punción lumbar desde L3-4 a L4-5 de acuerdo a los estándares operacionales del ADNI en tubos de polipropileno y guardados a −80°C. El laboratorio de biología molecular de FLENI corre los biomarcadores de LCR usando los kits de ELISA de Innogenetics. El laboratorio está certificado por el programa de control de calidad ADNI1. Los pacientes fueron caracterizados de acuerdo a los biomarcadores de LCR en A (amiloide) positivo/negativo y N (neurodegeneración) positiva/negativa
Análisis estadístico de los datosEl análisis fue realizado con el paquete estadístico SPSS (del inglés, Statistical Package for the Social Sciences, v19.0, SPSS Inc., Ill., EE. UU.). Las variables continuas fueron expresadas en media (desviación estándar) y las variables categoriales como frecuencias (%). El test χ2 fue usado para la comparación de variables categoriales. La normalidad fue testeada usando el test de Shapiro-Wilk. La homogeneidad de la varianza fue evaluada usando el test de Levene. El test de ANOVA (one-way analysis of variance) fue usado para comparaciones de variables continuas si la muestra tiene una distribución normal. Si las muestras no tienen una distribución normal se usó el test de Kruskal-Wallis. Para test post hoc se utilizó el de múltiples comparaciones de Bonferroni. Se estimó la proporción de conversión. Las diferencias entre las medias son consideradas significativas con p<0,05.
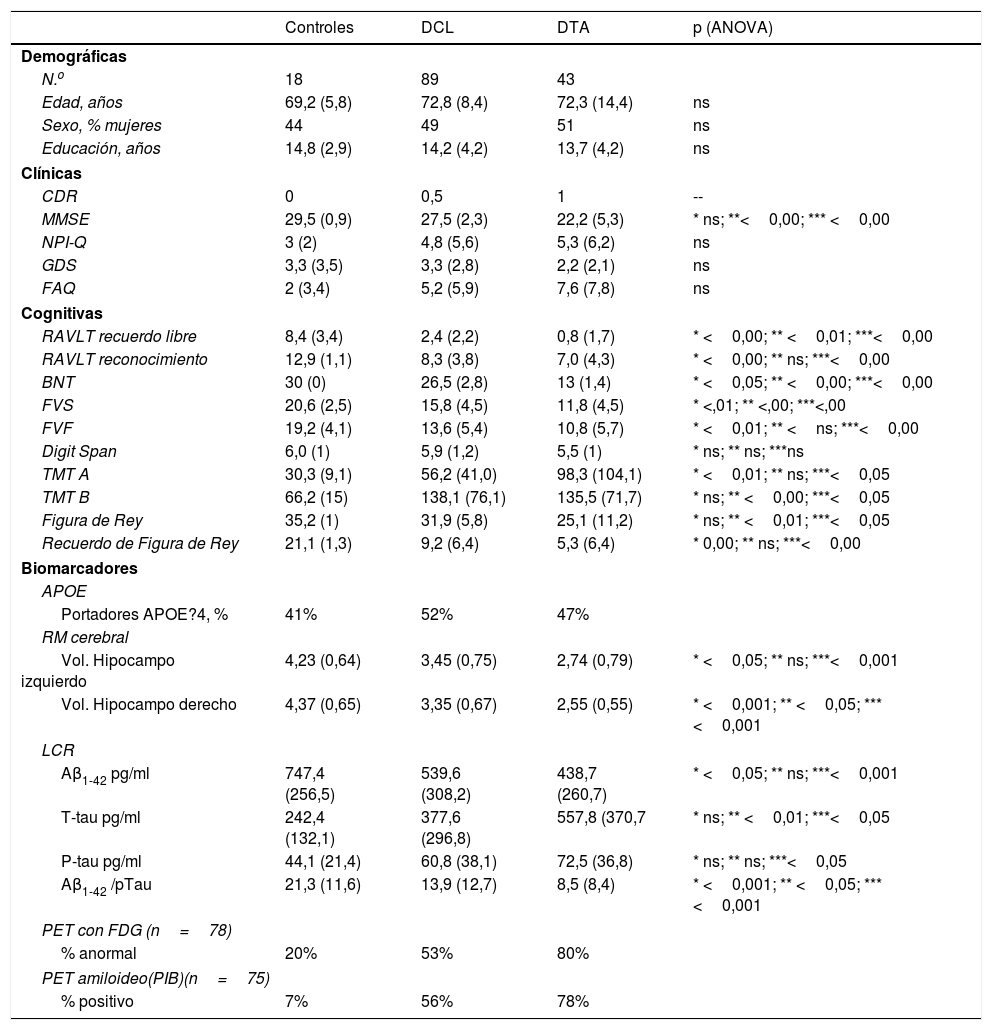
ResultadosCaracterísticas basales de los sujetos en estudioLa información basal inicial relacionada a las variables demográficas, clínicas, cognitivas y de los biomarcadores de EA de los participantes se describe en la tabla 1.
Variables demográficas, clínicas, cognitivas y biomarcadores de LCR
| Controles | DCL | DTA | p (ANOVA) | |
|---|---|---|---|---|
| Demográficas | ||||
| N.o | 18 | 89 | 43 | |
| Edad, años | 69,2 (5,8) | 72,8 (8,4) | 72,3 (14,4) | ns |
| Sexo, % mujeres | 44 | 49 | 51 | ns |
| Educación, años | 14,8 (2,9) | 14,2 (4,2) | 13,7 (4,2) | ns |
| Clínicas | ||||
| CDR | 0 | 0,5 | 1 | -- |
| MMSE | 29,5 (0,9) | 27,5 (2,3) | 22,2 (5,3) | * ns; **<0,00; *** <0,00 |
| NPI-Q | 3 (2) | 4,8 (5,6) | 5,3 (6,2) | ns |
| GDS | 3,3 (3,5) | 3,3 (2,8) | 2,2 (2,1) | ns |
| FAQ | 2 (3,4) | 5,2 (5,9) | 7,6 (7,8) | ns |
| Cognitivas | ||||
| RAVLT recuerdo libre | 8,4 (3,4) | 2,4 (2,2) | 0,8 (1,7) | * <0,00; ** <0,01; ***<0,00 |
| RAVLT reconocimiento | 12,9 (1,1) | 8,3 (3,8) | 7,0 (4,3) | * <0,00; ** ns; ***<0,00 |
| BNT | 30 (0) | 26,5 (2,8) | 13 (1,4) | * <0,05; ** <0,00; ***<0,00 |
| FVS | 20,6 (2,5) | 15,8 (4,5) | 11,8 (4,5) | * <,01; ** <,00; ***<,00 |
| FVF | 19,2 (4,1) | 13,6 (5,4) | 10,8 (5,7) | * <0,01; ** <ns; ***<0,00 |
| Digit Span | 6,0 (1) | 5,9 (1,2) | 5,5 (1) | * ns; ** ns; ***ns |
| TMT A | 30,3 (9,1) | 56,2 (41,0) | 98,3 (104,1) | * <0,01; ** ns; ***<0,05 |
| TMT B | 66,2 (15) | 138,1 (76,1) | 135,5 (71,7) | * ns; ** <0,00; ***<0,05 |
| Figura de Rey | 35,2 (1) | 31,9 (5,8) | 25,1 (11,2) | * ns; ** <0,01; ***<0,05 |
| Recuerdo de Figura de Rey | 21,1 (1,3) | 9,2 (6,4) | 5,3 (6,4) | * 0,00; ** ns; ***<0,00 |
| Biomarcadores | ||||
| APOE | ||||
| Portadores APOE?4, % | 41% | 52% | 47% | |
| RM cerebral | ||||
| Vol. Hipocampo izquierdo | 4,23 (0,64) | 3,45 (0,75) | 2,74 (0,79) | * <0,05; ** ns; ***<0,001 |
| Vol. Hipocampo derecho | 4,37 (0,65) | 3,35 (0,67) | 2,55 (0,55) | * <0,001; ** <0,05; ***<0,001 |
| LCR | ||||
| Aβ1-42 pg/ml | 747,4 (256,5) | 539,6 (308,2) | 438,7 (260,7) | * <0,05; ** ns; ***<0,001 |
| T-tau pg/ml | 242,4 (132,1) | 377,6 (296,8) | 557,8 (370,7 | * ns; ** <0,01; ***<0,05 |
| P-tau pg/ml | 44,1 (21,4) | 60,8 (38,1) | 72,5 (36,8) | * ns; ** ns; ***<0,05 |
| Aβ1-42 /pTau | 21,3 (11,6) | 13,9 (12,7) | 8,5 (8,4) | * <0,001; ** <0,05; ***<0,001 |
| PET con FDG (n=78) | ||||
| % anormal | 20% | 53% | 80% | |
| PET amiloideo(PIB)(n=75) | ||||
| % positivo | 7% | 56% | 78% | |
BNT: Boston naming test; CDR: Clinical Dementia Rating; DCL: deterioro cognitivo leve; DTA: demencia tipo Alzheimer; FAQ: Functional Activities Questionnaire; FVF: fluencia verbal fonológica (p); FVS: fluencia verbal semántica (animales);GDS: Geriatric Depression Scale; MMSE: Mini Mental State Examination; NPI-Q: Neuropsychiatric Inventory; ns: no significativo; RAVLT: Rey Auditory Verbal Learning Test; TMT A y B: trail making test A and B.
Media (DE); p (ANOVA) y post hoc de Bonferroni.
* controles vs. DCL.
** DCL vs. DTA.
*** controles vs. DTA.
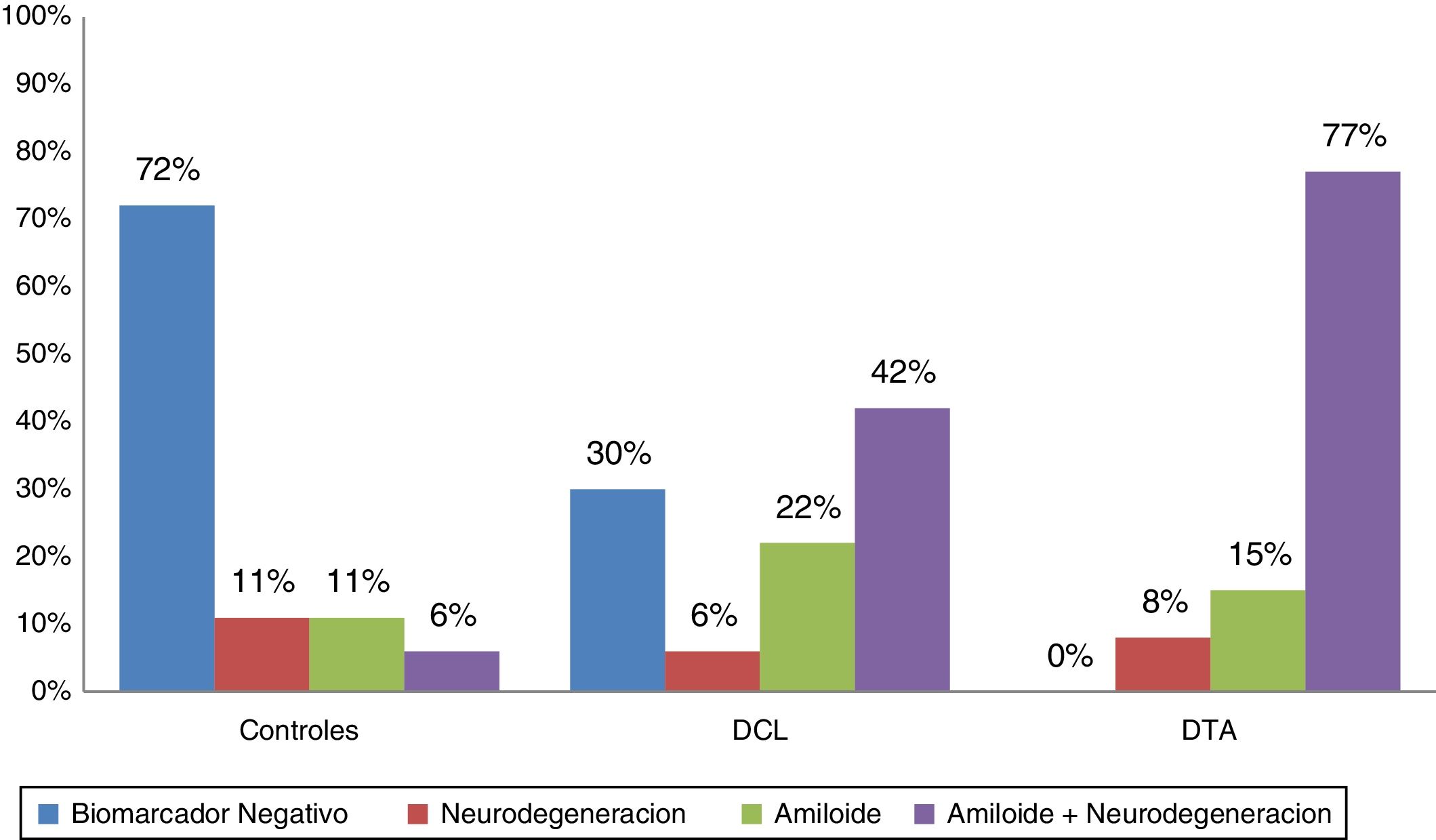
Los 3 grupos (DCL, DTA y controles normales) están apareados por edad, educación y sexo. Todos los sujetos eran de origen caucásico con el español como lengua materna. La evaluación cognitiva, el volumen hipocámpico y los biomarcadores de LCR basales son significativamente diferentes de los controles. Globalmente las 3 poblaciones tienen porcentaje similares en portadores ?4 de APOE 4. El hipometabolismo anormal estaba presente en el 80% de las DTA, el 53% de los DCL y el 20% de los controles normales. La PET con captación amiloidea (PIB) fue positiva en el 78% de las DTA, el 56% de los DCL y el 7% de los controles.
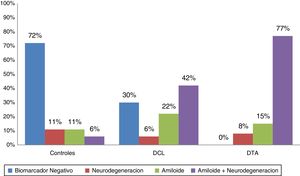
De acuerdo con los biomarcadores de LCR los pacientes fueron categorizados como biomarcador negativo (A−/N−); amiloide solo (A+/N−), neurodegeneración sola (A−/N+) y amiloidosis con neurodegeneración (A+/N+). En la figura 1 se observan las distribuciones en las 3 poblaciones, mostrando amiloide positivo en el 92% de las DTA, el 64% de los DCL y el 18% de los controles. Se encontró SNAP en el 11% de los controles, el 6% de los DCL y el 8% de las DTA.
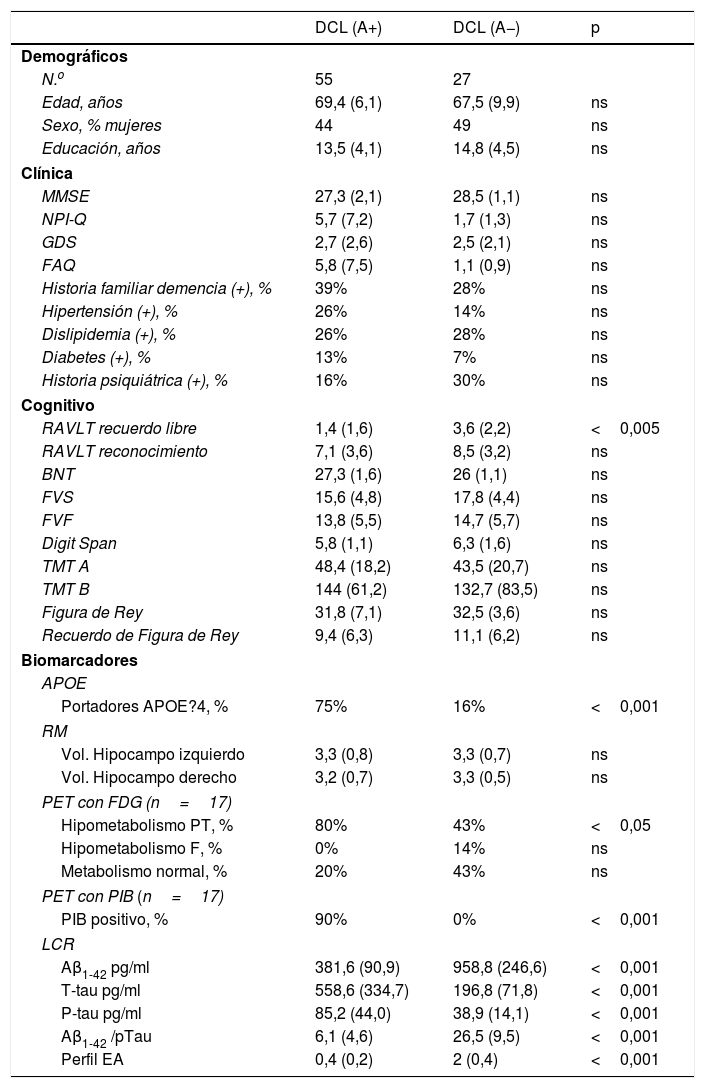
Basados en la presencia o ausencia de amiloide en LCR los pacientes con DCL fueron divididos en aquellos con amiloide positivo (n=55) y aquellos con amiloide negativo (n=27). Ambos grupos están apareados por edad, educación y sexo. No hay diferencias en el rendimiento cognitivo global por MMSE, ni en los síntomas neuropsiquiátricos ni en el compromiso funcional. (Ver tabla 2).
Comparación entre DCL con amiloide positivo vs. amiloide negativo
| DCL (A+) | DCL (A−) | p | |
|---|---|---|---|
| Demográficos | |||
| N.o | 55 | 27 | |
| Edad, años | 69,4 (6,1) | 67,5 (9,9) | ns |
| Sexo, % mujeres | 44 | 49 | ns |
| Educación, años | 13,5 (4,1) | 14,8 (4,5) | ns |
| Clínica | |||
| MMSE | 27,3 (2,1) | 28,5 (1,1) | ns |
| NPI-Q | 5,7 (7,2) | 1,7 (1,3) | ns |
| GDS | 2,7 (2,6) | 2,5 (2,1) | ns |
| FAQ | 5,8 (7,5) | 1,1 (0,9) | ns |
| Historia familiar demencia (+), % | 39% | 28% | ns |
| Hipertensión (+), % | 26% | 14% | ns |
| Dislipidemia (+), % | 26% | 28% | ns |
| Diabetes (+), % | 13% | 7% | ns |
| Historia psiquiátrica (+), % | 16% | 30% | ns |
| Cognitivo | |||
| RAVLT recuerdo libre | 1,4 (1,6) | 3,6 (2,2) | <0,005 |
| RAVLT reconocimiento | 7,1 (3,6) | 8,5 (3,2) | ns |
| BNT | 27,3 (1,6) | 26 (1,1) | ns |
| FVS | 15,6 (4,8) | 17,8 (4,4) | ns |
| FVF | 13,8 (5,5) | 14,7 (5,7) | ns |
| Digit Span | 5,8 (1,1) | 6,3 (1,6) | ns |
| TMT A | 48,4 (18,2) | 43,5 (20,7) | ns |
| TMT B | 144 (61,2) | 132,7 (83,5) | ns |
| Figura de Rey | 31,8 (7,1) | 32,5 (3,6) | ns |
| Recuerdo de Figura de Rey | 9,4 (6,3) | 11,1 (6,2) | ns |
| Biomarcadores | |||
| APOE | |||
| Portadores APOE?4, % | 75% | 16% | <0,001 |
| RM | |||
| Vol. Hipocampo izquierdo | 3,3 (0,8) | 3,3 (0,7) | ns |
| Vol. Hipocampo derecho | 3,2 (0,7) | 3,3 (0,5) | ns |
| PET con FDG (n=17) | |||
| Hipometabolismo PT, % | 80% | 43% | <0,05 |
| Hipometabolismo F, % | 0% | 14% | ns |
| Metabolismo normal, % | 20% | 43% | ns |
| PET con PIB (n=17) | |||
| PIB positivo, % | 90% | 0% | <0,001 |
| LCR | |||
| Aβ1-42 pg/ml | 381,6 (90,9) | 958,8 (246,6) | <0,001 |
| T-tau pg/ml | 558,6 (334,7) | 196,8 (71,8) | <0,001 |
| P-tau pg/ml | 85,2 (44,0) | 38,9 (14,1) | <0,001 |
| Aβ1-42 /pTau | 6,1 (4,6) | 26,5 (9,5) | <0,001 |
| Perfil EA | 0,4 (0,2) | 2 (0,4) | <0,001 |
BNT: Boston naming test; DCL (A+): deterioro cognitivo leve con amiloide positivo; DCL (A−): deterioro cognitivo leve con amiloide negativo; F: frontal; FAQ: Functional Activities Questionnaire; FVF: fluencia verbal fonológica (p); FVS: fluencia verbal semántica (animales); GDS: Geriatric Depression Scale; LCR: líquido cefalorraquídeo; MMSE: Mini Mental State Examination; NPI-Q: Neuropsychiatric Inventory; ns: no significativo; PT: parietotemporal; RAVLT: Rey Auditory Verbal Learning Test; TMT A y B: trail making test A and B Hipometabolismo
Media (DE); p (ANOVA) y post hoc de Bonferroni. ns: no significativo.
En la evaluación cognitiva no hay diferencia intergrupal salvo en la memoria diferida (RAVLT recuerdo libre p<0,005). No se encontraron diferencias en el volumen hipocámpico. El 75% de los amiloide-positivo tenían al menos un alelo 4 en APOE contra un 16% de los negativos. Los pacientes con amiloide positivo tenían significativamente más hipometabolismo parietotemporal típico de Alzheimer (80 vs. 43%) en la PET con FDG. El 90% de los pacientes con amiloide positivo en el LCR tenían PIB positivo en la PET, habiendo una discordancia del 10%.
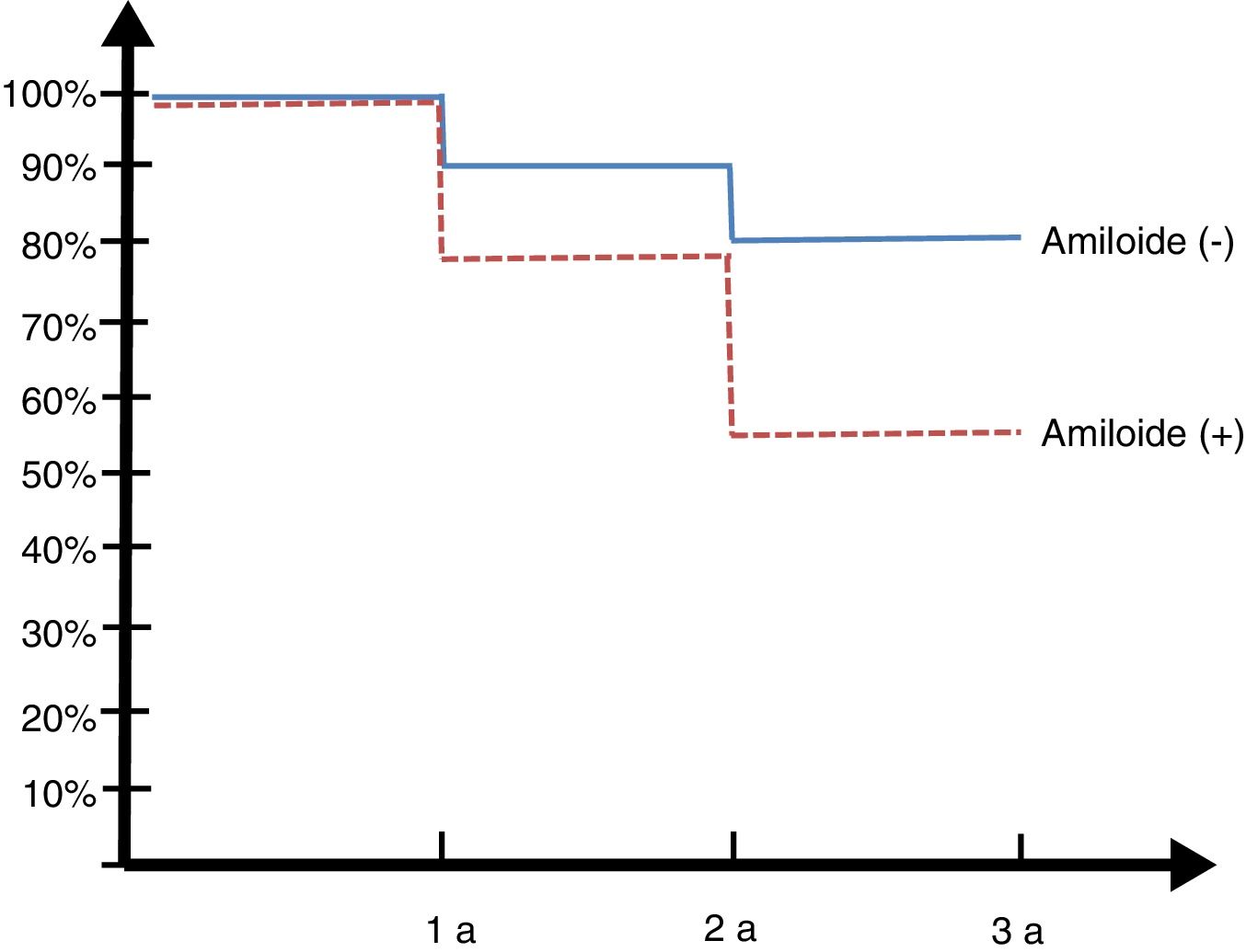
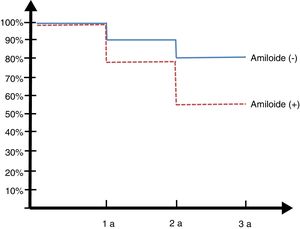
Seguimiento longitudinal 30 mesesLos pacientes de la cohorte argentina ADNI fueron reevaluados a los 6, 12 y 30 meses (ver figura 2, curva de Kaplan Meyer).
De los 14 controles normales solo uno (7%) convirtió en DCL a los 2 años. Entre los 23 DCL, 8 (34,7%) rotaron a DTA, de los 13 que tenían amiloide positivo 6 (45%) rotaron a demencia y de los 10 amiloide negativo (SNAP) solo 2 (20%) rotaron.
DiscusiónEl diagnóstico de la EA a partir de los criterios de McKhann et al. (1984)8 fue modificado a partir del uso frecuente de los biomarcadores de EA21. Petersen y Morris (1999)7 en un intento por llegar en forma precoz al diagnóstico definen los criterios del DCL como un constructo de riesgo aumentado. Pero la variabilidad de patologías y pronósticos finales de este llevó a una confusión en la literatura21,22. El Instituto Nacional de Envejecimiento y la Asociación de Alzheimer de EE. UU. basados en los biomarcadores de EA sugirieron las nuevas recomendaciones para el diagnóstico de DCL debido a EA4. Es aceptado internacionalmente que los nuevos tratamientos en desarrollo beneficiaran sobre todo a los individuos con formas leves (DCL) o presintomáticas de la enfermedad23. Así, los biomarcadores mejoran sustancialmente la agudeza diagnóstica y permiten un estricto monitoreo terapéutico24. Nuestro trabajo realizado en un Centro de Memoria (Instituto Neurológico FLENI, Buenos Aires) de Latinoamérica muestra la aplicabilidad en la práctica clínica local. Las 3 poblaciones iniciales (controles, DCL y DTA) permiten demostrar la adecuada caracterización poblacional y son fácilmente diferenciables por la clínica neuropsicológica que muestra en las enfermedades el clásico perfil cortical de la EA con un compromiso más profundo en la DTA a pesar de no haber diferencias significativas en el MMSE entre DCL y controles1,21. La volumetría hipocámpica muestra el avance de la atrofia bilateral en el DCL y aun mayor en la DTA como fue referido sistemáticamente en la literatura25. A nivel del Aβ1-42 en LCR el DCL y la DTA son diferentes de los controles pero no entre ellos. Esta característica ha sido ya mostrada por Sperling et al. (2011)5 quienes describieron una caída brusca de esta proteína en LCR en los estadios iniciales con una meseta posterior entre el DCL y la DTA. No sucede lo mismo con tau y f-tau que aumentan progresivamente en la medida que empeora la clínica de la enfermedad5. Cuando estudiamos el comportamiento de los biomarcadores amiloideos (Aβ1-42) y de neurodegeneración (tau y f-tau) en LCR en las 3 poblaciones, el 18% de los controles, el 64% de los DCL y el 92% de los pacientes con clínica de DTA tenían amiloide positivo similar a lo reportado por ADNI en la literatura26. La presencia de neurodegeneración sin amiloidosis que habla de una enfermedad no Alzheimer fue descripta como SNAP6; en nuestra muestra la tenían el 11% de los controles, el 6% de los DCL y el 8% de las DTA. Estos resultados son similares a los reportados en el estudio ADNI27 quienes encontraron un 17% en DCL y un 7% en DTA. Algunos autores28 creen que el DCL debido a EA o con SNAP es indistinguible en los rasgos clínicos, factores de riesgo y pronóstico. A partir de la presencia de amiloidosis o no en LCR los pacientes con DCL de nuestra muestra fueron divididos en 2 grupos, aquellos que tenían DCL debido a EA (amiloidosis positiva) y aquellos no tenían Alzheimer (amiloidosis negativa) ambos grupos similares en las características basales de edad, educación, sexo, y nivel cognitivo global (por MMSE). Como refirieron Caroli et al.28 no se encontraron diferencias en los síntomas neuropsiquiátricos, funcionales ni neuropsicológicos salvo un resultado ligeramente menor en el recuerdo libre de la memoria episódica. Tampoco se encontró diferencias entre ambas poblaciones en la volumetría hipocámpica.
Cuando se consideró la APOE, los DCL amiloide-positivo tenían un 75% de portadores de al menos un alelo 4 y entre los negativos un 16%. Este resultado es similar al publicado por ADNI29 que mostraron un 70,6% en los DCL amiloide-positivos y un 18,7% en los negativos. El 10% de los pacientes con Aβ1-42 bajo en LCR tenían amiloide negativo en PET con marcación amiloidea; esta discordancia ha sido justificada debido a que ambos métodos marcan diferentes estadios del depósito amiloideo y sistemáticamente se ha referido que primero se encuentra la reducción del Aβ1-42 en líquido y posteriormente el depósito cerebral medido por PET30. En el seguimiento de los pacientes a 30 meses globalmente el 34,7% de los DCL rotaron a demencia pero cuando se los dividió según el amiloide positivo/negativo, el 45% de los DCL amiloide-positivo (debidos a EA) contra el 20% de los DCL amiloide-negativo rotaron a demencia. Si bien casi la mitad de los que tenían amiloide positivo rotaron, el número de conversión a demencia de los no debido a EA fue significativamente mayor a los sujetos controles como otros autores27,28. Esto es sumamente importante debido a que cuando en clínica asistencial estamos frente a un DCL la presencia de amiloide nos habla de EA, pero la ausencia no nos habla de normalidad sino de la posibilidad de otra enfermedad no Alzheimer como lo referido por otros autores31 quienes propusieron el primary age related tauopathy (PART). Duyckaerts et al.32 creen que no hay evidencia de que el PART y la EA sean estrictamente 2 entidades diferentes. Dada la controversia actual en esto es sumamente importante tener más estudios para aclarar esta discusión.
Como factor limitante de este trabajo tenemos el corto seguimiento (30 meses) de una cohorte reducida de 40 pacientes (cohorte argentina del ADNI1). Sin embargo, la ausencia de datos en la región hace válidos los descriptos en este trabajo en forma de preliminar, esperando los resultados de una cohorte mayor.
ConclusionesLos biomarcadores de EA están permitiendo conocer en forma más detallada la fisiopatología de la enfermedad y probablemente va a ser la base para resolver en los próximos tiempos la terapéutica adecuada. La posibilidad de tener resultados locales en Latinoamérica permitirá sumar y comparar a lo obtenido en los países desarrollados y mejorar la caracterización de esta enfermedad en la práctica diaria.
FinanciaciónEl presente trabajo ha sido subsidiado por la fundación FLENI, Buenos Aires, Argentina.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses potencial relacionado con los contenidos de este artículo.