La craneotomía en el paciente despierto se ha generalizado y su aplicación ha evolucionado continuamente. La anestesia para este procedimiento plantea un reto singular para los anestesiólogos. Los objetivos de este artículo son revisar, bajo la perspectiva crítica del autor, la evidencia actual y la aplicación de la craneotomía en el paciente despierto, y describir brevemente los principios del manejo anestésico durante el procedimiento.
Awake craniotomy has become a common procedure and its application has been continually evolving. Anesthesia for awake craniotomy poses a unique challenge to anesthesiologists. The aims of this article are to review, under a critical perspective of the author, the current evidence and application of awake craniotomy and to briefly describe the principles of anesthetic management during this procedure.
La craneotomía en el paciente despierto plantea un reto singular para los anestesiólogos, y el éxito del procedimiento depende en gran medida de una selección cuidadosa del paciente y de la experiencia del equipo quirúrgico y de anestesia. La era moderna de las craneotomías con el paciente despierto comenzó hace más de 50 años, cuando Penfield y Andre Pasquet comenzaron a realizar este procedimiento para extirpar focos de epilepsia1. Históricamente, la anestesia para la craneotomía en el paciente despierto fue siempre un procedimiento de alto riesgo, realizado únicamente cuando estaba absolutamente indicado. Con el mejor conocimiento de la localización cerebral y la disponibilidad de nuevos agentes anestésicos, la aplicación de la craneotomía en el paciente despierto se ha ampliado y es más segura que antes. Los objetivos de este artículo son revisar la evidencia actual de la aplicación de la craneotomía en el paciente despierto y describir brevemente los principios del manejo anestésico durante este procedimiento.
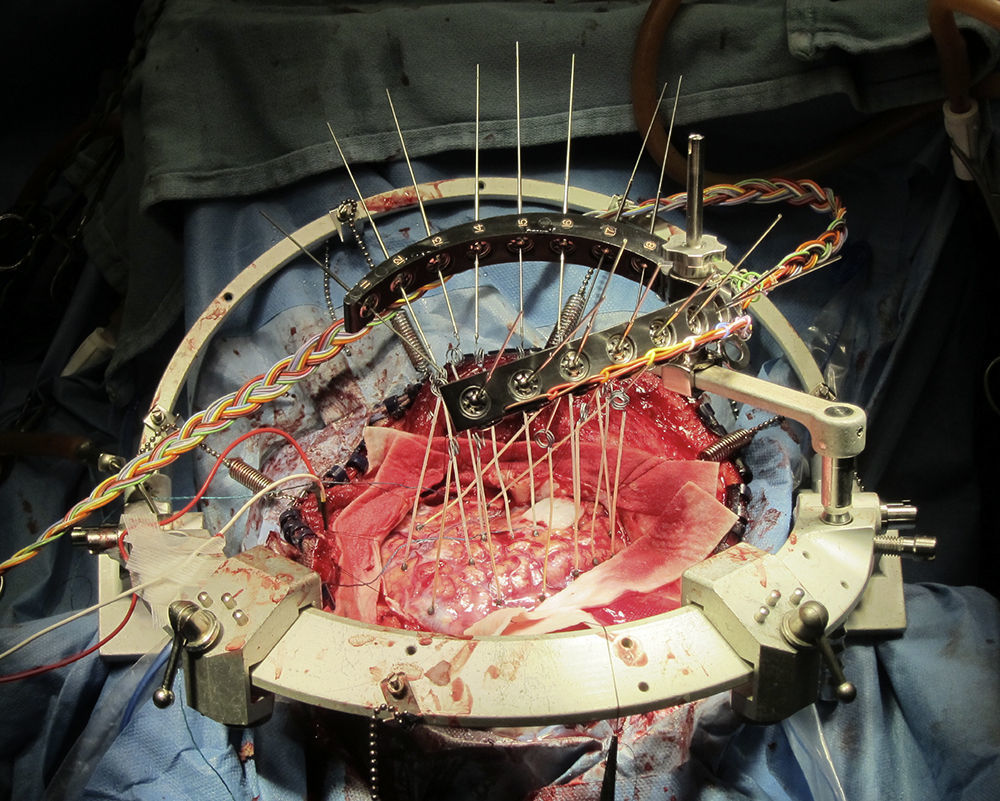
Indicaciones para la craneotomía en el paciente despiertoLas indicaciones actuales para la craneotomía en el paciente despierto se enumeran en la tabla 1. El uso de este procedimiento para extirpar quirúrgicamente los focos epilépticos con ayuda electrocorticográfica se inició con Penfield en los años 501. La electrocorticografía es una técnica electrofisiológica invasiva para registrar directamente los potenciales corticales de la superficie cerebral a fin de localizar los focos convulsivos (fig. 1). Sin embargo, los agentes anestésicos afectan considerablemente la electrocorticografía intraquirúrgica y la craneotomía en el paciente despierto está indicada para minimizar la interferencia farmacológica con los registros2. Gracias a los avances de las técnicas de imágenes prequirúrgicas se ha reducido sustancialmente la utilización de la electrocorticografía intraquirúrgica para la localización y, por consiguiente, también el uso asociado de la craneotomía en el paciente despierto para ese fin.
Indicaciones actuales para la craneotomía en el paciente despierto
| Indicación | Raciocinio | Ejemplos |
|---|---|---|
| Mapeo cortical funcional en el paciente despierto | Se requiere que el paciente esté despierto y coopere para realizar las actividades requeridas | Lesiones localizadas en estrecha proximidad del área elocuente (ej. resección de un tumor y lesionectomía) Lesiones vasculares que irrigan el área elocuente (ej. MAV y resección de aneurisma) |
| Mapeo y registro electrofisiológico | Los agentes anestésicos anulan fácilmente las señales corticales o subcorticales | Electrocorticografía intraquirúrgica Estimulación cerebral profunda |
| Mejorar los desenlaces perioperatorios | Propósitos no funcionales encaminados a lograr un alta más temprana, estancias más cortas y menos admisiones en la Unidad de Cuidados Intensivos | Biopsia cerebral estereotáctica, ventriculostomía y resección de pequeñas lesiones del cerebro |
Fuente: autor.
En la actualidad, la craneotomía en el paciente despierto está indicada en procedimientos que requieren la realización de un mapa cortical funcional en el cual se localiza la lesión en proximidad a los tejidos corticales elocuentes indispensables para unas funciones corticales definidas. Se ha logrado hacer con éxito mapas de la corteza motora, sensorial, visual y del lenguaje durante la craneotomía en el paciente despierto3,4. Estos mapas permiten realizar una resección adaptada para preservar la función del paciente. Un ejemplo típico de esta categoría es la resección de un glioma en el área motora o de Broca (tabla 2).
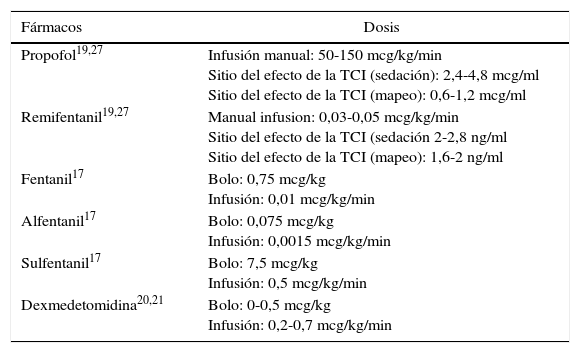
Agentes anestésicos y dosis comúnmente utilizados para la craneotomía en el paciente despierto
| Fármacos | Dosis |
|---|---|
| Propofol19,27 | Infusión manual: 50-150 mcg/kg/min Sitio del efecto de la TCI (sedación): 2,4-4,8 mcg/ml Sitio del efecto de la TCI (mapeo): 0,6-1,2 mcg/ml |
| Remifentanil19,27 | Manual infusion: 0,03-0,05 mcg/kg/min Sitio del efecto de la TCI (sedación 2-2,8 ng/ml Sitio del efecto de la TCI (mapeo): 1,6-2 ng/ml |
| Fentanil17 | Bolo: 0,75 mcg/kg Infusión: 0,01 mcg/kg/min |
| Alfentanil17 | Bolo: 0,075 mcg/kg Infusión: 0,0015 mcg/kg/min |
| Sulfentanil17 | Bolo: 7,5 mcg/kg Infusión: 0,5 mcg/kg/min |
| Dexmedetomidina20,21 | Bolo: 0-0,5 mcg/kg Infusión: 0,2-0,7 mcg/kg/min |
Fuente: autor.
Con la disponibilidad del propofol y de opioides de acción ultracorta que permiten un control anestésico rápido y suave se ha establecido una amplia gama de aplicaciones de la craneotomía en el paciente despierto en procedimientos de neurocirugía, independientemente de la necesidad de un mapa cortical funcional o de unos registros electrofisiológicos. Durante los años 90 se preconizó el uso de la craneotomía en el paciente despierto para procedimientos ambulatorios5. La indicación de la craneotomía en el paciente despierto se ha ampliado para incorporar no solamente procedimientos que requieren un mapa funcional sino también métodos encaminados a mejorar los resultados perioperatorios y minimizar la utilización de recursos, entre ellos la biopsia cerebral estereotáctica, la ventriculostomía y la resección de lesiones pequeñas del cerebro5,6. En algunas instituciones, la craneotomía en el paciente despierto se ha utilizado de rutina y de manera no selectiva en la mayoría de los pacientes en quienes es preciso extirpar un tumor supratentorial7.
Evidencia actual para la craneotomía en el paciente despiertoEl beneficio mayor de la craneotomía en el paciente despierto es que permite adaptar la resección para maximizar, en teoría, el tamaño de la resección y minimizar el daño neurológico. La evidencia actual sobre la que se apoya el procedimiento se basa principalmente en estudios de cohortes prospectivas y revisiones retrospectivas de historias clínicas8. Uno de los estudios grandes de una cohorte de la población en el cual se incluyeron 575 pacientes comparó la tasa de resección macroscópica total y los déficits neurológicos postquirúrgicos entre pacientes despiertos y pacientes con anestesia general sometidos a craneotomía9. La craneotomía en el paciente despierto se asoció con una tasa más elevada de resección total macroscópica en el área elocuente (37 vs. 14%, p<0,05), menos déficits neurológicos permanentes (4,6 vs. 16%, p<0,001) y menos déficits neurológicos postquirúrgicos de nueva aparición (3,3 vs. 58% de los pacientes, p<0,001). Sin embargo, otros estudios no fueron coherentes en demostrar estos beneficios, en particular en lo referente a la prevención de los déficits neurológicos8. Es interesante señalar que el único estudio aleatorizado controlado sobre el tema reveló que la anestesia general se tradujo en déficits neurológicos menos significativos y menos frecuentes10.
La evidencia que sustenta el beneficio de la craneotomía en el paciente despierto en cuanto a la estancia hospitalaria más corta es más constante, y casi todos los estudios previos han demostrado permanencias hospitalarias más cortas en los pacientes sometidos a este procedimiento. Entre los beneficios adicionales se cuentan una permanencia más corta en la UCI, una permanencia total más corta, menor utilización de recursos y una elevada satisfacción de los pacientes7,8.
Manejo perioperatorioPreparación prequirúrgicaLa cuidadosa selección de los pacientes es uno de los determinantes primordiales del éxito de la craneotomía en el paciente despierto. La selección debe ser individualizada y basarse en la valoración de la vía aérea, los riesgos de que falle la sedación, la cooperación del paciente y los riesgos de complicaciones intraquirúrgicas como la hemorragia. Una historia de consumo excesivo de alcohol o drogas, trastornos de dolor crónico, poca tolerancia al dolor y la ansiedad o los trastornos psiquiátricos son factores de riesgo conocidos para la falla de la sedación11. La selección de los pacientes que presentan convulsiones o disfasia mixta, con historia de uso de múltiples anticonvulsivantes o sometidos a una carga perioperatoria de fenitoína se asocia con ausencia de cooperación transoperatoria y craneotomía fallida12. Los pacientes maduros y bien motivados son los mejores candidatos para la craneotomía en el paciente despierto. Recientemente se realizó también un estudio piloto en el cual se utilizaron pruebas psicológicas y psicofisiológicas objetivas para seleccionar a los pacientes13. Aunque hay informes sobre el uso seguro de la craneotomía en el paciente despierto en Pediatría, la selección de los casos debe ser más rigurosa y se debe basar en la madurez del paciente y la evaluación individual del riesgo frente al beneficio14.
La preparación psicológica previa y construir una relación con el paciente son componentes importantes de la preparación prequirúrgica. En la conversación previa al procedimiento se debe incluir una descripción objetiva de todo el procedimiento, los malestares esperados, el nivel de cooperación deseado, las actividades a realizar y la posibilidad de eventos adversos. Una consulta prequirúrgica bien realizada por lo general sirve para aliviar la ansiedad del paciente y lograr una mayor cooperación durante la craneotomía.
Manejo intraquirúrgicoLa craneotomía en el paciente despierto plantea tres dificultades para el anestesiólogo: a) proveer una transición rápida y suave de la profundidad de la anestesia en respuesta a las distintas etapas de la cirugía; b) mantener una función cerebral, hemodinámica y cardiopulmonar estable; y c) manejar las crisis en un paciente despierto con el cráneo abierto. La necesidad con respecto a la profundidad de la anestesia varía sustancialmente durante las distintas etapas de la cirugía. El exceso de sedación puede provocar apnea, hipoxemia, hipercapnia y edema cerebral, mientras que la sedación subóptima puede traducirse en agitación, hipertensión arterial y taquicardia. Las metas anestésicas comunes a todos los pacientes neurológicos, como evitar la hipoxemia y la hipercapnia, mantener una presión de perfusión cerebral adecuada y la relajación cerebral, podrían no lograrse fácilmente en los casos de craneotomía en el paciente despierto si no hay control de la vía aérea.
Por lo general se puede lograr una anestesia adecuada ya sea mediante un bloqueo de cuero cabelludo o un bloqueo regional del campo. Comúnmente se utiliza una línea arterial, pero por lo general no se requiere ningún otro tipo de monitorización invasivo como un acceso venoso central. Es imprescindible una posición cómoda para el paciente porque después de fijar la cabeza puede haber una limitación extrema del movimiento. La colocación de los campos debe permitir siempre acceso fácil al rostro y a la vía aérea del paciente. Se puede utilizar un micrófono para facilitar la comunicación.
Selección de las técnicas anestésicasLas distintas instituciones y los distintos anestesiólogos tienen sus técnicas preferidas para la craneotomía en el paciente despierto, entre ellas la anestesia local, la sedación consciente, las técnicas de dormido-despierto-dormido y dormido-despierto. Ninguna de ellas ha demostrado ser superior. En las técnicas con el paciente dormido-despierto-dormido, el paciente está bajo anestesia general, con máscara laríngea o intubación endotraqueal durante el posicionamiento, la fijación de la cabeza y la craneotomía. La anestesia general se suspende durante el período de la realización del mapa cortical funcional y la electrocorticografía. Después de realizada la resección completa, al paciente se le da nuevamente anestesia general para el cierre de la piel15. En la técnica con el paciente dormido-despierto, el paciente se mantiene despierto durante el resto del procedimiento, con la flexibilidad de permitir mapeo adicional en caso de presentarse sintomatología16. A manera de contraste, para la sedación consciente al paciente se lo mantiene con respiración espontánea durante todo el procedimiento, y los sedantes y los analgésicos se titulan con base en las etapas de la cirugía.
Selección de los agentes anestésicosLa selección de los agentes anestésicos para la craneotomía en el paciente despierto depende en gran medida de la necesidad de realizar un mapa cortical funcional y una electrocorticografía intraquirúrgica. Los diferentes anestésicos afectan sustancialmente los trazados de la electrocorticografía intraquirúrgica, y los agentes elegidos deben tener los menores efectos posibles sobre la supresión o la hiperactivación. Se ha recomendado interrumpir del todo los agentes anestésicos durante 20 o 30 minutos antes de la electrocorticografía; sin embargo, quizás no sea factible aplicar esta recomendación en todos los casos de craneotomía en el paciente despierto y la anestesia general puede de hecho ser necesaria en algunos pacientes. El examen detallado de los efectos de los anestésicos sobre la electrocorticografía va más allá del alcance de este artículo, y los lectores pueden remitirse a otros artículos sobre el tema4.
La meta anestésica para el mapeo cortical es mantener al paciente despierto y cooperando con las actividades requeridas. El propósito del procedimiento de mapeo es identificar con confiabilidad las áreas corticales y las vías subcorticales que participan en las funciones motrices, sensoriales, cognitivas y de lenguaje. Un mapa inexacto podría crear una falsa sensación de seguridad y llevar a una resección con márgenes incorrectos. La observación de la reacción del paciente a la estimulación transcortical se usa para definir la función del área de prueba. El movimiento clónico refleja la estimulación del área motora primaria, mientras que el movimiento tónico se relaciona más con el área premotora. Para el mapa de las funciones cognitivas y del lenguaje, es crucial que el paciente esté totalmente despierto y pueda responder a actividades como nombrar las cosas y hacer ejercicios mentales como pensar en cosas dentro de una determinada categoría. La inhibición inducida del habla, el lenguaje y la cognición se debe poder diferenciar de la incapacidad para obedecer, el exceso de sedación y las convulsiones focales2. Durante el mapeo, el paciente puede sentir molestia y ansiedad al experimentar movimientos involuntarios o la inhibición del lenguaje o de los movimientos voluntarios. El nivel de la anestesia debe lograr un equilibrio entre la comodidad del paciente y la exactitud del resultado del mapeo.
En la tabla 3 aparecen los agentes y las dosis utilizados más comúnmente. La infusión de propofol con un opioide suplementario es la opción más comúnmente reportada para la craneotomía en el paciente despierto. Se ha descrito que la anestesia solamente con propofol y el paciente respirando espontáneamente es segura17. Es común la práctica de adicionar un opioide para mejorar la calidad analgésica y reducir la necesidad de un hipnótico. En una comparación entre diferentes tipos de opiodes como fentanil, alfentanil, o sulfentanil, no se encontró diferencia significativa con respecto a la condición operatoria, la electrocorticografía o las pruebas de estimulación18. En una comparación entre infusión continua de remifentanil y la administración intermitente de fentanil, los resultados con los dos narcóticos fueron semejantes en términos de satisfacción del paciente, recordación y complicaciones intraquirúrgicas, aunque fue menor el número de pacientes que experimentaron depresión respiratoria reversible con el uso de remifentanil19. Por consiguiente, se considera que todos los narcóticos son igualmente buenos para utilizarse durante la craneotomía en el paciente despierto. Cabe señalar que el tiempo para salir de la sedación con remifentanil-propofol durante las pruebas intraquirúrgicas es de aproximadamente 9 minutos20.
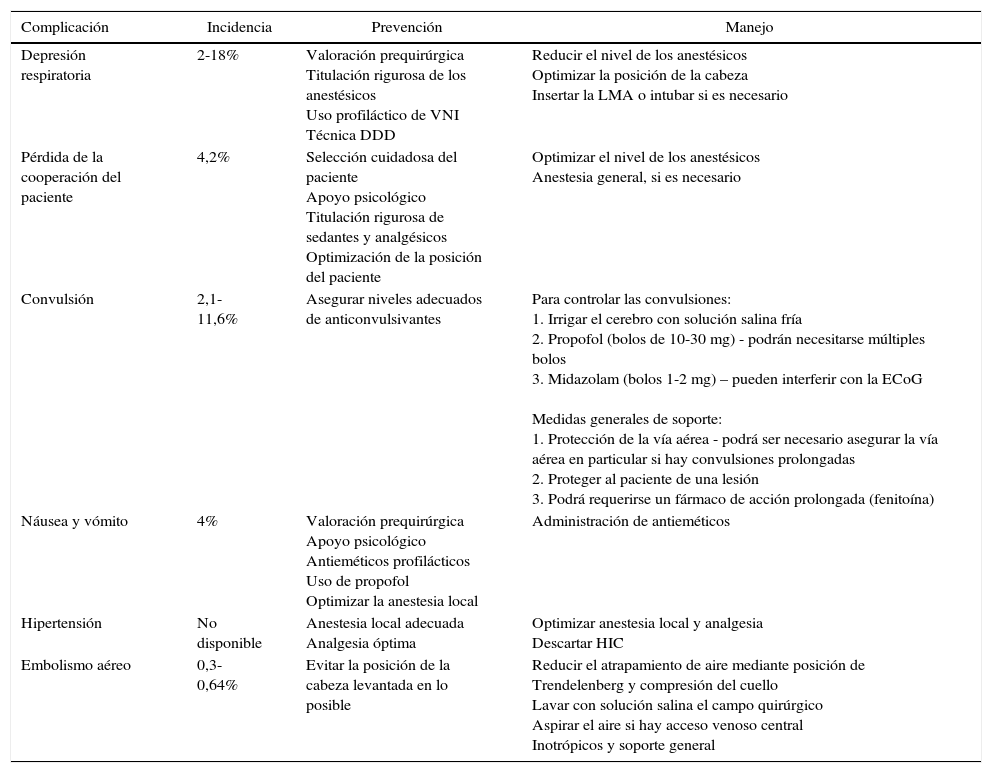
Complicaciones intraquirúrgicas de la craneotomía en el paciente despierto
| Complicación | Incidencia | Prevención | Manejo |
|---|---|---|---|
| Depresión respiratoria | 2-18% | Valoración prequirúrgica Titulación rigurosa de los anestésicos Uso profiláctico de VNI Técnica DDD | Reducir el nivel de los anestésicos Optimizar la posición de la cabeza Insertar la LMA o intubar si es necesario |
| Pérdida de la cooperación del paciente | 4,2% | Selección cuidadosa del paciente Apoyo psicológico Titulación rigurosa de sedantes y analgésicos Optimización de la posición del paciente | Optimizar el nivel de los anestésicos Anestesia general, si es necesario |
| Convulsión | 2,1-11,6% | Asegurar niveles adecuados de anticonvulsivantes | Para controlar las convulsiones: 1. Irrigar el cerebro con solución salina fría 2. Propofol (bolos de 10-30 mg) - podrán necesitarse múltiples bolos 3. Midazolam (bolos 1-2 mg) – pueden interferir con la ECoG Medidas generales de soporte: 1. Protección de la vía aérea - podrá ser necesario asegurar la vía aérea en particular si hay convulsiones prolongadas 2. Proteger al paciente de una lesión 3. Podrá requerirse un fármaco de acción prolongada (fenitoína) |
| Náusea y vómito | 4% | Valoración prequirúrgica Apoyo psicológico Antieméticos profilácticos Uso de propofol Optimizar la anestesia local | Administración de antieméticos |
| Hipertensión | No disponible | Anestesia local adecuada Analgesia óptima | Optimizar anestesia local y analgesia Descartar HIC |
| Embolismo aéreo | 0,3-0,64% | Evitar la posición de la cabeza levantada en lo posible | Reducir el atrapamiento de aire mediante posición de Trendelenberg y compresión del cuello Lavar con solución salina el campo quirúrgico Aspirar el aire si hay acceso venoso central Inotrópicos y soporte general |
La dexmedetomidina, un agonista α2, ha adquirido popularidad para la craneotomía con el paciente despierto debido a sus propiedades analgésicas, a sus menores efectos desinhibitorios, y a sus efectos mínimos sobre la depresión respiratoria. Hay una tendencia creciente a utilizar la combinación de propofol con dexmedetomidina para minimizar la desinhibición y asegurar un despertar rápido. También se ha demostrado que la dexmedetomidina tiene efectos mínimos sobre la electrocorticografía, y se ha utilizado exitosamente en la craneotomía en el paciente despierto llevado a cirugía para epilepsia21,22. Sin embargo, ha habido informes en el sentido de que se necesita un mayor esfuerzo para despertar al paciente cuando se utiliza sedación con dexmedetomidina (por medio de un estímulo físico como friccionar el esternón y llamar al paciente por su nombre). Sin embargo, una vez despierto y atento, el paciente puede seguir cooperando con las pruebas cognitivas23. Todavía está por evaluarse una comparación directa entre la dexmedetomidina y la combinación de propofol-remifentanil, en particular para la realización del mapa cortical con el paciente despierto.
Complicaciones y realización segura de la craneotomía en el paciente despiertoEntre las complicaciones intraquirúrgicas más serias se cuentan las convulsiones, la depresión respiratoria, el embolismo aéreo, el edema cerebral y el reflejo trigeminocardíaco. En la tabla 3 aparecen las complicaciones comunes, las medidas preventivas y las técnicas de manejo. La tasa total de complicaciones reportada es de cerca del 16,5%5, y en un 6,4% de los pacientes no es posible completar el procedimiento de mapeo12. Las causas principales de falla son la aparición de convulsiones y la pérdida de la cooperación del paciente a causa de somnolencia severa, agitación o el desarrollo de disfasia mixta. Las craneotomías fallidas se asocian con una menor incidencia de resecciones macroscópicas totales, mayor deterioro del habla después del procedimiento, y una permanencia hospitalaria más prolongada12.
Considerando que las complicaciones intraquirúrgicas no son poco comunes, es crucial tomar determinadas medidas preventivas y monitorizar a fin de realizar una craneotomía segura. Además de todos los monitores de rutina, la monitorización de la respiración a nivel clínico y mediante el CO2 al final de la espiración es obligatorio para todos los pacientes. Optimizar la posición del paciente y el acceso es esencial para poder controlar fácilmente la vía aérea, manejar las emergencias y comunicarse con el paciente durante el procedimiento de mapeo. Se debe preparar el equipo de intubación como la máscara laríngea, el tubo endotraqueal, el laringoscopio y los medicamentos para uso en caso de emergencia. También debe haber fácil acceso a la fibrobronscopía dentro del complejo de las salas de cirugía. Es sabido que la convulsión intraquirúrgica es una complicación durante la craneotomía en el paciente despierto. La mayoría de las convulsiones intraquirúrgicas son focales, relacionadas con la estimulación cortical, y por lo general se resuelven espontáneamente una vez cesa la estimulación. Sin embargo, en algunos casos podría ser necesario que el cirujano aplique solución salina helada a la superficie del cerebro y que se administren dosis pequeñas de anticonvulsivantes (ej. 1mg/kg de propofol)4.
Protocolos de craneotomía en el paciente despiertoEn Toronto, la craneotomía en el paciente despierto se ha realizado de manera ambulatoria y se ha estudiado extensamente desde principios de los años 90. La tasa inicial de alta de los pacientes el mismo día de un procedimiento exitoso fue del 89,1%24, y en los datos de dos estudios de cohorte de la misma institución, dicha tasa se mantuvo en 92,4 y 94%, respectivamente25,26. El protocolo de la institución hace énfasis en la necesidad de seleccionar rigurosamente a los pacientes, utilizar técnicas anestésicas y quirúrgicas mínimamente invasivas y realizar procedimientos estrictos para dar de alta al paciente. A todos los pacientes se los monitoriza al menos durante 6 horas después de la cirugía y se les realiza una tomografía antes de dárseles de alta. Adicionalmente, tanto el cirujano como el anestesiólogo hacen su valoración individual a fin de determinar si el paciente está listo para el alta. También se hace seguimiento domiciliario a cargo de enfermería, y a los pacientes se les educa sobre los signos de alerta asociados con complicaciones graves tales como la hemorragia intracraneana.
ConclusionesLa aplicación de la craneotomía en el paciente despierto ha venido evolucionando continuamente. La clave del éxito de este procedimiento está en prestar atención a cada uno de los componentes, como son la selección cuidadosa del paciente, la preparación psicológica previa, la construcción de una relación sólida, garantizar la posición cómoda del paciente, una anestesia regional óptima, la selección correcta de los agentes y de la técnica anestésica, la preparación y el manejo oportuno de las crisis, y la comunicación constante entre los miembros del equipo. Un perfecto control de la anestesia y la realización meticulosa de los procedimientos de mapeo son esenciales para lograr la mayor precisión con los resultados de la localización cerebral. Por último, puesto que es común que se presenten complicaciones durante la craneotomía en el paciente despierto, la comunicación y un equipo integrado por cirujanos y anestesiólogos expertos son importantes para maximizar la utilidad y la seguridad de este procedimiento27–40.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.