Describir tasas de remisión completa de pacientes con leucemia aguda refractaria o en recaída tratados con el esquema IDA-FLAG y establecer la supervivencia global y libre de evento, toxicidad y duración de la remisión completa en servicios rutinarios.
MétodosEstudio retrospectivo de pacientes mayores de 15 años. Se describen variables discretas y continuas mediante frecuencias y medidas de tendencia central. La supervivencia global y libre de evento se determinó por el método de Kaplan-Meir usando la prueba de log-Rank para la comparación entre estratos.
ResultadosFueron incluidos 64 pacientes. No hubo diferencias significativas en las tasas de remisión respecto al sexo, la edad, el tipo de leucemia o la duración de la primera remisión. La toxicidad fue principalmente hematológica y el 100% de los pacientes presentaron neutropenia febril posterior al inicio del tratamiento. La mediana de supervivencia global fue de 5,83 meses y la supervivencia libre de evento fue de 79 días. Se encontraron diferencias significativas en la supervivencia global entre el grupo de pacientes que logró y no logró remisión completa.
ConclusionesEl tratamiento de rescate con el régimen IDA FLAG logra inducir remisión completa en un porcentaje significativo de pacientes con leucemia aguda en recaída, con una toxicidad aceptable siendo la principal hematológica. Es necesario realizar estudios prospectivos y con un diseño adecuado para validar la efectividad del mismo y confirmar nuestros hallazgos.
To describe complete remission rates in patients with refractory or relapsed acute leukemia following the IDA-FLAG scheme, and establish the overall and event free survival, toxicity and duration of the complete remission.
MethodsRetrospective analysis of patients over 15 years old. Discrete and continuous variables are described by using frequencies and measures of central tendency. Overall and event free survival were determined with the Kaplan-Meier method using the log-Rank test for comparison among categories.
ResultsA total of 64 patients were included. There were no significant differences in the remission rate as regards sex, type of leukemia, or duration of the first remission. The toxicity was mainly hematological, and 100% of the patients had subsequent febrile neutropenia at the start of the treatment. The median overall survival was 5.83 months, and the event free survival was 79 days. Significant differences were found in the overall survival between the patient group that achieved complete remission and those that did not.
ConclusionsRescue treatment with the IDA-FLAG scheme managed to induce a complete remission in a significant percentage of patients with relapsed acute leukemia, with an acceptable toxicity, which was mainly hematological. Prospective studies are needed with a design suitable for validating its efficacy and to confirm our results.
El tratamiento con quimioterapia convencional es altamente efectivo para inducir en remisión a los pacientes con leucemia aguda. Las tasas de remisión completa (RC) con los esquemas actuales de tratamiento en pacientes con leucemia linfoblástica aguda (LLA), varían entre el 60% y el 90%1 y un esquema de inducción basado en la combinación de citarabina más un antracíclico ha mostrado tasas de respuesta entre el 50% y el 80% en pacientes con leucemia mieloide aguda (LMA), con diferencias en función de características como la edad, la citogenética y las alteraciones moleculares de la clona tumoral2.
Aún con estas altas tasas de remisión, la supervivencia global (SG) y libre de enfermedad (SLE) a largo plazo siguen siendo insatisfactorias en ambas condiciones. A 5 años, solamente el 30% a 35% de los pacientes con LLA y 40% a 50% de los pacientes con LMA se encontrarán libres de enfermedad y en primera remisión completa habiendo recaído la proporción restante2,3.
Las opciones de tratamiento al momento de la recaída son limitadas y en pacientes jóvenes y con una adecuada función orgánica la quimioterapia de rescate seguida de un trasplante alogénico es la opción que ofrece mejores resultados en términos de supervivencia global y libre de enfermedad y se considera el tratamiento estándar. Aún con la disponibilidad cada vez mayor de centros de trasplante, los resultados en pacientes que han recaído luego de una primera remisión completa siguen considerándose insatisfactorios y algunos estudios han mostrado que la supervivencia a 5 años de pacientes con LLA en recaída son menores al 10%4,5. Las variables que se relacionan con un peor pronóstico luego de la recaída son la falla en lograr una segunda remisión completa y utilizar el trasplante como estrategia de consolidación.
Los esquemas de rescate utilizan combinaciones de fármacos con el objetivo de lograr una nueva remisión. En pacientes con recaídas tardías mayores a 12 meses, la utilización del mismo esquema de tratamiento inicial ha sido exitosa en cerca de la mitad de los casos5. La selección del esquema de rescate es influenciada por diferentes factores, dentro de los cuales se encuentran: la edad, la duración de la primera remisión, y la posibilidad o no de consolidar la respuesta con trasplante alogénico.
No existen ensayos clínicos aleatorizados que comparen diferentes esquemas de rescate en pacientes con LLA o LMA y que permitan definir cuál es superior, pero una aproximación racional al problema de la adquisición de resistencia en la clona tumoral es la utilización de combinaciones de fármacos y modificaciones en la secuencia de administración que incrementen la citotoxicidad. Una de las estrategias de tratamiento que sigue esa aproximación es la combinación del análogo de las purinas fludarabina con citarabina6,7.
La citarabina (1-B-D-arabinofuranosilcitosina) (ara-C) se encuentra dentro de los agentes más efectivos tanto en la quimioterapia de inducción como en el tratamiento de rescate de los pacientes con leucemias agudas. Una vez transportado al interior de la célula, el ara-C debe ser convertido en su forma activa ara-CTP por la acción secuencial de tres enzimas de las cuales la deoxicitidin monofosfato kinasa es la enzima limitante. Inicialmente el ara-C es convertido en ara-C 5¿monofosfato y subsecuentemente en ara-C-5¿-trifosfato que es la forma activa (ara-CTP)8,9 y la cual puede ser incorporada en el DNA durante la fase S del ciclo celular. El porcentaje de incorporación al DNA determina la citotoxicidad y es producto de la concentración de ara-CTP. Asimismo, se ha establecido la existencia de una correlación entre la farmacocinética intracelular del ara-CTP y la respuesta al tratamiento10,11.
Una estrategia que incrementa la concentración intracelular de ara-CTP es el pre-tratamiento con el análogo nucleósido de las purinas fludarabina. La fludarabina es transportada y fosforilada a su forma activa fludarabina-5¿- trifosfato (F-ara-ATP) por la misma vía que la citarabina y estimula la producción de ara-CTP por un efecto directo en la deoxicitidina kinasa y uno indirecto en la ribonucleótido reductasa. Adicionalmente, el tratamiento con factor estimulante de colonias de granulocitos (CSF-G), incrementa las concentraciones de F-ara-ATP y la administración de los fármacos en secuencia (CSF-G – Fludarabina – Citarabina), potencia la citotoxicidad de la citarabina.
Se ha descrito que el pre-tratamiento con CSF-G incrementa el porcentaje de células en fase S del ciclo celular, lo que las hace más susceptibles a la inducción de apoptosis por medicamentos citotóxicos que actúen en dicha fase12. Esta evidencia experimental trascendió en el diseño de un esquema de tratamiento que se fundamenta en estos principios farmacológicos (FLAG) y que adiciona en la mayoría de los casos un antracíclico (IDA-FLAG).
Basados en los resultados de diferentes series publicadas que trataron pacientes con LLA y LMA, con este y otros esquemas, y en consideración de las tasas de respuesta y la toxicidad, el régimen IDA-FLAG fue implementado como estrategia de rescate en ambos grupos de pacientes en nuestro centro desde 200913–17.
El objetivo principal de este estudio retrospectivo es describir las tasas de remisión completa con el régimen IDA-FLAG en pacientes con LLA o LMA refractaria o en recaída y de forma secundaria, para establecer la supervivencia global y libre de evento, la toxicidad del tratamiento y la mediana de duración de la remisión completa.
Materiales y métodosEste estudio retrospectivo de tipo serie de expuestos, incluyó todos los pacientes adultos mayores de 15 años tratados con el esquema IDA-FLAG en el Instituto Nacional de Cancerología de Colombia, entre el 01 de abril de 2009 y el 30 de abril de 2012.
Se revisaron los registros físicos y digitales de muestras recibidas y analizadas en el laboratorio de patología (morfología y citometría de flujo) y los registros internos del servicio de hematología. La búsqueda se complementó consultando el sistema electrónico de historias clínicas de la institución, en donde el diagnóstico principal se encuentra codificado de acuerdo a la versión 9 de la Clasificación Internacional de Enfermedades (CIE9).
El diagnóstico de leucemia aguda fue confirmado por la realización de un aspirado de la medula ósea que demostrará un porcentaje de blastos mayor al 20%. En todos los casos, se verificó el linaje de los mismos mediante citometría de flujo, utilizando un panel de anticuerpos monoclonales estandarizado. Asimismo, fueron incluidos todos los pacientes con diagnóstico de LLA de precursores B o T, LMA no promielocítica y leucemia mieloide crónica en crisis blástica linfoide o mieloide con enfermedad refractaria o en recaída y que recibieron tratamiento con el régimen IDA-FLAG durante el periodo de estudio.
La enfermedad refractaria fue definida para los pacientes con LLA como la falla en lograr remisión completa con el primer o segundo ciclo de tratamiento con el protocolo Hyper-CVAD18, que es el esquema estándar de primera línea para adultos en nuestra institución, y en el caso de los pacientes adultos jóvenes (entre 16 y 21 años) tratados con el protocolo FRALLE 9319 y que no lograron remisión luego de la fase de inducción.
Para los pacientes con LMA se definió la falla en lograr remisión completa luego de un curso estándar de inducción con una antracíclina combinada con citarabina en un esquema 7+3 y de haber recibido, por lo menos, un ciclo de dosis altas de citarabina (3 gramos/m2/12 horas, días 1,3 y 5)20.
Los requisitos para el inicio de tratamiento con el régimen IDA-FLAG fueron: edad mayor a 15 y menor a 61 años; estado funcional adecuado determinado por la escala del ECOG con un valor menor a 2; fracción de eyección mayor del 50% por ventriculografía isotópica; filtración glomerular mayor de 50ml/min,; creatinina menor de 2 mgs/dl; bilirrubinas menores de 2 mgs/dl; ausencia de infección por el virus de la hepatitis B, C y el virus de la inmunodeficiencia humana (VIH 1 y 2), y brindar su consentimiento informado tanto para iniciar la terapia como para recibir transfusiones. Todos los pacientes tratados fueron incluidos en el presente análisis. La evaluación de la respuesta se realizó al momento de la recuperación hematológica definida por un recuento de neutrófilos mayor a 1500/mm3 y un recuento de plaquetas mayor a 50.000/mm3 o máximo en el día 28 de tratamiento en ausencia de recuperación del hemograma.
El tratamiento consistió en una fase de inducción y una de consolidación. El protocolo de tratamiento fue modificado a partir de una publicación previa17 y consistió en una fase de inducción con: fludarabina 30 mgs/m2 por vía intravenosa (IV) en infusión de 30 minutos, administrado 4 horas antes del inicio de la citarabina, días 1 al 4; citarabina 2 gramos/m2 IV en infusión de 4 horas, iniciado 4 horas después de la administración de la fludarabina, días 1 al 4; idarrubicina 10 mgs/m2 IV en infusión de 2 horas, días 1 al 3 y filgrastim 300 mcgs subcutáneos (SC) iniciados 30 minutos antes de cada dosis de fludarabina, días 1 al 4 seguido de 300 mcgs SC cada 12 horas, desde el día 5 hasta lograr neutrófilos mayores a 1500/mm3 por dos días consecutivos o mayores a 5000/mm3 un solo día. El tratamiento fue administrado de forma intrahospitalaria por una vía central. Únicamente los pacientes que lograron remisión completa con la inducción fueron considerados para la fase de consolidación.
Los pacientes menores de 60 años y con un ECOG menor de 2 en las primeras 4 semanas posterior a la remisión fueron candidatos a consolidación con el régimen 5 x 3 consistente en citarabina 200 mgs/m2 IV en infusión de 6 horas, días 1 al 5; idarrubicina 10 mgs/m2 IV en infusión de 2 horas, días 1 al 3 y filgrastim 300 mcgs SC desde el día 6 hasta la recuperación hematológica o filgrastim pegilado 6 mgs SC dosis única el día 6.
Los pacientes con LLA de cualquier edad que rechazaron la consolidación, presentaron toxicidad no hematológica de grado 3 o mayor o tenían un ECOG mayor de 2 al finalizar la fase de inducción. Por lo que fueron ingresados a tratamiento con vincristina 2 mgs IV día 1, prednisona 100 mgs vía oral días 1 al 5, mercaptopurina 100 mgs al día y metotrexate 25 mgs/m2/semanal por vía oral.
Los pacientes con LMA con un ECOG mayor de 2 o que rechazaron la consolidación fueron dejados en observación. En todos los pacientes que se consideraron potenciales candidatos a trasplante, se inició la búsqueda de un donante intrafamiliar idéntico al momento de la recaída o de la falla de la inducción. Sin embargo, no se consideró un criterio de selección el hecho de tener o no tener donante.
Todos los pacientes recibieron profilaxis antibiótica y antifúngica con fluconazol 200 mgs vía oral cada 12 horas; trimetropim- sulfametoxasol 160/800 mgs vía oral tres veces por semana y aciclovir 200 mgs vía oral cada 12 horas. En todos los casos los ciclos fueron administrados de manera intrahospitalaria desde el inicio del tratamiento hasta la resolución de la neutropenia y la trombocitopenia. El monitoreo de laboratorio se realizó mediante hemograma diario y pruebas de función renal, hepática, electrolitos y proteína C reactiva dos a tres veces por semana o más frecuente según el criterio clínico.
El tratamiento de los episodios de neutropenia febril se realizó siguiendo los protocolos institucionales. El soporte transfusional con plaquetas fue administrado a todos los pacientes con recuentos menores a 10.000/mm3 o con recuentos superiores en caso de síntomas hemorrágicos. El soporte transfusional con glóbulos rojos se administró a pacientes con hemoglobina inferior a 7 gramos/dl o con valores entre 7 y 8 gramos/dl a pacientes seleccionados. Todos los componentes fueron irradiados antes de su administración y filtrados antes de su almacenamiento. Una vez los pacientes fueron dados de alta se programaron citas de seguimiento en la consulta externa con una periodicidad mensual o mayor en caso necesario.
Este estudio contó con la aprobación del comité de ética en investigaciones institucional y fue conducido de acuerdo con los principios de la declaración de Helsinki y las guías de buena práctica clínica.
Análisis estadísticoLas variables nominales y ordinales se describieron mediante frecuencias absolutas y relativas, resumidas en tablas. Las variables continuas se describieron mediante la media y la desviación estándar o mediante la mediana y el rango intercuartílico dependiendo de si cumplían o no el criterio de normalidad. La comparación de proporciones de las variables categóricas se realizó mediante el estadístico exacto de Fisher y el Chi-cuadrado.
La supervivencia libre de evento se definió como el tiempo transcurrido desde el inicio del tratamiento hasta la falla en el logro de remisión completa, recaída o muerte por cualquier causa. La supervivencia global, libre de evento y la duración de la remisión completa fueron determinadas por el método de Kaplan-Meir y las comparaciones entre funciones de supervivencia por estratos, fueron realizadas usando la prueba de los rangos logarítmicos (log-Rank). Las diferencias se consideraron estadísticamente significativas si tenían un valor de p menor de 0,05. Todos los análisis fueron realizados en el software R versión 2.14.1 (2011-12-22)21.
ResultadosLas características de los pacientes se muestran en la tabla 1. Fueron incluidos 64 pacientes adultos de los cuales cuarenta fueron hombres (62.5%). La mediana de edad para todo el grupo fue de 25.5 años (17-56, IQR 17.25), sin diferencia significativa entre hombres y mujeres (22.5 y 32 respectivamente, p=0.07). Más del 80% de los pacientes tuvieron diagnosticados con leucemia aguda de precursores linfoides o linfoma linfoblástico y de estos, cincuenta fueron de linaje B (78%).
Características de los pacientes
| Variable | Número (%) |
| Pacientes | 64 |
| Sexo (No./%) | |
| Mujeres | 24 (37.5) |
| Hombres | 40 (62.5) |
| Edad (mediana/rango) | 25.5 años (17–56) |
| Mujeres | 32 años (17–56) |
| Hombres | 22.5 años (17–49) |
| Diagnóstico primario (No./%) | |
| LLA precursores B | 50 (78) |
| LLA precursores T | 1 (1.5) |
| LMA no promielocítica | 9 (14) |
| Linfoma linfoblástico B | 1 (1.5) |
| LMC en crisis blástica | 3 (4.6) |
| Estado (No./%) | |
| Recaído | 51 (80) |
| Refractario | 13 (20) |
| Duración primera remisión (No./%) | |
| Menos de 12 meses | 38 (75) |
| Más de 12 meses | 13 (25) |
| Índice de masa corporal (No./%) | |
| Total | 21.3 |
| Hombres | 21.4 (17.2–27.12) |
| Mujeres | 21.08 (17.0–31.2) |
| Tratamiento inicial (No./%) | |
| LLA (B o T) | |
| Hyper-CVAD | 36 (57) |
| FRALLE 93 | 6 (9.5) |
| GMALL 04/89 | 8 (12) |
| Hyper-CVAD+ITK | 2 (3) |
| LMA | |
| 7 x 3 - HIDAC | 9 (14) |
| LMC en crisis blástica | |
| Hyper-CVAD+ITK | 1 (1.5) |
| ITK solo | 2 (3) |
El conjunto de los pacientes con LLA de precursores B y T o linfoma linfoblástico constituyó más del 80% de la población.
Tres pacientes tenían diagnóstico de leucemia mieloide crónica en crisis blástica y en todos los casos el linaje de los blastos era linfoide. Todos los pacientes con LMA incluidos correspondían a subtipos diferentes a M3 de acuerdo a la clasificación FAB.
Para efectos del análisis los pacientes fueron agrupados como LLA (incluyendo todos los casos de LLA B o T y linfoma linfoblástico) y LMA. Los pacientes con crisis blástica recibieron tratamiento adicional con un inhibidor de tirosina kinasa (dasatinib o nilotinib) y fueron analizados de manera independiente para los datos de respuesta al tratamiento.
De acuerdo a los protocolos de nuestro centro y al predominio de pacientes con LLA en nuestra cohorte, la mayoría de los pacientes (57%) recibió tratamiento inicial con el esquema Hyper-CVAD. Los seis pacientes adultos jóvenes que recibieron tratamiento inicial con el esquema FRALLE-93 tuvieron una mediana de edad de 18 años (17-22 IQR: 2.25). Un paciente recibió tratamiento inicial en otro centro sin respuesta y se mantuvo con quimioterapia oral por cerca de dos años, siendo remitido a nuestro centro para rescate una vez se obtuvo un donante.
Todos los pacientes con LMA habían recibido tratamiento con un esquema 7 x 3 seguido de dosis altas de citarabina. De los nueve pacientes con LMA incluidos, siete (78%) habían tenido respuesta inicial y recaído y dos habían sido refractarios al tratamiento. Del total de pacientes incluidos, 51 (80%) se encontraban en la primera recaída luego de haber logrado remisión completa y el resto se consideró refractario. Todos los pacientes fueron incluidos en el análisis.
La mediana de tiempo desde la falla del tratamiento inicial hasta el inicio de la quimioterapia IDA-FLAG fue de 6.5 días (0-617, IQR 28). Un paciente en el que el tiempo de inicio del tratamiento, desde el momento de la recaída, fue de 617 días, fue identificado como un valor atípico por la prueba de Grubbs (Paquete outliers versión 0.13-2, CRAN Project).
En total, 37 pacientes (58%) lograron remisión completa y 27 (42%) fueron refractarios. Solamente uno de los tres pacientes con crisis blástica logró remisión completa con el tratamiento y continuó recibiendo un inhibidor de tirosina quinasa por vía oral hasta el último seguimiento.
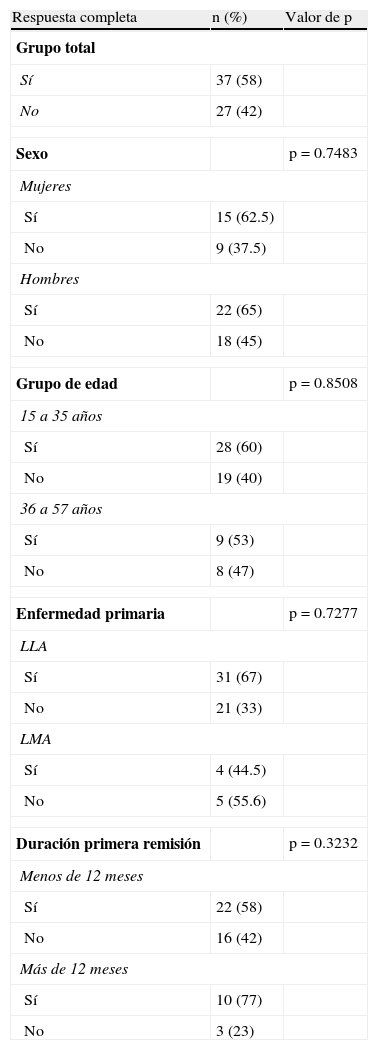
No se encontraron diferencias significativas en las tasas de remisión en relación con el sexo, la edad (mayores o menores de 35 años), el tipo de leucemia (LLA vs LMA) o la duración de la primera remisión. Estos resultados, se resumen en la tabla 2.
Remisión completa
| Respuesta completa | n (%) | Valor de p |
| Grupo total | ||
| Sí | 37 (58) | |
| No | 27 (42) | |
| Sexo | p=0.7483 | |
| Mujeres | ||
| Sí | 15 (62.5) | |
| No | 9 (37.5) | |
| Hombres | ||
| Sí | 22 (65) | |
| No | 18 (45) | |
| Grupo de edad | p=0.8508 | |
| 15 a 35 años | ||
| Sí | 28 (60) | |
| No | 19 (40) | |
| 36 a 57 años | ||
| Sí | 9 (53) | |
| No | 8 (47) | |
| Enfermedad primaria | p=0.7277 | |
| LLA | ||
| Sí | 31 (67) | |
| No | 21 (33) | |
| LMA | ||
| Sí | 4 (44.5) | |
| No | 5 (55.6) | |
| Duración primera remisión | p=0.3232 | |
| Menos de 12 meses | ||
| Sí | 22 (58) | |
| No | 16 (42) | |
| Más de 12 meses | ||
| Sí | 10 (77) | |
| No | 3 (23) | |
Los valores de p fueron obtenidos por la prueba del Ji-cuadrado o el estadístico exacto de Fisher de acuerdo a las frecuencias esperadas por categoría para cada variable. En ninguno de los casos se encontraron valores estadísticamente significativos. La categoría LLA incluye un paciente con Linfoma linfoblástico B que no logró remisión completa y un paciente incluido con LLA de precursores T que logró remisión completa. De los tres pacientes con LMC en crisis blástica linfoide incluidos, solamente uno logró remisión completa y no fueron incluidos en el análisis por enfermedad primaria, pero sí en el del grupo total.
Todos los pacientes fueron incluidos en el análisis de toxicidad. En total, treinta pacientes (47%), presentaban neutropenia febril antes de iniciar tratamiento con el régimen IDA-FLAG y todos los pacientes restantes desarrollaron neutropenia febril posterior al inicio del tratamiento para una incidencia del 100%. La mediana de tiempo al desarrollo de neutropenia febril desde el inicio del tratamiento fue de 2.5 días (0-14 IQR: 5). El episodio de neutropenia febril fue catalogado como: infección con foco clínico en el 31% de los pacientes; fiebre de origen desconocido en 33%, y bacteremia aislada en la proporción restante.
Del total, 45 pacientes (70%) requirieron adición de tratamiento anti-fúngico durante la inducción por persistencia de la fiebre o hallazgos clínicos o radiológicos sugestivos de enfermedad fúngica invasiva. Dos pacientes (3.1%) desarrollaron fungemia durante la inducción. En ambos casos, la inducción de remisión fue fallida y los pacientes murieron a los 35 y 98 días de iniciado el tratamiento.
De 64 pacientes incluidos, 14 (21.8%), no tuvieron recuperación de los neutrófilos. Ninguno de estos pacientes cumplió criterios de remisión completa. La mediana de tiempo a recuperación de los neutrófilos en los 50 pacientes restantes fue de 20 días (7-45 IQR: 6.75).
Veintinueve pacientes (45%) no cumplieron el criterio de recuperación de plaquetas de este estudio. Diez de estos pacientes fueron considerados en remisión completa por el grupo médico tratante de los cuales cinco recayeron durante el periodo de seguimiento. La mediana de tiempo a recuperación de las plaquetas en los 35 pacientes restantes fue de 23 días (11-53 IQR: 12).
Seis pacientes (9.4%) requirieron tratamiento en la Unidad de Cuidado Intensivo, de los cuales cinco requirieron soporte vasopresor e inotrópico y cuatro soporte ventilatorio.
Dos pacientes (3.1%) murieron en aplasia antes de lograr la recuperación hematológica. Los dos casos fueron considerados como muertes asociadas al tratamiento de inducción y contados como eventos durante el análisis.
De los 37 pacientes que lograron remisión completa, 15 (40.5%) fueron llevados a consolidación. La mediana de tiempo desde el logro de la remisión completa hasta el inicio de la consolidación fue de 27 días (1-95 IQR 26.5). Las causas registradas para la no consolidación en los 22 pacientes restantes fueron: decisión médica en 8 (36.6%), toxicidad severa en la inducción en dos (9.1%) y no se pudo establecer en 12 (54.5%). Catorce pacientes (93.3%) presentaron neutropenia febril durante la consolidación y cuatro (26.6%) requirieron adición de un agente antifúngico por persistencia de la fiebre o hallazgos clínicos o radiológicos sugestivos de enfermedad fúngica invasiva. Un paciente (6.6%) murió en remisión completa durante la consolidación por aplasia prolongada y complicaciones infecciosas asociadas.
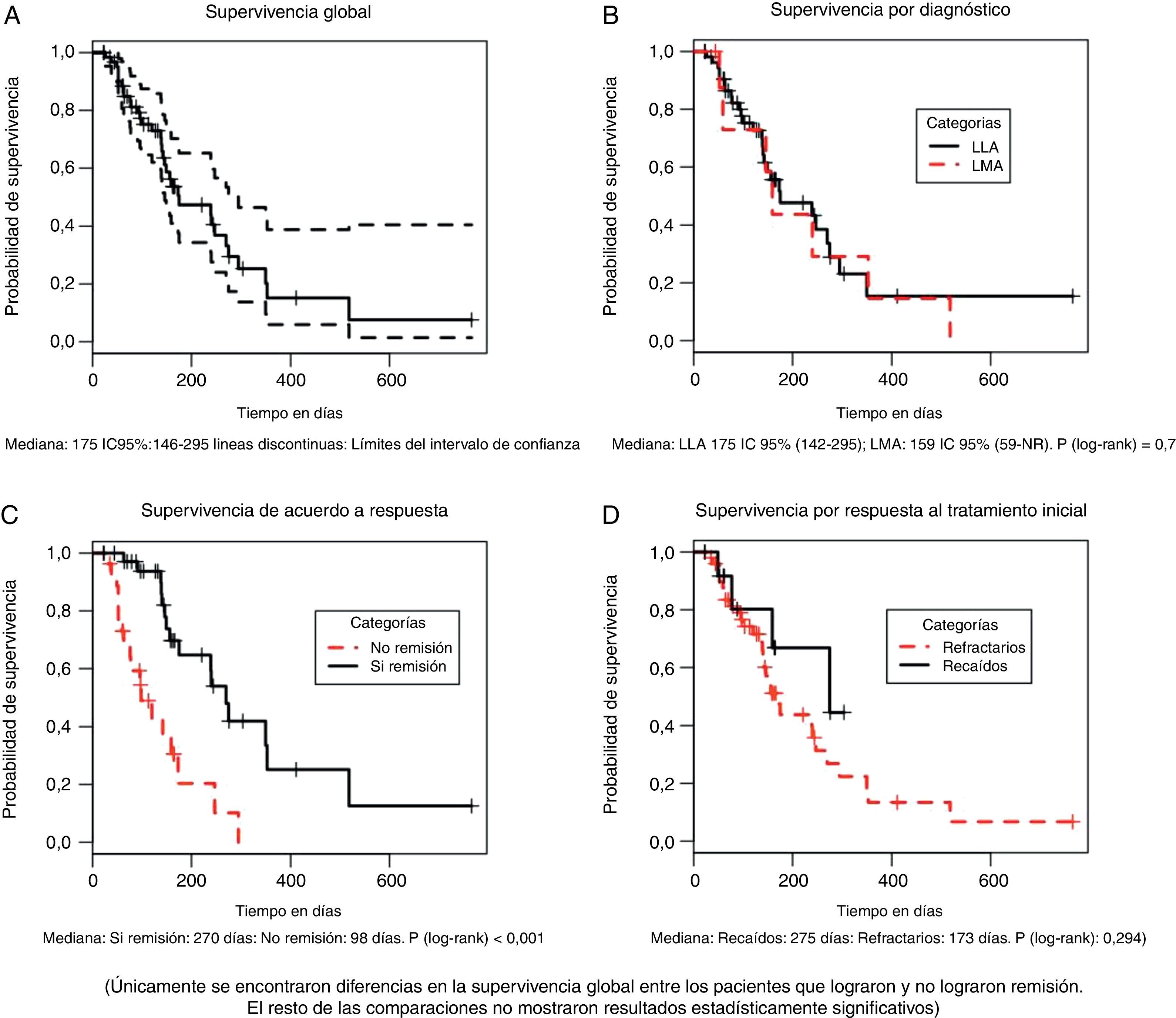
La mediana de supervivencia para el grupo total, medida desde el inicio de la quimioterapia IDA FLAG hasta la muerte por cualquier causa fue de 5.83 meses (175 días. IC 95%: 146-295) (fig. 1A), sin diferencias significativas entre el grupo de pacientes con LLA y LMA (175 y 159 días respectivamente; p (log-Rank)=0.78) (fig. 1B), ni entre pacientes recaídos o refractarios al tratamiento inicial (173 y 275 días respectivamente [p (log-Rank)=0.294] (fig. 1D).
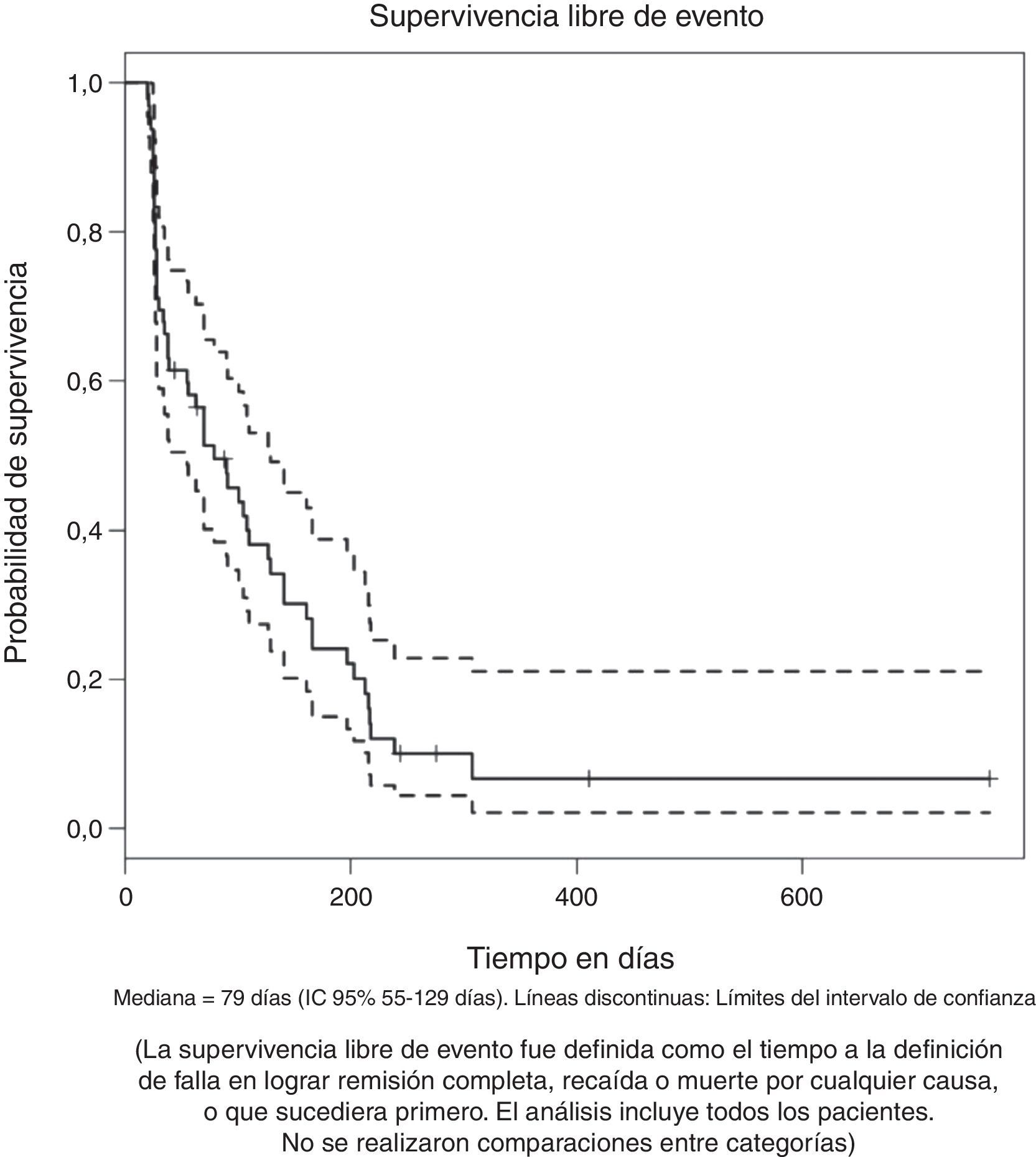
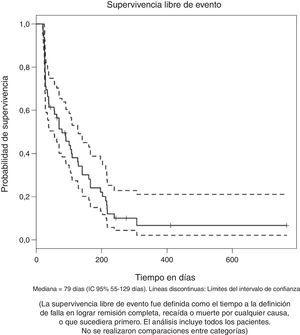
La mediana de supervivencia entre aquellos que lograron y no lograron remisión completa fue de 270 y 98 días respectivamente con una diferencia estadísticamente significativa [p (log-Rank)=<0.001] (fig. 1C). La supervivencia libre de evento para el grupo total, medida desde el inicio del tratamiento hasta la falla en lograr remisión completa, recaída o muerte por cualquier causa, fue de 79 días (IC 95% 55 a 129), como se muestra en la figura 2.
La mediana de duración de la remisión completa para los 37 pacientes que lograron la misma, fue de 93 días. Sin embargo, en dieciséis casos (43%) se produjo pérdida del seguimiento. En los veintiún pacientes (56.7%) en los que no hubo pérdida de seguimiento, la mediana de duración de la remisión completa fue de 104 días (33-741 IQR:105). Diez pacientes que fueron considerados en remisión completa por el grupo médico tratante, no cumplieron el criterio de recuperación de plaquetas mayor a 100.000/mm3 al momento de la valoración. La mediana de edad de este grupo fue de 23.5 años y nueve pacientes (90%) cursaban con LLA de precursores B y un paciente con LMA no promielocítica. La mediana de duración de la remisión en este grupo fue de 97 días (4-392 IQR: 122)
Al momento del cierre de este estudio, siete pacientes estaban vivos, seis de ellos con diagnóstico de LLA de precursores B y un paciente con LMC en crisis blástica. Únicamente un paciente con LLA de este grupo no logró remisión completa con el esquema IDA-FLAG y requirió un segundo esquema de rescate con el que logró remisión y fue llevado a trasplante alógenico de un donante intrafamiliar idéntico. El paciente con LMC en crisis blástica recibe tratamiento con dasatinib 70 mgs vía oral dos veces al día y se mantiene en remisión hematológica hasta la fecha del último seguimiento.
DiscusiónEl tratamiento de rescate de las leucemias agudas refractarías o en recaída, sigue siendo en la mayoría de los casos insatisfactorio. En los pacientes con LMA los esquemas de rescate que incluyen dosis intermedias o altas de citarabina sola o combinada con otros medicamentos, han mostrado resultados que varían en función de características propias de la enfermedad como la citogenética y características propias de los pacientes como la edad, el estado funcional y la duración de la primera remisión3. Para los pacientes con LLA la información es aún más escasa y la mayoría de los estudios dejan a decisión del médico la selección del esquema de tratamiento de rescate que puede ser similar al inicial o adicionar nuevos componentes. Nuestros resultados se comparan favorablemente con estudios con otros esquemas de tratamiento y con los publicados por otros grupos con el régimen IDA-FLAG.
El tratamiento con el esquema Hyper-CVAD ha sido utilizado como estrategia de rescate en pacientes con LLA con mejores resultados comparado con una cohorte histórica de pacientes rescatados con esquemas que incluían altas dosis de citarabina. Sin embargo, las tasas de respuesta fueron de tan solo el 44% y la toxicidad significativa22. Esta opción no es factible en nuestro centro ya que la mayoría de los pacientes recibe este esquema como primera línea de tratamiento.
Una aproximación diferente fue publicada por el grupo GIMEMA en un estudio fase II que incluyó 135 pacientes mayores de 15 años con enfermedad recaída o refractaría, utilizando un esquema con dosis altas de citarabina más idarrubicina seguido de hasta dos líneas adicionales de rescate si no se lograba remisión con el ciclo inicial. La respuesta completa en este grupo de pacientes fue de 55% con una toxicidad hematológica significativa y una mediana de tiempo a la recuperación de los conteos de neutrófilos y de plaquetas de cerca de 27 días13, la cual es superior en una semana a la de nuestro estudio.
Más del 80% de nuestros pacientes tenían LLA y la tasa de respuesta completa de 67% en este grupo es superior a la informada con otros esquemas de tratamiento. El menor número de pacientes con LMA incluidos limita la comparación de los datos con otras series, pero continua siendo satisfactoria.
Un estudio realizado por Specchia et al.23 y que incluyó 23 pacientes con LLA recaídos o refractarios tratados con el esquema IDA FLAG mostró resultados inferiores a nuestro esquema en términos de respuesta completa (39%). Este estudio utilizó una dosis total de fludarabina y citarabina más alta que la reportada por nosotros, administrando el tratamiento durante cinco días en vez de cuatro. Llamativamente la toxicidad hematológica fue muy similar a la de nuestro grupo. En el estudio de Specchia ningún paciente con enfermedad refractaria logró respuesta completa a diferencia de nuestro estudio, en el cual cinco de trece pacientes la lograron. Es posible que la menor mediana de edad de nuestros pacientes, la mayor proporción de pacientes con enfermedad refractaria que lograron respuesta y otras características biológicas expliquen las diferencias.
Además de este estudio, el régimen IDA-FLAG ha sido reportado por otros como estrategia de rescate, y los resultados de los principales estudios publicados son similares en términos de toxicidad, existiendo diferencias en la dosis total de los medicamentos y en la estrategia luego de la segunda remisión16,17,24.
Una de las modificaciones al esquema de tratamiento que realizamos en nuestro estudio, fue la administración del filgrastim en un periodo de tiempo más corto antes de la primera dosis de fludarabina. Esta modificación no parece afectar a las tasas de respuesta ni a la toxicidad.
El tratamiento con mejores resultados, en términos de supervivencia global y libre de recaída, luego de lograr segunda remisión completa en pacientes con LLA o LMA con condiciones clínicas aceptables es el trasplante alogénico25. La duración de la remisión de 104 días resalta la necesidad de agilizar la identificación de donantes para poder así ofrecer de forma rápida el mismo, luego de lograda la remisión. La no disponibilidad para el momento de inclusión de los pacientes de un programa de trasplante de donantes no relacionados en el país, sumado con limitaciones derivadas del aseguramiento, derivaron en que solamente 2 pacientes fueron llevados a trasplante alogénico. En ambos casos fueron donantes intrafamiliares idénticos y de los cuales uno estaba vivo al momento del cierre de este estudio. Una mediana de supervivencia de cerca de 6 meses para el grupo total el cual en su mayoría fue tratado solamente con quimioterapia es significativa y se aproxima a lo presentado por otras series.
Las debilidades de nuestro estudio son: su naturaleza retrospectiva; la inclusión de un número limitado de casos con LMA, y la pérdida del seguimiento de algunos pacientes. De igual forma, siendo la citogenética una variable pronóstica independiente, el no tener la información de los datos de citogenética al diagnóstico y la recaída, estas falencias podrían dificultar su comparación con otros estudios. Sin embargo, el tratamiento de todos los casos con un esquema estricto y unificado así como la atención estandarizada de las complicaciones y la valoración homogénea de la respuesta, se constituyen en fortalezas del mismo.
En conclusión, el tratamiento de rescate con el régimen IDA FLAG logra inducir remisión completa en un porcentaje significativo de pacientes con leucemia aguda en recaída, con una toxicidad aceptable siendo la principal hematológica. Es necesario realizar estudios prospectivos y con un diseño adecuado para validar la efectividad del mismo y confirmar nuestros hallazgos.
Este estudio es, en nuestro conocimiento, el que incluye mayor número de pacientes con LLA publicado en texto completo a la fecha y muestra que la mediana de supervivencia puede prolongarse con la administración de este esquema y que en los pacientes que logran remisión completa llega a ser hasta de 9 meses aún sin trasplante. La corta duración de la remisión, resalta la necesidad de consolidar de forma temprana la respuesta con trasplante alogénico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.