El concepto de «riesgo en salud» es relativamente nuevo, surge en el lenguaje epidemiológico británico en los inicios del sigloxx y es definido por la OMS como la probabilidad de un resultado sanitario adverso, o la presencia de un factor que aumenta esa probabilidad. La gestión del riesgo se define, a su vez, como el proceso de identificar, analizar y cuantificar las probabilidades de pérdidas y efectos secundarios que se desprenden de los actos en salud, así como de las acciones preventivas, correctivas y reductivas correspondientes que deben emprenderse. La gestión del riesgo es un proceso gerencial estructurado que tiene por objetivo identificar los principales riesgos en salud de la población o del individuo. Los riesgos identificados son intervenidos mediante estrategias coordinadas que buscan disminuir su ocurrencia.
El Ministerio de Salud Colombiano define «medicamentos biológicos» como aquellos medicamentos derivados de organismos o células vivas o sus partes. Se pueden obtener de fuentes tales como tejidos o células, componentes de la sangre humana o animal (como antitoxinas y otro tipo de anticuerpos, citoquinas, factores de crecimiento, hormonas y factores de coagulación), virus, microorganismos y productos derivados de ellos como las toxinas. Estos productos son obtenidos con métodos que comprenden (pero no se limitan a cultivo de células de origen humano o animal, cultivo y propagación de microorganismos y virus) procesamiento a partir de tejidos o fluidos biológicos humanos o animales, transgénesis, técnicas de ácido desoxirribonucleico (ADN) recombinante y técnicas de hibridoma. Los medicamentos que resultan de estos 2 últimos métodos se denominan biotecnológicos.
Partiendo del mecanismo de acción de estos medicamentos se esperaba el potencial riesgo del desarrollo de enfermedades infecciosas. Con su uso, otros efectos secundarios se han podido identificar. Es por esta razón que es imperativo para todo profesional que prescriba terapia biológica conocer los potenciales riesgos de su uso y cómo evitarlos o disminuirlos. Con este documento, la Asociación Colombiana de Reumatología (Asoreuma) propone unificar criterios de prescriptores y prestadores en cuanto a la gestión del riesgo en el uso de la terapia biológica.
La selección adecuada del paciente, el asesoramiento y la educación a pacientes, cuidadores y personal de la salud son medidas necesarias para el uso exitoso de esta terapia inmunosupresora. Una historia clínica detallada que permita detectar las contraindicaciones de esta terapia y el desarrollo de guías de seguimiento con su respectiva implementación son pasos importantes para disminuir el riesgo inherente a la administración de los agentes biológicos1.
El objetivo de estas recomendaciones es proporcionar herramientas a los reumatólogos y otros especialistas con el fin de hacer una adecuada gestión del riesgo derivado de la prescripción de la terapia biológica inmunosupresora durante el tratamiento de las diferentes patologías autoinmunes e inflamatorias.
MetodologíaSe creó un grupo de expertos miembros de Asoreuma con invitación a médicos especialistas en cardiología, infectología y neumología, quienes realizaron un trabajo presencial y virtual en grupos. En una primera reunión se generaron las preguntas de investigación que iban a desarrollarse en la guía, y ello con el apoyo de metodólogos expertos en medicina basada en la evidencia y desarrollo de guías de atención.
Una vez definidos los grupos de trabajo y las preguntas de investigación, se desarrolló la estrategia de búsqueda por parte del Centro de Evaluación de Tecnologías de la Universidad CES; la búsqueda contó con la asesoría de Asoreuma.
Se realizó una búsqueda sistemática en Pubmed, Cochrane Library Plus, EBSCO, HINARI, IMBIOMED, LILACS, MEDLINE, OVID, Taylor & Francis, para cada pregunta clínica de la guía con las palabras clave MeSH (Medical Subject Headings) y DeCS (Descriptores en Ciencias de la Salud). Se incluyeron estudios epidemiológicos experimentales y observacionales, sin restricciones en cuanto a fecha de publicación; como límite de idioma solo se evaluaron artículos publicados en inglés o en español. La fecha de finalización de la búsqueda fue junio de 2013.
Los resultados de la búsqueda fueron enviados a los equipos de trabajo de Asoreuma, quienes realizaron 2 reuniones del grupo nominal de consenso, moderadas por el metodólogo del CES. En la primera reunión se evaluó la calidad de la información (calidad de la evidencia) y se decidieron los temas más controvertidos y de mayor interés para el consenso. Los estudios clínicos identificados por los especialistas de las diferentes áreas fueron enviados al Centro de Evaluación de Tecnologías de la Universidad CES para evaluar la calidad de forma independiente.
En las reuniones siguientes se resolvieron dudas sobre la calidad de la evidencia (acuerdo entre los revisores para la selección de los estudios), se dio respuesta a las preguntas clínicas y se estableció el grado de las recomendaciones. La revisión del texto completo del artículo y la extracción de los datos fueron realizadas por los grupos de trabajo establecidos previamente.
La calidad de la evidencia para estudios observacionales fue evaluada mediante la declaración de la iniciativa Strengthening the Reporting of Observational studies in Epidemiology (STROBE), los ensayos clínicos se evaluaron con la escala de Jadad y los metaanálisis mediante la declaración Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA).
Los ensayos clínicos con una calificación menor de 3 en la escala de Jadad no fueron tenidos en cuenta, así como los artículos que no informaran adecuadamente sobre la metodología y los resultados de acuerdo con el STROBE y la declaración PRISMA.
Los niveles de evidencia (NE) y grados de recomendaciones (GR) se expresan de acuerdo con el modelo de la Agency for Healthcare Research and Quality (tabla 1).
Modelo de la Agency for Healthcare Research and Quality
| Grados de recomendación |
| A Existe buena evidencia con base en la investigación para apoyar la recomendación |
| vB Existe moderada evidencia con base en la investigación para apoyar la recomendación |
| C La recomendación se basa en la opinión de expertos o en un panel de consenso |
| X Existe evidencia de riesgo para esta intervención |
| Clasificación de las recomendaciones en función de la evidencia disponible |
| Ia La evidencia científica procede a partir de metaanálisis, ensayos clínicos controlados y aleatorizados |
| Ib La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV La evidencia científica procede de documentos u opiniones de expertos o experiencias clínicas de autoridades de prestigio |
| A Recoge los niveles de evidencia científica Ia y Ib |
| B Recoge los niveles de evidencia científica IIa, IIb, III |
| C Recoge el nivel de evidencia IV |
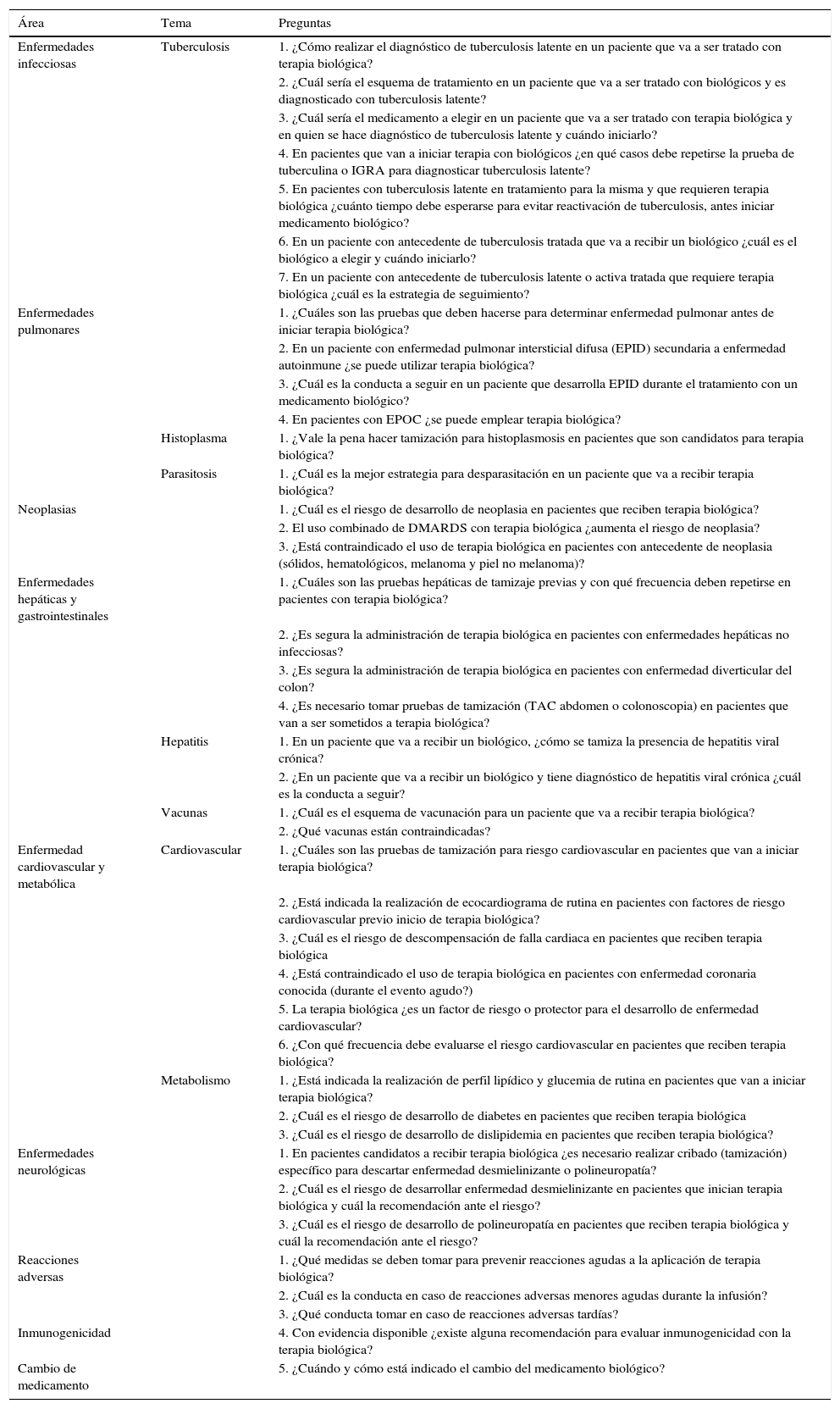
La tabla 2 enumera los temas y preguntas establecidos que fueron posteriormente desarrollados por los expertos.
Preguntas del consenso de expertos
| Área | Tema | Preguntas |
|---|---|---|
| Enfermedades infecciosas | Tuberculosis | 1. ¿Cómo realizar el diagnóstico de tuberculosis latente en un paciente que va a ser tratado con terapia biológica? |
| 2. ¿Cuál sería el esquema de tratamiento en un paciente que va a ser tratado con biológicos y es diagnosticado con tuberculosis latente? | ||
| 3. ¿Cuál sería el medicamento a elegir en un paciente que va a ser tratado con terapia biológica y en quien se hace diagnóstico de tuberculosis latente y cuándo iniciarlo? | ||
| 4. En pacientes que van a iniciar terapia con biológicos ¿en qué casos debe repetirse la prueba de tuberculina o IGRA para diagnosticar tuberculosis latente? | ||
| 5. En pacientes con tuberculosis latente en tratamiento para la misma y que requieren terapia biológica ¿cuánto tiempo debe esperarse para evitar reactivación de tuberculosis, antes iniciar medicamento biológico? | ||
| 6. En un paciente con antecedente de tuberculosis tratada que va a recibir un biológico ¿cuál es el biológico a elegir y cuándo iniciarlo? | ||
| 7. En un paciente con antecedente de tuberculosis latente o activa tratada que requiere terapia biológica ¿cuál es la estrategia de seguimiento? | ||
| Enfermedades pulmonares | 1. ¿Cuáles son las pruebas que deben hacerse para determinar enfermedad pulmonar antes de iniciar terapia biológica? | |
| 2. En un paciente con enfermedad pulmonar intersticial difusa (EPID) secundaria a enfermedad autoinmune ¿se puede utilizar terapia biológica? | ||
| 3. ¿Cuál es la conducta a seguir en un paciente que desarrolla EPID durante el tratamiento con un medicamento biológico? | ||
| 4. En pacientes con EPOC ¿se puede emplear terapia biológica? | ||
| Histoplasma | 1. ¿Vale la pena hacer tamización para histoplasmosis en pacientes que son candidatos para terapia biológica? | |
| Parasitosis | 1. ¿Cuál es la mejor estrategia para desparasitación en un paciente que va a recibir terapia biológica? | |
| Neoplasias | 1. ¿Cuál es el riesgo de desarrollo de neoplasia en pacientes que reciben terapia biológica? | |
| 2. El uso combinado de DMARDS con terapia biológica ¿aumenta el riesgo de neoplasia? | ||
| 3. ¿Está contraindicado el uso de terapia biológica en pacientes con antecedente de neoplasia (sólidos, hematológicos, melanoma y piel no melanoma)? | ||
| Enfermedades hepáticas y gastrointestinales | 1. ¿Cuáles son las pruebas hepáticas de tamizaje previas y con qué frecuencia deben repetirse en pacientes con terapia biológica? | |
| 2. ¿Es segura la administración de terapia biológica en pacientes con enfermedades hepáticas no infecciosas? | ||
| 3. ¿Es segura la administración de terapia biológica en pacientes con enfermedad diverticular del colon? | ||
| 4. ¿Es necesario tomar pruebas de tamización (TAC abdomen o colonoscopia) en pacientes que van a ser sometidos a terapia biológica? | ||
| Hepatitis | 1. En un paciente que va a recibir un biológico, ¿cómo se tamiza la presencia de hepatitis viral crónica? | |
| 2. ¿En un paciente que va a recibir un biológico y tiene diagnóstico de hepatitis viral crónica ¿cuál es la conducta a seguir? | ||
| Vacunas | 1. ¿Cuál es el esquema de vacunación para un paciente que va a recibir terapia biológica? | |
| 2. ¿Qué vacunas están contraindicadas? | ||
| Enfermedad cardiovascular y metabólica | Cardiovascular | 1. ¿Cuáles son las pruebas de tamización para riesgo cardiovascular en pacientes que van a iniciar terapia biológica? |
| 2. ¿Está indicada la realización de ecocardiograma de rutina en pacientes con factores de riesgo cardiovascular previo inicio de terapia biológica? | ||
| 3. ¿Cuál es el riesgo de descompensación de falla cardiaca en pacientes que reciben terapia biológica | ||
| 4. ¿Está contraindicado el uso de terapia biológica en pacientes con enfermedad coronaria conocida (durante el evento agudo?) | ||
| 5. La terapia biológica ¿es un factor de riesgo o protector para el desarrollo de enfermedad cardiovascular? | ||
| 6. ¿Con qué frecuencia debe evaluarse el riesgo cardiovascular en pacientes que reciben terapia biológica? | ||
| Metabolismo | 1. ¿Está indicada la realización de perfil lipídico y glucemia de rutina en pacientes que van a iniciar terapia biológica? | |
| 2. ¿Cuál es el riesgo de desarrollo de diabetes en pacientes que reciben terapia biológica | ||
| 3. ¿Cuál es el riesgo de desarrollo de dislipidemia en pacientes que reciben terapia biológica? | ||
| Enfermedades neurológicas | 1. En pacientes candidatos a recibir terapia biológica ¿es necesario realizar cribado (tamización) específico para descartar enfermedad desmielinizante o polineuropatía? | |
| 2. ¿Cuál es el riesgo de desarrollar enfermedad desmielinizante en pacientes que inician terapia biológica y cuál la recomendación ante el riesgo? | ||
| 3. ¿Cuál es el riesgo de desarrollo de polineuropatía en pacientes que reciben terapia biológica y cuál la recomendación ante el riesgo? | ||
| Reacciones adversas | 1. ¿Qué medidas se deben tomar para prevenir reacciones agudas a la aplicación de terapia biológica? | |
| 2. ¿Cuál es la conducta en caso de reacciones adversas menores agudas durante la infusión? | ||
| 3. ¿Qué conducta tomar en caso de reacciones adversas tardías? | ||
| Inmunogenicidad | 4. Con evidencia disponible ¿existe alguna recomendación para evaluar inmunogenicidad con la terapia biológica? | |
| Cambio de medicamento | 5. ¿Cuándo y cómo está indicado el cambio del medicamento biológico? |
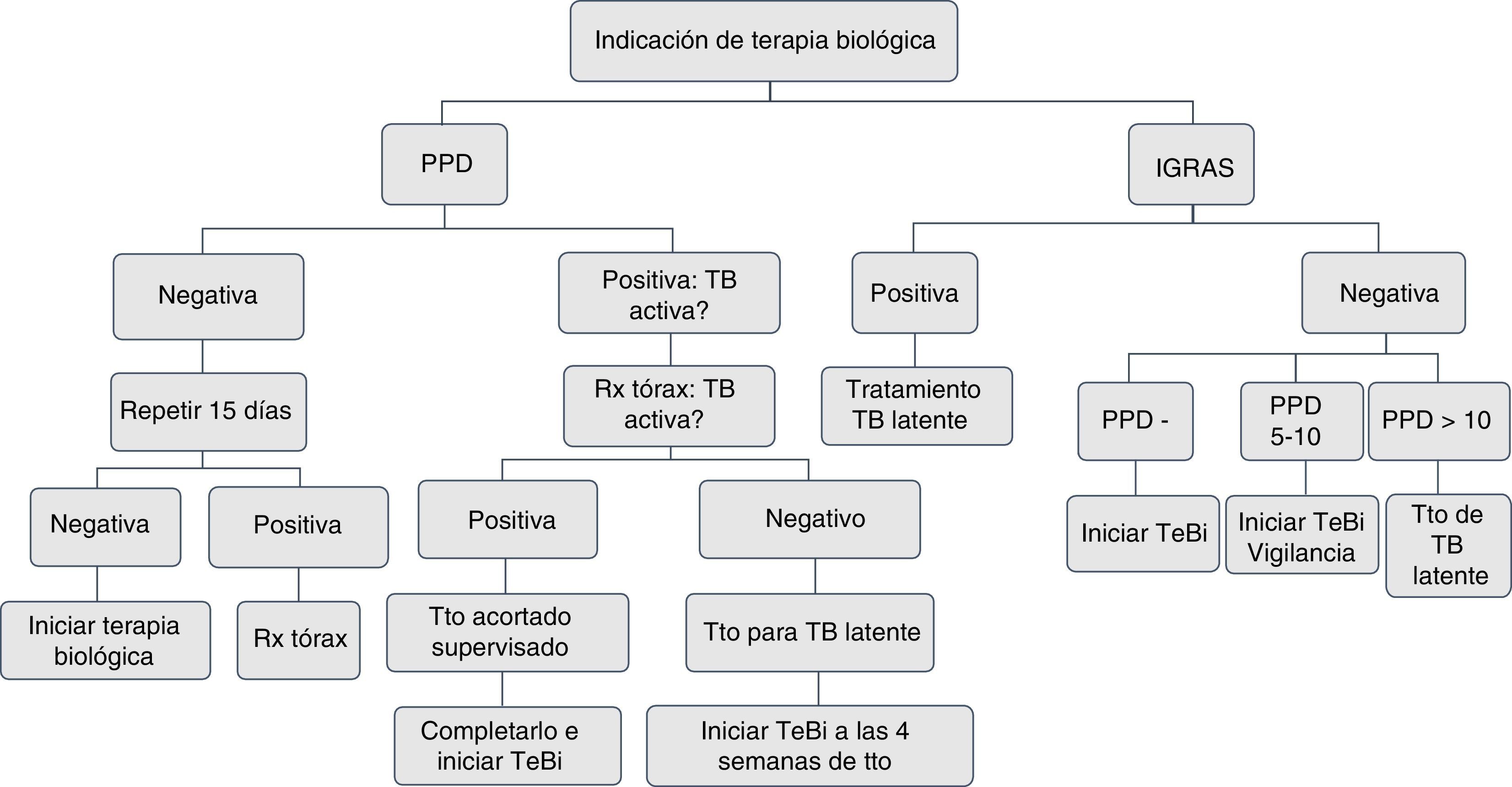
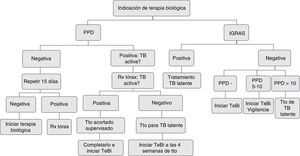
A todo paciente a quien se le prescriba terapia biológica inmunosupresora debe realizársele un cribado para tuberculosis latente con una prueba de tuberculina o interferon-γ release assays (IGRA) y una radiografía del tórax. La prueba de tuberculina (unipunción 5U) o IGRA (QuantiFERON-TB Gold In Tube o TB spot) tienen igual sensibilidad para el cribado2,3. Se considera prueba positiva la induración ≥5mm.
La prueba de tuberculina negativa TST (<5mm) se debe repetir entre 1 y 3 semanas, cuando el paciente tenga factores de riesgo para tuberculosis activa, como confinamiento en condiciones de hacinamiento, contacto con pacientes con tuberculosis activa o trabajadores de la salud3,4.
Todo paciente al inicio de la terapia biológica debe tener una placa de tórax. Si el resultado de TST es positivo, la placa se debe evaluar con el neumólogo en la búsqueda de tuberculosis activa. Se deben realizar baciloscopias de esputo para establecer la presencia de bacilos ácido-alcohol resistentes en pacientes con síntomas respiratorios activos5–7. En pacientes con tuberculina positiva, con sospecha de falso positivo por las condiciones del paciente, el sitio de la aplicación o la calidad de la lectura, se indica el uso de los IGRA7,8.
Si la historia de vacunación para BCG del paciente es menor de 3años, utilizar IGRA9,10.
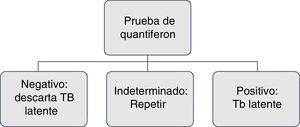
En pacientes con antecedentes de lesión hepática de origen tóxico o infeccioso, consumo de múltiples fármacos y alto riesgo de complicaciones, con el uso de isoniazida se recomiendan los IGRA por tener mayor especificidad11 (figs. 1 y 2).
En pacientes con dificultades para hacerse la tuberculina, por razones geográficas y de desplazamiento, se pueden utilizar los IGRA, dado que tienen igual sensibilidad11,12.
Se recomienda el uso de calculadora The Online TST/IGRA (http://tstin3d.com/en/calc.html)13,14 para establecer el riesgo; si este supera el 0,02% anual, se debe considerar tratamiento de tuberculosis latente.
En caso de no disponer de tuberculina ni de los IGRA, se debe descartar tuberculosis activa con placa de tórax, y si hay síntomas, con baciloscopias. Debe hacerse un seguimiento clínico y de educación al paciente, la familia y los cuidadores sobre signos y síntomas que indiquen la posibilidad de una tuberculosis activa13,15,16.
2. ¿Cuál sería el esquema de tratamiento en un paciente que va a ser tratado con biológicos y es diagnosticado con tuberculosis latente?Recomendación: NE: 1; GR: AEl grupo de trabajo consideró que una vez se realice el diagnóstico de tuberculosis latente debe iniciarse tratamiento previo al inicio de los medicamentos biológicos. Como primera línea se recomienda tratamiento con isoniazida (INH) 5mg/kg/día en dosis no mayor a 300mg/día más piridoxina 50mg/día durante 9 meses17–20.
En caso de intolerancia a INH se debe suministrar rifampicina 10mg/kg/día hasta un máximo 600mg/día, durante 4 meses19,20. Una vez se inicie el tratamiento se deben controlar las pruebas hepáticas periódicamente y direccionar al paciente al grupo de seguimiento de casos de tuberculosis20.
3. ¿Cuál sería el medicamento a elegir en un paciente que va a ser tratado con terapia biológica y en quien se hace diagnóstico de tuberculosis latente y cuándo iniciarlo?Recomendación: NE, 5; GR, D21En los pacientes con diagnóstico de tuberculosis latente se puede iniciar la terapia biológica una vez se completen las primeras 4 semanas del tratamiento indicado22,23.
No existe evidencia en contra del inicio de alguna de las terapias biológicas una vez el paciente haya completado como mínimo un mes de tratamiento para tuberculosis latente y finalizado el tratamiento acortado supervisado para tuberculosis activa21,23,24.
4. En pacientes que van a iniciar terapia con biológicos ¿en qué casos debe repetirse la prueba de tuberculina o IGRA para diagnosticar tuberculosis latente?Recomendación NE 2b; GR B16.La prueba de tuberculina inicial que resulte <5mm debe repetirse a las 3 semanas cuando el paciente tenga factores de riesgo para tuberculosis activa, como confinamiento en condiciones de hacinamiento, contacto con pacientes con tuberculosis activa, trabajadores de la salud o en estado de inmunosupresión25.
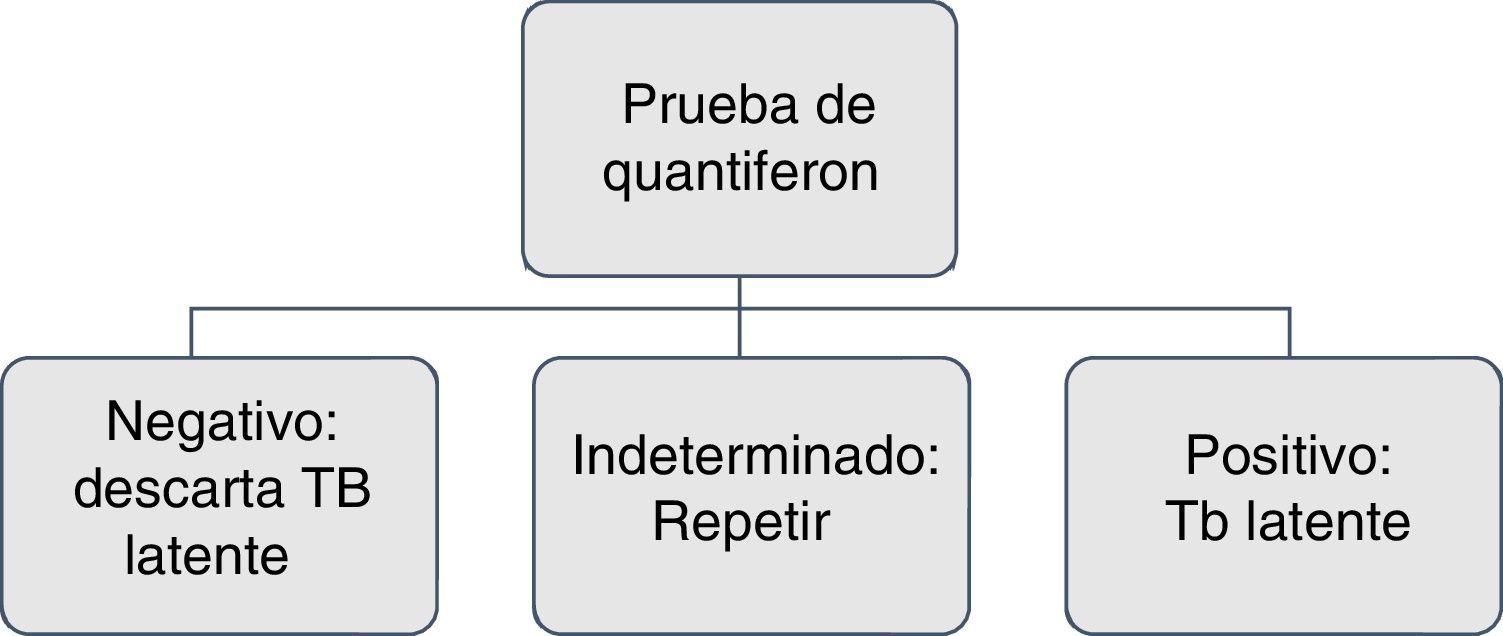
Realizar de nuevo IGRA si el paciente tiene alto grado de inmunosupresión y el resultado no es interpretable o es indeterminado17,26.
Debe repetirse la prueba de IGRA cuando el paciente tenga factores de riesgo como contacto con sujetos con tuberculosis activa, es trabajador de la salud o vive en condiciones de hacinamiento26,27.
La tuberculina o los IGRA deben repetirse anualmente en los pacientes en tratamiento con terapia biológica que tengan las pruebas basales negativas y presenten los factores de riesgo antes descritos27,28.
Si el paciente tiene historia de tratamiento para tuberculosis activa o latente completo, previo, no debe hacerse de nuevo estas pruebas27.
5. En pacientes con tuberculosis latente en tratamiento para la misma y que requieren terapia biológica ¿cuánto tiempo debe esperarse para evitar reactivación de la tuberculosis antes de iniciar medicamento biológico?Recomendación: NE, 5; GR, DEl paciente con tuberculosis latente diagnosticada antes del inicio de medicamento biológico debe recibir terapia con isoniazida a razón de 5mg/kg, máximo 300mg/día, más piridoxina 50mg/día, durante un mes como mínimo antes de iniciar terapia biológica, con plan de 9 meses de la misma28–31.
En el caso de paciente intolerante a isoniazida, la terapia debe ser con rifampicina 10mg/kg/día, hasta un máximo de 600mg/día19,20.
6. En un paciente con antecedente de tuberculosis tratada y que necesita terapia biológica ¿cuál es la molécula a elegir y cuál es el momento de iniciarla?Recomendación: NE 4; GR CEn pacientes con antecedente de tuberculosis activa o latente adecuadamente tratada se puede iniciar terapia biológica, con seguimiento clínico estricto del paciente22,32.
Los datos de los registros de vigilancia poscomercialización han mostrado un mayor riesgo de tuberculosis en pacientes que reciben anti-TNF, con un riesgo de 3 a 4 veces más alto asociado con infliximab y adalimumab que con etanercept33.
7. En un paciente con antecedente de tuberculosis latente o activa tratada que requiere terapia biológica ¿cuál es la estrategia de seguimiento?Recomendación: NE 5; GR DEn pacientes con antecedente de tuberculosis latente o activa adecuadamente tratada, que requieren terapia biológica, no es necesario hacer nuevas pruebas de tuberculina, ni profilaxis1.
El seguimiento clínico del paciente y su educación sobre síntomas de alerta para tuberculosis activa es fundamental1,3,13.
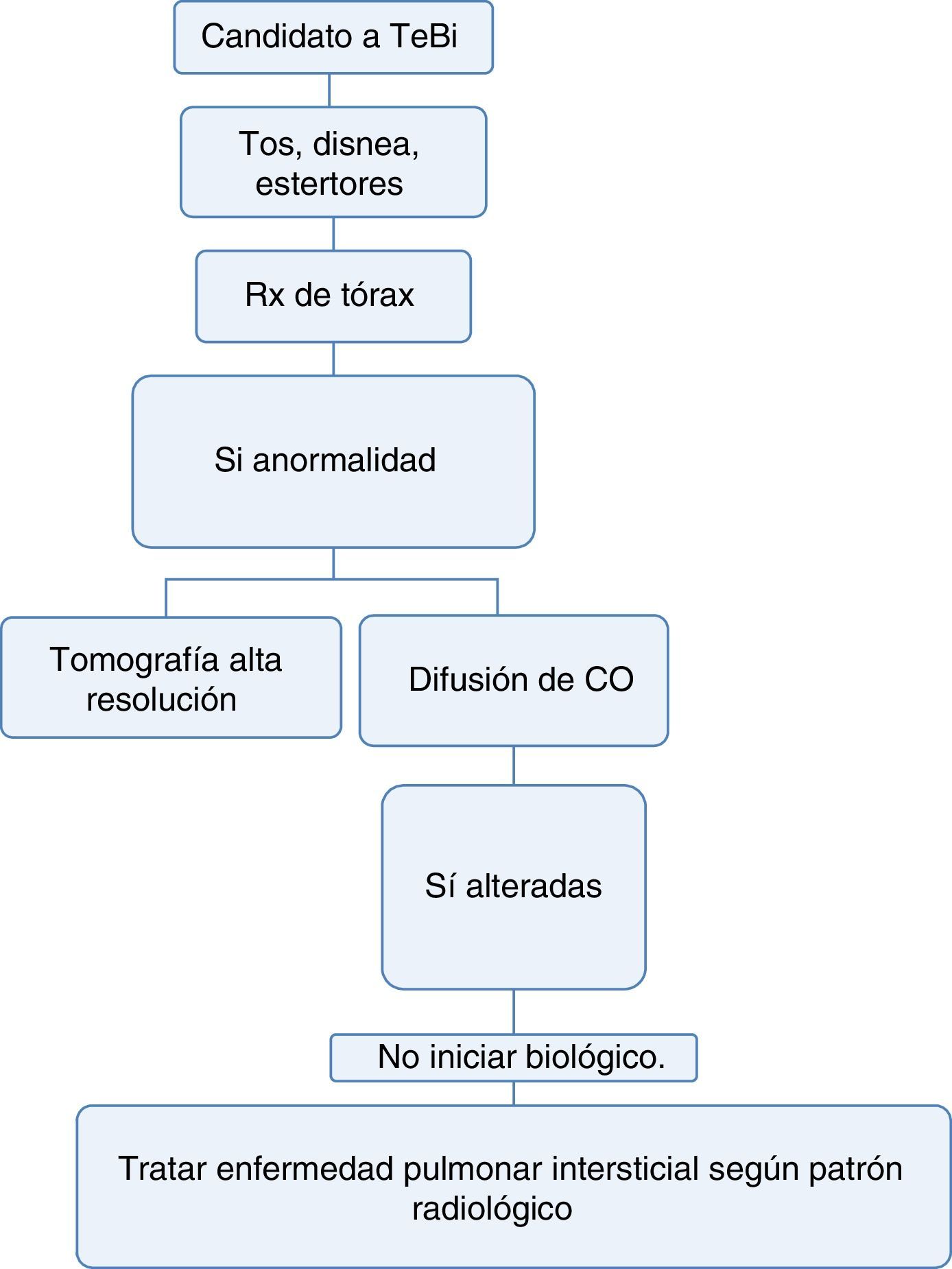
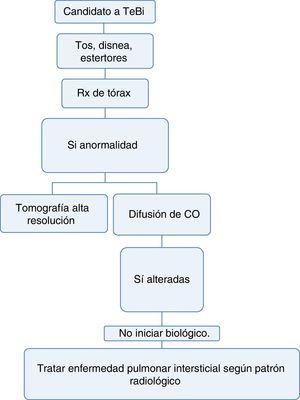
Neumología1. ¿Cuáles son las pruebas que deben hacerse para determinar enfermedad pulmonar antes de iniciar terapia biológica?Recomendación: NE: 4; GR: CTodo paciente que se considere candidato a inicio de terapia biológica debe tener:
- a)
Historia clínica completa que incluya antecedentes de exposición al humo de combustión de biomasa, tabaquismo activo o pasivo, exposición a humos tóxicos o cualquier exposición respiratoria medioambiental o laboral de riesgo para el desarrollo de enfermedad pulmonar intersticial34.
- b)
Examen físico completo enfocado a detección de tos, disnea o cualquier anormalidad a la auscultación pulmonar34,35.
- c)
Radiografía de tórax en proyecciones posteroanterior y lateral, idealmente, para poderla comparar con la radiografía hecha en el momento del diagnóstico de la enfermedad36.
- d)
Si tiene una enfermedad que puede, dentro de sus manifestaciones, generar enfermedad pulmonar intersticial difusa (EPID) o la radiografía convencional sugiere alteraciones, podría realizarse una prueba de capacidad de difusión de monóxido de carbono (DLCO) y tomografía axial computarizada del tórax de alta resolución (TACAR). Con esta última se aumenta la sensibilidad diagnóstica hasta en 60% para EPID y permite acercarse al patrón de compromiso intersticial para definir la terapia36–38 (fig. 3).
Con la información disponible en la literatura no se recomienda el uso de terapia biológica en pacientes con enfermedad pulmonar difusa, dado que estos medicamentos pueden exacerbar el compromiso pulmonar39.
Los medicamentos con mecanismo de acción de tipo anti-interleucinas han demostrado exacerbar la enfermedad pulmonar intersticial de base y también inducir esta patología en pacientes sin antecedentes previos40,41.
La mortalidad se incrementa hasta en un 35% en pacientes con enfermedad autoinmune o inflamatoria con enfermedad pulmonar intersticial asociada22,42.
La evidencia es contradictoria con abatacept y no pueden hacerse recomendaciones43.
La terapia con mecanismo de acción anti CD20, específicamente rituximab, también exacerba la enfermedad pulmonar intersticial. Se han demostrado casos de neumonía organizada hipoxémica aguda y subaguda, y neumonía organizada macronodular44,45.
3. ¿Cuál es la conducta a seguir en un paciente que desarrolla enfermedad pulmonar intersticial difusa durante el tratamiento con un medicamento biológico?Recomendación: NE: 4; GR: CEn pacientes que desarrollen enfermedad pulmonar intersticial durante el tratamiento con terapia biológica, la conducta debe ser la suspensión del medicamento y el inicio de la terapia apropiada según corresponda por gravedad46,47.
4. En pacientes con enfermedad pulmonar obstructiva crónica ¿se puede emplear terapia biológica?Recomendación: NE: 4; GR: CEn pacientes con enfermedad pulmonar obstructiva crónica (EPOC) se puede emplear terapia biológica siempre y cuando se descarte previamente infección pulmonar, incluyendo tuberculosis activa48–50.
Existen datos respecto a que abatacept podría incrementar el riesgo de infecciones pulmonares, lo cual aumentaría las exacerbaciones; sin embargo, las evidencias existentes no permiten conclusiones estadísticamente significativas51.
5. ¿Se debe realizar cribado para histoplasmosis en pacientes candidatos a terapia biológica?Recomendación: NE: 4; GR: CEn pacientes que se encuentren en áreas endémicas para Histoplasma capsulatum esta infección debe ser sospechada52,53.
Parasitosis1. ¿Cuál es la mejor estrategia para desparasitación en un paciente que va a recibir terapia biológica?Recomendación: NE: 4; GR: CPara todo paciente en quien se vaya a iniciar terapia biológica se recomienda hacer profilaxis con ivermectina a dosis de 200μg/kg/día (una gota por kilogramo) por 2 días, dosis que debe repetirse 2 semanas después54–56.
Una opción terapéutica cubierta por el Plan Obligatorio de Salud (POS) es albendazol 400mg/día, por 3 días56.
Malignidad1. ¿Cuál es el riesgo de desarrollo de neoplasias en pacientes que reciben terapia biológica?Recomendación: NE: 1; GR: ANo hay evidencia de aumento del riesgo de tumores sólidos en pacientes con terapia biológica57–59.
2. ¿Existe un mayor riesgo de carcinoma basocelular en pacientes con el uso de medicamentos anti-TNF?Recomendación: NE: 1; GR: AActualmente no hay evidencia de aumento significativo del riesgo de linfoma en los pacientes con AR con uso de terapia biológica en comparación con los pacientes tratados con DMARD y con las cohortes históricas de AR60–62.
3. El uso combinado de DMARD con terapia biológica ¿aumenta el riesgo de neoplasia?Recomendación: NE: 1; GR: ALa evidencia evaluada no mostró que los grupos de terapia combinada de DMARD con terapia biológica tengan un mayor riesgo de neoplasia58.
4. ¿Está contraindicado el uso de terapia biológica en pacientes con antecedente de neoplasia (tumores sólidos, hematológicos, melanoma y piel no melanoma)?Recomendación: NE: 4, GR: C63.No se recomienda el uso de terapia biológica en pacientes con antecedentes de neoplasias linfoproliferativas, excepto el rituximab27.
5. ¿Es factible su utilización pasados 5 años del diagnóstico de la neoplasia y sin evidencias de recidiva27?Recomendación: NE: 4; GR: CEn ausencia de datos suficientes sobre el cáncer recurrente, los pacientes con un cáncer previo o nuevo cáncer deben ser informados acerca del posible riesgo de cánceres nuevos o recurrentes durante el tratamiento con anti-TNF o algunos de los DMARD. Se recomienda evaluar con el oncólogo los riesgos y beneficios de iniciar terapia biológica para AR. Es factible su utilización pasados 5 años del diagnóstico de la neoplasia y sin evidencias de recidiva27,57,58,58a.
Enfermedad gastrointestinal y hepática no infecciosa1. ¿Cuáles son las pruebas hepáticas de cribado previas y con qué frecuencia deben repetirse en pacientes con terapia biológica?Recomendación: NE: 4; GR: CNo hay recomendación formal de solicitud de pruebas de función hepática (TGO, TGP, fosfatasa alcalina, GGT) previo al inicio de terapia biológica. Sin embargo, se han descrito casos de enfermedad hepática inducida por anti-TNF, y por esta razón se recomienda realizar estas pruebas previamente64–66.
En todo paciente a quien se va a iniciar terapia se debe descartar infección pasada o presente por HBV o HCV mediante la realización de las siguientes pruebas: HBsAg, HBsAb, HBcAb y anti HCV. Si hay evidencia de infección actual por HBV, se debe realizar carga viral27,67.
2. ¿Es segura la administración de terapia biológica en pacientes con enfermedades hepáticas no infecciosas?Recomendación: NE: 4; GR: CLa evidencia disponible es escasa; existen reportes de casos que no permiten hacer una clara recomendación de su uso.
La terapia anti-TNF no ha sido evaluada para el tratamiento de pacientes con esteatohepatitis no alcohólica (NASH). Sin embargo, hay reportes de pacientes con NASH que han presentado rápida normalización de pruebas bioquímicas hepáticas durante el tratamiento de AR con adalimumab. Más estudios son requeridos para evaluar el papel de los anti-TNF en los pacientes con NASH68–70.
Los anti TNF han demostrado seguridad aceptable a corto plazo, y la hepatotoxicidad puede ocurrir en pacientes susceptibles; se debe asegurar el monitoreo regular de los niveles de aminotransferasas en pacientes tratados con estos agentes.
3. ¿Es segura la administración de terapia biológica en pacientes con enfermedad diverticular del colon? En particular ¿hay un riesgo incrementado de perforación o diverticulitis?Recomendación NE: 4; GR: CDurante el tratamiento con medicamentos biológicos la presencia de perforación intestinal es poco común, pero constituye un efecto adverso serio especialmente en pacientes con AR. El riesgo es mayor en pacientes con tratamiento concomitante con AINE o glucocorticoides (GC) (HR: 4,7) y enfermedad diverticular. Los AINE y los GC han sido asociados con complicaciones severas de enfermedad diverticular. Dieciocho casos de perforación gastrointestinal baja han sido documentados en pacientes con AR tratados con tocilizumab en ensayos clínicos. En los estudios faseiii que evalúan la eficacia y la seguridad de tocilizumab se ha encontrado una tasa de perforación gastrointestinal de 1,9 por 1.000 pacientes (1,3 para anti-TNF, GC: 3,9). La mayoría de estos pacientes estaban recibiendo AINE o GC71–73.
No existe contraindicación para el uso de terapia biológica en pacientes con enfermedad diverticular; sin embargo, se sugiere precaución con su uso74.
4. ¿Es necesario tomar pruebas de tamización (TAC abdomen o colonoscopia) en pacientes que van a ser sometidos a terapia biológica?Recomendación: NE: 4; GR: CEl riesgo de perforación diverticular puede ser ligeramente más alto en pacientes tratados con tocilizumab, comparado con DMARD convencionales o agentes anti-TNF, pero menos que con GC. El mecanismo de acción del antagonismo de IL-6 en la fisiopatología de la perforación diverticular se desconoce72.
Se debe tener precaución con el uso de medicación inmunosupresora en pacientes con enfermedad diverticular sintomática. Es importante la realización de estudios adicionales en pacientes con síntomas gastrointestinales bajos que reciben agentes biológicos75.
Enfermedad hepática infecciosa1. En un paciente que va a recibir un biológico ¿cómo se tamiza la presencia de hepatitis viral crónica?Recomendación: NE: 4; GR: CEn el proceso de cribado inicial se debe solicitar: HBsAg: antígeno de superficie de hepatitis B; anti-HBc: anticuerpos anticore; anti-HBs: anticuerpos anti-HBs y anticuerpos totales para hepatitisC.
Remitir los pacientes con infección crónica por hepatitisB y hepatitisC a infectología y hepatología para iniciar tratamiento.
Los pacientes negativos para el anticuerpo en contra del antígeno de superficie hepatitisB deben ser vacunados siguiendo el esquema de vacunación recomendado para la población general, siempre realizándose previo al inicio de la terapia para optimizar la formación de anticuerpos protectores.
Existen series de casos de pacientes con enfermedades autoinmunes tratados con terapia biológica que muestran que en aquellos con hepatitisB y hepatitisC crónica se puede reactivar la enfermedad, posterior a la inmunosupresión76–83.
2. En pacientes con hepatitis B o C a quienes se deba iniciar terapia biológica ¿cuál es el medicamento de elección?Recomendación: NE: A; GR: CLas hepatitis B y C crónica pueden ser comorbilidades serias en pacientes con enfermedades reumáticas. Es frecuente la reactivación de hepatitisB en pacientes infectados que reciben terapia con anti-TNF o rituximab y a quienes no se les da una adecuada profilaxis antiviral.
La terapia antiviral oral puede prevenir la reactivación del virus de la hepatitisB y se recomienda para todos los pacientes infectados que reciben terapia inmunosupresora de alto riesgo.
Los pacientes con historia de infección pasada por hepatitisB deben ser cuidadosamente evaluados y monitorizados durante la terapia, en especial aquellos que reciban medicamentos depletores de célulasB.
En pacientes con enfermedad reumática con hepatitisC crónica, la terapia biológica con anti-TNF o rituximab parece ser segura84–89.
Vacunación1. ¿Qué vacunas deben recomendarse antes del inicio de un biológico?Recomendación: NE: 4; GR: CSe recomienda revisar el esquema de vacunación en pacientes con enfermedad autoinmune y completarlo siguiendo las recomendaciones que se aplican para paciente inmunosuprimido no VIH positivo. Está contraindicado el uso de vacunas vivas o atenuadas (tabla 3). Se siguen las recomendaciones de la Guía de Práctica Clínica para la Vacunación del Adulto y del Adolescente en Colombia 201290 y el esquema recomendado de vacunación para adultos en Estados Unidos90–94. http://www.cdc.gov/vaccines/schedules/downloads/adult/adult-schedule.
Recomendaciones para aplicaciones de vacunas
| Recomendación | Vacunas |
|---|---|
| Aplicar | Vacuna contra neumococo e influenza inactivada (intramuscular, trivalente) |
| Recomendación de acuerdo con la población general | Toxoide tetánico, VPH, hepatitis A |
| Considerar | Hepatitis B en pacientes no vacunados o no infectados previamente |
| No aplicar (vacunas vivas o atenuadas) | Polio oral, BCG, fiebre amarilla |
Se recomienda en general una evaluación de riesgo cardiovascular anual a todos los pacientes que cursen con artritis inflamatorias, la cual puede espaciarse a cada 2 años en pacientes con bajo riesgo; de igual forma, cada vez que se determine cambio en el tratamiento incluyendo terapia biológica, este riesgo debe reevaluarse95–98.
2. ¿Está indicada la realización de ecocardiograma de rutina en pacientes con factores de riesgo cardiovascular previo al inicio de terapia biológica?No hay evidencia suficiente para formular recomendaciones. Las guías publicadas para evaluación de riesgo cardiovascular no incluyen evaluación de rutina con ecocardiografía95,99–101.
3. En pacientes que reciben terapia biológica ¿cuál es el riesgo de desarrollar enfermedad cardiovascular (enfermedad coronaria, enfermedad arterial oclusiva crónica)?Recomendación: NE: 2b; GR: CEl uso de terapia biológica ha demostrado disminuir el riesgo de desarrollar enfermedad cardiovascular. Su uso disminuye el uso de esteroides y AINE, que son reconocidos factores de riesgo102–104.
La inhibición de TNF-alfa mejoraría la función endotelial y disminuiría la progresión de la disfunción endotelial106; al parecer, con base en estudios de cohortes, se ha demostrado una tendencia hacia la reducción del riesgo para todos los eventos, aunque se necesita más evidencia al respecto105,107–109.
4. ¿Cuál es el riesgo de descompensación de falla cardiaca en pacientes que reciben terapia biológica?Aunque no se ha establecido con precisión el riesgo de desarrollo de falla cardiaca con anti-TNF, hay evidencia suficiente que indica que su uso afecta en forma adversa a pacientes con falla cardiaca moderada a severa110–129.
5. La presencia de diabetes ¿aumenta el riesgo de infección en pacientes a quienes se les inicia terapia biológica?La diabetes es un factor de riesgo independiente para infección en los pacientes con enfermedad inflamatoria que utilizan terapia inmunomoduladora. Sin embargo, es controversial si se presenta un aumento en el riesgo de infecciones con la adición de la terapia anti-TNF130–135.
6. ¿Cuál es el riesgo de desarrollo de dislipidemia en pacientes que reciben terapia biológica?La AR está asociada con un aumento de la morbilidad y la mortalidad cardiovascular, debido no solo a los factores tradicionales de riesgo cardiovascular, sino también a un estado inflamatorio crónico. Sin embargo, los valores lipídicos en los pacientes con AR son diferentes a los observados en la población general en riesgo de patologías cardiovasculares, donde hay evidencia de una relación positiva entre la enfermedad y los altos niveles de colesterol. Los pacientes no tratados con AR activa muestran niveles paradójicamente bajos de lípidos con relación a su frecuencia de enfermedad cardiovascular.
Los pacientes con AR que reciben tratamiento con medicamentos modificadores de la enfermedad, biológicos y sintéticos, experimentan una reducción en la inflamación a pesar de aumentar los niveles de cLDL. Se produce una reducción en los niveles de la PCR que se correlaciona con aumentos en la apoA1 y mejoras en la capacidad de flujo de salida de cHDL136–160.
7. ¿Con qué frecuencia se debe evaluar el riesgo cardiovascular en pacientes que reciban terapia biológica?Recomendación: NE: 4; GR: CSe recomienda una evaluación de riesgo cardiovascular anual a todos los pacientes que cursen con artritis inflamatorias, la cual puede espaciarse a cada 2 años en pacientes con bajo riesgo; de igual forma, cada vez que se determine el cambio en el tratamiento, incluyendo terapia biológica, este riesgo debe reevaluarse95,112,121,150,161–178.
8. ¿Cuál es la herramienta más recomendada para hacer esta evaluación?Las publicaciones sugieren la evaluación de riesgo cardiovascular a partir de la o las herramientas de cálculo usadas en cada país; en caso de no existir una recomendación clara, se sugiere el uso de índices de riesgo estandarizados, como Score de Framigham o el índice SCORE179–188.
Inmunogenicidad1. Con la evidencia disponible ¿existe alguna recomendación para evaluar inmunogenicidad con la terapia biológica (anticuerpos monoclonales, quiméricos)?No hay evidencia que soporte una recomendación para evaluar la presencia de anticuerpos antimedicamento (AMA) en pacientes en tratamiento con terapia biológica. Sin embargo, se ha descrito la presencia de estos anticuerpos en diferentes tipos de terapias. Su frecuencia disminuye con la administración concomitante de inmunomoduladores.
Hasta el momento no existen estudios que hayan evaluado el costo-efectividad de la terapia guiada por las determinaciones de niveles de medicamentos o presencia de anticuerpos, aunque sí hay evidencias de la asociación de estos anticuerpos con falla secundaria a este tipo de terapias (NE: 4; GR: C).
La identificación de AMA es útil en pacientes con pérdida de efectividad del medicamento; si estos son positivos, posiblemente no habrá respuesta al incremento de la dosis (NE: 4; GR: C)189–192.
Neurológico1. En pacientes candidatos a recibir terapia biológica ¿es necesario realizar cribado (tamización) para descartar enfermedad desmielinizante o polineuropatía?Recomendación: NE 3; GR BNo se debe dar terapia anti-TNF cuando hay una historia clara de esclerosis múltiple, y se debe usar con precaución en pacientes con otras enfermedades desmielinizantes. Se debe suspender la terapia anti TNF en caso de cuadro sugestivo de enfermedad desmielinizante193–197.
Reacciones adversas1. ¿Qué medidas se deben tomar para prevenir reacciones agudas a la aplicación de terapia biológica?Recomendación: NE: 4; GR: CEn lo referente a las medicaciones subcutáneas, así como a los anticuerpos monoclonales humanizados o las moléculas de fusión para aplicación intravenosa, no se recomienda ninguna premedicación. En lo referente al infliximab y al rituximab, moléculas quiméricas, se recomienda premedicación con glucocorticoides, acetaminofén y antihistamínicos198–202.
2. ¿Cuál es la conducta en caso de reacciones adversas menores agudas (fiebre, rash, síntomas de resfriado, tales como malestar general o mialgias)?Recomendación: NE: 4; GR: CComo primera medida se debe interrumpir la medicación y brindar tratamiento con antihistamínicos y glucocorticoides. De acuerdo con los síntomas, se pueden administrar analgésicos y antipiréticos (acetaminofén). Una vez controlada la reacción adversa, se puede reiniciar la aplicación. En el caso del rituximab, las reacciones agudas se presentaron más frecuentemente en la primera aplicación que en las siguientes (29% versus 8%). Por lo tanto, una reacción adversa aguda menor durante la primera aplicación del medicamento no necesariamente contraindica la segunda198,203,204.
Reacciones adversas tardías1. ¿Qué conducta se tomaría en caso de reacciones adversas tardías?RecomendaciónLas reacciones en el sitio de inyección han sido descritas principalmente con los compuestos subcutáneos; generalmente son leves o moderadas y no deben, necesariamente, llevar a la descontinuación del medicamento, ya que con frecuencia se resuelven de manera espontánea durante las aplicaciones subsiguientes205. El tratamiento local o sistémico de estas lesiones se hará según el criterio del médico tratante (NE: 4; GR: C).
Exacerbación de psoriasis: descontinuar el medicamento anti-TNF y tratar las lesiones por parte de dermatología206 (NE: 4; GR: C).
El uso de anti-TNF diferente puede ser considerado a juicio del médico tratante (NE: 4; GR: C).
Las lesiones psoriasiformes (en general relacionadas con anti-TNF) deben ser evaluadas por dermatología. De acuerdo con la severidad de las lesiones cutáneas y la respuesta al tratamiento, se puede considerar continuar el mismo tratamiento o reiniciarlo si ha sido suspendido. El uso de un anti-TNF diferente puede ser considerado a juicio del médico tratante207,208 (NE: 4, GR: C).
En lo referente a las complicaciones cutáneas infecciosas como la tiña, la infección por herpes simplex y la infección aguda por estafilococo, debe indicarse el tratamiento específico y no implican necesariamente la descontinuación del tratamiento (NE: 4; GR: C)209–214.
Guías de administración1. ¿Cuáles son los requisitos mínimos para la administración de los medicamentos biológicos por primera vez y durante su mantenimiento en relación a clínica, paraclínicos y aspectos administrativos en enfermedades reumáticas?RecomendaciónLos medicamentos de aplicación intravenosa deben administrarse en centros que cumplan las normas de habilitación del respectivo ente regulatorio. El centro de atención debe contar con la supervisión de un reumatólogo (NE: 4, GR: C).
Para la aplicación de los medicamentos biológicos deben tenerse en cuenta las siguientes recomendaciones.
- •
Requisitos para iniciar tratamiento (Guías SER AR).
- -
Descartar embarazo, infección (incluida tuberculosis), cáncer, insuficiencia cardiaca, citopenias, enfermedad desmielinizante u otra comorbilidad relevante.
- -
Practicar los siguientes exámenes de laboratorio: hemograma, perfil hepático, función renal, uroanálisis, marcadores de hepatitis B y C, radiografía de tórax, PPD. Antes de iniciar tocilizumab se recomienda realizar perfil lipídico.
- -
Vacunación de acuerdo con la recomendación establecida en esta guía.
- -
Desparasitar (NE: 4; GR: C).
- -
- •
Durante el tratamiento:
- -
Monitoreo de aparición de infecciones, neuritis óptica (enfermedades desmielinizantes), cáncer, insuficiencia cardiaca.
- -
Exámenes recomendados para seguimiento: cuadro hemático, función hepática, renal, uroanálisis, marcadores de inflamación.
- -
Recomendaciones higiénicas: evitar alimentos crudos o hacer un lavado adecuado de vegetales y frutas (NE: 4; GR: C).
- -
- •
Indicaciones para suspensión:
- -
Infección, cáncer, enfermedad desmielinizante, neuritis óptica, citopenia grave. Eventos graves relacionados con el medicamento, cirugía mayor programada, embarazo (NE: 4, GR: C).
- -
No existe una recomendación al respecto. En los registros no se habla de periodos específicos de lavado (wash out)215–221.
Cirugía1. ¿Cuándo suspender la terapia biológica antes de un procedimiento quirúrgico y cuándo reiniciarla?Recomendación: NE 4; GR CEn pacientes que reciben terapia anti-TNF se debe realizar un balance riesgo-beneficio para suspender el medicamento antes de una cirugía mayor programada (riesgo de infección vs. riesgo de reactivación de la enfermedad). El medicamento se debe suspender entre 3 y 5 vidas medias antes del procedimiento y reiniciarse después de que el riesgo de infección ha pasado222–226.