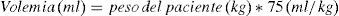Revisar el tratamiento perioperatorio de los pacientes con fracturas de cadera y tratamiento concomitante con antiagregantes plaquetarios, así como analizar las diferencias de mortalidad al año, y el sangrado perioperatorio según la pauta de cirugía precoz (<48h) vs. demorada (>5 días).
Paralelamente, determinar al ingreso y en el preoperatorio inmediato la agregabilidad plaquetaria en todos los pacientes incluidos en el estudio.
Pacientes y métodoSobre 175 pacientes mayores de 65 años con fractura de cadera de baja energía se aleatorizaron 3 grupos: antiagregados con cirugía precoz, antiagregados con cirugía demorada, y no antiagregados con cirugía precoz; se recogieron prospectivamente los mismos datos clínicos y analíticos para todos ellos.
La agregabilidad plaquetaria se determinó mediante un sistema informatizado semicuantitativo basado en la agregometría por impedancia en sangre completa.
ResultadosEl sangrado, los requerimientos transfusionales y los resultados analíticos no mostraron diferencias estadísticamente significativas entre los grupos.
Un 59,8% de los pacientes que no referían tomar antiagregantes se encontraban analíticamente antiagregados al ingreso, mientras que un 13,5% de los que tomaban antiagregantes no se encontraban correctamente antiagregados.
El análisis multivariante mostró mayor mortalidad a 12 meses para las variables del índice de Barthel bajo previo a la fractura (OR: 0,9-0,9) y número de transfusiones (OR: 1,1-1,5).
La estancia media fue de 4,1 días mayor en el grupo demorado.
ConclusiónLa pauta de cirugía precoz para los pacientes en tratamiento antiagregante tiene resultados clínicos parecidos a la demorada, pero mejora la eficiencia hospitalaria al reducir la estancia media.
La antiagregación farmacológica referida por el paciente resultó poco concordante con la determinación de la agregabilidad.
A review of the perioperative management of patients with hip fractures and concomitant therapy with antiplatelet agents, and to analyse the differences in mortality and perioperative bleeding in early surgery (<48h) versus delayed surgery (>5 days).
Platelet aggregation was measured on admission and immediately before surgery in all patients included in the study
Patients and methodsA total of 175 patients over 65 years old, with low energy hip fracture were randomised into 3 groups: Patients on antiplatelet therapy undergoing early surgery, patients on antiplatelet therapy undergoing delayed surgery, and patients not on antiplatelet therapy undergoing early surgery. The same clinical and laboratory data were collected prospectively up to 12 months for all the patients.
The platelet aggregation was determined by a semi-quantitative computerised system based on impedance aggregometry in whole blood.
ResultsBleeding, transfusion requirements and analytical results showed no significant differences between groups.
More than half (59.8%) of the patients not taking antiplatelet therapy had normal platelet aggregation on admission, while 13.5% of those taking antiplatelet agents did not.
Multivariate analysis showed increased mortality at 12 months for the variables, low Barthel index before hip fracture (OR: 0.9-0.9) and number of transfusions (OR: 1.1-1.5).
The average lenth of stay was 4.1 days greater in the delayed surgery group.
ConclusionEarly surgery for patients receiving antiplatelet therapy has similar clinical outcomes to the delayed, but improves hospital efficiency by reducing the average length of stay.
The antiplatelet drug reported by the patient showed low concordance with the determination of the platelet aggregation.
Las fracturas de cadera (FC) son consideradas las fracturas osteoporóticas más graves, porque asocian con mayor morbimortalidad1,2, y un importante impacto económico en la sociedad, tanto por su frecuencia3,4, como por los gastos sanitarios directos e indirectos que generan.
El amplio uso de los antiagregantes plaquetarios (AP) en la población de mayor edad, y la elevada incidencia de las FC en este mismo grupo, favorece que ambos hechos puedan coincidir en un mismo paciente. Esto obliga a tener en cuenta los teóricos riesgos asociados al sangrado quirúrgico y en consecuencia, condiciona la elección de la técnica anestésica. La falta de consenso en el tratamiento perioperatorio del tratamiento AP lo convierte en uno de los problemas candentes en la literatura médica5,6.
Demora quirúrgica en el tratamiento de la fractura de caderaEl tratamiento estándar para la FC es la intervención quirúrgica dentro de las primeras 24-36h desde el ingreso, puesto que se consigue minimizar el dolor, reducir la estancia hospitalaria, limitar los requerimientos farmacológicos, reducir la morbimortalidad, y anticipar la recuperación funcional7–12. Algunos trabajos van más allá, y recomiendan ignorar cualquier interferencia que pueda provocar un retraso en la cirugía más de 48h que no sea una amenaza vital, dando así un trato a las FC de verdadera urgencia quirúrgica13. La mayoría de protocolos y guías clínicas coinciden en que el momento óptimo para la intervención es aquel en el que el paciente se encuentra en las mejores condiciones posibles y que, si se presenta una complicación reversible, es razonable demorar la intervención hasta resolver el cuadro para permitir la intervención14–16. Sin embargo, un trabajo británico de 2007 al respecto concluye que no se puede cumplir esta precocidad hasta en un 75% de las ocasiones por la falta de disponibilidad del área quirúrgica17.
También existen publicaciones en el sentido contrario al recomendado en las guías18. El mayor estudio en número de pacientes describe una mayor mortalidad para la pauta de cirugía precoz19.
El tiempo de demora hasta la intervención es tan solo uno de los factores implicados en las complicaciones perioperatorias y en el resultado final. Otros factores como la edad, el estado nutricional, las comorbilidades previas, el estatus socio-económico o incluso la experiencia del equipo quirúrgico también afectan a la morbimortalidad en la FC20–22, por lo cual, a pesar de las teóricas ventajas de la intervención precoz, el momento idóneo para realizar el tratamiento quirúrgico sigue suscitando controversias y siendo objeto de revisión y estudio.
Antiagregantes plaquetariosLos fármacos antiagregantes se utilizan como profilaxis o tratamiento de episodios trombóticos arteriales23, que son afecciones especialmente prevalentes en la población más anciana. Casi un 50% de los casos de FC en el anciano asocian a su ingreso el uso concomitante de algún fármaco AP24.
Los AP actúan sobre la hemostasia primaria bloqueando alguna de las múltiples vías de la activación plaquetaria25, por lo tanto, producen una inhibición parcial de la agregabilidad que se traduce en un alargamiento del tiempo de sangrado, aunque clínicamente resulta poco significativo26. Además, existe un amplio espectro de respuesta a los AP bien sea por idiosincrasia, por incumplimiento de la pauta terapéutica, por interacciones farmacológicas, por factores ambientales o dietéticos. Estos hechos provocan que no siempre se corresponda en un paciente la agregabilidad plaquetaria objetivada mediante algún estudio analítico con la esperada según se encuentren o no en tratamiento con AP.
Hasta hace pocos años, para la medición de la actividad plaquetaria se venía utilizando el tiempo de sangría: un método cualitativo y poco reproducible, por lo que no se realizaba de forma rutinaria. Tan solo en algunos casos se utilizaba el analizador de la función plaquetaria por alto flujo sobre un soporte de membrana in vitro (PFA-100®, Siemens), pero en el momento del diseño del estudio solo estaba validado para la medición de AAS27.
En los últimos años se ha desarrollado un sistema de medición de la agregación plaquetaria basado en la agregabilidad inducida por impedancia28 sobre sangre total, de fácil aplicación, alta reproductibilidad y sensibilidad, y que permite medir también otras vías de agregación plaquetaria, por lo que se ha incluido en las recientes guías clínicas de análisis del funcionalismo plaquetario29. En la actualidad este sistema sigue sin estar disponible de forma generalizada en los laboratorios hospitalarios, y no se determina de forma rutinaria.
Consideraciones anestésicasEl tipo de anestesia para la FC también ha sido objeto de revisión en guías y protocolos30–32. La anestesia general se ha asociado a un aumento del sangrado de las complicaciones tromboembólicas y de la confusión postoperatoria; por contra, la anestesia regional ha mostrado mejor recuperación funcional y menor índice de complicaciones sistémicas, pero en cuanto a la mortalidad no se han demostrado diferencias significativas entre ambas, de forma que no hay suficiente evidencia científica para señalar un tipo de anestesia como estándar en la cirugía de cadera32,33. Por lo tanto, no hay un estándar anestésico para esta afección y la técnica más adecuada debe individualizarse en cada caso, y uno de los factores a tener en cuenta para elegir la técnica anestésica es precisamente si el paciente se encuentra en tratamiento con AP.
Las guías y protocolos de principios de la década pasada34–36 recomendaban demorar la intervención hasta recuperar un pool plaquetario funcional (entre 5 y 14 días dependiendo del AP) con la excepción de la AAS a dosis bajas. En los últimos años han aparecido varias publicaciones sugiriendo que se ha sobrevalorado el aumento del riesgo hemorrágico perioperatorio atribuido al tratamiento antiagregante y, que por el contrario, se ha infravalorado el aumento del riesgo trombótico que se asume al retirar este tratamiento, especialmente, en aquellos pacientes de mayor riesgo trombótico37–41. Este cambio de actitud ya se ha visto reflejado en la nueva guía del tratamiento perioperatorio de AP en la cirugía no cardiaca de la Sociedad Española de Anestesiología, publicada en mayo del presente año42.
Objetivos del estudioNos proponemos realizar la comparación entre grupos de los pacientes con FC en función de las 2 variables a considerar: el tiempo de demora quirúrgico (antes de 48h vs. más allá de 5 días), y el estado de antiagregación plaquetaria al ingreso.
El objetivo primario de este estudio es describir el efecto de la demora del tratamiento quirúrgico respecto a la mortalidad los 12 meses siguientes a la intervención.
Un objetivo secundario es medir si existen diferencias de sangrado entre los grupos en cuanto a diferencias analíticas de hematocrito y en cuanto a requerimientos transfusionales.
Otro objetivo secundario es valorar la concordancia entre la determinación analítica de la agregabilidad de los pacientes y su tratamiento con AP.
Creemos que demorar la cirugía en los pacientes antiagregados con FC no reduce la mortalidad, así como tampoco se incrementa significativamente el sangrado respecto a la pauta habitual de cirugía precoz que se aplica en los pacientes no antiagregados. Por el contrario, la pauta demorada sí que alarga el periodo de ingreso hospitalario y, consiguientemente, el gasto sanitario directo por cada proceso.
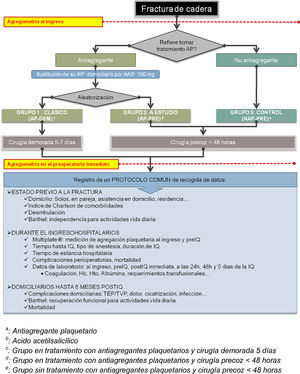
Material y métodoEste es un estudio prospectivo aleatorizado sobre 206 pacientes mayores de 65 años ingresados de forma consecutiva en el Hospital Universitari Arnau de Vilanova de Lleida con el diagnóstico de FC de baja energía durante el año comprendido entre septiembre de 2009 y septiembre de 2010.
De estos 206 pacientes iniciales se han excluido aquellos con fracturas de alta energía, patológicas, periprotésicas por no ser objeto del presente estudio. También se han descartado los pacientes con coagulopatías o alteraciones plaquetarias conocidas previas para reducir la confusión con la medición de la agregabilidad plaquetaria, así como los pacientes en tratamiento anticoagulante con dicumarínicos. Tampoco se han incluido a los pacientes con morbilidades previas que condicionasen el tipo de técnica anestésica (como la enfermedad pulmonar obstructiva crónica grave o la estenosis aórtica grave), ni a los pacientes que presentasen una contraindicación absoluta de retirar el tratamiento AP (como infartos cerebrales o cardíacos en los 6 meses previos a la fractura, y los portadores de dispositivos intravasculares). Por último, no se han recogido aquellos pacientes que declinaron formar parte del estudio.
Sobre los 175 pacientes que finalmente fueron incluidos en el estudio, se programó un seguimiento prospectivo desde el ingreso hospitalario hasta cumplir los 12 meses desde la intervención quirúrgica o hasta su muerte. El seguimiento se realizó mediante controles clínicos presenciales en el área de consultas externas al mes, a los 3 meses, y a los 6 meses. El control a los 12 meses también se realizó mediante entrevista telefónica. En aquellos pacientes que no podían realizar el desplazamiento hasta el centro hospitalario para los controles presenciales por su estado de salud, el seguimiento se realizó de forma telefónica, con el propio paciente o con el familiar de referencia designado durante su ingreso.
A los pacientes y a sus familiares se les informaba de la posibilidad de participar en el presente estudio en el momento de su ingreso hospitalario y se les solicitaba su consentimiento informado antes de conocer la pauta de tratamiento que les sería asignada.
Los pacientes se distribuyeron según si tomaban medicación AP a su ingreso. Sobre los pacientes que afirmaron tomar algún AP se aleatorizó su distribución en 2 grupos mediante un sistema de sobres cerrados, se sustituyó su tratamiento antiagregante domiciliario por AAS 100mg (tal y como recomiendan las guías anestésicas42).
Por otro lado, todos los pacientes que no se encontraban en tratamiento con AP fueron asignados a un grupo control en el cual se aplicó la pauta de tratamiento precoz. Se descartó la posibilidad de crear un grupo control de pacientes sin tratamiento AP, y con pauta demorada quirúrgica por no ser objeto de este estudio, por ser un tema ya ampliamente evaluado en otros trabajos ya publicados, y por consideraciones éticas.
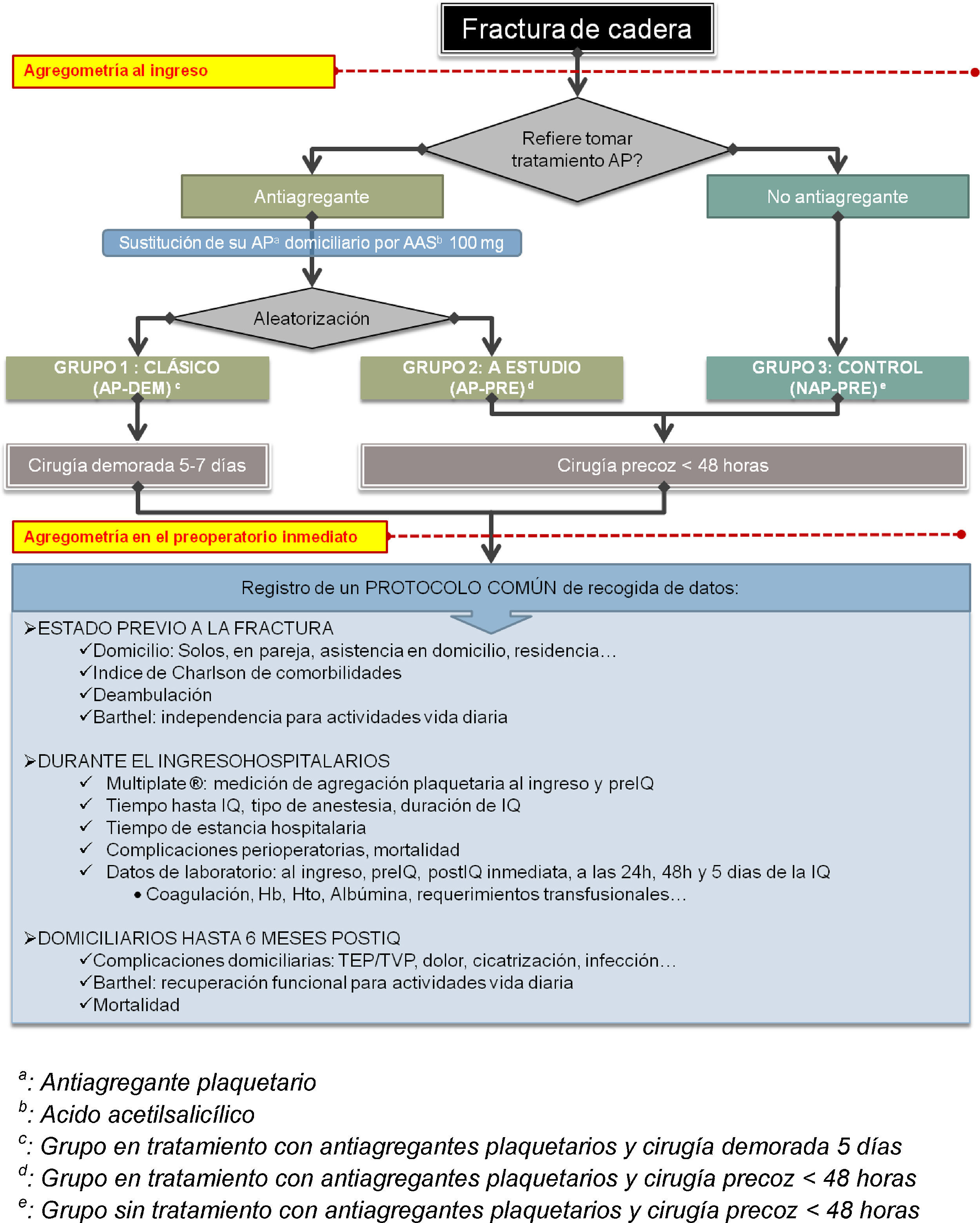
Según lo expuesto, resulta una distribución en 3 grupos que se resume en la figura 1 y se detalla a continuación:
- -
Grupo de pacientes en tratamiento antiagregante con pauta demorada (en adelante grupo AP-DEM). Se realizó la pauta habitual de tratamiento de los pacientes antiagregados sustituyendo su fármaco AP habitual y demorando el tratamiento quirúrgico hasta más allá de los 5 días desde el ingreso.
- -
Grupo de pacientes en tratamiento antiagregante con pauta quirúrgica precoz (en adelante grupo AP-PRE), que representa el grupo a estudio. Se realizó la pauta de tratamiento quirúrgico dentro de las primeras 48h desde el ingreso siempre que la disponibilidad de medios técnicos lo permitiese, exactamente igual que se realizaría en los pacientes no antiagregados.
- -
Grupo control formado por los pacientes sin tratamiento antiagregante (en adelante grupo NAP-PRE), sobre los cuales se realizó la pauta de cirugía precoz estándar en las primeras horas en función de la disponibilidad de medios técnicos.
La elección de la técnica anestésica utilizada quedó a criterio del anestesista asignado excepto en el grupo AP-PRE, puesto que el riesgo teórico de provocar un hematoma espinal en caso de realizar una punción raquídea, condicionó a realizar una anestesia general en todos estos pacientes.
Todos los pacientes fueron intervenidos siguiendo el protocolo estandarizado del servicio de Traumatología del Hospital Universitari Arnau de Vilanova de Lleida, en quirófanos programados o urgentes, según la disponibilidad del área quirúrgica y de forma indistinta por los facultativos que se encontraran a cargo de ese paciente. Este protocolo incluye una profilaxis preoperatoria antibiótica que se administró después de la toma de muestra para la medición de la función plaquetaria con el fin de no interferir en la determinación analítica. También se siguió el protocolo profiláctico de trombosis venosa con enoxaparina con dosis ajustadas según el peso y el protocolo de la comisión de prevención de enfermedad tromboembólica de nuestro centro.
Durante el ingreso hospitalario todos los pacientes recibieron las atenciones de un equipo multidisciplinar, que cuenta con miembros de los servicios de traumatología, geriatría, rehabilitación y con un asistente social. Como norma general no se modificó el tratamiento domiciliario previo, y no se inició de forma sistemática ninguna pauta para la osteoporosis.
Para todos los pacientes incluidos en el estudio se recogió el mismo protocolo como se detalla en la figura 1.
Dentro del protocolo de datos, se registraron: la procedencia al ingreso, si requería asistencia domiciliaria previamente a la fractura, el índice de Barthel y el índice de comorbilidad de Charlson. Respecto a las analíticas realizadas, fueron las mismas que se practican habitualmente: hemograma, recuento y fórmula, ionograma y estudio de coagulación, pero se añadió una nueva determinación en las analíticas al ingreso y en la preoperatoria inmediatamente antes de la intervención quirúrgica correspondiente a la medición de la agregación plaquetaria.
Para la determinación de la agregabilidad plaquetaria se utilizó un medidor informatizado de la función plaquetaria de electrodo múltiple (Multiplate® Verum Diagnostica GmbH, Munich, Alemania), que está basado en la agregometría por impedancia sobre sangre total descrita en 1980 por Cardinal y Flower28. Este sistema de análisis informatizado y multicanal mide cada vía de la activación plaquetaria, en función de la variación de la impedancia entre 2 pares de electrodos de alta conductividad independientes sumergidos en cubetas con sangre total a temperatura fisiológica. Las plaquetas se adhieren a los electrodos bajo una activación específica en cada cubeta mediante reactivos específicos disponibles comercialmente. Los resultados se expresan en forma de 2 gráficas superpuestas coincidentes que muestran la agregación plaquetaria y también en formato numérico como unidades arbitrarias denominadas área bajo la curva (AUC). El método está descrito con detalle en el artículo de Toth et al.43 de 2006. Las muestras se recogieron en tubos con hirudina (anticoagulante inhibidor directo de la trombina), y se analizaron por el personal de laboratorio, previamente entrenado.
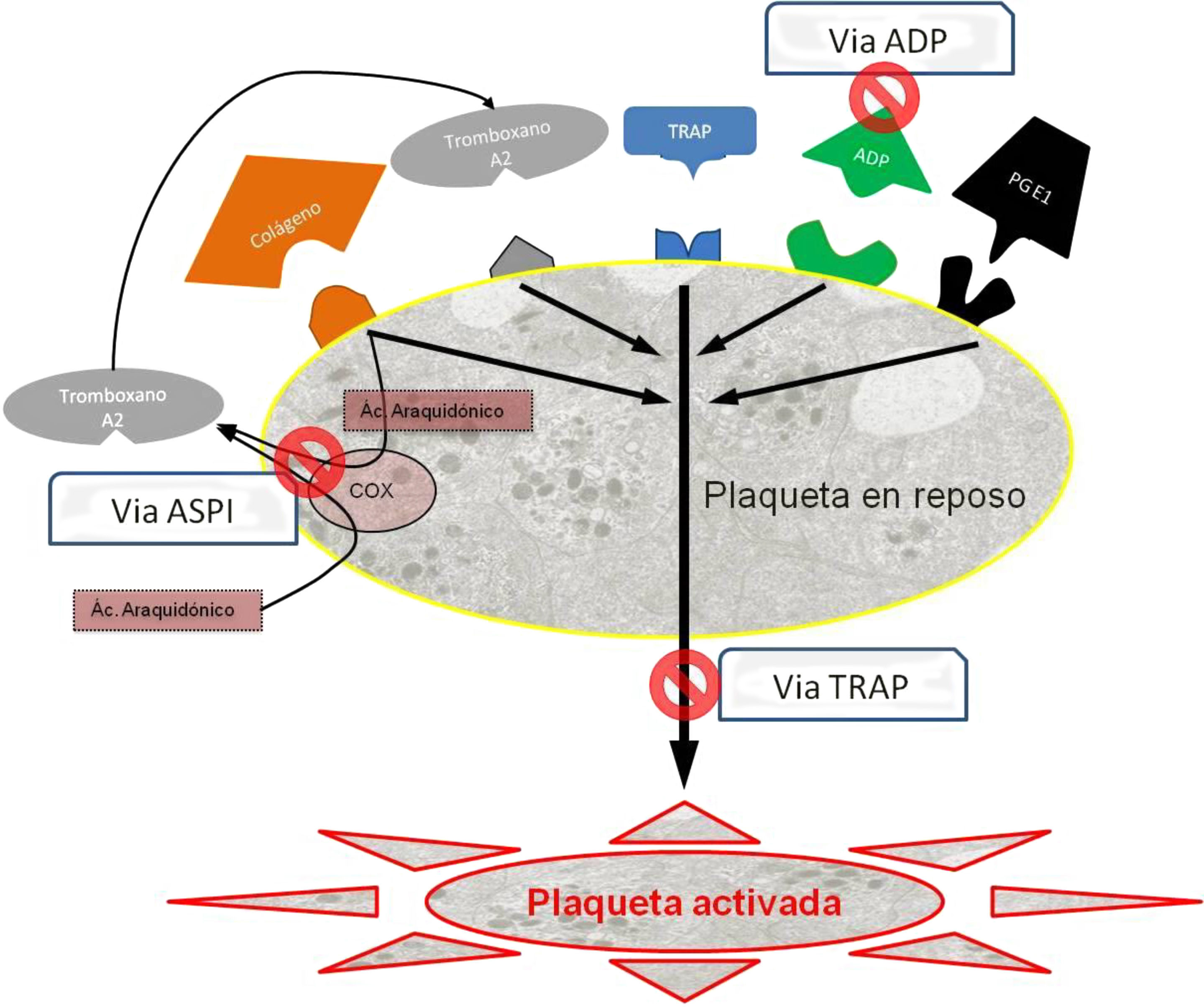
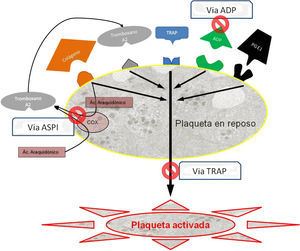
Existen 3 tipos de fármacos según la vía de activación que tienen como diana terapéutica (fig. 2), y son las que hemos determinado sistemáticamente para todos los pacientes al ingreso y antes de la intervención:
- 1.
Vía del adenosín difosfato (ADP): Inhibidores del receptor de ADP, que incluyen entre otros, el clopidogrel (Plavix®, Iscover®), el prasugrel y la ticlopidina (Tiklid®). Los valores de referencia para la vía del ADP se han tomado del estudio realizado por Ranucci et al.44, que establecen el punto de corte en 40 unidades de área bajo la curva (U AUC), y dentro de los límites propuestos por Gorlinger et al.45.
- 2.
Vía del ácido araquidónico (ASPI): Inhibidores de la ciclooxigenasa-1 (COX-1) representados entre otros, por el ácido acetilsalicílico (AAS), y el triflusal (Disgren®). Hemos tomado niveles parecidos para ASPI en 40 U AUC45.
- 3.
Vía de la trombina (TRAP): Inhibidores de la vía común iib-iiia, correspondiente a la función plaquetaria global, y que hace la función de control de calidad interno. Son de uso hospitalario intravenoso, como el abciximab, epitifabide y tirofiban. En los casos en que esta vía resulta por debajo de los niveles funcionales (<40 U AUC)45, se considera que existe un problema en la función plaquetaria global, que puede ser por múltiples orígenes (trombocitopenia, disfunciones plaquetarias o interferencias medicamentosas entre las más frecuentes). Dado que no se puede valorar si la baja agregabilidad es consecuencia del efecto de fármacos de AP, en estos casos se excluyó el paciente de la valoración.
Esquema de las vías de activación plaquetaria.
Ac. araquidónico: ácido araquidónico; ADP: adenosín difosfato; COX: ciclooxigenasa; PGE1: prostaglandina E1; TRAP: péptido activador del receptor de la trombina.
Fuente: adaptado de Compendium multiplate final por Calatzis A, Loreth R y Spannagl M, 2007.
Los resultados de la agregometría se mantuvieron cegados hasta la conclusión del estudio para no condicionar las decisiones del equipo médico responsable del paciente.
El sangrado perioperatorio se determinó mediante una fórmula que mide la diferencia entre el hematocrito determinado en el preoperatorio inmediato, y el hematocrito a las 24h postoperatorias46, y las relaciona con el hematocrito al ingreso, y la volemia del paciente de la forma que detalla la siguiente ecuación:
Considerando la volemia como:
Asimismo como medición indirecta del sangrado también se recogieron las necesidades transfusionales de cada paciente mediante el recuento del número de concentrados de hematíes transfundidos durante todo el ingreso hospitalario.
Los 3 grupos de distribución de los pacientes en el estudio (NAP-PRE, AP-PRE y AP-DEM) nos permiten realizar comparaciones 2 a 2 entre:
- 1.
La pauta de cirugía precoz vs. cirugía demorada en los pacientes que tienen en común tomar antiagregantes al ingreso (grupo AP-PRE vs. AP-DEM), en cuanto al sangrado, requerimientos transfusionales y la mortalidad.
- 2.
Entre los pacientes que refieren tomar AP al ingreso vs. los que refieren no tomarlos tratados todos ellos de forma precoz (AP-PRE vs. NAP-PRE) en cuanto al sangrado, requerimientos transfusionales y la mortalidad.
- 3.
Respecto a la agregabilidad plaquetaria determinada según el sistema Multiplate®:
- •
Implicación de la antiagregación objetivada analíticamente en el sangrado, los requerimientos transfusionales y la mortalidad.
- •
Verificar cuál es la concordancia entre la antiagregación referida y la analítica para la población con fractura de cadera.
- •
Las variables descriptivas se expresan como media ± desviación estándar o como porcentaje. La diferencia entre los distintos grupos se estableció con la prueba de Chi-cuadrado para las variables categóricas y el test de ANOVA para las cuantitativas.
Se ha realizado un estudio de remisión logística univariante y multivariante con variable resultado de mortalidad hospitalaria calculando los Odds ratio (con su intervalo de confianza al 95%) para las variables empleadas. Para el modelo multivariante se han incluido en el modelo todas las variables (full model) interesantes por su posible capacidad predictiva, y se han seleccionado las variables significativas con un sistema no automático. El modelo se ha valorado calculando la curva ROC y su área bajo la curva (ABC).
Se ha determinado una significación estadística con p<0,05. Hemos utilizado el programa estadístico SPSS® versión 16.0.
El protocolo de este estudio cuenta con la conformidad del comité ético del Hospital Universitari Arnau de Vilanova.
ResultadosEl análisis estadístico descriptivo de nuestra muestra, que se detalla en la tabla 1, ha resultado comparable entre los grupos de estudio excepto en 3 variables en las que mostró diferencias estadísticamente significativas:
- 1.
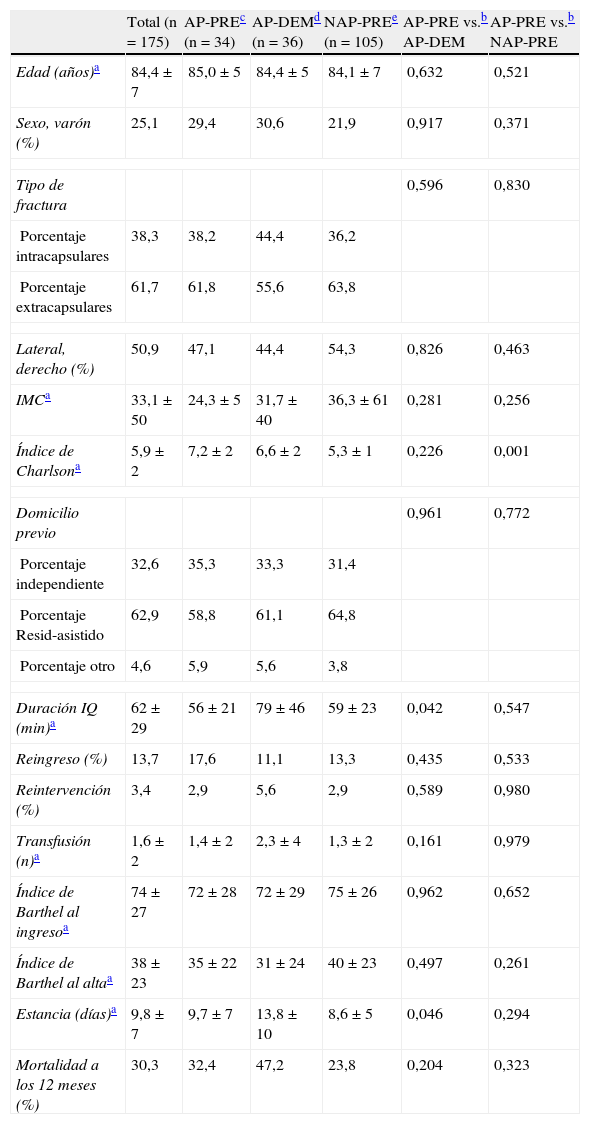
Un mayor número de comorbilidades en el índice de Charlson en el grupo antiagregado AP-PRE, estadísticamente significativo respecto al grupo no antiagregado NAP-PRE (7,2±2 vs. 5,3±1; p<0,001), pero sin diferencias significativas en la comparativa entre los grupos antiagregados AP-PRE y AP-DEM (7,2±2 vs. 6,6±2).
- 2.
Una estancia media más larga en el grupo de cirugía demorada AP-DEM respecto al grupo de cirugía precoz AP-PRE (9,7±7 vs. 13,8±10; p=0,046).
- 3.
Una mayor duración media de la intervención en el grupo AP-DEM respecto al grupo AP-PRE (79±46 vs. 56±21; p=0,042).
Características demográficas (n=175)
| Total (n=175) | AP-PREc (n=34) | AP-DEMd (n=36) | NAP-PREe (n=105) | AP-PRE vs.b AP-DEM | AP-PRE vs.b NAP-PRE | |
| Edad (años)a | 84,4±7 | 85,0±5 | 84,4±5 | 84,1±7 | 0,632 | 0,521 |
| Sexo, varón (%) | 25,1 | 29,4 | 30,6 | 21,9 | 0,917 | 0,371 |
| Tipo de fractura | 0,596 | 0,830 | ||||
| Porcentaje intracapsulares | 38,3 | 38,2 | 44,4 | 36,2 | ||
| Porcentaje extracapsulares | 61,7 | 61,8 | 55,6 | 63,8 | ||
| Lateral, derecho (%) | 50,9 | 47,1 | 44,4 | 54,3 | 0,826 | 0,463 |
| IMCa | 33,1±50 | 24,3±5 | 31,7±40 | 36,3±61 | 0,281 | 0,256 |
| Índice de Charlsona | 5,9±2 | 7,2±2 | 6,6±2 | 5,3±1 | 0,226 | 0,001 |
| Domicilio previo | 0,961 | 0,772 | ||||
| Porcentaje independiente | 32,6 | 35,3 | 33,3 | 31,4 | ||
| Porcentaje Resid-asistido | 62,9 | 58,8 | 61,1 | 64,8 | ||
| Porcentaje otro | 4,6 | 5,9 | 5,6 | 3,8 | ||
| Duración IQ (min)a | 62±29 | 56±21 | 79±46 | 59±23 | 0,042 | 0,547 |
| Reingreso (%) | 13,7 | 17,6 | 11,1 | 13,3 | 0,435 | 0,533 |
| Reintervención (%) | 3,4 | 2,9 | 5,6 | 2,9 | 0,589 | 0,980 |
| Transfusión (n)a | 1,6±2 | 1,4±2 | 2,3±4 | 1,3±2 | 0,161 | 0,979 |
| Índice de Barthel al ingresoa | 74±27 | 72±28 | 72±29 | 75±26 | 0,962 | 0,652 |
| Índice de Barthel al altaa | 38±23 | 35±22 | 31±24 | 40±23 | 0,497 | 0,261 |
| Estancia (días)a | 9,8±7 | 9,7±7 | 13,8±10 | 8,6±5 | 0,046 | 0,294 |
| Mortalidad a los 12 meses (%) | 30,3 | 32,4 | 47,2 | 23,8 | 0,204 | 0,323 |
IMC: índice de masa corporal; IQ: intervención quirúrgica.
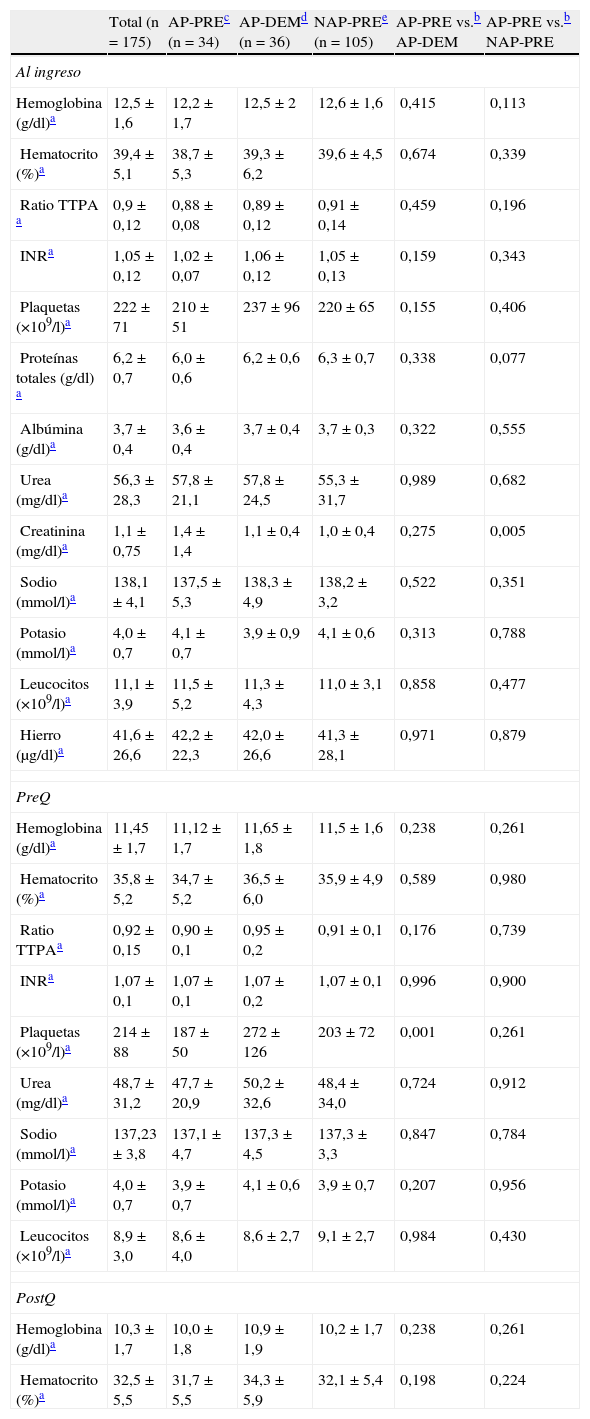
En cuanto a los valores analíticos habituales (hemoglobina, hematocrito, coagulación, plaquetas, urea, leucocitos, sodio, potasio, creatinina, proteínas, albúmina y hierro) recogidos en el protocolo común al ingreso y en el preoperatorio inmediato, no se han encontrado diferencias clínicamente significativas en las comparativas entre los grupos AP-DEM vs. AP-PRE ni entre AP-PRE vs. NAP-PRE. Los resultados, detallados en la tabla 1, muestran algunos hallazgos que resultan con significación estadística, tales como una diferencia de creatinina al ingreso hospitalario entre los grupos AP-PRE y NAP-PRE (resultando 1,1±0,4 vs. 1,0±0,4 respectivamente), que carecen de significación clínica. Un caso parecido en cuanto al hallazgo estadístico sin valor clínico ocurre con el número total de plaquetas en el preoperatorio entre los grupos AP-PRE y AP-DEM (187±50 vs. 272±126 respectivamente).
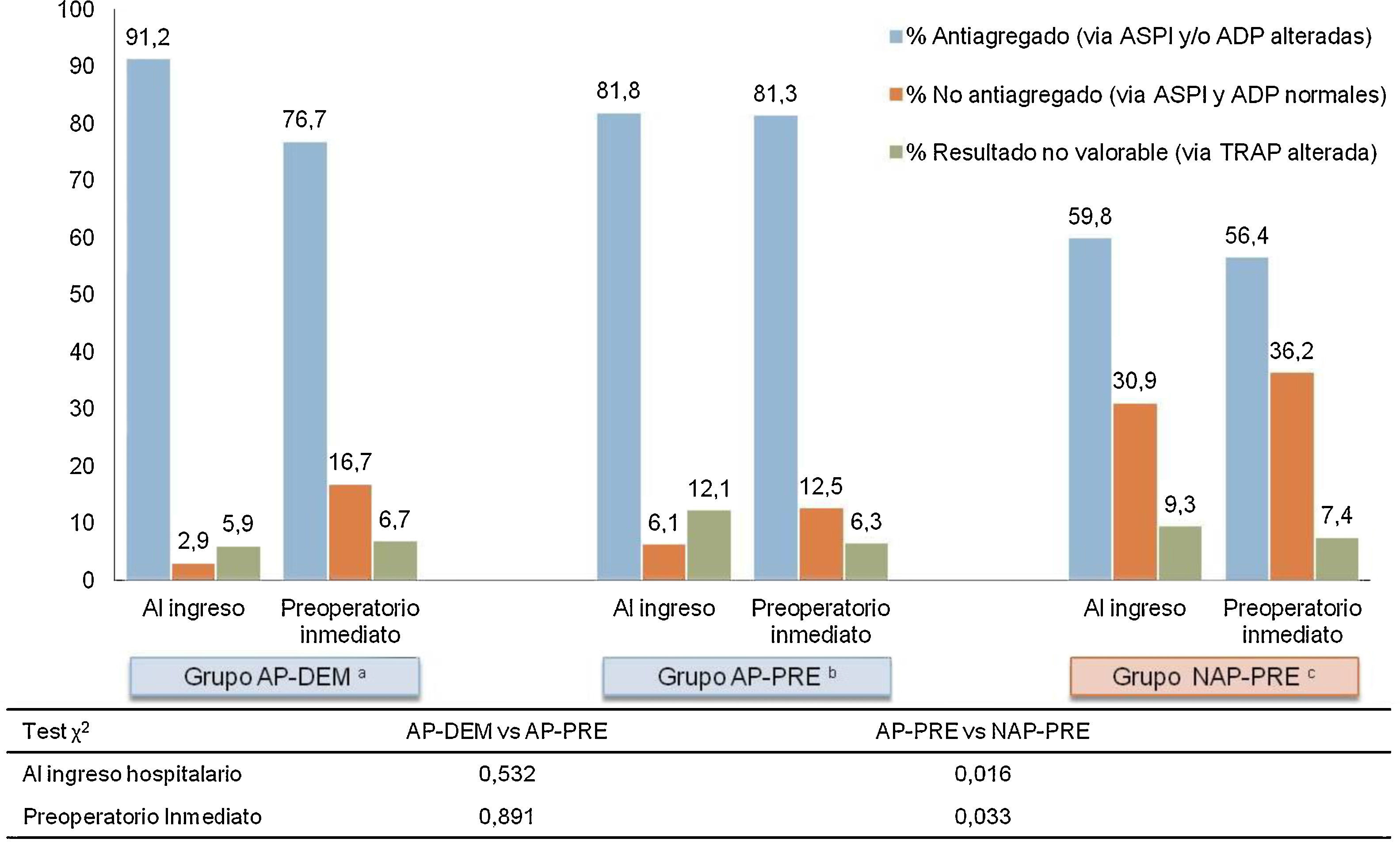
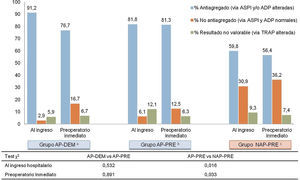
Los resultados de la agregometría por impedancia muestran una baja concordancia entre la antiagregación medida, y lo referido por el paciente a su ingreso, y se resumen en la figura 3. Los pacientes que al ingreso refieren tomar antiagregantes, se encuentran en un 86,5% de los casos efectivamente antiagregados. Pero un 59,8% de los pacientes asignados al grupo que al ingreso negaban tomar fármacos AP (NAP-PRE), mostraban un estado de antiagregación plaquetaria por alguna de las vías analizadas (ASPI o ADP) según Multiplate®.
Resultados MULTIPLATE al ingreso y preintervención (n=164).
aGrupo en tratamiento con antiagregantes plaquetarios y cirugía demorada 5 días
bGrupo en tratamiento con antiagregantes plaquetarios y cirugía precoz mejor de 48h.
cGrupo sin tratamiento con antiagregantes plaquetarios y cirugía precoz menor de 48h.
Se detecta analíticamente un subgrupo, correspondiente al 9% de todos los pacientes analizados, que presenta una alteración de la vía común de la agregación plaquetaria (vía TRAP). Este resultado analítico invalida la medición de las vías comunes de activación plaquetaria que realiza Multiplate®, ya que los resultados de las otras vías (ADP y ASPI) quedan alterados y pierden fiabilidad. Este subgrupo se presenta en todos los grupos (NAP-PRE, AP-PRE y AP-DEM) de forma consistente y parecida. Estos pacientes se han contabilizado en un apartado propio para la realización de la estadística, tal y como se muestra en la figura 3.
En los grupos de cirugía precoz, las mediciones entre el ingreso y el preoperatorio inmediato son concordantes. El porcentaje de pacientes que están antiagregados al ingreso y se mantienen antiagregados en el preoperatorio inmediato para el grupo AP-PRE varía únicamente en un 0,5%, y en 3,4% para el grupo NAP-PRE, mientras que en el grupo demorado 5 días desde el ingreso se produce una disminución del porcentaje de antiagregados de un 14,5%, manteniéndose analíticamente un 76,7% como antiagregados en el momento de la intervención.
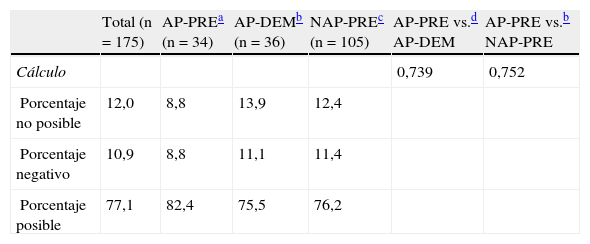
El cálculo de la pérdida sanguínea perioperatoria (entre el hematocrito del preoperatorio inmediato y el realizado a las 24h de la intervención) se ha completado en el 88% de pacientes del estudio. En los pacientes que falta la recogida de alguna muestra (sea la del ingreso o bien la preoperatoria inmediata) no se ha podido realizar la comparación. Un 10,9% han presentado valores absolutos de sangrado negativo y también han sido excluidos de la valoración. Los valores estimados de sangrado muestran una tendencia a ser mayores en el grupo AP-PRE (308±182ml) respecto al grupo AP-DEM (278±210ml), y al NAP-PRE (265±128ml), sin que estas diferencias presenten significación estadística (tabla 2).
Cálculo de pérdida sanguínea (n=175)
| Total (n=175) | AP-PREa (n=34) | AP-DEMb (n=36) | NAP-PREc (n=105) | AP-PRE vs.d AP-DEM | AP-PRE vs.b NAP-PRE | |
| Cálculo | 0,739 | 0,752 | ||||
| Porcentaje no posible | 12,0 | 8,8 | 13,9 | 12,4 | ||
| Porcentaje negativo | 10,9 | 8,8 | 11,1 | 11,4 | ||
| Porcentaje posible | 77,1 | 82,4 | 75,5 | 76,2 |
| Total (n=135) | AP-PRE (n=28) | AP-DEM (n=27) | NAP-PRE (n=80) | AP-PRE vs AP-DEMb | AP-PRE vs NAP-PREb | |
| Valor pérdida (ml)e | 276±159 | 308±182 | 278±210 | 265±128 | 0,587 | 0,193 |
Los requerimientos transfusionales se detallan en la tabla 3: en los grupos con pauta precoz NAP-PRE y AP-PRE resultaron respectivamente de 1,3±2 y 1,4±2 concentrados de hematíes por paciente, mientras que en el grupo de pauta demorada AP-DEM fue de 2,3±4, con amplia variabilidad y sin poder demostrar diferencias estadísticamente significativas (tabla 3).
Resultados de las determinaciones analíticas (n=175)
| Total (n=175) | AP-PREc (n=34) | AP-DEMd (n=36) | NAP-PREe (n=105) | AP-PRE vs.b AP-DEM | AP-PRE vs.b NAP-PRE | |
| Al ingreso | ||||||
| Hemoglobina (g/dl)a | 12,5±1,6 | 12,2±1,7 | 12,5±2 | 12,6±1,6 | 0,415 | 0,113 |
| Hematocrito (%)a | 39,4±5,1 | 38,7±5,3 | 39,3±6,2 | 39,6±4,5 | 0,674 | 0,339 |
| Ratio TTPA a | 0,9±0,12 | 0,88±0,08 | 0,89±0,12 | 0,91±0,14 | 0,459 | 0,196 |
| INRa | 1,05±0,12 | 1,02±0,07 | 1,06±0,12 | 1,05±0,13 | 0,159 | 0,343 |
| Plaquetas (×109/l)a | 222±71 | 210±51 | 237±96 | 220±65 | 0,155 | 0,406 |
| Proteínas totales (g/dl) a | 6,2±0,7 | 6,0±0,6 | 6,2±0,6 | 6,3±0,7 | 0,338 | 0,077 |
| Albúmina (g/dl)a | 3,7±0,4 | 3,6±0,4 | 3,7±0,4 | 3,7±0,3 | 0,322 | 0,555 |
| Urea (mg/dl)a | 56,3±28,3 | 57,8±21,1 | 57,8±24,5 | 55,3±31,7 | 0,989 | 0,682 |
| Creatinina (mg/dl)a | 1,1±0,75 | 1,4±1,4 | 1,1±0,4 | 1,0±0,4 | 0,275 | 0,005 |
| Sodio (mmol/l)a | 138,1±4,1 | 137,5±5,3 | 138,3±4,9 | 138,2±3,2 | 0,522 | 0,351 |
| Potasio (mmol/l)a | 4,0±0,7 | 4,1±0,7 | 3,9±0,9 | 4,1±0,6 | 0,313 | 0,788 |
| Leucocitos (×109/l)a | 11,1±3,9 | 11,5±5,2 | 11,3±4,3 | 11,0±3,1 | 0,858 | 0,477 |
| Hierro (μg/dl)a | 41,6±26,6 | 42,2±22,3 | 42,0±26,6 | 41,3±28,1 | 0,971 | 0,879 |
| PreQ | ||||||
| Hemoglobina (g/dl)a | 11,45±1,7 | 11,12±1,7 | 11,65±1,8 | 11,5±1,6 | 0,238 | 0,261 |
| Hematocrito (%)a | 35,8±5,2 | 34,7±5,2 | 36,5±6,0 | 35,9±4,9 | 0,589 | 0,980 |
| Ratio TTPAa | 0,92±0,15 | 0,90±0,1 | 0,95±0,2 | 0,91±0,1 | 0,176 | 0,739 |
| INRa | 1,07±0,1 | 1,07±0,1 | 1,07±0,2 | 1,07±0,1 | 0,996 | 0,900 |
| Plaquetas (×109/l)a | 214±88 | 187±50 | 272±126 | 203±72 | 0,001 | 0,261 |
| Urea (mg/dl)a | 48,7±31,2 | 47,7±20,9 | 50,2±32,6 | 48,4±34,0 | 0,724 | 0,912 |
| Sodio (mmol/l)a | 137,23±3,8 | 137,1±4,7 | 137,3±4,5 | 137,3±3,3 | 0,847 | 0,784 |
| Potasio (mmol/l)a | 4,0±0,7 | 3,9±0,7 | 4,1±0,6 | 3,9±0,7 | 0,207 | 0,956 |
| Leucocitos (×109/l)a | 8,9±3,0 | 8,6±4,0 | 8,6±2,7 | 9,1±2,7 | 0,984 | 0,430 |
| PostQ | ||||||
| Hemoglobina (g/dl)a | 10,3±1,7 | 10,0±1,8 | 10,9±1,9 | 10,2±1,7 | 0,238 | 0,261 |
| Hematocrito (%)a | 32,5±5,5 | 31,7±5,5 | 34,3±5,9 | 32,1±5,4 | 0,198 | 0,224 |
INR: ratio internacional normalizada o tiempo de protrombina; PostQ: postoperatorio inmediato; PreQ: preoperatorio inmediato; Ratio TTPA: ratio del tiempo de tromboplastina parcial activado.
La estancia media global es de 9,8±7 días, pero se incrementa en el grupo AP-DEM en 4,1 días de media respecto a AP-PRE (9,7±7 vs. 13,8 ±10) de forma estadísticamente significativa (p=0,046); en el grupo NAP-PRE (8,6±5) se ha mantenido por debajo de la media aunque sin diferencias significativas con AP-PRE (tabla 3).
A los 12 meses la mortalidad global de los 3 grupos fue del 30,3%; en el grupo de control NAP-PRE llegó al 23,8%; en el grupo AP-PRE ascendió hasta el 32,4%, y resultó aún más elevada en el grupo AP-DEM alcanzando un 47,2%, aunque estos valores no llegaron a lograr significación estadística (tabla 3).
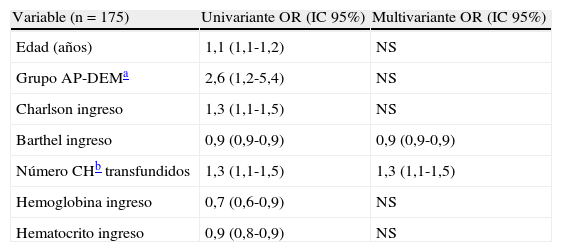
En el análisis de remisión logística de las variables asociadas a la mortalidad a 12 meses, aparecen en la valoración univariante con Odds ratio significativas la edad (1,1-1,2), el pertenecer al grupo AP-DEM (1,2-5,4), un mayor índice de Charlson al ingreso (1,1-1,5), un menor índice de Barthel al ingreso (0,9-0,9), el número de concentrados de hematíes transfundidos (1,1-1,5), y valores bajos de hemoglobina (0,6-0,9) y hematocrito (0,8-0,9) al ingreso. Pero de todos estos factores, las únicas variables que se mantienen como estadísticamente significativas en el análisis multivariante completo son el índice de Barthel bajo al ingreso, y el número de concentrados de hematíes transfundidos (tabla 4).
Análisis de remisión logística múltiple. Se muestran solo las variables que se asocian de forma independiente con la mortalidad a los 12 meses
| Variable (n=175) | Univariante OR (IC 95%) | Multivariante OR (IC 95%) |
| Edad (años) | 1,1 (1,1-1,2) | NS |
| Grupo AP-DEMa | 2,6 (1,2-5,4) | NS |
| Charlson ingreso | 1,3 (1,1-1,5) | NS |
| Barthel ingreso | 0,9 (0,9-0,9) | 0,9 (0,9-0,9) |
| Número CHb transfundidos | 1,3 (1,1-1,5) | 1,3 (1,1-1,5) |
| Hemoglobina ingreso | 0,7 (0,6-0,9) | NS |
| Hematocrito ingreso | 0,9 (0,8-0,9) | NS |
NS: diferencia no estadísticamente significativa. Modelo de remisión logística múltiple con ABC, ROC de 0,81 (0,73-0,89).
Las diferencias apreciadas en el análisis descriptivo de la muestra pueden suponer ciertos sesgos de selección, pero son justificables en cuanto a:
- •
El mayor número de comorbilidades en el índice de Charlson, en el grupo antiagregado AP-PRE respecto al grupo no antiagregado NAP-PRE se explica porque los pacientes que están tratados con antiagregantes a su ingreso tienen mayor frecuencia de presentar problemas de salud que los que no lo están. Este hecho lo confirma que no se encuentre esta diferencia entre AP-PRE y AP-DEM.
- •
La mayor duración media de la intervención en el grupo AP-DEM respecto al grupo AP-PRE puede explicarse porque, al poder prever la fecha de intervención con unos días de antelación, se realizaron mayor número de cirugías en parte quirúrgico programado. Por contra, los grupos en pauta de cirugía precoz se intervinieron en el momento en que se tuvo disponibilidad de un área quirúrgica, frecuentemente, en el área quirúrgica de urgencias.
El tipo de anestesia utilizado se ha distribuido de forma diferente entre los grupos de estudio, y esto podría representar un sesgo en nuestros resultados. En el grupo AP-PRE la anestesia general fue la norma para evitar el riesgo de sangrado a consecuencia de realizar una punción raquídea. Pero en cuanto a la distribución de los tipos de anestesia en aquellos grupos en los que la técnica quedaba a criterio del anestesista, se aprecia una clara predilección por la anestesia subaracnoidea: grupo AP-DEM: 30 anestesia regional, 2 anestesia general, 4 sin poder recoger los datos; NAP-PRE: 92 anestesia regional, 6 anestesia general, 9 sin poder recopilar datos.
Aunque las directrices reflejadas en el documento de tratamiento multidisciplinar de la fractura de cadera realizado por el Grupo de Estudio e Investigación de la Osteoporosis (GEIOS) de la Sociedad Española de Cirugía Ortopédica y Traumatología, avalado también por la Sociedad Española de Anestesiología, Reanimación y Terapéutica del dolor, y que fue publicado en 200947 señalan que no existe suficiente evidencia científica respecto a qué técnica anestésica obtiene mejor resultado, general o raquídea, la mayoría de los anestesiólogos prefieren la técnica regional siempre y cuando no esté contraindicada.
Como se expone en el artículo publicado por Luger et al. en 201048, la elección de la técnica anestésica debe personalizarse en función de las preferencias del paciente, las comorbilidades asociadas, las complicaciones postoperatorias previstas, y la experiencia del anestesiólogo. Por este motivo, en los casos en los que se optó por una anestesia general, se utilizaron múltiples variantes. Resulta clínicamente imposible estandarizar un protocolo concreto para este tipo de pacientes puesto que padecen afecciones variadas, graves y muchas veces requieren someterse a la intervención en condiciones subóptimas.
El sangrado perioperatorio de 24h mostró una tendencia no significativa estadísticamente a ser mayor en el grupo AP-PRE respecto a los otros grupos, pero las diferencias en números absolutos (30ml respecto al grupo AP-DEM y 43ml respecto a NAP-PRE) tampoco implican ninguna relevancia clínica. La medición, basada en la diferencia de hematocrito previo a la intervención, y a las 24h de la cirugía, ha mostrado problemas de valoración arrojando valores de sangrado operatorio negativos contrarios a la lógica, nada ajustados a la realidad, y que pueden generar confusión. Las justificación de este resultado está en que la variabilidad circunstancial del hematocrito en determinadas situaciones clínicas. La deshidratación, la hemoconcentración o la hemodilución, así como la interferencia que pueden provocar las transfusiones sanguíneas durante la intervención quirúrgica o durante las primeras horas postoperatorias, pueden provocar un resultado sesgado en uno u otro sentido (minimizado o sobredimensionado). Este problema no se puede tampoco evitar cambiando el intervalo de tiempo a 48h, o restringiéndolo exclusivamente al periodo intraoperatorio. Por este motivo, creemos que el hematocrito no es un parámetro útil para estimar el sangrado perioperatorio.
La media de requerimientos transfusionales fue mayor en el grupo AP-DEM, aunque no mostró significación estadística en la comparativa. Las necesidades transfusionales no solo son una forma de medir de forma indirecta el sangrado perioperatorio, sino que también pueden estar influenciadas por el estado de salud previo del paciente49 (nutrición, anemia, etc.), y sobre todo por la evolución postoperatoria. Aquellos pacientes que evolucionan de forma más tórpida suelen requerir transfusión de mayor número de concentrados de hematíes, y de la misma forma tienen mayor riesgo de sufrir complicaciones y exitus. Este compendio de factores previos a la cirugía, propios de la intervención y posquirúrgicos influye en esta variable, y justifica que se relacione de forma estadísticamente significativa a mayor mortalidad, tanto en el análisis univariante y multivariante.
La estancia media incrementada en el grupo AP-DEM en 4,1 días de media respecto a AP-PRE de forma estadísticamente significativa está acorde a la demora en la intervención en ese grupo, que se realiza entre 4 y 5 días más tarde que en el protocolo precoz de forma sistemática. Este resultado es una consecuencia directa del diseño del estudio, pero al aplazar la intervención días sistemáticamente el tiempo medio de hospitalización se alarga de forma proporcional, y esto implica un mayor gasto sanitario directo para cada proceso del grupo con pauta demorada respecto a los grupos con pauta precoz.
La mortalidad a los 12 meses es comparable con los índices publicados en la bibliografía, aunque se sitúa en el rango más elevado. Los grupos de pacientes antiagregados muestran una tendencia a disponer de una mortalidad globalmente mayor, puesto que tienen mayor índice de comorbilidades, y resulta mayor de forma estadísticamente significativa en el grupo demorado AP-DEM. Por ello, pertenecer a este grupo es un factor asociado a la mortalidad en el análisis univariante, aunque pierde la significación estadística en el análisis multivariante. Más allá de si se trata de un factor de mayor mortalidad o no, lo que traduce es que la demora en la intervención para los pacientes en tratamiento con AP no solo no consigue mejorar los resultados clínicos en cuanto a complicaciones hemorrágicas o requerimientos transfusionales en nuestro trabajo, sino que incluso muestra cierta tendencia a incrementar la mortalidad. Estos datos apoyan el cambio de actitud que empieza aparecer en las últimas revisiones de las sociedades de anestesia42, en la que se aboga por mantener el tratamiento antiagregante durante el perioperatorio, y no demorar la intervención por este motivo.
Aunque existen múltiples factores que pueden alterar la agregación plaquetaria por diferentes vías, resulta sorprendente que el 59,8% de los pacientes que no referían tomar antiagregantes (NAP-PRE) presentaban una analítica patológica para alguna de las vías de activación plaquetaria estudiadas (ADP y ASPI). Por lo tanto, en ocasiones hemos tratado como no antiagregados a pacientes que en realidad lo estaban y, aún así, no hemos apreciado un aumento en las complicaciones. Esta situación no parece tener consecuencias hemorrágicas, pero los pacientes se exponen al riesgo grave, aunque infrecuente, que conlleva utilizar una técnica anestésica como la punción raquídea cuando la agregación plaquetaria se encuentra alterada. En estos pacientes podría ser de interés el análisis preoperatorio de la función plaquetaria.
Por otro lado, el 86,5% de los pacientes que afirmaban tomar antiagregantes (AP-PRE y AP-DEM) presentaban efectivamente antiagregación según la determinación analítica y, por lo tanto, un 13,5% no se encontraban correctamente antiagregados. Esta situación se puede dar por la falta de respuesta al fármaco, o por no tomarlo en una dosis que los mantenga dentro del rango terapéutico. Cualquiera que sea el origen, este dato resultaría clínicamente poco relevante si la indicación del tratamiento antiagregante es como profilaxis primaria con bajo riesgo trombótico, pero sí que resultaría más preocupante si el origen de la medicación fuera el tratamiento de un episodio trombótico agudo o la profilaxis secundaria con alto riesgo trombótico. Aunque no se presentaron problemas durante la intervención, los pacientes se encuentran en riesgo de sufrir trombosis arteriales, lo cual resulta importante más allá del periodo perioperatorio. Por lo tanto, parece aconsejable consensuar algún método de control y seguimiento de la respuesta terapéutica al fármaco AP, especialmente en el seguimiento clínico de los pacientes con mayor riesgo trombótico, tal y como se propone en las guías de consenso de cardiología50.
También resulta interesante resaltar que en el grupo AP-DEM, muestra un 76,7% de antiagregación por agregometría después de los 5 días, a pesar de que el protocolo del estudio incluye un tratamiento de mantenimiento con AAS 100mg durante la demora. El porcentaje de pacientes antiagregados reales debería ascender puesto que no hay incumplimiento terapéutico, pero desciende en unos 14,5 puntos porcentuales respecto al ingreso. De nuevo, esta situación puede resultar importante en los pacientes de alto riesgo trombótico. La explicación puede tener relación con el tipo de fármaco antiagregante y la dosis utilizada, pero deberían realizarse nuevos estudios y determinaciones hospitalarias seriadas para confirmarlo.
Tras el análisis univariable, aparecen diversos factores relacionados con la mortalidad, pero en el análisis multivariante completo, más próximo a la realidad, las variables que se mantienen estadísticamente significativas son un índice de Barthel bajo al ingreso, y el número de concentrados de hematíes transfundidos.
El hecho de que los valores de la agregometría no hayan mostrado relación estadística con la mortalidad, con el sangrado, ni con los requerimientos transfusionales, puede poner en duda su necesidad en el perioperatorio de forma rutinaria, aunque parecen muy recomendables en el seguimiento de los pacientes con alto riesgo trombótico. No deja de ser sorprendente que un tratamiento tan ampliamente utilizado, que ha venido condicionando el tratamiento perioperatorio de estos pacientes, e incrementando su coste económico, disponga de tan escasos recursos para determinar su efecto real. Creemos que podría estar justificado realizar estudios para valorar el gasto/beneficio de esta determinación, quedando quizás reservada a los pacientes seleccionados que fueran candidatos a la anestesia raquídea.
Existen debilidades inevitables en el diseño del estudio, en el sentido de que la demora quirúrgica del paciente y sus antecedentes medicamentosos no se pueden cegar al equipo médico a cargo del paciente, y quizás pueda tener alguna relevancia en la selección del tipo de anestesia, como se ha comentado. Creemos que el estudio podría mejorarse con un mayor número de pacientes, incluyendo los datos de otros centros con protocolos de tratamiento parecidos, y también incluyendo datos que permitan medir las variables más allá de la mortalidad como la evolución de la calidad de vida posterior a la fractura, así como las valoraciones respecto a la recuperación de la autonomía y la capacidad de deambulación previas a la fractura.
Conclusiones- 1.
La determinación analítica del funcionalismo plaquetario consigue detectar un número relevante de pacientes en los que su agregabilidad objetiva no concuerda con la esperada según sus antecedentes medicamentosos.
- 2.
La pauta de cirugía precoz sobre los pacientes antiagregados muestra un aumento del sangrado intraoperatorio no significativo ni clínicamente relevante.
- 3.
La pauta quirúrgica demorada sobre los pacientes antiagregados no consigue mejorar los resultados clínicos ni analíticos y, además, muestra una tendencia a incrementar la mortalidad, aunque no resulta estadísticamente significativa.
- 4.
La estancia media en el grupo de pacientes con pauta quirúrgica demorada es mayor, y produce un incremento proporcional de los costes sanitarios directos por cada proceso.
Por lo tanto, a la luz de las conclusiones obtenidas, no creemos aconsejable demorar la intervención a causa del tratamiento AP. En cualquier caso la decisión última del momento óptimo de la intervención debe ser tomada por cada equipo asistencial multidisciplinar, esto es, cirujano, anestesista y geriatra o internista, en el mejor interés de cada paciente y, por supuesto, en función de la disponibilidad de los medios técnicos. Estudios como el que se presenta pueden ayudar a tomar decisiones con mayor criterio.
Nivel de evidenciaNivel de evidencia i.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente estudio se ha financiado mediante una beca de investigación de la Fundación SECOT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Fundación SECOT por la oportunidad de llevar a cabo el presente estudio mediante la concesión de una de sus becas de investigación en la convocatoria de 2009.