Las enfermedades fúngicas invasoras (EFI) son causas importantes de morbilidad y mortalidad en los receptores de trasplantes de órganos sólidos (RTOS). Las modificaciones y mejoras en los procedimientos quirúrgicos de trasplante, los cuidados de apoyo y los avances, tanto diagnósticos como terapéuticos, han provocado cambios importantes en la epidemiología y el pronóstico de las EFI. Candida y otras levaduras siguen desempeñando un papel etiológico muy relevante, pero Aspergillus y otros hongos filamentosos se han convertido en las principales causas de EFI en receptores de trasplante de pulmón. Este artículo de revisión es una actualización de los hallazgos más relevantes dentro del campo de la epidemiología, el diagnóstico y el tratamiento de las EFI en RTOS, pero con un interés más específico en las aspergilosis y candidiasis invasoras.
Invasive fungal diseases (IFD) are important causes of solid organ transplant-related morbidity and mortality. Modifications and improvements in the transplant surgical procedures, supportive care, and advances in the diagnosis and treatment of these IFD have produced notable changes in their epidemiology and outcome. Candida and other yeast genera continue to play an important etiological role, but Aspergillus and other filamentous fungi are the cause of most IFD in lung transplant recipients. This review is an update of the relevant findings in the literature related to the epidemiology, diagnosis and treatment of IFD in solid organ transplant recipients, with a main focus on invasive aspergillosis and candidiasis.
Los trasplantes de órganos sólidos (TOS) y de progenitores hematopoyéticos (TPHP) son tratamientos médico-quirúrgicos cada vez más habituales y han supuesto una importante mejora en la esperanza y la calidad de vida para muchos pacientes con enfermedades graves. El control de la respuesta inmunológica del receptor contra el órgano trasplantado para evitar su rechazo y pérdida, constituía hasta hace pocos años el problema más importante. En los últimos años se han conseguido fármacos inmunosupresores e inmunomodulado-res más efectivos, pero el trasplante de órganos se enfrenta al difícil equilibrio que supone controlar el rechazo y evitar que el paciente presente infecciones que ensombrezcan su futuro vital.En el período inicial o perioperatorio (hasta el primer mes después del trasplante), el mayor riesgo de infección se relaciona con el estado previo del receptor del trasplante y sus enfermedades, con el proceso quirúrgico y con los patógenos que estaban latentes en el paciente oen el órgano trasplantado (citomegalovirus, Toxoplasma, Mycobacterium,etc.), o por patógenos que aprovechan la rotura de las barreras cutáneo-mucosas, las alteraciones o complicaciones en el órgano trasplantado o el efecto de los inmunosupresores. Entre el primer y elsexto mes después del trasplante, pueden permanecer los efectos y lascomplicaciones del período perioperatorio, pero el riesgo fundamental se asocia con el estado de inmunodepresión o inmunodeficiencia del paciente. Pueden aparecer infecciones oportunistas cuya etiología, en muchas ocasiones, depende de la profilaxis que recibe el paciente.
El riesgo de infección oportunista va a persistir mientras el paciente necesite concentraciones altas de inmunosupresores. Con una evolución satisfactoria del trasplante, esta inmunosupresión se reducirá al mínimo posible y las infecciones serán muy similares a las de otras personas. Sin embargo, como en los dos períodos previos, permanece el riesgo de reactivación de infecciones latentes.
Las enfermedades fúngicas invasoras (EFI) son uno de los problemas más preocupantes en los receptores de órganos sólidos (RTOS). Su frecuencia es baja y afectan a poblaciones muy concretas de pacientes, pero su morbilidad y mortalidad se mantienen elevadas[18,131] Las EFI en RTOS se producen generalmente en el período posoperatorio temprano (< 1 mes) y se relacionan con factores perioperatorios conocidos, como retrasplante, fallo renal, transfusiones importantes, tratamiento inmunosupresor o factores específicos de cada tipo de trasplante, como es el caso de la hepato-yeyunostomía en el trasplante hepático, que pueden suponer una importante agresión tisular[16,20]. Sin embargo, también se describen EFI en pacientes que han pasado esta fase inicial después de recibir el trasplante, y los factores relacionados con la inmunosupresión y las posibles complicaciones del trasplante son los que tiene más peso en este período. La mayoría de las EFI están causadas por Candida y Aspergillus, pero otros hongos como Pneumocystis, Cryptococcus, Fusarium, Scedosporium o los mucorales pueden provocar enfermedades devastadoras. Se dispone de fármacos como las formulaciones lipídicas de anfotericina B, las nuevas equinocandinas (anidulafungina, caspofungina y micafungina) o los azoles de espectro extendido (voriconazol y posaconazol) que son herramientas excelentes contra los hongos[112,113]. Sin embargo, estos antifúngicos pueden no ser tan eficaces contra determinados hongos, pueden también aumentar la toxicidad de otros fármacos que esté recibiendo el paciente o alterar la función del órgano recibido.
1Epidemiología de las micosis invasorasSe estima que los hongos aparecieron hace un millón y medio de años y que las especies fúngicas superan el millón, aunque la gran mayoría son todavía desconocidas[12,62]. Los hongos han sido capaces de adaptarse y sobrevivir en un amplio abanico de nichos ecológicos, sobre todo telúricos, con presencia de tejidos animales y vegetales en descomposición[63,64,121]. Algunos, como los dermatofitos, Malassezia, Candida, los microsporidios o Pneumocystis jiroveci, se han adaptado a la vida parásita en animales y humanos[13,30,31]. A pesar de la ubicuidad de los hongos, la mayoría de las personas en contacto habitual con ellos no presentan ningún tipo de infección fúngica[32]. Sin embargo, está aumentando la población predispuesta a tener una EFI, en la que se incluyen los niños prematuros de bajo peso (por su inmunoinmadurez), las personas de edad avanzada (inmunosenescencia), las personas con enfermedades crónicas o tratadas con terapias médicas intensas o quirúrgicas amplias, los receptores de trasplantes y otros pacientes con inmunodeficiencias[117,128,131]. Se han descrito EFI causadas por más de 100 especies fúngicas diferentes, pero sólo alrededor de 20 son relativamente comunes[55,117]. El conocimiento de la etiología y la epidemiología de las EFI es fundamental para el diagnóstico y el tratamiento más adecuado para cada paciente[3,19,49].
El análisis paradigmático de la mortalidad de causa infecciosa en Estados Unidos, entre 1980 y 1997, publicado por McNeil et al. [82], mostraba que las EFI eran la séptima causa más frecuente. Candida era la cuarta etiología de infección hematológica nosocomial y sólo la superaban los estafilococos coagulasa negativos, Staphylococcus aureus y Enterococcus. Posteriormente, Wisplinghoff et al. [137] estudiaron 24.179 infecciones hematológicas nosocomiales entre 1995 y 2002 en 49 centros médicos dentro del USA Surveillance and Control of Pathogens of Epidemiological Importance Study. El 9,5% de estas infecciones nosocomiales eran micosis, con Candida como el cuarto agente etiológico más frecuente. Sin embargo, este estudio, aunque de gran utilidad, no era extrapolable a otros países y se ha observado una gran variabilidad en la frecuencia de las EFI entre países y hospitales. Estas diferencias están asociadas tanto con características locales de las enfermedades y los factores de riesgo, como con las diferentes praxis médicas.
Los estudios de incidencia en la población general de las EFI han proporcionado datos más exactos. Rees et al. [115] observaron una incidencia anual acumulada de 178 EFI por millón de habitantes en el área de la bahía de San Francisco (California [Estados Unidos]) entre 1992 y 1993. Los patógenos fúngicos implicados más comunes fueron Candida (73 casos por millón), Cryptococcus (65 casos), Aspergillus (12 casos) y los mucorales (2 casos). La alta incidencia de criptococosis era un reflejo del gran número de pacientes infectados por el virus de la inmunodeficiencia humana (VIH) en este período anterior al tratamiento antirretroviral de gran actividad. En un estudio danés más reciente de vigilancia de las fungemias durante 2004-2006, se observó una incidencia importante de EFI, con 1.089 episodios que representaban 104 casos anuales por millón de habitantes[14]. Hay que resaltar que la mayoría de los estudios son sobre candidemias cuya frecuencia varía entre 25 y 50 episodios por millón y año en las publicaciones europeas y entre 60 y 240 en las estadounidenses[10,14,110], pero debemos tener en cuenta que el resto de las EFI pueden cursar con episodios de fungemia infrecuentes y limitados y que los demás hongos, salvo Fusarium, son difíciles de aislar en hemocultivo[38,109,110]. Por esto se estima que las aspergilosis invasoras tienen una incidencia anual de 12-34 infecciones por millón de habitantes en Estados Unidos, pero no se sabe la frecuencia real de otras EFI[117,130].
La mayoría de las EFI son causadas por Candida albicans y otras especies de Candida, sobre todo en RTOS. Sin embargo, la epidemiología de las EFI está en evolución continua y se observa una disminución de las candidiasis invasoras por la mejora en su diagnóstico y profilaxis. Aspergillus fumigatus es cada vez más prevalente en RPHP y, dentro de los RTOS, las aspergilosis invasoras son más frecuentes que las candidiasis en pacientes con trasplante pulmonar[88,89]. Las EFI causadas por Cryptococcus, Fusarium, Paecilomyces, Pneumocystis, Rhodotorula, Saccharomyces, Scedosporium, Trichosporon, hongos endémicos, mucorales o microsporidios son mucho menos frecuentes, pero la mortalidad es mayor, bien porque se realiza un diagnóstico de certeza tardío, el tratamiento se instaura cuando los daños orgánicos son irreversibles, o porque este tratamiento no es suficientemente eficaz[16,24,65,71,72,75,81,84,87,116,119,129].
Neofytos et al. [88] estudiaron la epidemiología y la evolución de las EFI en 429 RTOS adultos de 17 centros norteamericanos de trasplantes, que presentaron 515 episodios de micosis invasora. La mayoría de las infecciones estaban causadas por Candida (59%), seguidas de Aspergillus (24,8%), Cryptococcus (7%) y otros hongos (5,8%). En los receptores de pulmón, las aspergilosis invasoras eran las micosis más frecuentes y, en más de la mitad de los casos, ocurrían un año después de realizarse el trasplante. La supervivencia global de los pacientes había mejorado en relación con la observada en los registros históricos utilizados en la comparación. En este sentido, es importante el estudio de Arthurs et al16, que revisaron las historias clínicas de los pacientes que habían recibido un trasplante pulmonar en la Clínica Mayo durante el período 1990-2005. El 20% de estos pacientes habían presentado una EFI y el 16% de ellos había fallecido por causa de esta infección. La presencia de micosis era un dato predictor significativo de mortalidad.
En el estudio prospectivo realizado entre 2001 y 2006 por la Transplant Associated Infection Surveillance Network en 23 centros estadounidenses, se observaron 1.208 EFI en 1.063 RTOS[94]. Las EFI más comunes fueron las candidiasis (53%), seguidas de las aspergilosis (19%). La incidencia anual fue de 1,95% para las candidiasis y de 0,65% para las aspergilosis. Otras micosis fueron menos frecuentes: criptococosis (8%), hialohifomicosis y feohifomicosis (8%), micosis endémicas (5%) y mucormicosis (2%). El tiempo medio de aparición de las candidiasis era de 103 días, de 184 en las aspergilosis, llegando hasta 575 días después del trasplante en las criptococosis. Las incidencias acumuladas de EFI según el órgano trasplantado fueron 11,6% (intestino delgado), 8,6% (pulmón), 4,7% (hígado), 4% (corazón), 3,4%(páncreas) y 1,3% (riñón).
Richardson and Lass-Flörl[117] han estimado que alrededor de 19.000 de los 99.000 pacientes tratados cada año en Europa de neoplasias hematológicas reciben TPHP o TOS. Alrededor de 6.000 de estos pacientes desarrollan una EFI causada por hongos filamentosos que pueden ser la causa final de su fallecimiento. Sin embargo, las diferencias entre las EFI en RTOS y las observadas en RPHP son importantes, tanto en epidemiología, factores de riesgo, características clínicas y mortalidad. En los RTOS, la incidencia de EFI es aproximadamente del 5-10%, variando según el tipo de trasplante, con una mortalidad atribuida del 25-35%. Las candidiasis son las micosis más frecuentes en RTOS, pero su incidencia se ha reducido en los últimos años hasta el 2% en el caso de las candidiasis invasoras, con una importante variación según el órgano trasplantado. La incidencia de candidiasis es mayor en los trasplantes de algunos órganos abdominales, como hígado, páncreas e intestino. Se ha descrito que, en un porcentaje pequeño de los casos, la EFI puede asociarse a la presencia de hongos, como C. albicans o Apophysomyces elegans, en el órgano trasplantado[7,8].
Entre las hipótesis más plausibles de este cambio epidemiológico destaca la que relaciona el uso profiláctico de antifúngicos con una reducción significativa de las EFI causadas por C. albicans, que sería muy sensible a estos. Además, cuando la profilaxis antifúngica es activa contra otras especies de Candida diferentes de C. albicans y contra las especies más frecuentes de Aspergillus, el espacio ecológico que dejan estas podría ser ocupado por otros hongos, como los mucorales, que podrían causar ocasionalmente EFI de brecha. De hecho se está observando la descripción de EFI causadas por especies muy diversas de hongos filamentosos y levaduriformes que no pertenecen a los géneros Aspergillus y Candida. Los cambios introducidos en los procedimientos médico-quirúrgicos empleados en los trasplantes de órganos, como las diferentes fuentes de obtención de células madre, las mejoras quirúrgicas o las diferentes pautas de inmunosupresión empleadas, también desempeñan un papel importante en este cambio epidemiológico[12,61,76,106,138].
Hay diferencias apreciables entre los RTOS y los RPHP, tanto en su epidemiología, factores de riesgo, características clínicas, pautas de terapia empírica y mortalidad. Alrededor del 15% de los RTPH alogénicos presentan EFI después del trasplante, con una mortalidad cruda de alrededor del 80%. Las EFI causadas por hongos filamentosos tienen una mortalidad elevada, a pesar de los progresos alcanzados en el diagnóstico y el tratamiento de estas enfermedades. La mortalidad cruda varía entre amplios márgenes (25-80%) y llega a ser devastadora (100%) en grupos concretos de pacientes, como los RPHP con neutropenia persistente y aspergilosis del sistema nervioso central[11,73,76]. En RTOS la incidencia es aproximadamente del 5-10%, dependiendo del tipo de trasplante, y la mortalidad atribuible alrededor del 35%. La mortalidad atribuida directamente a las EFI sería del 25-35% para las candidiasis invasoras, 30-100% para las aspergilosis invasoras, 40-100% para las fusariosis, 40-100% para las escedosporiosis, y 60-100% para las mucormicosis[70,88–90,92,119,122,126,129].
La aspergilosis es una micosis con un amplio espectro de presentaciones clínicas que varían desde cuadros alérgicos en personas atópicas, pasando por aspergilomas, hasta aspergilosis invasora dependiendo del estado inmunitario del paciente. La aspergilosis invasora se presenta en pacientes con inmunodeficiencia importante en los que suele progresar con rapidez y asociarse a una mortalidad elevada[124]. La población de pacientes predispuestos a tener una aspergilosis invasora está en aumento y se compone de personas con neutropenia prolongada, infección avanzada por el VIH, con inmunodeficiencias hereditarias o receptores de TPHP o trasplante de pulmón.
En dos estudios recientes de la Prospective Antifungal Therapy Alliance[88,89], se ha mostrado que la aspergilosis invasora era una de las EFI más común en RPHP adultos (59,2% de los casos) y RTOS adultos (24,8%). Sin embargo, se ha observado una gran variablilidad en la incidencia de aspergilosis invasora entre centros médicos, debido a las diferentes poblaciones de pacientes, metodologías diagnósticas, tratamientos profilácticos y seguimiento de los pacientes después del trasplante[67,74,125]. Además, se observan muy pocas aspergilosis invasoras en los trasplantes de riñón y páncreas (0,4-5%), son más frecuentes en los trasplantes de corazón e hígado (1-8% y 1-14%, respectivamente), y aún más en los receptores de pulmón (6-16%)[34,35,128]. En un programa prospectivo de vigilancia que incluyó 110 RTOS de 19 centros norteamericanos[86,128], la incidencia acumulada de aspergilosis invasora a los 12 meses fue del 2,4% después del trasplante de pulmón, del 0,8% después del cardíaco, del 0,3% después del hepático y del 0,1% después del renal. En los pacientes pediátricos con factores o enfermedades predisponentes, la frecuencia de aspergilosis invasora parece estar entre el 4 y el 10%, con una mortalidad cruda asociada del 40-95%. La incidencia de aspergilosis invasora, con datos del año 2000, era de 0,4% en niños con inmunodeficiencias en Estados Unidos, con una mortalidad intrahospitalaria global del 18%[28,139]. La mayoría de estas aspergilosis eran pulmonares invasoras y el 30% con riesgo de diseminación al sistema nervioso central[57]. Baddley et al. [20] estudiaron los factores que se asociaban con la muerte de 642 receptores de trasplantes con aspergilosis invasora probada o probable entre pacientes de 23 hospitales estadounidenses, entre marzo de 2001 y octubre de 2005, como parte de la Transplant Associated Infection Surveillance Network. De estos, 317 (49,4%) murieron en el período máximo de estudio (12 semanas). La mortalidad era mayor en RPHP (57,5%) que en RTOS (34,4%). En estos últimos, los indicadores independientes del mal pronóstico fueron insuficiencia hepática, malnutrición y aspergilosis cerebral. El uso de prednisona se asociaba con un riesgo menor de muerte en RTOS que contrastaba con la asociación del empleo de este fármaco con un riesgo mayor de muerte en RPHP. En los RPHP se encontró que también la neutropenia y las insuficiencias hepática y renal eran indicadores de mal pronóstico. En este estudio, la administración de anfotericina B como parte de la terapia inicial también se asoció a un riesgo mayor de muerte. La ruta de adquisición de Aspergillus suele ser respiratoria con colonización de senos paranasales y vías respiratorias inferiores. Se estima que alrededor de la mitad de los receptores de trasplante de pulmón son colonizados por Aspergillus y que los pacientes colonizados en los primeros 6 meses después del trasplante tiene una probabilidad once veces mayor de presentar una aspergilosis invasora que los no colonizados[54,79]. Bonatti et al. [26] describieron una incidencia, en un único hospital, del 0,6% de aspergilosis pulmonar invasora en 143 RTOS (86 con trasplante hepático, 50 con renal, 6 con trasplante de páncreas y 1 con trasplante de pulmón). Sin embargo, la aspergilosis puede presentarse como sinusitis invasora, traqueobronquitis o absceso pulmonar y diseminarse a cualquier órgano, como bazo, hígado, hueso, ojo, piel y riñón. Es importante el tropismo de Aspergillus por el sistema nervioso central, que se observa en el 10-20% de los casos de aspergilosis diseminada67. Los receptores tardíos de un nuevo trasplante hepático tienen una mayor probabilidad de presentar una aspergilosis cerebral[127,128]. El signo más relevante de la aspergilosis pulmonar invasora es la angioinvasión, que puede causar trombosis, infartos y necrosis del parénquima pulmonar circundante e incluso provocar hemorragias[56,117].
Davis et al. [40] describieron 235 casos de criptococosis dentro del estudio de la Prospective Antifungal Therapy Alliance. De estos, 52 pacientes eran RTOS, 107 tenían infección por el VIH y 76 ni eran receptores de trasplante ni presentaban una infección por el VIH. Se observó una meningitis criptocócica en el 48% de los RTOS y en el 84% de los infectados por el VIH, con una mortalidad del 22% entre los primeros y del 16% entre los últimos. La distribución geográfica de la criptococosis en RTOS es muy variable. En el estudio de Osawa et al. [91] se observó que en 120 pacientes con criptocososis la forma pulmonar era la más frecuente (64%), seguida por la meníngea (51%) y la cutánea (15%). Sin embargo, la presentación cutánea era la más probable en pacientes del sur de Estados Unidos. Estas influencias geoclimáticas también han sido mencionadas por Panackal et al. [93] en los casos de aspergilosis invasora en RPHP estadounidenses.
2Diagnóstico micológico y tratamientoEs fundamental desarrollar estrategias diagnósticas y terapéu-ticas que reduzcan de forma significativa la mortalidad atribuida a las EFI. Son puntos fundamentales alcanzar un diagnóstico tempra-no y certero[19], y dilucidar la necesidad de instaurar los tratamientos profilácticos, empíricos, anticipados (en referencia a biomarcadores diagnósticos) o dirigidos (basados en los factores predisponentes y en claves clínicas compatibles) más eficaces y tempranos posibles en pacientes con elevado riesgo de presentar una EFI[3,49,120].
Las definiciones revisadas de la European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group y el National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG)[41] proponen tres grados de certeza diag-nóstica en las EFI: probada, probable y posible (esta última sólo apli-cable en RPHP). El diagnóstico de EFI probada exige un diagnóstico anatomo-patológico o el aislamiento del hongo patógeno de mues-tras clínicas habitualmente estériles. En el caso de la EFI probable los criterios implican tres situaciones: los factores del huésped, la sintomatología y los signos radiológicos que apunten a una mico-sis, y las evidencias microbiológicas que los apoyen, como cultivos o biomarcadores.
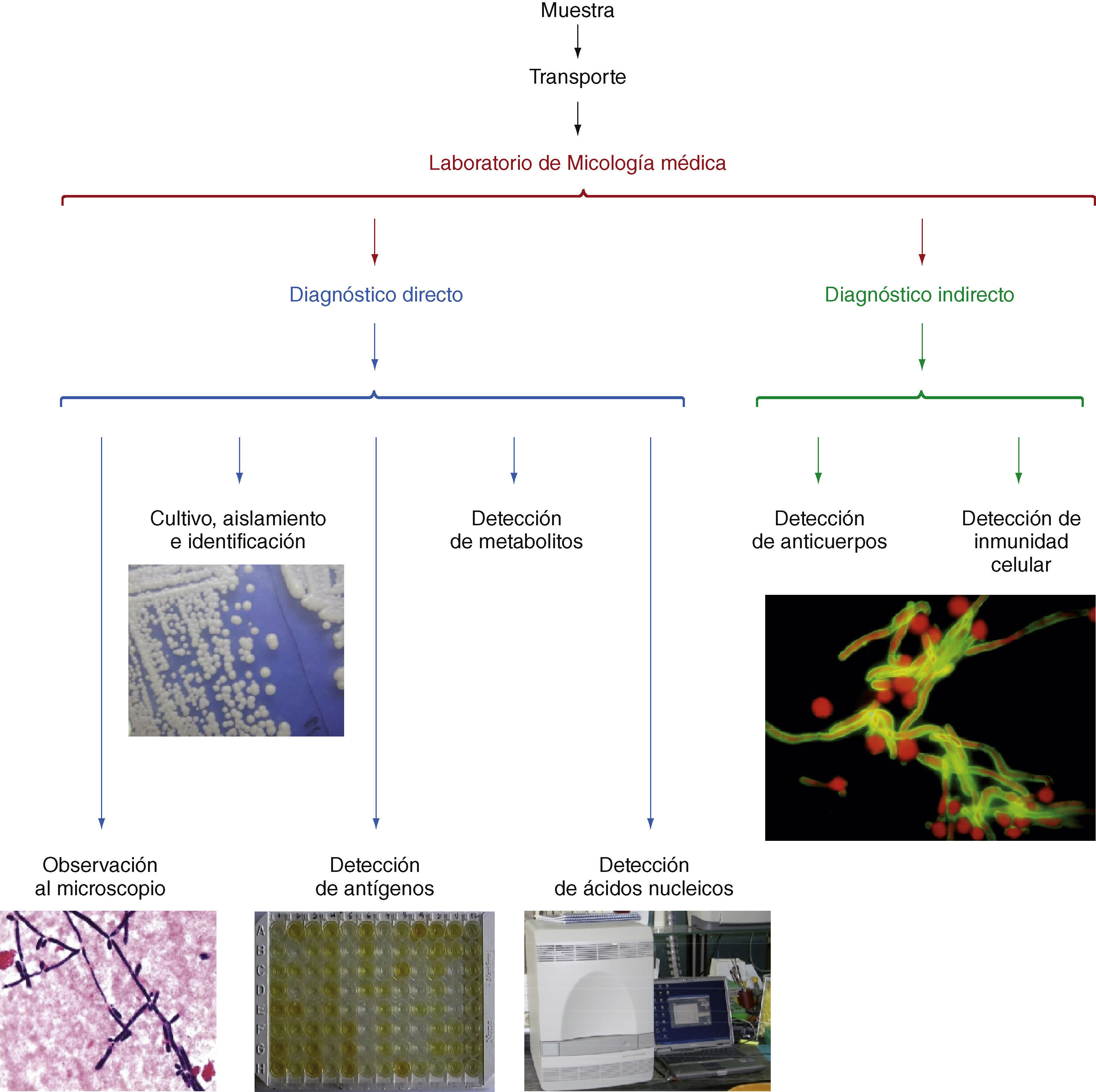
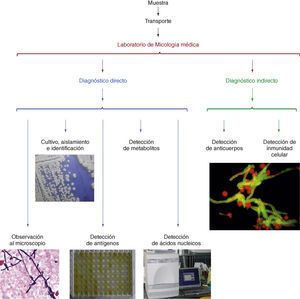
El diagnóstico micológico se basa en la observación de los pató-genos o sus componentes antigénicos, nucleicos o metabólicos en las muestras clínicas (Fig. 1)[66] y su aislamiento en medios de culti-vo adecuados. La baja sensibilidad diagnóstica de la observación al microscopio de elementos fúngicos en las muestras clínicas puede mejorarse con el empleo de tinciones más específicas con calcoflúor, metenamina de plata o ácido peryódico de Schiff; o con anticuerpos policlonales o monoclonales marcados con fluoresceína o con sondas FISH[30,109]. El aislamiento del hongo en cultivo puro permite realizar su identificación mediante una serie de pruebas morfológicas, bioquí-micas, inmunológicas o moleculares (Fig. 2) y estudiar la sensibilidad in vitro del hongo a los antifúngicos cuando esto sea necesario[22,23,109].
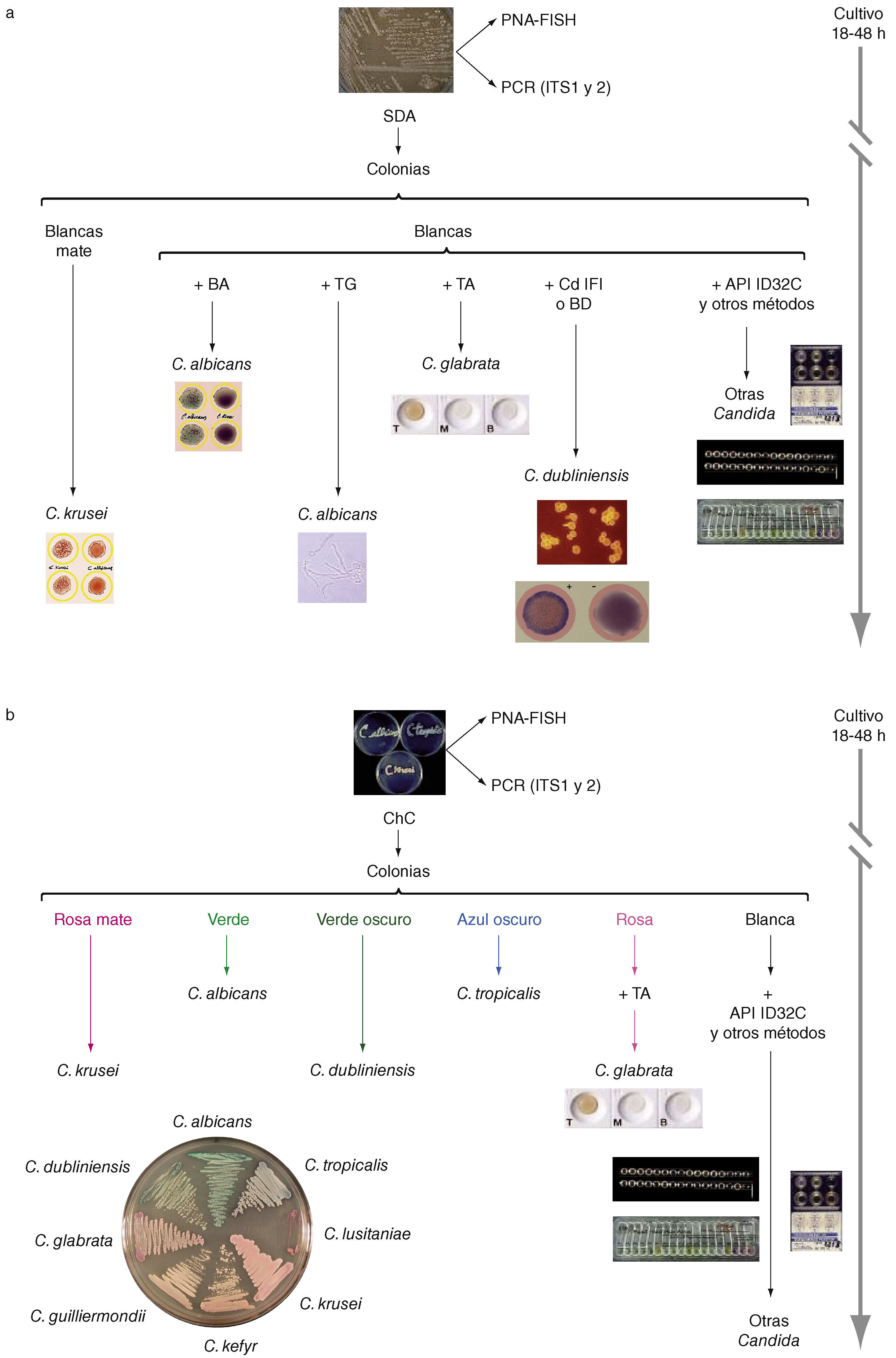
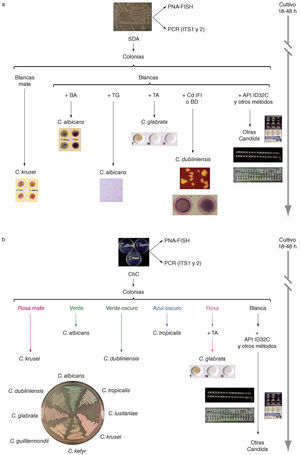
Identificación de las diferentes especies de Candida a partir de su aislamiento en agar glucosado de Sabouraud (a) o en un medio cromógeno como CHROMagar Candida (b). BA: Bichro-latex Albicans; BD: Bichro-Dubli; CdIFi: inmunofluorescencia indirecta con anticuerpos anti-Candida dubliniensis; ChC: cultivo en CHROMagar Candida; PNA-FISH: hibridación in situ fluorescente con sondas de ácido nucleico peptídico; SDA: cultivo en agar glucosado de Sabourand; TA: Trehalosa (GLABRATA RTT); T6: tubo germinal. Diseño gráfico e ilustraciones realizadas por Tania Quindós González.
El hemocultivo es el método de referencia para las EFI disemina-das aunque su sensibilidad es baja (alrededor del 50% en el caso de las candidiasis invasoras y menos del 20% en otras micosis)19. El cultivo de sangre se realiza habitualmente en medios líquidos en aparatos automáticos o semiautomáticos, aunque en ocasiones pueden ser necesarias técnicas más complejas de lisis-centrifugación[100]. Otros, como el cultivo de tejidos obtenidos por biopsia, el de líquido cefa-lorraquídeo y de otras muestras clínicas habitualmente estériles, o el del lavado broncoalveolar, pueden aportar una información diagnóstica esencial[19,109]. Los hongos crecen bien en la mayoría de los medios de cultivo, pero suele utilizarse el agar glucosado de Sabouraud con o sin antibacterianos, como medio selectivo. Algunos medios de cultivo contienen cromógenos que permiten realizar una identificación pre-suntiva bastante certera de Candida o Cryptococcus[42,44,123]. En determi-nados casos, puede ser necesaria la utilización de medios específicos para el aislamiento de hongos exigentes, como Malassezia.
Los métodos de diagnóstico alternativos al cultivo, como la detección de determinadas moléculas metabólicas, antigénicas o ácidos
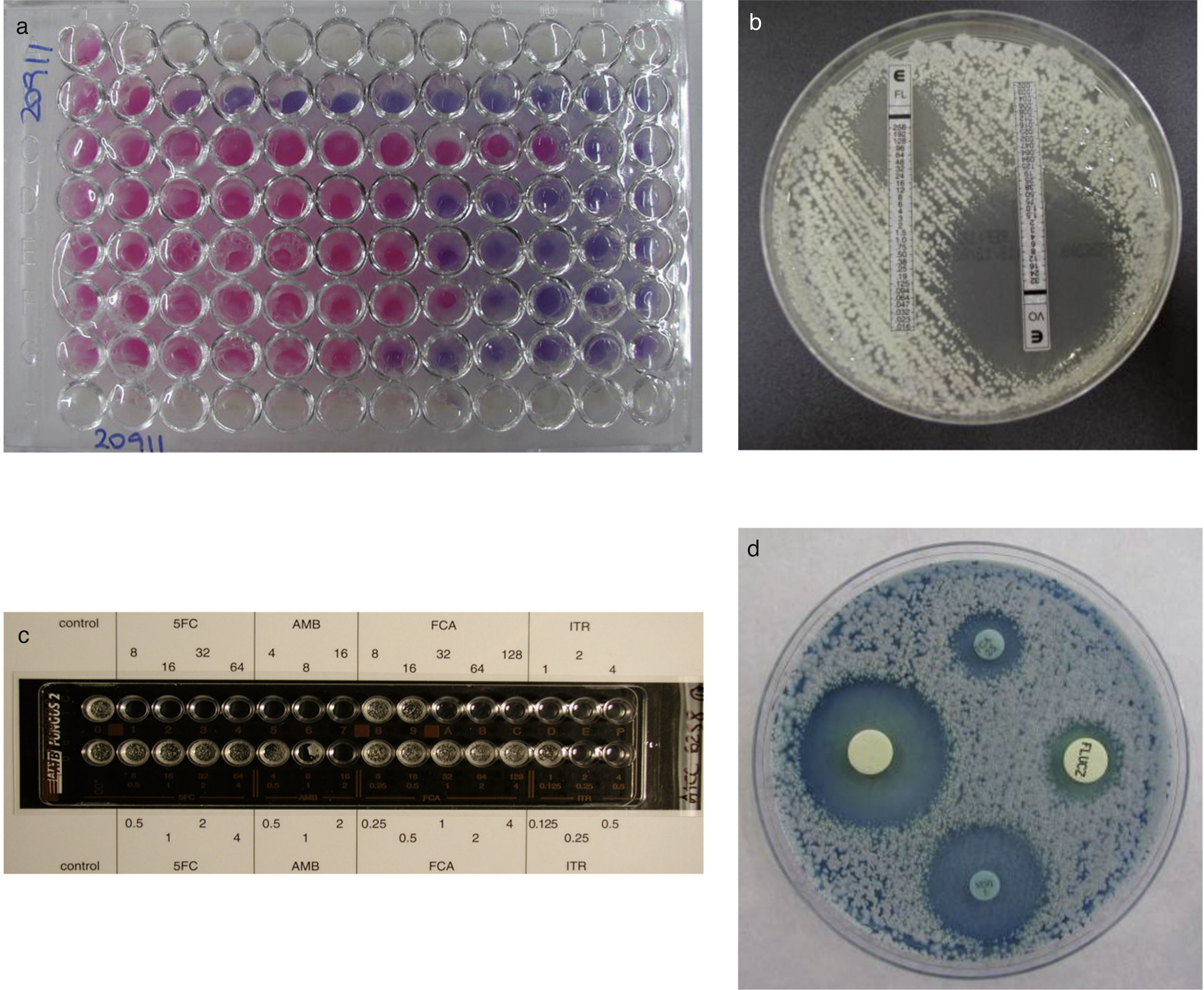
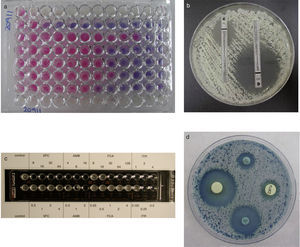
nucleicos, como biomarcadores de EFI, se consideran útiles, aunque la mayoría de los estudios están realizados en RPHP y hay pocos en RTOS[107]. Entre los biomarcadores que más fiabilidad diagnóstica han alcanzado destacan la detección de 1→3-β-D-glucano, que es un marcador panfúngico (con la excepción de Cryptococcus y los mucorales), la de glucuroxilomanano en la criptococosis meníngea, y la de galactomanano en la aspergilosis invasora[59,97–99]. Fortún et al. [50] estudiaron la utilidad diagnóstica de la detección de galactomanano en receptores de trasplante de hígado, y encontraron un importante número de falsos positivos. La administración de ampicilina como profilaxis antibacteriana durante los primeros días después del trasplante era una de las causas para obtener un falso positivo. Alexander et al. [9] observaron que la detección de 1→3-β-D-glucano en 756 sueros de 73 receptores de trasplante de pulmón (14 con EFI y 59 sin ella) tenía un alto valor predictivo negativo, pero su bajo valor predictivo positivo limitaba su utilidad diagnóstica. Hay menos experiencia con otros biomarcadores, como manano y anticuerpos antimanano, anticuerpos antimicelio o la detección de ADN, que pueden detectarse por separado o de forma combinada[83,95,101,134]. Algunos métodos comercializados, como el Light- Cycler® SeptiFast Test (Roch [Estados Unidos]), permiten la detección de ADN de varios patógenos incluidas algunas especies de Aspergillus y Candida[27,133,135]. Sin embargo, el diagnóstico temprano de las EFI causadas por hongos menos comunes, como los mucorales, Scedosporium o Fusarium, plantea problemas más importantes[48]. La estandarización de los métodos de estudio de la sensibilidad in vitro a los antifúngicos (EUCAST [European Committee on Antimicrobial Susceptibility Testing] y CLSI [Clinical Laboratory Standard Institute]) ha permitido conocer el perfil de sensibilidad de muchos aislamientos clínicos a los antifúngicos clásicos y a los más novedosos[15,36,37,45,46,103,104]. Se han establecido puntos de corte para los aislamientos de Candida, pero aunque todavía no se han propuesto para otras especies de levaduras y para los hongos filamentosos, se recomienda no tratar al paciente o ser cautos con el empleo de fármacos que no sean activos in vitro contra la especie causante de la EFI[19,105,118]. También se han desarrollado varios métodos comerciales y de difusión en agar (Fig. 3) que son más prácticos para los laboratorios clínicos[33,43,114].
La profilaxis y el tratamiento de las EFI en los RTOS son temas en continuo debate[39,120]. En este mismo número se describen diferentes aproximaciones al diagnóstico y al tratamiento de algunas situaciones clínicas problemáticas de EFI en RTOS[47,80,108,132]. En la profilaxis, parece recomendable el empleo de fluconazol o, como alternativa, una nueva formulación de anfotericina B durante la primera y segunda semanas postrasplante en los pacientes que han recibido un trasplante hepático, pancreático o de intestino[3,95,96,120]. Las equinocandinas serían una buena alternativa en los pacientes con insuficiencia renal, diálisis, trasplante urgente o retrasplante[3,51]. En la prevención de las EFI por hongos filamentosos son fundamentales las medidas médico-quirúrgicas para un control adecuado de la inmunosupresión y de la presencia de determinados hongos en el ambiente[120]. Además, el uso de itraconazol, voriconazol o posaconazol, se ha propuesto en receptores de pulmón para prevenir la aspergilosis invasora en otras EFI por hongos filamentosos[29,68]. Cada vez tienen más respaldo las medidas de profilaxis selectiva que se basan en un análisis adecuado de los riesgos de un paciente concreto para tener una EFI49. El tratamiento antifúngico de las candidiasis invasoras en RTOS sigue las pautas recomendadas para estas infecciones en otros pacientes[3,95]. El uso de fluconazol está recomendado en RTOS sin neutropenia ni antecedentes de uso previo de antifúngicos azólicos cuando se desconoce la especie que causa la infección. En pacientes neutropénicos y/o que han sido tratados previamente con azoles como profilaxis, es preferible bien el uso de una equinocandina o de una de las nuevas formulaciones de anfotericina B, o bien de voriconazol[2,3]. Si se conoce la especie de Candida que provoca la EFI, es importante realizar un estudio de la sensibilidad in vitro del aislamiento a los antifúngicos. Mientras se conoce la sensibilidad, son útiles el fluconazol cuando la causa es Candida parapsilosis, una equinocandina cuando es Candida glabrata, y el voriconazol o una equinocandina cuando es Candida krusei[52,53]. Una vez conocida la sensibilidad del aislamiento, debe utilizarse el antifúngico que sea más activo, que menos interactúe con otros fármacos que recibe el paciente y le cause la menor toxicidad posible.
Más complicado resulta el abordaje terapéutico de las EFI causadas por otros hongos, por lo que el conocimiento de la sensibilidad in vitro es primordial. El tratamiento de las criptococosis invasoras (diseminada, cerebral o pulmonar) se realiza con las nuevas formulaciones de anfotericina B en la primera fase del tratamiento (o de inducción) que debe durar entre 4 y 6 semanas[102]. El tratamiento de mantenimiento se realiza con fluconazol durante varios meses. El fluconazol puede ser la primera elección terapéutica cuando hay una neumonía criptocócica sin diseminación a otros órganos3. El tratamiento de las EFI causadas por hongos filamentosos es un reto importante para el médico y debe tenerse en cuenta la diferencia de sensibilidad a los antifúngicos entre Aspergillus y otros hongos filamentosos60. También es muy importante la individualización de la terapia según la enfermedad subyacente y los factores de riesgo que concurren, el tipo de trasplante y órgano trasplantado, la inmunosupresión realizada, la presentación clínica de la micosis y el hongo implicado[49]. El tratamiento de las aspergilosis invasoras se basa en el uso de voriconazol, reservando la anfotericina B liposómica como alternativa para los pacientes con riesgo de toxicidad hepática, intolerancia o interacciones farmacológicas[49,136]. También puede utilizarse anfotericina B en nebulización para el tratamiento de la aspergilosis invasora pulmonar[69,85]. Es aconsejable que se evalúen de forma periódica las concentraciones séricas de voriconazol. El tratamiento debe mantenerse entre 6 y 12 semanas una vez desaparecidos los signos y los síntomas de aspergilosis invasora, aunque puede ser recomendable el mantenimiento del tratamiento con voriconazol oral hasta el sexto mes[49]. Otros antifúngicos, como las diferentes formulaciones lipídicas de anfotericina B, la anidulafungina, la caspofungina, el itraconazol, la micafungina o el posaconazol, pueden ser útiles para el tratamiento de rescate en aquellos pacientes que toleran mal o no responden adecuadamente al tratamiento inicial2. Hay que tener en cuenta que Aspergillus fumigatus es la especie que causa alrededor de la mitad de los casos de aspergilosis invasora, se-guida por Aspergillus flavus (9%), Aspergillus niger (7%) y Aspergillus terreus (5%). Aunque un número reducido de aislamientos clínicos de A. fumigatus son resistentes a los azoles[1,21,60] y los de A. terreus muestran resistencia clínica a la anfotericina B[25,77,78], la mayoría dev los aislamientos clínicos son sensibles a los antifúngicos[21,60]. Se ha descrito una sensibilidad menor a los antifúngicos en otras especies, como Aspergillus calidoustus, Aspergillus glaucus, Aspergillus lentulus y Aspergillus nidulans[5,111–113]. Aunque estos datos pueden ser preocupantes, existe la certeza de que el pronóstico de la aspergilosis invasora depende más del estado real del sistema inmune del paciente y otros factores clínicos concurrentes que de la virulencia o resistencia de las diferentes especies de Aspergillus[117].
Las dificultades son mayores en el tratamiento de las escedosporiasis, fusariosis y mucormicosis[4,6]. La cirugía para eliminar tejidos necróticos y la corrección de la inmunosupresión son herramientas terapéuticas esenciales, sobre todo para tratar las mucormicosis. La escedosporiasis puede estar producida por diferentes especies del complejo Scedosporium-Pseudallescheria. Mientras que Scedosporium prolificans es resistente in vitro a casi todos los antifúngicos, Scedosporium apiospermum, Scedosporium aurantiacum y otras especies de Scedosporium, muestran una sensibilidad variable[58,87,119]. En las EFI producidas por S. apiospermum y S. aurantiacum, el fármaco más recomendado es el voriconazol. Las fusariosis se tratan con dosis altas de anfotericina B o voriconazol. Finalmente, el tratamiento antifúngico de las mucormicosis se basa en el uso de formulaciones lipídicas de anfotericina B o de posaconazol o de ambas en combinación, como alternativas[17,49].
La disminución de la mortalidad y de las complicaciones causadas por las EFI en los RTOS es uno de los objetivos médicos principales. Un buen conocimiento de la etiología y la epidemiología de estas infecciones es la base fundamental para establecer un diagnóstico correcto que permita realizar el tratamiento más adecuado para conseguir la curación del paciente y mantener o mejorar su calidad y esperanza de vida.
Conflicto de interesesEn los últimos 5 años, el autor ha recibido fondos de investigación de la Consejería de Educación, Universidades e Investigación y del Departamento de Industria, Comercio y Turismo del Gobierno Vasco-Eusko Jaurlaritza, del Fondo de Investigación Sanitaria (FIS), de la Universidad del País Vasco-Euskal Herriko Unibertsitatea, de Astellas Pharma y de Pfizer. Además ha recibido honorarios por ponencias de Astellas Pharma y Pfizer.
El trabajo de investigación del autor ha sido parcialmente subven-cionado por los proyectos GIC07 123-IT-222 (Departamento de Edu-cación, Universidades e Investigación, Gobierno Vasco), S-PE08UN35 y S-PR09UN01 (Saiotek 2008 y 2009, Departamento de Industria, Comercio y Turismo, Gobierno Vasco) y PI061895/2006 (Fondo de Investigación Sanitaria del Ministerio de Sanidad y Consumo de Es-paña).