Las onicomicosis representan aproximadamente el 50% de las onicopatías, pueden ser causadas por dermatofitos, levaduras u hongos filamentosos no dermatofitos.
Objetivos y metodologíaSe realizó un estudio multicéntrico para conocer la prevalencia de onicomicosis, los agentes causales y las formas clínicas más frecuentes. Se evaluaron todas las muestras de uñas de manos y pies durante el período de un año en 9 centros asistenciales.
ResultadosSe procesaron 5.961 muestras, el 82,3% correspondieron a uñas de pies y el 17,7% a uñas de manos. La edad promedio de los pacientes fue 49,7 años y el 66% perteneció al sexo femenino. Los exámenes directos fueron positivos en el 61% de los casos. En adultos, las uñas de los pies presentaron un 61,2% de resultados positivos en el examen directo, y los cultivos fueron positivos en un 43,7%. Los hongos predominantes fueron los dermatofitos (82,8%) y la forma clínica más frecuente fue la distal subungueal. En uñas de manos la positividad del examen directo fue del 59,8% y los cultivos fueron positivos en un 52,9%; los hongos predominantes fueron de tipo levaduriforme y la forma clínica más frecuente fue la onicolisis.
ConclusionesSe encontró un 61% de positividad en el examen directo, valor superior al de otras investigaciones. En las uñas de los pies prevalecieron los dermatofitos en ambos sexos, y en uñas de manos las levaduras, en el sexo femenino, y dermatofitos, en el masculino. El 4,8% de los aislamientos de uñas de pies y el 2,05% de los de uñas de manos fueron de hongos filamentosos no dermatofíticos.
Onychomycosis accounts for up to 50% of all nail disorders. They can be caused by: yeasts, dermatophytes and non-dermatophyte moulds.
Objectives and methodsA multicentre study designed to determine the prevalence, mycological test results, aetiological agents, and clinical presentation of onychomycosis was carried out. All fingernail and toenail samples taken during a one year period at 9 diagnostic centres were included.
ResultsA total of 5,961 samples were analysed, of which 82.3% were from toenails and 17.7% from fingernails. The mean age of the patients was 49.7 years, and 66% were females. Direct microscopic examination was positive in 61% of the samples. In adults, 61.2% of toenails were positive using potassium hydroxide (KOH), and 43.7% were positive in cultures. The prevailing aetiological agents belong to the dermatophyte group (82.8%), and distal subungual was the most common clinical form. In fingernails, direct examination showed 59.8% positive samples, and cultures were positive in 52.9%. The prevailing agents were yeasts belonging to Candida species, and onycholysis was the most common lesion.
ConclusionsDirect mycological examinations were positive in 61%, a higher value than that found in other series. Dermatophytes were prevalent in toenails of both sexes, and in finger nails yeast were prevalent in females, and dermatophytes in males. Non-dermatophyte moulds corresponded to 4.8% of toenail and 2.05% of fingernails isolates.
El término onicomicosis se utiliza para referirse a las infecciones de las uñas ocasionadas por hongos levaduriformes o filamentosos30,51,52. Se estima que afectan al 5-20% de la población mundial5,10,15,19,29,30,50,51. Es una enfermedad común en los adultos6,50 y su prevalencia está relacionada con factores predisponentes, distintas patologías de base, clase social, ocupación, edad y clima. Entre las patologías de base más frecuentes se encuentran la diabetes, la psoriasis, inmunodeficiencia, etc.6,13,15,22,24,34,39,53.
Los dermatofitos son la causa más frecuente de onicomicosis y se denomina a esta infección tinea unguium. El agente etiológico más común es Trichophyton rubrum1,3,12,14,19,51,52. Existen diferentes formas clínicas de onicomicosis8,14,28: distal y lateral subungueal, proximal profunda, blanca superficial5,7, invasión endonix, distrofia ungueal total y onicolisis5; la primera de ellas es la más frecuente3,19.
Los hongos del género Candida se pueden aislar de lesiones de las uñas de las manos donde se observa inflamación periungueal dolorosa, denominada paroniquia o perionixis, así como en las onicolisis, o también como colonizante en otro tipo de lesiones3,14,29,30.
Otros hongos filamentosos considerados agentes etiológicos oportunistas, tales como Fusarium spp., Aspergillus spp., Scopulariopsis spp. y Acremonium spp., también pueden causar esta patología entre 1,5 y 12% de los casos14,16,20,38,51.
Debido a las características clínicas similares a otras alteraciones ungueales de origen no infeccioso, como la psoriasis, las onicodistrofias traumáticas o vasculares, el liquen, etc., es importante realizar el diagnóstico diferencial, en el que el examen micológico es imprescindible12,52.
Los objetivos del presente trabajo fueron evaluar la prevalencia de onicomicosis en 9 centros de diagnóstico, analizar los resultados de los estudios micológicos, conocer los agentes causales y las formas clínicas más frecuentes y analizar la presencia de diferencias entre formas clínicas y agentes etiológicos en uñas de manos (UM) y uñas de pies (UP) y su relación con el sexo de los pacientes.
Materiales y métodosLa subcomisión de Micología de la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica (SADEBAC) convocó a 9 laboratorios de Micología para realizar este estudio: 6 pertenecientes a la Ciudad de Buenos Aires (Hospital Alemán, Hospital Británico, Hospital General de Agudos J. A. Fernández, Hospital Italiano, Hospital de Enfermedades Infecciosas F. J. Muñiz, CEMIC), 2 de la provincia de Buenos Aires (Hospital Posadas y Laboratorio Mario Bianchi) y uno de la provincia de Chaco (Universidad del Nordeste). En estos centros de diagnóstico se incluyeron todos los pacientes que concurrieron para estudio micológico de uñas durante un año (marzo de 2009 a febrero de 2010).
Se confeccionó una planilla donde se asentaron los datos y antecedentes del paciente, así como las características de las lesiones, que se definieron de la siguiente manera: a) distal o lateral subungueal (DSU) cuando el ataque comenzaba por el borde libre o el borde lateral de la uña; b) blanco superficial (BS) cuando las lesiones se presentaban como manchas blancas en la cara externa de la uña; c) proximal profunda (PP) cuando la lesión se localizaba en la región proximal pero abarcaba las capas ungueales más profundas; d) distrofia ungueal total (DUT) cuando se observó la destrucción completa de la tabla ungueal; e) onicolisis (OL) correspondió al despegamiento de la uña del lecho subungueal; f) paroniquia (PQ) cuando se observó la inflamación del reborde de la uña; g) formas combinadas (FC), que correspondieron a aquellas uñas donde se observó más de una lesión de las antes mencionadas, y h) otras lesiones cuando el aspecto de la uña no correspondía a ninguna de las anteriores formas clínicas y presentaban alteraciones como cambio de color, estrías, onicosquisia, etc.
Los exámenes microscópicos directos se realizaron con KOH al 20-40% con o sin calcoflúor. Se distinguieron hifas tabicadas compatibles con dermatofitos o con otros hongos filamentosos no dermatofitos (H) y levaduras con o sin seudohifas (LEV). Los cultivos se realizaron en medios de agar: Sabouraud-miel, lactrimel de Borelli, Sabouraud con cicloheximida con o sin rojo de fenol como indicador, según los procedimientos de cada centro participante; fueron incubados a 28°C durante 3 semanas42.
Los hongos filamentosos se identificaron por sus características macro y micromorfológicas1,3,9,43,44, mientras que las levaduras se tipificaron mediante desarrollo en agar cromogénico, las características micromorfológicas en agar harina de maíz con Tween 80 y la producción de tubos germinativos y clamidoconidios en agar leche31,32,42.
Se consideraron onicomicosis por dermatofitos aquellas que presentaron examen microscópico directo con presencia de hifas o cultivos positivos para estos microorganismos, y por hongos filamentosos no dermatofitos (HFND) solamente cuando se aisló la misma especie fúngica en 2 muestras de uñas con examen directo positivo.
El análisis estadístico de los datos se realizó mediante las pruebas de Chi cuadrado y de proporciones utilizando el paquete estadístico SPSS para Windows, versión 15.0
ResultadosSe analizaron un total de 5.961 muestras provenientes de 5.663 pacientes; 4.905 de UP y 1.056 de UM. Doscientos noventa y ocho pacientes presentaron lesiones en pies y manos simultáneamente.
De las UP, 3.198 pertenecían a pacientes del sexo femenino (66%) y 1.707 del sexo masculino, mientras que en las UM se obtuvieron 775 (73%) de mujeres y 281 de varones.
Los pacientes tenían entre 5 meses y 94 años, con un promedio de edad de 49,69 años. El 96% de los pacientes tenía más de 18 años, y no se observaron diferencias en cuanto a la edad en los pacientes con lesiones en UM respecto de los pacientes con lesiones en UP.
Las muestras de pacientes pediátricos (≤18 años) fueron 232: 184 de UP y 48 de UM, correspondiendo 127 al sexo femenino y 105 al masculino.
Los exámenes directos fueron negativos en 2.327 (39,04%) muestras y positivos en 3.634 (60,96%); de ellos, en 2.905 se observaron hifas hialinas tabicadas, en 662 levaduras y en 67 casos levaduras más hifas.
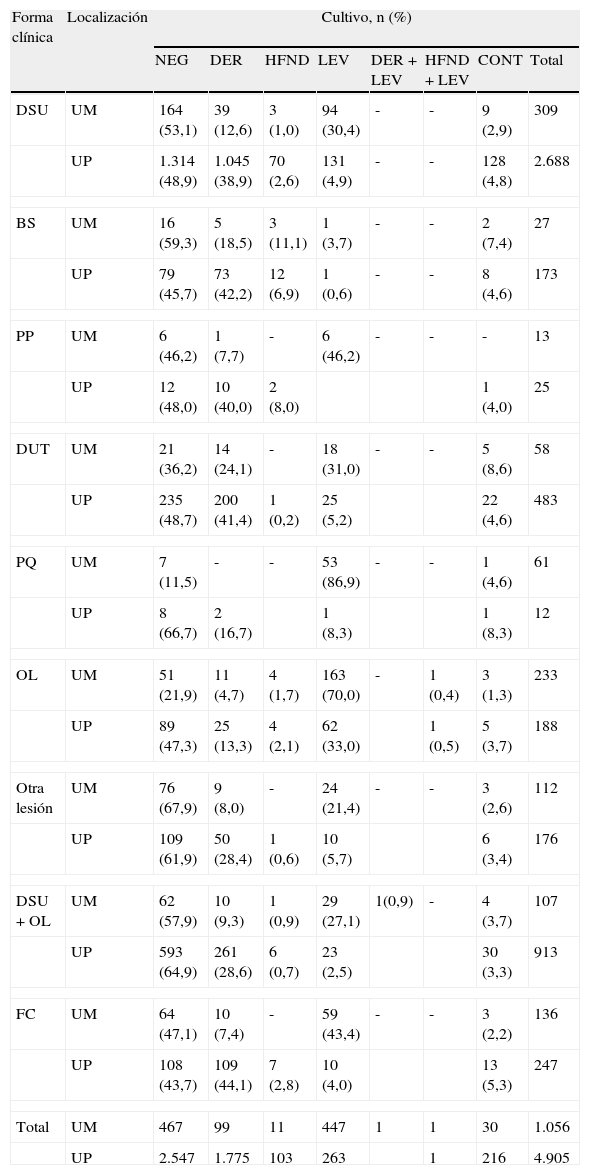
Las formas clínicas que presentaron los pacientes en UM y UP diferenciadas por sexo se observan en la tabla 1. En UM las 2 formas clínicas principales fueron la DSU y la OL. En las mujeres se observó una proporción mayor de PQ (p<0,05) y OL (p<0,01) respecto a los varones, mientras en el sexo masculino predominó la forma DSU y hubo un porcentaje significativamente mayor (p<0,01) de DUT. Se debe tener en cuenta también el elevado porcentaje de formas combinadas, ya sea DSU+OL u otras. En UP la forma predominante fue la DSU en más del 50% de los casos. Como ya se ha señalado, la forma clínica «otras lesiones» corresponde a características de las uñas tales como pigmentación, onicosquisia, descamación, entre otras, que no pudieron ser incluidas dentro de las formas clínicas clásicas.
Formas clínicas de las 5.961 lesiones ungueales según localización y sexo
| Forma clínica | Uñas de manos | Uñas de pies | ||||
| M | F | Total | M | F | Total | |
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| DSU | 100 (35,6) | 209 (27,0) | 309 (29,2) | 882 (51,7) | 1.806 (56,5)a | 2.688 (54,8) |
| BS | 11 (3,9) | 16 (2,1) | 27 (2,6) | 53 (3,1) | 120 (3,8) | 173 (3,5) |
| PP | 4 (1,4) | 9 (1,2) | 13 (1,2) | 12 (0,7) | 13 (0,4) | 25 (0,5) |
| DUT | 27 (9,6) | 31(4)b | 58 (5,5) | 196 (11,5) | 287 (9,0) | 483 (9,8) |
| PQ | 6 (2,1) | 55 (7,1)a | 61 (5,8) | 3 (0,2) | 9 (0,3) | 12 (0,2) |
| OL | 41 (14,6) | 192 (24,8)b | 233 (22,1) | 53 (3,1) | 135 (4,2) | 188 (3,8) |
| Otra lesión | 29 (10,3) | 83 (10,7) | 112 (10,6) | 68 (4,0) | 108 (3,4) | 176 (3,6) |
| DSU+OL | 32 (11,3) | 75 (9,7) | 107 (10,1) | 328 (19,1) | 585 (18,3) | 913 (18,6) |
| FC | 31 (11,0) | 105 (13,5) | 136 (12,9) | 112 (6,6) | 135 (4,2)b | 247 (5,0) |
| Total | 281 | 775 | 1.056 | 1.707 | 3.198 | 4.905 |
BS: blanco superficial; DSU: distal/lateral subungueal; DUT: distrofia ungueal total; F: sexo femenino; FC: formas combinadas; M: sexo masculino; OL: onicolisis; Otra lesión: alteraciones ungueales no comprendidas en el resto; PP: proximal profunda; PQ: paroniquia.
ap<0,05; bp<0,01, diferencia en la proporción de cada forma clínica por sexo.
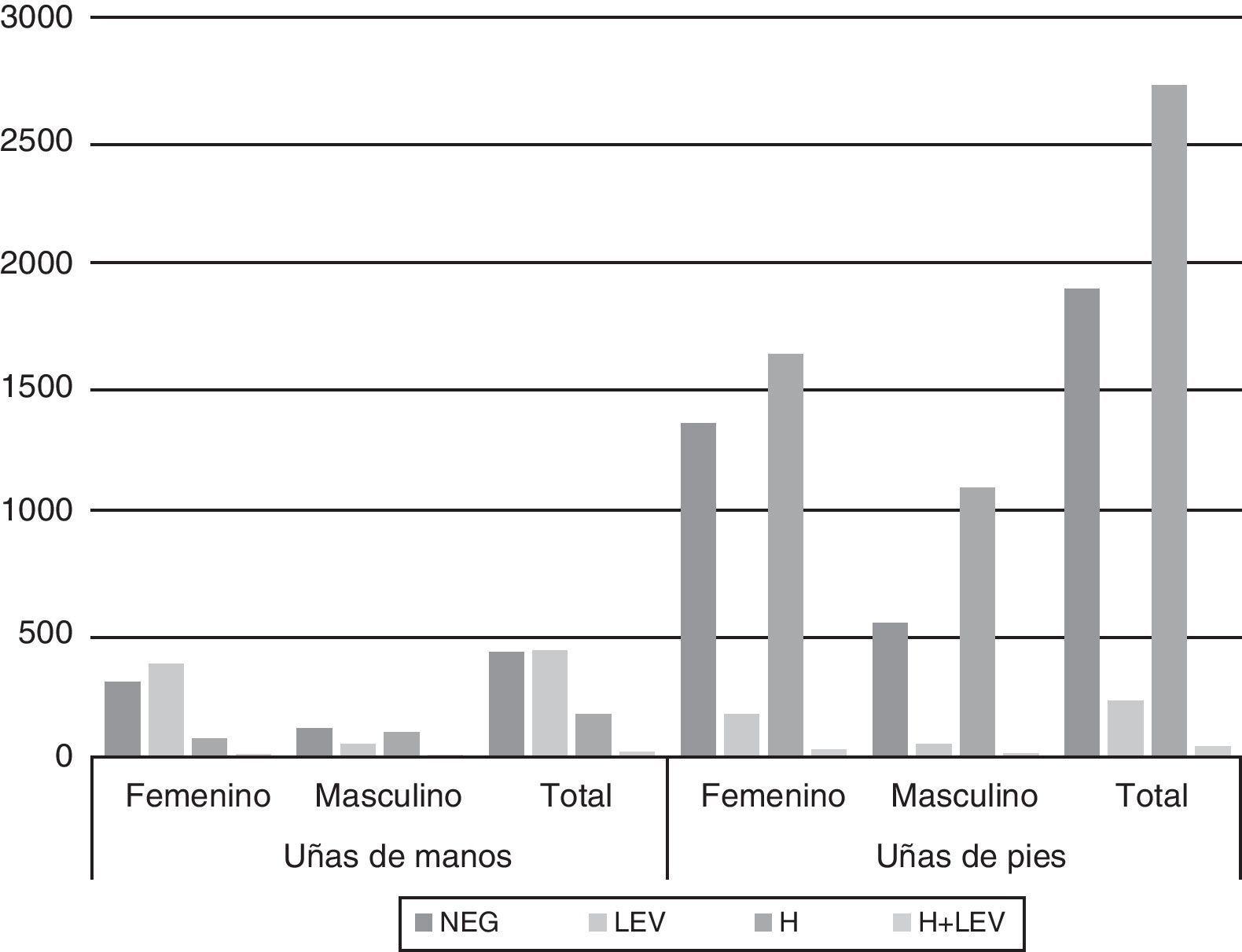
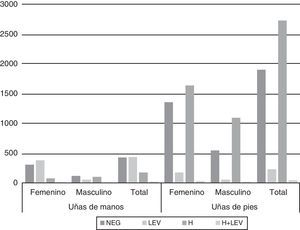
La figura 1 muestra los resultados de los exámenes directos de UM y UP respectivamente según el sexo de los pacientes. En UM la observación de levaduras en el examen directo fue significativamente mayor en el sexo femenino respecto al sexo masculino (p<0,01). Asimismo, en el sexo masculino la presencia de hifas tabicadas fue significativamente mayor (p<0,01).
En UP en ambos sexos la presencia de hifas fue la observación más frecuente, aunque significativamente mayor en varones (p<0,01), en tanto que la proporción de exámenes directos negativos fue significativamente mayor en muestras femeninas.
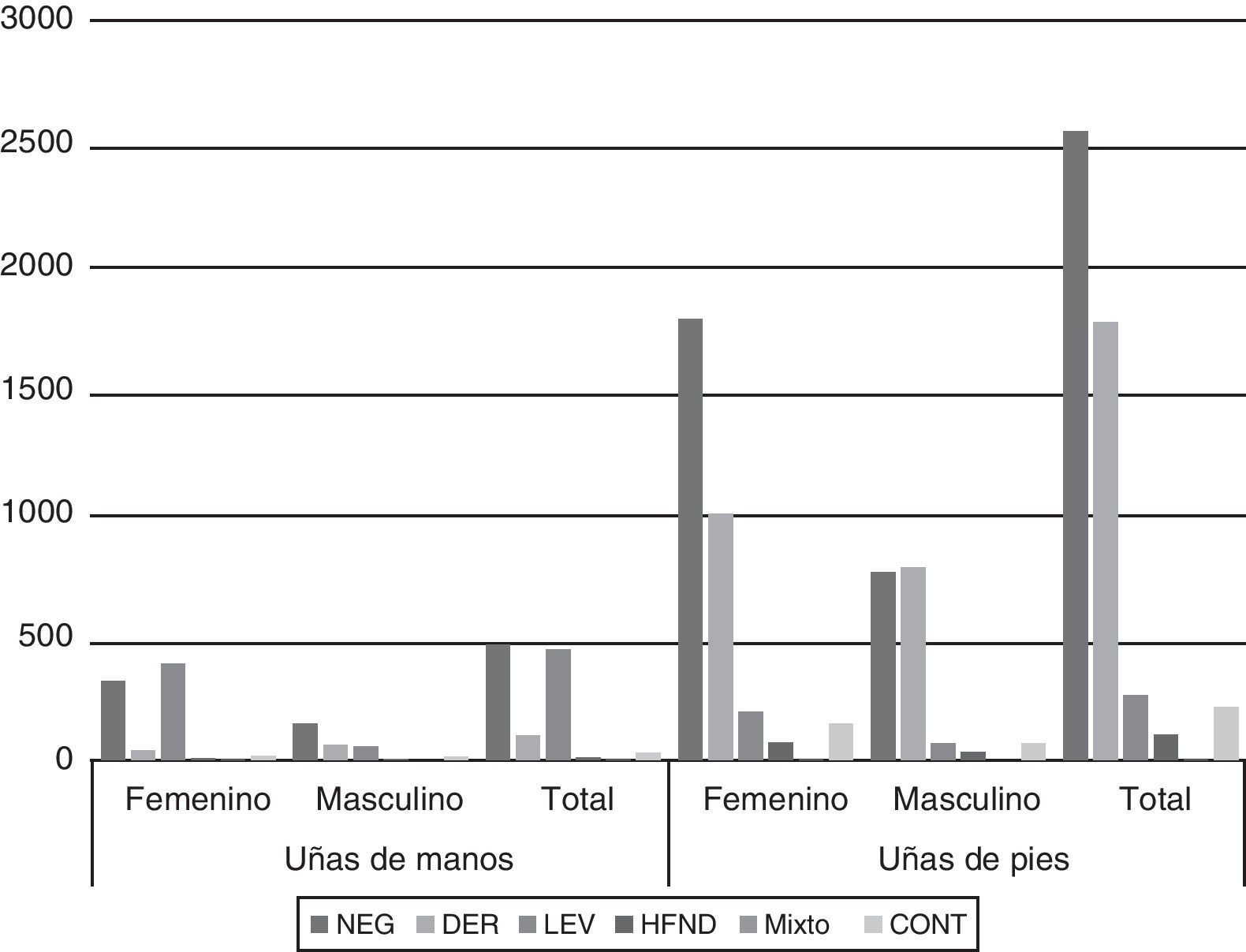
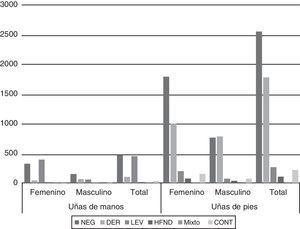
La figura 2 muestra los resultados del análisis de los cultivos de UM y UP según el sexo de los pacientes. El aislamiento de dermatofitos fue significativamente mayor en el sexo masculino (p<0,01) tanto en UM como UP. Por el contrario, el aislamiento de hongos levaduriformes fue más frecuente en el sexo femenino en UM. El resto de los agentes etiológicos no presentó diferencias en su aislamiento según el sexo.
En la tabla 2 se puede observar la correlación entre los resultados de los exámenes directos y los cultivos según la localización. Existe buena correlación (91%) entre examen directo negativo y cultivo negativo tanto para UM como para UP. En caso de observar levaduras en el examen directo, se recuperaron hongos levaduriformes en el 89% de los casos. Cuando en el examen directo se observaron hifas se obtuvo desarrollo de dermatofitos u hongos filamentosos no dermatofitos el 63,3% de las veces. Cuando se analizó la correlación entre cultivo y examen directo se observó que solamente un 70% de los cultivos negativos tenían también exámenes directos negativos. Este resultado es a expensas de las muestras donde se observaron hifas compatibles con dermatofitos o HFND que no crecieron en 29% de los casos (843 muestras).
Correlación entre los resultados de exámenes directos y cultivos de acuerdo con la localización
| Examen directo | Localización | Cultivo | % CORRb | |||||||
| NEG | DER | HFND | LEV | LEV+DER | LEV+HFND | CONT | Total | |||
| NEG | UP | 1.735 | 103 | - | 23 | 0 | 0 | 41 | 1.902 | 90,98 |
| UM | 382 | 15 | - | 24 | 0 | 0 | 4 | 425 | ||
| Total | 2.117 | 118 | - | 47 | - | - | 45 | 2.327 | ||
| LEV | UP | 29 | 4 | 0 | 190 | 0 | 0 | 5 | 228 | 89,43 |
| UM | 23 | 1 | - | 402 | - | - | 8 | 434 | ||
| Total | 52 | 5 | 0 | 592 | 0 | 0 | 13 | 662 | ||
| H | UP | 783 | 1.648 | 103 | 27 | 0 | 0 | 169 | 2.730 | 63,44 |
| UM | 60 | 81 | 11 | 5 | - | - | 18 | 175 | ||
| Total | 843 | 1.729 | 114 | 32 | 0 | 0 | 187 | 2.905 | ||
| H+LEV | UP | 0 | 20 | 0 | 23 | 0 | 1 | 1 | 45 | 26,86 |
| UM | 2 | 2 | - | 16 | 1 | 1 | - | 22 | ||
| Total | 2 | 22 | 0 | 39 | 1 | 2 | 1 | 67 | ||
| Total | 3.014 | 1.874 | 114 | 710 | 1 | 2 | 246 | 5.961 | ||
| % CORRa | 70,24 | 92,26 | 100,0 | 83,38 | 100 | 100 | 4,08 | |||
CONT: contaminados; DER: dermatofitos; H: hifas; HFND: hongos filamentosos no dermatofitos; LEV: levaduras; NEG: negativo; UM: uñas de mano; UP: uñas de pie.
En el 93% de los casos en que se aislaron dermatofitos en cultivo en el examen directo se habían observado hifas. En el 83% de las muestras donde se obtuvo desarrollo de levaduras, las mismas fueron observadas en el examen directo. En 47 casos el desarrollo de levaduras se produjo en muestras con exámenes directos negativos, por lo que el valor de estos hallazgos es muy controvertido.
La tabla 3 muestra la correlación entre forma clínica y cultivo tanto para UM como para UP. En los pacientes que presentaron DSU, con o sin OL, aproximadamente el 50% de los cultivos fue negativo tanto en UM como en UP. En esta forma clínica en UM se aislaron principalmente levaduras, mientras que en UP el mayor porcentaje correspondió a dermatofitos. En caso de presentar PQ en UM se correspondió generalmente con el hallazgo de levaduras en los cultivos (86,9%), mientras que en UP esta forma clínica presentó cultivos negativos la mayor parte de las veces.
Correlación entre formas clínicas y cultivos
| Forma clínica | Localización | Cultivo, n (%) | |||||||
| NEG | DER | HFND | LEV | DER+LEV | HFND+LEV | CONT | Total | ||
| DSU | UM | 164 (53,1) | 39 (12,6) | 3 (1,0) | 94 (30,4) | - | - | 9 (2,9) | 309 |
| UP | 1.314 (48,9) | 1.045 (38,9) | 70 (2,6) | 131 (4,9) | - | - | 128 (4,8) | 2.688 | |
| BS | UM | 16 (59,3) | 5 (18,5) | 3 (11,1) | 1 (3,7) | - | - | 2 (7,4) | 27 |
| UP | 79 (45,7) | 73 (42,2) | 12 (6,9) | 1 (0,6) | - | - | 8 (4,6) | 173 | |
| PP | UM | 6 (46,2) | 1 (7,7) | - | 6 (46,2) | - | - | - | 13 |
| UP | 12 (48,0) | 10 (40,0) | 2 (8,0) | 1 (4,0) | 25 | ||||
| DUT | UM | 21 (36,2) | 14 (24,1) | - | 18 (31,0) | - | - | 5 (8,6) | 58 |
| UP | 235 (48,7) | 200 (41,4) | 1 (0,2) | 25 (5,2) | 22 (4,6) | 483 | |||
| PQ | UM | 7 (11,5) | - | - | 53 (86,9) | - | - | 1 (4,6) | 61 |
| UP | 8 (66,7) | 2 (16,7) | 1 (8,3) | 1 (8,3) | 12 | ||||
| OL | UM | 51 (21,9) | 11 (4,7) | 4 (1,7) | 163 (70,0) | - | 1 (0,4) | 3 (1,3) | 233 |
| UP | 89 (47,3) | 25 (13,3) | 4 (2,1) | 62 (33,0) | 1 (0,5) | 5 (3,7) | 188 | ||
| Otra lesión | UM | 76 (67,9) | 9 (8,0) | - | 24 (21,4) | - | - | 3 (2,6) | 112 |
| UP | 109 (61,9) | 50 (28,4) | 1 (0,6) | 10 (5,7) | 6 (3,4) | 176 | |||
| DSU+OL | UM | 62 (57,9) | 10 (9,3) | 1 (0,9) | 29 (27,1) | 1(0,9) | - | 4 (3,7) | 107 |
| UP | 593 (64,9) | 261 (28,6) | 6 (0,7) | 23 (2,5) | 30 (3,3) | 913 | |||
| FC | UM | 64 (47,1) | 10 (7,4) | - | 59 (43,4) | - | - | 3 (2,2) | 136 |
| UP | 108 (43,7) | 109 (44,1) | 7 (2,8) | 10 (4,0) | 13 (5,3) | 247 | |||
| Total | UM | 467 | 99 | 11 | 447 | 1 | 1 | 30 | 1.056 |
| UP | 2.547 | 1.775 | 103 | 263 | 1 | 216 | 4.905 | ||
BS: blanco superficial; CONT: contaminados; DER: dermatofitos; DSU: distal/lateral subungueal; DUT: distrofia ungueal total; FC: formas combinadas; HFND: hongos filamentosos no dermatofitos; LEV: levaduras; NEG: negativo; OL: onicolisis; Otra lesión: alteraciones ungueales no comprendidas en el resto; PP: proximal profunda; PQ: paroniquia UM: uñas de mano; UP: uñas de pie.
En la forma BS en UM generalmente los cultivos fueron negativos, mientras que en UP no existe diferencia entre el porcentaje de cultivos negativos y el aislamiento de dermatofitos en esta lesión. Los pacientes que presentaron forma PP en UP tuvieron cultivos positivos con dermatofitos en el 40% de los casos. En los pacientes con otro tipo de lesiones diferentes de las formas clínicas clásicas generalmente se obtuvo cultivo negativo (>60%). El porcentaje de cultivos contaminados de acuerdo a la forma clínica varió entre el 2,2 y el 8,6%.
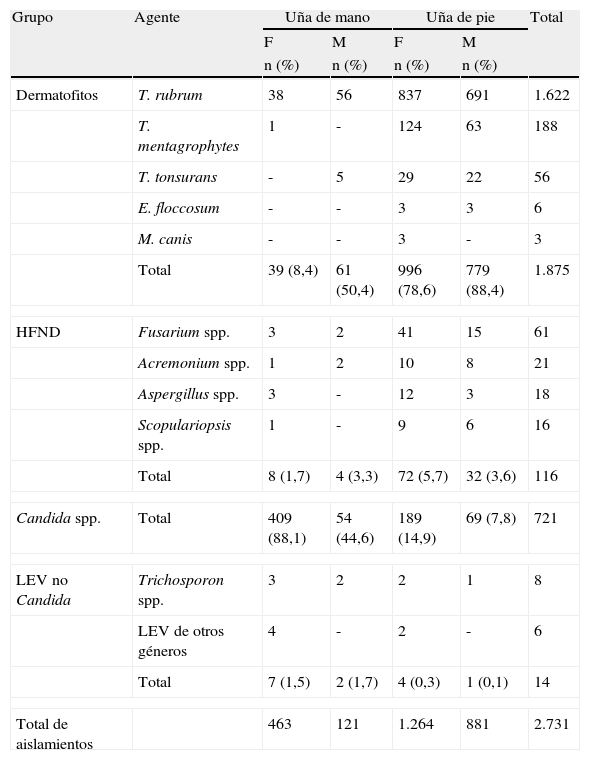
En la tabla 4 se pueden observar los agentes etiológicos más frecuentes en UM y UP, considerando el sexo de los pacientes. En UP el 82,8% de los 2.145 aislamientos correspondió a dermatofitos; 12,3% a LEV y 4,8% a HFND.
Agentes etiológicos de onicomicosis según localización
| Grupo | Agente | Uña de mano | Uña de pie | Total | ||
| F | M | F | M | |||
| n (%) | n (%) | n (%) | n (%) | |||
| Dermatofitos | T. rubrum | 38 | 56 | 837 | 691 | 1.622 |
| T. mentagrophytes | 1 | - | 124 | 63 | 188 | |
| T. tonsurans | - | 5 | 29 | 22 | 56 | |
| E. floccosum | - | - | 3 | 3 | 6 | |
| M. canis | - | - | 3 | - | 3 | |
| Total | 39 (8,4) | 61 (50,4) | 996 (78,6) | 779 (88,4) | 1.875 | |
| HFND | Fusarium spp. | 3 | 2 | 41 | 15 | 61 |
| Acremonium spp. | 1 | 2 | 10 | 8 | 21 | |
| Aspergillus spp. | 3 | - | 12 | 3 | 18 | |
| Scopulariopsis spp. | 1 | - | 9 | 6 | 16 | |
| Total | 8 (1,7) | 4 (3,3) | 72 (5,7) | 32 (3,6) | 116 | |
| Candida spp. | Total | 409 (88,1) | 54 (44,6) | 189 (14,9) | 69 (7,8) | 721 |
| LEV no Candida | Trichosporon spp. | 3 | 2 | 2 | 1 | 8 |
| LEV de otros géneros | 4 | - | 2 | - | 6 | |
| Total | 7 (1,5) | 2 (1,7) | 4 (0,3) | 1 (0,1) | 14 | |
| Total de aislamientos | 463 | 121 | 1.264 | 881 | 2.731 | |
F: sexo femenino; HFND: hongos filamentosos no dermatofitos; LEV: levaduras; M: sexo masculino.
En UM, de los 584 aislamientos el 17% fueron dermatofitos; 75% correspondieron a levaduras del género Candida, 2,05% a HFND y 1,5% a otros hongos levaduriformes.
Dentro de los dermatofitos la especie más frecuente fue T.rubrum (86,5%), tanto en UP como UM, seguido de Trichophyton mentagrophytes (10,0%) y Trichophyton tonsurans (3,0%), mientras que Microsporum canis y Epidermophyton floccosum se aislaron en raras ocasiones (0,5%).
Respecto de los HFND, Fusarium fue el más frecuentemente aislado (52,6%) y su recuperación fue mayor en UP, seguido por Acremonium (18,1%), Aspergillus (15,5%) y Scopulariopsis (13,8%).
Discusión y conclusionesLas onicodistrofias son lesiones muy frecuentes y motivo de preocupación para los pacientes que se ven afectados por las mismas. La mayoría de los estudios demuestran que las onicomicosis son las responsables del 50 al 60% de las onicopatías y presentan una prevalencia del 2 al 13% según la población estudiada14,21,37.
A pesar de ser afecciones comunes y fáciles de diagnosticar y tratar, las recidivas son frecuentes y la resistencia a los tratamientos constituye un problema en la actualidad. Debido a la diversidad de formas clínicas de las onicomicosis y al hecho de que muchas veces son indistinguibles de otras patologías ungueales o bien pueden combinarse con las mismas, es imprescindible realizar un correcto examen micológico para conocer la causa de la lesión e instaurar el tratamiento adecuado12. Por otra parte, debemos tener en cuenta que las onicomicosis pueden ser causadas por dermatofitos, HFND, y cuando hay causas predisponentes que las favorezcan, puede haber lesiones ungueales colonizadas por Candida.
En este estudio nos propusimos conocer la prevalencia de onicomicosis en 9 centros de diagnóstico, los agentes etiológicos más frecuentes en relación con el sexo y la edad de los pacientes así como la localización de las lesiones, cuáles fueron las principales formas clínicas y si se asociaban con algún tipo de agente etiológico. En el mismo se incluyeron todos los pacientes que fueron derivados a los laboratorios de Micología participantes, para realizar exámenes micológicos de lesiones ungueales, a diferencia de los estudios realizados en Canadá25 y EE. UU.21, donde analizaron las uñas de individuos que consultaban por otras afecciones y se excluyeron los que lo hacían por sospecha de onicomicosis. Estos autores encontraron que de 15.000 pacientes, el 8% presentó onicomicosis y que estas fueron casi 20 veces más frecuentes en UP con respecto a UM, a diferencia de nuestro estudio, donde la prevalencia fue del 61% y la relación de micosis en estas localizaciones fue de casi 5 veces mayor en UP que en UM.
En nuestra población el 70,2% de los pacientes correspondió al sexo femenino, lo que es similar a lo encontrado por Godoy et al. (70,5%) en Chile23, Souza et al. (72,2%) en Brasil47, Manzano-Gayoso (61,7%) en México35 y Arechavala et al. (66,1%) en Argentina2. En general, en nuestro medio las mujeres suelen consultar más frecuentemente por este tipo de alteraciones que tienen connotación estética y que puede llevarlas a sentirse socialmente discriminadas e inhibidas para mostrar sus uñas.
La edad promedio de nuestros pacientes fue de 49,7 años, que fue muy semejante a lo observado en otros estudios realizados en Buenos Aires2 y en México35, en que era de 51 años. En el trabajo de Souza et al.47 la mayor frecuencia de onicomicosis se situaba en el rango de 40-49 años, en tanto que en la investigación de Gupta et al.26 la edad de presentación es bastante más baja: 35,6 años en las mujeres y 42,9 años en los varones. En otras publicaciones se consigna que el rango de edad más frecuente entre los individuos con onicomicosis es el de 40-60 años4,25. Por su parte, Summerbell et al.48 encuentran que la mediana de edad es de 64 años. Aunque el rango de edad es muy amplio, en general este tipo de afecciones se manifiesta principalmente en la edad media de la vida.
Con respecto a la localización, en nuestro estudio encontramos que 4 de cada 5 consultas correspondían a lesiones en UP, que es semejante a lo observado en el trabajo de Souza et al.47, con 68% de onicomicosis de pie, y con el de Arechavala et al.2, con el 82% en esa localización, pero se diferencia de la frecuencia de presentación observada en las publicaciones de Mercantini et al.36 y de Chadeganipour et al.11, donde el 57 y el 73%, respectivamente, corresponde a UM.
En las UP la lesión más frecuente tanto en el sexo femenino como en el masculino fue la DSU en más del 50% de los casos. Esto es concordante con la mayoría de los estudios publicados8,12,28.
En un estudio retrospectivo de Romano et al.45 se encontró que de 4.046 casos de onicomicosis, el 90% tuvo una presentación clínica DSU, un 7% BS y un 3% PP. Gupta et al.25 publicaron que la relación en UP entre las formas DSU, BS y PP resultó de 360:59:1, respectivamente. Las mismas formas clínicas en nuestro estudio tuvieron la siguiente relación: 79:5,2:1; además, frecuentemente se encontraron formas combinadas de lesiones DSU con OL (18,6%). En un grupo de 54 pacientes VIH positivos también se halló mayor proporción de formas DSU (61%) y DUT (55%) y la tercera parte de ellos presentaba formas combinadas39.
Con respecto a las lesiones en UM, las más frecuentes correspondieron a las formas DSU (29,2%), las OL (21,1%) y la combinación de ambas (10,1%), en tanto que en otro estudio realizado en nuestro país las OL fueron la presentación más frecuente (75%)2.
Como ya se discutió previamente, el estudio micológico es fundamental para diferenciar las onicomicosis de otras onicopatías clínicamente semejantes. El estudio microscópico directo permite visualizar la presencia de elementos fúngicos en estas muestras en la gran mayoría de las onicomicosis y su rendimiento diagnóstico es mayor que el de los cultivos. Summerbell et al. encuentran que la positividad del examen directo se corresponde con el diagnóstico de onicomicosis en el 75,6% de los casos48. En nuestro trabajo, el 96,7% de las muestras que permitieron el diagnóstico de onicomicosis tuvieron examen directo positivo, lo que demuestra el gran valor de esta prueba ya que permite iniciar el tratamiento antimicótico sin esperar el resultado de los cultivos, que en casi el 30% de los casos ocasionados por dermatofitos pueden resultar negativos (tabla 2); estos datos son coincidentes con los de otras series2,33,49. Según Elewsky et al. y otros autores15,37,51 entre el 20 y el 50% de los especímenes de onicomicosis fallan en el aislamiento en los cultivos, a diferencia de los estudios mencionados previamente, donde se tiene una recuperación de aproximadamente el 70%. La negatividad de los cultivos podría deberse a que la muestra sea de la parte distal de la uña donde se suelen encontrar microorganismos no viables, a contaminaciones por bacterias y hongos ambientales, al uso de antifúngicos que inhiben el crecimiento de estos agentes, a la siembra de una cantidad insuficiente de muestra, o al uso de medios que no sean los más adecuados. En los casos de una fuerte sospecha clínica de onicomicosis, con examen directo y cultivos negativos, la repetición de los estudios micológicos hasta 2-3 veces aumenta la recuperación del agente etiológico48,51.
En nuestro trabajo, el porcentaje de positividad de cultivos en UM fue del 52,9%, de los cuales en el sexo femenino predominaron los aislamientos de levaduras del género Candida (87,7% de aislamientos) y en los hombres prevalecieron los dermatofitos (50,4% de los aislamientos). En el trabajo de Luque et al.33 se encuentran datos similares en las mujeres, ya que se aislaron especies de Candida en el 91,3%, aunque también las aislaron en el 75% de las uñas de los varones, al igual que Godoy-Martinez et al., quienes encontraron una prevalencia de 94,5 y 75% de levaduras en mujeres y hombres, respectivamente23. Por su parte, Souza et al., en Brasil47, aislaron un 54,5% de dermatofitos en varones y un 86,3% de levaduras en mujeres. Manzano-Gayoso et al. analizaron las onicomicosis ocasionadas por levaduras y encontraron un mayor número de aislamientos en pies que en manos, sin embargo no indican el número de muestras analizadas en cada localización, por lo que no es posible estimar la frecuencia correspondiente35.
Cuando consideramos las lesiones en UP, los dermatofitos predominaron en ambos sexos (78,9% en mujeres y 88,6% en hombres) y la especie más frecuente fue T. rubrum, que se aisló en 1.528 casos (86,1% de los dermatofitos aislados); T. mentagrophytes fue la segunda especie, con 187 (12,2%) casos, y T. tonsurans se aisló en 51. Los hongos levaduriformes correspondieron al 12,3% del total de aislamientos. Mercantini et al.36 encontraron un 21,1% de aislamientos de levaduras y un 48% de dermatofitos (48,7% de T. rubrum y 46,3% de T. mentagrophytes), en tanto Elewsky et al.15 aislaron un 84% de T. rubrum y un 7% de T. mentagrophytes). Gupta et al.25 obtuvieron un 66,5% de T. rubrum y un 32% de T. mentagrophytes, mientras que en un trabajo realizado en población geriátrica en Portugal, donde casi el 60% de los pacientes eran diabéticos, también se aisló T. rubrum en el 83% de los casos de onicomicosis y Trichophyton interdigitale en segundo lugar13.
En otros trabajos donde no se especifica la localización, también T. rubrum fue el dermatofito predominante, con un 70,9% para Ghannoum et al. en Canadá, el 86,9% para Arechavala et al. en nuestro país, un 55,3% para Souza et al. en Brasil y un 81,7% para Godoy-Martinez et al. en Chile2,21,23,47.
En estudios realizados en pacientes VIH positivos se ha encontrado que las onicomicosis eran más frecuentes que en la población general y que en este grupo de enfermos también prevalecía T. rubrum como agente causal24,39. Por otra parte, en un estudio llevado a cabo en Teherán, se observó que el 43% de 504 muestras analizadas fueron positivas con una relación mano/pie de 2:1. En el mismo se aislaron un 60% de levaduras, un 21% de dermatofitos −el más frecuente fue T. mentagrophytes−, y un 19% de HFND, especialmente Aspergillus27.
Según Moreno et al.38 algunos factores como la hiperhidrosis, los traumatismos, la mala circulación periférica o la inmunosupresión favorecen la aparición de onicomicosis ocasionadas por hongos miceliales con menor capacidad queratinolítica que los dermatofitos (2-12%), entre los que se encuentran especies de Scopulariopsis, Aspergillus, Fusarium y Scytalidium y que se asocian con lesiones blancas superficiales, leuconiquias o melanoniquias. En nuestra casuística se aislaron 4,8% de HFND en UP y 2% en UM. El mayor porcentaje correspondió a Fusarium spp. (52,6%), similar a lo encontrado por Souza et al. (50%), Godoy-Martinez et al. (61,5%), Escobar y Carmona-Fonseca (49,4%) y Negroni et al. (58,7%), en tanto que Gupta et al. solamente aislaron un 5,9% de estos agentes, Veer et al. un 8,3% y Midgley y Moore un 10,4%17,23,25,41,47. En nuestra investigación, Acremonium spp. corresponde al segundo HFND en frecuencia (18,1%), al igual que en el trabajo de Negroni et al. (29,3%)41, en tanto que en otras publicaciones Scopulariopsis spp. y Aspergillus spp. son los HFND más frecuentes11,20,25,27,37,49. El aislamiento de HFND tiene implicancias terapéuticas y epidemiológicas, ya que las onicomicosis producidas por este último grupo de hongos en pacientes inmunocomprometidos pueden ser la puerta de entrada de una micosis invasora con alta tasa de mortalidad, además de ser más difíciles de tratar y erradicar18,22,34,40,46.
En este estudio multicéntrico, donde se procesaron casi 6.000 muestras, que es una de las series más importantes de nuestro país, podemos recalcar la importancia de la realización de un estudio micológico completo, por profesionales entrenados a fin de obtener una muestra representativa, cumpliendo con la preparación del paciente y jerarquizando el examen directo, ya que tuvimos cerca de un 30% de cultivos negativos con exámenes directos positivos. Sin embargo, la realización de cultivos es importante ya que permite la correcta identificación de las especies causales y porque además una pequeña proporción de muestras tienen examen directo negativo y se recuperan dermatofitos en el cultivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.