En la era de los nuevos antipsicóticos, el grave cuadro conocido con el nombre de síndrome neuroléptico maligno (SNM) sigue presentando elevada incidencia y mortalidad. Revisamos su origen, fisiopatología, criterios diagnósticos y de estadificación, tratamiento general y especialmente con terapia electroconvulsiva (TEC), proponiendo un uso menos restrictivo y más ajustado al conocimiento actualizado de esta técnica.
En concreto, consideramos justificado el uso de localizaciones bilaterales de entrada, frecuencia de tres sesiones semanales y cargas calculadas por edad, que aseguren crisis eficaces con respuesta temprana, evitando el uso de estímulos subconvulsivos repetidos al calcular el umbral por titulación. Creemos poco fundamentado el temor al riesgo incrementado de hipertermia maligna en SNM por sustancias empleadas en la anestesia, pero sí justificado emplear relajantes no despolarizantes por el riesgo de hiperpotasemia al exponerse a succinilcolina.
Consideramos finalmente imprescindible familiarizar con la TEC a los otros especialistas implicados en el tratamiento, e incrementar la disponibilidad de la técnica y nuestra formación en ella en el nivel de complejidad actualmente disponible.
In the era of new antipsychotic drugs the severe symptomatology known by the name of neuroleptic malignant syndrome (NMS) continues to have a high incidence and mortality. We review its origin, pathophysiology, diagnostic criteria and staging, particularly with electroconvulsive therapy (ECT), and proposing a less restrictive use and more adjusted to the updated knowledge of this technique.
In particular, we consider the justified use of bilateral lead placement, a frequency of three sessions per week, and loads calculated for age, which would ensure effective seizures with an early response, thus avoiding the use of repeated sub-seizure stimuli to calculate the threshold by titration. We believe there is little evidence on the fear of the risk of increasing malignant hyperthermia in NMS due to the substances used in anaesthesia, but is justified to use non-depolarising relaxants due to the risk of hyperkalaemia on being exposed to succinylcholine.
Finally we believe it is essential to familiarise the other specialists involved in the treatment with ECT, to increase the availability of the technique and our training in this to the currently available complexity.
Se revisó la literatura existente en relación con el sindrome neuroleptico maligno (SNM) mediante una búsqueda bibliográfica realizada en PubMed de los artículos publicados entre 1965 y 2010, incluyendose articulos en ingles, frances y espanol, desde casos publicados hasta revisiones narrativas. De todos los artículos encontrados se obtuvo información general. Posteriormente se concretó la búsqueda y se amplió en aquellos artículos en relación al tratamiento del SNM y mas en concreto al tratamiento de la terapia electroconvulsiva (TEC) del SNM (). Se revisaron de forma exhaustiva todos los artículos sobre tratamiento de SNM, así como las referencias cruzadas, ampliando la búsqueda a los artículos en los que se revisaba el empleo de diferentes agentes anestésicos en la TEC.
Síndrome neuroléptico malignoEl actualmente denominado síndrome neuroléptico maligno (SNM) fue descrito inicialmente por Delay en 1960 y denominado por aquel entonces síndrome acinético hipertónico1. Se definió como una reacción idiosincrática, poco frecuente, pero potencialmente letal al tratamiento con neurolépticos. A pesar de que tanto la fisiopatología como la clínica de este síndrome se relacionan con reacciones desencadenados por otros fármacos y tóxicos, y que es posible su conceptualización en el marco más global de catatonía maligna2–4 (actualmente la APA admite que el SNM es una forma de catatonía maligna con un precipitante tóxico definido), se mantiene en la práctica la definición del DSM IV TR, que lo limita a una reacción adversa acontecida tras el uso de antipsicóticos5.
Los datos de incidencia varían notablemente en distintas fuentes, desde el 2,2 al 0,07% de los pacientes tratados con antipsicóticos6,7, con una media aceptable en torno al 1%8. Aunque la tendencia aparente podría sugerir un descenso en número y gravedad5 por la generalización del uso de antipsicóticos atípicos, el empleo de dosis menores y tal vez su detección temprana7, sigue tratándose de una situación grave, con una mortalidad en torno al 10%2,7,9, y probablemente infradiagnosticada en nuestro medio.
El inicial optimismo ante los efectos secundarios de los nuevos antipsicóticos calificados como atípicos se ha ido atenuando también en este tema: aunque parece mantenerse un riesgo menor que con los convencionales, menudean los casos en que los protagonistas del SNM son atípicos10–13. Entre los casos de SNM inducidos por antipsicóticos atípicos, posiblemente la clozapina sea el antipsicótico que presenta menor riesgo de desarrollar un SNM por su perfil farmacodinámico diferente (baja afinidad por los receptores D2 y elevada por los D4 y 5HT 2A, 2C, 6 y 7, H1 y muscarínicos), aunque no se han realizado estudios comparativos de incidencia de SNM con antipsicóticos atípicos que respalden esta hipótesis. Sí se plantea sin embargo una cierta diferencia en la manifestación del SNM inducido por la clozapina respecto del SNM inducido por otros antipsicóticos, diferencia que se objetiva en la menor presencia de rigidez y temblor y mayores alteraciones en la presión arterial y diaforesis, así como la menor probabilidad de que aparezcan síntomas extrapiramidales antes de la aparición de fiebre14.
Además del empleo de antipsicóticos, se han descrito otros factores de riesgo, ninguno de ellos con capacidad predictiva en clínica. La agitación, la deshidratación, la deficiencia de hierro, el empleo de contención mecánica y la elevada temperatura ambiental se asocian a riesgo incrementado15–17.
El antecedente de SNM en el mismo paciente se recoge en el 15-20% de los casos18. Hay pocos datos sobre una posible vulnerabilidad genética al SNM. Se han publicado hallazgos que sugieren que el polimorfismo TaqI 1 A DRD2 se asocia con predisposición a SNM, tal vez en relación con un mayor bloqueo DRD2. Lo único objetivable es la mayor frecuencia del alelo A1 en pacientes con SNM18,19.
En cuanto a la fisiopatología del SNM, hace ya 20 años que Henderson y Wooten propusieron el bloqueo dopaminérgico hipotalámico generador de hipertermia como el determinante central. Existen evidencias prácticas que apoyan este mecanismo: las drogas relacionadas provocan bloqueo dopaminérgico, las drogas empleadas en su tratamiento son pro dopaminérgicas, y los pacientes con lesiones en las vías dopaminérgicas, o bien tras la supresión brusca de tratamiento con L-DOPA, presentan una clínica similar9.
Compatible con el mecanismo anterior sería el bloqueo nigroestriatal provocador de extrapiramidalismo, y frontal/mesocortical, posible contribuyente a las alteraciones cognitivas20. La elevación de catecolaminas podría relacionarse con una acción directa sobre el eje adrenérgico21. En definitiva, son múltiples las alteraciones neuroquímicas y neuroendocrinas que determinarían un síndrome hipermetabólico3.
Existen hipótesis en las que se baraja que además de la alteración a nivel central, puede existir un daño directo a nivel muscular, alterando el transporte del Ca en los miocitos a través del retículo sarcoplásmico; quizás en situaciones de deshidratación, agitación o agotamiento el músculo se vuelve sensible a este posible efecto lesivo de los neurolépticos7,9.
Para el diagnóstico de dicho síndrome, la rigidez y la hipertermia son dos síntomas que aparecen mencionados como indispensables en el DSM IV TR22, a los que deben añadirse al menos dos síntomas entre los siguientes: diaforesis, disfagia, temblor, incontinencia, cambios en el nivel de conciencia, mutismo, taquicardia, presión arterial elevada o lábil, leucocitosis y evidencia en laboratorio de daño muscular (CPK entre otros). Además, es preciso excluir que los síntomas se deban a trastorno mental, alteración médica o neurológica u otros tipos de fármacos o sustancias (fenciclidina, entre otras).
Las alteraciones de laboratorio son inespecíficas, y en el 90% de los casos son normales. El estudio del LCR no presenta hallazgos patológicos, la neuroimagen es normal, y el único hallazgo en el EEG es un enlentecimiento generalizado.
En general la clínica se desencadena en los primeros 30 días tras administrar el antipsicótico, el 16% en las primeras 24 h y el 66% en la primera semana23, y en la mayoría de los casos la alteración del estado mental y los signos neurológicos preceden a las demás alteraciones18. Se debe tener en cuenta que si el antipsicótico es depot, este período se puede prolongar. En el caso de que se resuelva espontáneamente tras la retirada del antipsicótico, habitualmente lo hace en los primeros 30 días, recuperándose el 63% en la primera semana. En algunos pacientes la catatonía y el parkinsonismo pueden persistir semanas después de la resolución metabólica7.
El SNM es un diagnóstico de exclusión. Entre los diversos cuadros cuya presentación puede ser similar destacaremos la encefalitis viral, que difiere en la presencia de importante cefalea, signos meníngeos, alteraciones de laboratorio (LCR) y neuroimagen6. Cuadros psicóticos extremos, como la manía estuporosa o la catatonía maligna, resultan indistinguibles en una cuarta parte de los casos, conceptualizándose el SNM como una forma de catatonía maligna inducida por drogas2,5,8,24-26. Las medidas serán similares: retirar los antipsicóticos por ineficaces y emplear la TEC como indicación idónea, ya que el empleo de TEC y benzodiazepinas (BDZ) es el tratamiento de elección en la catatonía maligna, así como en SNM graves o prolongados.
Los ictus pueden presentarse con hipertermia, confusión, taquicardia y taquipnea, y puede ser difícil distinguirlos en pacientes psiquiátricos que reciben antipsicóticos. Algunos casos de estatus epiléptico no convulsivo también llegan a parecer un SNM.
Los bloqueantes dopaminérgicos no empleados como antipsicóticos (antieméticos) o la retirada de sustancias dopaminérgicas (amantadina, L Dopa) pueden provocar un auténtico SNM sin antipsicóticos. Drogas serotoninérgicas como ISRS, ADT, IMAO (incluido el linezolid) y triptanes pueden causar un síndrome serotoninérgico, que suele presentarse como un cuadro de delírium agitado, aunque en muchos casos simula un SNM.
Algunas sustancias, como cocaína y anfetaminas (MDMA), pueden provocar SNM-like. La intoxicación por alucinógenos, abstinencia enólica o de sedantes puede provocar síntomas similares a SNM, y el riesgo aumenta en pacientes con dependencia enólica cuando están recibiendo tratamiento con tiapride o droperidol9. También es necesario diferenciarlo de la hipertermia maligna (HM) intraoperatoria por fármacos (succinilcolina, anestésicos inhalados)7,26.
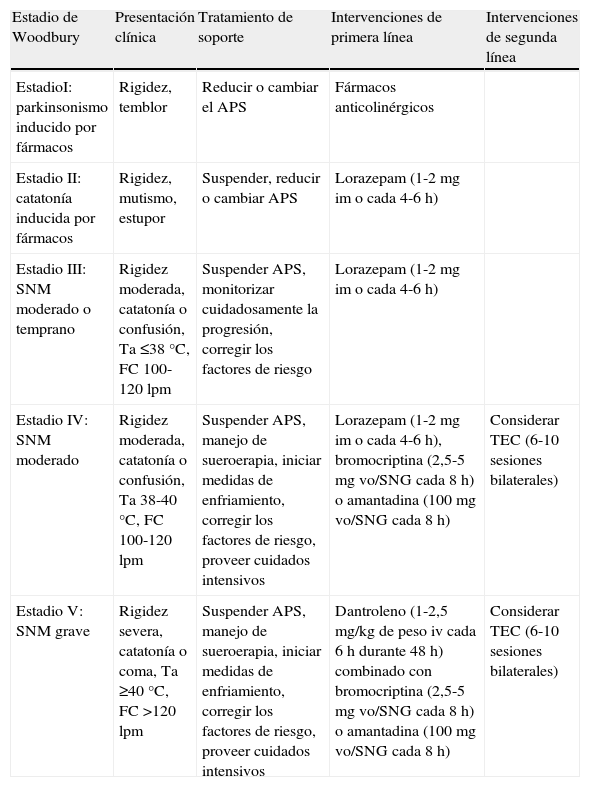
Tratamiento del síndrome neuroléptico malignoComo medida inicial se debe retirar el fármaco que lo ha precipitado e iniciar terapia de soporte individualizada. El algoritmo propuesto por Woodbury27 en 1992 puede resultar orientativo (tabla 1). La rehidratación y la regulación de las alteraciones iónicas deben ser objetivos fundamentales, y se pueden emplear medidas para disminuir la intensidad y la duración de la hipertermia. Se han descrito diversas causas de muerte: arritmias cardíacas, IAM, neumonía aspirativa, TEP, neumonía nosocomial y fallo renal mioglobinúrico entre las más frecuentes, por lo que deben monitorizarse las funciones cardíaca, respiratoria y renal, proporcionando las medidas de soporte necesarias, así como prevenir las coagulopatías.
Algoritmo propuesto para terapia de soporte individualizada
| Estadio de Woodbury | Presentación clínica | Tratamiento de soporte | Intervenciones de primera línea | Intervenciones de segunda línea |
| EstadioI: parkinsonismo inducido por fármacos | Rigidez, temblor | Reducir o cambiar el APS | Fármacos anticolinérgicos | |
| Estadio II: catatonía inducida por fármacos | Rigidez, mutismo, estupor | Suspender, reducir o cambiar APS | Lorazepam (1-2mg im o cada 4-6 h) | |
| Estadio III: SNM moderado o temprano | Rigidez moderada, catatonía o confusión, Ta ≤38°C, FC 100-120 lpm | Suspender APS, monitorizar cuidadosamente la progresión, corregir los factores de riesgo | Lorazepam (1-2mg im o cada 4-6 h) | |
| Estadio IV: SNM moderado | Rigidez moderada, catatonía o confusión, Ta 38-40°C, FC 100-120 lpm | Suspender APS, manejo de sueroerapia, iniciar medidas de enfriamiento, corregir los factores de riesgo, proveer cuidados intensivos | Lorazepam (1-2mg im o cada 4-6 h), bromocriptina (2,5-5mg vo/SNG cada 8 h) o amantadina (100mg vo/SNG cada 8 h) | Considerar TEC (6-10 sesiones bilaterales) |
| Estadio V: SNM grave | Rigidez severa, catatonía o coma, Ta ≥40°C, FC >120 lpm | Suspender APS, manejo de sueroerapia, iniciar medidas de enfriamiento, corregir los factores de riesgo, proveer cuidados intensivos | Dantroleno (1-2,5 mg/kg de peso iv cada 6 h durante 48 h) combinado con bromocriptina (2,5-5mg vo/SNG cada 8 h) o amantadina (100mg vo/SNG cada 8 h) | Considerar TEC (6-10 sesiones bilaterales) |
Adaptada de Woodbury27.
FC: frecuencia cardiaca; Ta: temperatura; APS: antipsicóticos; vo: vía oral; iv: intravenoso; SNG: sonda nasogástrica; TEC: terapia electroconvulsiva; SNM: síndrome neuroléptico maligno.
En cuanto al tratamiento farmacológico, en ocasiones es suficiente con el cese de la administración del fármaco que lo ha desencadenado, pero a menudo serán necesarias actuaciones complementarias en una gradación proporcional a la gravedad27,28.
El primer paso habitualmente propuesto son las BDZ. Aunque con resultados contradictorios, en casos leves y moderados, tanto por vía oral como parenteral (lorazepam, 1-2mg) podrían disminuir los síntomas y acelerar la recuperación29.
La segunda línea de tratamiento farmacológico son los agonistas dopaminérgicos. La amantadina y la bromocriptina aparecen en series de casos y metaanálisis como fármacos que aceleran la recuperación y disminuyen la mortalidad, solos o en combinación. La dosis de amantadina que se suele emplear oscila entre 200 y 400mg/día divididos en varias tomas, administrada de forma oral o por sonda nasogástrica. La bromocriptina (2,5mg orales 2-3 veces al día, llegando a 45mg como máximo) puede empeorar la psicosis subyacente y provocar hipotensión; además puede precipitar vómitos, con lo cual incrementa el riesgo de aspiración en pacientes con bajo nivel de conciencia30,31.
En casos en los que el SNM cursa con vómitos y acalasia se ha descrito un posible tratamiento con apomorfina, ante la dificultad de administrar bromocriptina y amantadina oral. En los casos revisados, la apomorfina, un agonista D2 utilizado en la enfermedad de Parkinson y en la disfunción sexual, se administró en una dosis subcutánea de 2mg cada 3h durante 3 días, y de 2mg cada 6h durante 2 días32.
También en casos severos se emplea el dantroleno, que inhibe la liberación de Ca desde el retículo sarcoplasmático, actuando como relajante muscular. Se emplea de forma exitosa en casos de HM secundaria a agentes anestésicos. Solo se debe emplear en casos de rigidez severa, hipertermia e hipermetabolismo. La hipertermia y la rigidez suelen desaparecer de forma rápida, sin embargo la retirada precoz del fármaco puede hacer que reaparezcan.
Se administra de forma intravenosa a dosis de 1-2,5mg/kg inicialmente, seguido de 1mg/kg cada 6h, pasando a vía oral en pocos días, si responde. Otra opción es la infusión intravenosa continua de dantroleno, que parece ser eficaz en pacientes con SNM grave con fallo renal agudo. Presenta riesgo de hepatotoxicidad a partir de 10mg/kg/día.
El uso de dantroleno, comparado con el tratamiento exclusivamente de soporte, presenta menor tiempo de recuperación y menor mortalidad25,26, aunque algunos trabajos resultan contradictorios33.
Existen casos publicados en los que se ha usado con buena respuesta valproato intravenoso (250mg el primer día y 250mg cada 12h a partir del segundo día); los niveles en sangre tras dos semanas fueron de 87μg/ml34.
Terapia electroconvulsiva en el síndrome neuroléptico malignoEn general, se considera que los efectos de los tratamientos farmacológicos aparecen en los primeros días; si en estos el fármaco no es eficaz, es improbable que lo sea7,9,26,35. En este punto es donde cobra protagonismo la TEC, que parece resultar eficaz no solo en situaciones graves sino muy evolucionadas en el tiempo, con franca disminución de la mortalidad36. A pesar de la línea de resistencia tradicional al empleo de TEC, hoy en día se tienen suficientes datos que la convierten en la segunda línea de tratamiento en el SNM14
Hermesh37 y su grupo fueron los primeros en describir en 1987 un caso de SNM que respondía a TEC. Posteriormente Scheftner y Shulman38 en 1992 y Trollor et al39 en 1999, con series de casos, lo proponen como una modalidad de tratamiento efectivo cuando los fármacos no resultan eficaces. Scheftner publicó respuestas con una latencia de menos de 72h tras la primera sesión, mientras que Trollor encontró mejoría en general a partir de la sexta sesión de TEC39-41.
Se describen situaciones en las que se postula la TEC como primera opción terapéutica, sin esperar a comprobar la eficacia del tratamiento farmacológico. Se trataría por un lado de casos severos y con grave riesgo de complicaciones, pero también cuando no se puede excluir el diagnóstico de catatonía letal, o en los casos en que, resuelto el cuadro metabólico agudo del SNM, persisten síntomas motores parkinsonianos o catatoniformes7. Una última indicación que se propone para indicar la TEC tempranamente sería la de los casos en que la depresión psicótica es la enfermedad de base39,41.
La TEC disminuye la mortalidad en estas situaciones. En los referidos como casos severos, la probabilidad de éxito del tratamiento farmacológico es escasa. En el caso de que predominen o persistan los síntomas motores/catatónicos, recordemos que hemos aludido a que el SNM se vincula con el concepto de catatonía letal. Teniendo en cuenta que guías de consenso conservadoras como la del Royal College sobre TEC de 200542 defienden que la TEC es el tratamiento de elección de la catatonía maligna, cuando se plantee el diagnóstico diferencial o la contextualización en este marco global según el predominio sintomático parece lógico comenzar el tratamiento con TEC.
Las cifras de eficacia son variables, escasas y difícilmente interpretables partiendo de la heterogeneidad conceptual y de la variabilidad de los tratamientos.
Addonizio et al43 obtuvieron datos positivos con TEC en 43 de sus pacientes. Trollor et al39 revisaron 46 casos de la literatura y 9 pacientes propios. En 31 casos (56%) el TEC se empleó después del fracaso del tratamiento farmacológico, mientras que en 40 (73%) casos fue la primera opción terapéutica. La recuperación completa se observó en 25 casos (63%), la recuperación parcial en 11 casos (26%), beneficiándose del tratamiento un total de 36 pacientes (90%)43,44.
A la pregunta que, como señala Reid45, se plantea de forma particularmente insistente cuando se habla de TEC, referente a su mecanismo de acción en el SNM, no existe una respuesta evidente; sin embargo, los datos hasta ahora recogidos parecen apuntar en la dirección de un mecanismo basado en el incremento de la sensibilidad a la neurotrasmisor dopamina quizás incrementando también su liberación, que lo vincularía a su tradicional uso en el parkinsonismo evolucionado14. También parece que potencia la transmisión serotoninérgica y noradrenérgica44.
Sin embargo, la TEC en el SNM no está exenta de riesgos. Como principales, tanto por su severidad como por su frecuencia, se recogen las complicaciones cardiovasculares por la TEC, la HM por sustancias empleadas en la anestesia y la hiperpotasemia32.
Recordemos que, tras el estímulo eléctrico, tanto la presión arterial como la frecuencia cardíaca caen inicialmente para luego volver a remontar. El estímulo vagal desencadenado provoca bradicardia, en ocasiones períodos de asistolia o incluso silencio eléctrico43; esto es rápidamente reemplazado por una taquicardia secundaria a estímulo hipotalámico, lo que, al incrementar el trabajo cardíaco y disminuir el aporte de oxígeno por la menor duración del tiempo de diástole, puede conllevar un accidente isquémico y diversos tipos de arritmias46,47.
Si además se emplean estímulos subconvulsivos, se pueden provocar largos períodos de bradicardia, argumento a menudo empleado por los detractores del método de titulación en el cálculo individualizado de la carga inicial47–50. El riesgo de asistolia se incrementa con el empleo de betabloqueantes, y para atenuar la bradicardia, tal vez de modo excesivamente sistemático, se emplea atropina.
Se trataría, pues, de factores de riesgo cardiovascular incrementado para cardiópatas previos. En 2000, Brodaty et al51 no relacionaban el número y la severidad de efectos adversos cardiovasculares con la edad. La mayor parte de las alteraciones cardiovasculares son transitorias. Zielinski et al52 publicaron en 1993 que la TEC se puede emplear de forma bastante segura en pacientes con enfermedad cardíaca severa. La APA21 defendía en 2001 la seguridad del empleo de la TEC en la mayoría de pacientes cardiovasculares. No hemos encontrado datos concretos sobre riesgo cardiovascular incrementado con TEC en SNM.
El riesgo de HM por sustancias empleadas en la anestesia de la TEC es un tema controvertido que parte de las semejanzas clínicas entre ambos cuadros53, pero no se corresponde con las distintas patogenias de ambos, ni se confirma con datos clínicos o experimentales50. Así, mientras, como hemos recogido, las alteraciones del SNM derivan de la acción esencialmente central por hipoactividad dopaminérgica, la HM se plantea como un trastorno familiar por déficit de inositol 1,4,5 trifosfato fosfatasa, que supondría un riesgo de hipercontractilidad de la fibra muscular ante la exposición a sustancias como halotano, cafeína o relajantes musculares despolarizantes como la succinilcolina, pero no con antipsicóticos.
Los contradictorios datos de estudios in vitro54–57 con fibras musculares de pacientes con HM y SNM, que compartirían una hipercontractilidad ante la administración de halotano frente a controles sanos, pueden interpretarse como un riesgo que justificaría la exclusión en pacientes afectos de SNM de ciertos fármacos anestésicos con riesgo de desencadenar HM. Sin embargo, otros autores58 proponen una lectura diferente de los hallazgos: el tejido muscular sensibilizado de pacientes que han sufrido ambos cuadros desarrollaría una respuesta anómala al verse expuesto (in vitro) a sustancias como el halotano, sin que exista conexión entre SNM e HM.
La alternativa que se plantea a la habitual succinilcolina cuando se considera ese hipotético riesgo compartido59,60, descartada la opción de no emplear relajantes por los riesgos conocidos de la convulsión no modificada9,37, son los relajantes no despolarizantes. Se ha empleado el vecuronio, el atracurio y el mivacurio8,61,62, pero tampoco son opciones inocuas: el uso de este tipo de relajantes prolonga significativamente el tiempo de anestesia requerida, y por tanto la dosis de anestésico, con el aumento de riesgos proporcional.
El empleo de succinilcolina se ha relacionado también con riesgo de hiperpotasemia en varias alteraciones neuromusculares, como miopatías, lesiones musculares traumáticas o daño muscular tóxico57,59,62–64. Si asumimos que la rigidez está presente en el SNM y que esta conlleva un daño de fibras musculares llegando a la posible mionecrosis, así como el hipotético daño directo desencadenado por neurolépticos en las fibras musculares vulnerables, y en consecuencia liberación de potasio al líquido extracelular por alteraciones de membrana, se debe considerar el posible riesgo de emplear relajantes musculares despolarizantes, como succinilcolina, ya que su mecanismo implica una despolarización de las fibras musculares masiva con la necesaria entrada de Na del medio externo y salida de K para lograr la extenuación y la relajación final del miocito tras un estímulo exagerado. La suma de ambos factores puede elevar los niveles de K en sangre hasta cifras que podrían ser arritmógenas. La alternativa serían los relajantes musculares no despolarizantes (atracurio, vecuronio, mivacurio…), que no provocarían esa salida masiva de potasio8.
Una alternativa que solucionaría el problema del efecto prolongado de los relajantes no despolarizantes, utilizados como sustitutos de la succinilcolina en la TEC del SNM, es la utilización conjunta del sugammadex, reversor específico y reversible del rocuronio. Introducido de manera reciente en el mercado, permite acabar con la relajación muscular de manera rápida y sin los efectos adversos de los inhibidores de la acetilcolinesterasa. Los únicos inconvenientes serían su elevado precio, así como su contraindicación en la insuficiencia renal severa65.
Los aspectos técnicos específicos sobre la forma de aplicación de la TEC en el SNM (al igual que en otras situaciones salvo, tal vez, los cuadros depresivos) no se basan en pruebas sino en consensos intuitivos. En general se proponen actuaciones enérgicas, con localizaciones bilaterales, cargas elevadas claramente supraumbral, y series largas, justificadas en que la gravedad del cuadro tratado compensa los riesgos asumidos66.
La discusión todavía abierta hoy sobre la localización de los electrodos67 tiene sentido a nivel de investigación, pero existe un consenso claro en clínica para dejar de lado el posible mayor riesgo de afectación cognitiva con localizaciones bitemporales, y aprovechar su respuesta más segura y rápida cuando existe riesgo vital42,67.
En el mismo sentido, la frecuencia de aplicación de tres semanales (práctica estándar en la mayoría de los países) frente a dos asegura una respuesta precoz con un nivel de riesgo asumible dada la gravedad de la situación42.
Aunque somos partidarios del cálculo del umbral por titulación como norma general, en situaciones como la presente, con urgencia de respuesta y riesgo médico incrementado, creemos justificada la excepción que se recoge incluso en criterios como los del Royal Collage británico de 200442. Emplearemos un cálculo de carga en función de edad (método de la «mitad de la edad» de Petrides y Fink)68, considerando otras posibles variables clínicas o farmacológicas, evitando el uso de estímulos subconvulsivos repetidos y la prolongación de las sesiones inevitables al calcular el umbral por titulación.
Con cierta controversia se ha planteado el uso de «Multiple TEC», que consiste en repetir en una misma sesión anestésica 2-3 estimulaciones eficaces. McKinney y Kellner69 recogen una heterogénea serie de casos que sugiere la eficacia de repetir la estimulación en una misma sesión de anestesia. A destacar que, como señala Ray66, este método es diferente del definido por Maletzky70 en 1981, llamado MMECT, en el que se realizaban de 4 a 6 convulsiones de forma rutinaria por sesión. La evidencia que existe actualmente en relación a la repetición de 2-3 estimulaciones en la misma sesión anestésica solo se ve respaldada por publicaciones de series de casos, por lo que no se suele emplear en la práctica habitual.
La respuesta de la TEC suele darse tempranamente, generalmente a partir de seis sesiones. Ni el sexo, ni la edad, ni el diagnóstico psiquiátrico u otros predicen la respuesta a la TEC37. En general, las recomendaciones son de seis a diez sesiones, si es preciso diarias, manteniendo el mínimo de seis aunque exista respuesta antes, para así minimizar el riesgo de recaída. El frecuente uso de BDZ en el SNM puede suponer una elevación del umbral que precisará ajustes de carga, anestésicos como el etomidato, o reversión con flumazenilo8. Generalmente se recomienda mantener las BDZ durante la aplicación de la TEC en el SNM ya que, a pesar de elevar el umbral convulsivo, parece existir un efecto sinérgico beneficioso con la TEC que acelera la recuperación del SNM71.
Finalmente, una vez resuelto el SNM se plantea el hecho de restablecer el tratamiento antipsicótico, proponiéndose un plazo orientativo de 2 semanas de espera7. Se recomienda comenzar con dosis bajas y antipsicóticos de baja potencia o atípicos e ir titulando, siendo la clozapina el agente de elección, en base a su menor afinidad D234. A pesar de las precauciones, la reanudación de fármacos antipsicóticos tras un SNM se asocia con un 30% de recaída.
Una alternativa a la reanudación de antipsicóticos en pacientes con elevado riesgo de recaída de SNM41,43 sería el empleo de TEC a modo de mantenimiento en pacientes resueltos con esta medida, o incluso tras una resolución con tratamiento farmacológico.
ConclusionesEl SNM es un cuadro probablemente infradiagnosticado en sus formas leves y con riesgo de ser confundido en los casos graves, sigue existiendo en la era de los nuevos antipsicóticos y mantiene una mortalidad del 10%. Además de plantear tempranamente el diagnóstico y manejar con fluidez los fármacos habituales, insistimos en considerar apropiadamente la TEC, tanto en momento como en técnica.
La gravedad de estas situaciones sugiere una indicación temprana y una técnica que asegure su eficacia desde el primer momento. Proponemos localizaciones bitemporales de entrada, frecuencia de tres semanales y cargas claramente supraumbral, que aseguren crisis eficaces con respuesta temprana durante al menos seis sesiones.
Es preciso asimismo establecer una rigurosa coordinación con el equipo anestésico, considerando juiciosamente el riesgo cardiovascular incrementado e individualizando el uso de atropina y de betabloqueantes. Creemos poco fundamentado el temor al riesgo incrementado de HM en SNM por sustancias empleadas en la anestesia, pero sí justificado emplear relajantes no despolarizantes por el riesgo de hiperpotasemia al exponerse a succinilcolina8.
Consideramos finalmente imprescindible familiarizar con la TEC a los otros especialistas implicados en el tratamiento, e incrementar la disponibilidad de la técnica y nuestra formación en ella acorde con el nivel de complejidad actualmente disponible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.