La hiperprolactinemia iatrogénica (HPRLi) se ha descrito con más frecuencia con algunos antipsicóticos, dependiendo de su capacidad de bloqueo de los receptores de dopamina D2. Existe gran heterogeneidad de la práctica clínica y posiblemente falta de concienciación sobre este problema entre los médicos. Dada la elevada frecuencia con la que los pacientes con enfermedad mental grave reciben antipsicóticos de forma prolongada, se precisa vigilar posibles riesgos en su salud física. La HPRLi y sus síntomas pueden pasar desapercibidos si no se investigan rutinariamente.
MetodologíaSe realiza una revisión profunda de la literatura para elaborar un consenso multidisciplinario con psiquiatras junto a otros especialistas (de Endocrinología, Medicina Interna y Oncología) con el fin de consensuar los riesgos clínicos y los métodos de detección más adecuados de la HPRLi de acuerdo con los distintos niveles de evidencia científica (I-IV).
ResultadosLos síntomas a corto plazo incluyen amenorrea, galactorrea y disfunción sexual (descenso del deseo y disfunción eréctil por hipogonadismo secundario). A medio-largo plazo y relacionado con la disminución de estrógenos, se pueden inducir baja masa ósea (osteopenia y osteoporosis), hipogonadismo, menopausia precoz, incremento del riesgo de algunos tipos de cáncer (mama y endometrio), aumento del riesgo cardiovascular, alteraciones en la inmunidad, dislipidemia y disfunción cognitiva, entre otros. La petición de niveles de PRL debería realizarse al inicio del tratamiento en todos los pacientes que reciben antipsicóticos, aunque no se observen síntomas precoces (amenorrea, galactorrea) por el riesgo de subestimar otros síntomas que pueden aparecen a medio plazo. Se aconseja determinar también niveles de FSL, LH, testosterona y vitamina D. Se recomienda explorar rutinariamente la función sexual, ya que puede ser un síntoma mal tolerado que podría conducir al abandono del tratamiento. Se propone un especial cuidado en niños y adolescentes, así como en pacientes con PRL>50ng/ml (intensidad moderada), revisando periódicamente si existe hipogonadismo o disfunción sexual. En los pacientes con PRL>150ng/ml debe descartarse siempre un prolactinoma radiológicamente y se debe prestar especial atención a posibles antecedentes de cáncer de mama o endometrio. Se aconseja realizar densitometrías en varones >50 años y en mujeres con amenorrea>6 meses o menopausia precoz para detectar osteoporosis y evitar riesgo de fracturas por fragilidad.
Iatrogenic hyperprolactinaemia (IHPRL) has been more frequently related to some antipsychotic drugs that provoke an intense blockade of dopamine D2 receptors. There is a wide variation in clinical practice, and perhaps some more awareness between clinicians is needed. Due to the high frequency of chronic treatment in severe mental patients, careful attention is recommended on the physical risk. IHPRL symptoms could be underestimated without routine examination.
MethodologyAn intense scientific literature search was performed in order to draw up a multidisciplinary consensus, including different specialists of psychiatry, endocrinology, oncology and internal medicine, and looking for a consensus about clinical risk and detection of IHPRL following evidence-based medicine criteria levels (EBM I- IV).
ResultsShort-term symptoms include amenorrhea, galactorrhoea, and sexual dysfunction with decrease of libido and erectile difficulties related to hypogonadism. Medium and long-term symptoms related to oestrogens are observed, including a decrease bone mass density, hypogonadism, early menopause, some types of cancer risk increase (breast and endometrial), cardiovascular risk increase, immune system disorders, lipids, and cognitive dysfunction. Prolactin level, gonadal hormones and vitamin D should be checked in all patients receiving antipsychotics at baseline although early symptoms (amenorrhea-galactorrhoea) may not be observed due to the risk of underestimating other delayed symptoms that may appear in the medium term. Routine examination of sexual dysfunction is recommended due to possible poor patient tolerance and low compliance. Special care is required in children and adolescents, as well as patients with PRL levels >50ng/ml (moderate hyperprolactinaemia). A possible prolactinoma should be investigated in patients with PRL levels >150ng/ml, with special attention to patients with breast/endometrial cancer history. Densitometry should be prescribed for males >50 years old, amenorrhea>6 months, or early menopause to avoid fracture risk.
Existe un creciente interés en la comunidad clínica sobre la importancia de la salud física en el paciente con enfermedad mental grave, con especial mención al síndrome metabólico y al incremento general de la mortalidad de estos pacientes1,2. Esto sin duda incluye un problema real muchas veces minusvalorado por los clínicos, la hiperprolactinemia (HPRL) provocada por algunos antipsicóticos (APS) y sus cada vez más conocidas consecuencias sobre la salud global y la calidad de vida del paciente3–5.
Si bien otros efectos metabólicos y endocrinos de los tratamientos con APS han dominado la literatura de los últimos años6, la HPRL es uno de los efectos secundarios más comunes asociados con los APS, en especial con la mayoría de los APS típicos y algunos de segunda generación como risperidona, paliperidona o amisulpride7,8, que llega a detectarse en el 30-70% de los pacientes que los toman de forma continuada7,9,10 y hasta en un 80% de los que los toman a corto plazo, en especial las poblaciones jóvenes11.
El aumento de los niveles séricos de PRL puede provocar sufrimiento al paciente (disfunción sexual), ser estigmatizante (ginecomastia en varones), poner en riesgo la salud global y afectar a la funcionalidad y satisfacción con el tratamiento. La HPRL se asocia a consecuencias sobre el organismo a corto, medio y largo plazo, y son muchas las incógnitas acerca de sus efectos12,13.
La adherencia al tratamiento se puede ver comprometida, ya que estudios recientes han puesto de manifiesto que una de las razones principales para el abandono en pacientes tratados con APS fue la mala tolerabilidad, por encima de la falta de eficacia, y acompañada de otros factores como la falta de conciencia de enfermedad14. En concreto, los efectos adversos relacionados con la HPRL se han asociado a un descenso en los niveles de adherencia (OR: 0,69; p = 0,034) en una encuesta realizada en 876 pacientes con esquizofrenia15. Se ha descrito un 36% de riesgo de abandono del tratamiento en los varones y un 20% en mujeres por disfunción sexual cuando se utiliza un cuestionario específico y validado para pacientes con esquizofrenia que mide la disfunción sexual y la predisposición de los pacientes al abandono de la medicación debido a ese efecto adverso como es el Psychotropic Related Sexual Dysfunction Questionnaire (PRsexDQ)16,17.
Los efectos silentes a medio y largo plazo (a menudo no valorados por los médicos si no se piensa en ello) incluyen osteoporosis, hipoestrogenia, mayor riesgo cardiovascular y posible incremento del riesgo de cáncer de mama y endometrio, entre otros. Estos efectos se manifiestan tras muchos años de tratamiento crónico y de ellos existen cada vez más evidencias, que revisaremos en este consenso.
Resulta muy conveniente, tras los últimos trabajos publicados, conocer y evaluar adecuadamente el alcance real de las consecuencias de la HPRL iatrogénica crónica por APS en el paciente con enfermedad mental grave, así como su posible abordaje clínico y terapéutico.
Para ello, se llevó a cabo este consenso que recoge las conclusiones de un grupo de expertos españoles con relevancia internacional en Psiquiatría, Endocrinología, Medicina Interna, Oncología y Reumatología, reunidos para estudiar el alcance real a la luz de la evidencia científica actualizada disponible en este momento y para establecer recomendaciones sobre la detección y el manejo clínico de la HPRL iatrogénica provocada por el tratamiento a corto, medio y largo plazo con APS.
MetodologíaEl actual consenso se desarrolló en 3 fases: 1) revisión de la literatura científica; 2) una mesa redonda posterior presencial para intentar alcanzar el consenso de los expertos y 3) una revisión por todos los autores de las conclusiones finales hasta alcanzar un acuerdo completo. El resultado final ha sido consensuado por los todos los expertos: se alcanzó el acuerdo en el 4.° borrador del manuscrito. Todo el proceso tuvo lugar entre marzo de 2014 y marzo de 2015.
Revisión de la literatura científicaSe llevó a cabo una revisión extensa de la literatura científica para conocer la evidencia publicada disponible sobre la HPRL asociada a APS, sus causas, prevalencia y consecuencias clínicas, así como cuestiones relacionadas con su detección y estrategias terapéuticas.
La búsqueda de literatura se hizo a través de PubMed y las bases de datos Cochrane, con los términos «prolactina» y «antipsicótico» o «hiperprolactinemia» incluidos en el título y abstract, en lengua inglesa y sin límite de año de publicación. Esta búsqueda proporcionó 3.341 artículos que, una vez filtrados por la relevancia de su contenido, se concretaron en 267. Esta primera parte centrada en los riesgos clínicos y en la detección de la HPRL recoge 179 artículos.
Mesa redonda de consensoSe reunió a un grupo de 18 expertos en Psiquiatría (15), Endocrinología (1), Medicina Interna (1) y Oncología (1) elegidos por el coordinador del consenso y procedentes de diferentes lugares de España, con impacto científico y del ámbito académico, investigador y clínico en una reunión presencial en Madrid en 2 sesiones de mañana y tarde. El consenso fue auspiciado por la Asociación Española de Sexualidad y Salud Mental (AESexSAME) y se contó con el patrocinio científico de la Sociedad Española de Psiquiatría Biológica (SEPB). El patrocinador logístico no intervino en ninguna de las partes científicas del consenso, ni en la elaboración de este manuscrito.
Cada uno de los expertos se responsabilizó previamente de la revisión de la bibliografía recopilada en relación con su área de experiencia clínica y de investigación, y elaboró una comunicación con las conclusiones más relevantes que se presentaron sucesivamente en la mesa redonda de debate presencial de la conferencia de consenso celebrada en Madrid en marzo de 2014. Tras la sesión presencial de debate se completó, mediante comunicaciones electrónicas, la revisión y perfeccionamiento de conclusiones hasta alcanzar su aprobación por unanimidad. Para la presentación de resultados se tomaron como referencia los niveles de evidencia y recomendación de la US Agency for Health Research and Quality (tabla 1). Posteriormente, se estableció una discusión sobre la evidencia presentada por cada ponente para llegar a un consenso acerca de ella y acerca del contenido final que debía ser reflejado en este artículo. El coordinador elaboró un primer manuscrito global que fue revisado por todos los miembros del consenso, quienes enviaron sus comentarios por correo electrónico. Fueron necesarias 4 revisiones consecutivas del manuscrito para alcanzar un consenso global durante el año 2014-2015. Las conclusiones fueron consensuadas por el 100% de los firmantes.
Niveles de evidencia utilizados y grados de recomendación (Según la US Agency for Health Research and Quality)
| Nivel de evidencia (I-IV) |
|---|
| Ia: La evidencia proviene de metaanálisis de ensayos controlados, aleatorizados, bien diseñados |
| Ib: La evidencia proviene de, al menos, un ensayo controlado aleatorizado |
| IIa: La evidencia proviene de, al menos, un estudio controlado bien diseñado sin aleatorizar |
| IIb: La evidencia proviene de, al menos, un estudio no completamente experimental, bien diseñado, como los estudios de cohortes. Se refiere a la situación en la que la aplicación de una intervención está fuera del control de los investigadores, pero cuyo efecto puede evaluarse |
| III: La evidencia proviene de estudios descriptivos no experimentales bien diseñados, como los estudios comparativos, estudios de correlación o estudios de casos y controles |
| IV: La evidencia proviene de documentos u opiniones de comités de expertos o de experiencias clínicas de autoridades de prestigio o de los estudios de series de casos |
| Grado de la recomendación (A-D) |
|---|
| A: Basada en una categoría de evidencia I. Extremadamente recomendable |
| B: Basada en una categoría de evidencia II. Recomendación favorable |
| C: Basada en una categoría de evidencia III. Recomendación favorable pero no concluyente |
| D: Basada en una categoría de evidencia IV. Consenso de expertos, sin evidencia adecuada de investigación |
La prolactina (PRL) es una hormona polipeptídica secretada por las células lactotropas de la adenohipófisis de manera pulsátil, siguiendo un ritmo circadiano18,19 con un nivel máximo a las 4 h del inicio del sueño y un nivel mínimo 6 h después del despertar20. Se ha demostrado expresión de receptores de PRL no solo en la mama sino en diferentes células y tejidos (que sin duda juegan un papel en la iatrogenia de la HPRL crónica) tales como cerebro, endometrio, ovario, testículo, próstata, páncreas, hígado, riñón, intestino, piel, pulmón, miocardio, células linfoides, adipocitos y células endoteliales21,22. Asimismo, se sabe de una secreción local de PRL tipo paracrino (no dependiente de dopamina) en algunos de estos tejidos.
Los niveles circulantes de PRL son el resultado de un complejo balance de factores estimulantes e inhibidores, mediados por diferentes neurotransmisores y hormonas, de origen hipotalámico, hipofisario y periférico, que actúan de manera directa o indirecta sobre las células lactotropas23,24. Su función fundamental es la de iniciar la lactancia, y los estímulos fisiológicos más importantes de la secreción de PRL son la succión del pezón, el aumento de los niveles de estrógenos, el sueño, el coito y el estrés. La hormona liberadora de tiroxina, la histamina y la serotonina, entre otros, también actúan estimulando la secreción de PRL25–27. La secreción de PRL es inhibida por la dopamina secretada por las neuronas tuberoinfundibulares, al unirse a los receptores D2 de membrana de las células lactotropas19,28. Los antipsicóticos que bloquean D2 de forma potente impiden el freno natural de PRL y esta se eleva dependiendo de la intensidad del bloqueo D2. Otros factores como el GABA, somatostatina, acetilcolina y norepinefrina poseen también un efecto inhibidor, aunque mucho menor que la dopamina27.
El estrés incrementa la secreción de PRL por un mecanismo dependiente de la secreción de dopamina. La importancia fisiológica de este hecho es desconocida, pero algunas hipótesis proponen que tendría un efecto protector de tipo inmunomodulador19,29. La PRL tendría un efecto antiapoptótico y proliferativo sobre los linfocitos, al aumentar la producción de citocinas, inmunoglobulinas, granulocitos y macrófagos e interactuaría con los glucocorticoides en determinados tejidos, reduciendo el efecto inmunosupresor de estos, normalizando la respuesta inmune y optimizando la respuesta adaptativa al estrés30,31.
Niveles normales de prolactinaEn las mujeres se consideran normales niveles de PRL inferiores a 530 miU/l (equivalente a 25ng/ml en cifras de los laboratorios españoles) y de 424 miU/l (20ng/ml) en el hombre; 1ng/ml es equivalente a 21,2 mIU/l. Un aspecto de gran relevancia es la repercusión clínica de la HPRL, ya que puede ser minusvalorada si no se toman en cuenta sus diferentes niveles de gravedad.
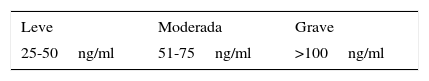
En cuanto a los niveles de gravedad, se considera HPRL leve por debajo de 1.000 miU/l (50ng/mL), HPRL moderada con valores entre 1.000 y 1.600 miU/l (51-75ng/mL) y grave por encima de 2.120 miU/l (>100ng/mL) (tabla 2)32. La HPRL como fenómeno global es más frecuente en mujeres que en varones33.
Niveles de gravedad de la hiperprolactinemia
| Leve | Moderada | Grave |
|---|---|---|
| 25-50ng/ml | 51-75ng/ml | >100ng/ml |
Fuente: Adaptado de Serri et al.32. (2003).
La «gravedad» de los niveles de PRL hace referencia a que en general el grado de hipogonadismo sería proporcional al grado de elevación de la PRL. Aunque los niveles pueden orientar hacia la etiología de la HPRL, hay un importante solapamiento en las cifras entre diferentes etiologías, sobre todo entre las que habitualmente se observan en un microprolactinoma y en las secundarias a fármacos.
Aunque los niveles de PRL pueden elevarse patológicamente por diferentes causas (tabla 3), la más frecuente de HPRL no fisiológica es la exposición a fármacos y, entre todos ellos, fundamentalmente los APS, con mucha diferencia con respecto a todas las demás34.
Etiología de la hiperprolactinemia
| Farmacológicas |
| Neurolépticos/antipsicóticos (+++) (causa más frecuente y potente) |
| Antidepresivos tricíclicos, IMAO, ISRS, ISRSN |
| Benzodiazepinas |
| Anticonvulsivantes |
| Anestésicos |
| Opiáceos |
| Estrógenos: anticonceptivos orales |
| Antihipertensivos: verapamilo, metildopa |
| Antihistamínicos H2 |
| Procinéticos/antieméticos |
| Agonistas colinérgicos |
| Procesos hipotálamo-hipofisarios |
| Enfermedad hipofisaria: prolactinomas, acromegalia, adenomas plurihormonales, cirugía, radioterapia, traumatismo, hipofisitis |
| Enfermedad hipotalámica o compresión del tallo hipofisario: tumores (craneofaringioma, germinoma, meningioma, metástasis, quiste de Rathke), granulomas, enfermedades infiltrativas, radioterapia, traumatismos con sección del tallo |
| Otros procesos |
| Hipotiroidismo primario (vía estimulación de tiroxina) |
| Insuficiencia renal crónica |
| Cirrosis hepática |
| Síndrome de ovario poliquístico |
| Neurogénicas: traumatismo torácico, herpes zóster |
| Hiperprolactinemia idiopática |
Fuente: Modificado de Halperin et al.68.
La HPRL por APS es sin duda la más frecuente y se produce por el bloqueo de los receptores D2 de dopamina, que en las células lactotropas hipofisarias produce una pérdida del factor inhibitorio dopaminérgico (PIF). Esto explica que los APS con un mayor índice de ocupación D2 sean los que producen mayores y más frecuentes elevaciones de PRL. Tal es el caso de risperidona y su 9-hidroximetabolito paliperidona35–37, considerados los APS de segunda generación que con mayor frecuencia provocan HPRL, con niveles incluso superiores a los del haloperidol34. Otro mecanismo de acción implicado es su capacidad para atravesar la barrera hematoencefálica: risperidona y paliperidona son los que más tiempo permanecen fuera de ella por su baja liposolubilidad y, por tanto, actúan durante más tiempo en la vía tuberoinfundibular provocando HPRL38. La relación entre la concentración del APS en cerebro y plasma (B/P ratio) mediante PET es un reciente biomarcador para el riesgo de HPRL. Los ratios son más bajos para risperidona y sulpiride que para olanzapina y haloperidol39.
En contraste con otros APS atípicos, la HPRL secundaria a risperidona parece ser dosis dependiente y la elevación se produce rápidamente permaneciendo estable durante el tiempo que dura el tratamiento3,13.
En una revisión de la literatura se muestran frecuencias del 69% con risperidona, que llega hasta el 100% en mujeres7. Amisulpride se asocia también con elevados índices de HPRL, de hasta el 100% en algunos estudios de diseño observacional40, o bien de revisión41, efecto que parece ser independiente de la dosis y ocurre a dosis tan bajas como 50mg/día42. Múltiples datos, aunque de diversos diseños metodológicos y con diferentes niveles de evidencia, informan de HPRL asociado a los APS de primera generación43: son haloperidol44 y flufenazina los que provocan más HPRL45 en sendos estudios observacionales y prospectivos.
La asociación estable entre HPRL y el uso de risperidona, paliperidona, amisulpride y la mayoría de los APS de primera generación hace que como grupo sean denominados en la literatura «APS prolacting-raising» o hiperprolactinémicos. Un estudio en 158 pacientes refractarios al tratamiento que compara los niveles de PRL de varios APS estima que un 60-100% de las mujeres y el 40-80% de los hombres tratados con un APS hiperprolactinémico presenta HPRL8.
En contraposición, otros APS atípicos, denominados en la literatura APS «prolacting-sparing», como aripiprazol, asenapina, clozapina, quetiapina y ziprasidona presentan un mejor perfil en relación con la escasa elevación de PRL5,46–49 (nivel de evidencia [NE]: Ib).
Olanzapina (OLZ) produce HPRL en menor cuantía que risperidona (90% en hombres y 87% en mujeres con risperidona) en un estudio a largo plazo en primeros episodios y permanece elevada con risperidona (70%) al año de inicio del tratamiento13. En un ensayo clínico controlado con placebo vs. haloperidol, OLZ provocó HPRL de manera dosis-dependiente: fue de 38% (15mg/día), 24% (10mg/día) y de 13% (5mg/día). La frecuencia de HPRL fue del 72% con haloperidol y 8% con placebo. Existió un efecto de normalización a las 6 semanas. La frecuencia de HPRL con OLZ fue comparable a placebo50 (NE: Ib). Con respecto a los APS de más reciente aprobación como iloperidona, tendría un perfil similar al de clozapina, mientras que lurasidona se asemejaría más al de olanzapina y ziprasidona51.
A modo de resumen, en un reciente metaanálisis sobre eficacia y tolerabilidad de 15 APS, se sitúa a paliperidona y risperidona como los APS más relacionados con HPRL. Aripiprazol y quetiapina son los de mejor perfil de HPRL (NE: Ia)52.
En pacientes «drug-naive» con diferentes diseños de predominio observacional, se ha observado que hasta el 20% de los individuos con riesgo de psicosis y hasta en un 70% presentan incrementos de PRL en el momento del diagnóstico del primer episodio13,53–56, que es más frecuente en las mujeres57 y no está asociado, en principio, ni con la edad ni con la gravedad de los síntomas clínicos. Sin embargo, estos aumentos iniciales son mucho más leves que los provocados por los APS. Esta leve elevación de PRL inicial en pacientes psicóticos puede explicarse por factores diferentes al tratamiento como el estrés asociado a la experiencia de la enfermedad, la estimulación del péptido liberador de la PRL, procesos de tipo inflamatorio, anomalías en la vía serotoninérgica o incluso el distrés producido por la inyección para la extracción sanguínea58. Existe una fuerte evidencia de que la causa de la HPRL moderada-grave y mantenida es el propio tratamiento con APS19,27,28 (NE: Ib). En un estudio aleatorizado abierto comparativo entre risperidona, haloperidol y olanzapina13 se detectó HPRL leve en el 58,5% de casos antes de instaurar tratamiento APS. Tras iniciarse el tratamiento, la tasa de HPRL moderada-grave a los 3 meses era del 60% y al año del 36%, mayor en el grupo de risperidona (71%) comparado con haloperidol (20%) y olanzapina (16%) (NE: Ib).
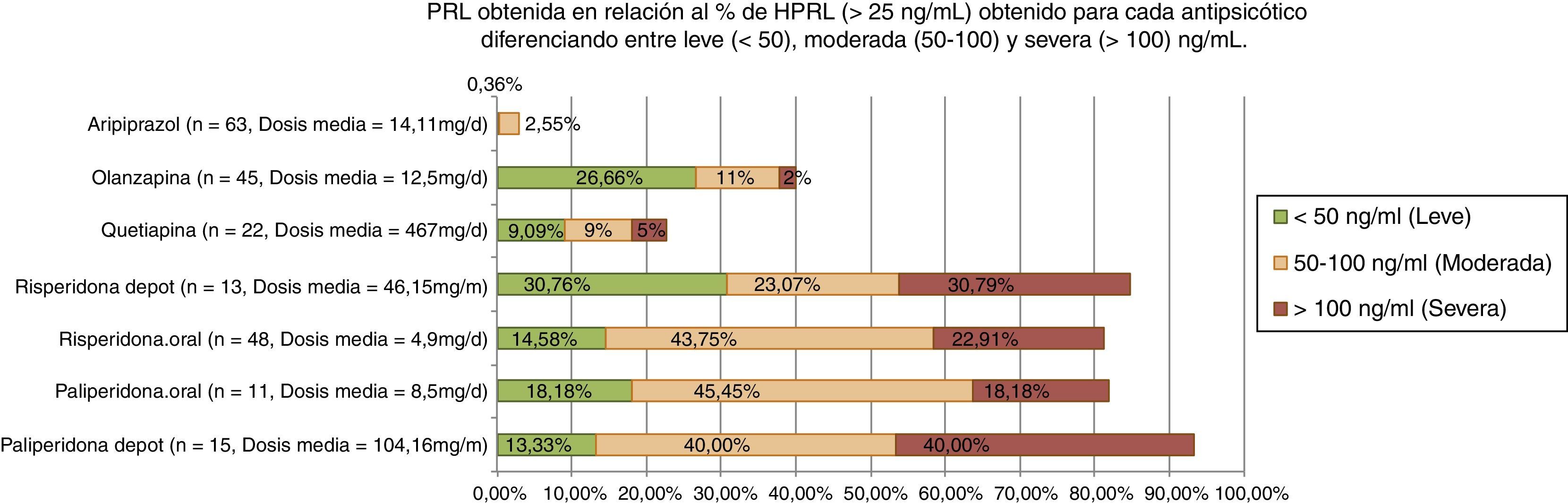
En un reciente estudio observacional y transversal, la HPRL provocada por APS se ha dividido en leve/moderada/grave siguiendo los criterios de Serri, 2003 (fig. 1). Se ha encontrado HPRL grave (>100ng/ml) en el 40% de pacientes con paliperidona depot; 30,8% con risperidona depot; 23% con risperidona y 18% con paliperidona a dosis clínicas habituales59.
A la luz de la evidencia disponible, existen pruebas consistentes de la relación directa entre HPRL y algunos tratamientos de APS (risperidona, paliperidona, amisulpride y haloperidol, fundamentalmente) y que con estos APS predominan las formas moderadas/graves sobre las leves por lo que es necesario conocer el alcance clínico en cada paciente y sus consecuencias a medio y largo plazo (NE: I y II).
Consecuencias clínicas de la hiperprolactinemia por antipsicóticosLas consecuencias clínicas de los efectos de la HPRL asociada al tratamiento APS en los pacientes con enfermedad mental grave no difieren de las descritas en personas sanas con HPRL. Las manifestaciones clínicas de la HPRL no son siempre visibles a corto plazo: a menudo se trata de efectos adversos rara vez comunicados espontáneamente por los pacientes (disfunción sexual) o que pueden ponerse de manifiesto tiempo después del inicio del tratamiento5,60 (NE: IIb).
Las consecuencias clínicas de la elevación patológica de los niveles de PRL pueden manifestarse a corto, medio y a largo plazo. Los efectos más inmediatos ocurren sobre la función gonadal y sexual y sobre la mama, tanto en mujeres como en varones. Las consecuencias a largo plazo vienen en buena medida condicionadas por el mantenimiento de estos efectos en el tiempo, pero también probablemente como consecuencia de otros efectos pleiotrópicos directos de la PRL en diferentes órganos y tejidos. Es importante para los clínicos tener en cuenta que, aun cursando de forma asintomática en el corto plazo, la HPRL mantenida en pacientes tratados con APS suele ser clínicamente relevante por las posibles complicaciones a largo plazo41. El efecto silente sobre el que hay mayores evidencias es el riesgo de fractura de cadera asociado a osteoporosis por HPRL (NE: II)61.
Seguidamente se analizan de forma más pormenorizada las diferentes manifestaciones clínicas de la HPRL mantenida.
HipogonadismoLa HPRL interfiere con la secreción pulsátil del factor liberador de gonadotrofinas inhibiendo la secreción hipofisaria de LH y FSH y generando hipogonadismo esto es, una disminución de estrógenos en las mujeres y una disminución de testosterona en los hombres27,62–64. La repercusión clínica va a venir condicionada por el sexo, la edad, la intensidad de la HPRL y su duración32,63,65. Las manifestaciones clínicas son más evidentes y ocurren de manera más temprana en las mujeres que en los varones, pero entrañan riesgos potenciales para la salud en ambos sexos.
En los niños y adolescentes el hipogonadismo por HPRL origina un retraso puberal. Los síntomas predominantes son la amenorrea en las niñas y el hábito eunucoide, con testes pequeños y blandos, en los varones66,67. De ahí la importancia de evaluar la morbilidad por HPRL de los APS que se prescriben a niños y adolescentes.
Tanto en mujeres como en hombres adultos la consecuencia más frecuente del hipogonadismo por HPRL es la disfunción sexual (DS), revisada en el apartado específico de DS más adelante y que incluye bajo deseo y problemas de excitación y orgasmo.
En las mujeres adultas premenopáusicas, la HPRL origina trastornos menstruales que, según la intensidad de la elevación hormonal y la sensibilidad individual, cursará con anovulación, acortamiento de fase lútea, oligomenorrea o amenorrea o infertilidad27,32,68. La HPRL crónica puede también cursar con síntomas de hiperandrogenismo como acné, hirsutismo e incremento de peso, mediados por un aumento secundario de la secreción de dehidroepiandrosterona por parte de las adrenales y por una disminución de la proteína transportadora de hormonas sexuales, con el consiguiente incremento de los niveles de testosterona libre69,70.
La infertilidad puede ser una de las mayores frustraciones para algunas pacientes jóvenes que planean quedarse embarazadas y para sus parejas. El deseo de maternidad pocas veces es explorado por los médicos antes de iniciar un APS con HPRL y, por lo tanto, la infertilidad asociada puede interferir en los planes de vida de los pacientes17.
En el varón, el hipogonadismo por HPRL causa disminución de la producción espermática, y puede llegar incluso a la infertilidad64, también causa la aparición de síntomas generales secundarios al descenso de los niveles de testosterona como astenia, fatigabilidad, disminución de la masa muscular y del vello corporal27,68,71.
Disfunción sexualUn porcentaje importante de los pacientes en tratamiento por APS presenta DS (38-68%) dependiendo de los sistemas de medida17,72,73 y, desafortunadamente, menos del 38% lo comunican espontáneamente, por lo que tiende a pasar desapercibido17. Se ha demostrado que la frecuencia es más alta cuando se utilizan cuestionarios validados para detectar DS en estos pacientes como la escala PRsexDQ-SalSEX4 (NE: IIb).
Existen múltiples estudios con diferentes NE que demuestran la asociación entre APS hiperprolactinémicos (risperidona fundamentamente) y la aparición de DS. Este efecto adverso es menos frecuente con otros APS como aripiprazol, quetiapina, ziprasidona e, incluso, olanzapina4,17,74–77. Estos datos se han analizado en un reciente metaanálisis78 y en un artículo de revisión específico sobre el tema79.
Las manifestaciones más frecuentes de la DS por HPRL son la disminución de la libido17,80,81 y la disfunción de excitación/orgasmo17,82 (NE: IIb). La combinación de disminución de la libido con disfunción eréctil es el patrón más frecuente en varones con HPRL, que es generalmente mal tolerado por los pacientes sexualmente activos. El retraso o ausencia de orgasmo puede asociarse al patrón anterior o, más raramente, presentarse de manera aislada. En las mujeres puede aparecer dispareunia secundaria a sequedad vaginal.
La DS causa un deterioro en la calidad de vida de los pacientes, especialmente en el varón83–85, y tiene un impacto sustancial en la adherencia al tratamiento medida con cuestionarios específicos y validados para disfunción sexual en esquizofrenia (PRSexDQ-SALSEX)4, o a través de encuestas86. Según estos datos obtenidos de pacientes con esquizofrenia seleccionados con criterios de inclusión y exclusión, hasta un 36% de los pacientes varones declara haber abandonado el tratamiento de APS o estar pensando en hacerlo a causa de la DS, cifra que se reduce al 19% en las mujeres17. De ahí la importancia de evaluar de forma sistemática la presencia e intensidad de DS en pacientes tratados con APS (NE: IIb).
La DS provoca también el deterioro de las relaciones interpersonales de los pacientes y dificultades importantes a la hora de conseguir y mantener vínculos afectivos17,87,88, lo que, sin duda, deteriora el estado clínico y contribuye al aislamiento y empeoramiento de los síntomas negativos. Los varones sufren especialmente este problema y están en doble riesgo de incumplimiento que las mujeres17,86.
En cuanto al mecanismo fisiopatogénico de la DS por APS, a pesar de que hay cierta discusión sobre si la PRL es el único factor implicado, existen datos consistentes sobre su papel en este efecto adverso89–91. La DS vendría condicionada en gran medida por la situación de hipogonadismo secundario a la HPRL, si bien también hay datos a favor de un efecto directo de la HPRL en la libido y en la disfunción eréctil80,92 (NE: IIb), probablemente mediado por el sistema dopaminérgico93. A nivel local, la disfunción eréctil estaría relacionada con la disfunción endotelial secundaria a la disminución de la producción de óxido nítrico (ON) por inhibición de la ON sintetasa endotelial94,95 y la vasoconstricción por efecto beta 2 adrenérgico96. No obstante, en algún estudio específico de DS en pacientes con HPRL secundaria al uso de APS, no se observó una relación directa con los niveles séricos de PRL97. Probablemente la elevación de la PRL no sea, por tanto, el único factor responsable de la DS en pacientes tratados con APS, aunque sí uno de los más implicados.
Efectos de la hiperprolactinemia sobre la mamaLa galactorrea es una de las posibles manifestaciones de la HPRL sobre la mama, con una prevalencia estimada de entre 10 y 50% en pacientes con esquizofrenia tratados con antipsicóticos98,99. Es más común en mujeres premenopáusicas que en varones y mujeres posmenopáusicas, ya que se requiere una adecuada imprimación del tejido mamario por estrógenos y progesterona100,101.
Otro de los efectos de HPRL sobre la mama en los varones es la ginecomastia, uni- o bilateral, presente hasta en un 20% de los pacientes según las series102 (NE: IV). Se ha encontrado ginecomastia en varones tratados con risperidona y cifras de PRL normal, lo que indica hipersensibilidad en el receptor de PRL103.
La galactorrea y la ginecomastia son consecuencia del efecto proliferativo de la PRL sobre las células epiteliales, y de la estimulación de la síntesis de ADN, caseína, lactoalbúmina, lactosa y ácidos grasos libres24.
El posible efecto proliferativo tumoral de la PRL sobre la mama se recoge más adelante en el apartado de HPRL y riesgo de cáncer, pues la HPRL estimularía la proliferación tumoral así como la migración y supervivencia de estas células en aquellos tumores con alta expresión del receptor de membrana para la PRL104.
Efectos de la hiperprolactinemia sobre el huesoEn los pacientes con psicosis la masa ósea está disminuida en relación con su edad y sexo105,106, especialmente en la población más joven y, además, la prevalencia de osteoporosis es elevada107 con un riesgo de fractura aumentado61,108 (NE: IIa). Existen diversos factores de riesgo implicados, como el estilo de vida sedentario, el mayor grado de tabaquismo y consumo de alcohol109,110 o los niveles bajos de vitamina D105,111. Sin embargo, el factor más relevante y estudiado en los últimos años es el tratamiento con APS a largo plazo y su relación con la elevación de los niveles de PRL, incluso en jóvenes112 (NE: IIb).
Existen datos consistentes sobre la asociación de la HPRL en pacientes con psicosis, la disminución de hormonas sexuales y de la masa ósea y el incremento del riesgo de fractura (NE: IIa). En un reciente estudio longitudinal se analizó la evolución de la densidad mineral ósea (DMO) medida por densitometría DXA en pacientes tratados con APS durante una media de 26,7 ± 13,8 años (DE), y se observó una tendencia a mantenerse más elevada en el grupo de los APS no hiperprolactinémicos113. En otro estudio de cohortes en gemelos se comprobó una mayor reducción de la DMO en mujeres con esquizofrenia tratadas con APS comparadas con sus gemelos, más acusada en el grupo de APS que elevan la PRL114 (NE: IIb). En un extenso estudio de casos y controles, se observó también la relación entre el tratamiento con APS hiperprolactinémicos y fractura de cadera, tanto en los varones (OR 2,6; IC 95%: 2,43–2,78), como en las mujeres (OR 1,93; IC 95%: 1,78-2,10)61 (NE: IIb). Un estudio transversal en mujeres posmenopáusicas con esquizofrenia refiere que las que tomaban APS elevadores de PRL tenían menores niveles de hormonas sexuales y DMO comparado con el grupo de olanzapina112. En otro estudio transversal con 402 pacientes diagnosticados de esquizofrenia y tratamiento APS superior a 3 meses, se constató que el 25% de las mujeres y el 33% de los varones tenían una masa ósea baja, asociada a niveles elevados de PRL en los varones115. Se observó un aumento de los marcadores de remodelado óseo relacionado con la duración del tratamiento y, en los varones, con una disminución de la testosterona. También se constató una disminución de la DMO del radio en otro estudio trasversal en 74 varones con esquizofrenia tratados con APS, de los que un 87% presentaba HPRL que se correlacionaba con niveles bajos de FSH, LH y estradiol116. Existió, asimismo, una correlación negativa entre la duración del tratamiento y la masa ósea.
Aunque es universalmente admitido que el déficit de esteroides sexuales constituye el mecanismo fisiopatológico fundamental por el que la HPRL condiciona la disminución de la DMO, algunos estudios experimentales apuntan a un posible efecto adverso directo de la PRL sobre la función osteoblástica117. Ello explicaría el hallazgo en algunos estudios clínicos de un mayor deterioro de DMO en mujeres amenorreicas con HPRL frente a normoprolactinémicas con similares niveles de estradiol y duración de la amenorrea71 y el mayor riesgo de fracturas vertebrales en varones con HPRL, independientemente de sus valores de testosterona118 (NE: III).
Efecto de la hiperprolactinemia y riesgo de cáncerParece que ciertos tumores fundamentalmente hormonodependientes, como el de mama, pueden relacionarse con la ruta molecular de señalización de los receptores de PRL. No obstante, existen importantes limitaciones de tipo epidemiológico a la hora de establecer la relación entre la HPRL asociada a la administración crónica APS y la malignización celular119. De ahí las conclusiones contradictorias de los más de 20 estudios de casos y controles publicados al respecto, muchos de ellos con muestras pequeñas y determinaciones hormonales posteriores al diagnóstico del tumor, que no permiten confirmar si hubo o no exposición previa a HPRL mantenida, ni su grado7. A pesar de todo, existe creciente evidencia de una posible relación entre la HPRL mantenida a largo plazo por el uso de antipsicóticos y algunos tipos de cáncer como el de mama y endometrio, entre otros.
Cáncer de mamaA pesar de las limitaciones y de la imposibilidad de tener niveles de evidencia tipo I o ensayos clínicos al respecto, existe un importante número de estudios, tanto experimentales como epidemiológicos, que señalan que los niveles plasmáticos elevados de PRL parecen relacionarse con un riesgo incrementado de cáncer, fundamentalmente de mama, en especial en mujer posmenopáusica (NE: III)120–125. En un amplio estudio de casos y controles recientemente publicado, se observó un incremento significativo del riesgo de cáncer de mama en el grupo de mujeres posmenopáusicas con niveles más elevados de PRL: la relación más marcada fue en el caso del carcinoma lobular vs. el de tipo ductal, e independiente del receptor estrogénico (NE: III)126. En otra serie de estudios prospectivos de casos y controles anidados previos se detectó también un aumento del riesgo relativo de cáncer de mama de 1,7 en el grupo con valores más altos de PRL, incrementado hasta 2,1 veces en el caso de los tumores con receptor estrogénico positivo, si bien en estas muestras la relación resultó ser independiente del estado menopáusico, del tipo de tumor y de su grado de invasividad (NE: III)127. Un estudio observacional muy reciente con más de 30.000 mujeres en seguimiento durante 20 años concluyó que los niveles altos de PRL medidos en los 10 años más próximos del diagnóstico tumoral están fuertemente asociados con el riesgo de cáncer de mama en pacientes posmenopáusicas, especialmente para tumores con receptor estrogénico positivo y enfermedad metastásica (NE: IIb)128.
Existen incluso estudios de supervivencia que indican que los casos de cáncer de mama con HPRL previa a la instauración del tratamiento antineoplásico se asocian a tasas más altas de fracaso terapéutico, recurrencia temprana y peor supervivencia global129.
En cuanto a las bases fisiopatogénicas que explicarían este mayor riesgo de cáncer de mama, la propia PRL estimularía la proliferación tumoral, así como la migración y supervivencia de estas células, en aquellos tumores con alta expresión del receptor de membrana para la PRL, que llegan al 95% de los tumores mamarios104.
Otros tipos de cáncer: ovario y endometrioEn relación con el cáncer de ovario y endometrio, diferentes estudios describen una elevación de los niveles circulantes de PRL en las pacientes que los presentan130–132 (NE: III), así como una sobreexpresión de los receptores de esta hormona en ambos tipos de tejido tumoral, lo que podría indicar algún papel de la PRL en el desarrollo de la transformación neoplásica inicial, posiblemente a través de una potencial activación del oncogén Ras132.
En cuanto al cáncer de próstata, se han publicado datos contradictorios, si bien el mayor NE existente parece señalar que la HPRL se relaciona con un riesgo igual o incluso reducido de desarrollar cáncer de próstata (NE: IIb-III)133,134.
Con respecto a otros tipos de cáncer, en un reciente estudio de cohortes se observó una asociación positiva entre niveles elevados de PRL y mortalidad por cáncer en varones en general, aunque no en mujeres3 (NE: IIb). En el estudio de cohortes de Berinder134 se objetivó un aumento generalizado del riesgo de cáncer asociado a la HPRL, fundamentalmente a expensas de tumores del tracto gastrointestinal superior en ambos sexos y de estirpe hematopoyética en mujeres (NE: IIb). Sin embargo, el riesgo concreto de cáncer de mama no se vio incrementado de forma significativa en esta serie.
Hiperprolactinemia y efectos cardiovascularesLa HPRL se ha asociado a efectos cardiovasculares a largo plazo, mediados principalmente por el déficit de esteroides sexuales y por acción directa de la PRL a nivel cardiovascular. Recientemente, en un estudio de cohortes que incluía a 3.929 hombres y mujeres seguidos durante 10 años, se demuestra una correlación positiva entre niveles de PRL y mortalidad cardiovascular en ambos sexos3 (NE: IIb). En mujeres con menopausia precoz se ha demostrado una correlación entre los niveles de PRL, la presión arterial y la rigidez de la pared arterial, que puede indicar una aceleración del proceso aterosclerótico con incremento del riesgo calculado de mortalidad cardiovascular a 10 años135 (NE: III).
Estudios in vitro han demostrado que la PRL per se puede modular la respuesta inflamatoria136–138 (NE: III) y producir disfunción endotelial al reducir la producción de NO94–96,139 (NE: IIa). La PRL podría también estimular la angiogénesis de manera indirecta, al promover la síntesis de sustancias como el factor de crecimiento endotelial o el factor de crecimiento de fibroblastos140,141, estimulando la proliferación de las células musculares lisas de la pared vascular y la adhesión de las células mononucleares al endotelio vascular. También se ha relacionado a la PRL con un aumento de la agregación plaquetaria142 (NE: III) y con un incremento del grosor de la íntima a nivel carotídeo, compatible con una aterosclerosis preclínica143 (NE: III). Por último, se ha demostrado la expresión de receptores de PRL en macrófagos de la placa de ateroma144,145.
Hiperprolactinemia y efectos metabólicosTambién existe cierta evidencia de una influencia directa de la HPRL en el metabolismo lipídico e hidrocarbonado146. Se ha descrito la asociación entre HPRL y dislipidemia137 (NE: III), pues los receptores de PRL se expresan en el tejido adiposo humano147 donde la PRL reduce la actividad de la lipoproteinlipasa e inhibe la secreción de adiponectina, originando a su vez resistencia a la insulina148,149. Estudios in vitro también han demostrado la potencial influencia de esta hormona en el desarrollo de las células β-pancreáticas y en la secreción de insulina150,151. Algunos ensayos clínicos139,152 realizados en un pequeño número de pacientes evidencian la existencia de resistencia a la insulina en pacientes con HPRL que mejora tras el tratamiento con bromocriptina (NE: IIa). Otros autores no encuentran correlación entre los niveles de PRL y diferentes parámetros del síndrome metabólico153 o no obtienen evidencia suficiente de que los niveles de PRL jueguen un papel causal como factor de riesgo para el desarrollo de síndrome metabólico o diabetes de tipo 2154 (NE: IIb).
La HPRL se ha asociado también con incremento ponderal, no siempre reversible, cuando se normalizan los niveles de PRL mediante tratamiento farmacológico155–157 (NE: IV). En su patogenia se han barajado factores como la reducción del tono dopaminérgico, la resistencia a la leptina o el descenso de los niveles de adiponectina158.
Efectos sobre el sistema inmuneVarios autores han descrito una asociación entre HPRL y diferentes enfermedades autoinmunes, como la diabetes mellitus tipo I, la artritis reumatoide o el lupus eritematoso sistémico, entre otras30,159–162 (NE: IV). El mecanismo fisiopatológico podría estar mediado por el efecto antiapoptótico de la PRL en los linfocitos B163,164 y la estimulación de la producción de interferón-γ e interleucina-2 por los linfocitos T30.
Efectos sobre el sistema nervioso central: función cognitiva y emocionalesUn estudio reciente en población femenina no psiquiátrica señala que la HPRL puede tener efectos negativos directos en la función cognitiva165 (NE: III), cuyo origen podría estar en los niveles bajos de esteroides gonadales (NE: Ib-IIa)166–169. También en varones se ha observado que los niveles bajos de testosterona se relacionan con deterioro de la memoria y de las habilidades visuoespaciales170–172 y con un mayor riesgo de demencia173 (NE: IIb). No obstante, serían necesarios estudios específicos en población con HPRL secundaria a APS para evaluar este posible efecto cognitivo en relación con este efecto adverso.
También se ha relacionado a la HPRL con algunas alteraciones psiquiátricas, sobre todo en mujeres174. Se han descrito mayores tasas de hostilidad, ansiedad, depresión y distimia en pacientes con hiperprolactinemia175,176 (NE: III). El mecanismo por el que se originaría no está claro y probablemente está en relación con la situación de hipogonadismo69,177.
Resumen de niveles de evidenciaLa HPRL es uno de los efectos adversos infravalorado/desconocido por los prescriptores de APS. Las consecuencias a corto, medio y largo plazo de la HPRL comprometen la adherencia terapéutica, e incluso pueden ser graves.
- 1.
La PRL se incrementa tras la administración de algunos APS. Los que producen niveles más elevados son los APS típicos, amisulpride, risperidona y paliperidona y los que menos clozapina, quetiapina y aripiprazol (que incluso baja los niveles previos de PRL) (NE: I).
- 2.
Existe evidencia de que la HPRL se relaciona claramente con efectos adversos sobre la sexualidad, fertilidad, la mama y el hueso (NE: I y II) y existen datos que a largo plazo indican una asociación con el incremento del riesgo cardiovascular así como de algunos tipos de cáncer, especialmente en mama y endometrio (NE: IIb y III).
- 3.
La población infantil y anciana es más sensible a las consecuencias de la HPRL, que afecta a la formación de hueso en los más jóvenes, en quienes debería evitarse por el gran riesgo de masa ósea baja y, por tanto, osteoporosis y fracturas en etapas posteriores (NE: II).
La HPRL desafortunadamente y con frecuencia puede pasar inadvertida para los clínicos, y dar lugar a una exposición prolongada de los pacientes a PRL que puede tener consecuencias graves para la salud de los pacientes a corto, medio y largo plazo4,178.
Método de determinación de los niveles de prolactinemiaLas guías de la Endocrine Society21, de la Pituitary Society63, de la British Association for Psychopharmacology178 y de la Sociedad Española de Endocrinología y Nutrición (SEEN)68 coinciden en que la determinación de PRL en una extracción única es suficiente para el diagnóstico si la venopunción no ha sido traumática. Esta puede hacerse a cualquier hora del día, con el paciente en reposo y al menos una hora después de haberse despertado o de haber ingerido alimento. Si los niveles de PRL están elevados en esta primera determinación, sobre todo si la elevación es discreta, debe confirmarse repitiendo la extracción otro día, con colocación previa de catéter y con 2 o 3 muestras obtenidas a intervalos de 15-20 min para minimizar el efecto del estrés y de la pulsatilidad. Si se confirma la HPRL, hay que descartar que sea secundaria a la presencia de niveles circulantes elevados de macroprolactina (moléculas de PRL de mayor tamaño, en general por unión de la PRL a un anticuerpo IgG, o bien por dimerización o glucosilación de la PRL monomérica). La macroprolactina tiene una baja actividad biológica y se acumula por disminución de su aclaramiento, dando lugar a una pseudo-HPRL. Puede estar presente en el 20-40% de los pacientes con HPRL21,63.
No obstante, en aras de una práctica clínica realista y efectiva en pacientes en tratamiento con APS, basándonos en evidencias recientes, una única toma sería suficiente. En un estudio comparativo en pacientes con esquizofrenia y tratados con APS se realizaron medidas de PRL con 2 técnicas diferentes (toma única a primera hora de la mañana versus 3 tomas secuenciadas separados por 20 min) y se encontraron variaciones que pueden considerarse insignificantes desde el punto de vista clínico (1-3ng/ml)59.
La recomendación de la Endocrine Society21 y de la SEEN68 es que una vez confirmada la HPRL y descartada la macroprolactina como causa, se suspenda el fármaco sospechoso, si es posible, durante 72 h o se sustituya por otro de similar eficacia para la enfermedad de base del paciente y que no eleve la PRL, y se repita la prueba. Si persiste la HPRL o bien no es posible suspender el fármaco, recomiendan realizar RMN hipofisaria para descartar prolactinoma. Si no fuera posible hacer RMN, realizar tomografía computarizada de alta definición.
De cara a detectar de forma precoz la HPRL y sus posibles síntomas asociados, tras la reunión de consenso, nuestro grupo propone una serie de recomendaciones a tener en cuenta en los pacientes con necesidad de tratamiento prolongado con APS, además de informar a los pacientes adecuadamente sobre los aspectos de seguridad y tolerabilidad del tratamiento que se le prescribe, a fin de mejorar su bienestar y evitar el posible abandono ante la aparición de efectos adversos de los que no haya sido debidamente informado (p. ej. DS o infertilidad). Por otra parte, la falta de información adecuada podría tener consecuencias éticas y clínicas en el futuro.
Recomendaciones para el diagnóstico de hiperprolactinemia- 1.
Hacer una anamnesis inicial detallada, incluyendo la presencia de factores de riesgo (fundamentalmente de osteoporosis y cáncer) en antecedentes personales y familiares; presencia de DS previa, historia menstrual/menopáusica; posibilidad/deseo de un embarazo actual o futuro, historia de galactorrea o ginecomastia, historia previa o familiar de cáncer de mama o prolactinoma, así como antecedentes de fracturas u osteoporosis diagnosticada. Se recomienda incluir toda esta información en la historia clínica habitual de forma que quede clara constancia de que se ha informado al respecto.
- 2.
Se recomienda informar a los pacientes de los efectos asociados a la HPRL cuando se detecta (NE: I; GR: A) y decidir conjuntamente con ellos la mejor estrategia para mantener la eficacia y preservar la seguridad y la adherencia.
- 3.
Se recomienda la determinación sistemática de niveles de PRL, al tratarse de un conjunto de efectos secundarios a menudo silentes y rara vez comunicados espontáneamente, en todos los pacientes con tratamiento APS de forma rutinaria y continuada, basalmente y a los 3 meses del inicio del tratamiento (GR: A). En los casos en que se detecte HPRL (bien sea asintomática o bien aparezcan síntomas-signos indicativos de HPRL) se recomienda seguimiento periódico de niveles séricos, dependiendo de la gravedad de la HPRL. La ausencia de amenorrea o galactorrea no es suficiente para interpretar que no existe clínica de HPRL, y es recomendable explorar siempre posible DS como marcador en pacientes sexualmente activos. Niveles de HPRL leves (25-50ng/ml) deben ser monitorizados periódicamente (cada 6 meses) y en caso de amenorrea >3 meses hay que valorar el cambio de APS por el riesgo de osteoporosis (NE: II; GR: B). En caso de niveles PRL >150ng/ml, se recomienda descartar prolactinoma y realizar pruebas de imagen adecuadas (RNM) o derivar a Endocrinología (GR: B).
- 4.
Si se prescribe aumento de dosis o cambio del APS es conveniente reevaluar la PRL a los 3 meses de establecido el tratamiento, especialmente en los pacientes tratados con un APS asociado a HPRL (GR: A).
- 5.
Si hay HPRL, es recomendable evaluar conjuntamente el estado hormonal gonadal, con determinaciones de FSH, LH y testosterona junto a la PRL, basalmente y cada 6 meses para descartar hipogonadismo (GR: B).
- 6.
Se recomienda explorar de forma rutinaria los efectos adversos más frecuentemente asociados a HPRL, con especial hincapié en aquellos que los pacientes no reportan de forma espontánea como la DS (GR: A). Los pacientes con vida sexual activa y los que planean un embarazo deben ser especialmente seleccionados para evitar la HPRL. La maternidad puede ser un deseo para muchas pacientes y debería ser tenida siempre en cuenta, discutida y valorada adecuadamente junto con la realidad clínica de cada caso (GR: B).
- 7.
Las posibles alteraciones sobre la mama y el ciclo menstrual en la mujer deben ser explorados tanto al inicio del tratamiento como durante el seguimiento, al menos trimestralmente. Sería de gran ayuda completar un formulario específico para seguimiento de todos estos posibles síntomas secundarios a HPRL (GR: B).
- 8.
En pacientes en los que se detecte HPRL y que hayan tenido una exposición prolongada al tratamiento de APS (>5 años) se debe realizar examen de densidad ósea para evaluar el riesgo de fractura y osteoporosis mediante la medida de la DMO, preferentemente con DXA lumbar y de zona proximal de fémur por su mayor coste-efectividad (GR: B).
- 9.
Se debe considerar como situación de alto riesgo de fractura si hay historia de fractura por fragilidad u osteoporosis densitométrica (T-score<−2,5) en varones >50 años y en mujeres posmenopáusicas. Pueden utilizarse escalas de riesgo de fractura para calcular el riesgo absoluto de fractura osteoporótica calculado por FRAX. Puede considerarse situación de alto riesgo para fractura de cadera cuando es>3% o para fractura mayor si es>10% a partir de los 50 años (GR: B). En relación con el riesgo incrementado de osteoporosis, es también conveniente medir los niveles de vitamina D a nivel basal y cada 6 meses si hay HPRL (GR: B).
- 10.
Las opciones de tratamiento de la HPRL podrán ser consideradas en función del tipo de efecto secundario detectado, su impacto en el paciente, la ponderación cuidadosa de los beneficios y desventajas de continuar con la medicación actual o iniciar una nueva estrategia terapéutica (GR: B).
- 1.
Niveles superiores a 50ng/ml o con repercusión clínica (incluyendo exploración sistemática de DS mal tolerada) requieren una intervención en el tratamiento adecuada a cada caso particular, como disminución de dosis, cambio de APS o adición de fármacos con demostrada capacidad para disminuir los niveles de PRL (aripiprazol) (NE: I; GR: A).
- 2.
En casos de HPRL grave (>100ng/ml) debería siempre intervenirse aunque no exista amenorrea-galactorrea por el riesgo a medio/largo plazo de osteoporosis, enfermedad cardiovascular y posible incremento de los factores de riesgo de cáncer de mama o endometrio (NE: II; GR: B).
Es deseable la construcción de un nuevo modelo de intervención en los problemas relacionados con la seguridad, la calidad de vida y la adherencia al tratamiento que considere la valoración exhaustiva de los efectos secundarios asociados al uso de APS, a menudo no manifestados por el paciente o minimizados por el médico evaluador, pero que comprometen la continuidad y la seguridad del paciente.
FinanciaciónEl consenso ha sido financiado por laboratorios Lundbeck y Otsuka.
Conflicto de intereses1. Dr. Montejo ha sido consultor o ha recibido honorarios o fondos de investigación de Eli Lilly, Forum Pharmaceuticals, Rovi, Servier, Lundbeck, Otsuka, Janssen Cilag, Pfizer y Roche, Instituto de Salud Carlos III, Junta de Castilla y León, Osakidetxa.
2. Dr. Arango ha sido consultor o ha recibido honorarios o fondos de investigación de Abbot, AMGEN, AstraZeneca, Bristol-Myers Squibb, Caja Navarra, CIBERSAM, Fundación Alicia Koplowitz, Instituto de Salud Carlos III, Janssen Cilag, Lundbeck, Merck, Ministerio de Ciencia e Innovación, Ministerio de Sanidad, Ministerio de Economía y Competitividad, Mutua Madrileña, Otsuka, Pfizer, Roche, Servier, Shire, Takeda y Schering Plough.
3. Dr. Bernardo ha sido consultor o ha recibido honorarios o fondos de investigación de ABBiotics, Adamed, AMGEN, Eli Lilly, Ferrer, Forum Pharmaceuticals, Gedeon, Janssen-Cilag, Lundbeck, Otsuka, Pfizer y Roche.
4. Dr. Carrasco ha sido consultor o ha recibido honorarios o fondos de investigación de Lilly, Janssen-Cilag, Pfizer y Lundbeck. También ha participado como orador en Lilly, Janssen-Cilag, Lundbeck, Pfizer, Servier y Otsuka.
5. Dr. Crespo-Facorro ha sido consultor o ha recibido honorarios o fondos de investigación de Otsuka, Lundbeck y Johnson & Johnson.
6. Dr. Cruz Hernández ha sido consultor o ha recibido honorarios o fondos de investigación de Janssen-Cilag, Eisai, Roche Farma, Mundipharmaceuticals, Astra-Zeneca, Glaxosmithkline, Sanofi-Aventis, Celgen, Lundbeck España S.A., Bristol-Myers Squibb, Pfizer, Merck Sharp y Dohne Spain.
7. Dr. del Pino-Montes ha sido consultor o ha recibido honorarios o fondos de investigación de AMGEN, Lilly, Lundbeck, MSD, Otsuka y Pfizer.
8. Dr. García Escudero ha sido consultor o ha recibido honorarios o fondos de investigación de Janssen, Otsuka, Pfizer, Esteve y Servier.
9. Dr. García ha sido consultor o ha recibido honorarios o fondos de investigación de Ferrer, Otsuka, Bristol Myers Squibb, Janssen Cilag, Lundbeck y Eli Lilly.
10. Dra. Gonzalez-Pinto ha sido consultora o ha recibido honorarios o fondos de investigación de Almirall, AstraZeneca, Bristol-Myers Squibb, Cephalon, Eli Lilly, Glaxo-Smith-Kline, Janssen-Cilag, Jazz, Johnson & Johnson, Lundbeck, Merck, Otsuka, Pfizer, Sanofi-Aventis, Servier, Shering-Plough, Solvay, CIBERSAM, Instituto Carlos III, Gobierno Vasco, Stanley Medical Research Institute y Wyeth.
11. Dra. Ana I. Hernández no tiene conflicto de intereses.
12. Dr. Martin-Carrasco ha sido consultor o ha recibido honorarios o fondos de investigación de Esteve, Eli Lilly, Glaxo-Smith-Kline, Janssen, Lundbeck, Novartis, Otsuka, Pfizer, Rovi, Servier, y del CIBERSAM.
13. Dr. Mayoral ha sido consultor o ha recibido honorarios o fondos de investigación de Roche, Lundbeck y Jansen
14. Dra. Mayoral van Son no tiene conflicto de intereses.
15. Dra. Mories ha sido consultor o ha recibido honorarios o fondos de investigación de Eli Lilly, Lundbeck, Novo Nordisk y Weber Economía y Salud S.L.
16. Dr. Ros ha sido consultor o ha recibido honorarios o fondos de investigación de Otsuka, Lundbeck, Servier, Ferrer, Pfizer y Esteve.
17. Dr. Vieta ha sido consultor o ha recibido honorarios o fondos de investigación de AstraZeneca, Bristol-Myers Squibb, Eli Lilly, Ferrer, Forest Research Institute, Gedeon Richter, Glaxo-Smith-Kline, Janssen, Lundbeck, Otsuka, Pfizer, Roche, Sanofi-Aventis, Servier, Shire, Solvay, Sunovion, Takeda, Teva, CIBERSAM, the Seventh European Framework Programme (ENBREC), y de la Stanley Medical Research Institute.
18. Dra. Isabella Pacchiarotti no tiene conflicto de intereses.