Se denomina psicosis inducida por sustancias (PIS) a la psicosis que empieza en el contexto del uso de una sustancia pero persiste días y semanas en ausencia del uso continuado de la misma. Los conocimientos sobre el curso longitudinal de las PIS son aún escasos y sugieren que un porcentaje importante son más adelante diagnosticadas de trastorno mental grave (TMG). El objetivo de este estudio es analizar la evolución de las PIS a TMG en nuestro medio y los posibles factores que puedan estar implicados en esa conversión.
Material y métodosUtilizamos un diseño retrospectivo de seguimiento de una cohorte. Se revisaron todos los diagnósticos de los pacientes dados de alta en la unidad de hospitalización de psiquiatría del Hospital Universitario de Basurto desde enero de 2002 hasta diciembre de 2015. Además de datos sociodemográficos y clínicos se recogió información sobre el consumo de cannabinoides, opiáceos, anfetaminas, cocaína y alcohol. Los datos se analizaron mediante estadística descriptiva, curvas de supervivencia Kaplan-Meier y regresión de Cox.
ResultadosDe los 116 pacientes incluidos el 78,4% fueron hombres, tenían una edad media de 33,0 (DE: 8,9) años y el 44,0% estaban solteros; el 31,0% tenían antecedentes familiares psiquiátricos; la sustancia más consumida fue cannabis (60,3%), seguido por cocaína (40,5%). El riesgo acumulado de conversión diagnóstica a TMG en 16años fue del 41,6% (IC95%: 32,2-52,2) en un tiempo medio de 36,43meses.
ConclusionesEn las intervenciones en episodios de PIS debemos tener presente que una proporción importante evolucionará a TMG en los tres primeros años.
Substance-induced psychosis (SIP) is the name given to a psychosis that starts in the context of substance abuse but persists for days and weeks with no substance use. There is as yet little knowledge about the longitudinal course of this psychosis, which suggests that significant numbers go on to be diagnosed with a severe mental disorder (SMD). The objective of this study was to analyse the progression of SIP to SMD in our environment and the possible factors that may be involved in that conversion.
Material and methodsWe used a retrospective cohort follow-up design. We reviewed all diagnoses of patients discharged from the psychiatric hospitalisation unit of the University Hospital of Basurto from January 2002 to December 2015 inclusively. In addition to sociodemographic and clinical data, information was collected on the consumption of cannabinoids, opioids, amphetamines, cocaine and alcohol. The data were analysed using descriptive analysis, Kaplan-Meier survival curves and Cox regression.
ResultsOf the 116 patients, 78.4% were male, had an average age of 33.0 (SD: 8.9) years and 44.0% were single; 31.0% had a psychiatric family history; the most commonly used substance was cannabis (60.3%), followed by cocaine (40.5%). The cumulative risk of diagnostic conversion to an SMD in 16years was 41.6% (95%CI: 32.2-52.2) over a mean 36.43months.
ConclusionsIn interventions in episodes of SIP we must bear in mind that a significant proportion will progress to an SMD in the first three years.
Se denomina psicosis en sentido amplio a cuadros clínicos heterogéneos con repercusión grave en el funcionamiento de las personas que presentan una alteración en el juicio de realidad con síntomas psicóticos, principalmente delirios y alucinaciones, y otros, como alteraciones formales del pensamiento y de la afectividad1. El modelo de vulnerabilidad/estrés plantea que determinados individuos son vulnerables o están predispuestos a la psicosis, y que algunos factores ambientales pueden influir en la activación de esta predisposición favoreciendo la activación del trastorno o, al contrario, ejercer un papel protector2. El consumo de sustancias puede provocar sintomatología psicótica en diferentes contextos, incluyendo intoxicación aguda, abstinencia, delirium por intoxicación o abstinencia, trastornos afectivos con síntomas psicóticos inducidos por sustancias y psicosis inducida por sustancias (PIS) o psicosis tóxica. La PIS ha sido conceptualizada como aquella condición en la que la psicosis empieza en el contexto de un uso de sustancia pero persiste días y semanas en ausencia del uso continuado de la misma3. La lista de sustancias potencialmente inductoras es extensa4. Hay evidencias de que cannabis, anfetaminas y alcohol pueden además provocar síntomas psicóticos persistentes5. La PIS es un cuadro de presentación frecuente en hospitales y servicios de emergencias, pero la investigación de su tratamiento y de su curso longitudinal es escasa6. Resulta difícil diferenciar entre los pacientes con PIS o con psicosis secundaria al consumo de sustancias y en quienes la sintomatología se debe a un trastorno psicótico primario o un trastorno mental grave5. El concepto de trastorno mental grave (TMG) engloba un heterogéneo grupo de enfermedades mentales que incluye generalmente la esquizofrenia y los trastornos del espectro de esquizofrenia (TEE), los trastornos afectivos con síntomas psicóticos y algunos trastornos de personalidad graves; la característica determinante es que generan alteraciones mentales de duración prolongada que conllevan discapacidad y disfunción social relevantes, y que requerirán atención prolongada por parte de los recursos sociosanitarios y las redes de atención psiquiátrica. La incidencia y la prevalencia en la población general no son claras, y tampoco los factores de riesgo asociados a la PIS que inducen un trastorno mental permanente7. Las guías de tratamiento precoz de PIS son menos claras que las guías para el tratamiento temprano de las psicosis primarias8,9.
Diversos autores han estudiado la inestabilidad en el tiempo de los diagnósticos psiquiátricos10. En el diagnóstico de PIS algunos estudios muestran que del 25 al 50% de los pacientes reciben diagnósticos de TMG en seguimientos de entre 3 y 20años5,10-20. Puede deberse a la propia evolución de la enfermedad, a la obtención de nueva información sobre el inicio o curso de la misma, o a la falta de fiabilidad de la evaluación diagnóstica21,22. Se han investigado factores de riesgo que expliquen la inestabilidad diagnóstica de la PIS, tanto sociodemográficos (edad, género, antecedentes familiares) como clínicos (tiempo de estancia, sintomatología, tipo de sustancia)5,6,15,19,23-25.
La distinción entre PIS y trastorno psicótico primario es importante, porque requieren aproximaciones terapéuticas diferentes23. La intervención temprana en psicosis es un modelo de atención que promueve la recuperación de la psicosis a través de la detección temprana y los tratamientos más efectivos desde el inicio de la sintomatología psicótica26. El diagnóstico realizado modula las expectativas del paciente, de su familia y de los propios clínicos que le tratan27. Diagnosticar de psicosis primaria a un episodio de PIS puede conllevar a estigmatización, usos más prolongados de medicaciones antipsicóticas y efectos adversos a nivel social, educacional y vocacional28,29. Si episodios de PIS pueden ser signos tempranos de TMG, un mejor conocimiento de las PIS permitiría intervenciones más tempranas y adecuadas sobre el TMG5.
Nuestra hipótesis de trabajo es que muchos pacientes que en un primer momento son diagnosticados de PIS evolucionan de forma que posteriormente reciben un diagnóstico de TMG. El objetivo de este estudio es conocer la proporción de pacientes que tras ingresar en nuestra unidad hospitalaria y ser diagnosticados al alta de un primer episodio de PIS son más adelante diagnosticados de TMG y cuánto tiempo transcurre hasta el cambio diagnóstico. Además, analizamos la influencia de otros factores relacionados con esta conversión diagnóstica como la edad, el género, los antecedentes familiares psiquiátricos, la sustancia de consumo, la duración del ingreso y el tratamiento recibido.
MétodosEstudio retrospectivo de seguimiento de una cohorte a partir de la información recogida en las historias clínicas del Hospital Universitario Basurto (HUB). Con anterioridad al inicio del estudio se obtuvo la autorización del Comité Ético del HUB. Se incluyeron todos los pacientes que recibieron un diagnóstico de PIS o psicosis tóxica en el informe de alta de un ingreso en la Unidad de Agudos del Servicio de Psiquiatría del HUB entre el 1 de enero de 2002 y el 31 de diciembre de 2015. Esta unidad consta de 42 camas, es la unidad de referencia para ingreso de los pacientes residentes en Bilbao, con una población aproximada de 325.000 usuarios, e ingresan cada año unos 800 pacientes. Un único investigador se encargó de revisar las historias y recabar la información mediante su lectura detallada. Los diagnósticos fueron realizados mediante analíticas de orina y las entrevistas clínicas habituales en la unidad de hospitalización.
Se incluyeron los pacientes mayores de 18años que presentaran un diagnóstico F10-F19 (con tercer dígito5) según la Clasificación Internacional de Enfermedades, décima revisión (CIE-10). Fueron motivos de exclusión una historia previa de psicosis y la presencia de otros diagnósticos en el ejeI distintos a trastornos por consumo de sustancias. Se siguieron los casos hasta la aparición de un primer diagnóstico de TMG al alta de un nuevo ingreso, variable principal, o hasta la fecha límite establecida en el 31 de marzo de 2018. A efectos de este estudio se consideran TMG los diagnósticos CIE-10 incluidos entre los códigos F20-F29 (esquizofrenia y TEE), F30-F31 (episodio maniaco y trastorno afectivo bipolar [TAB]), F32.3 (episodio depresivo grave con síntomas psicóticos) y F33.3 (trastorno depresivo recurrente, episodio actual grave con síntomas psicóticos). Se excluyen los diagnósticos de trastorno de personalidad grave como único diagnóstico.
Se consideraron las siguientes sustancias: cannabinoides, opiáceos, anfetaminas, cocaína y alcohol. Cuando la sustancia sospechosa de inducir el episodio no aparecía especificada en el informe de alta se consideraron aquellas que habían resultado positivas en los análisis de orina realizados. Se tuvo en cuenta si hubo consumos de una única sustancia (monoconsumo) o más sustancias (policonsumo). Adicionalmente se recogió información sobre edad (en años) en el momento del episodio, género, estado civil, antecedentes familiares de enfermedad mental diferentes al consumo de sustancias, y situación laboral. Del evento de PIS se registró la duración en días de la estancia hospitalaria, la presencia concomitante de otras patologías y el tratamiento prescrito al alta. Se realizó una equiparación entre la dosis de antipsicótico prescrita en el evento (si lo hubiera) y la dosis equivalente de clorpromazina, dividiéndose en tres grupos: dosis baja (menor de 200mg/día), dosis media (entre 200mg y 500mg/día) y dosis alta (más de 500mg/día).
Análisis estadísticoLas características basales de la muestra se describen mediante media y desviación estándar (mediana y rango intercuartil, si fuera apropiado) en el caso de las variables cuantitativas, y frecuencia y porcentajes en variables categóricas. Para la comparación entre grupos de las variables categóricas se ha utilizado la prueba chi cuadrado (χ2) de Pearson (o exacta de Fisher, si fuera necesario), mientras que las variables continuas se han comparado mediante la prueba t de Student (o la prueba de los rangos de Mann-Whitney si fuera necesario un test no paramétrico). Como la duración del seguimiento no es similar en todos los pacientes, además de los porcentajes crudos de presencia de TMG se han calculado las tasas de incidencia en forma de episodios de TMG por persona-año. Se ha empleado el análisis de supervivencia para datos censurados de Kaplan-Meier para la evaluación del tiempo de supervivencia y la probabilidad acumulada de conversión a un TMG desde un primer ingreso por PIS. Además del método Kaplan-Meier, la probabilidad acumulada fue calculada también mediante el método Nelson-Aalen. Las curvas de supervivencia según los distintos estratos de las variables género (hombre), días de estancia del ingreso índice (>7días) y edad >30años fueron comparadas mediante el método de log-rank. A continuación se realizó una regresión de Cox (tras comprobar la asunción de riesgos proporcionales) para estimar el riesgo diferencial de provocar un TMG entre las distintas sustancias y ajustados por las variables que en los análisis univariantes hubieran resultado significativas o próximas a la significación. Debido al limitado tamaño muestral de este estudio no se han aplicado técnicas de imputación sobre los datos perdidos. El nivel de significación estadística se estableció en p<0,05, y para realizar los análisis estadísticos se han empleado los programas estadísticos IBM SPSS v23.0 y Stata v14.230,31.
ResultadosDurante el periodo de estudio se registraron 11.263 altas en el Servicio de Psiquiatría, de las que 116 fueron diagnosticadas por primera vez de PIS. Fueron mayoritariamente hombres (78,4%), con edad media (desviación estándar [DE]) de 33,0 (8,9) años. El 44,0% estaban solteros. El 31,0% tenían antecedentes familiares psiquiátricos. Las variables sociodemográficas y del episodio PIS se resumen en la tabla 1. El tiempo de seguimiento medio (aparición de TMG o fin de seguimiento) fue de 84,8 (61,5) meses (rango 1-194). La sustancia más consumida fue cannabis (60,3%), seguido por cocaína (40,5%). Solo el 51,7% de los pacientes consumían una única sustancia, siendo más frecuente cannabis (53,3%). La estancia media fue de 11,6 (7,7) días. Al alta, el 91,4% fueron tratados con algún antipsicótico, en el 37,7% de los casos como único tratamiento; en más de dos tercios (69,8%) se administró una dosis en rango medio (entre 200 y 500mg de clorpromazina o equivalentes).
Variables sociodemográficas y basales de los pacientes diagnosticados de psicosis inducida por sustancias participantes en el estudio
| Variable | n = 116 | |
|---|---|---|
| Edad al diagnóstico en años, media (DE) | 33 | (8,9) |
| Género, n (%) | ||
| Hombre | 91 | (78,4) |
| Mujer | 25 | (21,6) |
| Estado civil, n (%) | ||
| Soltero | 51 | (44,0) |
| Casado | 16 | (13,8) |
| Divorciado | 20 | (17,2) |
| No especificado | 29 | (25,0) |
| Situación laboral, n (%) | ||
| Activo | 36 | (31,0) |
| Inactivo | 38 | (32,8) |
| Incapacidad laboral | 4 | (3,4) |
| No especificado | 38 | (32,8) |
| Antecedentes familiares de enfermedad mental, n (%) | 36 | (31,0) |
| Días de ingreso en episodio inicial, media (DE) | 11,6 | (7,7) |
| Sustancia sospechosa episodio PISa | ||
| Cannabis [en monoconsumo] | 70 [32] | 60,3% [27,6%] |
| Cocaína | 47 [9] | 40,5% [7,8%] |
| Anfetaminas | 37 [13] | 31,9% [11,2%] |
| Alcohol | 27 [4] | 23,3% [3,4%] |
| Opiáceos | 14 [2] | 12,1% [1,7%] |
DE: desviación estándar; PIS: episodio inicial de psicosis tóxica.
Todos los porcentajes son sobre el total de pacientes (n = 116).
Hubo 42 conversiones (36,2%) de diagnóstico de PIS a TMG, con un tiempo medio de conversión de 36,4 (34,8) meses (mediana: 25,3meses). No se encontraron diferencias significativas del tiempo de conversión entre las distintas sustancias. La mayoría de las conversiones a TMG (69,0%) tuvieron lugar durante los tres primeros años de seguimiento. En el momento del diagnóstico de TMG el 50,0% no consumían sustancias. Esquizofrenia y TEE fueron los diagnósticos más frecuentes (85,7%). La mayor probabilidad de conversión diagnóstica entre el grupo con antecedentes familiares (44%) y sin ellos (32,5%) no fue significativa. Tampoco las variables edad, género, estado civil o laboral, sustancia consumida, mono/policonsumo, dosis de antipsicótico al alta o tiempo de ingreso mostraron variaciones significativas, aunque en este último caso se aprecia una diferencia relevante entre las estancias menores de 8días (25,0% de TMG) y las de mayor duración (42,1%). Estas variables se resumen en la tabla 2.
Descripción de los episodios de TMG y comparación con pacientes estables
| TMG (n = 42) | Sin episodio (n = 74) | RR (IC 95%) | p | |
|---|---|---|---|---|
| Género, n (%) | ||||
| Mujer | 8 (32,0) | 17 (68,0) | ref | 0,621 |
| Hombre | 34 (37,4) | 57 (62,6) | 1,05 (0,87 a 1,27) | |
| Antecedentes familiares, n (%) | ||||
| No | 26 (32,5) | 54 (67,5) | ref | 0,216 |
| Sí | 16 (44,4) | 20 (55,6) | 1,41 (0,82 a 2,41) | |
| Edad de inicio, media (DE) | ||||
| Menor de 31 años | 16 (32,7) | 33 (67,3) | ref | 0,496 |
| 31 años o más | 26 (38,8) | 41 (61,2) | 1,12 (0,82 a 1,53) | |
| Duración del ingreso de PIS, media (DE) | ||||
| Menor o igual a 7 días | 10 (25,0) | 30 (75,0) | ref | 0,068 |
| 8 días o más | 32 (42,1) | 44 (57,9) | 1,28 (0,99 a 1,65) | |
| Derivación inicial, n (%) | ||||
| Toxicomanías | 9 (30,0) | 21 (70,0) | ref | 0,408 |
| CSM | 23 (42,6) | 31 (57,4) | 1,21 (0,88 a 1,65) | |
| Otros | 10 (31,3) | 22 (68,8) | 1,03 (0,61 a 1,73) | |
| Dosis equivalente de clorpromacina en PIS, n (%)a | ||||
| Media/baja | 28 (33,3) | 56 (66,7) | ref | 0,291 |
| Alta | 10 (45,5) | 12 (54,5) | 1,49 (0,71 a 3,12) | |
| Diagnóstico final episodio TMG, n (%) | ||||
| Esquizofrenia y espectro TEE | 36 (85,7) | n.a. | ||
| Trastorno afectivo | 6 (14,3) | n.a. | ||
| Tiempo medio hasta diagnóstico, meses, media (DE) | 36,4 (34,8) | n.a. | ||
DE: desviación estándar; IC: intervalo de confianza; n.a.: no aplicable; PIS: psicosis inducida por sustancias; RR: riesgo relativo; TMG: trastorno mental grave.
Debido a que la duración del seguimiento de los pacientes con un primer episodio de PIS es muy dispar (rango: 0,8-193,9meses), se ha considerado también el tiempo como factor modulador del análisis. La tasa de incidencia global de la aparición de un TMG en pacientes que previamente han ingresado por PIS se estima en 5,1casos de TMG por 100pacientes-año. En la tabla 3 se observa que el monoconsumo de cannabis (además del monoconsumo de alcohol) parece presentar tasas de incidencia mayores que el policonsumo de sustancias (6,6 frente a 4,6 casos de TMG por 100pacientes-año), aunque el limitado tamaño muestral impide sacar conclusiones al respecto. En la misma tabla se aprecia que los consumidores de cannabis tienen una edad media inferior a los consumidores de otro tipo de sustancias o con policonsumo.
Tasas crudas de conversión a TMG según el tipo de sustancia de abuso (monoconsumo) o policonsumo de sustancias en el momento del episodio PIS (n = 116)
| Sustancia | Pacientes, n | Hombre, n (%) | Mujer, n (%) | Edad, años, media (DE) | Conversiones, n | Años de seguimientoa | Tasa cruda (IC 95%)b |
|---|---|---|---|---|---|---|---|
| Alcohol | 4 | 4 (100) | 0 | 45,5 (6,0) | 2 | 23,13 | 8,64 (2,16 a 34,57) |
| Anfetaminas | 13 | 5 (38,5) | 8 (61,5) | 32,5 (6,9) | 4 | 73,51 | 5,44 (2,04 a 14,50) |
| Cannabis | 32 | 28 (87,5) | 4 (12,5) | 29,9 (9,8) | 14 | 212,25 | 6,60 (3,91 a 11,13) |
| Cocaína | 9 | 6 (66,7) | 3 (33,3) | 36,4 (9,8) | 1 | 54,96 | 1,82 (0,26 a 12,92) |
| Opiáceos | 2 | 2 (100) | 0 | 32 (0) | 1 | 20,64 | 4,84 (0,68 a 34,39) |
| Policonsumo | 56 | 46 (82,1) | 10 (17,9) | 33,5 (8,0) | 20 | 435,25 | 4,60 (2,96 a 7,12) |
DE: desviación estándar; IC: intervalo de confianza; PIS: psicosis inducida por sustancias.
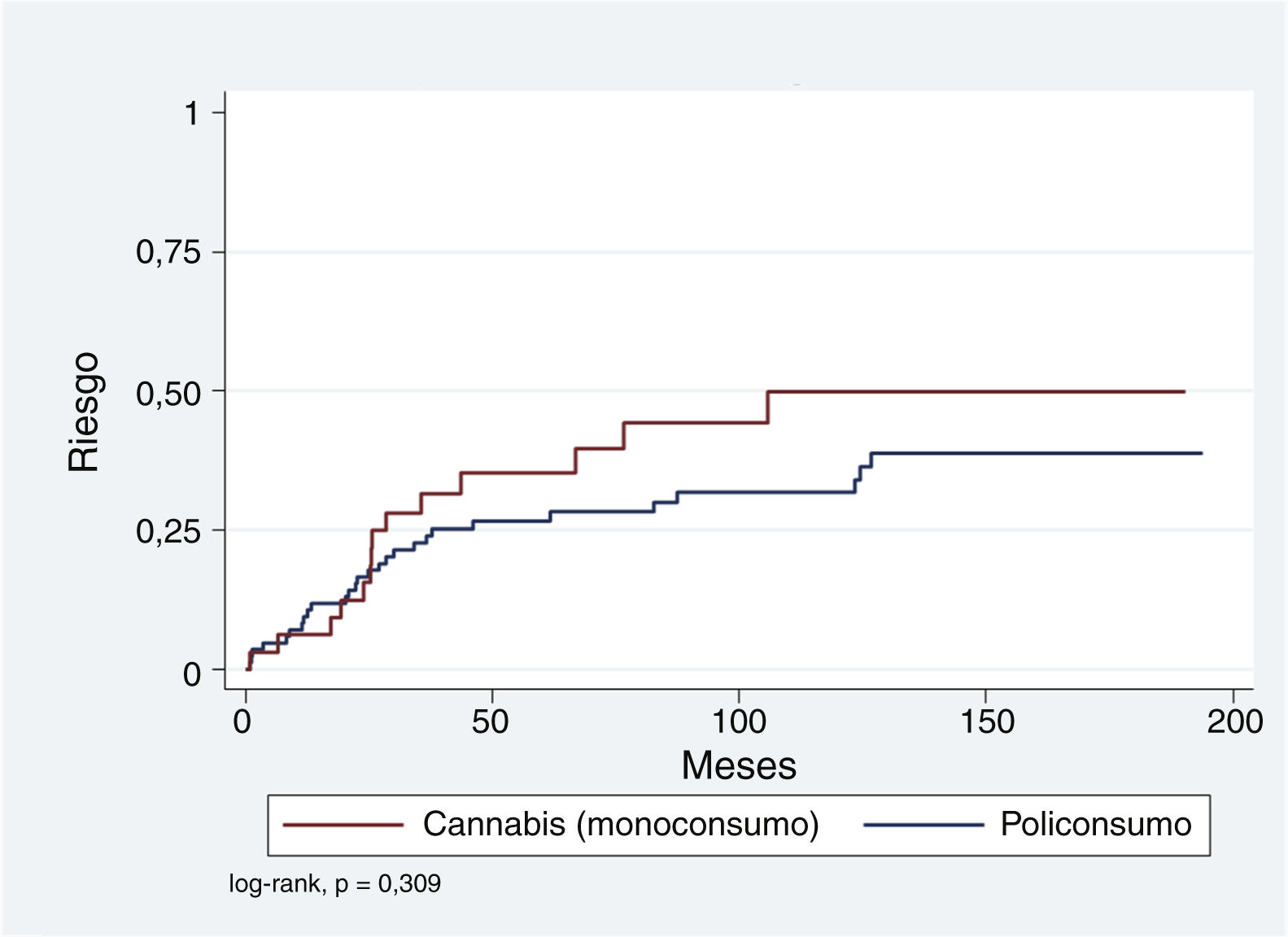
En primer lugar se han calculado los riesgos acumulados de presentar un evento de TMG en los pacientes con un episodio previo de PIS, en función de la sustancia asociada al PIS en monoconsumo o policonsumo (tabla 4). El riesgo acumulado estimado para un máximo de seguimiento de 16,1años mediante el método de Kaplan-Meier (KM) para el monoconsumo de cannabis es del 49,9% (error estándar [EE]: 10,1). El policonsumo presenta un riesgo acumulado menor, del 38,5% (EE: 6,9). Tal como se aprecia en la tabla 4, el método de cálculo de Nelson-Aalen (más adecuado con datos censurados) arroja riesgos aún mayores, aunque se mantienen también los resultados KM para facilitar su comparación con otros estudios publicados.
Riesgos acumulados según el tipo de sustancia de abuso (monoconsumo) o policonsumo de sustancias (n = 116)
| Sustancia | Pacientes, n | Conversiones, n | % bruto | Riesgo acumulado, % (EE)a | Riesgo acumulado, % (EE)b |
|---|---|---|---|---|---|
| Alcohol | 4 | 2 | 50,0% | 50,0 (25,0) | 58,3 (41,7) |
| Anfetaminas | 13 | 4 | 30,8% | 48,7 (22,3) | 58,5 (36,4) |
| Cannabis | 32 | 14 | 43,8% | 49,9 (10,1) | 67,1 (19,4) |
| Cocaína | 9 | 1 | 11,1% | 11,1 (10,5) | 11,1 (11,1) |
| Opiáceos | 2 | 1 | 50,0% | ||
| Policonsumo | 56 | 20 | 35,7% | 38,5 (6,9) | 48,1 (11,2) |
| Policonsumo/Otrosc | 84 | 28 | 33,3% | 38,8 (6,2) | 48,7 (10,0) |
| Global | 116 | 42 | 36,2% | 41,6 (5,2) | 53,5 (8,9) |
EE: error estándar; IC: intervalo de confianza.
Se han analizado también mediante el método log-rank de las curvas de supervivencia KM la posible influencia de las variables género, edad (mayor o menor de 30años), duración del ingreso (mayor o menor de 7días) y monoconsumo de cannabis en la presentación de un TMG a lo largo del tiempo. En ninguna de estas comparaciones el resultado del log-rank ha sido estadísticamente significativo.
Debido a que la representación de episodios de PIS asociados exclusivamente a alcohol, anfetaminas, cocaína u opiáceos es relativamente baja comparada con el monoconsumo de cannabis y el policonsumo, se decidió agrupar aquellos con el policonsumo y compararlos con el monoconsumo de cannabis. En la figura 1 se observa que aunque el riesgo acumulado de conversión a TMG es más elevado para el monoconsumo de cannabis comparado con el resto, esta diferencia no resulta significativa (log-rank p=0,309). Se ha explorado esta relación mediante regresión de Cox y ajustado por variables que en otros estudios han resultado relevantes: edad <30años, género hombre y estancia en ingreso PIS >7días. Como se observa en la tabla 5, el monoconsumo de cannabis y un ingreso >7días parecen asociarse a un mayor riesgo (hazard ratio [HR]: 1,54 y 1,69, respectivamente), mientras que una edad más joven en el momento de PIS parece tener un efecto protector (HR: 0,64); de todas formas, ninguna de estas asociaciones resulta estadísticamente significativa.
Resultados de la regresión de Cox para la conversión a TMG; influencia de distintas variables
| HR | EE | z | p > z | IC 95% | ||
|---|---|---|---|---|---|---|
| Cannabis monoconsumo | 1,5369 | 0,5383 | 1,23 | 0,220 | 0,7735 | 3,0534 |
| Sexo, hombre | 1,0558 | 0,4207 | 0,14 | 0,892 | 0,4835 | 2,3056 |
| > 7 días de ingreso | 1,6911 | 0,6135 | 1,45 | 0,148 | 0,8305 | 3,4434 |
| Edad ≤ 30 años | 0,6385 | 0,2153 | −1,33 | 0,183 | 0,3297 | 1,2366 |
EE: error estándar; HR: hazard ratio; IC: intervalo de confianza; z: estadístico z.
El 36,2% de los pacientes diagnosticados de un primer episodio de PIS en un ingreso hospitalario reciben el diagnóstico de TMG en un ingreso posterior en la misma unidad, principalmente esquizofrenia y TEE (85,6%). Este porcentaje y el riesgo acumulado de conversión diagnóstica, estimado en el 41,6% (IC95%: 32,2-52,2), son similares a los observados en otros estudios5,12-15,19,32, aunque mayores que los observados en un estudio escocés reciente33 que solo considera el diagnóstico de esquizofrenia. Contrasta con estudios que observan mayor consistencia en el tiempo para el diagnóstico de PIS34,35, aunque con muestras muy pequeñas y un seguimiento de solo 2años en el segundo. El hecho de que hayamos incluido solamente los cambios diagnósticos que se producen en pacientes que reingresan en la misma unidad donde previamente han recibido un primer diagnóstico de PIS supone una fortaleza en la validez de los diagnósticos pero impide considerar los casos en que se haya producido una conversión diagnóstica sin necesitar un nuevo ingreso o cuando este se haya realizado en otra unidad.
La mayoría de las conversiones diagnósticas se producen en los primeros años5,12,14,19,33. En nuestro estudio transcurren 36,43meses de media. En el estudio de Starzer et al.19 la mitad de los casos que eran diagnosticados de esquizofrenia ocurrían también en los 3,1años después del diagnóstico de PIS y la conversión en TAB a los 4,4años. La muestra de pacientes diagnosticados de TAB (6/42) no nos permite considerar esta diferencia. En el estudio finlandés5 la mayoría de las conversiones a TEE se producían durante los tres primeros años de seguimiento, especialmente en las PIS atribuidas a cannabinoides. Las PIS debidas a opiáceos, cocaína o anfetaminas presentaban un patrón de cambio diagnóstico más lineal en el tiempo. En concordancia con estos datos, en nuestro estudio el 69% de las conversiones se produjeron durante los tres primeros años, y al terminar el cuarto ya se habían producido el 78,6%. No hemos podido apreciar diferencias entre las sustancias.
El diagnóstico de TMG más frecuente fue esquizofrenia y TEE, con el 85,7% de los pacientes, de forma similar a otros estudios5,12-14,19,23,33. Esquizofrenia supone el 44,6% de todas las conversiones a un TEE. Esto nos hace pensar en la gravedad subyacente al diagnóstico de PIS, que no debe tratarse como una patología transitoria y asociada únicamente al consumo de sustancias. Herramientas diagnósticas como la Psychiatric Research Interview for Substance and Mental Disorders (PRISM) diseñadas específicamente para diferenciar los trastornos mentales primarios y los inducidos por sustancias podrían ser de ayuda en esta tarea36.
El estudio de las sustancias asociadas a los episodios de PIS como variable muestra policonsumo en casi la mitad de los casos. El monoconsumo más frecuente es de cannabis, con un riesgo acumulado de conversión en TMG del 49,9% (10,1) en el seguimiento de 16,1años. No se observan diferencias entre policonsumo y cannabis u otras sustancias, como se ve en la tabla 3. La literatura disponible13,15,19,23,25,37 muestra resultados similares. Un estudio25 que revisa la estabilidad diagnóstica de las psicosis agudas tras 5años de evolución en más de 24.000 pacientes, incluyendo las psicosis por consumo de cannabis y anfetaminas, constata un cambio del 46% de los diagnósticos a esquizofrenia, donde la odds ratio (OR) para cannabis es de 1,2 (IC95%: 1,01-1,24) y para anfetaminas de 0,81 (IC95%: 0,67-0,97), concluyendo por tanto que las PIS atribuidas a anfetaminas eran de mejor pronóstico que las PIS por cannabis.
Nuestros resultados no permiten refrendar la hipótesis ofrecida por otros estudios18,23 que indican que los pacientes con historia familiar de enfermedad mental tienen mayor probabilidad de cambio diagnóstico, sugiriendo mayor vulnerabilidad genética a padecer TMG. Tampoco otros estudios lo confirman5,11,32,33.
Apreciamos una diferencia no significativa entre el porcentaje de conversión de los pacientes con PIS con ingresos >7días (42,1%) frente a quienes ingresan 7 o menos días (25%). Esta variable nos interesa porque estudios previos5,33 relacionan el riesgo de conversión con estancias más prolongadas, aunque debemos tener en cuenta que la longitud de un ingreso no depende únicamente de la persistencia de síntomas psicóticos, ya que otros factores, como el insight o las dificultades sociales, entre otros, pueden influir de forma notable.
Otra forma en que intentamos considerar si la gravedad sintomática del primer episodio puede estar relacionada con la probabilidad de conversión diagnóstica es mediante la dosis de antipsicótico recibida, suponiendo que a mayor gravedad se precisan dosis mayores. No hemos podido hallar diferencias estadísticamente significativas, al igual que el otro estudio38 que utiliza esta estrategia, considerando además que los pacientes con PIS podrían mostrarse más disruptivos conductualmente y, por ello, requerir más dosis de medicación.
Se ha discutido el papel que juega la edad a la que se presenta el primer episodio de PIS en el desarrollo posterior de un trastorno primario. En nuestra muestra no vemos relación entre la edad de inicio y el riesgo de conversión en TMG. Un estudio que incluye pacientes desde los 16años18, a diferencia de los 18 del nuestro, y otro5 en el que la muestra tiene una edad media 10años menor que la nuestra (23,4 frente a 33años) observaron mayor riesgo para los pacientes jóvenes. También se ha descrito33 que presentar PIS con menos de 30años supone un factor de riesgo de progresión a esquizofrenia y que las personas con psicosis inducida por cannabis que desarrollaron posteriormente esquizofrenia eran más jóvenes que las que sufrieron conversiones diagnósticas tras psicosis inducidas por otras sustancias (p<0,0001 para el alcohol, p=0,005 para los opiáceos, p=0,018 para los estimulantes y p=0,007 para el policonsumo). En nuestro estudio no hemos recogido los datos de tiempo de consumo de sustancias previo al desarrollo del episodio de PIS, cantidad de consumo o edad de inicio del consumo, que parece más relevante que la propia edad de diagnóstico del episodio39,40.
En la última década se están dedicando esfuerzos a dilucidar el papel del género en la patología adictiva y en el desarrollo de los síntomas psicóticos porque existe todavía una falta importante de conocimiento, en gran parte atribuible a la deficiencia de datos que solo una investigación multidisciplinar e integrada podrá aportar41,42. Profundizar en la comprensión de las diferencias permitirá diseñar tratamientos más específicos42,43. Aunque nuestro estudio no muestra diferencias considerando el género como variable, otros autores observaron mayores tasas de conversión en hombres que en mujeres12,33. Parte de la dificultad del análisis del género también radica en que en estudios como este es generalmente mucho mayor el porcentaje de hombres que el de mujeres, y esto puede ocasionar sobreestimar la influencia de esta variable a favor del género masculino. En un estudio reciente44 realizado en nuestro país con 141 pacientes con un primer episodio psicótico (31,25% mujeres), un 58,9% presentaban algún consumo problemático de sustancias. Se encontraron diferencias significativas de género en la edad de inicio, la edad de ingreso en el programa, el estado civil, la convivencia y diferencias en el consumo de sustancias y la frecuencia del consumo. Sin embargo, el género no fue un factor predictor de reingreso.
LimitacionesSe trata de un estudio que pretende conocer la realidad clínica con una aproximación pragmática, de manera que la información obtenida ayude en la toma de decisiones concretas, y se basa en datos extraídos retrospectivamente de las historias clínicas, lo que supone una limitación relevante a la hora de interpretar los resultados. Existe variación en los clínicos que han realizado los diagnósticos; para minimizar esta variación se ha utilizado la estrategia de considerar solo los diagnósticos realizados en reingresos en la misma unidad psiquiátrica, asumiendo además la consecuencia de no disponer de información de pacientes con episodios de PIS que no hubieran requerido ingreso y de perder el seguimiento de conversiones diagnósticas de pacientes que no han necesitado reingresar, lo hicieran en otro hospital o hubieran trasladado su domicilio. La calidad de la información es de nivel asistencial y los datos relativos al tiempo previo de consumo de sustancias, a la edad de inicio del consumo, a la frecuencia y la intensidad del mismo no se han detallado. No se han utilizado entrevistas diagnósticas estructuradas o semiestructuradas ni escalas clínicas. No se ha realizado una asignación inequívoca de la causa de las PIS a una sustancia concreta, porque el consumo múltiple de sustancias y el modo en que se ha recogido la información en la historia clínica lo impide. Se ha intentado por todos los medios disponibles obtener toda la información necesaria sobre los pacientes que se han perdido, pero en algunos casos no ha sido posible debido al carácter retrospectivo del estudio. El reducido tamaño muestral de nuestro estudio, comparado con el de otros estudios5,12,33, ha podido impedir alcanzar significación estadística en la influencia observada en dichos estudios de determinadas variables (edad, estancia, sexo) en la aparición de TMG; de cualquier forma, la muestra de nuestro estudio ha sido la disponible en ese periodo, ya que no ha mediado selección muestral y permite el estudio de las variables principales con garantías.
Otra limitación es no disponer de un grupo de comparación sin episodio previo de PIS.
ConclusionesLa conclusión principal de este estudio es que en situaciones clínicas reales más del 35% de los pacientes que sufren un episodio psicótico relacionado con sustancias y que son diagnosticados como PIS presentarán una evolución hacia la persistencia de la sintomatología que causará un cambio diagnóstico a una de las categorías incluidas en el grupo de TMG. Y esto se producirá antes de que pasen 3años a partir del primer diagnóstico en la gran mayoría de los casos. Esta información añade un poco de luz a la falta de conocimientos sobre el curso longitudinal de las PIS y corrobora a nivel nacional informaciones proporcionadas por estudios extranjeros. Deja claro que es un grupo de pacientes que requieren ser considerados desde el principio como potenciales TMG y desarrollar intervenciones terapéuticas tempranas y proactivas alejadas de la expectativa de resolución espontánea de la sintomatología. También parece constatado que los primeros años tras el diagnostico de PIS son los fundamentales. Lamentablemente, no hemos podido dilucidar qué características de los episodios de PIS hacen más probable una evolución desfavorable para así poder focalizar las intervenciones. Creemos que precisamente estas variables suponen un área interesante en investigaciones futuras.
FinanciaciónLa elaboración de este artículo ha sido posible gracias a la Convocatoria Interna de Ayudas a la Investigación 2018 del Hospital Universitario Basurto. Por otra parte, el desarrollo del proyecto no ha tenido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
Gracias por su colaboración y apoyo a Itxaso Muñoz, a Iñigo Zubiaguirre y al Hospital Universitario Basurto.