O ultrassom intracoronário (USIC) é o método adjunto mais utilizado na Cardiologia Intervencionista, e sua análise depende de normas para a aquisição, mensuração e interpretação das imagens. Ao associar a caracterização tecidual, o artefato causado pelo fio‐guia pode hiperestimar o porcentual de núcleo necrótico em determinadas lesões, levando à classificação equivocada de fibroateroma. Descrevemos os efeitos quantitativos e na análise tecidual resultantes da subtração do efeito do artefato do fio‐guia nas lesões ateroscleróticas em pacientes com síndrome coronária aguda.
MétodosForam avaliados 21 pacientes com infarto do miocárdio pós‐trombólise com USIC em escala de cinzas e com a tecnologia iMAP®, totalizando 76 lesões.
ResultadosO USIC em escala de cinzas mostrou que as lesões tinham extensão média de 21,01 ± 18,03mm e apresentavam elevada carga de placa (52,07 ± 7,56%). A análise pelo iMAP® demonstrou que, após a subtração do artefato do fio‐guia, houve redução de todos os componentes teciduais (necrótico, calcífico, lipídico e fibrótico), porém de maneira mais acentuada do núcleo necrótico (diferença média de 3,59%). Além disso, após a subtração do artefato, 12,4% das lesões que inicialmente apresentavam núcleo necrótico ≥ 10% passaram a não ser mais classificadas como fibroateroma.
ConclusõesA análise da placa de ateroma pela tecnologia iMAP® mostrou que o artefato do fio‐guia superestimou o componente tecidual do núcleo necrótico. Essa interferência pode mudar errônea e categoricamente as características fenotípicas de lesões mais benignas e estáveis (fibróticas) para lesões potencialmente instáveis, como os fibroateromas, na relação de um em cada dez pacientes.
Intravascular ultrasound (IVUS) is the most widely used ancillary method in Interventional Cardiology, and its analysis depends on standards for acquisition, measurement and interpretation of the images. By associating tissue characterization, the artifact caused by the guidewire may overestimate the percentage of necrotic core in certain lesions, leading to misclassification of fibroatheroma. In this paper we described quantitative and tissue analysis effects resulting from subtracting the effect of guidewire artifact on atherosclerotic lesions in patients with acute coronary syndrome.
MethodsTwenty‐one patients with post‐thrombolysis myocardial infarction were evaluated with grayscale IVUS and iMAPTM technology, totaling 76 lesions.
ResultsGrayscale IVUS showed that the lesions had a mean length of 21.01 ± 18.03mm and revealed high plaque burden (52.07 ± 7.56%). The analysis by iMAPTM demonstrated that, after subtracting the guidewire artifact, there was a reduction of all tissue (necrotic, calcific, lipid and fibrotic) components, but more markedly in necrotic core (mean difference: 3.59%). In addition, after artifact subtraction 12.4% of the lesions that initially exhibited a necrotic core ≥ 10% ceased to be classified as fibroatheroma.
ConclusionsAn atheroma analysis by iMAPTM technology showed that the guidewire artifact overestimated the tissue component of the necrotic core. This interference may change, in an erroneous and categorical way, the phenotypic characteristics of more stable and benign (fibrotic) lesions to potentially unstable lesions, for example, fibroatheromas, in a ratio of one out of ten patients.
O ultrassom intracoronário (USIC) é um dos métodos adjuntos mais utilizados na Cardiologia Intervencionista moderna. Apesar de a angiografia coronária permanecer como o método de imagem mais importante no diagnóstico da doença arterial coronária (DAC), nas últimas décadas o USIC evoluiu de maneira considerável, ocupando papel relevante no laboratório de hemodinâmica.
Embora inicialmente sua análise fosse baseada em relatos individuais e pouco uniformes,1,2 recentemente, diversos grupos se organizaram na tentativa de padronizar a análise e a interpretação das imagens ultrassonográficas, tanto pela análise pela escala de cinzas,3,4 quanto pela caracterização tecidual com histologia virtual (VH® IVUS; Volcano Corporation, San Diego, Estados Unidos) e tecnologia iMAP® (Boston Scientific, Santa Clara, Estados Unidos).5 Com essa padronização, muito se avançou no uso do USIC na prática clínica cotidiana, principalmente como guia em intervenções coronárias percutâneas (ICP) complexas,6,7 como nas lesões em bifurcação, nas lesões longas, nas ICPs de tronco de coronária esquerda8,9 e nos estudos de progressão e regressão de aterosclerose.10–12
Com a adição da caracterização tecidual aos dados da análise pela escala de cinzas, por meio da análise de radiofrequência das ondas de ultrassom, foi possível propor as características do fibroateroma e seus diversos subtipos13 e da “placa vulnerável”, propensa à ruptura e responsável pelos eventos coronarianos agudos.14–17 Conceitualmente, dentre outros critérios, tais como capa fibrosa fina (< 65 mm) e remodelamento arterial positivo, a placa vulnerável, também chamada de “fibroateroma de capa fina”, deve apresentar grande núcleo necrótico (≥ 10%), confluente e com > 30% em contato com o lúmen, por, no mínimo, três frames consecutivos.
No entanto, um dos grandes obstáculos para a adequada identificação e, principalmente, quantificação do núcleo necrótico é o artefato causado pelo fio‐guia, quando aplicada a tecnologia iMAP®. O fio‐guia, por ser constituído de material altamente refletor das ondas de ultrassom (ecorrefletor), gera um artefato similar àquele gerado pelo cálcio, chamado de sombra acústica.18 A tecnologia iMAP®, ao detectar o sinal reverberado a partir do fio‐guia, interpreta esse sinal como compatível com tecido necrótico e erroneamente classifica a área da sombra acústica como núcleo necrótico. Isso, em última instância, acaba por superestimar a quantidade de núcleo necrótico de determinada lesão.
Objetivamos descrever os efeitos quantitativos e na análise tecidual resultantes da subtração do efeito do artefato do fio‐guia nas lesões ateroscleróticas de pacientes com síndrome coronária aguda, utilizando o USIC com análise em escala de cinzas e a tecnologia iMAP®.
MétodosCasuística e desenho do estudoNo período de setembro de 2011 a fevereiro de 2012, 21 pacientes com diagnóstico clínico‐eletrocardiográfico de infarto agudo do miocárdio com supradesnivelamento do segmento ST (IAMCST), totalizando 76 lesões, foram prospectivamente incluídos no estudo iWonder. O desenho do estudo foi previamente descrito.19 Em resumo, cem pacientes com infarto agudo do miocárdio foram analisados com USIC das três artérias coronárias epicárdicas em escala de cinzas e iMAP® quanto às características fenotípicas e teciduais das lesões consideradas culpadas e das não culpadas. O estudo foi realizado no setor de Hemodinâmica e Cardiologia Intervencionista do Hospital São Paulo, em São Paulo (SP), tendo sido previamente aprovado pelo Comitê de Ética em Pesquisa da referida instituição (projeto 0889/11, de 5 de agosto de 2011) e identificado no ClinicalTrials.org sob o número NCT01437553. Todos os pacientes ou seus representantes legais foram informados sobre os objetivos e riscos dos procedimentos relacionados ao estudo, tendo assinado o Termo de Consentimento Livre e Esclarecido anteriormente ao procedimento diagnóstico.
Procedimento do ultrassom intracoronárioA obtenção de imagens com o USIC das artérias coronárias epicárdicas foi realizada imediatamente após o procedimento diagnóstico, heparinização plena do paciente (heparina não fracionada 100 U/kg objetivando tempo de coagulação ativada entre 250 e 350 segundos) e administração de vasodilatador intracoronário (nitroglicerina 100 a 200 μm). Inicialmente, foi realizado o estudo USIC da artéria relacionada ao evento clínico (vaso culpado), seguido de angioplastia, se necessária. A seguir, as duas outras artérias coronárias não relacionadas ao evento clínico (vasos não culpados) foram analisadas com o USIC. Foi utilizado cateter de USIC de 40 MHz (Atlantis® SR Pro, Boston Scientific, Santa Clara, Estados Unidos), com análise pela escala de cinza e caracterização morfológica utilizando a modalidade iMAP‐Intravascular Ultrasound® (iMAP‐IVUS®, Boston Scientific, Santa Clara, Estados Unidos). Foram realizados recuos automáticos (pullback) do cateter de USIC, na velocidade de 0,5 mm/s, iniciando‐se em um ponto 10 mm distal da lesão culpada, em direção ao óstio da artéria em análise. Nas artérias não culpadas, a mesma rotina foi realizada para análise das placas não relacionadas ao evento.
Análise das imagens do ultrassom intracoronárioTodas as imagens da angiografia e do USIC foram arquivadas em mídia digital e copiadas para um disco rígido externo para análise off‐line no laboratório de imagem intravascular da Cardiovascular Research Foundation (Nova Iorque, Estados Unidos).
A análise do USIC foi realizada em três etapas sequenciais, conforme se segue.
Etapa 1 – análise quantitativaA análise volumétrica quantitativa foi realizada de acordo as diretrizes vigentes.3,4 Essa etapa da análise off‐line do USIC consistiu na definição do segmento a ser analisado em cada recuo, incluindo, no mínimo, 10 mm de extensão distalmente ao óstio do respectivo vaso. Em seguida, utilizando‐se o software QIvus 2.1® (Medis Medical Imaging Systems, Leiden, Holanda), foram obtidos os contornos automáticos do vaso e do lúmen a cada 1 mm dentro do segmento definido. Em seguida, utilizando o método de Simpson, os volumes do lúmen, do vaso e da placa (vaso menos lúmen) foram computados. A carga de placa (plaque burden) foi calculada como a área de secção transversa da placa dividida pela área de secção transversa do vaso, multiplicada por 100. Área luminal mínima foi definida como a menor área de secção transversa do lúmen dentro da lesão.
Etapa 2 – caracterização tecidual pelo iMAPO iMAP‐IVUS® é uma modalidade de imagem que utiliza análise por radiofrequência espectral, a fim de se obter um algoritmo para classificar a placa aterosclerótica em quatro componentes: fibrótico, lipídico, necrótico e calcífico. O desenvolvimento desse algoritmo foi baseado em análises histológicas ex vivo20 e, para cada componente, foi atribuída uma cor: componente fibrótico como verde, componente lipídico como amarelo, componente necrótico como vermelho e componente calcífico como branco.
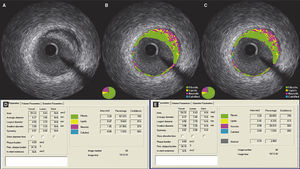
Etapa 3 – subtração do artefato do fio‐guiaAo término do contorno da área de secção transversa do vaso e do lúmen, as medidas obtidas foram exportadas para o banco de dados adequado. A seguir, utilizando‐se a ferramenta de subtração disponível no software QIvus 2.1®, o artefato do fio‐guia foi manualmente delimitado por um examinador experiente (C. F. S.) em cada frame no segmento definido como lesão (foram excluídos os segmentos de referência proximal e distal), conforme demonstrado na figura 1. As medidas obtidas foram então exportadas para o banco de dados para comparação com as medidas iniciais.
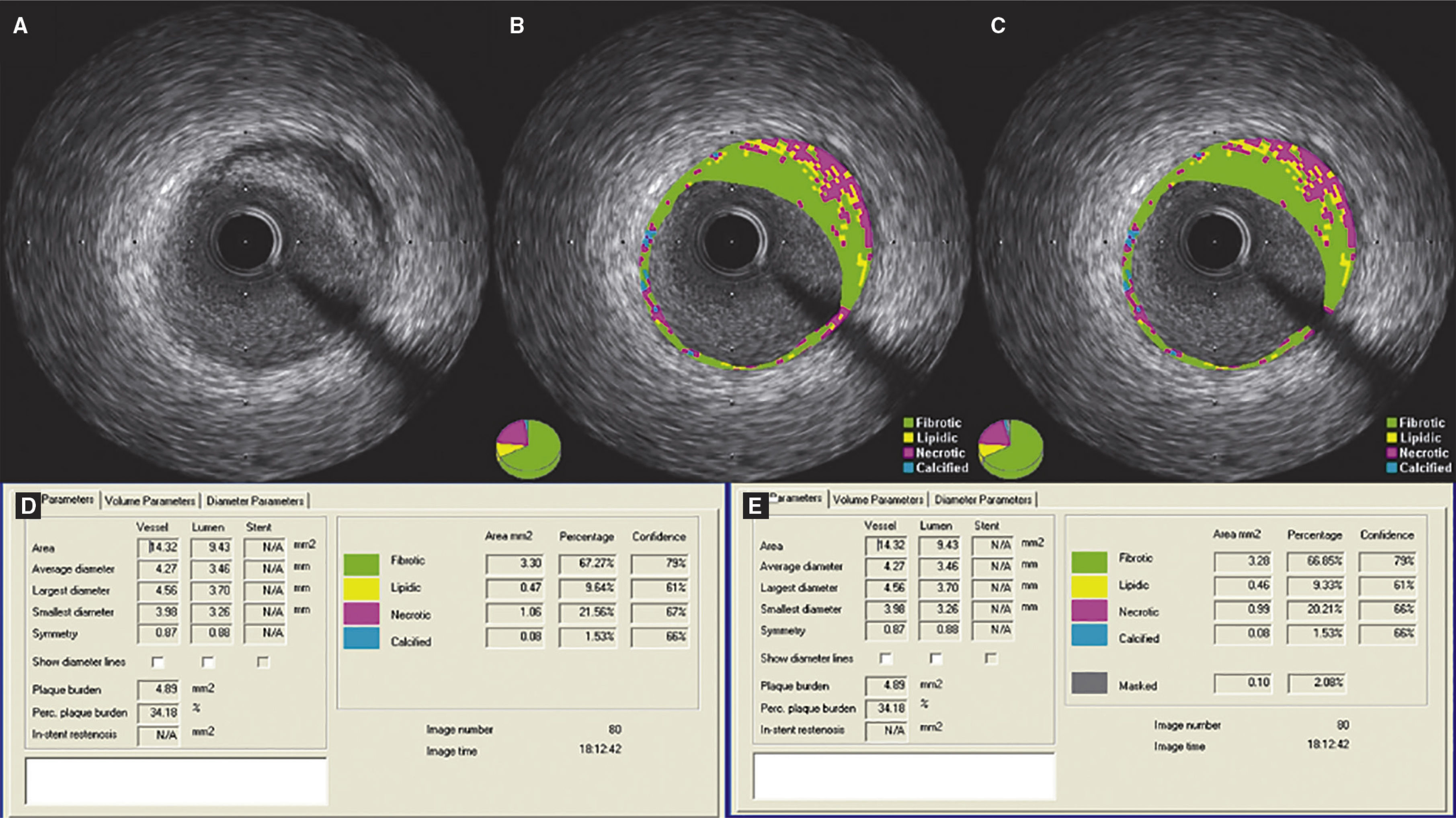
Demonstração do efeito da subtração do artefato do fio‐guia. (A) Ultrassom intracoronário em escala de cinzas; (B) caracterização tecidual com iMAP® observando o artefato causado pelo fio‐guia às 4h, sendo interpretado como núcleo necrótico (vermelho); (C) caracterização tecidual pós‐subtração do artefato do fio‐guia; (D e E) resultados pelo iMAP® pré e pós‐subtração do artefato do fio‐guia mostrando variação do núcleo necrótico de 21,56% para 20,21%.
Na análise estatística descritiva, as variáveis categóricas foram expressas como frequências absolutas e porcentuais. As variáveis contínuas foram expressas como média ± desvio padrão. Para a comparação entre os grupos utilizou‐se o teste t pareado. O valor de p foi considerado significativo quando < 0,05. Para realizar tais análises, foi utilizado o pacote estatístico SPSS (Statistical Package for the Social Science), versão 13.0 (SPSS Inc., Chicago, Estados Unidos).
ResultadosA média das idades dos pacientes foi de 53,3 ± 13,1 anos, com predomínio do sexo masculino (61,9%). O tempo médio entre o evento índice e a realização do procedimento de USIC foi de 6,1 ± 2,4 dias. Dentre os fatores de risco para DAC, puderam ser constatados: elevada prevalência de diabetes (52,4%), hipertensão arterial sistêmica (66,7%) e tabagismo (66,7%). As demais características clínicas e angiográficas estão resumidas na tabela 1.
Características clínicas basais, exames laboratoriais e terapia medicamentosa
| Variáveis | n = 21 |
|---|---|
| Idade, anos | 53,3 ± 13,1 |
| Sexo masculino, n (%) | 13 (61,9) |
| IMC, kg/m2 | 28,53 ± 6,56 |
| Diabetes melito, n (%) | 11 (52,4) |
| Hipertensão arterial, n (%) | 14 (66,7) |
| Tabagismo, n (%) | 14 (66,7) |
| Dislipidemia, n (%) | 8 (38,1) |
| Exames laboratoriais de admissão | |
| Colesterol total, mg/dL | 159,0 ± 42,5 |
| HDL‐c, mg/dL | 34,5 ± 11,8 |
| LDL‐c, mg/dL | 104,6 ± 34,5 |
| Triglicérides, mg/dL | 104,5 ± 40,0 |
| Clearance de creatinina, mL/kg | 109,3 ± 53,1 |
| PCR‐ultrassensível, mg/L | 14,2 ± 18,6 |
| Glicemia de jejum, mg/dL | 132,6 ± 64,4 |
| Hemoglobina glicada, % | 7,03 ± 2,65 |
| Artéria culpada, n (%) | |
| Descendente anterior | 7 (33,3) |
| Circunflexa | 4 (19,0) |
| Coronária direita | 10 (47,6) |
| Medicações na admissão, n (%) | |
| Ácido acetilsalicílico | 3 (14,3) |
| Tienopiridínicos | 0 (0) |
| IECA/BRA | 11 (52,4) |
| Estatinas | 7 (33,3) |
| Betabloqueadores | 8 (38,1) |
| Medicações na alta hospitalar, n (%) | |
| Ácido acetilsalicílico | 21 (100) |
| Tienopiridínicos | 21 (100) |
| IECA/BRA | 18 (85,7) |
| Estatinas | 21 (100) |
| Betabloqueadores | 7 (33,3) |
IMC: índice de massa corporal; HDL‐c: lipoproteína de alta densidade‐colesterol; LDL‐c: lipoproteína de baixa densidade‐colesterol; PCR: proteína C‐reativa; IECA/BRA: inibidores de enzima conversora de angiotensina/bloqueadores dos receptores de angiotensina.
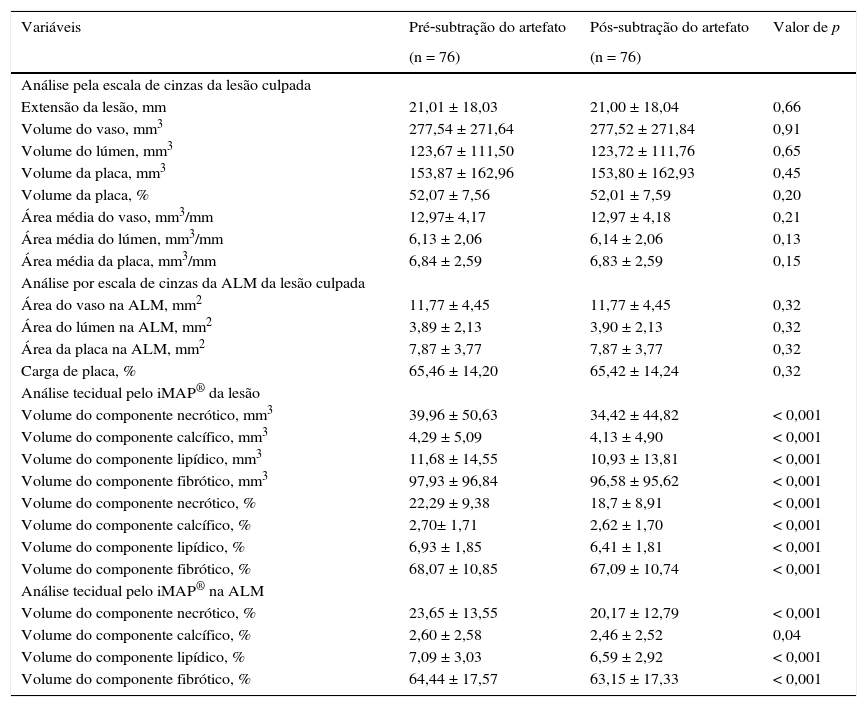
Na análise pelo USIC em escala de cinzas (tabela 2), observamos se tratar de lesões culpadas com extensão média de 21,01 ± 18,03 mm e volume de placa de 52,07 ± 7,56%. A área luminal mínima foi de 3,89 ± 2,13 mm2, e carga de placa de 65,46 ± 14,20%.
Dados do ultrassom intracoronário em escala de cinzas da lesão culpada
| Variáveis | Pré‐subtração do artefato | Pós‐subtração do artefato | Valor de p |
|---|---|---|---|
| (n = 76) | (n = 76) | ||
| Análise pela escala de cinzas da lesão culpada | |||
| Extensão da lesão, mm | 21,01 ± 18,03 | 21,00 ± 18,04 | 0,66 |
| Volume do vaso, mm3 | 277,54 ± 271,64 | 277,52 ± 271,84 | 0,91 |
| Volume do lúmen, mm3 | 123,67 ± 111,50 | 123,72 ± 111,76 | 0,65 |
| Volume da placa, mm3 | 153,87 ± 162,96 | 153,80 ± 162,93 | 0,45 |
| Volume da placa, % | 52,07 ± 7,56 | 52,01 ± 7,59 | 0,20 |
| Área média do vaso, mm3/mm | 12,97± 4,17 | 12,97 ± 4,18 | 0,21 |
| Área média do lúmen, mm3/mm | 6,13 ± 2,06 | 6,14 ± 2,06 | 0,13 |
| Área média da placa, mm3/mm | 6,84 ± 2,59 | 6,83 ± 2,59 | 0,15 |
| Análise por escala de cinzas da ALM da lesão culpada | |||
| Área do vaso na ALM, mm2 | 11,77 ± 4,45 | 11,77 ± 4,45 | 0,32 |
| Área do lúmen na ALM, mm2 | 3,89 ± 2,13 | 3,90 ± 2,13 | 0,32 |
| Área da placa na ALM, mm2 | 7,87 ± 3,77 | 7,87 ± 3,77 | 0,32 |
| Carga de placa, % | 65,46 ± 14,20 | 65,42 ± 14,24 | 0,32 |
| Análise tecidual pelo iMAP® da lesão | |||
| Volume do componente necrótico, mm3 | 39,96 ± 50,63 | 34,42 ± 44,82 | < 0,001 |
| Volume do componente calcífico, mm3 | 4,29 ± 5,09 | 4,13 ± 4,90 | < 0,001 |
| Volume do componente lipídico, mm3 | 11,68 ± 14,55 | 10,93 ± 13,81 | < 0,001 |
| Volume do componente fibrótico, mm3 | 97,93 ± 96,84 | 96,58 ± 95,62 | < 0,001 |
| Volume do componente necrótico, % | 22,29 ± 9,38 | 18,7 ± 8,91 | < 0,001 |
| Volume do componente calcífico, % | 2,70± 1,71 | 2,62 ± 1,70 | < 0,001 |
| Volume do componente lipídico, % | 6,93 ± 1,85 | 6,41 ± 1,81 | < 0,001 |
| Volume do componente fibrótico, % | 68,07 ± 10,85 | 67,09 ± 10,74 | < 0,001 |
| Análise tecidual pelo iMAP® na ALM | |||
| Volume do componente necrótico, % | 23,65 ± 13,55 | 20,17 ± 12,79 | < 0,001 |
| Volume do componente calcífico, % | 2,60 ± 2,58 | 2,46 ± 2,52 | 0,04 |
| Volume do componente lipídico, % | 7,09 ± 3,03 | 6,59 ± 2,92 | < 0,001 |
| Volume do componente fibrótico, % | 64,44 ± 17,57 | 63,15 ± 17,33 | < 0,001 |
ALM: área luminal mínima.
É importante observar as diferenças relacionadas à composição tecidual por meio da análise pelo iMAP® (fig. 2). Após a subtração do artefato do fio‐guia, houve redução estatisticamente significativa do porcentual de todos os componentes (necrótico, calcífico, lípidico e fibrótico; p < 0,001 para todos). Além disso, o único componente tecidual que apresentou diferença média relevante no porcentual pré e pós‐subtração do artefato do fio‐guia foi o núcleo necrótico (variação de 3,59%), enquanto o restante apresentou variação mínima (componente calcífico com 0,07%, lipídico com 0,52% e fibrótico com 0,98%).
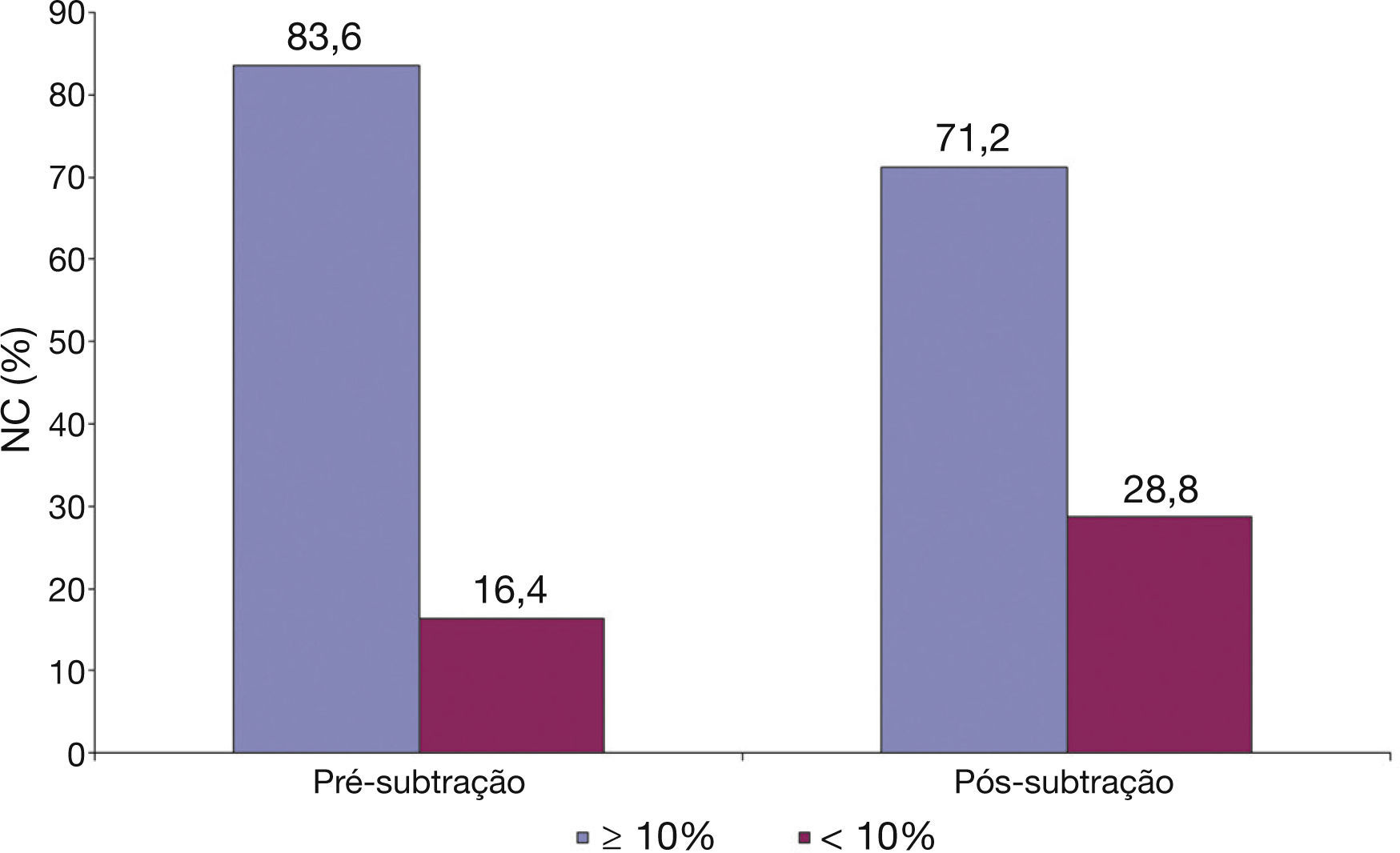
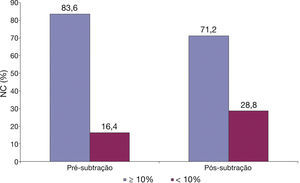
Finalmente, conforme ilustrado na figura 3, utilizando‐se o limite de 10% de núcleo necrótico como critério diagnóstico para definir uma lesão como um fibroateroma, ao subtrair o artefato do fio‐guia, 12,4% das lesões que apresentavam núcleo necrótico ≥ 10% passaram a não ser mais caracterizadas como fibroateroma.
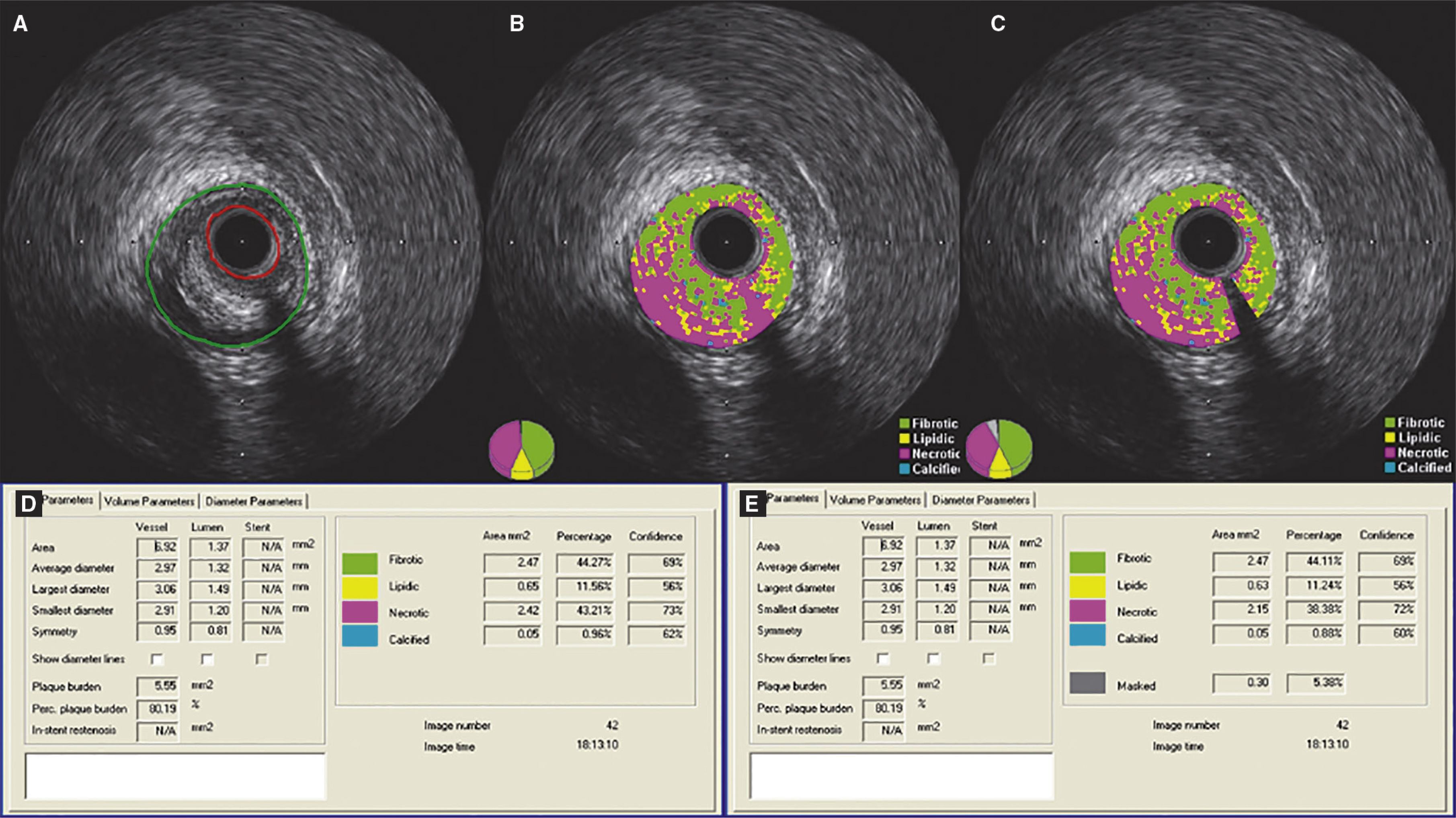
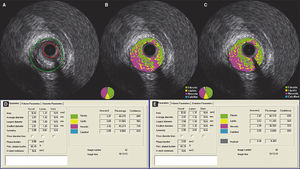
Demonstração do efeito da subtração do artefato do fio‐guia em uma lesão classificada como fibroateroma. (A) Ultrassom intracoronário em escala de cinzas; (B) caracterização tecidual com iMAP® observando o artefato causado pelo fio‐guia às 4h, sendo interpretado como núcleo necrótico (vermelho); (C) caracterização tecidual pós‐subtração do artefato do fio‐guia; (D e E) resultados pelo iMAP® pré e pós‐subtração do artefato do fio‐guia mostrando variação do núcleo necrótico de 43,21 para 38,38%.
No presente estudo, avaliamos 76 lesões em 21 pacientes com IAMCST utilizando USIC com escala de cinzas e caracterização tecidual com tecnologia iMAP®. Assim, definimos o impacto causado pelo artefato do fio‐guia na composição tecidual das placas ateroscleróticas. Os principais achados foram: após a subtração do artefato do fio‐guia, ocorreu redução estatisticamente significativa de todos os quatro componentes teciduais identificados pelo iMAP® (necrótico, calcífico, lipídico e fibrótico); o componente tecidual que apresentou redução mais significativa foi o componente necrótico (variação de 3,59%); ao subtrair o artefato do fio‐guia, 12,4% das lesões que previamente apresentavam núcleo necrótico ≥ 10% (preenchendo um dos critérios para classificação de fibroateroma) passaram a não ser mais assim classificadas.
No presente estudo, descrevemos pela primeira vez os efeitos da subtração do artefato causado pelo fio‐guia na caracterização tecidual da doença aterosclerótica coronariana utilizando‐se a tecnologia iMAP®. É possível que a interpretação equivocada da sombra acústica causada pelo fio‐guia como núcleo necrótico possa levar à classificação errônea de uma lesão ainda em estágio inicial de aterosclerose como um fibroateroma. Além disso, a possibilidade do fio‐guia superestimar o conteúdo necrótico pode ser ainda mais acentuada em vasos de maior calibre e em lesões com maior carga de placa.
Uma vez que a definição ultrassonográfica de fibroateroma envolve a obrigatoriedade da presença de 10% ou mais de núcleo necrótico confluente,13 qualquer artefato que leve ao aumento equivocado da quantidade desse componente pode resultar na classificação errônea de uma lesão. Em estudo similar, porém utilizando o VH‐IVUS®, Sales et al.21 demonstraram que o artefato causado pelas hastes metálicas dos stents, ao refletir as ondas do USIC, produziu efeito similar ao do cálcio. Dessa maneira, nesse tipo de tecnologia, o artefato é interpretado como componente calcífico. Em 17 lesões tratadas com stent, esses autores mostraram que, na comparação entre VH‐IVUS pré e pós‐ICP, houve aumento estatisticamente significativo na quantidade do componente calcífico. Entretanto, eles também demonstraram que, ao redor das hastes dos stents, pode ser identificado componente necrótico. Como não houve relação comprovada entre ICP e surgimento de tecido necrótico local, os autores concluíram que esse achado deveu‐se ao artefato causado pela haste metálica dos stents.
Diferentemente do VH‐IVUS, a tecnologia iMAP® identifica o artefato do fio‐guia (sombra acústica) como componente necrótico (e não calcífico).22 Em um dos nossos casos, uma lesão que inicialmente apresentava 43,21% de componente necrótico passou a apresentar 38,38% após a subtração do artefato do fio‐guia. Nessa circunstância, não houve impacto na classificação fenotípica da lesão. Porém, é possível que lesões limítrofes, que inicialmente seriam classificadas como fibroateroma, após a subtração do artefato, passem a ser classificadas como formas mais incipientes da aterosclerose, como espessamento intimal patológico ou placa fibrótica (ambas com núcleo necrótico < 10%).
LimitaçõesA análise de subtração do artefato fio‐guia foi feita manualmente, podendo sub ou superestimar os componentes teciduais. A aplicabilidade clínica da tecnologia iMAP® e de outras, que propõem o diagnóstico tecidual da placa de ateroma, ainda é tema de debate, não apresentando suporte na tomada de decisão clínica à luz das diretrizes vigentes. A baixa resolução espacial do USIC (aproximadamente 200 μm) pode interferir no delineamento e cálculo das áreas do vaso e, principalmente, na área da luz, podendo, assim, ter impacto no porcentual de cada componente tecidual.
ConclusõesA análise da placa de ateroma pela tecnologia iMAP® em pacientes portadores de infarto agudo do miocárdio com supradesnivelamento do ST mostrou que o artefato do fio‐guia superestimou o componente tecidual do núcleo necrótico da placa aterosclerótica. Essa interferência do fio‐guia pode mudar errônea e categoricamente as características fenotípicas de lesões mais benignas e estáveis (fibróticas) para lesões potencialmente instáveis, como os fibroateromas, na relação de um em cada dez pacientes.
Fonte de financiamentoHouve financiamento parcial por parte da Boston Scientific, que doou cateteres.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.