El síndrome de Evans se caracteriza por la disminución de, al menos, dos líneas celulares en ausencia de otros diagnósticos. Anteriormente, se definía como el desarrollo simultáneo o secuencial de trombocitopenia inmune primaria y anemia hemolítica autoinmune sin etiología específica. Se ha reportado una incidencia del 37% y una mortalidad del 10% de este síndrome.
Casos clínicosSe presenta la información clínica y la evolución del síndrome de Evans en dos pacientes lactantes que inicialmente fueron diagnosticados con trombocitopenia inmune primaria. El diagnóstico clínico se apoyó con estudios de gabinete, donde se corroboraron las alteraciones hematológicas. El manejo se realizó con esteroides e inmunoglobulina.
ConclusionesEn el abordaje del paciente pediátrico con trombocitopenia se deben buscar alteraciones de otra línea celular. En los casos reportados se detectó la presencia de anemia hemolítica y monocitosis, por lo que se deben incluir estudios infecciosos e inmunológicos. El tratamiento de primera línea es con esteroides, y debe considerarse la administración de inmunoglobulina si existe trombocitopenia severa asociada, como se observó en estos casos.
Evans syndrome is characterized by the reduction of at least two blood cell lineages in the absence of other diagnoses; it was previously described as the simultaneous or sequential development of autoimmune hemolytic anemia and immune thrombocytopenia with unknown etiology. An incidence of 37% and mortality rate of 10% were reported for Evans syndrome.
Clinical casesWe report the clinical presentation and evolution of Evans syndrome in two infants who were initially diagnosed with immune thrombocytopenia. The clinical diagnosis was supported on complementary studies, where hematological disorders were corroborated. Both cases received treatment with steroids and intravenous immunoglobulin.
ConclusionsFor the management of children with thrombocytopenia, the pediatrician must analyze for other cell lineage disorders. In the cases that we report here, we found the presence of autoimmune hemolytic anemia and monocytosis. Therefore, infectious and immunological studies must be included. The first-line treatment of choice are steroids, and intravenous immunoglobulin can be considered if severe immune thrombocytopenia is associated, as observed in these cases.
El síndrome de Evans (SE) es un trastorno definido por la disminución de, al menos, dos líneas celulares en ausencia de otros diagnósticos1. Anteriormente, se conocía como el desarrollo simultáneo o secuencial de trombocitopenia inmune primaria y anemia hemolítica autoinmune2. Aunque son pocos los datos estadísticos disponibles, se ha reportado que entre 13 y 73% de pacientes con anemia hemolítica autoinmune (AIHA) presentan compromiso de otras líneas celulares. En el estudio más grande de AIHA que se ha realizado, que incluyó 265 niños, se definió el SE por el compromiso de eritrocitos y plaquetas, y se reportó una incidencia del 37% y una mortalidad del 10%.
Se logró identificar alguna etiología solamente en el 10% de los pacientes. El SE puede ser primario o secundario a otras enfermedades, principalmente infecciones, enfermedad sistémica autoinmune o inmunodeficiencias primarias (estas últimas reportadas hasta en el 50 al 60% de los casos)1–3. Solo existe un caso reportado en la literatura asociado con la vacunación por influenza en un paciente adulto4, y pocos casos reportados secundarios a infección por citomegalovirus5.
La presentación de este síndrome oscila entre los 4 y 12 años de edad3,6–8. La presentación clínica se caracteriza por palidez, fatiga, disnea, taquicardia y fiebre. Cuando, además, cursa con trombocitopenia, se asocia con sangrado mucocutáneo. La alteración hematológica principal de SE es la anemia normocítica o macrocítica, frecuentemente hipocrómica. Los pacientes pueden desarrollar dependencia gradual o rápida en el rango de hemólisis y en la eficacia de la respuesta compensadora de la médula ósea. En el caso de la serie blanca, se asocia principalmente con neutropenia1.
Se deben buscar datos sugestivos de hemólisis mediada por mecanismo inmunológico en el protocolo diagnóstico de SE. Estos datos se basan en la prueba de Coombs directa positiva (negativa en el 5 a 10% de los casos), reticulocitos (normales o disminuidos hasta en el 40% de los casos), hiperbilirrubinemia indirecta, incremento de lactato deshidrogenasa y haptoglobulina sérica disminuida; el frotis de sangre periférica puede mostrar esferocitos que sugieren hemólisis extravascular. El aspirado de médula ósea se considera cuando existe reticulocitopenia y en lactantes con neutropenia. Además de estas pruebas, se debe incluir un estudio inmunológico con determinación de inmunoglobulinas y subclases de inmunoglobulina G (IgG), así como serología y el estudio molecular de agentes infecciosos, ya que podrían ser los agentes desencadenantes. La primera línea de tratamiento se basa en la administración de esteroides1–3,9. Se debe llevar un adecuado seguimiento con los pacientes diagnosticados con SE, ya que este síndrome se ha asociado con el desarrollo de enfermedades autoinmunes, como lupus eritematoso sistémico, e inmunodeficiencias, como la inmunodeficiencia común variable2,3,7,9.
2Casos clínicos2.1Caso 1Paciente masculino lactante de 1 mes 3 semanas de edad, originario de Nogales, Sonora. No presentó antecedentes heredofamiliares hemato-oncológicos ni perinatales de importancia para el padecimiento actual. Negó exposición a mielotóxicos, así como vacunación reciente.
Tres días previos a su ingreso inició con el padecimiento, con aparición de petequias en la cara, aumento progresivo y extensión de lesiones en tórax, abdomen, genitales y extremidades. Posteriormente, lesiones húmedas en el paladar y en las paredes laterales de la cavidad oral. Acudió a urgencias pediátricas, donde se documentó trombocitopenia grave y se derivó al servicio de hematología pediátrica. Se observó palidez generalizada, ictericia conjuntival, faringe sin secreciones, con petequias húmedas en el paladar y paredes laterales de la cavidad oral, sin adenomegalias palpables, hígado palpable a 1cm por debajo de reborde costal, sin esplenomegalia, piel marmórea, con llenado capilar inmediato, múltiples equimosis en sitios de venopunción y petequias diseminadas generalizadas.
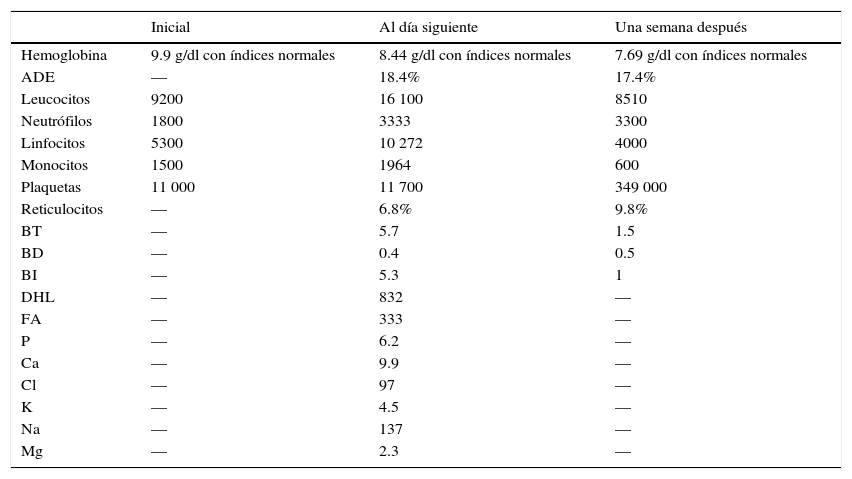
Los resultados de la biometría hemática (BH) inicial fueron anemia normocítica normocrómica, monocitosis y trombocitopenia grave. Se realizó una nueva BH al día siguiente, donde se detectó descenso de 1g/dl de hemoglobina, ancho de distribución eritrocitario amplio, leucocitosis a expensas de linfocitosis y monocitosis, trombocitopenia grave, tiempos de coagulación normales. En la bioquímica sanguínea se encontraron la deshidrogenasa láctica y el fósforo elevados. Se realizó perfil infeccioso, obteniéndose los siguientes resultados: toxoplasma IgG (+) 14.4, IgM (-) 0.05, citomegalovirus IgG (+) 212, IgM (-) 0.1, virus de inmunodeficiencia humana (VIH) negativo. Además, se realizó protocolo de anemia, solicitando análisis de reticulocitos, los cuales se encontraron elevados. También se encontraron índices de hemólisis: hiperbilirrubinemia indirecta, prueba de Coombs directa negativa (ya se habían administrado esteroides e inmunoglobulina). Para valorar la morfología, se realizó frotis de sangre periférica que resultó con monocitosis, neutropenia, granulación tóxica y linfocitos reactivos (tabla 1).
Resultados de laboratorio del caso 1
| Inicial | Al día siguiente | Una semana después | |
|---|---|---|---|
| Hemoglobina | 9.9 g/dl con índices normales | 8.44 g/dl con índices normales | 7.69 g/dl con índices normales |
| ADE | — | 18.4% | 17.4% |
| Leucocitos | 9200 | 16 100 | 8510 |
| Neutrófilos | 1800 | 3333 | 3300 |
| Linfocitos | 5300 | 10 272 | 4000 |
| Monocitos | 1500 | 1964 | 600 |
| Plaquetas | 11 000 | 11 700 | 349 000 |
| Reticulocitos | — | 6.8% | 9.8% |
| BT | — | 5.7 | 1.5 |
| BD | — | 0.4 | 0.5 |
| BI | — | 5.3 | 1 |
| DHL | — | 832 | — |
| FA | — | 333 | — |
| P | — | 6.2 | — |
| Ca | — | 9.9 | — |
| Cl | — | 97 | — |
| K | — | 4.5 | — |
| Na | — | 137 | — |
| Mg | — | 2.3 | — |
ADE: ancho de distribución eritrocitario; BT: bilirrubina total; BD: bilirrubina directa; BI: bilirrubina indirecta; DHL: deshidrogenasa láctica; FA: fosfatasa alcalina; P: fósforo; Ca: calcio; Cl: cloro; K: potasio; Na: sodio; Mg: magnesio.
Los estudios de imagenología (ultrasonido abdominal y ultrasonido transfontanelar) se reportaron normales.
El paciente cumplió con los criterios para anemia hemolítica y trombocitopenia autoinmune (SE), por lo que se inició manejo con inmunoglobulina (tres dosis de 1g/kg) y metilprednisolona (tres dosis de 30mg/kg), sin realizar transfusiones.
Su evolución fue hacia la mejoría durante su hospitalización, con buena respuesta al manejo e incremento de su recuento plaquetario (de 11 000 a 231 000/μl) posterior a las dosis de inmunoglobulina y metilprednisolona. Dada la persistencia de datos de hemólisis, se administró la tercera dosis de inmunoglobulina (1g/kg). Posterior a las dosis de metilprednisolona, se continuó con hidrocortisona (9mg/kg/día) y se observó el incremento progresivo del nivel de hemoglobina en el paciente, con índices eritrocitarios normales, descenso de leucocitos con diferencial conservada y recuento plaquetario normal, así como la mejoría de los índices de hemólisis por descenso de ancho de distribución eritrocitario y bilirrubinas. Únicamente persistió la reticulocitosis (tabla 1).
Debido a las condiciones de mejoría y estabilidad, el paciente recibió su egreso con prednisona (2mg/kg/día). Se valoró en la consulta externa de Hemato-pediatría después de 2 semanas y se encontró con evolución estable y sin datos de recurrencia hasta ese momento.
2.2Caso 2Paciente masculino de 7 meses de edad, originario de Hermosillo, Sonora. Se negaron antecedentes hemato-oncológicos y exposición a mielotóxicos. Solo se refirió vacunación reciente (3 semanas previas recibió una dosis de pentavalente e influenza), y se detectó probable dermatitis atópica por exantema generalizado 3 meses antes e infección de vías respiratorias altas en las 3 semanas previas.
El paciente inició su cuadro actual una semana después de la aplicación de vacunas y de haber padecido una infección respiratoria alta, con aparición de lesiones equimóticas en la región occipital, con extensión y generalización de las mismas (tórax, abdomen y extremidades), aparición de petequias y sangrado en mucosas (paladar, lengua y paredes laterales de cavidad oral).
En la unidad médica se documentó trombocitopenia de 16 000. Se inició el manejo con inmunoglobulina, metilprednisolona y transfusión de concentrados plaquetarios (se desconoce dosis, frecuencia y duración del tratamiento). El paciente fue trasladado a esta unidad a los tres días, con cuadro ya modificado por inicio de manejo y sin protocolo de estudio previo.
A su ingreso, clínicamente con manifestación de sangrado mucocutáneo generalizado, se corroboró trombocitopenia grave y anemia moderada; se solicitó valoración por Hemato-pediatría, quienes iniciaron protocolo de abordaje diagnóstico.
El reporte de la BH de ingreso fue anemia normocítica normocrómica, ancho de distribución eritrocitario amplio, fórmula blanca conservada, trombocitopenia grave, electrolitos séricos, proteína C reactiva y tiempos de coagulación normales. Se realizó monitoreo durante las siguientes 8h, sin variaciones de la cifra de hemoglobina. Se corroboró reticulocitosis, prueba de Coombs directa negativa, fórmula blanca conservada, trombocitopenia grave, bilirrubinas y transaminasas normales (tabla 2).
Resultados de laboratorio del caso 2
| Inicial | A las 8 h | A los 7 días | |
|---|---|---|---|
| Hemoglobina | 6.38 g/dl con índices normales (VCM 81.3, HCM 25.2) | 6.5 g/dl, con índices normales (VCM 79.2, HCM 25.1) | 8.4 g/dl con índices normales |
| ADE | 15.3% | 12.1% | — |
| Leucocitos | 10 700 | 11 100 | 16 500 |
| Neutrófilos | 7400 | 8100 | 13 200 |
| Linfocitos | 2700 | 2700 | 1200 |
| Monocitos | 500 | — | 2000 |
| Plaquetas | 17 300 | 13 800 | 119 000 |
| Reticulocitos | — | 18% | — |
| BT | — | 0.8 | — |
| BD | — | 0.4 | — |
| BI | — | 0.4 | — |
| DHL | — | — | — |
| FA | — | 126 | — |
| ALT | — | 20 | — |
| AST | — | 29 | — |
VCM: tamaño promedio de los glóbulos rojos; HCM: cantidad de hemoglobina por glóbulo rojo; ADE: ancho de distribución eritrocitario; BT: bilirrubina total; BD: bilirrubina directa; BI: bilirrubina indirecta; DHL: deshidrogenasa láctica; FA: fosfatasa alcalina; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa.
Para el estudio de la etiología desencadenante, se realizó protocolo de agentes infecciosos: TORCH (que informó IgG de citomegalovirus positiva en 199) e IgM negativa, toxoplasma IgG positiva en 7.5 e IgM negativa y rubeola negativa. Se realizó un último control de citometría hemática un día previo a su egreso, con mejoría de la hemoglobina y el conteo plaquetario, solo con elevación de la fórmula blanca a expensas de neutrofilia y monocitosis asociadas a un proceso infeccioso en piel.
En el abordaje de imagenología, se realizó un ultrasonido abdominal, que reportó hígado y bazo sin alteraciones, de tamaño normal para su edad.
El paciente presentó bicitopenia, definida por anemia normocítica normocrómica regenerativa con ancho de distribución eritrocitario amplio y reticulocitosis. A pesar de haber presentado prueba de Coombs directa negativa y bilirrubinas normales (probablemente por cuadro modificado por inicio de tratamiento), reunió las características para el diagnóstico con anemia hemolítica y trombocitopenia autoinmunes, compatible con SE.
Se inició manejo agudo con inmunoglobulina (1g/kg) y esteroides, en bolos de metilprednisolona (30mg/kg). El paciente completó tres dosis de ambos, con adecuada respuesta al manejo. Presentó mejoría clínica evidente desde las primeras 24h, aunque la evolución en los estudios de laboratorio fue lenta, ya que los datos de hemólisis persistieron. Por lo anterior, se administró la tercera dosis de inmunoglobulina y se continuó con el manejo con esteroides intravenosos a base de hidrocortisona. Durante su estancia hospitalaria, el paciente se mantuvo estable. Recibió su egreso para continuar el manejo ambulatorio con prednisona (2mg/kg) por 2 semanas más. Se valoró en consulta a las 2 semanas, con remisión de sintomatología, normalización de fórmula roja y plaquetas y sin datos de hemólisis. Sin embargo, presentó recurrencia con trombocitopenia en dos ocasiones, asociadas con el incremento de IgG para citomegalovirus. El paciente fue valorado por el servicio de infectología pediátrica, para proporcionar el seguimiento del caso.
3DiscusiónExisten pocos datos estadísticos de la presentación del síndrome de Evans. Solamente en el 10% de los casos se logra determinar una etiología, lo cual es de suma importancia para el tratamiento y pronóstico de la enfermedad. En los dos casos reportados, se observó la asociación con títulos elevados de IgG para citomegalovirus. Si bien no es diagnóstico, puede sospecharse infección latente que se confirma mediante la reacción en cadena de la polimerasa (PCR) para citomegalovirus. Dicho virus puede infectar a pacientes inmunocompetentes en forma simultánea con otros agentes (como virus sincitial respiratorio, virus Epstein Barr, Chlamydia pneumoniae, herpesvirus 6, virus de sarampión y otros10) hasta en el 68.9% de los casos, por lo que en el paciente con sospecha o diagnóstico de SE, se debe hacer un estudio infeccioso completo, ya que el citomegalovirus es el agente infeccioso más común asociado con trombocitopenia en niños de entre 1 y 6 meses de edad5.
Los casos reportados en este trabajo no se encuentran en la edad de presentación habitual del síndrome, que es entre los 4 y 12 años3,6–8. En estos casos, el SE se manifestó antes del año de edad (1 mes 3 semanas y 7 meses). En una cohorte francesa se observó que 13 de 156 pacientes con diagnóstico de SE desarrollaron su primera citopenia antes del año de edad3. Los hallazgos clínicos de los pacientes con SE correspondieron a lo esperado de acuerdo con la línea celular hematológica afectada y severidad de la misma. En los casos aquí reportados, se manifestó como síndrome hemorrágico mucocutáneo y síndrome anémico principalmente, asociado con síndrome infeccioso en el primer caso. El diagnóstico se sospechó por las manifestaciones clínicas y se confirmó al comprobar, mediante estudios de laboratorio, los datos de afección de dos líneas celulares (eritrocitos y plaquetas), con evidencia de hemólisis. Si bien la prueba de Coombs directa de los pacientes resultó negativa, la literatura menciona este dato entre el 5 al 10% de casos de anemia hemolítica. En estos casos, no fue posible realizar el estudio hematológico para la búsqueda intencionada de anticuerpos eritrocitarios, ya que se recibieron con cuadro modificado por hemotransfusiones y tratamiento esteroideo. Es importante mencionar que en el primer caso hubo afección de una tercera línea hematológica: monocitos, lo que sugirió una etiología infecciosa del SE al asociarse con títulos elevados de IgG para citomegalovirus.
En los pacientes reportados, el valor de IgG para citomegalovirus se encontró aumentado más de cuatro veces su valor normal. Esto llevó a sospechar de una infección latente, por lo que se solicitó PCR (una prueba más sensible y específica) para citomegalovirus para establecer el diagnóstico, resultando negativa en ambos pacientes. Sin embargo, el segundo caso ha presentado dos recaídas con trombocitopenia asociadas con el incremento de la IgG para citomegalovirus5,10,11.
Se debe considerar también la asociación de SE con inmunodeficiencias, ya que hay reportes donde se documenta inmunodeficiencia variable común asociada, por lo que se debe realizar nivel sérico de inmunoglobulinas previo al inicio del tratamiento con inmunoglobulina2,7. Sin embargo, en ambos pacientes ya se había iniciado el manejo previamente, por lo que no se pudo realizar dicho estudio en el momento de su diagnóstico.
Por otro lado, el antecedente de vacunación debe buscarse intencionadamente, ya que es bien conocida la asociación de la misma con el desarrollo de trombocitopenia inmune primaria (que es un componente del SE), principalmente con las vacunas de virus vivos atenuados12,13. En el segundo paciente, se tenía el antecedente de vacunación contra influenza; si bien el SE no se puede atribuir por completo a este factor al sospecharse también de componente infeccioso, se debe recordar que existe el reporte de un caso de SE asociado con dicha vacuna4.
Por último, el manejo de los pacientes fue con base en inmunoglobulina (1g/kg por tres dosis) y esteroide sistémico (metilprednisolona 30mg/kg por 3 días), y posteriormente hidrocortisona (8mg/kg por 5 días). Se continuó con esteroide tipo prednisona (2mg/kg) hasta su próxima revaloración por hematología pediátrica. En estos casos se decidió administrar tres dosis de inmunoglobulina a dosis de 1g/kg, por la persistencia de datos de hemólisis en los exámenes de laboratorio, ya que se catalogó como respuesta no satisfactoria de la primera línea de tratamiento (esteroide) de anemia hemolítica autoinmune. La inmunoglobulina es la segunda línea de tratamiento, con esquemas desde 400mg hasta 1g/kg de 1 a 5 días. Los esquemas terapéuticos para SE son variables, y se han adaptado del manejo de la trombocitopenia inmune primaria (TIP) y de AIHA.
En el abordaje del paciente pediátrico con trombocitopenia se deben buscar alteraciones de otra línea celular, ya que como se observó en estos dos casos, inicialmente fueron catalogados como trombocitopenia inmune primaria. Sin embargo, existía también afección eritrocitaria (anemia hemolítica) y leucocitaria (monocitosis), por lo que se integró el SE como posible diagnóstico al reunir los parámetros clínicos y de laboratorio.
En la búsqueda de una etiología se debe incluir el estudio infeccioso e inmunológico, con el fin de dar un manejo oportuno en caso de determinar una causa específica y seguimiento adecuado de la misma. El tratamiento habitualmente se basará en el uso de esteroide como primera línea e inmunoglobulina si se encuentra trombocitopenia severa asociada.
Se debe recordar que el seguimiento del paciente con citopenia aislada es importante, ya que puede presentar una segunda citopenia hasta 3 años más tarde y tratarse de SE, por lo que se debe sospechar incluso en pacientes que no remitan, o bien que presenten recurrencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal médico (adscrito y becarios) y administrativo del Departamento de Pediatría del Hospital General Regional Número Uno del Instituto Mexicano del Seguro Social, en Ciudad Obregón, Sonora, México.