Introducción
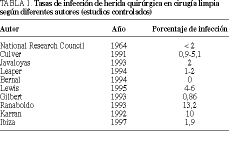
En los últimos años se ha desarrollado un interesante debate sobre la utilidad y eficacia de la profilaxis antibiótica en determinados tipos de cirugía limpia1,2. Si bien existen numerosos protocolos de profilaxis antibiótica con diferentes regímenes antibióticos, en el área concreta de la cirugía limpia, las pautas son mucho más homogéneas. Se acepta que, debido a la teóricamente baja tasa de infección de herida quirúrgica en las intervenciones limpias, la profilaxis antibiótica sólo está indicada cuando las consecuencias de una infección suponen un riesgo importante para el paciente (p. ej., prótesis vasculares, ortopédicas, cardíacas, etc.)3. Sin embargo, no es infrecuente constatar la administración de profilaxis antibióticas en intervenciones limpias. Además, aunque se han admitido porcentajes de infección de herida inferiores al 2,5%, las tasas de infección en este tipo de intervenciones varían de unos grupos a otros, oscilando entre menos del 1% hasta más del 15% (encuesta de la Asociación Española Cirujanos realizada en 19965)4,5 (tabla 1).
La cirugía de la hernia inguinal ha experimentado sustanciales cambios en cuanto a la técnica quirúrgica desde la aparición de las mallas sintéticas, debido fundamentalmente a su sencilla colocación, disminución del dolor postoperatorio y reducción de la incidencia de recidiva. Sin embargo, la utilización de mallas, que no dejan de ser por otra parte cuerpos extraños, ha añadido un elemento más de confusión a la hora de valorar la necesidad de realizar profilaxis antibiótica en estos pacientes. En algunos estudios se ha atribuido a estos materiales una mayor capacidad de inducir una respuesta inflamatoria y, por tanto, causar una mayor susceptibilidad de infección. Así mismo, se ha descrito una relación entre la infección local y una mayor probabilidad de recidiva en la reparación.
Considerando estos argumentos razonables, no resulta difícil entender que los cirujanos nos preguntemos por la necesidad de realizar profilaxis antibiótica en la reparación de la hernia inguinal mediante mallas sintéticas. La revisión de la bibliografía en este sentido lleva a una gran controversia y a una conclusión final en el que concluyen prácticamente la totalidad de los trabajos: "...son necesarios estudios prospectivos que recojan un amplio número de pacientes para valorar la eficacia y utilidad de la profilaxis antibiótica en los pacientes sometidos a la reparación de una hernia inguinal/femoral mediante la colocación de una malla sintética..."6.
Pacientes y método
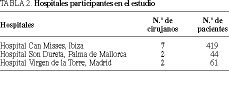
El estudio se realizó desde el 1 de junio de 1994 al 1 de junio de 1997. Para obtener una muestra suficientemente amplia se incluyeron pacientes de tres hospitales, Hospital Can Misses, Ibiza (INSALUD); Hospital Son Dureta, Palma de Mallorca (INSALUD) y Hospital Virgen de la Torre, Madrid (INSALUD) (tabla 2). Todas las intervenciones fueron realizadas por cirujanos no residentes. Se designó un coordinador del estudio en cada centro responsable de la recogida de datos y de velar por el cumplimiento de los criterios de inclusión de los pacientes, así como de la aleatorización, estratificación y aleatoriedad del estudio, y de la confidencialidad de los resultados. El diseño del trabajo fue aprobado por los comités de ética y de investigación (Unidad Docente de las Islas Baleares, Palma de Mallorca).
Ingreso hospitalario
Todos los pacientes ingresaron el mismo día de la intervención. El alta hospitalaria varió en función de las características de los pacientes, hallazgos operatorios y tipo de reparación. En el Hospital de Ibiza, donde existe una unidad de cirugía mayor ambulatoria, 51 pacientes fueron ingresados y dados de alta el mismo día de la intervención. A efectos de determinación de la estancia media, estos casos se computaron como media estancia.
Criterios de inclusión y exclusión
Antes de comenzar el estudio se elaboró un protocolo de inclusión y exclusión de pacientes consensuado por los miembros del estudio. Fueron incluidos todos aquellos pacientes operados de forma programada y con colocación de prótesis sintética de polipropileno para su reparación. Los criterios de exclusión se exponen en la tabla 3.
Preparación de la piel
La preparación de la piel se realizó de una forma estandarizada mediante la aplicación de una solución antiséptica de polividona yodada (10 g/yodo/100 ml).
Profilaxis y placebo
Se establecieron de forma aleatoria dos grupos de pacientes: pacientes con profilaxis antibiótica y pacientes con placebo.
Profilaxis antibiótica. Se utilizó como profilaxis la cefazoli na (2 g i.v.), administrada durante la inducción anestésica. En los pacientes alérgicos a los betalactámicos se utilizó eritro micina 1 g i.v. El antibiótico fue diluido en 100 ml de suero fisiológico.
Placebo. El placebo consistió en la administración de 100 ml de suero fisiológico, en el mismo tipo de envase que el utilizado en los casos con antibiótico, siendo administrado igualmente antes de la incisión de la piel.
Aleatorización y doble ciego
Se realizó una clasificación de los pacientes de forma aleatoria, mediante la extracción de tarjetas marcadas como "sí" (profilaxis) o "no" (placebo). La administración de la solución (antibiótico o placebo) fue realizada por la enfermera circulante, no informando del contenido de la solución a ninguno de los dos cirujanos implicados en la intervención. El contenido de la solución fue comunicado al coordinador del estudio, para facilitar la recogida de datos y evitar la pérdida de éstos. En el seguimiento postoperatorio, los cirujanos, las enfermeras de planta y la de consulta externa desconocían la solución administrada al paciente. Las infecciones de herida fueron detectadas en la consulta externa, informando al coordinador del nombre del paciente para su registro.
Estratificación de pacientes
En la fase de diseño del estudio se consideró especialmente importante cuantificar la tipología o case mix de los pacientes. Por esta razón, se realizó una estratificación de los pacientes de acuerdo a su riesgo biológico individual. Para conseguir este objetivo elegimos la clasificación ASA (American Society of Anaesthesiology) por su simplicidad y facilidad de aplicación.
Criterios de infección de herida quirúrgica
La existencia de uno de los 4 criterios fue suficiente para considerar una herida infectada: a) eritema cutáneo > 2 cm a cada lado de la incisión; b) descarga de exudado purulento por la herida; c) exudado no purulento, con cultivo microbiológico positivo, y d) herida abierta por el cirujano que no fue cerrada después de su apertura.
Criterios de definición de seroma . Definimos como seroma de herida a aquella colección líquida, no purulenta, que ocupa el tejido celular subcutáneo, y cuya punción-aspiración estéril ofrece un exudado con cultivo negativo.
Sistema de vigilancia de infección postoperatoria
Todas las heridas de los pacientes fueron evaluadas diariamente por el cirujano responsable durante el ingreso hospitalario. Después del alta hospitalaria, los pacientes fueron instruidos para seguir el siguiente control postoperatorio:
1. Control al séptimo día postoperatorio en la consulta externa de cirugía.
2. Control el día 30 del postoperatorio en la consulta externa de cirugía.
3. Evaluación en la consulta externa o en el servicio de urgencias del hospital en caso de que presentase cualquier tipo de complicación como: fiebre > 38 °C, dolor en la herida, eritema, supuración de cualquier tipo de exudado, control en la consulta externa al año de la intervención.
Clasificación del tipo de hernia
Las dos clasificaciones más frecuentemente empleadas son la de Gilbert (1989) y la de Nyhus (1991)27. La clasificación de Gilbert no incluye la hernia femoral en ninguno de sus grupos. Nyhus incluye las hernias femorales en el grupo III-C, como forma especial de defecto de la pared posterior; sin embargo, tanto anatómica como clínicamente nos parecen planos y entidades diferentes. En nuestra opinión, las hernias femorales o crurales, por su anatomía, índice de recurrencia y técnica de reparación, deberían ser consideradas como un grupo aparte. Por estas razones hemos seguido una clasificación anatomoclínica diseñada por Sabrido28. De esta forma, hemos mantenido los dos primeros tipos sin cambios (tipo I y tipo II). El tipo III está constituido por aquellos pacientes con hernias directas puras. El tipo IV se compone de "defectos mixtos", es decir, asociación de hernia indirecta y directa en un mismo paciente o la presencia de una hernia indirecta con franca debilidad de la pared posterior. Consideramos las hernias femorales como un grupo aparte (tipo V), pero sin incluirlas como defectos de la pared inguinal posterior. El tipo V lo constituyen las hernias recidivadas (tabla 5).
Tipo de prótesis (malla)
Se utilizaron en todos los casos mallas de polipropileno debido a su facilidad de utilización y menor precio en relación a otras mallas sintéticas. La fijación de la malla a los tejidos se hizo con sutura de polipropileno. El cierre de la piel se realizó mediante la aplicación de grapas.
Análisis estadístico
Las hipótesis principales del estudio fueron dos:
1. La profilaxis antibiótica permite reducir de forma significativa la incidencia de infección de herida quirúrgica.
2. Los pacientes con un mayor riesgo biológico, determinado por la clasificación ASA, presentan una mayor tasa de infecciones de herida quirúrgica.
Basándonos es estudios prospectivos previos se aceptó una incidencia de infección de herida en torno al 3%, por lo que para un intervalo de confianza del 95% se estimó una muestra de 250 pacientes en cada grupo (antibiótico-placebo). La determinación de la homogeneidad de la muestra se realizó mediante tablas 2 * 2. El cálculo del riesgo relativo y odds ratio para un intervalo de confianza del 95% fue el siguiente: odds ratio = 1,24 (0,31-5,31) y riesgo relativo = 1,13 (0,53-2,44).
Las pruebas utilizadas para analizar la significación estadística fueron la * 2 y la t de Student.
Resultados
El rango de edad osciló entre los 17 y 87 años (edad media = 54,2 años; mediana = 56; desviación típica: 15,565). La distribución por sexos fue la siguiente: varones, 471 (89,9%) y mujeres, 53 (10,1%).
Distribución según profilaxis antibiótica o placebo
Los 524 pacientes fueron divididos de forma aleatoria en dos grandes grupos según recibieran profilaxis antibiótica (237 casos; 54,8%) o placebo (287 casos; 45,2%). La distribución de la profilaxis antibiótica según el sexo se expone en la tabla 4.
Estratificación según la clasificación ASA
Todos los pacientes fueron estratificados según su índice de riesgo intrínseco evaluado por la clasificación ASA, de acuerdo a la distribución siguiente: ASA-I, 224 (42,7%); ASA-II, 219 (41,8%), y ASA-III, 78 (14,9%).
Clasificación según el tipo de hernia
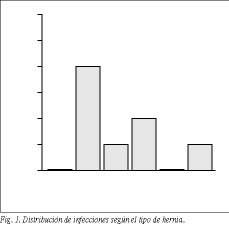
La distribución por frecuencias de los tipos de hernia se resume en la tabla 5. El tipo de hernia más frecuente fue el tipo mixto (38,4% de los pacientes). Se estudió la proporción de infecciones de herida quirúrgica según el tipo de hernia. La distribución de infecciones para cada tipo de hernia se describe en la figura 1. No se encontraron diferencias significativas al comparar la incidencia de la infección de herida con el tipos de hernia ( * 2: p = 0,515).
Infección de herida quirúrgica (IHQ)
Durante el estudio se detectaron 10 infecciones de herida quirúrgica, lo que supone una incidencia global del 1,9%.
Realizamos un estudio estadístico relacionando la infección de la herida quirúrgica con las siguientes variables: a) profilaxis antibiótica; b) ASA; c) duración de la cirugía; d) edad; e) presencia de hematoma; f) presencia de seroma, y g) tipo de hernia.
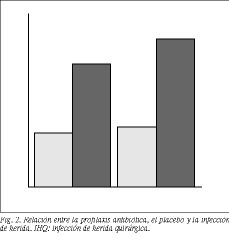
Profilaxis antibiótica. Del total de 524 pacientes del estudio, 233 recibieron profilaxis antibiótica, registrándose en este grupo 4 infecciones de herida (1,7%). Por su parte, 281 pacientes no recibieron profilaxis, con una tasa de IHQ en este grupo del 2,1% (6 casos) (diferencia no estadísticamente significativa: * 2 = Pearson: 0,737; Fisher: 0,498) (fig. 2).
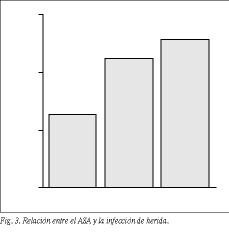
Relación entre la IHQ y la clasificación ASA. El análisis relacionando el ASA y la IHQ objetivó diferencias pequeñas y sin significación estadística. En el grupo ASA-I se registraron 3 infecciones (1,35%), en el grupo ASA-II, 5 infecciones (2,31%), y en el grupo ASA-III, 2 infecciones (2,63%). Un correcto análisis entre estas dos variables precisa de una muestra superior a la utilizada en este estudio. Sin embargo, parece existir una tendencia a incrementarse el riesgo de desarrollar una infección de herida a medida que aumenta el riesgo de los pacientes (fig. 3).
Edad de los pacientes. Comparamos la edad media de los pacientes que presentaron infección de la herida con la edad media de los pacientes que no desarrollaron ninguna infección. Las diferencias observadas no pusieron de manifiesto tampoco en este caso una significación estadística (54,1 años en los pacientes con infección y 54,2 años en los pacientes sin infección) (t de Student: p = 0,701).
Duración de las intervenciones. Se registraron resultados similares al comparar la duración de la cirugía con la infección de herida quirúrgica. La duración media de los pacientes con infección de herida fue de 34 min, frente a una duración de 36,5 min en los pacientes en los que no se desarrolló infección de la herida (t de Student: p = 0,956).
Relación entre la IHQ y las complicaciones locales (hematomas-seromas). La presencia de hematomas y seromas postoperatorios fueron las únicas variables que, de forma independiente, manifestaron una diferencia significativa con la infección de herida.
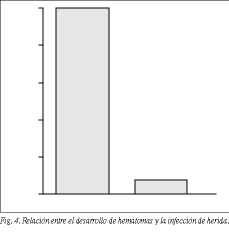
1. Hematomas. En 14 pacientes (2,7%) se desarrolló un hematoma inguinal en el postoperatorio inmediato. De estos 14 pacientes, dos casos (16,6%) evolucionaron después con una infección de herida. Al comparar la presencia o no de hematomas en relación con la infección de herida se observa que el 25% de los pacientes con hematomas sufrieron posteriormente una infección de herida. Por su parte, tan sólo un 2,4% de los pacientes sin hematomas desarrollaron una infección de herida (nivel de significación estadística: * 2; Pearson = 0; Fisher = 0,026) (fig. 4).
De los 14 pacientes con hematoma, fue necesario realizar un drenaje quirúrgico de urgencia en 4 casos, debido a la naturaleza expansiva del hematoma o por intenso dolor del paciente. Ninguno de estos 4 pacientes reintervenidos presentaron después una infección de herida.
2. Seromas. Un total de 11 pacientes (2,1%), presentaron como complicación local un seroma de herida. Al comparar la relación existente entre la presencia de seromas y la infección de herida se observó que el 66% de los pacientes con seromas desarrollaron posteriormente una infección de herida, mientras que un 1,4% de los pacientes sin seroma evolucionaron después con una infección de herida (nivel de significación: * 2; Pearson = 0; Fisher = 0,00002).
Sin embargo, es necesario analizar estos últimos datos con prudencia ya que la conducta que seguimos en los pacientes que presentan seromas de herida es el vaciamiento mediante punción percutánea, lo cual introduce un factor de riesgo importante para el desarrollo de infecciones locales.
Formas de presentación de la infección. La infección de herida se presentó de dos formas. En 6 casos la presentación inicial fue en forma de absceso de herida con los signos inflamatorios agudos habituales. En los 4 pacientes restantes se desarro lló una fístula cutánea con sepsis local crónica que se mantuvo durante varias semanas. En estos 4 pacientes fue necesaria la extracción de la malla debido al fracaso del tratamiento conservador con curas locales y antibióticos. El cultivo de la malla extraída confirmó la presencia del mismo germen que el culti vo previo de la herida en todos los casos. Después de la extracción de la malla, la recuperación fue satisfactoria en todos los pacientes, cerrándose la fístula en un tiempo variable entre los 10 y 15 días. No se ha registrado hasta el momento ningún caso de recidiva de la hernia en los pacientes a los que se les extrajo la malla por sepsis local mantenida. La distribución de frecuencias de los gérmenes cultivados de las heridas infectadas se expresa en la tabla 6.
Complicaciones locales
De las 524 intervenciones controladas se produjeron un total de 40 complicaciones (morbilidad global del 7,7%). El tipo y porcentaje de complicaciones se exponen en la tabla 7. La complicación más frecuente fue la aparición de hematomas inguinoscrotales (14 casos; 2,7%). La presencia de seromas en la herida quirúrgica se observó en 11 pacientes (2,1%). Todos ellos fueron tratados mediante punción percutánea y estudio microbiológico del líquido aspirado. Un paciente desarrolló una neuropatía inguinal postoperatoria. Fue trasladado a la consulta del dolor donde fue tratado mediante infiltraciones con bupivacaína al 0,25% y corticoides, instaurándose después tratamiento con carbamacepina. La evolución fue favorable, con desaparición completa del dolor a los 10 meses de iniciado el tratamiento.
Discusión
La profilaxis antibiótica se ha demostrado como el factor independiente de mayor importancia en la reducción de la incidencia de infección de herida quirúrgica en determinados tipos de cirugía limpia y limpia-contaminada. Conseguir disminuir la tasa de infección de herida tiene una extraordinaria trascendencia por varias razones:
1. Mejorar la evolución postoperatoria de los pacientes y evitar las molestias derivadas de cualquier infección de herida.
2. Reducir la estancia media hospitalaria. Se estima que los pacientes que desarrollan infecciones de herida permanecen ingresados un promedio de 4-7 días más que los que no se infectan9.
3. Reducir el gasto que se genera por el tratamiento de una infección de herida, estimado entre un 10 y un 20% del total de la hospitalización9,13,24.
Aspectos farmacocinéticos
El propósito de la profilaxis antibiótica es conseguir una concentración suficiente del antibiótico en los tejidos antes de realizar la incisión. La profilaxis se considera una ayuda de los sistemas de defensa del paciente, en particular de la fagocitosis. Cuando se administra un antibiótico por vía intravenosa, se necesita una media de 30 min para conseguir que la concentración del fármaco en los tejidos sea la misma que la conseguida en el plasma, y esto es especialmente importante si se utilizan antibióticos de vida media corta (cefalosporinas)3,7. La vía tradicional de administración de la profilaxis antibiótica ha sido, por razones farmacocinéticas, la intravenosa. Sin embargo, han aparecido recientemente trabajos evaluando la ruta oral con resultados similares a los obtenidos con la profilaxis intravenosa y una reducción significativa del coste18-29.
Profilaxis con múltiples dosis frente a dosis única
Los regímenes se han modificado a medida que se publicaban estudios prospectivos y controlados. Desde 1977, año en que Strachan et al30 demostraron que la profilaxis antibiótica administrada como dosis única conseguía reducir la incidencia de infección de herida quirúrgica a un 3%, frente al 6% obtenido mediante múltiples dosis, se han elaborado varios trabajos confirmando estos resultados31-33. Las conclusiones generales de estos estudios permiten afirmar que con la administración de la profilaxis antibiótica en dosis únicas se consigue los siguientes objetivos7: a) misma eficacia en la prevención de la infección de la herida quirúrgica; b) disminución del número de efectos secundarios, y c) dado que la profilaxis antibiótica se realiza en procedimientos quirúrgicos de relativa gran frecuencia, la utilización de dosis única permite abaratar su coste total.
A pesar de estas recomendaciones, es frecuente encontrar regímenes de profilaxis antibiótica en cirugía limpia que se mantienen más allá de las primeras 24 h del postoperatorio, llegando a prolongarse en algunos casos hasta el cuarto día. Éste es uno de los resultados de la encuesta nacional llevada a cabo en 1995 por el Comité Nacional de Infección Quirúrgica realizado por la Asociación Española de Cirujanos5.
Indicaciones de la profilaxis antibiótica en la cirugía limpia
Actualmente se está desarrollando un interesante debate en relación con la profilaxis antibiótica de determinadas intervenciones consideradas como cirugía limpia4-6,15,17,19,22,23. La profilaxis antibiótica en cirugía limpia se encuentra indicada en intervenciones con colocación de materiales sintéticos, como prótesis vasculares, cardíacas o articulares, debido fundamentalmente a las graves implicaciones que suponen el desarrollo de una infección en estos casos. En los demás procedimientos clasificados como cirugía limpia, no se ha recomendado la utilización de profilaxis antibiótica, debido a la teóricamente baja incidencia de infección de herida. Sin embargo, la utilización de mallas sintéticas se ha difundido y desarrollado de tal manera que hoy día representa una de las técnicas quirúrgicas de elección en la reparación de la hernia inguinal y crural. El empleo de estas prótesis supone un factor de complejidad añadido, al basarse en la colocación de un cuerpo extraño, no biológico. Con estos dos planteamientos sencillos surgen dos preguntas:
1. ¿La administración de profilaxis antibiótica permite reducir de forma significativa la incidencia de infecciones locales en este tipo de cirugía?
2. ¿La infección local de una hernioplastia con malla sintética tiene las implicaciones clínicas suficientes para justificar la administración sistemática de profilaxis antibiótica?
Incidencia de infecciones de herida en cirugía limpia
Existe cierta discrepancia en la tasa de infección de herida en la cirugía limpia entre las diferentes series. Si bien el National Research Council recomienda mantener una incidencia en torno al 2%9, cuando se realizan estudios prospectivos controlados la tasa real es mayor3,4,10-12,18 (tabla 1). Debido a que la incidencia de infecciones de herida quirúrgica en este tipo de cirugía es baja, el primer problema que se plantea es conseguir una muestra de pacientes lo suficientemente amplia que permita realizar un adecuado análisis estadístico.
Sistemas de vigilancia y detección de infección de herida
Uno de los indicadores de calidad de las unidades quirúrgicas es la medición de la tasa de infecciones de forma periódica. A pesar de que está demostrada la superior eficacia de los estudios de incidencia frente a los de prevalencia, el mayor coste, junto con la dificultad de diseño y realización de los primeros, hace que los estudios de incidencia no se realicen rutinariamente en nuestros hospitales6-26. Una segunda dificultad en la vigilancia de las infecciones quirúrgicas reside en el desarrollo cada día más generalizado de los programas de alta precoz y de cirugía mayor ambulatoria o cirugía sin ingreso. Durante los primeros 6 meses de funcionamiento de la Unidad de Cirugía Mayor Ambulatoria del Hospital Can Misses de Ibiza se realizaron 270 intervenciones, y en la actualidad aproximadamente el 70% de las hernias inguinales se realizan sin ingreso. Estos programas dificultan en cierto modo la detección de las infecciones de herida, al desarrollarse éstas mientras los pacientes se encuentran en su domicilio, lo que nos obliga a extremar los sistemas de vigilancia y seguimiento. Estudios controlados estiman en más de un 70% la proporción de complicaciones detectadas después del alta hospitalaria en la cirugía de corta estancia18.
Eficacia de la profilaxis antibiótica
Al comparar la incidencia de infecciones entre los dos grandes grupos del estudio (profilaxis antibiótica y placebo), observamos que si bien el grupo sin profilaxis presentó una mayor tasa de infecciones (2,1%) que el grupo con profilaxis (1,7%), la diferencia no fue estadísticamente significativa (p = 0,737), por lo que, en nuestra serie, la administración de profilaxis ambulatoria, no redujo la infección de la herida quirúrgica de forma significativa.
Estratificación del riesgo individual de los pacientes
Dentro de los sistemas de vigilancia de infección nosocomial se plantea la necesidad de evaluar el riesgo individual de cada paciente según su tipología (case mix), ya que la probabilidad de que un paciente desarrolle una infección varía dependiendo de diversos factores (edad, grado de severidad de la enfermedad, enfermedades asociadas) o tratamientos concomitantes (inmunodepresores). El desarrollo e implantación de sistemas de estratificación permite una comparación precisa de las tasas de IHQ entre diferentes cirujanos, servicios de un mismo hospital o diferentes hospitales. Hasta ahora han aparecido diversos índices de riesgo en la bibliografía médica6,8,10,12,35. El primer intento de estratificación fue realizado por el Study of the Efficacy of Nosocomial Infection Control (SENIC) en 19858, en el que se demostró la presencia de cuatro factores independientes de riesgo para el desarrollo de una IHQ: a) intervención en la cavidad abdominal; b) duración mayor de 2 h; c) intervenciones contaminadas o sucias, y d) presencia de 3 o más diagnósticos al alta. En 1991, el National Nosocomial Infection Surveilliance (NNIS) simplificó a tres los factores de riesgo independientes: a) ASA-III, IV; b) intervención contaminada o sucia, y c) duración de la intervención por encima del percen til 75.
En el presente estudio hemos utilizado la clasificación ASA por su facilidad de aplicación y difusión como índice de riesgo y porque se ha demostrado que, como variable independiente, tiene el mismo valor predictivo que la clasificación de la NCR sobre el tipo de intervención8.
Si bien hasta ahora las diferencias obtenidas en nuestros pacientes no ponen de manifiesto una significación estadísti ca, se puede observar una cierta tendencia según la cual la in cidencia de IHQ es mayor cuanto mayor es el ASA de los pacientes:
ASA-I (1,35%) < ASA-II (2,31%) < ASA-III (2,63%)
La subdivisión de los pacientes en tres grupos de riesgo hace necesario ampliar el tamaño del estudio para conseguir una muestra adecuada. Por otra parte, el hecho de que los pacientes ASA-III constituyan el subgrupo menos numeroso complica el tratamiento estadístico, al ser precisamente este grupo el que, al menos teóricamente, debe estar sometido a un mayor riesgo de desarrollar complicaciones. Por tanto, es preciso proseguir el trabajo en el tiempo para poder demostrar de forma concluyente la relación entre el desarrollo de una IHQ y el índice de riesgo de nuestros pacientes.
En el caso de que los resultados se mantuvieran, este gru po de mayor riesgo (ASA-III) podría ser individualizado en el sentido de precisar profilaxis antibiótica como grupo especí fico.
Infección de herida quirúrgica
Del total de los 524 pacientes, se registraron 10 infecciones (1,9%). De estos 10 casos, en 4 (40%) se desarrolló una infección local crónica en forma de sinus cutáneo del que se cultivó en la mayoría de los casos Staphylococcus aureus. En estos 4 pacientes la infección local se mantuvo durante semanas a pesar de las curas locales, sin conseguir en ninguno de ellos la curación completa, por lo que fue necesario reintervenir a los cuatro pacientes y extraer la malla. En todos los casos el cultivo de la malla demostró el mismo germen cultivado a partir del sinus cutáneo, produciéndose el cierre por segunda intención de la herida entre los 10 y 15 días después de la extracción de la malla. Este hecho se diferencia de la experiencia publicada por Gilbert et al11, en la que no fue necesario extraer la prótesis en ninguno de sus pacientes con infección de herida. El seguimiento de los pacientes a los que se les extrajo la malla ha oscilado entre los 2 años y los 6 meses, y no se ha registrado hasta el momento actual ningún caso de recidiva de la hernia.
Reflexiones sobre el aumento del coste y la estancia hospitalaria derivada de las infecciones de herida
Resulta importante conocer la repercusión que las infecciones quirúrgicas tienen en el coste global de la atención sanitaria12,24,25,34. Por tanto, es útil aplicar la relación coste/beneficio tanto para las rutinas de la práctica clínica ya existentes, como para la evaluación de los cambios que se proponen en dichas rutinas. De esta forma, son necesarias tres consideraciones relacionadas con la profilaxis antibiótica en cirugía limpia:
1. Determinar si la profilaxis antibiótica permite reducir la incidencia de infecciones, y por tanto, conocer su eficacia.
2. Conocer el gasto derivado de la propia profilaxis antibiótica.
3. Conocer el gasto que una infección de herida supone en nuestro medio.
Las estimaciones económicas realizadas sobre infecciones de heridas en pacientes operados por hernia inguinal concluyen que la infección de herida supone un gasto adicional entre un 20 y un 40%12 y la estancia hospitalaria aumenta entre 7 y 11 días34,35.
No hemos podido demostrar en nuestro estudio una disminución de la incidencia de infección de herida mediante la administración de profilaxis antibiótica, por lo que ésta podría evitarse en un gran número de procedimientos quirúrgicos, al ser la hernia inguinal uno de las intervenciones más frecuentes dentro de la cirugía programada.
Relación de la infección de herida con otras variables
Este trabajo se completa con el análisis comparativo de distintas variables en relación con la infección de la herida. Hasta el momento actual, no hemos podido demostrar ninguna diferencia significativa con la edad, duración de la cirugía, diabetes y tipo de hernia, a diferencia de otros estudios que demuestran una mayor tasa de infecciones de herida en los pacientes de mayor edad y pacientes con hernias recidivadas16.
Complicaciones locales
Las únicas variables que demostraron una diferencia significativa cuando se relacionaron con la infección de herida fueron la presencia de seromas y de hematomas. En 11 pacientes (2,1%) se desarrolló un seroma en el postoperatorio inmediato. En 7 de estos pacientes con seroma se detectó, pocos días después, una infección de herida con significación estadística (p < 0,0001). Del mismo modo, 14 pacientes presentaron un hematoma inguinoscrotal (2,7%), de los cuales en 2 casos se desarrolló posteriormente una infección en la herida (nivel de significación, p < 0,0001). De los 14 pacientes con hematoma, en 4 casos fue necesario el drenaje quirúrgico por ser hematomas expansivos o por provocar intenso dolor al paciente. Llama la atención que en ninguno de estos 4 casos reintervenidos de urgencia se desarrollara ninguna infección de herida, a pesar del riesgo añadido que supone una reintervención en presencia de un cuerpo extraño.
Conclusiones
1. Hasta este momento, no hemos podido demostrar una reducción estadísticamente significativa del número de infecciones de la herida mediante la administración de profilaxis antibiótica, en la reparación de una hernia inguinal con colocación de una malla sintética de polipropileno.
2. Basados en estos datos, la profilaxis antibiótica podría evitarse en un gran número de pacientes operados en nuestro país, al ser la hernia inguinal uno de los procedimientos más frecuentes dentro de la cirugía programada, lo que permitiría una disminución del gasto farmacéutico.
3. Los pacientes con mayor riesgo (ASA-III) parecen tener una mayor incidencia de infección de herida quirúrgica, si bien el número de pacientes ASA-III es demasiado reducido en nuestra serie para demostrar como grupo independiente una diferencia estadísticamente significativa.
4. Estos resultados sugieren la necesidad de estratificar a los pacientes de acuerdo con su índice de riesgo.