Una manifestación temprana de las enfermedades cardiovasculares es la disfunción endotelial, asociada a un entorno oxidativo e inflamatorio. En este trabajo se propone que, incluso durante un envejecimiento sano, en ausencia de enfermedades cardiovasculares, la capacidad vasodilatadora de las arterias humanas se reduce, ya que se ponen en marcha procesos oxidativos e inflamatorios en la pared vascular que alteran sus funciones fisiológicas y aumentan su fragilidad frente a las agresiones externas.
Endothelial dysfunction, associated with an oxidative and inflammatory environment, is an early finding in cardiovascular diseases. In this communication, we propose that even during healthy aging, in the absence of cardiovascular diseases, the vasodilator ability of human arteries is reduced due to the development of several oxidative and inflammatory processes in the vascular wall that alter its physiological functions and increase its susceptibility to external injuries.
La incidencia y prevalencia de enfermedades cardiovasculares se incrementa con la edad, hasta el extremo de que se ha identificado como un factor de riesgo dominante en este tipo de patologías1,2. Aunque la disfunción endotelial es un suceso clave en el desarrollo de estas enfermedades, nuestro conocimiento de los mecanismos subyacentes se limita en gran medida a los modelos animales1,3,4. De hecho, se ha considerado casi imposible determinar estos mecanismos en humanos, ya que se requiere la obtención de vasos aislados de un gran número de sujetos4. Actualmente se acepta que el endotelio vascular es una delgada capa de células que tapiza la cara interior de las arterias y tiene un papel fundamental en la regulación de la circulación sanguínea. Entre otras cosas, es capaz de secretar sustancias, como el óxido nítrico (NO) y la prostaciclina, que actúan sobre la pared vascular subyacente y producen vasodilatación, manteniendo los vasos en buen estado y con una adecuada presión arterial.
Deterioro de la función endotelial asociada al envejecimientoEn modelos animales hay evidencia demostrada de la presencia de disfunción endotelial asociada al envejecimiento3–8. En humanos, también se ha descrito una disfunción endotelial relacionada con la edad en estudios in vivo9–13, aunque los posibles mecanismos implicados han sido escasamente investigados hasta ahora. Recientemente, nuestro grupo ha analizado la capacidad vasodilatadora dependiente del endotelio vascular en sujetos de entre 18 y 91 años sin enfermedad cardiovascular conocida ni factores de riesgo asociados (tabaquismo, diabetes, obesidad, hipercolesterolemia, etc.). El estudio se ha realizado tanto in vivo en sujetos conscientes (mediante una técnica denominada pletismografía del antebrazo) como in vitro (obteniendo microvasos mesentéricos humanos de pacientes sometidos a cirugía abdominal). En los microvasos aislados, además, se analizaron los factores pro-oxidantes y pro-inflamatorios implicados14.
Confirmando datos anteriores, en este trabajo se ha demostrado una disminución asociada al envejecimiento de las respuestas vasodilatadoras dependientes del endotelio vascular. Así, la combinación de las dos aproximaciones experimentales utilizadas (in vivo e in vitro) en una importante muestra de sujetos con un amplio rango de edad y carentes de enfermedad cardiovascular conocida o factores de riesgo clásicos, demostró la existencia de un deterioro específico de la función endotelial dependiente de la edad, de acuerdo a lo previamente publicado en pacientes in vivo9–13. Una aportación interesante y novedosa fue que la disfunción endotelial observada fue muy parecida con ambas aproximaciones experimentales, in vivo e in vitro, aunque la relajación endotelio-dependiente en vasos aislados se indujo con bradicinina (BK), mientras que la observada en los estudios de pletismografía se provocó con acetilcolina (ACh). Esto tiene considerable relevancia, ya que nos permite postular que los mecanismos hallados en los estudios in vitro son aplicables previsiblemente a los datos in vivo.
Por otro lado, cabe destacar que, en nuestra aproximación in vitro con BK, los vasos se pre-contrajeron con un estímulo despolarizante (35 mmol/l de cloruro potásico [KCl]), lo que eliminaba la participación del factor endotelial hiperpolarizante en la relajación inducida por BK, descrita por algunos autores15. Aun así, la respuesta vasodilatadora y su deterioro con la edad observado in vitro con BK fueron análogos a los obtenidos con ACh in vivo, lo que sugiere que el papel del factor hiperpolarizante en estos vasos es probablemente limitado. En este sentido, y confirmando datos anteriores de nuestro laboratorio16, se observó que el componente fundamental de la relajación inducida por BK in vitro era el NO que, en el caso de sujetos menores de 60 años, estaba acompañado de un pequeño componente vasodilatador sensible al bloqueo por indometacina, lo que sugería un papel vasodilatador secundario para un derivado de la ciclooxigenasa14.
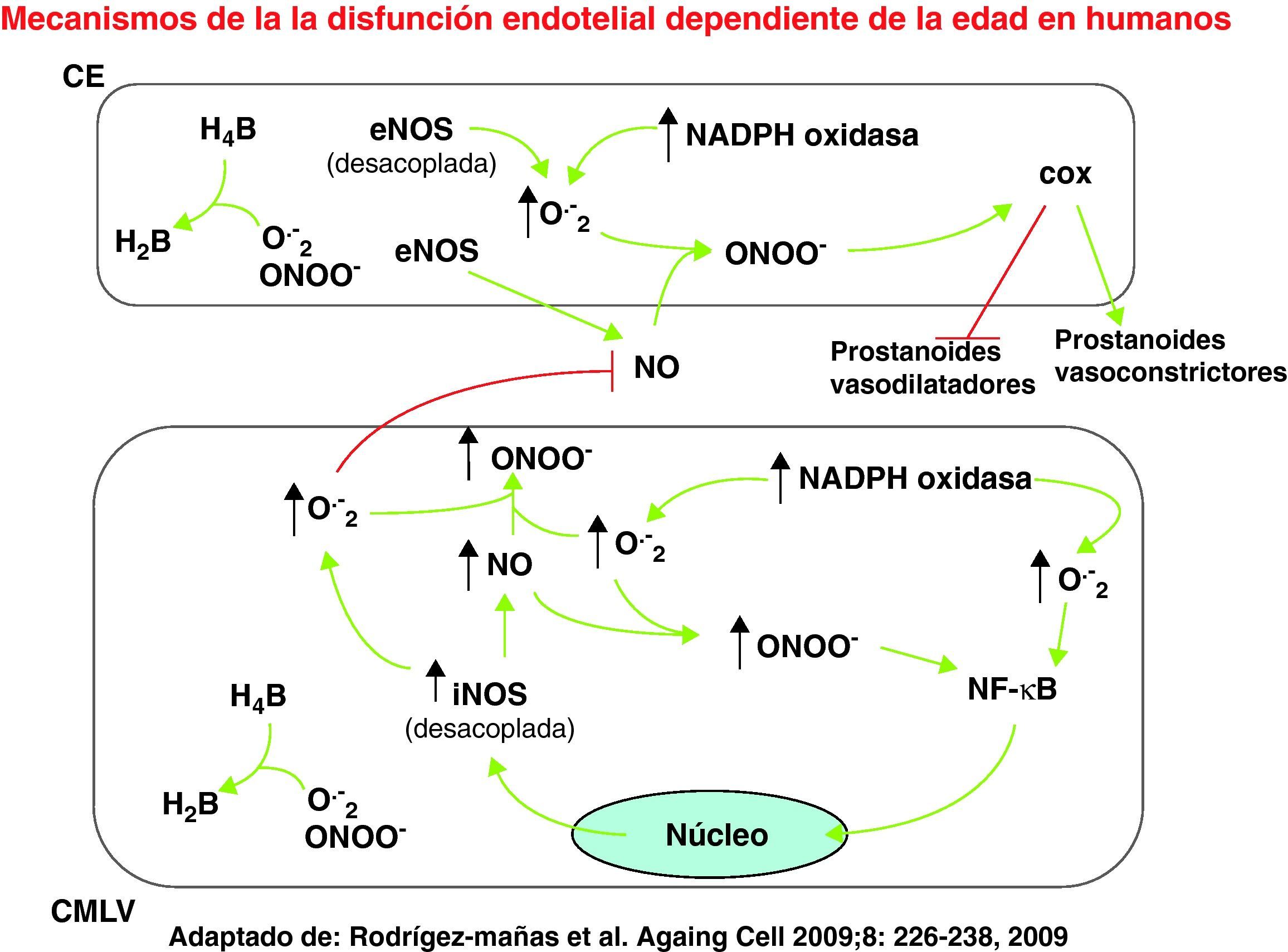
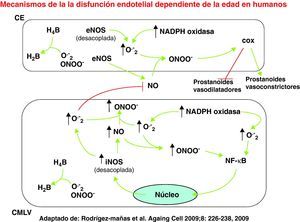
Por el contrario, las respuestas en vasos de sujetos mayores de 60 años fueron claramente distintas. De manera interesante, la vía del NO parecía bien conservada en estos vasos, de modo que el único factor vasodilatador producido por el endotelio en vasos envejecidos era el NO. Por tanto, la disfunción endotelial no es necesariamente debida a una reducción en la síntesis de NO, como sugieren otros autores17. Por otro lado, tras bloquear la síntesis de NO se abolió toda respuesta vasodilatadora a BK, apareciendo en su lugar una respuesta vasoconstrictora mediada por el endotelio y dependiente de la ciclooxigenasa (COX). En base a estos resultados, hemos postulado que el endotelio vascular envejecido es todavía capaz de producir suficiente NO para alcanzar una completa relajación del músculo liso vascular subyacente. Sin embargo, este NO es contrarrestado por un compuesto vasoconstrictor derivado del endotelio y producido por COX, así como por especies reactivas de oxígeno, preferentemente aniones superóxido (O–2), también producidos por las células endoteliales14.
Mecanismos inflamatorios implicados en la disfunción endotelial asociada al envejecimiento humanoPapel de la COXLa existencia de un factor vasoconstrictor endotelial asociado a la edad se ha propuesto con anterioridad en base a evidencias indirectas13,18, pero nuestro laboratorio ha sido el primero en demostrarlo directamente en vasos humanos14. La naturaleza de este factor no se ha dilucidado todavía, pero desaparece en presencia de bloqueantes para los receptores de tromboxano/prostaglandina H2. Tampoco es descartable un papel para los O–2, ya que esas especies reactivas de oxígeno se han descrito como mediadores de la vasoconstricción endotelial dependiente de la COX18.
No existe consenso sobre la isoforma de la COX implicada en la producción de factores vasoconstrictores endoteliales8. Tampoco nosotros hemos podido esclarecer este punto, ya que no se observaron diferencias en los niveles de ARN mensajero (ARNm) para las dos isoformas conocidas de la enzima COX-1 y COX-214. Sin embargo, existen mecanismos post-transcripcionales que pueden modular la actividad de esta enzima. En este sentido, se ha descrito que la actividad de COX puede estar regulada por distintos compuestos, como NO y peroxinitrito (ONOO–)19. Además, se conoce una interacción fisiológica entre COX-2 e iNOS (la isoforma inducible de la NO sintasa), que lleva al NO o al ONOO– a activar la COX-2, en una interacción molecular sinérgica que interconecta dos enzimas inflamatorias como son COX-2 e iNOS20.
Papel del estrés oxidativo y nitrosativoEs conocido el papel del estrés oxidativo en la disfunción endotelial asociada a la edad10,12. Recientemente, Donato et al21 han encontrado una relación entre marcadores de oxidación en células endoteliales y vasodilatación. Se acepta que el estrés oxidativo, principalmente los O–2, reducen la disponibilidad de NO e inhiben su diana principal, la guanilato ciclasa soluble. Nuestro grupo ha podido visualizar la presencia de niveles aumentados de O–2 en microvasos mesentéricos humanos procedentes de sujetos mayores de 60 años, mediante la sonda fluorescente dihidroetidio. Además, el papel funcional de los O–2 se ha comprobado mediante compuestos barredores de los mismos, como tempol o superóxido dismutasa, capaces de mejorar la disfunción endotelial asociada a la edad14.
La generación de ONOO– emerge cada vez más como un mecanismo determinante en la producción de daño oxidativo en la pared vascular22,23. También se han encontrado marcadores biológicos de este compuesto en microvasos mesentéricos de sujetos mayores de 60 años, como el incremento de los residuos de nitrotirosina14, lo que indica una mayor producción de ONOO– vascular, análogo al descrito previamente en ratas22,23. El papel funcional del ONOO– como mediador de la disfunción endotelial asociada a la edad se ha confirmado con un agente barredor de ONOO– (ácido úrico), que mejora la relajación inducida por BK tanto como el antioxidante tempol14.
La formación de ONOO– requiere la interacción química de O–2 y NO con una estequiometría de uno a uno24,25. La producción de ONOO– depende de la concentración disponible de NO, que a su vez está en relación con la actividad de la sintasa de NO (NOS). Aunque la cantidad de tejido disponible sea muy pequeña, es posible investigar la expresión de ARNm para las isoformas constitutiva e inducible de la sintasa de NO (eNOS e iNOS, respectivamente) en la pared vascular de microvasos mesentéricos procedentes de sujetos menores y mayores de 60 años. Datos previos en rata sugieren un aumento de la iNOS vascular dependiente de la edad23,26, mientras que los datos sobre la expresión de eNOS son controvertidos4,22,27. En nuestro laboratorio se ha observado que la expresión de ARNm para eNOS no se modifica con la edad, mientras que la isoforma iNOS se incrementa significativamente en la pared vascular de los sujetos mayores de 60 años14. La mejoría de la disfunción endotelial asociada a la edad producida por un inhibidor específico de la iNOS (1.400W) sugiere además de forma clara que la iNOS es la fuente principal de NO para formar ONOO– en la pared de los vasos envejecidos. Aunque existe algún dato previo en cultivos de mesotelio humano27, ésta ha sido la primera demostración en la pared vascular humana de la implicación de la isoforma inflamatoria iNOS en la disfunción endotelial asociada a la edad14.
Respecto del origen de los O–2 detectados en la pared vascular, se ha obtenido evidencia de la posible participación del complejo enzimático NADPH oxidasa. Así, el ARNm de la isoforma nox-4 de la NADPH oxidasa, cuya expresión ha sido demostrada en la pared vascular humana28, está incrementado en microvasos mesentéricos de sujetos mayores de 60 años, mientras que el inhibidor de esta enzima apocinina mejora la disfunción endotelial asociada a la edad14. Por el contrario, no hay evidencia alguna que apoye el papel de la enzima xantinooxidasa como fuente de O–2, lo que sugiere que la fuente principal de estrés oxidativo en el envejecimiento vascular no patológico es la NADPH oxidasa, de acuerdo a lo indicado por otros autores21,29.
Otra posible fuente de O–2 en el envejecimiento vascular puede ser el desacoplamiento de la NOS4,25,30. Se sabe que el ONOO– desacopla la isoforma endotelial de la NOS31, que también puede producirse por una disminución de la biodisponiblidad del cofactor tetrahidrobiopterina (BH4), como consecuencia de su oxidación a BH2 por O–2 o ONOO–32,33. Así, algunos datos en humanos indican que la administración del cofactor de NOS BH4 mejora claramente la disfunción endotelial asociada a la edad medida por técnicas pletismográficas in vivo34. En nuestro modelo de microvasos mesentéricos humanos aislados se ha observado un efecto similar, ya que la administración de BH4 mejora la disfunción endotelial asociada a la edad de manera similar a la observada en presencia de agentes barredores de O–214. Aunque muchos trabajos mencionan la eNOS como la principal isoforma de NOS desacoplada capaz de producir O–24, la isoforma inflamatoria inducible iNOS es mucho más activa catalíticamente, consumiendo cantidades mayores de sustrato y cofactores, por lo que puede constituir una importante fuente de O–2 en situaciones de carencia de sustrato o de BH435.
Inflamación vascular y disfunción endotelial asociada a la edadHay cada vez más evidencia obtenida en modelos experimentales de que el envejecimiento vascular está asociado a procesos de inflamación vascular36–38. En humanos, existen datos epidemiológicos que sugieren una asociación entre citocinas inflamatorias circulantes y mortalidad en sujetos ancianos39,40. Más recientemente, Wang et al41 han descrito un perfil pro-inflamatorio en la pared aórtica de sujetos sin engrosamiento patológico. Por su parte, Donato et al21 han observado en células endoteliales una regulación al alza del factor de transcripción nuclear κB (NF-κB), fuertemente implicado en los fenómenos inflamatorios, que parece asociarse con la disfunción endotelial. Nuestro laboratorio ha descrito asimismo un aumento de la expresión y actividad de NF-κB con la edad en células mesoteliales peritoneales humanas en cultivo, en ausencia de estímulos inflamatorios27. En microvasos mesentéricos humanos, hemos utilizado técnicas histoquímicas de Southwestern42 para demostrar de modo directo in situ la activación de NF-κB en función de la edad14. Además, hemos encontrado una correlación significativa entre la edad y el número de células vasculares con activación nuclear de NF-κB, lo que sugiere claramente un entorno inflamatorio en la pared vascular de los sujetos envejecidos. También se ha encontrado una clara correlación entre la presencia de disfunción endotelial asociada a la edad y la activación de NF-κB in situ. Hasta lo que sabemos, ésta es la primera demostración en la pared vascular humana de una relación entre la disfunción endotelial dependiente de la edad y el desarrollo de un entorno pro-inflamatorio en la pared vascular14.
ConclusionesEn base a los datos expuestos, nuestro grupo propone que la disfunción endotelial asociada a la edad es un proceso complejo que implica mediadores pro-oxidantes y pro-inflamatorios. Desgraciadamente, un estudio de esta naturaleza no permite establecer relaciones de causalidad entre estos mediadores o mostrar cuál de ellos precede al otro. Tampoco se puede descartar la existencia de relaciones bidireccionales entre factores pro-oxidantes y pro-inflamatorios (fig. 1). Por una parte, se ha propuesto que un entorno pro-inflamatorio puede ser una típica característica del envejecimiento vascular humano en ausencia de riesgo cardiovascular añadido43. En este sentido, el aumento del estrés oxidativo y de la inflamación en la pared vascular, junto con la disfunción endotelial, podría ser consecuencia de la senescencia de las células vasculares, con alteraciones indistinguibles de las observadas en fases tempranas de la aterosclerosis. No obstante, también puede ocurrir lo contrario, es decir, que el estrés oxidativo, la inflamación y la disfunción endotelial sean la causa, antes que la consecuencia, de la senescencia celular vascular y de la aterosclerosis44. Es importante recordar que todos nuestros datos se han obtenido en vasos de sujetos mayores, pero que en ningún caso tenían evidencia clínica de enfermedad cardiovascular. Eso indica que, incluso durante un envejecimiento sano desde el punto de vista cardiovascular, se genera un ambiente oxidante y pro-inflamatorio que incrementa la fragilidad vascular y facilita el desarrollo de la enfermedad vascular clínica frente a factores de riesgo cardiovascular.
En las células endoteliales (CE), los aniones superóxido (O2–), generados por la NADPH oxidasa o el desacoplamiento de la sintasa de óxido nítrico endotelial (eNOS), producen peroxinitrito (ONOO–) al combinarse con el óxido nítrico (NO). El ONOO– generado puede modular la actividad de la ciclooxigenasa (COX) endotelial favoreciendo la síntesis de prostanoides vasoconstrictores en detrimento de los prostanoides vasodilatadores. En la célula de músculo liso vascular (CMLV) se produce O2– como resultado de la actividad NADPH oxidasa o del desacoplamiento de la sintasa de óxido nítrico inducible (iNOS). De nuevo, la combinación de O2– con NO produce ONOO–, capaz de activar al factor de transcripción nuclear κB (NF-κB), que juega un papel esencial en los fenómenos de inflamación celular.