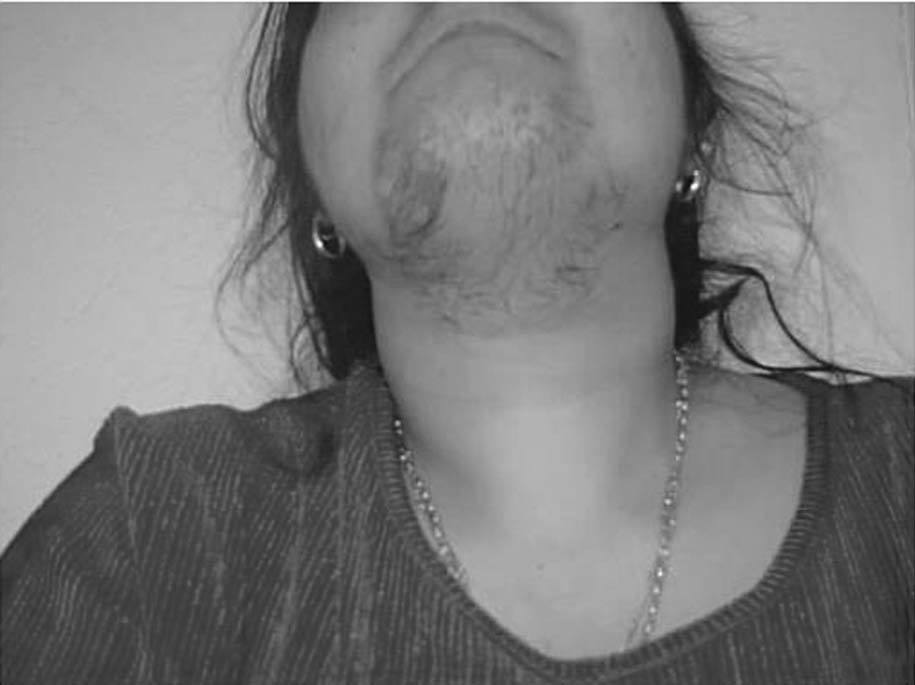
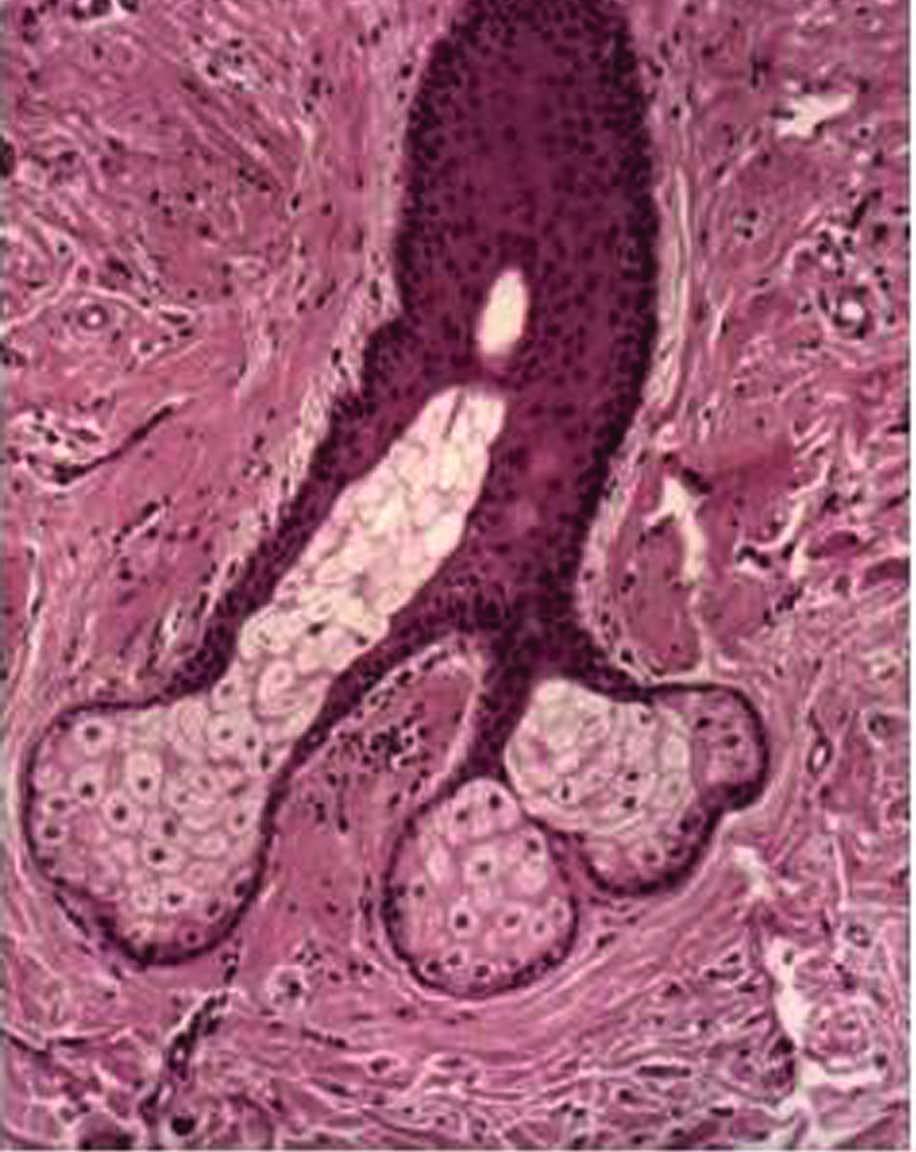
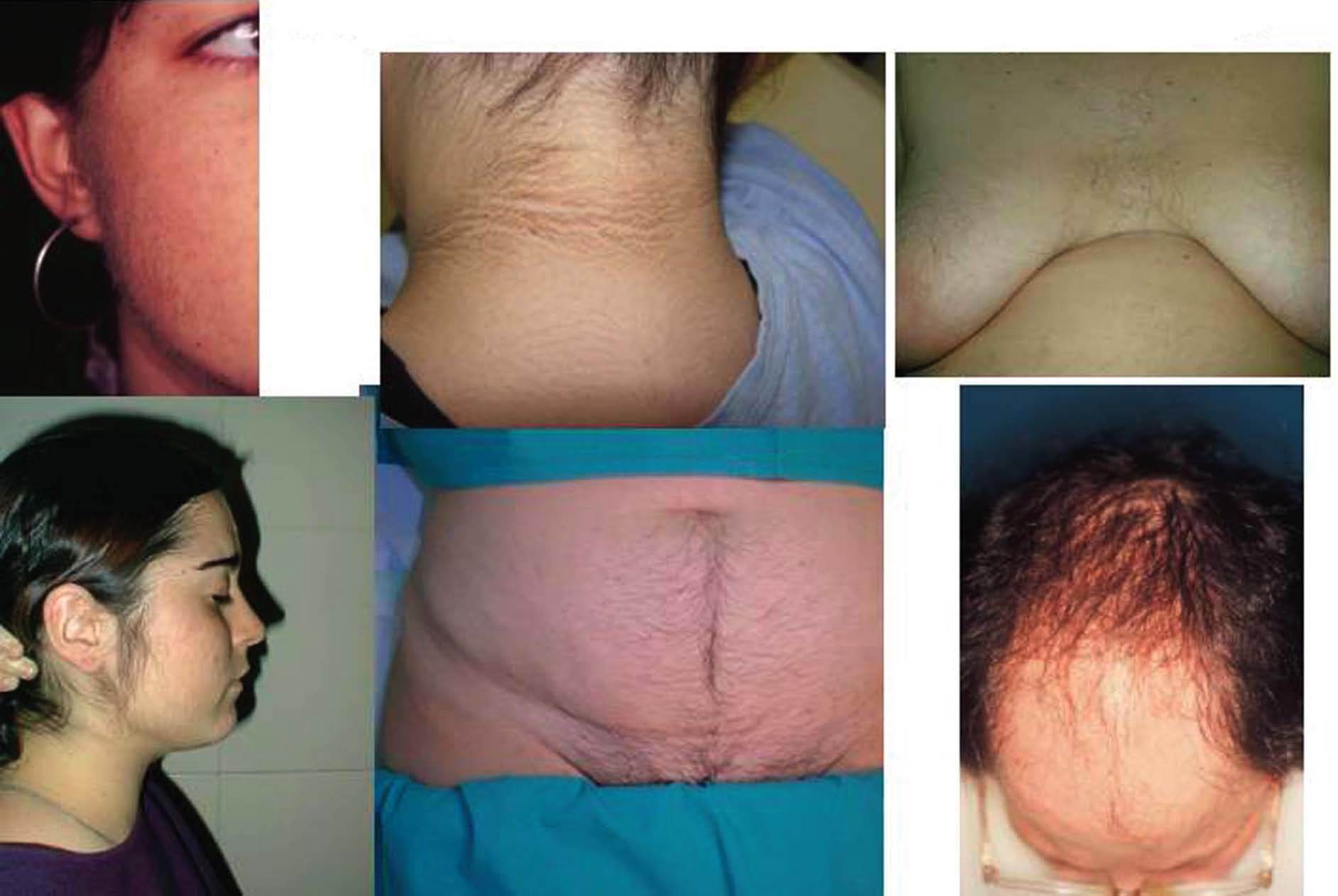
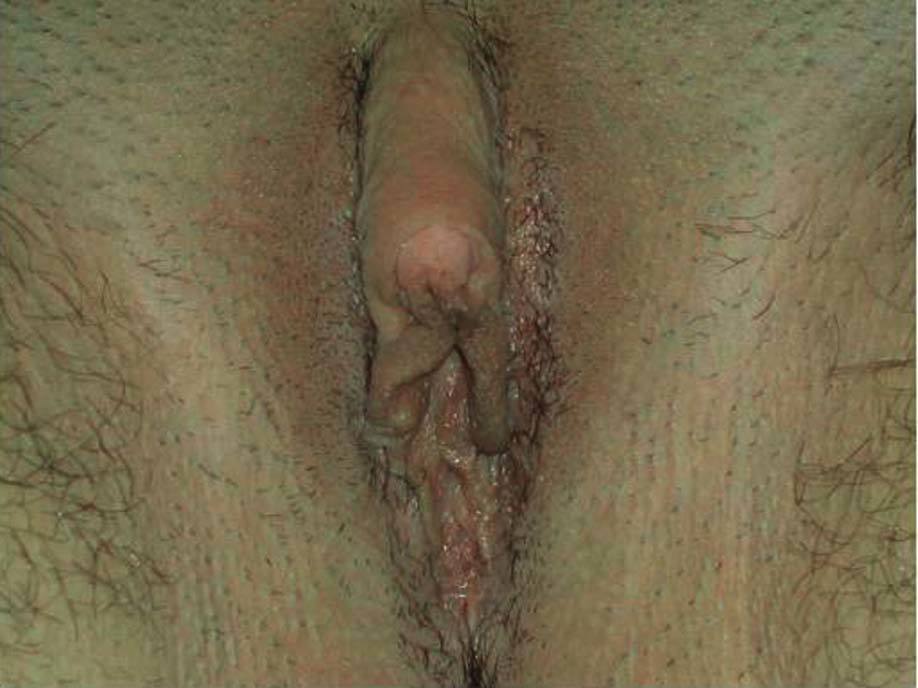
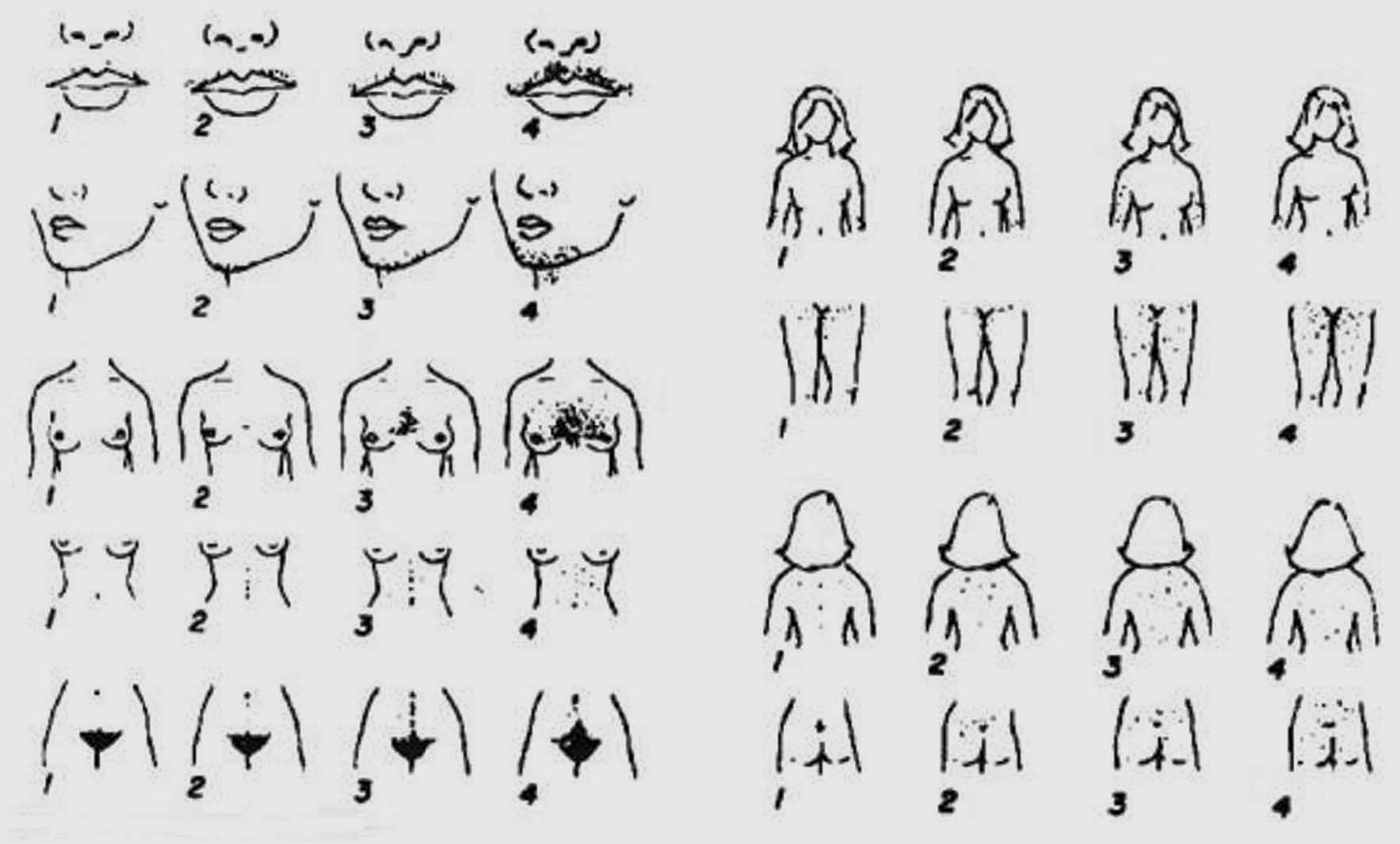
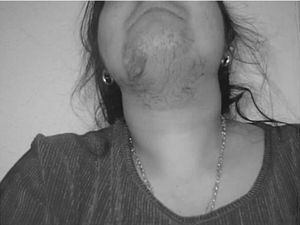
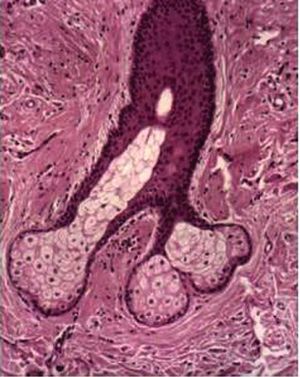
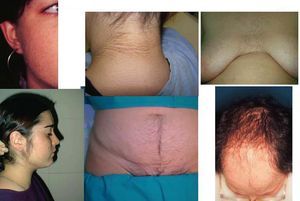
Fig. 1. Hirsutismo.
INTRODUCCION: DEFINICION Y ASPECTOS CONCEPTUALES
Los estados hiperandrogénicos son un conjunto de cuadros clínicos caracterizados por un exceso en la producción de andrógenos, con consecuencias clínicas no deseables. Puesto que se trata de esteroides normales en la mujer, la definición de su exceso se establece de acuerdo con criterios tanto sociales como clínicos o bioquímicos. Las consultas por hirsutismo, por ejemplo, responden a situaciones muy diferenciadas, donde, en ocasiones, no llega a objetivarse ningún signo clínicamente evidente. En nuestra sociedad, en cualquier caso, la aparición de vello en mejillas, aréolas mamarias o línea media abdominal suele considerarse anormal y no deseable. Esta situación se extiende al vello del labio superior o un exceso de él en los brazos. Otro signo dependiente de la producción androgénica y con semejante repercusión clínica es el acné.
Con estos límites relativistas, se ha distinguido tres niveles conceptuales: hirsutismo, hipertricosis y virilismo. Los dos primeros hacen énfasis en la producción de pelo. Signos como el acné o la acantosis nigricans quedan fuera del cuadro clínico englobado por cualquiera de los tres.
El hirsutismo, que afecta hasta un 15% de las mujeres, es el crecimiento excesivo de pelo terminal en las zonas andrógeno-dependientes en la mujer (fig. 1). Tiene origen en una actividad excesiva en la unidad pilosebácea como consecuencia de un exceso androgénico o de un aumento de la sensibilidad del folículo a los andrógenos1.
Debe diferenciarse de la hipertricosis que consiste en el crecimiento uniforme de pelo suave y delgado (no terminal) en toda la superficie corporal (fig. 2). No es producido por un exceso androgénico, sino que se asocia a circunstancias como anorexia nerviosa, hipotiroidismo, tratamientos con fenitoína, ciclosporina o minoxidilo.
Fig. 2. Hipertricosis.
El hirsutismo puede acompañarse de otras manifestaciones clínicas asociadas al hiperandrogenismo, que incluyen otros signos cutáneos como acné, alopecia y acantosis nigricans, alteraciones del ciclo menstrual en forma de oligoamenorrea o amenorrea y anovulación, alteraciones metabólicas como aumento generalizado de la grasa y su distribución centrípeta (que se relaciona con el síndrome X: dislipemias, diabetes y enfermedades cardiovasculares) (fig. 3).
Fig. 3. Hiperandrogenismo.
La exposición a concentraciones de andrógenos muy altas induce a la aparición de virilización: clitoromegalia (fig. 4), alopecia parietooccipital, voz grave, hipotrofia mamaria, cambio en la tonalidad de la voz y aumento de la masa muscular.
Fig. 4. Virilización.
El hirsutismo es un signo clínico que no tan sólo puede reflejar una enfermedad endocrinológica subyacente, sino que también representa un problema estético de gran trascendencia para las pacientes afectadas.
BASES FISIOLÓGICAS
En el estudio del hirsutismo debemos considerar los dos determinantes: el folículo piloso y el ambiente hormonal.
El folículo pilosebáceo es el sistema de anclaje del pelo, determina sus características y controla su crecimiento. En el adulto, se puede diferenciar tres tipos de folículos pilosebáceos: los «vellosos», de profundidad y diámetro reducido; los intermedios, de mayor profundidad y con pelo más pigmentado, y los folículos terminales, con pelo más grueso y pigmentado, localizados en el cuero cabelludo, las axilas y el pubis en ambos sexos y en la cara y el tórax de los varones. El ciclo de crecimiento del pelo presenta tres fases diferenciadas: anágeno o fase de crecimiento activo, catágeno o fase de involución rápida y, finalmente, la fase de telógeno o fase de inactividad.
La producción de andrógenos en la mujer tiene lugar en el ovario, en la capa reticular de la suprarrenal y en tejidos no endocrinos (tabla I). Para expresar su actividad biológica en las células diana, la testosterona precisa su transformación a dihidrotestosterona por la enzima 5 alfa-reductasa. Su producción es 25% suprarrenal, 25% ovárica y 50% periférica. La androstendiona puede transformarse a testosterona, estrona y a estradiol a partir de éstos. Su origen es 50% suprarrenal y 50% ovárico en fase folicular y 70% ovárico en fase periovulatoria. La deshidroepiandrosterona (DHEA) y su sulfato (DHEAS) son de producción fundamentalmente suprarrenal.
El transporte de los andrógenos a través de la circulación tiene lugar en forma de unión reversible a determinadas proteínas plasmáticas (albúmina y sex steroid hormone-binding globulin [SHBG]). La concentración plasmática de SHBG, principal determinante de la biodisponibilidad de la testosterona, fluctúa dependiendo de varios factores: aumenta en las situaciones de hiperestrogenismo como la fase lútea, el embarazo o tras la administración exógena de estrógenos y en las dietas ricas en hidratos de carbono, mientras que disminuye con la elevación plasmática de los andrógenos, insulina, prolactina, cortisol, somatotropina (GH) y en el hipotiroidismo, en situaciones de hipoestronismo, en la obesidad, tras tratamiento con corticoides, danazol, progestágenos y con el factor de crecimiento semejante a la insulina. La testosterona circula unida a la SHBG en un 80%, a la albúmina en un 20% y presenta una fracción libre del 1%. La androstenodiona, por otro lado, circula unida a SHBG solamente en un 4%.
Para llevar a cabo su acción en la célula diana, el andrógeno se une a receptores intracitoplasmáticos o nucleares activándolos e induciendo un cambio estructural de ellos. A seguir, el complejo ligando-receptor se une a los elementos reguladores de respuesta de los genes y se desencadena la transcripción del ADN. El metabolismo de los andrógenos tiene lugar en el hígado y se excretan por la orina, principalmente en forma de 3-alfa androstenodiol y su glucurónido.
ETIOPATOGENIA DEL HIPERANDROGENISMO
Un aumento en la producción de andrógenos en la mujer, así como una disminución de sus transportadores (fundamentalmente SHBG), una disminución de su metabolismo que tiene lugar en el hígado o una reducción de su excreción (en orina) pueden dar lugar a un aumento de la concentración de éstos que ocasionen clínica ligada al hiperandrogenismo como hirsutismo, acné o seborrea. Según el origen del exceso de secreción diferenciamos:
Hiperandrogenismo ovárico funcional. Es el exceso androgénico producido por los ovarios. Su causa más frecuente es el síndrome de ovarios poliquísticos (SOP) que se caracteriza en su forma completa por signos de hiperandrogenismo como hirsutismo, alteraciones menstruales, anovulación con consiguiente esterilidad, obesidad, elevación de lutropina (LH) sérica (o de la relación LH/folitropina [FSH]) y elevación de las concentraciones de andrógenos circulantes (testosterona libre, testosterona total, andostenodiona, DHEA y DHEAS), ecoestructura ovárica caracterizada por múltiples folículos antrales de tamaño reducido y resistencia a la insulina e hiperinsulinemia. No obstante, esta entidad engloba un grupo heterogéneo de pacientes con clínica, analítica y ecografía totalmente variables, incluso se ha demostrado hiperproducción androgénica suprarrenal en algunas pacientes2,3. Aparte de estos trastornos funcionales, la presencia de un tumor ovárico también puede ser una fuente productora de andrógenos.
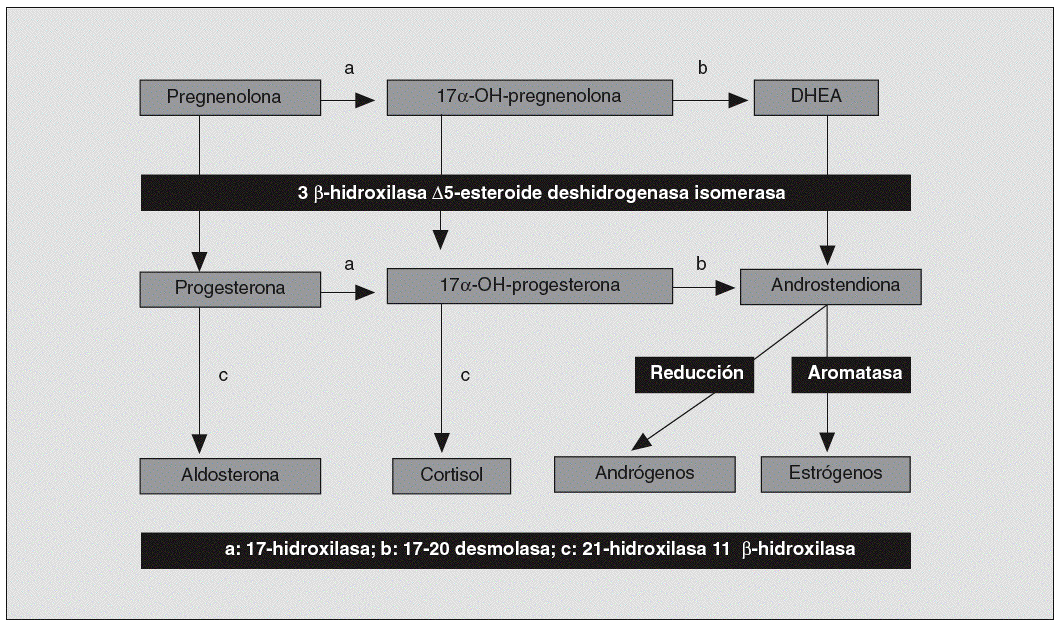
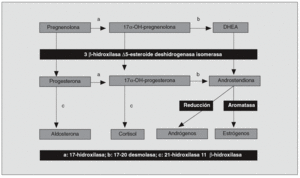
Hiperandrogenismo suprarrenal (fig. 5). Representa entre el 12 y el 42% de los hiperandrogenismos en la mujer; la hiperplasia suprarrenal congénita en su forma de presentación tardía (déficit de 21-hidroxilasa) es su causa más frecuente. Otras alteraciones enzimáticas que desencadenan hiperproducción androgénica son las disfunciones de la 17-alfa-hidroxilasa, la 17-20 liasa o la 3-beta-hidroxiesteroide deshidrogenasa4. Los tumores suprarrenales también pueden ser causa de hiperandrogenismo.
Fig. 5. Esteroidogénesis. DHEA: deshidroepiandrosterona.
Hiperandrogenismo insulínico. La resistencia insulínica y la hiperinsulinemia consiguiente conducen a una hiperproducción de andrógenos por el ovario, así como a una reducción de las concentraciones de SHBG. Incluye síndrome HAIRAN (hiperandrogenismo, resistencia insulínica y acantosis nigricans), resistencia insulínica tipo A de Kahn y resistencia insulínica tipo B.
Hiperandrogenismo gestacional. Forma rara, generalmente debida a la presencia de luteomas o quistes tecaluteínicos en el ovario.
Hiperandrogenismo funcional/idiopático. Representa entre un 5 y un 15% de los casos de hirsutismo. Engloba los casos no clasificables en los anteriores apartados y en los que no se ha demostrado una hiperproducción de andrógenos por la suprarrenal o el ovario, aunque pruebas de estimulación con análogos de la gonadoliberina (Gn-RH) o corticotropina (ACTH) han demostrado cierto grado de anomalía funcional ovárica o suprarrenal como origen del hiperandrogenismo.
Por otro lado, también se han descrito casos de pacientes con clínica de hiperandrogenismo y concentraciones de andrógenos circulantes normales. En estas pacientes se ha evidenciado un aumento de la actividad de la enzima 5-alfa-reductasa (transforma testosterona en dihidrotestosterona, que es la que tiene actividad biológica sobre el folículo piloso).
IMPLICACIONES CLINICAS
Alteraciones del ciclo menstrual y de la fertilidad. Alrededor de un tercio de las pacientes hiperandrogénicas presentarán algún tipo de alteraciones del ciclo menstrual generalmente secundarias a un estado de anovulación crónica; las afecciones más frecuentes son la oligomenorrea o la amenorrea secundaria.
La oligomenorrea se asocia habitualmente a otras manifestaciones severas del hiperandrogenismo, como el hirsutismo y la obesidad, pero no es imprescindible su presencia para establecer el diagnóstico de sospecha de un hiperandrogenismo ni de un síndrome de los ovarios poliquísticos. La amenorrea suele presentarse en los estados hiperandrogénicos de origen tumoral, o cuando hay una exposición prolongada a concentraciones elevadas de andrógenos, aunque su existencia no debe excluir la búsqueda de otras causas distintas del hiperandrogenismo.
La esterilidad, cuando aparece en pacientes con hiperandrogenismo, está causada secundariamente por la anovulación, aunque muchas de estas pacientes presentan, de forma habitual o episódica, ovulaciones, por lo que pueden conseguir una gestación sin la mediación de tratamientos específicos.
Modificaciones de la apariencia externa. Las alteraciones en la piel son las más características y a la vez las más frecuentes de los estados hiperandrogénicos. Los cambios ocurren de una manera secuencial y progresiva. La seborrea se produce inmediatamente después de la elevación de los andrógenos, consecuentemente el acné es la primera manifestación cutánea y aparece poco después de la menarquia en las niñas con hiperandrogenismo. El hirsutismo requiere la transformación de vello en pelo terminal, más oscuro, más rígido y más grueso. Este proceso requiere más tiempo y aparece alrededor de los 20 años. Finalmente, la alopecia es poco frecuente antes de los 30 años.
La acantosis nigricans es una lesión hiperpigmentada e hiperqueratósica de la piel, que le da un aspecto aterciopelado, y que aparece en la parte posterior del cuello y en zonas de flexuras, como las axilas. Se suele presentar en pacientes hiperandrogénicas muy obesas y su presencia tiene relación con la resistencia a la insulina y con la diabetes.
Alteraciones metabólicas. Las pacientes hiperandrogénicas cuando presentan obesidad, más que un aumento generalizado de la grasa, muestran una anomalía en su distribución, que se acumula en la mitad superior del cuerpo. Se trata, pues, de una obesidad androide, troncular o centrípeta.
Implicaciones sistémicas. La asociación en numerosos casos de hiperandrogenismo con hiperinsulinemia y resistencia a la insulina, hiperlipoproteinemia (especialmente hipertrigliceridemia, hipercolesterinemia, elevación de lipoproteínas de baja densidad [LDL] y disminución de lipoproteínas de alta densidad [HDL]), obesidad central e hipertensión arterial induce un importante incremento del riesgo de desarrollar enfermedades cardiovasculares secundarias a la aparición frecuente y precoz de arteriosclerosis en estas pacientes.
Diferentes estudios epidemiológicos sugieren que las mujeres con hiperandrogenismo presentan un incremento del riesgo de desarrollar enfermedad endometrial, incluido el adenocarcinoma del endometrio, lo que se explica fácilmente por la coexistencia de factores de riesgo de esta neoplasia como son la anovulación crónica, el hiperinsulinismo, la obesidad y la hipertensión. Finalmente, aunque sin evidencias consistentes, también algunos han relacionado los estados hiperandrogénicos con un incremento del riesgo de cáncer de mama.
DIAGNÓSTICO DEL HIRSUTISMO
El diagnóstico debe orientarse a descartar procesos con tratamiento específico y, en las restantes pacientes, detectar la fuente de andrógenos y evaluar la intensidad de la clínica.
Anamnesis. Ante una paciente que nos consulta por presentar uno o varios signos y/o síntomas relacionados con el hiperandrogenismo es importante, en primer lugar, recoger los antecedentes personales y la historia menstrual. La anamnesis puede orientarnos sobre el origen neoplásico del proceso. Así, la existencia de un tumor será poco probable cuando la androgenización fue prepuberal, en ausencia de cambios de la voz, cuando la progresión del cuadro es lenta, con eumenorrea y en ausencia de virilización. También es importante recoger datos sobre la duración del proceso y los intentos terapéuticos ya realizados.
El examen ginecológico y somático nos permitirá excluir signos físicos de síndromes relacionados con los estados hiperandrogénicos, como la acantosis nigricans en el síndrome HAIRAN o la hipertensión, la galactorrea, la obesidad, la debilidad muscular, las estrías rojas y la joroba grasa en el síndrome de Cushing.
Una de las mayores dificultades es la cuantificación objetiva del hirsutismo. Finalmente, es necesario evaluar la localización, el grado, el momento de inicio y su intensidad y su progresión. En los casos que cursan con una virilización, se debe investigar posibles cambios en el tono de la voz, si se presenta calvicie, modificaciones de la libido, presencia de clitoromegalia, cambios en la distribución de la masa muscular y aparición de hipertrofia laríngea.
Puntos clave
1. Conocer el momento y la velocidad de instauración del hiperandrogenismo (evolución rápida con eventual virilización alerta sobre un posible origen tumoral).
2. Descartar la administración iatrogénica de andrógenos.
3. Descartar signos y síntomas asociados a otros síndromes endocrinos: hipotiroidismo, hiperprolactinemia, síndrome de Cushing.
4. Confirmar la presencia de hirsutismo (pelo terminal excesivo en zonas andrógeno-dependientes) y determinar su intensidad (escala semicuantitativa de Ferriman-Gallwey) (fig. 6 y tabla II).
Fig. 6. Escala semicuantitiva de Ferriman-Gallwey.
5. Descartar signos de virilización.
6. Descartar tumoraciones abdominales palpables.
PRUEBAS COMPLEMENTARIAS: DETERMINACIONES HORMONALES BASALES
Las determinaciones hormonales si sólo pueden practicarse de forma única es conveniente realizarlas en la fase folicular con el fin de separar el componente ovárico del suprarrenal. Sin embargo, la evaluación de dos muestras de sangre en diferentes fases del ciclo puede aportar una mayor información. En este último caso, sería deseable estudiar en la fase folicular los siguientes parámetros:
El índice LH/FSH es útil para el diagnóstico de sospecha del síndrome del ovario poliquístico.
La prolactina (PRL) permite detectar una hiperprolactinemia (causa del aumento de la producción de andrógenos suprarrenales).
La 17-OH-progesterona (17-OHP): si presenta unas concentraciones superiores a 10 ng/ml en esta fase del ciclo, deberá sospecharse la posibilidad de un déficit de 21-hidroxilasa.
La DHEA y el DHEAS tienen un origen suprarrenal y presentan un ritmo circadiano. Si las concentraciones plasmáticas de DHEAS son superiores a 7 mg/ml, hay que descartar la posibidad de un cáncer adrenocortical.
En la fase lútea del ciclo menstrual el estudio puede completarse con:
La repetición del índice LH/FSH.
Determinación de esteroides: estradiol (E2), estrona (E1), androstenodiona (A) y testosterona.
Metabolitos periféricos: androstendioles.
SHBG es determinante de los esteroides bioactivos. En condiciones normales la testosterona libre debe ser inferior del 3%.
Tests dinámicos. Cuando los resultados de las determinaciones basales no sean definitivos podemos recurrir a ellos:
Test de supresión con dexametasona para valorar el exceso de glucocorticoides y de androgénos suprarrenales. En los sujetos normales el cortisol es inferior a 5 µg/100 ml mientras que en el síndrome de Cushing raramente es inferior a 10 µg/100 ml.
Test largo de supresión con dexametasona. Se administran 2 mg/día de dexametasona durante 7 días consecutivos. En el síndrome de Cushing el cortisol es superior a 40 ng/ml y el DHEAS se sitúa por encima de 400 ng/ml.
Test de estimulación con ACTH. Se emplea para valorar el déficit enzimático de la 3b-hidroxiesteroide deshidrogenasa o de la 21-hidroxilasa. Una respuesta marcada con elevación de la DHEA, la 17-hidroxipregnenolona y del índice 17-hidroxipregnenolona/17-hidroxiprogesterona es indicativa de un déficit parcial de 3b-hidroxiesteroide deshidrogenasa. Por el contrario, una respuesta elevada de la 17-hidroxiprogesterona y un descenso del índice 17-hidroxipregnenolona/17-hidroxiprogesterona debe hacer pensar en un déficit de 21-hidroxilasa.
Ritmo del cortisol plasmático. Los valores de cortisol (y de ACTH) son más elevados por la mañana y más bajos (50%) al atardecer.
Test de frenación ovárica. Se puede utilizar una combinación de estroprogestágeno en la segunda mitad del ciclo o análogos de la Gn-RH cuando las cifras de testosterona son muy altas. La frenación sólo afecta a la secreción de testosterona dependiente de las gonadotrofinas, sin afectar a la secreción autónoma del tumor.
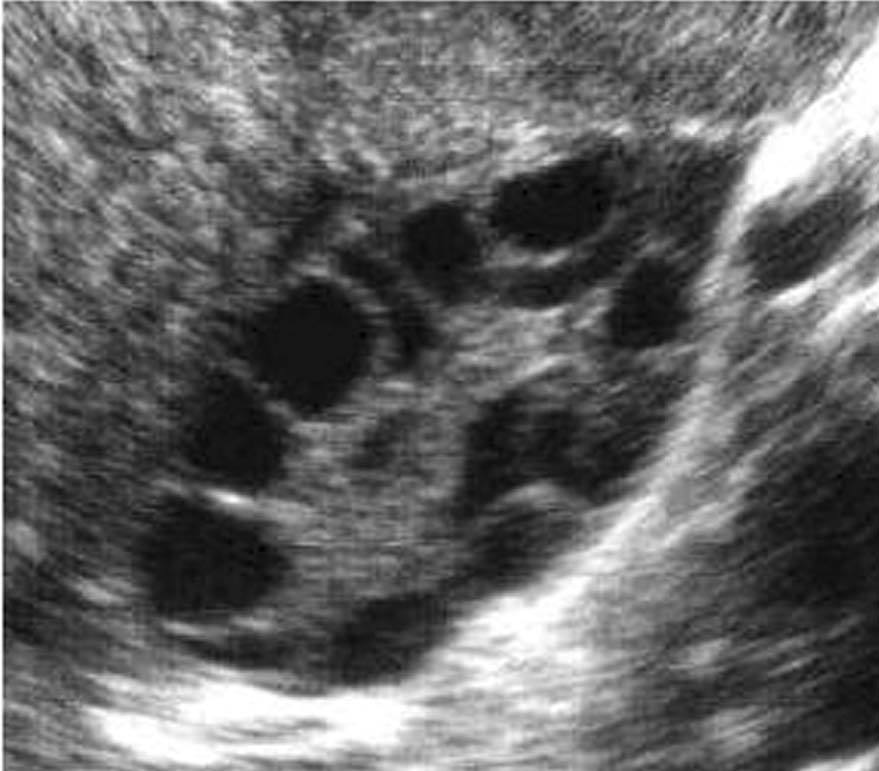
Ecografía. La ecografía permite visualizar la imagen del ovario. Sin embargo, imágenes que recuerdan al ovario poliquístico pueden observarse en mujeres asintomáticas e incluso en aquellas que toman anticeptivos orales (ACO) durante largos períodos. Por este motivo es importante diferenciar entre el ovario poliquístico y los ovarios multifoliculares.
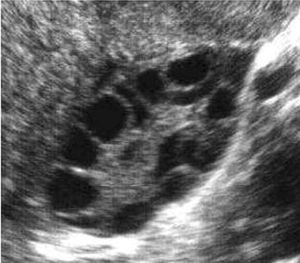
Características ecográficas del ovario poliquístico (fig. 7).
Fig. 7. Características ecográficas del síndrome del ovario poliquístico.
Ovario de gran tamaño: superficie superior a 6 cm2.
Aspecto globuloso: índice de esfericidad superior a 0,7.
Numerosos microquistes periféricos: 10-20 en cada ovario y pequeño tamaño (5 mm), con topografía periférica (en rueda de carro).
Hipertrofia/hiperecogenicidad de la estroma.
TRATAMIENTO DEL HIRSUTISMO
Tratamiento específico
En las pacientes con diagnóstico de enfermedad que requiera un tratamiento específico se aplicará:
Tumoración ovárica o suprarrenal: cirugía y eventual tratamiento radioterápico o quimioterápico dependiendo del resultado anatomopatológico y del estadio del tumor.
Determinadas pacientes con SOP pueden ser candidatas a tratamiento quirúrgico, en pacientes anovuladoras y en casos de resistencia farmacológica se puede recurrir al drilling, técnica laparoscópica de punción repetida de la cápsula ovárica mediante aguja monopolar o láser. No obstante, el efecto conseguido por este tratamiento no es permanente5,6.
En caso de detectar una endocrinopatía como el síndrome de Cushing, el hipotiroidismo o la hiperprolactinemia, debemos aplicar el protocolo diagnóstico y terapéutico adecuado a cada entidad.
En pacientes con un problema de obesidad, la pérdida de un 5-10% del índice de masa corporal (IMC) suele ser beneficiosa por la mejoría clínica y la mayor respuesta a los tratamientos indicados7.
En el resto de los pacientes, el tratamiento se orientará a contrarrestar la fuente productora de andrógenos, suprimiendo la glándula productora, impidiendo la acción de la hormona en el órgano diana o disminuyendo la biodisponibilidad de los andrógenos. Para estos fines disponemos de diversos fármacos que se desarrollan en el apartado siguiente.
Tratamiento general
Tratamiento dietético preventivo. Aunque las manifestaciones cutáneas del hiperandrogenismo (HA) son importantes, tales como el acné, el hirsutismo, la hipertricosis, la alopecia hiperandrogénica y la anovulación crónica, son las implicaciones metabólicas del HA las que tendrán mayor repercusión en la vida futura de la paciente. El HA puede cursar con un aumento de la resistencia insulínica (RI), hiperinsulinismo, dislipemia, obesidad. Por si fuera poco, un 20% de estas pacientes desarrollan, a lo largo de su vida, una intolerancia a los hidratos de carbono o una diabetes mellitus no insulinodependiente. En consecuencia, cualquier medida terapéutica debe comenzar, tan pronto se pueda, por un severo ajuste dietético, tendente a la normalización de su índice de masa corporal, con reducción de la ingesta calórica y de los hidratos de carbono simples. Además, debe incrementarse el ejercicio físico para aumentar el gasto calórico.
Tratamiento de las manifestaciones cutáneas
Antes de indicar un tratamiento para el hiperandrogenismo debemos tener en cuenta otros aspectos. Debemos conocer el deseo de fertilidad de la paciente en el momento de iniciar el tratamiento, no sólo para indicar o no un tratamiento con estroprogestágenos con acción anticonceptiva, sino por el riesgo de teratogenicidad de los antiandrógenos, su uso debe restringirse a pacientes sin deseo gestacional y deben asociarse siempre a un método anticonceptivo eficaz, como los anticonceptivos orales. Es esencial informar a la paciente que el tratamiento médico del hirsutismo no permite apreciar su eficacia hasta 6-12 meses de su inicio y, en muchos casos, su suspensión posterior significa la reaparición de la clínica8. Por este motivo, es recomendable asociar al tratamiento médico un tratamiento local. Entre los tratamientos estéticos locales están la depilación manual, el rasurado, la cera, la decoloración, los preparados depilatorios (cremas), la electrólisis y el láser, los dos últimos son los más recomendados por ser mecanismos de destrucción del folículo piloso.
Tratamientos sistémico-farmacológicos (tabla III)
Las opciones terapéuticas son variadas y se basan en suprimir la glándula productora, impedir la acción de la hormona en el órgano diana o disminuir la biodisponibilidad de los andrógenos. En el apartado siguiente se detallan de forma esquemática las principales características de los fármacos utilizados actualmente en el tratamiento del hirsutismo.
Anticonceptivos orales. Su mecanismo de acción se basa en la inhibición de la secreción de gonadotropinas y, consecuentemente, de la producción ovárica de andrógenos. También producen un aumento de la SHBG por su acción en el hígado y se ha descrito igualmente su capacidad para inhibir la síntesis androgénica suprarrenal9. Su indicación principal son los casos de hiperandrogenismo ovárico funcional, principalmente el SOP asociado a valores elevados de testosterona. También se han utilizado asociados a otros fármacos que alteran el ciclo menstrual (espironolactona). Las dosis de etinilestradiol pueden variar desde los 15 µg hasta los 35 µg combinado preferentemente con 2 mg de acetato de criproterona o con un gestágeno de tercera generación (dosis diaria, vía oral)10-12.
Acetato de ciproterona (ACP). Suprime la secreción ovárica de andrógenos por inhibición de las gonadotropinas, bloquea el receptor de testosterona y disminuye la actividad de la 5-alfa-reductasa en la piel. Además, induce un incremento del metabolismo hepático de los andrógenos. Entre otras de sus acciones se halla su papel como progestágeno, lo que le permite formar parte de formulaciones anticonceptivas, y además presenta una acción glucocorticoidea débil e induce un incremento marcado de SHBG. La combinación de etinilestradiol y acetato de ciproterona ha demostrado producir desaparición del acné y del hirsutismo leve o moderado, así como una mejoría en el hirsutismo severo, pero la suspensión del tratamiento se asocia a recidiva8. También tiene utilidad en el hirsutismo idiopático y en el hirsutismo suprarrenal. La dosis recomendada es de 100 mg/día, vía oral. Entre sus efectos adversos se hallan los trastornos del ciclo, aumento de peso y edemas. Debe realizase un seguimiento de las enzimas hepáticas por la posibilidad de que se eleven o de un cuadro de hepatitis9. El descenso de la libido no es infrecuente.
Análogos de la Gn-RH. Se ha utilizado como tratamiento de segunda línea9 o combinado con los anticonceptivos orales en el hiperandrogenismo ovárico13 variando la dosis y vía de administración según el fármaco utilizado14. Entre sus efectos adversos destacan los ligados al hipoestrogenismo, por lo cual se requiere suplementación con estroprogestágenos13,15,16. Otro inconveniente es su elevado coste económico.
Glucocorticoides (dexametasona). Actúa mediante la inhibición de la secreción de andrógenos suprarrenales. Su uso se centra en los hiperandrogenismos funcionales suprarrenales. También en ocasiones se utiliza en los de causa ovárica para mejorar los resultados de la inducción de la ovulación. En el déficit parcial de 21-hidroxilasa se ha objetivado una mejor respuesta terapéutica con antiandrógenos17. La dosis utilizada de dexametasona suele ospetitivamente el receptor periférico de los andrógenos (20% de afinidad). Se ha observado también que produce una reducción de la actividad de la 17-20 desmolasa suprarrenal y una inhibición de la secreción de DHEAS. Actúa como un antiandrógeno puro18 y, por tanto no reduce la secreción de estrógenos, progesterona, androstendiona, como tampoco reduce los valores de testosterona. Su uso se indica principalmente en el hiperandrogenismo funcional ovárico y en el hirsutismo idiopático19. Ha demostrado ser eficaz en casos de hirsutismo moderado a severo con respuesta rápida a este fármaco sin técnicas mecánicas asociadas y en 4 de cada 5 pacientes que no responden a espironolactona o dexametasona18,20. La dosis más empleada es de 250 mg/día por vía oral. En caso de requerir dosis mayores, en circunstancias especiales se puede aumentar a 500-750 mg/día, con estricto control clínico-analítico de la paciente. Se recomienda asociar a estroprogestágenos. Entre sus inconvenientes destacan el elevado coste, la hepatotoxicidad (0,5% de hepatitis potencialmente graves), las alteraciones del ciclo menstrual, sequedad cutánea, nauseas y aumento del apetito.
Espironolactona. Produce la inhibición del citocromo P450 c17 y, con ello, de la síntesis de testosterona. Además bloquea el receptor de testosterona y reduce la actividad 17-beta-hidroxilasa y 17-20 desmolasa. Posee actividad progestogénica débil21. Su uso se circunscribe al hiperandrogenismo ovárico, en pacientes normoovuladoras; en casos de SOP mejora los resultados al administrarse en combinación con anticonceptivos orales22. Estudios in vitro han demostrado una eficacia superior de este fármaco respecto al acetato de ciproterona9. La dosis más utilizada es de 100-200 mg/día, vía oral. Entre sus inconvenientes destacan: polimenorrea y metrorragia disfuncional, náuseas, mareos, poliuria-polidipsia e hipotensión. Al asociarse a determinados fármacos o administrarse a pacientes diabéticas o de mayor edad, hay riesgo de hiperpotasemia.
Finasterida. Se utiliza en casos de hirsutismo idiopático en pacientes que no toleran o no aceptan otras opciones terapéuticas23. Suele administrarse en dosis de 5 mg/día por vía oral. La vía tópica está en estudio, principalmente en el tratamiento del hirsutismo facial1,24. Como efectos adversos de este fármaco destacan las alteraciones del ciclo menstrual, por lo cual se aconseja asociarlo a estroprogestágenos.
Metformina. Aparte de mejorar la sensibilidad a la insulina, reduce la gluconeogénesis. En pacientes obesas con SOP, mejora las tasas de ovulación y de gestación y reduce la hiperinsulinemia y la hiperandrogenemia25.
Troglitazona. Mejora la secreción y la sensibilidad a la insulina. Al igual que la metformina mejora la tasa de ovulación, el hiperandrogenismo y la resistencia insulínica25,26. Además, la incidencia de efectos secundarios es similar a la que ocurre con tratamientos con placebo26.
Bicalutamida. Antiandrógeno puro no esteroideo utilizado en el tratamiento del cáncer de próstata. En pacientes con SOP se ha evidenciado una disminución en las concentraciones de andrógenos27. Se usa en el tratamiento del hirsutismo en dosis de 25 mg/día27,28. Se han descrito hepatitis tóxicas con el empleo de dosis elevadas.
Tratamiento local
Puede utilizarse de forma aislada o en combinación con los tratamientos sistémico-farmacológicos. El tratamiento cosmético del HA, del hirsutismo, incluye el rasurado, la depilación por cera, por electrólisis, la fotodepilación por pulsos continuos de láser-Rubí no está tampoco exenta de riesgos29,30.
Un avance reciente ha sido la eflornitina, inhibidor irreversible de la ornitina-descarboxilasa, enzima esencial para la división celular rápida en el folículo pilosebáceo indicada principalmente en el tratamiento del hirsutismo facial y para evitar los efectos adversos de otros tratamientos sistémicos31. Se administra en forma tópica, fórmula compuesta por eflornitina al 11,5% en crema. Se debe aplicar una fina capa de la crema 2 veces al día con un intervalo de al menos 8 h. La absorción cutánea es inferior al 1% y la tolerancia al tratamiento tópico es muy buena; no es comedogénico ni agrava el acné; tampoco produce fotosensibilidad, dermatitis de contacto ni reacciones fototóxicas; los únicos efectos adversos remarcables son sensación de quemazón, picor y hormigueo.
En tratamientos prolongados (de más de 6 meses), el 70% de las mujeres obtuvieron buenos resultados con la eflornitina tópica, con mejorías desde la cuarta semana de tratamiento31. Los estudios clínicos realizados en más de 1.800 pacientes han demostrado que el 70% de las mujeres que utilizan este tratamiento experimentan una reducción estadísticamente significativa del hirsutismo. La valoración global realizada por médicos y pacientes y el resultado de los análisis realizados por videoimagen constatan que la eflor nitina es eficaz en todos los tipos de piel y color de vello.
Los antiandrógenos utilizados para el tratamiento del hirsutismo (p. ej., el acetato de ciproterona) tienen un grado terapéutico muy próximo al de toxicidad, con un riesgo de efectos adversos graves. Además, para ser efectivo, cualquier tratamiento del hirsutismo requiere de una aplicación prolongada. La eflornitina tiene un perfil de seguridad alto, y se ha utilizado en población de mayores de 70 años y en mujeres embarazadas sin producir efectos adversos graves.
Este tratamiento tópico puede combinarse tanto con tratamientos farmacológicos, como los anticonceptivos, como con tratamientos cosméticos, como el láser, y los resultados son superiores con el uso combinado que con el tratamiento aislado.
La alopecia hiperandrogénica puede tratarse mediante tratamientos locales como el minoxidil tópico; su aplicación continua puede inducir leves crecimientos pilosos en la zona parietal.
Como tratamiento local suplementario pueden añadirse los tratamientos antibióticos locales en el caso de superinfección de los folículos pilosebáceos hiperandrogénicos.
Tratamiento según la situación clínica
Sin relaciones sexuales
Sin alteraciones menstruales. La paciente con hiperandrogenismo sin alteraciones menstruales y sin actividad sexual precisará únicamente normalizar su peso y del ajuste dietético cuando es obesa, y tratar su hirsutismo.
Con alteraciones menstruales. Más frecuente es la situación en que, de forma primaria o por pérdida del ciclo por efectos secundarios de los diferentes tratamientos farmacológicos empleados, la paciente está o entra en amenorrea secundaria o, simplemente, tiene un mal control del ciclo. En este caso, estará aconsejado el empleo de contraceptivos orales (CO) con ACP como progestágeno antiandrogénico. Esta combinación ha demostrado su eficacia al mejorar el hiperandrogenismo y reducir el hirsutismo, pues suprime la secreción de gonadotrofinas, incrementa la síntesis de SHBG y, además, inhibe la unión DHT-receptor androgénico periférico y reduce además la secreción androgénica a nivel ovárico y suprarrenal.
Con relaciones sexuales
Sin deseo reproductivo. Es el caso paradigmático de necesidad de anticoncepción, tratamiento antiandrogénico y protección frente al hipoestronismo si se añaden algunos fármacos antiandrógenos de los señalados más arriba; por tanto, estaremos ante la necesidad de anticoncepción oral combinada con ACP.
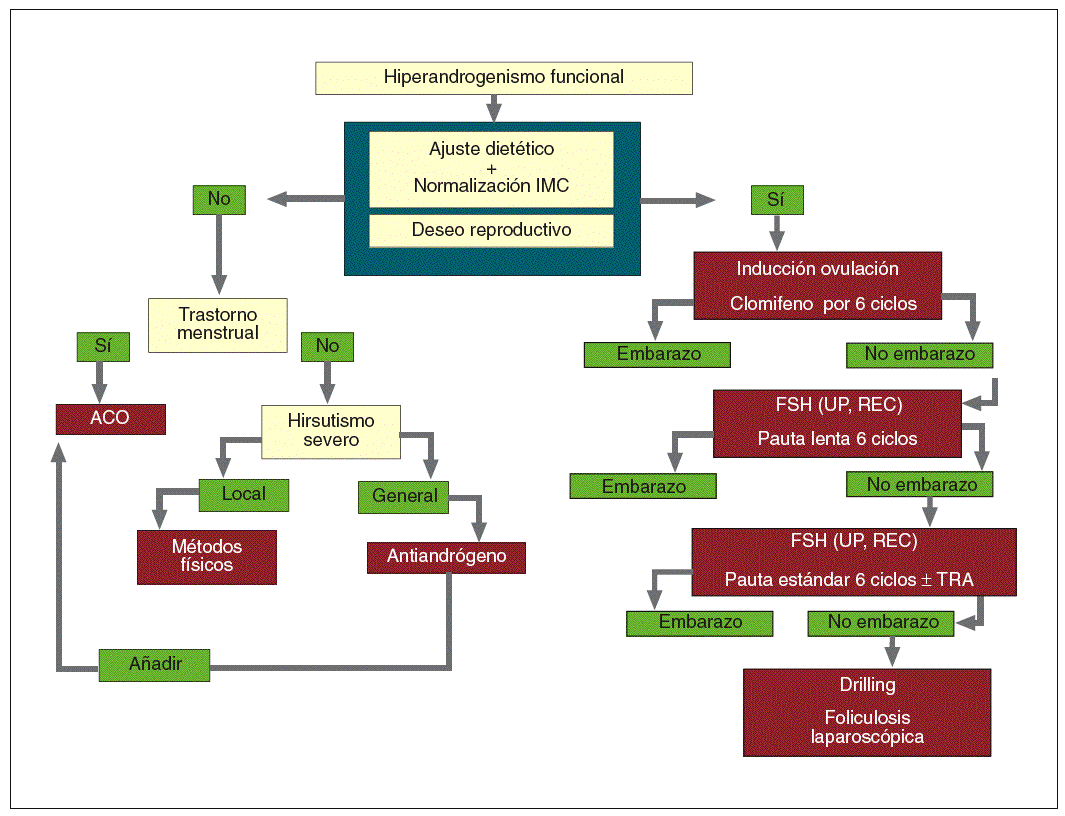
Con deseo reproductivo. La inducción de la ovulación (IO) es obligada. Siguiendo los postulados ya explicados (ajuste dietético y normalización del peso cuando hay obesidad), el objetivo fundamental en este punto es la ovulación y la protección del defecto de fase lútea muy común en situaciones de hiperandrogenismo de menor a mayor complejidad farmacológica:
Citrato de clomifeno (CC): nunca más allá de 6 ciclos seguidos, pues la probabilidad matemática de embarazo después de ese tiempo es estadísticamente despreciable; la dosis debe ser la más baja posible para conseguir la máxima eficacia, se debe empezar por 50 mg/día y requiere la complementación de la inducción de ovulación con gonadotrofina coriónica (hCG) tras 7 días desde la última dosis con suplemento de la fase lútea con progesterona natural micronizada.
FSH ultrapurificada o recombinante: estaría indicada en situaciones de fracaso con CC o ante la aparición de efectos secundarios. Su empleo debe comenzar por la dosis más baja posible para asegurar la ovulación. Si en 6 ciclos no se consiguiera el embarazo y/o existieran factores de esterilidad adicionales, estaría indicado aumentar la dosis y combinar con la técnica de reproducción asistida más apropiada a cada caso (inseminación artificial conyugal intrauterina, fecundación in vitro y transferencia embrionaria, técnicas de microfertilización asistida, etc).
La evaluación de la eficacia terapéutica puede realizarse de diversas formas: valorar el intervalo entre las sucesivas depilaciones, valorar en cada visita la escala de Ferriman-Gallwey, evaluar los cambios en longitud y/o diámetro del pelo (más laborioso y utilizado principalmente en ensayos clínicos)32.
MANEJO TERAPÉUTICO DEL HIRSUTISMO
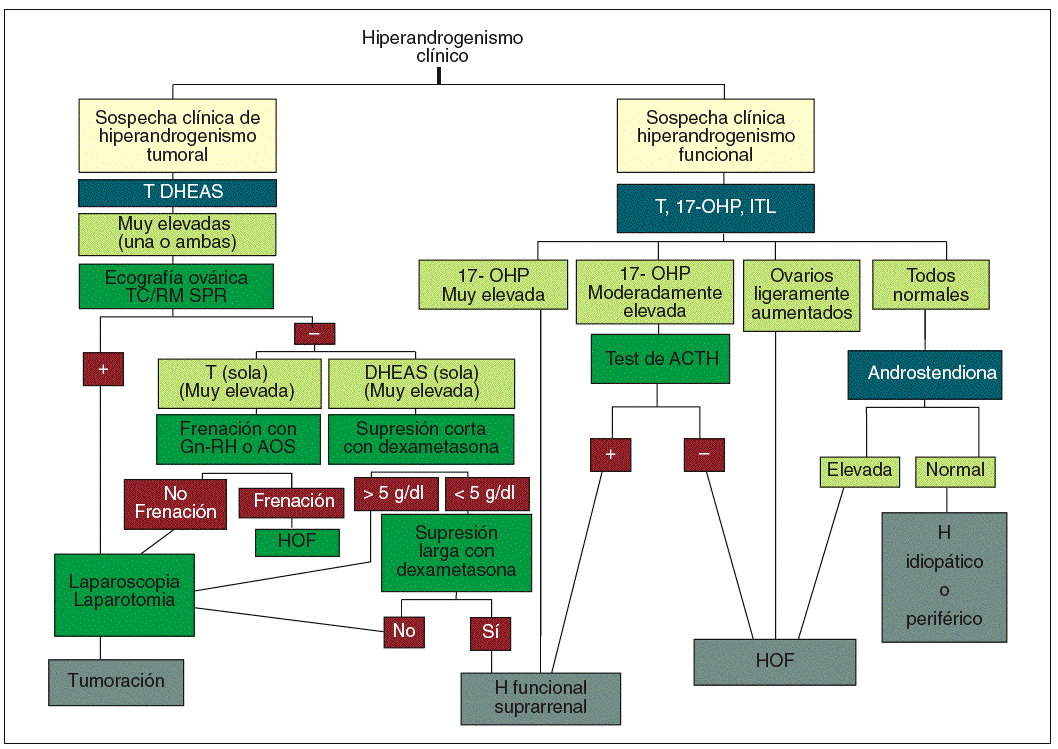
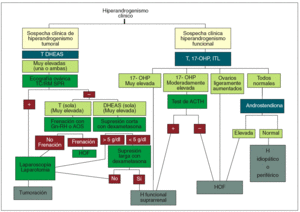
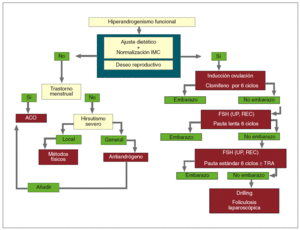
En el manejo terapéutico del hirsutismo es conveniente seguir los aforismos clásicos de «aquel que no sabe lo que busca no entiende lo que encuentra» y «saber de donde venimos para saber adónde vamos». Por ello, es fundamental determinar el origen del hiperandrogenismo (depende de LH, ACTH, si es tumoral, si se asocia a hiperprolactinemia o hiperinsulinemia, etc.) para poder indicar el tratamiento adecuado que abarcará desde la supresión glandular (hipofisaria, gonadal, adrenal) a la indicación quirúrgica o la inhibición del receptor del andrógeno. En la figura 8 se detalla el algoritmo diagnóstico y en la figura 9, el algoritmo terapéutico propuesto.
Fig. 8. Algoritmo diagnóstico. AOS: anticonceptivos hormonales; DHEAS: sulfato de deshidroepiandrosterona; Gn-RH: gonadoliberina; H: hirsutismo; HOF: hiperandrogenismo ovárico funcional; ITL: índice de testosterona libre; OHP: hidroxiprogesterona; T: testosterona; TC/RM SPR: scanner o resonancia magnética suprarrenal.
Fig. 9. Algoritmo terapéutico. ACO: anticonceptivo oral; FSH: follicle-stimulating hormone "hormona foliculoestimulante o folitropina"; IMC: índice de masa corporal; TRA: técnicas de reproducción asistida; UP, REC: ultrapura/recombinante.