La acalasia es un trastorno motor primario del esófago, de etiología desconocida e incurable. La intención de todo tratamiento es debilitar el esfínter esofágico inferior. Los 3 tratamientos endoscópicos establecidos son: la aplicación de toxina botulínica y las dilataciones neumáticas, además de otro en desarrollo llamado POEM (per-oral endoscopic myotomy). Los 2 primeros logran de manera efectiva debilitar la presión del esfínter esofágico inferior, sin embargo su efectividad y duración son muy variables. En el caso de la toxina botulínica tiene una recurrencia de síntomas en un 50% de los pacientes a 6 meses y en un 100% al año, mientras que en las dilataciones neumáticas a 5 años solo el 60% de los pacientes permanecen asintomáticos y la necesidad de múltiples dilataciones es la regla en más del 90% de los pacientes. El factor predictivo para remisión duradera es una presión del esfínter esofágico inferior<15mmHg posterior a la realización de cualquier tipo de procedimiento. Una nueva técnica promisoria y en evolución es el POEM, con resultados iniciales similares a la miotomía de Heller, sin embargo aún nos encontramos a la espera de que la técnica madure y tenga mayor experiencia.
Achalasia is an incurable primary esophageal motor disorder of unknown aetiology. The intent of any treatment is to weaken the lower esophageal sphincter. Established treatments for endoscopic management are endoscopic application of botulism toxin and pneumatic dilation, along with other treatments under development such as POEM (per-oral endoscopic myotomy). The first 2 are very effective in weakening lower esophageal sphincter pressure, but their efficacy and duration vary greatly. There is a recurrence of symptoms of 50% at 6 months and almost 100% in one year for botulism toxin, while with pneumatic dilation only 60% of patients are asymptomatic at 5 years, so the need for multiple pneumatic dilation is the rule in>90% of patients. The best positive predictor of lasting symptomatic response is lower esophageal sphincter pressure<15mmHg after performing any procedure. The POEM technique is promising and still evolving, initially offering results similar to the Heller myotomy; however, we are waiting for greater experience with more patients and for long-term results.
Es el trastorno motor primario del esófago que más fácil se reconoce y mejor se caracteriza. La acalasia puede ser primaria (idiopática) o secundaria. Es de causa desconocida (con múltiples teorías principalmente de tipo inmunológico), crónica, progresiva e incurable, que resulta de la degeneración de las células ganglionares del plexo mientérico de la pared esofágica que provoca relajación incompleta del esfínter esofágico inferior (EEI) y aperistalsis del cuerpo esofágico, mientras que la presión en reposo del EEI está elevada en el 60% de los casos. La acalasia afecta por igual a hombres y mujeres, con una incidencia de 1:100,0001,2.
Generalidades: cuadro clínico y diagnósticoLas manifestaciones clínicas pueden incluir: disfagia esofágica (la cual es gradual iniciando con sólidos y posteriormente con líquidos), regurgitaciones de alimentos no digeridos, dolor torácico no cardiaco y pérdida de peso, que son en conjunto síntomas que habitualmente se confunden con ERGE y retrasan su diagnóstico (1.5 años en promedio para el diagnóstico). Además se puede asociar a algunas complicaciones como es la neumonía por broncoaspiración. Radiográficamente, el esofagograma con bario se caracteriza esencialmente por: vaciamiento esofágico retardado, terminación en «pico de ave» y otros cambios de soporte como son: esófago dilatado o sigmoideo, divertículos epifrénicos y nivel hidroaéreo. Endoscópicamente se puede observar dilatación esofágica en grado variable, la presencia de alimento retenido no digerido con erosiones circundantes (generadas por estasis) y ausencia de estenosis u obstrucción mecánica2,3.
La manometría, ya sea de alta resolución, ya de tipo convencional (fig. 1), es el método estándar de oro para establecer el diagnóstico de esta enfermedad y se caracteriza esencialmente por aperistalsis del cuerpo esofágico y relajación incompleta del EEI (presión residual>15mmHg) y de soporte: EEI normal o hipertenso, contracciones esofágicas de baja amplitud. La manometría de alta resolución ofrece algunas ventajas con relación a la convencional; una de ellas es que a través de la clasificación de Chicago se pueden establecer 3 tipos de acalasia (i clásica, ii presurización panesofágica, iii espástica) y de esta forma es posible establecer un mejor pronóstico de respuesta al tratamiento, siendo la tipo iii la de peor respuesta a cualquier tipo de manejo (<50%) y la tipo ii la de mejor pronóstico (>80%)4–6.
A pesar de ser una enfermedad poco frecuente, existen hoy en día guías internacionales como la del Colegio Americano de Gastroenterólogos (CAG), la de la Asociación Americana de Gastroenterología (AGA) y la de la Sociedad Americana de Cirujanos Gastroenterólogos y Endoscopista (SAGES) que indican claramente el abordaje diagnóstico y de tratamiento de esta enfermedad7–9.
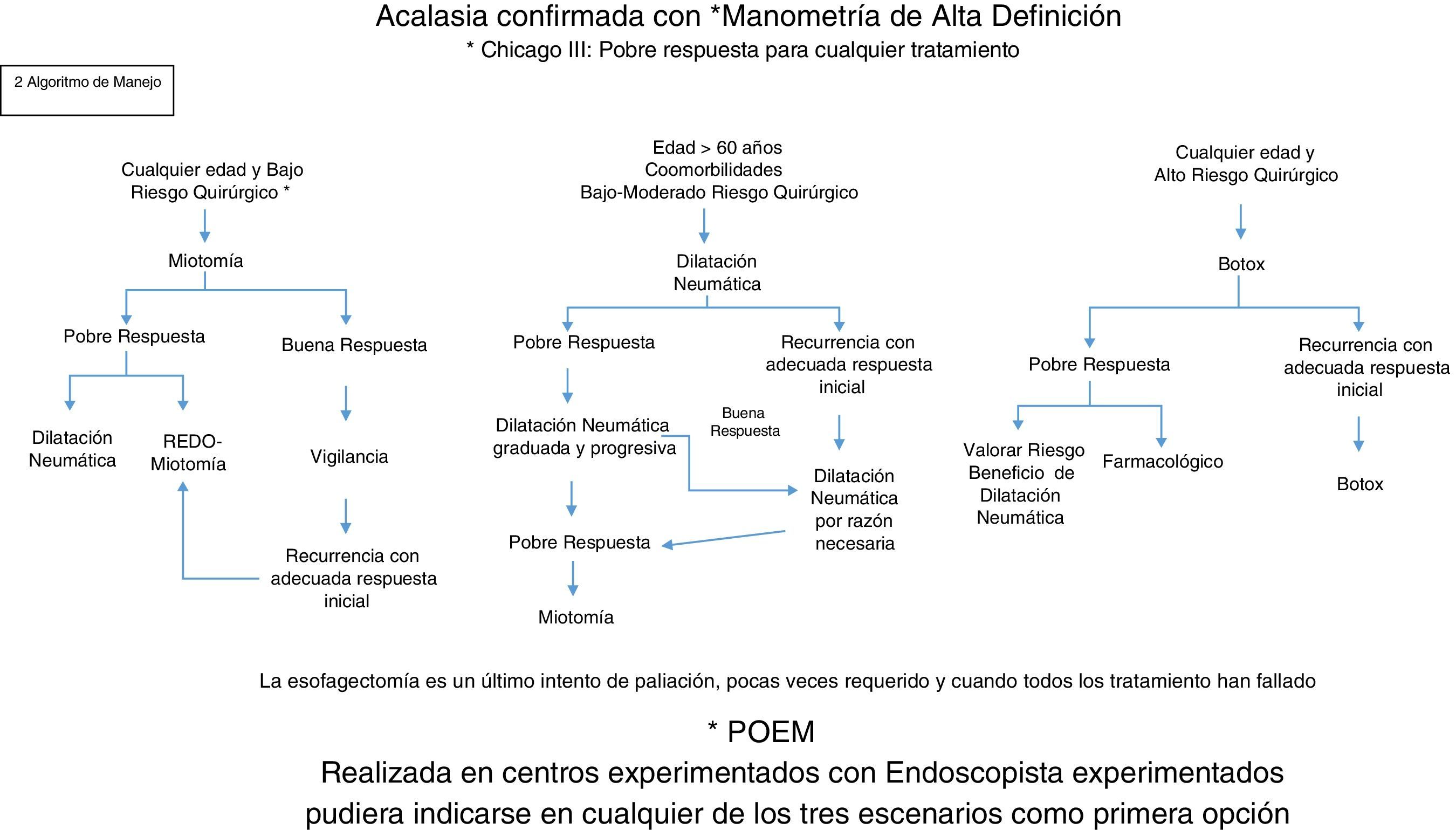
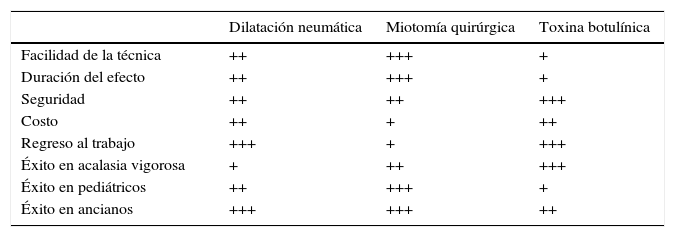
Para su tratamiento, la acalasia puede ser abordada de varias maneras: con tratamiento médico, endoscópico y quirúrgico (tabla 1). Hasta el día de hoy el estándar de oro para el manejo de la acalasia es el abordaje quirúrgico con la miotomía de Heller (MH). Sin embargo, los procedimientos endoscópicos como la inyección de toxina botulínica (TB) y las dilataciones neumáticas (DN) ofrecen resultados buenos para aquellos pacientes que no son candidatos a manejo quirúrgico, pero desafortunadamente con necesidad de múltiples reintervenciones endoscópicas debido a recurrencia de síntomas. Con los avances de la tecnología endoscópica y la cirugía a través de orificios naturales, hoy en día se propone la miotomía endoscópica (per-oral endoscopic myotomy [POEM]) como un tratamiento de mínima invasión, el cual con el tiempo y experiencia podrá compararse en resultados con la cirugía, incluso se perfila por algunos como la primera opción de tratamiento. El uso de TB con aplicación endoscópica y los medicamentos se utilizarán solamente en aquellos casos en donde el paciente no sea candidato a DN, POEM o MH, debido a la alta recurrencia de síntomas en el caso del TB y a los efectos adversos del tratamiento médico a base de fármacos como nitratos y calcioantagonistas7,9.
Tabla comparativa de los tratamientos tradicionales para acalasia
| Dilatación neumática | Miotomía quirúrgica | Toxina botulínica | |
|---|---|---|---|
| Facilidad de la técnica | ++ | +++ | + |
| Duración del efecto | ++ | +++ | + |
| Seguridad | ++ | ++ | +++ |
| Costo | ++ | + | ++ |
| Regreso al trabajo | +++ | + | +++ |
| Éxito en acalasia vigorosa | + | ++ | +++ |
| Éxito en pediátricos | ++ | +++ | + |
| Éxito en ancianos | +++ | +++ | ++ |
Fuente: Stavropoulos et al.48.
El objetivo de todas las modalidades es disminuir la presión en reposo del EEI a un punto en el que el esfínter no impida el paso del bolo alimenticio. Esto se puede realizar mediante rotura mecánica de las fibras musculares (p. ej., dilatación neumática, endoscópica o quirúrgica) o por una reducción farmacológica de la presión del EEI (p. ej., TB, nitratos o calcioantagonistas).
Tratamiento no endoscópicoFarmacológicoEs el menos eficaz y se caracteriza por una tasa baja de resolución de síntomas, poca tolerancia y bajo apego a tratamiento durante periodos prolongados debido a los efectos adversos y taquifilaxia. La efectividad es de corta duración y variable (se reporta del 0-75%) y recurrencia>50% al año, y una vez suspendido el tratamiento, del 100%10–12. Los calcioantagonistas como nifedipino sublingual a dosis de 10-30mg, 30min antes de los alimentos o 5mg de dinitrato de isosorbide 15min antes de comer pueden ser una opción. La baja tasa de resolución de síntomas y los efectos adversos como cefalea, mareo, edema y taquifilaxia son los principales motivos por los cuales los pacientes suspenden el tratamiento. Otra opción como los inhibidores de la 5 fosfodiesterasa (p. ej., sildenafil) han mostrado buenos resultados, sin embargo la información es escasa y existe poco poder estadístico que apoye su uso10–12.
QuirúrgicoEs hoy en día el tratamiento de elección para el paciente con acalasia que tenga un riesgo quirúrgico adecuado. Consiste en una miotomía quirúrgica del EEI, vía transabdominal y laparoscópica. Siempre se debe garantizar una rotura de las fibras musculares esofágicas del EEI, 6cm proximal y 2cm distales hacia el estómago, como mínimo. La tasa de éxito en resolución de síntomas a 5 años es>90%. En aquellos en los que falla la MH, se ha identificado como principal factor la inadecuada o insuficiente miotomía durante el procedimiento inicial, principalmente de la porción gástrica. También se ha identificado que las DN y la aplicación de TB incrementan de forma significativa el riesgo de perforación al realizar la cirugía.
El desarrollo de ERGE posterior a la cirugía (MH) es tan frecuente como en un 30% de los pacientes, lo cual tiene un impacto negativo en la calidad de vida y es por ello que se debe realizar una funduplicatura parcial para lograr una menor tasa de ERGE (15% aproximadamente)9,13,14. El tratamiento antirreflujo a realizar debe ser siempre una funduplicatura de tipo parcial, y las 2 principales opciones son la funduplicatura tipo Dor (anterior) y Toupet (posterior), con beneficios similares, pero quizá con mejor control de ERGE a largo plazo por parte de la tipo Toupet, de acuerdo a algunos estudios15.
Tratamiento endoscópicoDilatación neumáticaProcedimiento mínimamente invasivo, que hasta antes de la POEM era el tratamiento no quirúrgico más efectivo16. En 1970-1990 fue el procedimiento de elección y la MH tenía un papel secundario, sin embargo hoy en día su papel es más limitado, pero aun útil.
Indicaciones: Excelente procedimiento para aquellos pacientes que no sean candidatos para MH o POEM. Una segunda indicación es en aquellos en donde una MH fue fallida y hay recurrencia de síntomas; el pronóstico es menos favorable que antes de la cirugía17.
Objetivo: Rotura mecánica de las fibras musculares del EEI, a través de DN con balones especiales de polietileno resistentes a alta presión.
Quién y dónde: Endoscopista experimentado y centros de tercer nivel. Está documentado un menor número de perforaciones y mejor manejo de las complicaciones.
Factor de buen pronóstico: Edad>40 años, manometría de alta resolución: tipo ii, diámetro estrecho de la unión EG, mujer, presión posprocedimiento del EEI<15mmHg18.
Efectividad: Es costo-efectivo, el efecto es inmediato y duradero en más del 85% a un año, sin embargo a 5 años los síntomas recurren en un 40%, ameritando un nuevo procedimiento endoscópico con DN en más del 90% de los pacientes19–22.
Complicaciones: Es un procedimiento seguro, efectivo a largo plazo, aunque podrán ser necesarias múltiples DN. La perforación esofágica sucede en un 2% y la pirosis en un 15-35%. La perforación es la complicación más grave y potencialmente mortal, por lo que un diagnóstico y tratamiento oportuno es fundamental. Los factores de riesgo para perforación son: psi>11, uso de balón de 4cm de forma inicial y edad>65años23–26.
Precaución: La realización de MH tras tratamiento previo con dilatación esofágica incrementa el riesgo de perforación26.
Seguimiento: La persistencia de disfagia después de 3 dilataciones endoscópicas se considera un fallo en el tratamiento y al paciente se le debe ofrecer una nueva modalidad de tratamiento, endoscópica (POEM) o quirúrgica (MH)17.
Comparaciones: DN vs. MH: la MH es superior en términos de efectividad y durabilidad. Son similares en calidad de vida. Complicaciones transoperatorias similares. El costo-efectividad a largo plazo favorece a la DN27.
Método y técnica endoscópica: Procedimiento ambulatorio, salvo que haya alguna sospecha de complicación.
Se debe realizar bajo sedación y en sala de fluoroscopia con asistencia radiológica durante el procedimiento28,29. Los dilatadores neumáticos para acalasia vienen en 3 diámetros; 3, 3.5, 4cm y son los más frecuentemente utilizados. De forma inicial se realiza una panendoscopia completa, se coloca guía hidrofílica en el antro gástrico y posteriormente se extrae endoscopio. Se reintroduce el balón a través de guía, de forma simultánea y bajo visión endoscópica se posiciona el balón a nivel del EEI. El tercio medio del balón debe posicionarse a nivel del EEI, es aquí donde la asistencia fluoroscópica es de utilidad y debe visualizarse la desaparición de la cintura del balón al momento de la insuflación para lograr mejores resultados. La presión habitualmente requerida es de 7-15psi (360-775mmHg) de aire mantenidos por periodos aun no bien establecidos pero que van de 15 seg a 3min; esto depende mucho de cada grupo endoscópico19. Al momento de la dilatación se puede observar bajo visión endoscópica y a través del balón la rotura progresiva de las fibras musculares. Una dilatación inicial con balón de 3cm es la recomendada, y de forma progresiva en caso de persistencia o recurrencia de síntomas, incrementar el tamaño del balón19.
El comenzar con un balón más grande (p. ej., 3.5-4cm) no necesariamente impacta positivamente en los síntomas y sí aumenta el riesgo de complicaciones13,20. Los estudios muestran que con un abordaje de dilatación gradual los pacientes pueden alcanzar>90% de resolución de síntomas en el seguimiento a 2 años7. Se debe iniciar con un balón de 3cm, revalorar a las 4-6 semanas y, en caso de que el paciente persista con síntomas, se puede continuar con dilatación graduada a 3.5cm y 4cm progresivamente. El éxito de una sola DN se reportó en el 62% a 6 meses y en el 28% a 6 años, mientras que si se hace de forma seriada, graduada y progresiva la tasa de éxito es del 90% a 6 meses y del 44-70% a 6 años19.
Al término se visualiza la mucosa esofágica así como las roturas de las fibras musculares, tratando de descartar una potencial perforación o sangrado. Se recomienda siempre realizar un esofagograma con medio hidrosoluble en este momento, como otro método para descartar perforación25.
Recomendaciones al paciente: Es un procedimiento ambulatorio, se le debe especificar que en caso de hematemesis, fiebre, disnea o dolor torácico deberá acudir con brevedad al servicio de urgencias. Tampoco es infrecuente el inicio de síntomas relacionados con ERGE, que aparece hasta en el 30% de los pacientes, como son regurgitación y pirosis, por lo que en ese caso se deberá corroborar el diagnóstico e iniciar tratamiento.
Toxina botulínica con aplicación endoscópicaTratamiento farmacológico que requiere de aplicación endoscópica. Es un procedimiento mínimamente invasivo y con bajo riesgo de complicaciones, pero con alto tasa de recurrencia de síntomas. Se aplica la TB a dosis de 100UI, en cada uno de los 4 cuadrantes 2cm por arriba del EEI30. La aplicación de una dosis mayor no tiene impacto clínico31.
Indicaciones: Aquellos pacientes que no son candidatos a DN, MH o POEM. Aquellos pacientes ancianos, con múltiples comorbilidades y un riesgo quirúrgico muy elevado7.
Objetivo: La TB inyectada en las fibras del EEI bloquea las neuronas excitatorias en su proceso de liberación de acetilcolina (la cual incrementa la presión del EEI), provocando una disminución en su presión y entonces permite el vaciamiento esofágico.
Quién y dónde: Endoscopista entrenado en procedimientos terapéuticos básicos, centros de segundo y tercer nivel. Procedimiento ambulatorio.
Factor de buen pronóstico: Edad avanzada, acalasia tipo ii, ausencia de hipertonía del EEI32.
Efectividad: Reduce en un 50% la presión del EEI mientras se mantiene el efecto33. La respuesta inicial es excelente (pico al tercer día posprocedimiento), comparable con MH/DN y con resolución de síntomas>90%7. Sin embargo, el 50-80% de los pacientes requiere de nuevas dosis de TB durante los primeros 6-12meses por recurrencia de los síntomas, por lo que la tasa de resolución de síntomas con una sola aplicación a 5 años es<30%. Por lo anterior, comúnmente se requieren dosis repetidas, y hasta el 75% de los pacientes responderá a una segunda dosis. Hay que tener en cuenta que, de los no respondedores a la primera dosis, solo el 20% de los casos tendrá una respuesta a dosis subsecuentes34.
Complicaciones: Menores; la más frecuente es el dolor torácico en un 15-25%34,35.
Precaución: La realización de MH o DN tras previa aplicación de TB en el EEI incrementa de forma significativa el riesgo de perforación36–39. No se puede aplicar en pacientes con alergia al huevo.
Seguimiento: Si un paciente tiene una esperanza de vida larga (p. ej.,>10 años), con seguridad requerirá un cambio de tratamiento: endoscópico, médico o quirúrgico.
Método y técnica endoscópica: Fácil y rápido, consiste en aplicar vía endoscópica 100UI de TB a través de una aguja de escleroterapia de 21g, distribuidos en los 4 cuadrantes (25UI por cuadrante) a 1-2cm por arriba de la unión esofagogástrica. Las dosis mayores de 100UI no tienen ningún beneficio40.
Per-oral endoscopic myotomyConsiste en una miotomía endoscópica a través de la formación de un canal submucoso y posterior corte de las fibras musculares circulares del EEI. Campos et al.41, en un estudio sistemático demostraron que el tratamiento con respuesta más duradera y exitosa para acalasia es la MH. Ortega et al.42 publicaron hace más de 30 años un trabajo con relación a la realización de miotomía endoscópica con un needle knife y demostraron en 17 pacientes buena respuesta a corto plazo; sin embargo no hubo más resultados posterior a esto. En 2007, Sumiyama et al.43 describieron en Japón la realización de un túnel submucoso, miotomía del EEI y cierre de la mucosa con clips. Después de muchos intentos en animales, con esta misma técnica Inoue realizó la primera miotomía endoscópica en seres humanos en 2008 en Yokohama-Japón, presentando su trabajo en video en la DDW del 2009 y acuñando el término POEM44. Posteriormente en 2009 se realizó la primera POEM fuera de Japón, en Winthrop University, NY, EE. UU45.
Con la intención de estandarizar el procedimiento, en el año 2012 se realizó un cuestionario y encuesta multicéntricos en los que decidieron participar 16 centros endoscópicos con experiencia en POEM (The International Per Oral Endoscopic Myotomy Survey (IPOEMS)46), con la finalidad de contar con información real del estado actual de la POEM a nivel mundial y posteriormente realizar un consenso internacional (América, Europa y Asia) para establecer recomendaciones de manejo46.
Del consenso previo deriva la siguiente información: Actualmente aproximadamente 16 centros endoscópicos distribuidos en todo el mundo están llevando a cabo POEM y con una tasa rápida de expansión. Entre este grupo han publicado 841 casos, donde destacan 25 endoscopistas (11 gastroenterólogos y 14 cirujanos). El 80% lo realiza en una sala de quirófano, el tiempo promedio es de 107min (22-240min), la longitud de la miotomía promedio es de 10cm (2-26cm), con un uso promedio de narcóticos del 40% de los pacientes y estancia hospitalaria promedio de 3.3 días1–18. La acalasia tipo i y ii ocupa el 72% de las indicaciones, mientras que el tipo iii ocupa el 5.4% y otros trastornos motores primarios el 22.5%. Es una técnica nueva y en constante evolución, por lo que los resultados con relación a efectividad, complicaciones y factores de buen y mal pronóstico aún deben tomarse con reserva46.
Indicaciones: Paciente con acalasia, pero solo en centros certificados y con endoscopistas certificados. Se ha determinado su efectividad en espasmo esofágico difuso (EED), esfínter esofágico inferior hipertónico (EEIH) y esófago en cascanueces (EC)47–50.
Extensión de indicaciones: Se ha demostrado su utilidad cuando se realizan miotomía extendidas>10cm, para el tratamiento de trastornos motores primarios del esófago como EED, EC y EEIH47,49–51.
Con relación a pacientes con tratamiento endoscópicos previos con TB o DN, existe poca experiencia en ese sentido pero con adecuados resultados47,51,53. Incluso existe evidencia en pacientes previamente tratados con MH; 7 pacientes hasta el momento con resultados satisfactorios46. Sin embargo, de acuerdo a los expertos en los casos donde hubo tratamientos previos, quienes deben realizar esto son endoscopistas con experiencia en realización de>30 POEM. Respecto al estadio de la acalasia, específicamente estadios avanzados (megaesófago) de la enfermedad, existe poca experiencia en este sentido, sin embargo con resultados satisfactorios caracterizados por éxito técnico y resolución de síntomas46,47 En cuanto a pacientes pediátricos, la evidencia es todavía más escasa, encontrando solamente 2 pacientes reportados, también con buen resultado52,53.
Es un procedimiento que se ha efectuado con éxito en extremos de edad, comorbilidades múltiples o estadio avanzados de la enfermedad, incluso con complicaciones crónicas derivadas de la Acalasia como divertículos epifrénicos, esófagos sigmoideos y megaesófago47.
Objetivo: Realizar una miotomía del EEI (5-10cm) e incluso más extensa (>10cm) en caso de otros trastornos motores esofágicos primarios como son: EED, EEIH y EC.
Quién y dónde: Endoscopista entrenado en procedimientos terapéuticos avanzados. Centros de tercer nivel y certificados en realización de POEM.
En el consenso mencionado se estableció que el paciente debe ser sometido a anestesia general por un anestesista experto. La presión positiva durante la ventilación es esencial ya que minimiza el riesgo de neumotórax masivo o neumomediastino e incluso de neumotórax a tensión. El endoscopista debe tener amplia experiencia y habilidades endoscópicas, como son disección de submucosa, experto en control de sangrado y cierre de perforaciones, así como conocimiento sobre descompresión de neumoperitoneo con aguja. El equipo debe ser el apropiado, ha de contar con unidad electroquirúrgica moderna, uso de dióxido de carbono como gas, monitores de alta definición y con canal accesorio de irrigación; accesorios endoscópicos de corte de última generación y todo lo necesario en accesorios endoscópicos para cierre de enterotomías y control de sangrado. Se debe contar con un equipo quirúrgico disponible al momento y la capacidad para realizar una cirugía en caso de alguna urgencia; esto último se puede mejorar si el procedimiento se lleva a cabo dentro de un quirófano. Incluso en algunos centros se cuenta en «stand-by» con un cirujano experto en cirugía de mínima invasión robótica para la resolución de alguna complicación (p. ej., perforación) y completar del tratamiento para acalasia por la misma vía en el mismo tiempo, de forma mínimamente invasiva47.
Entrenamiento y acreditación: Es necesario un entrenamiento en laboratorio y modelos biológicos con>10 casos y posteriormente>10 casos, asesorado por experto, así como de acuerdo al consenso, en un futuro no muy lejano será necesario una acreditación internacional hospitalaria para realización de POEM (similar a la que se aplica para procedimientos de cirugía bariátrica). También se necesita certificación de endoscopista para la realización de POEM y la obligación de reportar todos los efectos adversos a un órgano central. Todo lo anterior, con la finalidad de garantizar la seguridad del paciente y garantizar una adecuada retroalimentación47.
Efectividad: A pesar del pequeño número de pacientes sometidos a este procedimiento hasta la fecha (aproximadamente 1,000 casos), la información inicial muestra una efectividad similar a la MH. La literatura reporta una resolución de síntomas en más del 90% a 2 años, además de baja morbimortalidad del procedimiento, aunque sus resultados a largo plazo son aun inciertos. De acuerdo al consenso, el promedio de los diferentes grupos informa una eficacia promedio en escala de Eckardt de 6 puntos de mejoría de síntomas, la presión del EEI pre-POEM 44mmHg y post-POEM 16.1mmHg, éxito global del 96.4% (811 pacientes) y un seguimiento promedio de 575 días45,47,49,53–56.
Factor de buen pronóstico: Aún por definir.
Complicaciones: Efectos adversos severos no mortales, neumomediastino, enfisema subcutáneo en el 3.2% (27 pacientes/841), complicaciones menores sin impacto clínico: neumoperitoneo que requirió descompresión con aguja en el 8.3%, neumotórax en el 6%, perforación de mucosa inadvertida en el 6.7%, perforación prematura de la capa muscular al momento de realización del túnel en el 2.4%, hematoma submucoso en el 0.8%, estenosis esofágica en el 0.8% y una mortalidad del 0%47,57.
Seguimiento: Sin cambios en relación con otras modalidades de tratamiento.
Precaución: La realización de POEM tras previa aplicación de TB, DN o MH es factible, pero solo en endoscopistas con experiencia de más de 30 POEM47,57.
Método y técnica endoscópica: En resumen, se deben llevar a cabo los siguientes pasos: 1.- En la pared lateral derecha del esófago, se realiza una inyección submucosa para disecar el espacio submucoso en un punto cercano a 15cm proximales al EEI, seguido de una incisión en la mucosa de aproximadamente 2cm con algún accesorio endoscópico de corte. 2.- El endoscopio se inserta en el espacio submucoso y de forma subsecuente a base de inyección submucosa y corte se genera un túnel submucoso hasta llegar a 2cm distales al cardias y sobre la curvatura menor; otra opción es el uso de un balón dilatador para realizar el túnel submucoso. 3.- Entonces el endoscopio se regresa 2cm distales al sitio de corte de la mucosa, en donde se inicia la miotomía con alguno de los múltiples accesorios endoscópicos para corte (p. ej., Tip Knife, Olympus y T-Hype Hybrid Knife, ERBE); es en este punto donde se diseca el músculo hasta encontrar el plano entre la capa circular interna y la longitudinal externa y es entonces cuando se enganchan las fibras circulares con el accesorio de corte endoscópico hasta continuar la miotomía en sentido caudal y hasta 2cm distales al cardias. Con relación a este punto, Li et al. realizaron un estudio comparativo de 103 pacientes, en donde se comparó el corte de ambas capas musculares frente a solamente la circular, encontrando que no había diferencia en complicaciones, incidencia de reflujo ni efectividad, pero sí un menor tiempo de procedimiento en aquellos en los que solo se seccionan las fibras circulares internas. 4.- Cierre de la mucosa, habitualmente con endoclips u OVESCO (Over the Endoscope Clips) e incluso ahora con el desarrollo de la sutura endoscópica (Apollo endosurgery)47–49.
Comparativos: Se han descrito potenciales ventajas de la POEM sobre la MH. Se anticipa que los resultados serán similares a los de la MH, pero obtenidos de una forma menos invasiva, como se ha demostrado en 2 centros en Alemania y EE. UU., con escaso número de pacientes. La POEM ofrece una extensión de la miotomía a placer del endoscopista, lo cual podría beneficiar a pacientes con otros trastornos motores del esófago como EC, EED o EEIH, con buenos resultados hasta el momento54. Se propone menor lesión al nervio vago y menor incidencia de ERGE al no manipular la membrana frenoesofágica; sin embargo, esta última aseveración está aún pendiente ya que algunos grupos quirúrgicos ven la ERGE post-POEM como la principal desventaja (hasta en un 30%), en donde algunos pacientes requerirán de una nueva intervención pero ahora quirúrgica para la realización de una funduplicatura, situación que hubiera podido realizarse de inicio en un mismo y único procedimiento como una MH+funduplicatura. Finalmente, menor dolor, menor uso de narcóticos y menor tiempo de incapacidad laboral serían potenciales ventajas de la POEM sobre la MH56.
Seguimiento postoperatorio: Al término del procedimiento, se inicia inhibidor de bomba de protones a doble dosis y se realiza tele de tórax. El paciente permanece en ayuno las primeras 24 h, al término se solicita esofagograma para valorar las características del esófago y descartar fuga (perforación), entonces se inicia con dieta líquidos completos y papillas durante una semana, al término se progresa a dieta blanda. No existe consenso sobre una endoscopia alta de «revisión», pero hay quienes la recomiendan. Generalmente los pacientes son dados de alta al tercer día56.
Comparativos en efectividadDilataciones neumáticas frente a toxina botulínicaSe han comparado en estudios aleatorizados; uno de ellos reporta un éxito de DN en un 70% vs. un 32% en TB a 12 meses58. Una revisión de Cochrane reciente que revisó 6 estudios (involucró a 178 pacientes) encontró que a 4 semanas no hay diferencia59, pero en 3 de estos estudios se evaluó a 12 meses, logrando un 70% (DN) vs. un 25% (TB) en resolución de síntomas.
Dilataciones neumáticas frente a miotomía de HellerUna revisión sistemática reciente comparó la efectividad de la miotomía laparoscópica en 3,086 pacientes y DN en 1,065 pacientes, logrando identificar una mejoría significativa en los pacientes con MH en comparación con DN a 12 meses (89% vs. 68%) y a>36 meses (89% vs. 53%)60. Existe también un estudio prospectivo, aleatorizado y multicéntrico europeo que comparó ambas en 200 pacientes con acalasia, y a 2 años no encontraron evidencia significativa a favor de ninguna (92% DN vs. 87% MH); sin embargo se le critica que es a corto plazo, no se especificó claramente la técnica empleada y se reportó una alta incidencia de perforación con MH (12%) muy por encima de lo reportado en la literatura mundial, y por tal motivo se duda de la experiencia del personal quirúrgico13,60. Los comparativos con POEM aún son muy preliminares, como se menciona en el apartado anterior, por lo que hay que esperar más resultados.
Comparativos en costosExisten 3 estudios que han comparado los costos de MH, DN y TB. En uno del 2000, el costo por cura sintomática a 10 años fue de 10,792 USD (MH), de 3,723 USD (TB) y de 3,111 USD (DN)61. En 2002 un estudio de costo-efectividad que evaluaba la calidad de vida en 5 años determinó que el costo de TB, DN y MH fue de 7,011; 7,069; y 21,407 USD respectivamente. El más reciente es del 2007, y comparó MH vs. DN. El costo esperado para MH fue de 10,789 USD comparado con 5,315 USD a 5 años; esto persistió a 10 años, con miotomía en 11,804 USD y DN 7,717 USD. En términos de costo-efectividad, la DN resulta el mejor procedimiento de acuerdo a los escasos y variados estudios realizados62.
Los comparativos de costos con POEM aún son escasos, por lo que habrá que esperas más resultados.
Seguimiento: valoración de efectividad del tratamientoEl seguimiento del paciente tras la realización de procedimientos con intento de resolución de la acalasia es fundamental. Esto puede consistir en la evaluación clínica con el uso de cuestionarios que evalúen síntomas y calidad de vida, y midiendo radiológicamente el tiempo de vaciamiento del bario y el diámetro esofágico. Por vía endoscópica, con el objetivo de detectar complicaciones a largo plazo como megaesófago, cáncer o esofagitis por reflujo. Algunos centros incluso optan por realizar manometrías entre las 4-12 semanas después del tratamiento endoscópico o quirúrgico. Una presión posprocedimiento<15mmHg del EEI es considerada como el mejor factor pronóstico positivo para una buena respuesta a largo plazo. A pesar de lo anterior, no hay evidencia sobre su uso rutinario, pero podría ser de gran utilidad si se planean reintervenciones de un procedimiento endoscópico determinado, como por ejemplo TB o DN. Si a un paciente se le aplicó TB o se le realizó DN y no se logró una presión del EEI<15mmHg, se debería replantear otro tipo de abordaje o evitar la realización del mismo en un segundo intento. Indudablemente en aquel paciente con recurrencia de síntomas a pesar de completar tratamiento, se deberá llevar a cabo una manometría de alta de resolución y también una reevaluación del paciente4,63,64.
VigilanciaLa acalasia es un factor de riesgo para cáncer, sin embargo el riesgo absoluto es bajo y no existe hoy en día un programa de screening establecido. Con relación a la evolución de la enfermedad, al no ser curable, algunos recomiendan seguimiento endoscópico o radiológico, sin embargo aún se necesitan estudios que respalden dicho manejo de forma rutinaria65.
Conclusiones¿Es la POEM o el desarrollo que esta técnica genere el tratamiento de elección para la acalasia y para otros trastornos motores del esófago en el futuro cercano? Solo es cuestión de tiempo.
La acalasia es una enfermedad que ofrece oportunidad para múltiples abordajes dependiendo de la experiencia del equipo médico, de la institución, pero sobre todo de las características del paciente, y que ha permitido la aplicación y desarrollo tecnológico (médicos, endoscópicos y quirúrgicos). Si bien son indiscutibles las ventajas de la DN, su uso debe restringirse para los NO candidatos a cirugía, mientras que la MH es hoy en día el estándar de oro para el tratamiento de la acalasia, que garantiza buenos resultados a largo plazo a través de un abordaje quirúrgico mínimamente invasivo.
En resumen, la acalasia debe pertenecer a un equipo multidisciplinario de radiólogos, gastroenterólogos, endoscopistas y cirujanos. La adecuada selección del paciente y la individualización del tratamiento es la base del éxito.
Conflicto de interesesNo hay conflicto de intereses por parte de los autores.