La eosinofilia es frecuente en viajeros e inmigrantes, siendo las helmintosis su principal etiología. El valor predictivo positivo de la eosinofilia para una infección parasitaria es bajo en viajeros. La eosinofilia puede ser un hallazgo incidental o sintomático, y constituye un reto clínico debido a la baja sensibilidad y especificidad de las técnicas parasitológicas directas e indirectas, respectivamente. Requiere una aproximación estructurada basada en áreas geográficas, riesgos de exposición ambientales y conductuales, y síntomas asociados. La evaluación inicial debe incluir anamnesis y exploración física dirigidas, analítica básica, examen coproparasitológico completo y serología de Strongyloides stercoralis, complementada con otras pruebas según procedencia y sospecha clínica. El tratamiento empírico con albendazol y/o ivermectina (más praziquantel si hay riesgo de esquistosomiasis) es una opción en eosinofilias persistentes no filiadas tras estudio, y en personas en las que la evaluación inicial o el seguimiento no se puedan asegurar. En pacientes con riesgo de estrongiloidosis candidatos a inmunodepresión farmacológica está indicado el cribado y tratamiento previo para prevenir el síndrome de hiperinfestación.
Eosinophilia is a common finding in international travelers and immigrants, being an helmintic infection its main etiology. The positive predictive value of eosinophilia for an helmintosis is low in travellers. Eosinophilia may be an incidental finding, or symptomatic, and it represents a clinical challenge due to the low sensitivity and specificity of direct and indirect parasitological diagnostic tests, respectively. It requires a structured approach based on geographical areas, environmental exposures and behavioral risks, and associated symptoms. The initial assessment should include a comprehensive and tailored anamnesis and physical examination, basic laboratory tests, a complete parasitological examination of stool samples and a Strongyloides stercoralis serology, supplemented with other explorations guided by epidemiological and clinical suspicion. Empiric treatment with albendazole and/or ivermectin (plus praziquantel if risk of schistosomiasis) is an option for unidentified persistent eosinophilia after study, and in persons in whom a proper assessment or follow-up can not be assured. In patients at risk for estrongiloidosis who are candidates for immunosuppressive therapies, it is indicated a prior screening and treatment to prevent a future hyperinfestation syndrome.
Se considera eosinofilia el aumento de los leucocitos eosinófilos en sangre periférica ≥500/μl (o ≥5% del total de leucocitos), y se clasifica como leve (500-999/μl), moderada (1.000-2.999/μl) o intensa (≥3.000/μl), reservándose el término hipereosinofilia para cifras ≥1.500 eosinófilos/μl, que, si son mantenidas, conllevan un potencial daño tisular asociado1. El adjetivo importada hace referencia a que su causa fue adquirida en otro país distinto al que se detecta o se diagnostica. Las causas de eosinofilia son múltiples, tanto primarias (o clonales) como secundarias (o reactivas, más frecuentes)2-4 (tabla 1). En este artículo revisaremos la eosinofilia importada en viajeros intercontinentales con estancias iguales o inferiores a 3semanas (de ahora en adelante, «viajeros») e inmigrantes, particularmente su epidemiología, etiología, fisiopatología y las bases del diagnóstico y del tratamiento.
Causas de eosinofilia en sangre periférica
| Eosinofilias secundarias (reactivas) |
|---|
| Infecciones |
| Parasitosis (fundamentalmente helmintosis) |
| Otras: coccidioidomicosis, HIV, HTLV-I, TBC, lepra, escarlatina |
| Atópicas/alérgicas |
| Dermatitis atópica |
| Asma |
| Rinitis alérgica |
| Aspergilosis broncopulmonar alérgica (ABPA) |
| Reacciones a medicamentos |
| Antibióticos: penicilinas, cefalosporinas, fluoroquinolonas, tetraciclinas, nitrofurantoína, metronidazol |
| Sulfonamidas/sulfonas: dapsona, sulfasalazina, trimetoprim-sulfametoxazol |
| Antirretrovirales: abacavir, nevirapina |
| Antipalúdicos: sulfadoxina-pirimetanina (Fansidar©), cloroquina |
| Antiepilépticos: fenitoína, fenobarbital, carbamazepina, valproato, lamotrigina |
| Antidepresivos: amitriptilina, fluoxetina |
| Antiinflamatorios: AAS, piroxicam, ibuprofeno, naproxeno, diclofenaco, colchicina |
| Antihipertensivos: hidroclortiacida, bloqueadores beta, IECA |
| Otros: alopurinol, ranitidina, ciclosporina A |
| Enfermedades reumatológicas e inmunológicas |
| Enfermedad de Churg-Strauss (eosinophilic granulomatosis with polyangyitis (EPGA) |
| Otras enfermedades autoinmunes (enfermedad de Wegener, artritis reumatoide, LES…) |
| Sinovitis idiopática eosinofílica |
| Fascitis difusa con eosinofilia |
| Miositis eosinofílica |
| Síndrome eosinofilia-mialgia |
| Síndrome de hiperIgE |
| Enfermedad por IgG-4 |
| Síndrome de Ommen |
| Síndrome de Gleich (angioedema episódico y esosinofilia) |
| Enfermedades inmunológicas con afectación predominante de órgano |
| Enfermedades gastrointestinales eosinofílicas |
| Esofagitis eosinofílica |
| Gastritis eosinofílica |
| Gastroenteritis eosinofílica |
| Colitis eosinofílica |
| Otras: enfermedad celiaca, enfermedad inflamatoria intestinal |
| Neumonía eosinofílica idiopática (aguda o crónica) |
| Meningitis eosinofílica idiopática |
| Miocarditis eosinofílica |
| Cistitis eosinofílica |
| Cutáneas: dermatitis herpetiforme, pénfigo, penfigoide ampolloso, enfermedad de Kimura, hiperplasia angiolinfoide con eosinofilia, síndrome de Wells, síndrome NERDS… |
| Neoplasias no mieloides |
| Linfomas (especialmente enfermedad de Hodgkin y linfomas de células T) |
| Otros: leucemia linfoblástica aguda, adenocarcinomas, carcinomas de células escamosasa |
| Enfermedades endocrinometabólicas |
| Insuficiencia suprarrenal |
| Embolismos de colesterol |
| Otras |
| Sarcoidosis |
| Anemia perniciosa |
| Enfermedad de injerto contra huésped, rechazo del injerto |
| Irradiación |
| Intoxicación por metales pesados |
| Eosinofilias primarias (clonales) |
| Leucemia mieloide aguda |
| Neoplasias mieloproliferativas |
| Síndrome mielodisplásico (SMD) |
| Formas mieloproliferativas de HES (con anomalías de los genes PDGFRA, PDGFRB, FGFR1). |
| Formas linfoproliferativas de HES (poblaciones aberrantes de células T, las más frecuentes CD3–/CD4+) |
| Síndrome hipereosinofílico idiopático (HES) |
La prevalencia de eosinofilia importada oscila sobre el 8-10% de los viajeros5 y el 12-53% de inmigrantes y refugiados6. A diferencia de la población general de los países desarrollados, las parasitosis (y especialmente las helmintosis) constituyen la principal etiología de la eosinofilia importada.
En la población general, la eosinofilia per se tiene un valor predictivo positivo (VPP) bajo para la existencia de una parasitosis subyacente. Como otros biomarcadores, su VPP aumenta en poblaciones con probabilidad pre-test elevada de padecer una parasitosis, como en viajeros e inmigrantes, donde la detección de una eosinofilia (sobre todo si es de reciente aparición) sugiere una helmintosis, sin olvidar por ello otras etiologías no infecciosas7.
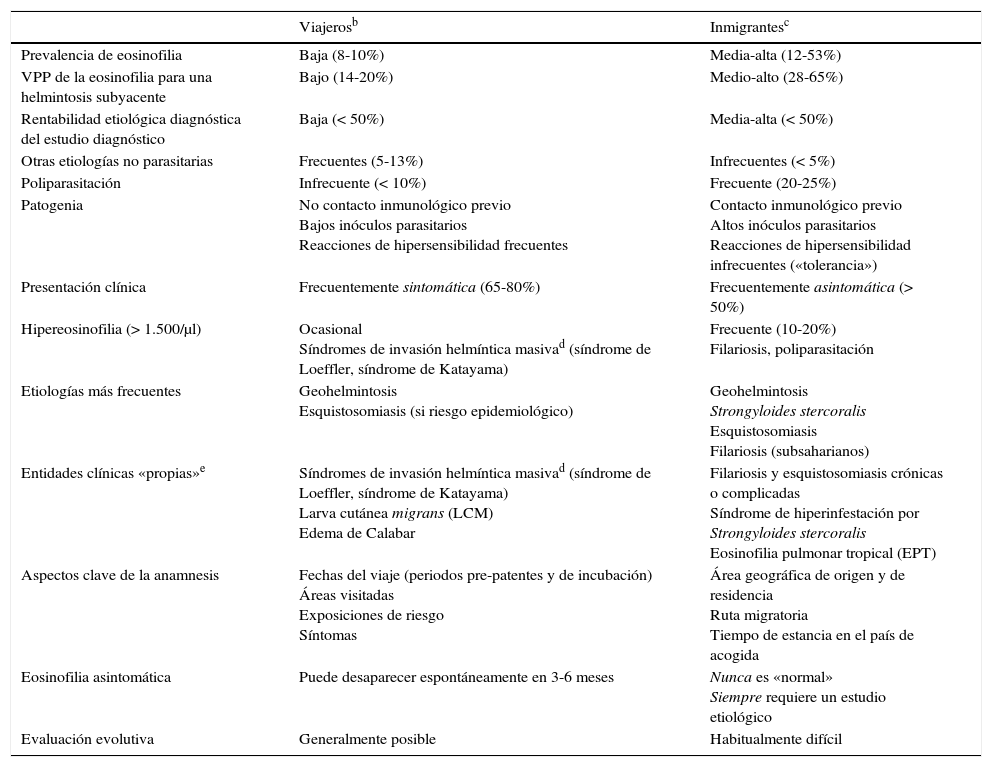
No obstante, en viajeros e inmigrantes no toda eosinofilia es debida a una parasitosis subyacente. En viajeros, el VPP de la eosinofilia como marcador de parasitosis es bajo (14-20%)8,9 y la rentabilidad diagnóstica de su estudio etiológico suele ser inferior al 50%8. Adicionalmente, su ausencia tampoco permite descartarla, debido a la existencia de un elevado número de falsos negativos: en muchas helmintosis la eosinofilia es intermitente, y los métodos de diagnóstico parasitológico poseen importantes limitaciones de sensibilidad y especificidad. Por el contrario, en inmigrantes el VPP de la eosinofilia como biomarcador de infección parasitaria es superior (28-65%)10-13, al presentar una mayor prevalencia de eosinofilia importada y parasitosis subyacentes (es decir, una mayor probabilidad pre-test) debido a una exposición más prolongada, una carga parasitaria potencialmente más elevada y una mayor frecuencia de helmintosis crónicas (Strongyloides stercoralis, Schistosoma spp. y filariosis). El valor de la elevación de la IgE en suelo como biomarcador de parasitosis es controvertido13,14. En la tabla 2 se muestran las principales diferencias entre la eosinofilia importada del viajero y la del inmigrante.
Eosinofilia importada: diferencias entre viajeros e inmigrantesa
| Viajerosb | Inmigrantesc | |
|---|---|---|
| Prevalencia de eosinofilia | Baja (8-10%) | Media-alta (12-53%) |
| VPP de la eosinofilia para una helmintosis subyacente | Bajo (14-20%) | Medio-alto (28-65%) |
| Rentabilidad etiológica diagnóstica del estudio diagnóstico | Baja (< 50%) | Media-alta (< 50%) |
| Otras etiologías no parasitarias | Frecuentes (5-13%) | Infrecuentes (< 5%) |
| Poliparasitación | Infrecuente (< 10%) | Frecuente (20-25%) |
| Patogenia | No contacto inmunológico previo Bajos inóculos parasitarios Reacciones de hipersensibilidad frecuentes | Contacto inmunológico previo Altos inóculos parasitarios Reacciones de hipersensibilidad infrecuentes («tolerancia») |
| Presentación clínica | Frecuentemente sintomática (65-80%) | Frecuentemente asintomática (> 50%) |
| Hipereosinofilia (> 1.500/μl) | Ocasional Síndromes de invasión helmíntica masivad (síndrome de Loeffler, síndrome de Katayama) | Frecuente (10-20%) Filariosis, poliparasitación |
| Etiologías más frecuentes | Geohelmintosis Esquistosomiasis (si riesgo epidemiológico) | Geohelmintosis Strongyloides stercoralis Esquistosomiasis Filariosis (subsaharianos) |
| Entidades clínicas «propias»e | Síndromes de invasión helmíntica masivad (síndrome de Loeffler, síndrome de Katayama) Larva cutánea migrans (LCM) Edema de Calabar | Filariosis y esquistosomiasis crónicas o complicadas Síndrome de hiperinfestación por Strongyloides stercoralis Eosinofilia pulmonar tropical (EPT) |
| Aspectos clave de la anamnesis | Fechas del viaje (periodos pre-patentes y de incubación) Áreas visitadas Exposiciones de riesgo Síntomas | Área geográfica de origen y de residencia Ruta migratoria Tiempo de estancia en el país de acogida |
| Eosinofilia asintomática | Puede desaparecer espontáneamente en 3-6 meses | Nunca es «normal» Siempre requiere un estudio etiológico |
| Evaluación evolutiva | Generalmente posible | Habitualmente difícil |
VPP: valor predictivo positivo.
La etiología más frecuente de eosinofilia importada son las helmintosis, y dentro de ellas, las tisulares, las hemáticas y aquellas con fase de migración larvaria. Las infecciones por helmintos intestinales y por cestodos tisulares (p.ej., hidatidosis o cisticercosis), algunas prototozoosis (Cystoisospora belli, previamente Isospora belli, Dientamoeba fragilis y Sarcocystis spp.), micosis endémicas (Coccidiodes spp. y Paracoccidioides brasiliensis) y ectoparasitosis (p.ej., sarna y miosis) son otras causas de eosinofilia importada, aunque menos comunes y frecuentemente transitorias y/o de grado leve. En las diversas series clínicas de casos publicadas de eosinofilia importada en viajeros9,15-19, inmigrantes10-13,20-22, o en poblaciones mixtas23, los principales helmintos detectados son, en diferente orden de frecuencia, geohelmintos (Ascaris spp., Trichuris trichiura y uncinarias: Ancylostoma duodenale y Necator americanus), S.stercoralis, Schistosoma spp. (siendo Schistosoma haematobium el más frecuente), y en pacientes que hayan viajado o procedan de África subsahariana, las filariosis (la loaosis en viajeros y las infecciones por Mansonella perstans y Onchocerca volvulus en inmigrantes).
Las campañas de tratamiento «en masa» o poblacionales en áreas endémicas frente a geohelmintos, filariosis linfáticas, oncocercosis y esquistosomiasis, integradas en programas de control específicos24, están cambiando continuamente el escenario epidemiológico25 y clínico. A modo de ejemplo, el número de casos de oncocercosis diagnosticados anualmente en una unidad de medicina tropical de referencia española experimentó un descenso significativo entre 1990-200526.
Fisiopatología de la eosinofilia importadaMuchas de las controversias y áreas de incertidumbre en la eosinofilia importada derivan de su fisiopatología, cuyo conocimiento es incompleto. Los eosinófilos son células multifuncionales predominantemente tisulares (especialmente abundantes en la mucosa gastrointestinal) que participan en la respuesta inmune innata y en las respuestas inmunológicas adaptativas tipo Th1 y Th2, siendo esta última la primordial frente a helmintosis y reacciones alérgicas. La activación de los eosinófilos resulta en su triple función como células citotóxicas (mediante la liberación de las proteínas básicas contenidas en sus gránulos inducida por la IL-5 e IgE, el principal mecanismo de defensa antiparasitario), pro-inflamatorias (ampliando la cascada inflamatoria a través del reclutamiento de otras células) e inmunomoduladoras (con capacidad de orientar la respuesta inmunológica adaptativa hacia un perfil Th1 o Th2)27-29.
En la hipereosinofilia (≥1.500 eosinófilos/μl) persistente, independientemente de su carácter primario (clonal) o secundario (reactivo), la activación de los eosinófilos puede resultar lesiva para los propios tejidos del huésped, especialmente a nivel cardiaco (fibrosis endomiocárdica y miocarditis eosinofílica) pero también en piel, tracto gastrointestinal, pulmones y sistema nervioso1.
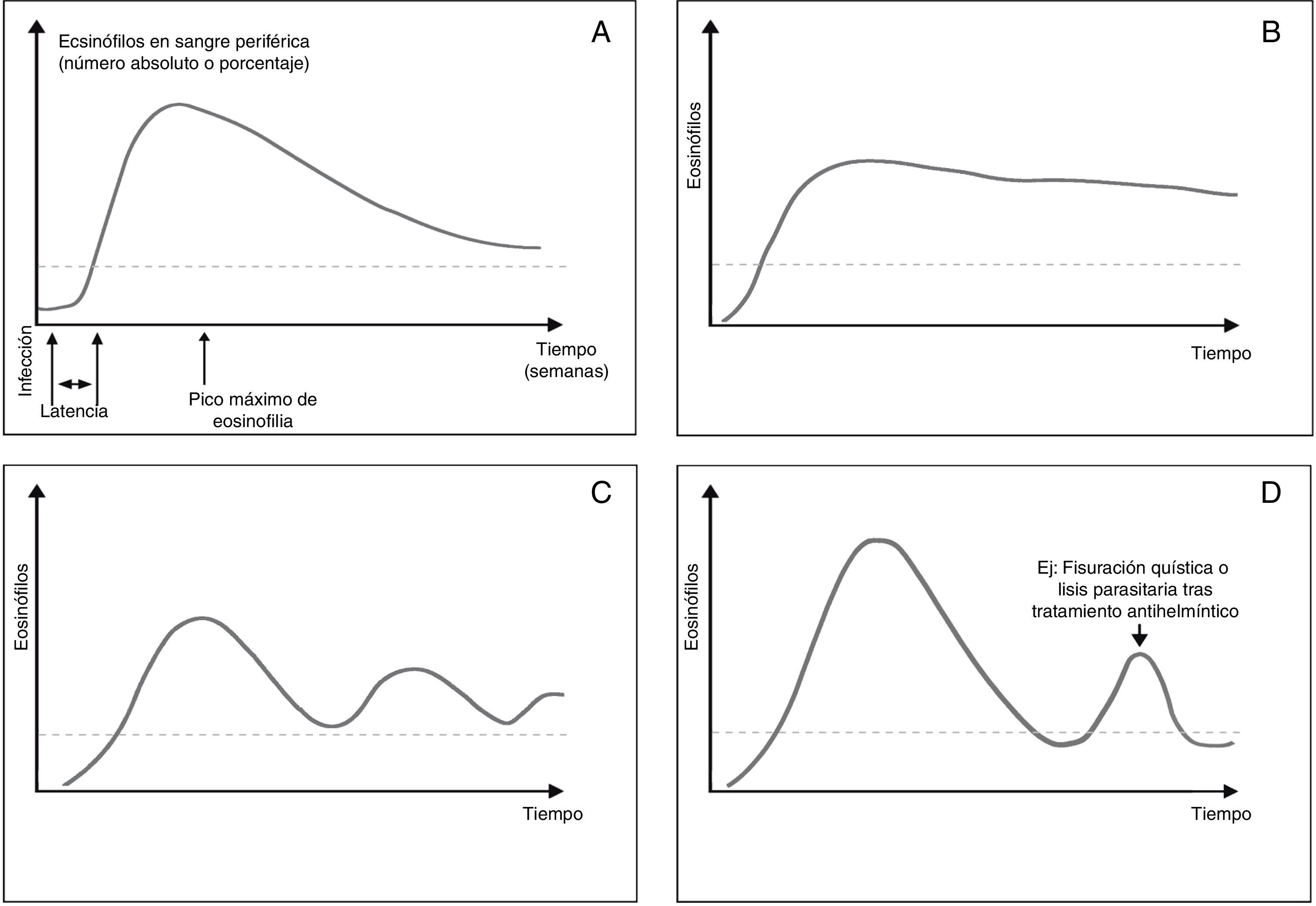
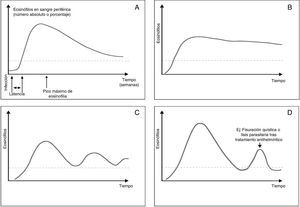
El grado y la expresividad clínica de la eosinofilia parasitaria dependen de varios factores: 1)la existencia o no de inmunidad previa en el huésped (la mayoría de viajeros suelen ser «inmunológicamente vírgenes», resultando en una eosinofilia más intensa y sintomática, mientras que en inmigrantes esta es, con frecuencia, asintomática); 2)la carga parasitaria y la duración de la infección (generalmente más elevadas y prolongadas en inmigrantes, siendo frecuentes en ellos las co-infecciones múltiples o poliparasitaciones); 3)el ciclo biológico de cada parásito, que determina los diferentes tipos de cinéticas o curvas temporales de la eosinofilia parasitaria30,31, tal como se muestran en la figura 1 y en la tabla 3) las interacciones inmunológicas parásito-hospedador. La intensidad aislada de la eosinofilia rara vez se correlaciona u orienta hacia su etiología, excepto en cifras extremas. La intensidad de la eosinofilia tiende a ser más elevada en los pacientes poliparasitados11,13,17 y en aquellos con filariosis frente a los infectados por geohelmintos o Schistosoma spp.10,11.
Tipos de cinéticas o curvas temporales de la eosinofilia parasitaria. A)«Clásica» o de Lavier (p.ej., Ascaris lumbricoides); B)«mantenida» (p.ej., filariosis, Fasciola hepatica); C)«fluctuante» (p.ej., Strongyloides stercoralis); D)«episódica» (p.ej., tras fisuración de un quiste parasitario o en el «síndrome de lisis parasitaria» tras tratamiento).
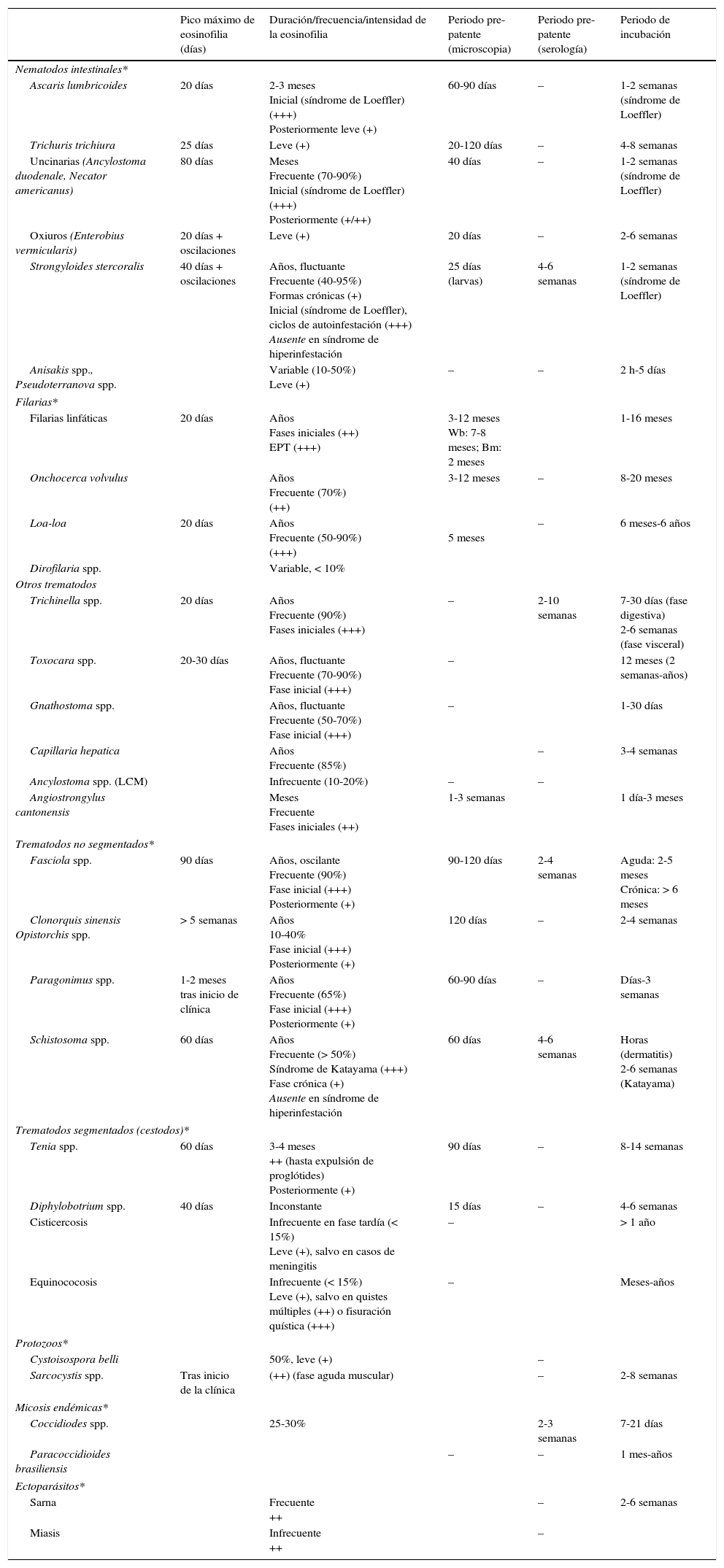
Eosinofilia importada: características, periodos pre-patentes y de incubación
| Pico máximo de eosinofilia (días) | Duración/frecuencia/intensidad de la eosinofilia | Periodo pre-patente (microscopia) | Periodo pre-patente (serología) | Periodo de incubación | |
|---|---|---|---|---|---|
| Nematodos intestinales* | |||||
| Ascaris lumbricoides | 20 días | 2-3 meses Inicial (síndrome de Loeffler) (+++) Posteriormente leve (+) | 60-90 días | – | 1-2 semanas (síndrome de Loeffler) |
| Trichuris trichiura | 25 días | Leve (+) | 20-120 días | – | 4-8 semanas |
| Uncinarias (Ancylostoma duodenale, Necator americanus) | 80 días | Meses Frecuente (70-90%) Inicial (síndrome de Loeffler) (+++) Posteriormente (+/++) | 40 días | – | 1-2 semanas (síndrome de Loeffler) |
| Oxiuros (Enterobius vermicularis) | 20 días + oscilaciones | Leve (+) | 20 días | – | 2-6 semanas |
| Strongyloides stercoralis | 40 días + oscilaciones | Años, fluctuante Frecuente (40-95%) Formas crónicas (+) Inicial (síndrome de Loeffler), ciclos de autoinfestación (+++) Ausente en síndrome de hiperinfestación | 25 días (larvas) | 4-6 semanas | 1-2 semanas (síndrome de Loeffler) |
| Anisakis spp., Pseudoterranova spp. | Variable (10-50%) Leve (+) | – | – | 2 h-5 días | |
| Filarias* | |||||
| Filarias linfáticas | 20 días | Años Fases iniciales (++) EPT (+++) | 3-12 meses Wb: 7-8 meses; Bm: 2 meses | 1-16 meses | |
| Onchocerca volvulus | Años Frecuente (70%) (++) | 3-12 meses | – | 8-20 meses | |
| Loa-loa | 20 días | Años Frecuente (50-90%) (+++) | 5 meses | – | 6 meses-6 años |
| Dirofilaria spp. | Variable, < 10% | ||||
| Otros trematodos | |||||
| Trichinella spp. | 20 días | Años Frecuente (90%) Fases iniciales (+++) | – | 2-10 semanas | 7-30 días (fase digestiva) 2-6 semanas (fase visceral) |
| Toxocara spp. | 20-30 días | Años, fluctuante Frecuente (70-90%) Fase inicial (+++) | – | 12 meses (2 semanas-años) | |
| Gnathostoma spp. | Años, fluctuante Frecuente (50-70%) Fase inicial (+++) | – | 1-30 días | ||
| Capillaria hepatica | Años Frecuente (85%) | – | 3-4 semanas | ||
| Ancylostoma spp. (LCM) | Infrecuente (10-20%) | – | – | ||
| Angiostrongylus cantonensis | Meses Frecuente Fases iniciales (++) | 1-3 semanas | 1 día-3 meses | ||
| Trematodos no segmentados* | |||||
| Fasciola spp. | 90 días | Años, oscilante Frecuente (90%) Fase inicial (+++) Posteriormente (+) | 90-120 días | 2-4 semanas | Aguda: 2-5 meses Crónica: > 6 meses |
| Clonorquis sinensis Opistorchis spp. | > 5 semanas | Años 10-40% Fase inicial (+++) Posteriormente (+) | 120 días | – | 2-4 semanas |
| Paragonimus spp. | 1-2 meses tras inicio de clínica | Años Frecuente (65%) Fase inicial (+++) Posteriormente (+) | 60-90 días | – | Días-3 semanas |
| Schistosoma spp. | 60 días | Años Frecuente (> 50%) Síndrome de Katayama (+++) Fase crónica (+) Ausente en síndrome de hiperinfestación | 60 días | 4-6 semanas | Horas (dermatitis) 2-6 semanas (Katayama) |
| Trematodos segmentados (cestodos)* | |||||
| Tenia spp. | 60 días | 3-4 meses ++ (hasta expulsión de proglótides) Posteriormente (+) | 90 días | – | 8-14 semanas |
| Diphylobotrium spp. | 40 días | Inconstante | 15 días | – | 4-6 semanas |
| Cisticercosis | Infrecuente en fase tardía (< 15%) Leve (+), salvo en casos de meningitis | – | > 1 año | ||
| Equinococosis | Infrecuente (< 15%) Leve (+), salvo en quistes múltiples (++) o fisuración quística (+++) | – | Meses-años | ||
| Protozoos* | |||||
| Cystoisospora belli | 50%, leve (+) | – | |||
| Sarcocystis spp. | Tras inicio de la clínica | (++) (fase aguda muscular) | – | 2-8 semanas | |
| Micosis endémicas* | |||||
| Coccidiodes spp. | 25-30% | 2-3 semanas | 7-21 días | ||
| Paracoccidioides brasiliensis | – | – | 1 mes-años | ||
| Ectoparásitos* | |||||
| Sarna | Frecuente ++ | – | 2-6 semanas | ||
| Miasis | Infrecuente ++ | – | |||
Bm: Brugia malayi; EPT: eosinofilia pulmonar tropical; LCM: larva cutánea migrans; Wb: Wuchereria bancroftii.
Intensidad de la eosinofilia:
(+): 450-1.000/μl.
(++): 1.000-3.000/μl.
(+++): > 3.000/μl.
Fuente: adaptado de Ehrhardt y Gerd14, Meltzer et al.18, Bourée30, Anane31, Leder y Weller35, Checkley et al.36 y O’Connell y Nutman37.
* «Subgrupos» de etiologías (helmintos, protozoos, ectoparásitos u hongos).
Por último, la inmunomodulación inducida por helmintos puede resultar no solo beneficiosa para el propio parásito (mediante mecanismos de evasión inmune)32, sino protectora para el huésped frente a respuestas alérgicas y autoinmunes (hipótesis higiénica)33,34.
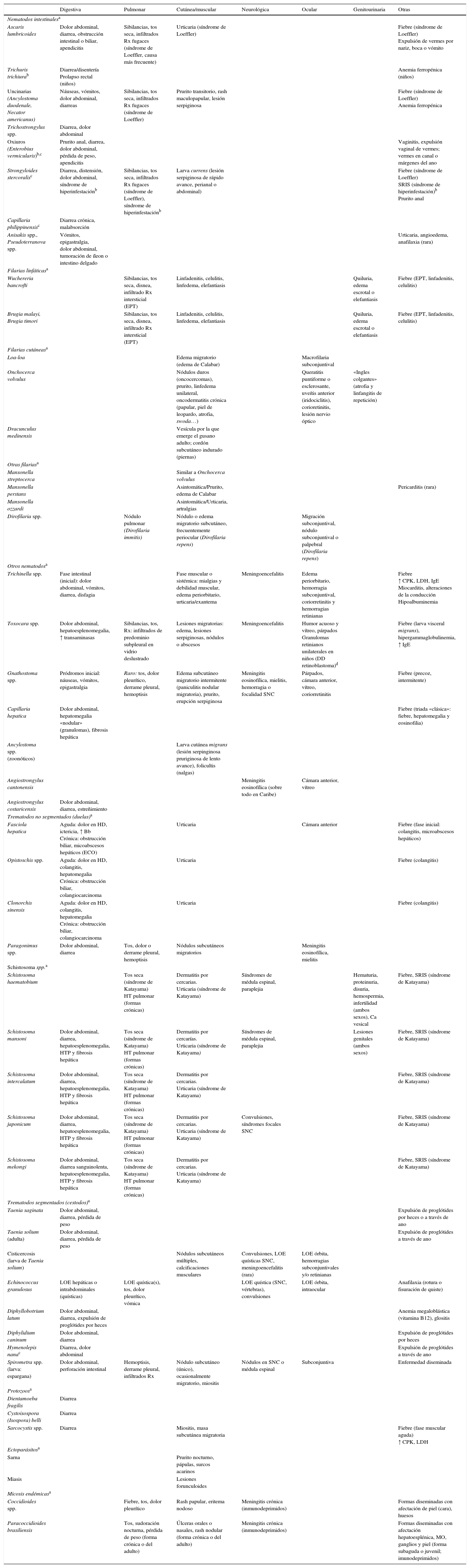
Manifestaciones clínicasLas manifestaciones clínicas de las múltiples causas de la eosinofilia importada son extraordinariamente variadas y pueden afectar a todos los órganos y sistemas. En la tabla 3 se muestran las características de la eosinofilia importada y los períodos pre-patente y de incubación de las principales etiologías implicadas, de gran utilidad diagnóstica, y en la tabla 4, sus principales presentaciones clínicas según etiología. Algunas de ellas requieren un breve comentario más detallado.
Principales presentaciones clínicas de la eosinofilia importada según etiología
| Digestiva | Pulmonar | Cutánea/muscular | Neurológica | Ocular | Genitourinaria | Otras | |
|---|---|---|---|---|---|---|---|
| Nematodos intestinalesa | |||||||
| Ascaris lumbricoides | Dolor abdominal, diarrea, obstrucción intestinal o biliar, apendicitis | Sibilancias, tos seca, infiltrados Rx fugaces (síndrome de Loeffler, causa más frecuente) | Urticaria (síndrome de Loeffler) | Fiebre (síndrome de Loeffler) Expulsión de vermes por nariz, boca o vómito | |||
| Trichuris trichiurab | Diarrea/disentería Prolapso rectal (niños) | Anemia ferropénica (niños) | |||||
| Uncinarias (Ancylostoma duodenale, Necator americanus) | Náuseas, vómitos, dolor abdominal, diarreas | Sibilancias, tos seca, infiltrados Rx fugaces (síndrome de Loeffler) | Prurito transitorio, rash maculopapular, lesión serpiginosa | Fiebre (síndrome de Loeffler) Anemia ferropénica | |||
| Trichostrongylus spp. | Diarrea, dolor abdominal | ||||||
| Oxiuros (Enterobius vermicularis)b,c | Prurito anal, diarrea, dolor abdominal, pérdida de peso, apendicitis | Vaginitis, expulsión vaginal de vermes; vermes en canal o márgenes del ano | |||||
| Strongyloides stercoralisc | Diarrea, distensión, dolor abdominal, síndrome de hiperinfestaciónb | Sibilancias, tos seca, infiltrados Rx fugaces (síndrome de Loeffler), síndrome de hiperinfestaciónb | Larva currens (lesión serpiginosa de rápido avance, perianal o abdominal) | Fiebre (síndrome de Loeffler) SRIS (síndrome de hiperinfestación)b Prurito anal | |||
| Capillaria philippinensisc | Diarrea crónica, malabsorción | ||||||
| Anisakis spp., Pseudoterranova spp. | Vómitos, epigastralgia, dolor abdominal, tumoración de íleon o intestino delgado | Urticaria, angioedema, anafilaxia (rara) | |||||
| Filarias linfáticasa | |||||||
| Wuchereria bancrofti | Sibilancias, tos seca, disnea, infiltrado Rx intersticial (EPT) | Linfadenitis, celulitis, linfedema, elefantiasis | Quiluria, edema escrotal o elefantiasis | Fiebre (EPT, linfadenitis, celulitis) | |||
| Brugia malayi, Brugia timori | Sibilancias, tos seca, disnea, infiltrado Rx intersticial (EPT) | Linfadenitis, celulitis, linfedema, elefantiasis | Quiluria, edema escrotal o elefantiasis | Fiebre (EPT, linfadenitis, celulitis) | |||
| Filarias cutáneasa | |||||||
| Loa-loa | Edema migratorio (edema de Calabar) | Macrofilaria subconjuntival | |||||
| Onchocerca volvulus | Nódulos duros (oncocercomas), prurito, linfedema unilateral, oncodermatitis crónica (papular, piel de leopardo, atrofia, swoda…) | Queratitis puntiforme o esclerosante, uveítis anterior (iridociclitis), corioretinitis, lesión nervio óptico | «Ingles colgantes» (atrofia y linfangitis de repetición) | ||||
| Dracunculus medinensis | Vesícula por la que emerge el gusano adulto; cordón subcutáneo indurado (piernas) | ||||||
| Otras filariasa | |||||||
| Mansonella streptocerca | Similar a Onchocerca volvulus | ||||||
| Mansonella perstans | Asintomática/Prurito, edema de Calabar | Pericarditis (rara) | |||||
| Mansonella ozzardi | Asintomática/Urticaria, artralgias | ||||||
| Dirofilaria spp. | Nódulo pulmonar (Dirofilaria immitis) | Nódulo o edema migratorio subcutáneo, frecuentemente periocular (Dirofilaria repens) | Migración subconjuntival, nódulo subconjuntival o palpebral (Dirofilaria repens) | ||||
| Otros nematodosa | |||||||
| Trichinella spp. | Fase intestinal (inicial): dolor abdominal, vómitos, diarrea, disfagia | Fase muscular o sistémica: mialgias y debilidad muscular, edema periorbitario, urticaria/exantema | Meningoencefalitis | Edema periorbitario, hemorragia subconjuntival, coriorretinitis y hemorragias retinianas | Fiebre ↑ CPK, LDH, IgE Miocarditis, alteraciones de la conducción Hipoalbuminemia | ||
| Toxocara spp. | Dolor abdominal, hepatoesplenomegalia, ↑ transaminasas | Sibilancias, tos, Rx: infiltrados de predominio subpleural en vidrio deslustrado | Lesiones migratorias: edema, lesiones serpiginosas, nódulos o abscesos | Meningoencefalitis | Humor acuoso y vítreo, párpados Granulomas retinianos unilaterales en niños (DD retinoblastoma)d | Fiebre (larva visceral migrans), hipergammaglobulinemia, ↑ IgE | |
| Gnathostoma spp. | Pródromos inicial: náuseas, vómitos, epigastralgia | Raro: tos, dolor pleurítico, derrame pleural, hemoptisis | Edema subcutáneo migratorio intermitente (paniculitis nodular migratoria), prurito, erupción serpiginosa | Meningitis eosinofílica, mielitis, hemorragia o focalidad SNC | Párpados, cámara anterior, vítreo, coriorretinitis | Fiebre (precoz, intermitente) | |
| Capillaria hepatica | Dolor abdominal, hepatomegalia «nodular» (granulomas), fibrosis hepática | Fiebre (triada «clásica»: fiebre, hepatomegalia y eosinofilia) | |||||
| Ancylostoma spp. (zoonóticos) | Larva cutánea migrans (lesión serpinginosa pruriginosa de lento avance), folicultis (nalgas) | ||||||
| Angiostrongylus cantonensis | Meningitis eosinofílica (sobre todo en Caribe) | Cámara anterior, vítreo | |||||
| Angiostrongylus costaricensis | Dolor abdominal, diarrea, estreñimiento | ||||||
| Trematodos no segmentados (duelas)a | |||||||
| Fasciola hepatica | Aguda: dolor en HD, ictericia, ↑ Bb Crónica: obstrucción biliar, micoabscesos hepáticos (ECO) | Urticaria | Cámara anterior | Fiebre (fase inicial: colangitis, microabscesos hepáticos) | |||
| Opistoschis spp. | Aguda: dolor en HD, colangitis, hepatomegalia Crónica: obstrucción biliar, colangiocarcinoma | Urticaria | Fiebre (colangitis) | ||||
| Clonorchis sinensis | Aguda: dolor en HD, colangitis, hepatomegalia Crónica: obstrucción biliar, colangiocarcinoma | Urticaria | Fiebre (colangitis) | ||||
| Paragonimus spp. | Dolor abdominal, diarrea | Tos, dolor o derrame pleural, hemoptisis | Nódulos subcutáneos migratorios | Meningitis eosinofílica, mielitis | |||
| Schistosoma spp.a | |||||||
| Schistosoma haematobium | Tos seca (síndrome de Katayama) HT pulmonar (formas crónicas) | Dermatitis por cercarias. Urticaria (síndrome de Katayama) | Síndromes de médula espinal, paraplejia | Hematuria, proteinuria, disuria, hemospermia, infertilidad (ambos sexos), Ca vesical | Fiebre, SRIS (síndrome de Katayama) | ||
| Schistosoma mansoni | Dolor abdominal, diarrea, hepatoesplenomegalia, HTP y fibrosis hepática | Tos seca (síndrome de Katayama) HT pulmonar (formas crónicas) | Dermatitis por cercarías. Urticaria (síndrome de Katayama) | Síndromes de médula espinal, paraplejia | Lesiones genitales (ambos sexos) | Fiebre, SRIS (síndrome de Katayama) | |
| Schistosoma intercalatum | Dolor abdominal, diarrea, hepatoesplenomegalia, HTP y fibrosis hepática | Tos seca (síndrome de Katayama) HT pulmonar (formas crónicas) | Dermatitis por cercarias. Urticaria (síndrome de Katayama) | Fiebre, SRIS (síndrome de Katayama) | |||
| Schistosoma japonicum | Dolor abdominal, diarrea, hepatoesplenomegalia, HTP y fibrosis hepática | Tos seca (síndrome de Katayama) HT pulmonar (formas crónicas) | Dermatitis por cercarias. Urticaria (síndrome de Katayama) | Convulsiones, síndromes focales SNC | Fiebre, SRIS (síndrome de Katayama) | ||
| Schistosoma mekongi | Dolor abdominal, diarrea sanguinolenta, hepatoesplenomegalia, HTP y fibrosis hepática | Tos seca (síndrome de Katayama) HT pulmonar (formas crónicas) | Dermatitis por cercarias. Urticaria (síndrome de Katayama) | Fiebre, SRIS (síndrome de Katayama) | |||
| Trematodos segmentados (cestodos)a | |||||||
| Taenia saginata | Dolor abdominal, diarrea, pérdida de peso | Expulsión de proglótides por heces o a través de ano | |||||
| Taenia solium (adulta) | Dolor abdominal, diarrea, pérdida de peso | Expulsión de proglótides a través de ano | |||||
| Cisticercosis (larva de Taenia solium) | Nódulos subcutáneos múltiples, calcificaciones musculares | Convulsiones, LOE quísticas SNC, meningoencefalitis (rara) | LOE órbita, hemorragias subconjuntivales y/o retinianas | ||||
| Echinococcus granulosus | LOE hepáticas o intrabdominales (quísticas) | LOE quística(s), tos, dolor pleurítico, vómica | LOE quística (SNC, vértebras), convulsiones | LOE órbita, intraocular | Anafilaxia (rotura o fisuración de quiste) | ||
| Diphyllobotrium latum | Dolor abdominal, diarrea, expulsión de proglótides por heces | Anemia megaloblástica (vitamina B12), glositis | |||||
| Diphylidium caninum | Dolor abdominal, diarrea | Expulsión de proglótides por heces | |||||
| Hymenolepis nanac | Diarrea, dolor abdominal | Expulsión de proglótides a través de ano | |||||
| Spirometra spp. (larva: espargana) | Dolor abdominal, perforación intestinal | Hemoptisis, derrame pleural, infiltrados Rx | Nódulo subcutáneo (único), ocasionalmente migratorio, miositis | Nódulos en SNC o médula espinal | Subconjuntiva | Enfermedad diseminada | |
| Protozoosa | |||||||
| Dientamoeba fragilis | Diarrea | ||||||
| Cystoisospora (Isospora) belli | Diarrea | ||||||
| Sarcocystis spp. | Diarrea | Miositis, masa subcutánea migratoria | Fiebre (fase muscular aguda) ↑ CPK, LDH | ||||
| Ectoparásitosa | |||||||
| Sarna | Prurito nocturno, pápulas, surcos acarinos | ||||||
| Miasis | Lesiones forunculoides | ||||||
| Micosis endémicasa | |||||||
| Coccidioides spp. | Fiebre, tos, dolor pleurítico | Rash papular, eritema nodoso | Meningitis crónica (inmunodeprimidos) | Formas diseminadas con afectación de piel (cara), huesos | |||
| Paracoccidioides brasiliensis | Tos, sudoración nocturna, pérdida de peso (forma crónica o del adulto) | Úlceras orales o nasales, rash nodular (forma crónica o del adulto) | Meningitis crónica (inmunodeprimidos) | Formas diseminadas con afectación hepatoesplénica, MO, ganglios y piel (forma subaguda o juvenil; imunodeprimidos) | |||
Bb: bilirrubina; CPK: creatina-fosfocinasa; DD: diagnóstico diferencial; ECO: ecografía; EPT: eosinofilia pulmonar tropical; HD: hipocondrio derecho; HT: hipertensión; HTP: hipertensión portal; LDH: lactato-deshidrogenasa; LOE: lesión ocupante de espacio; Rx: radiografía de tórax; SIRS: síndrome de respuesta inflamatoria sistémica.
Fuente: adaptado de Ehrhardt y Gerd14, Leder y Weller35, Checkley et al.36 y O’Connell y Nutman37.
Los denominados síndromes de invasión helmíntica masiva7 son cuadros clínicos agudos originados por la liberación masiva de antígenos parasitarios en la fase de migración larvaria tisular capaces de inducir una reacción de hipersensibilidad tipoi en el huésped potencialmente grave. Los 2 ejemplos clásicos son el síndrome de Loeffler34,38 (por geohelmintos con migración larvaria transpulmonar, como Ascaris spp. y uncinarias, y, en menor medida, por S.stercoralis), y la esquistosomiasis aguda (síndrome, enfermedad o fiebre de Katayama)37,39. Otros son la fase aguda de las infecciones por trematodos biliares o por filarias linfáticas, o de algunos nematodos tisulares (Toxocara spp., Trichinella spp. y Gnathostoma spp.). Estos cuadros son propios de los viajeros, aparecen precozmente tras la infección inicial (1-3semanas para el síndrome de Loeffler, 3-4semanas para el de Katayama) y se caracterizan por una eosinofilia muy intensa (habitualmente >3.000/μl) que acompaña al resto de los síntomas (neumonitis aguda en el síndrome de Loeffler; urticaria y afectación sistémica y multiorgánica en de Katayama; colangitis aguda en las trematodosis o duelas hepatobiliares; celulitis y linfangitis aguda en las filariosis linfáticas). Estos síndromes son excepcionales en inmigrantes adultos, aunque sí pueden observarse en niños, reflejando diferencias en la carga acumulativa parasitaria secundaria al grado y al tipo de exposición40.
El contrapunto a los síndromes de invasión helmíntica masiva en los inmigrantes adultos lo constituyen las formas crónicas de algunas helmintosis. En ellas, tanto la exposición prolongada (mantenida o repetida) como los mecanismos inmunes (relación parásito-hospedador, mecanismos de evasión inmune y daño de los órganos diana) juegan un papel patogénico importante32. Así, las infecciones crónicas por esquistosomas y filarias linfáticas pueden presentar un amplio espectro clínico en residentes en áreas endémicas, desde formas prácticamente asintomáticas («fenotipo tolerante») a otras caracterizadas por un importante daño tisular inmunomediado (fibrosis hepática y elefantiasis, respectivamente). Otro ejemplo demostrativo es la eosinofilia pulmonar tropical, mediada por una respuesta inmunológica excesiva frente a las microfilarias linfáticas pulmonares en zonas endémicas37,38.
¿Puede la eosinofilia importada constituir una urgencia médica? Existen 5 entidades, relativamente infrecuentes que requieren decisiones rápidas para bloquear la respuesta inflamatoria sistémica y evitar el daño de los órganos diana7: 1)los síndromes de invasión helmíntica masiva anteriormente comentados; 2)el síndrome de hiperinfestación por S.stercoralis; 3)una afectación helmíntica del SNC (fundamentalmente una meningitis eosinofílica aguda por Angiostrongylus cantonensis o Gnathostoma spp., pero también las lesiones ocupantes de espacio intracraneales o intramedulares en la cisticercosis, equinococosis y esquistosomiasis); 4)una reacción anafiláctica grave por rotura o fisuración de un quiste hidatídico no conocido, y 5)un síndrome de DRESS de etiología farmacológica.
De todos los anteriores, el más grave es el síndrome de hiperinfestación por S.stercoralis41-44, que adicionalmente requiere un elevado índice de sospecha clínica. Este helminto posee un ciclo de replicación endógena único (ciclo de autoinfestación) en el que las larvas rabditifomes generadas por los helmintos adultos pueden madurar a larvas filariformes infectivas en el interior del propio tubo digestivo, multiplicarse de forma incontrolada, atravesar la pared intestinal y diseminarse por todo el organismo bajo el estímulo de determinados factores, siendo los más importantes el uso de fármacos inmunodepresores (fundamentalmente, los corticoides a altas dosis) y la co-infección con el virus HTLV-I (endémico en muchas áreas tropicales y subtropicales). Cursa con enteritis e íleo paralítico, neumonía, púrpura hemorrágica en la pared anterior del abdomen y bacteriemia y/o sepsis por bacilos gramnegativos, y tiene una mortalidad superior al 50%. A diferencia de la estrongiloidosis crónica no complicada, el síndrome de hiperinfestación establecido cursa sin eosinofilia.
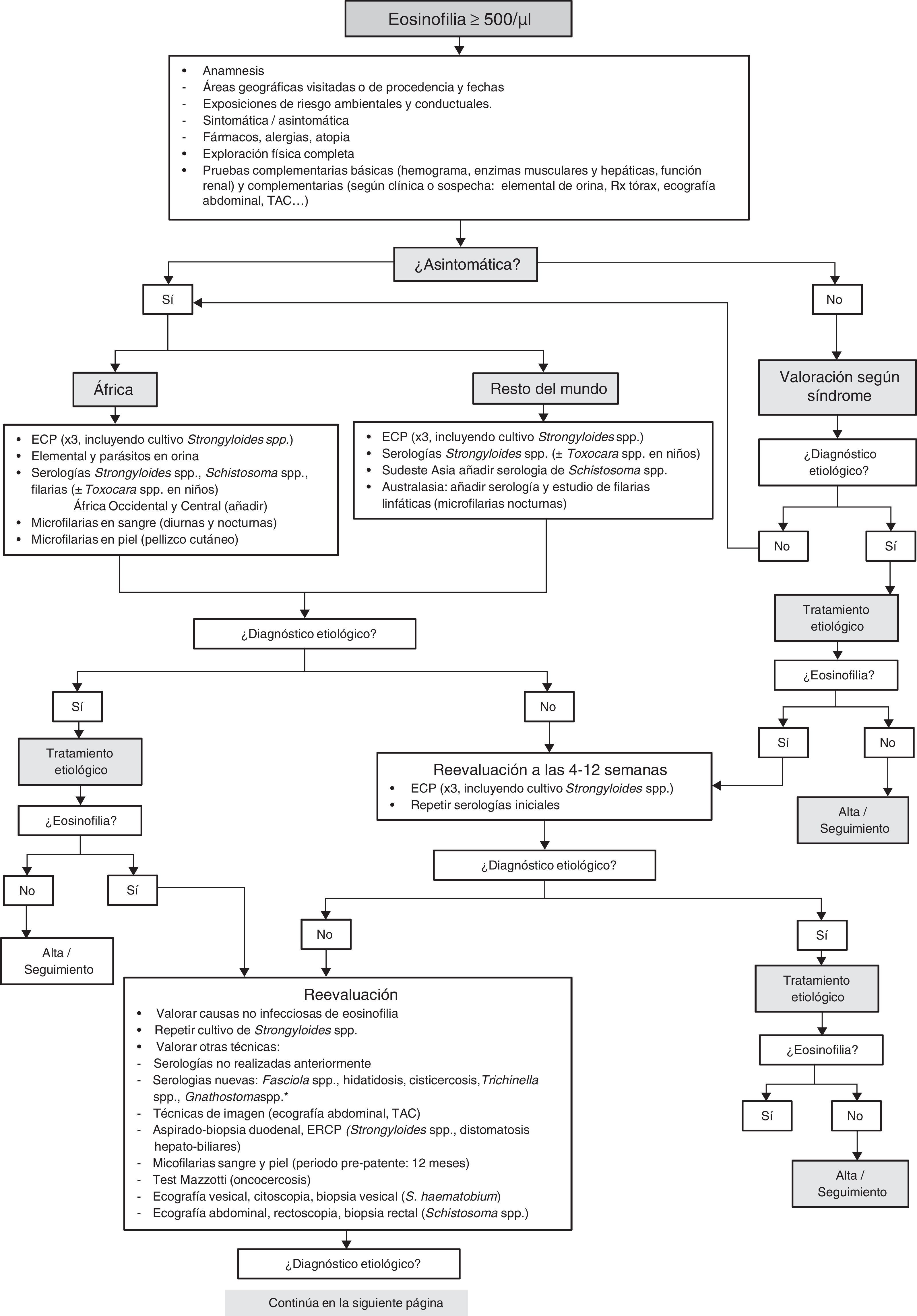
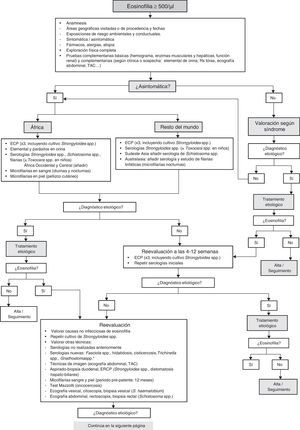
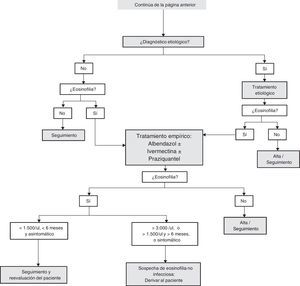
Aproximación diagnóstica a la eosinofilia importadaLa evaluación del paciente con eosinofilia importada supone un gran reto diagnóstico para el clínico, y puede resultar, difícil y desalentador si se pretende descartar todas las etiologías posibles. Por ello, debe realizarse de una forma estructurada e individualizada, basada en áreas geográficas y en los grados de exposición o de riesgo de cada paciente concreto, para optimizar el esfuerzo diagnóstico y minimizar procedimientos innecesarios17,45. No es infrecuente que el estudio etiológico inicial de una eosinofilia importada sea negativo. En estas circunstancias, si persiste la sospecha de una parasitosis subyacente tras descartar otras causas de eosinofilia, quedan 4 opciones: 1)repetir las pruebas parasitológicas (debido a lo prolongado de la mayoría de los periodos pre-patentes); 2)la observación y seguimiento evolutivo del paciente sin «factores de riesgo» (inmunocompetente, asintomático y con cifras inferiores a 1.500 eosinófilos/μl); 3)indicar un tratamiento empírico o «de prueba», y 4)consultar o derivar a un experto.
Historia clínicaEl abordaje clínico de la eosinofilia importada debe comenzar con una historia clínica exhaustiva y estructurada que recoja específicamente los siguientes aspectos:
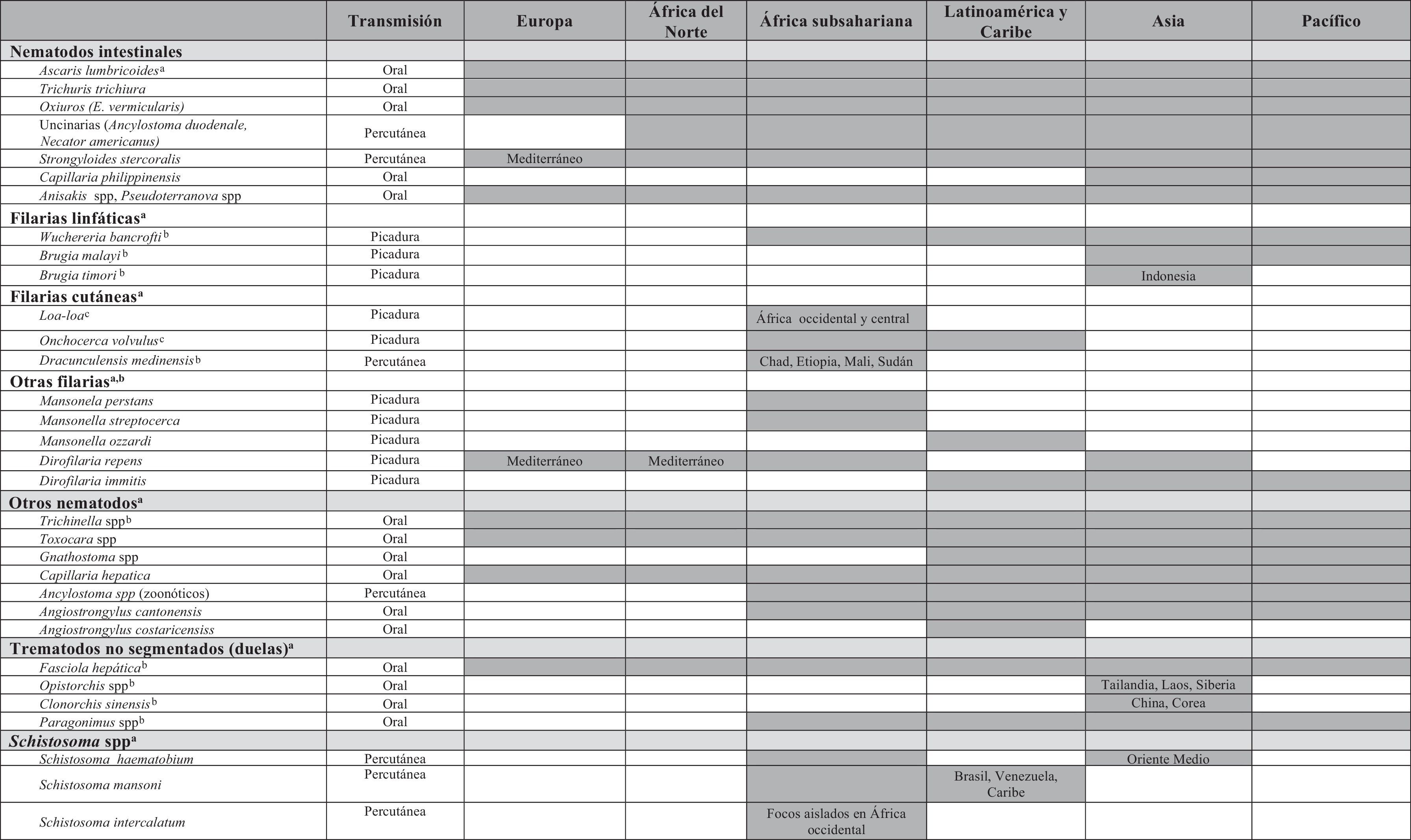
Áreas geográficas y fechasEs muy importante recoger de forma detallada los países y regiones visitadas o de procedencia, porque la distribución geográfica de las parasitosis es muy heterogénea (cosmopolitas o de distribución universal; endémicas de áreas tropicales y/o subtropicales, y restringidas a determinados enclaves geográficos, como la loaosis o la filariosis linfática por Brugia timori), como se muestra en la tabla 5. También es importante recoger las fechas para correlacionar, en viajeros, el momento de detección de la eosinofilia y/o aparición de síntomas con los periodos pre-patentes y de incubación, y en inmigrantes, con la ruta migratoria y con el tiempo de residencia en el país de acogida. En la tabla 3 se sugiere la utilidad de las fechas para evaluar el período pre-patente y el de incubación de las diferentes etiologías.
Distribución geográfica de las principales etiologías de la eosinofilia importada
Celdas con relleno en gris oscuro: denotan que la etiología correspondiente «existe» en dicha área geográfica.
Celdas con relleno en gris oscuro y texto: indican que, dentro de esa área geográfica concreta, dicha etiología existe única o exclusivamente en determinados países (p. ej., «Tailandia, Laos, Siberia» en el caso de Opsistorchis spp. para el área geográfica “Asia”) o zonas dentro de dicha área geográfica (p. ej., «Mediterráneo» en el caso de Strongyloides stercoralis en el área geográfica «Europa»).
Celdas vacías o con fondo gris claro: denotan que la etiología correspondiente «no existe» en dichas áreas geográficas.
a «Subgrupos» de etiologías (helmintos, protozoos, ectoparásitos u hongos).
b Poco frecuentes en viajeros de corta estancia (≤ 3 semanas).
c Puede transmitirse en viajeros de corta estancia (≤ 3 semanas).
La mayoría de las helmintosis intestinales tienen una esperanza de vida limitada lejos de las condiciones ambientales propicias, disminuyendo rápida y espontáneamente el inóculo parasitario en los 6-12meses siguientes tras abandonar áreas endémicas. No obstante, existen 3 especies de helmintos (S.stercoralis, Capillaria philippinensis e Hymenolepis nana) cuyas formas infectivas pueden desarrollarse directamente en el interior del intestino del huésped, originando ciclos de autoinfestación endógena con altas cargas parasitarias y supervivencia prolongada de los helmintos adultos en un mismo huésped. Otras helmintosis crónicas tisulares (p.ej., filarias, esquistosomas, duelas, hidatidosis y cisticercosis) pueden sobrevivir prolongadamente mediante mecanismos específicos de evasión de la respuesta inmune y originar enfermedad grave en el huésped años después de haber abandonado el área endémica de adquisición. A modo de ejemplo, las macrofilarias de O.volvulus pueden vivir 10-15años; las formas adultas de Schistosoma spp., 20-30años, y las de S.stercoralis, más de 50años41.
Exposiciones de riesgo ambientales y conductualesEsta información se debe incluir sistemáticamente en el interrogatorio dirigido, porque puede ser de gran ayuda diagnóstica, como el baño o contacto con aguas dulces contaminadas (Schistosoma spp.) o la ingesta de carne (Trichinella spp., Taenia spp.) o pescado (Anisakis spp., Gnathostoma spp.) crudo o insuficientemente cocinado. En la tabla 6 se muestran las exposiciones ambientales y conductas de riesgo más comunes.
Eosinofilia importada: exposiciones ambientales y conductas de riesgo
| Exposiciones y conductas | Etiologías asociadas |
|---|---|
| Ingestión | |
| Agua, manos y verduras/frutas contaminadas | Ascaris spp., Trichuris trichiura, Enterobius vermicularis, Toxocara spp., Taenia spp., Hymenolepis nana, Echinococcus granulosus, Cystoisospora belli, Sarcocystis spp., Fasciola hepatica, Capillaria hepatica, Spirometra spp. |
| Plantas acuáticas (berros salvajes, hojas de khat) | Fasciola hepatica |
| Carne cruda o poco cocinada | Taenia saginata (vaca), Taenia solium/cisticercosis (cerdo), Trichina spp. (cerdo, jabalí, cocodrilo, tortuga, morsa…), Toxocara spp. (hígado), Sarcocystis spp. (vaca, cerdo) |
| Pescado crudo o poco cocinado (agua salada) | Anisakis spp., Pseudodoterranova spp., Gnathostoma spp., Diphylobotrium latum (salmón del Pacífico) |
| Pescado crudo o poco cocinado (agua dulce) | Gnathostoma spp., Capillaria philippinensis, Clonorchis sinensis, Spirometra spp., Diphylobotrium latum |
| Caracoles crudos o poco cocinados | Angiostrongylus spp. |
| Crustáceos de agua dulce | Paragonimus spp. |
| Crustáceos microscópicos de agua dulce | Dracunculus medinensis, Spirometra spp. |
| Ranas o serpientes | Gnathostoma spp., Spirometra spp., Angiostrongylus cantonensis |
| Contacto con perros y/o gatos | Toxocara spp. (perros y/o gatos), Diphylidium caninum (perros) |
| Contacto con ovejas y/o perros | Echinococcus granulosus |
| Penetración percutánea | |
| Suelo fangoso | Strongyloides stercoralis, uncinarias |
| Andar descalzo sobre arena | Ancylostoma caninum, Ancylostoma brasiliensis (LCM) |
| Baño o contacto con agua dulce | Schistosoma spp. |
| Picadura de insecto | |
| Mosquitos | Filariosis linfáticas |
| Simúlidos (mosca negra) | Onchocerca volvulus |
| Tábanos (mosca del mango) | Loa-loa |
| Culicoides (mosquitos) | Mansonella spp. |
| Simúlidos y mosquitos | Dirofilaria spp. |
| Moscas | Miasis (Dermatobia hominis, Latinoamérica) |
| Larvas en camisa secada al aire libre | Miasis (Cordylobia antropophaga, África) |
| Contacto periocular con piel de rana | Spirometra spp. |
| Otras | |
| Contacto interhumano íntimo | Sarna |
| Inhalación de esporas | Coccidioidosis, paracoccidioidosis |
La eosinofilia importada puede ser asintomática (situación más frecuente en inmigrantes que en viajeros) o acompañarse de datos clínicos sistémicos y/o de órganos que orienten clínicamente hacia su etiología (tablas 2-4). Causas frecuentes de eosinofilia asintomática son las helmintiasis intestinales, las filariosis y las infecciones crónicas por Schistosoma spp. y S.stercoralis36. Los principales síndromes clínicos de presentación son los digestivos (gastrointestinales y hepatobiliares), cutáneos, respiratorios, musculares, genitourinarios, neurológicos y oculares (tabla 4).
La fiebre con eosinofilia es una característica destacada en los síndromes de invasión helmíntica masiva, en las fases iniciales de las parasitosis tisulares (Toxocara spp., Trichinella spp., Gnathostoma spp., Sarcocystis spp.); en las colangitis por trematodos hepatobiliares (Fasciola spp., Clonorchis sinensis, Opistorchis spp.) y por Capillaria hepatica, y en las linfangitis y celulitis centrífugas por filarias linfáticas. Adicionalmente, la fiebre puede constituir el síntoma guía en 2 entidades potencialmente graves: el síndrome de hiperinfestación por S.stercoralis y la paracoccidioidosis diseminada (forma juvenil o en inmunodeprimidos). Por último, recordar que en un mismo paciente pueden coexistir varias infecciones simultáneas, y la fiebre puede obedecer a una etiología distinta a la de la eosinofilia, como malaria, fiebre tifoidea, arbovirosis, brucelosis o leptospirosis, entre otras.
Una misma enfermedad se puede expresar de forma muy diferente en viajeros y en inmigrantes. El ejemplo más demostrativo son las diversas filariosis: así, en la loaosis, la forma de presentación más común en viajeros es el edema de Calabar asociado a una eosinofilia de alto grado, mientras que en inmigrantes son frecuentes las microfilaremias asintomáticas, la macrofilaria subconjuntival y eosinofilias menos intensas46,47. Finalmente, algunas entidades son casi exclusivas de viajeros de corta estancia, como la larva cutánea migrans (LCM), el síndrome de Loeffler o la esquistosomiasis aguda (síndrome de Katayama), mientras que otros, como la eosinofilia pulmonar tropical, son propios de residentes o inmigrantes de áreas endémicas de filariosis linfáticas.
Otros aspectosNo debe faltar la recogida detallada de antecedentes de atopia, de alergias y de consumo de fármacos potencialmente causantes de eosinofilia (tabla 1), ya sean de uso habitual o puntual durante el viaje.
Pruebas de diagnóstico microbiológicoEn este apartado nos referiremos fundamentalmente al diagnóstico parasitológico directo (examen microscópico) e indirecto (serológico) de la eosinofilia importada, y se comentarán brevemente algunas técnicas diagnósticas emergentes que no suelen estar disponibles en todos los centros, por lo que comúnmente necesitaremos un laboratorio de referencia. Los estudios microbiológicos se complementarán con un estudio analítico básico (hemograma, bioquímica con enzimas hepáticas y musculares, función renal…) y otras pruebas en función de los datos clínicos o epidemiológicos. Ante eosinofilias muy intensas (p.ej., >5.000-10.000/μl) es recomendable solicitar una valoración hematológica del frotis de sangre periférica48.
Se denomina «periodo pre-patente» al intervalo de tiempo que transcurre entre el momento de la infección y la aparición de elementos que permitan su diagnóstico mediante el examen parasitológico directo o microscópico (huevos, quistes o larvas en heces, sangre u otras muestras clínicas) o mediante métodos indirectos (detección de anticuerpos específicos), mientras que el «periodo de incubación» hace referencia al intervalo entre la infección y la aparición de síntomas clínicos en la persona infectada. El periodo pre-patente para el diagnóstico directo es generalmente prolongado y muy variable de un parásito a otro (tabla 3), mientras que las pruebas serológicas se suelen positivizar entre las 4 y las 12semanas. Por este motivo, algunos autores recomiendan, en viajeros con eosinofilia asintomática, posponer la realización de pruebas directas hasta 1-3meses tras la exposición, y en los sintomáticos, repetirlas si las pruebas iniciales fuesen negativas34. En los síndromes de invasión helmíntica masiva, característicamente el periodo de incubación es inferior al pre-patente.
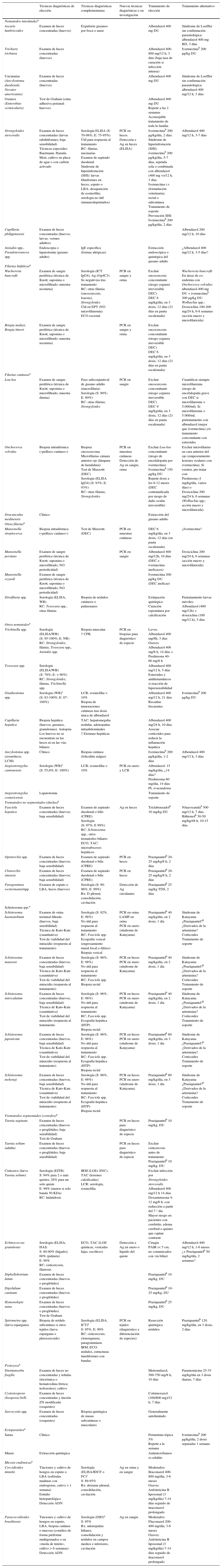
En la tabla 7 se muestran las pruebas diagnósticas (las de elección y las complementarias) y el tratamiento etiológico («dirigido») para las principales etiologías de la eosinofilia importada. A continuación se comentan algunas pruebas diagnósticas con más detalle.
Diagnóstico y tratamiento de las principales etiologías de la eosinofilia importada
| Técnicas diagnósticas de elección | Técnicas diagnósticas complementarias | Nuevas técnicas diagnósticas o en investigación | Tratamiento de elección | Tratamiento alternativo | |
|---|---|---|---|---|---|
| Nematodos intestinalesa | |||||
| Ascaris lumbricoides | Examen de heces concentradas (huevos) | Expulsión gusanos por boca o nariz | Albendazol 400 mg DU | Síndrome de Loeffler sin confirmación parasitológica: albendazol 400 mg BD, 3 días | |
| Trichuris trichiura | Examen de heces concentradas (huevos) | Albendazol 400-800 mg/12 h, 3 días (baja tasa de curación si infección intensa) | Ivermectinab 200 μg/kg DU | ||
| Uncinarias (Ancylostoma duodenale, Necator americanus) | Examen de heces concentradas (huevos) | Albendazol 400 mg DU | Síndrome de Loeffler sin confirmación parasitológica: albendazol 400 mg/12 h, 3 días | ||
| Oxiuros (Enterobius vermicularis) | Test de Graham (cinta adhesiva perianal: huevos) | Albendazol 400 mg DU Repetir a las 2 semanas Aconsejable tratamiento de toda la familia | |||
| Strongyloides stercoralis | Examen de heces concentradas (larvas rabditiformes; baja sensibilidad) Técnicas especiales: Baermann, Harada-Mori, cultivo en placa de agar o con carbón activado | Serología ELISA (S: 70-98%; E: 75-95%) Útil para respuesta al tratamiento RC: filarias, uncinarias Examen de aspirado duodenal Síndrome de hiperinfestación (SHI): larvas filariformes en heces, esputo o LBA; desaparición de eosinofilia; serología no útil (inmunodeprimidos) | PCR en heces. Detección e Ag en heces (ELISA) | Ivermectinab 200 μg/kg/día, 2 días. Síndrome de hiperinfestación (SHI): ivermectinab 200 μg/kg/día, 5-7 días, repetida sola o combinada con albendazol (400 mg vo/12 h, 3 días Ivermectina i.v. (formulación veterinaria), rectal o subcutánea Tratamiento de soporte Prevención SHI: Ivermectinab 200 μg/kg/día, 2 días | Albendazol 400 mg/12 h, 3-7 días |
| Capillaria philippinensis | Examen de heces concentradas (huevos, larvas, vermes adultos) | Albendazol 200 mg/12 h, 10 días | |||
| Anisakis spp., Pseudoterranova spp. | Endoscopia o laparotomía (gusano adulto) | IgE específica (formas alérgicas) | Extracción endoscópica o quirúrgica del gusano adulto | ¿Albendazol 400 mg/12 h, 3-5 días? | |
| Filarias linfáticasa | |||||
| Wuchereria bancrofti | Examen de sangre periférica (técnica de Knott, saponina o microfiltrado; muestra nocturna) | Serología (ICT IgG4), Ag (Og4C3) Se negativiza tras tratamiento RC: otras filarias (oncocercosis, loaosis), Strongyloides Útil en EPT (NO microfilaremia) ECO escrotal | PCR en sangre y orina | Excluir oncocercosis concomitante (riesgo ceguera irreversible DEC) DEC 6 mg/kg/día, en 3 dosis, 12 días (21 días en pauta escalonada) | Wuchereria bancrofti En áreas de co-endemia con Onchocerca volvulus: albendazol 400 mg DU + ivermectinab 200 μg/kg DU Wolbachia spp.: Doxiciclina 100-200 mg/24 h, 6-8 semanas (acción macro y microfilaricida) |
| Brugia malayi, Brugia timori | Examen de sangre periférica (técnica de Knott, saponina o microfiltrado; muestra nocturna) | PCR en sangre y orina | Excluir oncocercosis concomitante (riesgo ceguera irreversible DEC) DEC 6 mg/kg/día, en 3 dosis, 12 días (21 días en pauta escalonada) | ||
| Filarias cutáneasa | |||||
| Loa-loa | Examen de sangre periférica (técnica de Knott, saponina o microfiltrado; muestra diurna) | Paso subconjuntival de gusano adulto (macrofilaria) Serología (S: 90%; E: 80%) RC: otras filarias, Strongyloides | PCR en sangre | Excluir oncocercosis concomitante (riesgo ceguera irreversible DEC) DEC 9 mg/kg/día, en 3 dosis, 12 días (21 días en pauta escalonada) | Cuantificar siempre microfilaremia (riesgo de encefalopatía grave con DEC si microfilaremia > 5.000/ml). Si microfilaremia > 5.000/ml, pretratamiento con albendazol (mejor que ivermectina) y/o tratamiento concomitante con esteroides |
| Onchocerca volvulus | Biopsia intradérmica («pellizco cutáneo») | Biopsia oncocercoma Microfilarias cámara anterior ojo (lámpara de hendidura) Test de Mazzotti (DEC) Serología (ELISA IgG4) (S: 93%; E: 93%) RC: otras filarias, Strongyloides | PCR en muestras cutáneas Detección de Ag en sangre, orina | Excluir Loa-loa concomitante (riesgo de encefalopatía por ivermectina) Ivermectinab 150 μg/kg DU Repetir dosis a los 6-12 meses (DEC contraindicada por riesgo de daño ocular irreversible) | Excluir microfilarias en cara anterior del ojo (empeoramiento lesiones oculares con ivermectina). Si existen, pre-tratar con: Prednisona (1 mg/kg/día, varios días) o Doxiciclina 200 mg/24 h, 6 semanas (Wolbachia spp.: acción macro y microfilaricida) |
| Dracunculus medinensis | Clínico | Extracción del gusano adulto | |||
| Otras filariasa | |||||
| Mansonella streptocerca | Biopsia intradérmica («pellizco cutáneo») | Test de Mazzotti (DEC) | PCR en muestras cutáneas | DEC 6 mg/kg/día, en 3 dosis, 12 días (en pauta escalonada) | ¿Ivermectina? |
| Mansonella perstans | Examen de sangre periférica (técnica de Knott, saponina o microfiltrado; NO periodicidad) | PCR en sangre | Albendazol 400 mg/12h, 10 días (DEC e ivermectina ineficaces) | Doxiciclina 200 mg/24 h, 6 semanas (acción macro y microfilaricida) | |
| Mansonella ozzardi | Examen de sangre periférica (técnica de Knott, saponina o microfiltrado; NO periodicidad) | Ivermectina 200 μg/kg DU (DEC ineficaz) | |||
| Dirofilaria spp. | Serología (ELISA, WB) RC: Toxocara spp., otras filarias | Biopsia de nódulos cutáneos o pulmonares | Extirpación quirúrgica Curación espontánea por calcificación | Pretratamiento larvas móviles: Albendazol (400 mg/12h) + doxiciclina (100 mg/12 h), 5 días | |
| Otros nematodosa | |||||
| Trichinella spp. | Serología (ELISA/WB) (S: 95-100%; E: NR) RC: Strongyloides, filarias, Toxocara spp., Anisakis spp. | Biopsia muscular ↑ CPK | PCR en biopsias para diagnóstico de especie | Leves: Albendazol 400 mg/8h, 3 días Graves: Albendazol 400 mg/8 h, 14 días + Prednisona 40-60 mg/8 h | |
| Toxocara spp. | Serología (ELISA/WB) (S: 78%; E: > 90%) RC: Strongyloides, filarias, Trichinella spp. | Albendazol 400 mg/12 h, 5 días Esteroides y antihistamínicos si reacción de hipersensibilidad | |||
| Gnathostoma spp. | Serología (WB)c (S: 83-100%; E: 87-100%) | LCR: eosinofilia > 10% Biopsia de tumoraciones cutáneas tras dosis única de albendazol | Albendazol 400 mg/12 h, 21 días Recaídas frecuentes | Ivermectinab 200 μg/kg DU | |
| Capillaria hepatica | Biopsia hepática (huevos, gusanos, granulomas). Autopsia Los huevos no se encuentran en las heces ni en las vías biliares | TAC: hepatomegalia nodular, adenopatías intraabdominales ↑ Enzimas hepáticas | Albendazol 400 mg/24 h, 10 días Asociar corticoides para reducir la inflamación hepática | ||
| Ancylostoma spp. (zoonóticos, LCM) | Clínico | Biopsia cutánea (foliculitis nalgas) | Ivermectinab 200 μg/kg/día, 1-2 días | Albendazol 400 mg/12 h, 3 días | |
| Angiostrongylus cantonensis | Serología (WB)c (S: 55,6%; E: 100%) | LCR: eosinofilia > 10% | PCR en suero y LCR | Albendazol: 15 mg/kg/día, ¿14 días? Prednisoma 60 mg/día, 14 días PL evacuadoras | |
| Angiostrongylus costaricensis | Laparotomía | Tratamiento de soporte | |||
| Trematodos no segmentados (duelas)a | |||||
| Fasciola hepatica | Examen de heces concentradas (huevos; baja sensibilidad) | Examen de aspirado duodenal o bilis (CPRE) Serología (S: 97%; E 99%) RC: Schistosoma spp., otros trematodos biliares ECO, TAC: microabscesos hepáticos | Ag en heces | Triclabenzadolb 10 mg/kg DU | Nitazoxanidab 500 mg/12 h, 7 días Bithionolb 30-50 mg/hg/48 h, 10-15 días |
| Opistorchis spp. | Examen de heces concentradas (huevos; baja sensibilidad) | Examen de aspirado duodenal o bilis (CPRE) | PCR en heces | Praziquantelb 20-25 mg/kg/8 h, 2 días | |
| Clonorchis sinensis | Examen de heces concentradas (huevos; baja sensibilidad) | Examen de aspirado duodenal o bilis (CPRE) | PCR en heces | Praziquantelb 20-25 mg/kg/8 h, 2 días | |
| Paragonimus westermanni/spp. | Examen de esputo o LBA, heces (huevos) | Serología (S: 90-96%; E: 99%) Rx: D pleural, consolidación, cavitación | Detección de Ag circulantes | Praziquantelb 25 mg/kg TDS, 2 días | |
| Schistosoma spp.a | |||||
| Schistosoma haematobium | Examen de orina terminal filtrada (huevos, baja sensibilidad) Técnica de Kato-Katz (cuantitativa) Test de viabilidad del miracidio (respuesta al tratamiento) | Serología (S: 92%, E: 98%) No útil para respuesta al tratamiento RC: Fasciola spp. Ecografía vesical (engrosamiento mural focal o difuso) Biopsia vesical | PCR en orina LAMP en orina PCR en suero (síndrome de Katayama) | Praziquantelb 40 mg/kg/día, en 2 dosis, 1 día | Síndrome de Katayama ¿Praziquantel?b ¿Derivados de la artemisina? Corticoides Tratamiento de soporte |
| Schistosoma mansoni | Examen de heces concentradas (huevos, baja sensibilidad) Técnica de Kato-Katz (cuantitativa) Test de viabilidad del miracidio (respuesta al tratamiento) | Serología (S: 96%, E: 98%) No útil para respuesta al tratamiento RC: Fasciola spp. Biopsia rectal | PCR en heces PCR en suero (síndrome de Katayama) | Praziquantelb 40 mg/kg/día, en 2 dosis, 1 día | Síndrome de Katayama ¿Praziquantel?b ¿Derivados de la artemisina? Corticoides Tratamiento de soporte |
| Schistosoma intercalatum | Examen de heces concentradas (huevos, baja sensibilidad) Técnica de Kato-Katz (cuantitativa) Test de viabilidad del miracidio (respuesta al tratamiento | Serología (S: 96%, E: 98%) No útil para respuesta al tratamiento RC: Fasciola spp. Ecografía hepática (HTP) Biopsia rectal | PCR en heces PCR en suero (síndrome de Katayama) | Praziquantelb 40 mg/kg/día, en 2 dosis, 1 día | Síndrome de Katayama ¿Praziquantel?b ¿Derivados de la artemisina? Corticoides Tratamiento de soporte |
| Schistosoma japonicum | Examen de heces concentradas (huevos, baja sensibilidad) Técnica de Kato-Katz (cuantitativa) Test de viabilidad del miracidio (respuesta al tratamiento) | Serología (S: 96%, E: 98%) No útil para respuesta al tratamiento RC: Fasciola spp. Ecografía hepática (HTP) Biopsia rectal | PCR en heces PCR en suero (síndrome de Katayama) | Praziquantelb 60 mg/kg/día, en 3 dosis, 1 día | Síndrome de Katayama ¿Praziquantel?b ¿Derivados de la artemisina? Corticoides Tratamiento de soporte |
| Schistosoma mekongi | Examen de heces concentradas (huevos, baja sensibilidad) Técnica de Kato-Katz (cuantitativa) Test de viabilidad del miracidio (respuesta al tratamiento) | Serología (S: 96%, E: 98%) No útil para respuesta al tratamiento RC: Fasciola spp. Ecografía hepática (HTP) Biopsia rectal | PCR en heces PCR en suero (síndrome de Katayama) | Praziquantelb 60 mg/kg/día, en 3 dosis, 1 día | Síndrome de Katayama ¿Praziquantel?b ¿Derivados de la artemisina? Corticoides Tratamiento de soporte |
| Trematodos segmentados (cestodos)a | |||||
| Taenia saginata | Examen de heces concentradas (huevos o proglótides; baja sensibilidad) Test de Graham | PCR en heces para diagnóstico de especie | Praziquantelb 10 mg/kg, DU | ||
| Taenia solium (adulta) | Examen de heces concentradas (huevos o proglótides; baja sensibilidad) | PCR en heces para diagnóstico de especie | Excluir cisticercosis antes de tratamiento Praziquantelb 10 mg/kg, DU | ||
| Cisticerco (larva Taenia solium) | Serología (EITB) S: 94% para 2 o más quistes; 28% para un solo quiste E: 99% (menor si solo banda 50 KDa) RC: hidatidosis | IRM (LOEs SNC), TAC (lesiones calcificadas) LCR: serología, eosinofilia | Excluir infección por Strongyloides stercoralis Albendazol 400 mg/12 h 14 días Dexametasona 4-12 mg/6 h, con reducción a partir del 7.° día Mayor riesgo en pacientes con cerebritis, edema cerebral o quistes que captan contraste | ||
| Echinococcus granulosus | Serología (ELISA, HAI) S: 80-90% (hígado); 60% (pulmón) E: 90% RC: cisticercosis, filariosis | ECO, TAC (LOE quísticas, vesículas hijas, escólices) | Detección e Ag en suero o líquido del quiste | Cirugía PAIR (< 5 cm, no comunicados con vía biliar) | Albendazol 400 mg/12 h, 1-6 meses ¿+ Praziquantelb 50 mg/kg/día, 2 semanas? |
| Diphyllobotrium latum | Examen de heces concentradas (huevos o proglótides) | Praziquantelb 10 mg/kg, DU | |||
| Dipylidium caninum | Examen de heces concentradas (huevos o proglótides) | Praziquantelb 10-25 mg/kg, DU | |||
| Hymenolepis nana | Examen de heces concentradas (huevos o proglótides) Test de Graham | Praziquantelb 25 mg/kg, DU | |||
| Spirometra spp. (larva espargana) | Biopsia de nódulo subcutáneo u otros tejidos (larva espargana o plerocercoide) | Serología (ELISA, ICT)c S: 95%, E: 90% RC: cisticercosis, clonorquiasis, paragonimiasis IRM, ECO: nódulos, estructuras tuneliformes con bandas | PCR en tejidos (diagnóstico y diferenciación de especies) | Resección quirúrgica nódulos | Praziquantelb 120 mg/kg/día, en 3 dosis, 2 días |
| Protozoosa | |||||
| Dientamoeba fragilis | Examen de heces no concentradas y teñidas (tricrómica o hematoxilina férrica; trofozoitos); cultivo | Metronidazol, 500-750 mg/8 h, 10 días | Paramomicina 25-35 mg/kg/día en 3 dosis diarias, 7 días | ||
| Cystoisospora (Isospora) belli | Examen de heces concentradas y tinción ZN modificada (ooquistes) | Cotrimoxazol (160/800 mg)/12 h, 7 días | |||
| Sarcocystis spp. | Examen de heces concentradas (ooquistes) | Biopsia quirúrgica de masas subcutáneas o musculares | Generalmente autolimitado | ||
| Ectoparásitosa | |||||
| Sarna | Clínico | Permetrina tópica 5% Repetir a la semana | Ivermectinab 200 μg/kg/día, 2 dosis separadas 1 semana | ||
| Miasis | Extracción quirúrgica | Antimicrobianos si celulitis | |||
| Micosis endémicasa | |||||
| Coccidioides immitis | Tinciones y cultivo de hongos en esputo o LBA (esférulas maduras con endosporas, cutivo > 1 semana) Estudio histopatológico Detección ADN | Serología (ELISA/IDCF o FC)c S: 89-95% Rx: derrame pleural, consolidación, cavitación | Ag en orina y en sangre | Moderados: Itraconazol 400-800 mg/día, 3-6 meses Graves: Anfotericina B liposomal (3 mg/kg/día) 7-14 días seguido de itraconazol prolongado | |
| Paracoccidioides brasiliensis | Tinciones y cultivo de hongos en esputo, LBA, biopsia cutánea o mucosa (conidios de forma piriforme multigemados o en «rueda de timón», cultivo > 6 semanas) Detección ADN | Serología (DID)c S: 95% Rx: adenopatías hiliares, consolidación y nódulos en campos medios e inferiores, cavitación | Ag en sangre | Moderados: Fluconazol 200-400 mg/día, 3-6 meses Graves: Anfotericina B liposomal (3 mg/kg/día) 7-14 días seguido de itraconazol prolongado | |
Ag: antígeno parasitario; CPK: creatina-fosfoquinasa; CPRE: colangiopancreatografía retrógrada endoscópica; DEC: dietil-carbamazina; DID: doble inmunodifusión; DU: dosis única; E: especificidad; ECO: ecografía; EITB: Enzyme-linked Immumoelectrotransfer Blot Assay; ELISA: Enzyme-Linked ImmunoSorbent Assay (ensayo por inmunoadsorción ligado a enzimas); EPT: eosinofilia pulmonar tropical; FC: fijación de complemernto; HAI: hemaglutinación indirecta; HTP: hipertensión portal; ICT: inmunocromatografía; IDCF: immunodiffusion-complement fixation; IRM: imagen por resonancia magnética; LAMP: Loop-mediated isothermal amplification for DNA; LBA: lavado broncoalveolar; LCM: larva cutánea migrans; PAIR: punción, aspiración, inyección de escolicida y re-aspiración; PCR: reacción en cadena de la polimerasa; PL: punción lumbar; RC: reacciones cruzadas; Rx: radiografía de tórax; S: sensibilidad; TAC: tomografía axial computarizada; ZN: tinción de Zhiel-Neelsen; WB: Western Blot.
Adaptado de Checkley et al.36, Martín-Rabadán et al.55, Daly y Chiodini56, Udall57, Jiménez et al.58, Pardo-Lledias et al.59, Ricciardi y Ndao60 y The Medical Letter61.
En todo paciente con eosinofilia importada se deben examinar al menos 3 muestras seriadas de heces recogidas en días alternos para aumentar su sensibilidad, buscando quistes o trofozoítos (protozoos), proglótides (Taenia spp.) y huevos o larvas (helmintos). Un estudio completo debe incluir: 1)un examen en fresco; 2)otro tras técnicas de concentración como la de Ritchie, aunque en la actualidad la mayoría de los laboratorios trabajan con sistemas comerciales de concentración con solución fijadora SAF, y 3)otro tras tinciones específicas.
El examen copro-parasitológico convencional tiene una baja sensibilidad para muchos patógenos causantes de eosinofilia, y adicionalmente es laborioso, consume tiempo y recursos, y requiere un personal de laboratorio entrenado. Resulta óptimo para el diagnóstico de las geohelmintosis (Ascaris lumbricoides, T.trichiura y uncinarias), pero tiene un valor limitado en otras helmintosis digestivas (estrongiloidosis, oxiurosis, trematodosis hepatobiliares, teniasis y esquistosomiasis digestivas crónicas), en las que las formas diagnósticas están presentes en heces a una concentración muy baja, de forma intermitente o son difíciles de detectar aun en muestras concentradas. El ejemplo más representativo es S.stercoralis, en que la sensibilidad del estudio convencional aumenta considerablemente si se examinan 7 muestras fecales49 y/o si se utilizan métodos especiales, como el de Baermann y el de Harada-Mori, o el cultivo de larvas en placa con carbón activado o de agar, siendo esta última la más sensible de todas50. Otro ejemplo es Enterobius vermicularis, que deposita los huevos en los márgenes del ano y no en las heces, por lo que la técnica de elección es el test de Graham (o cinta adhesiva perianal), que también puede ser útil para la detección de huevos y/o proglótides de Taenia saginata y de H.nana.
Otros métodos de diagnóstico directoPara S.haematobium se debe examinar una muestra de orina terminal obtenida entre las 10:00 y las 14:00h procesada mediante técnicas de concentración (sedimentación, filtración a través de filtro de nitrocelulosa o centrifugación), siendo ocasionalmente necesario recurrir a la ecografía y a la biopsia vesical. Para el diagnóstico definitivo y de especie de las filariosis, las microfilarias deben buscarse en sangre (mediante frotis de sangre periférica, métodos de filtración y/o métodos de concentración como la técnica de Knott y la leucoconcentración con saponina) o en biopsias intradérmicas exangües (técnica del «pellizco cutáneo»). En las filariosis linfáticas (Wuchereria bancrofti y Brugia spp.), la microfilaremia tiene periodicidad nocturna (por lo que la extracción óptima de la sangre debe realizarse entre las 22:00h y las 2:00 de la madrugada), mientras que las microfilarias de Loa-loa, M.perstans y Mansonella ozzardi presentan periodicidad diurna (extracción óptima entre las 12:00 y las 14:00h). Las microfilarias de O.volvulus y Mansonella streptocerca solo pueden detectarse en dermis. Aunque en la mayoría de las trematodosis biliares (Fasciola spp., C.sinensis y Opistorchis spp.) y pulmonares (Paragonimus spp.) pueden encontrarse huevos en las heces (por excreción biliar o por deglución del esputo, respectivamente), su sensibilidad es baja y habitualmente hay que recurrir a muestras invasivas (aspirado duodenal y/o de bilis mediante colangiopancreatografía retrógrada endoscópica [CPRE]) o respiratorias (esputo y/o lavado broncoalveolar [LBA]). Por último, en las helmintiasis tisulares son necesarias técnicas invasivas para su diagnóstico definitivo: endoscopia digestiva y/o laparotomía (Anisakis spp., Pseudoterranova spp.), biopsia hepática (Capilaria hepatica), biopsia cutánea (nódulos subcutáneos de Spirometra spp., Dirofilaria spp. o Sarcocystis spp.; forma folicular de LCM), biopsia muscular (Trichinella spp., Sarcocystis spp.), laparotomía (Angiostrongilus costaricensis) o examen de LCR (meningitis eosinofilicas por A.cantonensis o Gnathostoma spp.).
Diagnóstico parasitológico indirectoEl diagnóstico serológico tiene una fiabilidad clínica aceptable en las infecciones por S.stercoralis, filarias linfáticas, Schistosoma spp., Fasciola hepatica, cisticercosis, equinococosis, Toxocara spp., Trichinella spp., Gnatostoma spp. y A.cantonensis. En el resto, la utilidad diagnóstica está limitada por varios factores: 1)las reacciones serológicas cruzadas entre distintos helmintos, que hace que su especificidad sea baja; 2)la sensibilidad de la técnica utilizada, que en general es baja para la inmunoelectroforesis (IE) y la inmunofluorescencia indirecta (IFI), y elevada para la hemaglutinación indirecta (HAI) y, sobre todo, para las técnicas inmunoenzimáticas (ELISA y Western Blot [WB])17; 3)generalmente se positivizan a las 4-12semanas de la infección inicial; 4)salvo excepciones, no sirven para diferenciar infecciones recientes de antiguas, ni para monitorizar la respuesta al tratamiento; 5)los resultados son poco comparables de un laboratorio a otro, al emplear diferentes antígenos, y 6)muchas técnicas no están comercializadas y/o solo están disponibles en centros de referencia. Todo ello hace que la interpretación de las serologías de los helmintos sea difícil, y que haya que recurrir con frecuencia a la opinión de un experto. De forma resumida y operativa, las serologías disponibles se pueden clasificar en 3 grupos: 1)esenciales para el diagnóstico (Toxocara spp., Trichinella spp., Gnatostoma spp., hidatidosis, cisticercosis y A.cantonensis); 2)de utilidad complementaria para el diagnóstico (Strongyloides, Schistosoma spp., filarias linfáticas y micosis endémicas: Coccidioides spp. y P.brasiliensis), y 3)útiles para el seguimiento del tratamiento (Strongyloides, filarias linfáticas y Trichinella spp.). De todas ellas, comentaremos brevemente las 3 más utilizadas en el abordaje clínico de la eosinofilia importada: S.stercoralis, filarias linfáticas y Schistosoma spp. El resto se usan en función de la sospecha clínica y/o epidemiológica, se muestran en la tabla 7 y pueden consultarse en la bibliografía especializada.
• Strongyloides stercoralis51-54. En ausencia de un «patrón oro» diagnóstico, los métodos serológicos son más sensibles que los directos. Existen varios métodos comercializados, con una sensibilidad óptima para el diagnóstico individual (>85%) y una especificidad >90%: 2 técnicas de ELISA que utilizan antígenos crudos (larvas de Strongyloides rati y S.stercoralis, respectivamente) y otras 2 que usan un antígeno recombinante (NIE) para detectar anticuerpos por ELISA (NIE-ELISA) o mediante un sistema de inmunoprecipitación con luciferasa (NIE-LIPS). Este último test alcanza una sensibilidad del 97% y una especificidad cercana al 100%. La sensibilidad de todas las pruebas serológicas es mayor en inmigrantes que en viajeros (98% vs. 73%), al contrario de la especificidad (77% vs. 94%), ya que presentan reacciones cruzadas con otras parasitosis (fundamentalmente, filarias). Para el diagnóstico clínico individual, y específicamente para la prevención del síndrome de hiperinfestación, es recomendable utilizar test con la máxima sensibilidad posible, para alcanzar un valor predictivo negativo (VPN) en poblaciones de baja prevalencia cercano al 100%. En poblaciones con alta probabilidad pre-test (inmigrantes), si el resultado inicial fuese negativo es necesario realizar un segundo test con un sustrato diferente, o combinarlo con un método de diagnóstico directo de máxima sensibilidad (>3muestras de heces o cultivo en placa de agar). En los pacientes inmunodeprimidos las pruebas serológicas tienen menor sensibilidad, y en el síndrome de hiperinfestación, donde existe una alta carga larvaria, son más útiles los métodos de diagnóstico directo en heces o en otras muestras (esputo, LBA…). Finalmente, las pruebas serológicas sirven para monitorizar la respuesta al tratamiento en inmunocompetentes, presentando una caída significativa o incluso negativización del título de anticuerpos en los 6-12 meses posteriores.• Filarias linfáticas. Para W.bancrofti se dispone de técnicas comercializadas que detectan antígenos filáricos circulantes (CAT) con una adecuada sensibilidad y especificidad, y que evitan el inconveniente de la periodicidad nocturna para la toma de muestras sanguíneas. Están disponibles en 2 formatos: inmunocromatografía y ELISA de captura55. La presencia de anticuerpos IgG4 específicos se considera un marcador sensible de infección activa. Estas pruebas son de gran utilidad para el diagnóstico de la eosinofilia pulmonar tropical56. Para otras filarias los métodos serológicos no están tan consolidados. No obstante, la elevada tasa de reacciones serológicas cruzadas entre especies hace atractiva la serología W.bancrofti en viajeros e inmigrantes de África occidental y central17, donde las infecciones por filarias linfáticas son infrecuentes, por lo que su positividad puede sugerir una oncocercosis o una loaosis subyacente que deben investigarse por métodos directos. Para oncocercosis se han desarrollado técnicas de detección de microfilarias en piel mediante PCR, y de antígenos en suero, orina y lágrimas, con sensibilidades y especificidades superiores al 90%57. También se han implementado técnicas de PCR para microfilarias de Loa-loa y M.perstans en sangre periférica, más sensibles que la técnica de Knott del diagnóstico directo convencional58.• Schistosoma spp. Su principal utilidad es para el diagnóstico de la esquistosomiasis aguda en personas sin inmunidad previa (síndrome de Katayama), en la que los anticuerpos se detectan habitualmente a las 4-6semanas de la infección inicial. Existen técnicas de HAI y de ELISA (más sensible), o una combinación de ambas. La sensibilidad de ambas es ligeramente inferior para S.haematobium que para las otras especies. En los pacientes crónicamente expuestos su utilidad es limitada, y no son útiles para detectar reinfecciones ni para monitorizar el tratamiento55,56; en estos casos puede ser útil el test de viabilidad del miracidio55.
Nuevas técnicas diagnósticasEn los últimos años existe una gran actividad para desarrollar nuevas técnicas diagnósticas que mejoren la sensibilidad y la especificidad de las pruebas parasitológicas directas y serológicas59,60. Las más utilizadas son técnicas moleculares (PCR y loop mediated isothermal amplification test [LAMP]) y los métodos de detección de antígenos parasitarios (tabla 7). La mayoría están en fase de desarrollo, y se puede consultar su disponibilidad en el Centro Nacional de Microbiología de Majadahonda (Madrid), del Instituto de Salud CarlosIII.
Algoritmo diagnóstico de la eosinofilia importadaEn la figura 2 se muestra un algoritmo para el diagnóstico y el seguimiento de la eosinofilia importada. En él se consideran, desde el punto de vista práctico, 2 grandes áreas geográficas y la presencia o no de síntomas. Las 2 áreas son: 1)África, donde además de geohelmintosis y estrongiloidosis se concentran la mayoría de las infecciones mundiales por Schistosoma spp.42. W.bancrofti está muy extendida, pero las infecciones son relativamente poco frecuentes. Adicionalmente, África occidental y central es endémica para O.volvulus y Loa loa, siendo los países de mayor riesgo (por orden alfabético): Benín, Burkina Faso, Camerún, Chad, Congo, Costa de Marfil, Gabón, Gambia, Ghana, Guinea Bissau, Guinea Conakry, Guinea Ecuatorial, Liberia, Níger, Nigeria, Mali, Mauritania, República Centroafricana, Senegal, Sierra Leona y Togo36; 2)el resto del mundo, donde las causas más frecuentes de eosinofilia importada son los geohelmintos y S.stercoralis. Algunos autores62 contemplan 2 áreas geográficas adicionales: el sudeste asiático (por la existencia de Schistosoma japonicum en partes de China, Filipinas y zonas aisladas de Indonesia, y de Schistosoma mekongi en los rápidos de Si Phan Don en Laos, y las riberas y el delta del Mekong en la frontera entre Laos y Camboya)63,64, y Australasia (Oceanía y la parte oriental de Indonesia), por el riesgo de filariosis linfática.
En el primer escalón de este algoritmo se incluye la valoración clínica (anamnesis clínica y epidemiológica dirigida, exploración física detallada, analítica básica y otras pruebas opcionales en función los datos clínicos y epidemiológicos), el examen de parasitológico de 3 muestras de heces en días alternos y una serología de S.stercoralis (que puede complementarse con un cultivo de larvas en heces, según disponibilidad local). Las investigaciones más complejas o invasivas deben reservarse para: 1)los pacientes sintomáticos sin diagnóstico etiológico tras el estudio básico inicial; 2)aquellos cuyos datos clínicos, epidemiológicos o complementarios sugieran etiologías que requieran otras técnicas, y 3)los pacientes cuya eosinofilia no responda a tratamiento dirigido o empírico17.
Algunas preguntas de interés práctico• ¿Debe toda eosinofilia importada ser investigada? Aunque algunas infecciones causantes de eosinofilia pueden autolimitarse en el tiempo, otras pueden originar morbimortalidad importante (p.ej., la toxocariosis, la estrongiloidosis o las formas crónicas de esquistosomiasis o filariosis) o tener implicaciones de salud pública (transmisibilidad y/o carga futura de enfermedad)8-10,17,22,47. Esto es especialmente importante en inmigrantes y refugiados, en los que la eosinofilia no debe considerarse un hecho «normal» y siempre debe ser investigada62. Adicionalmente, en inmigrantes subsaharianos se ha demostrado que incluso una eosinofilia «relativa» (definida como cifras absolutas <450 eosinófilos/μl con porcentaje >5% sobre el total de leucocitos) puede ser indicativa de una geohelmintosis o una esquistosomiasis12,13.
• ¿Qué conducta debe seguirse en las co-parasitaciones? Frecuentemente, el estudio inicial de heces detecta protozoos no inductores de eosinofilia, tanto patógenos (p.ej., Giardia lamblia o Entamoeba histolytica, que requieren tratamiento específico) como no patógenos (Blastocystis hominis, Entamoeba coli, Entamoeba dispar, Entamoeba hartmanni o Endolimax nana, que no deben tratarse), pero que constituyen «marcadores de riesgo» de exposición fecal-oral a aguas y/o alimentos contaminados65, por lo que es recomendable repetir el examen de heces unas semanas más tarde e insistir en la búsqueda de otra/s parasitosis subyacente/s causante/s de eosinofilia. De igual modo, un mismo paciente puede presentar simultáneamente varias parasitosis que originen eosinofilia, pero en distinto grado y diferente contribución relativa. A modo de ejemplo, la detección en heces de huevos de T.trichiura (sin fase de migración larvaria y que induce una eosinofilia generalmente modesta) asociada a una eosinofilia intensa obliga a la búsqueda de otros agentes causales2.
• ¿Es necesario estudiar a los acompañantes de viaje o a los contactos íntimos o familiares de una persona con eosinofilia importada, aunque estén asintomáticos y con hemograma normal? El estudio puede ser recomendable en los compañeros de viaje de personas diagnosticados de esquistosomiasis aguda66; en acompañantes, contactos íntimos y familiares de pacientes diagnosticados de una infestación de elevada transmisibilidad como la sarna o la oxiurosis, y en la helmintiasis por S.stercoralis67.
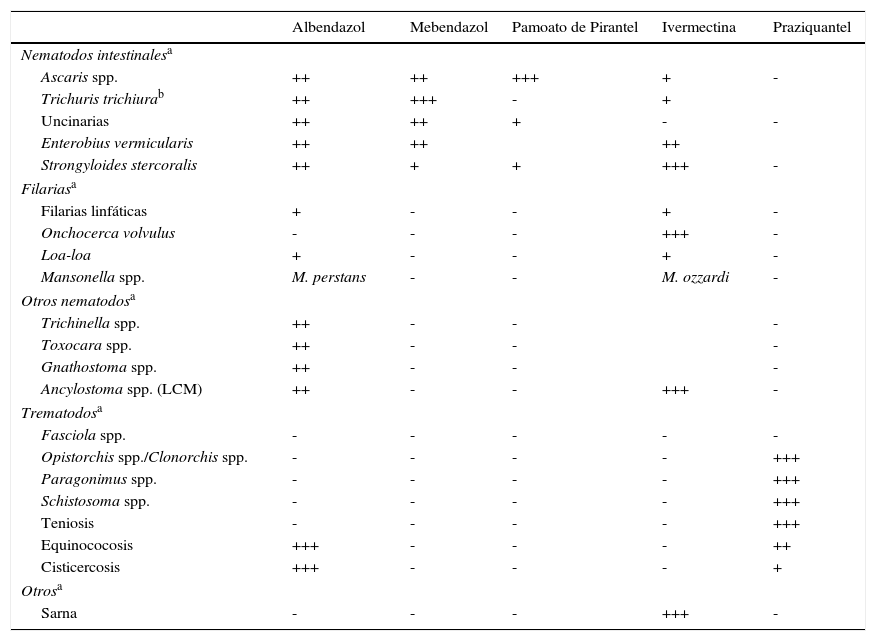
Tratamiento empírico de la eosinofilia importada no diagnosticadaSi finalmente no se alcanzase un diagnostico etiológico tras un estudio adecuado, se puede elegir entre el seguimiento del paciente y el tratamiento antihelmíntico empírico o «de prueba». La primera opción8 podría adoptarse en los pacientes con eosinofilia «sin factores de riesgo» asociados (asintomática, con cifras <1.500eosinófilos/μl, en pacientes inmunocompetentes y sin elevada probabilidad de «pérdida de seguimiento»). La segunda opción, el tratamiento empírico, debería idealmente cumplir los siguientes requisitos: 1)ser activo frente a la/las helmintosis más probable/s en el paciente a tratar; 2)ser activo frente a S.stercoralis, para evitar el riesgo futuro de un síndrome de hiperinfestación, y 3)minimizar el riesgo de precipitar un síndrome de lisis parasitaria deletéreo para el huésped7, y en la práctica estaría indicado en 2 situaciones: a)cuando no se pueda realizar un estudio diagnóstico completo ni asegurar el seguimiento del paciente (como sucede con frecuencia en inmigrantes recién llegados y en situación irregular), y b)ante una eosinofilia persistente tras estudio básico antes de indicar pruebas más complejas o de difícil disponibilidad22,68.
En la actualidad, los 3 antihelmínticos más utilizados para el tratamiento empírico (solo, secuencial o combinado) son albendazol (activo frente a la mayoría de los nematodos intestinales y muchos tisulares), ivermectina (con actividad frente a la mayor parte de las filarias y más activo que albendazol frente a S.stercoralis y LCM, aunque con menor actividad frente a A.duodenale, Ascaris spp. y T.trichiura) y praziquantel (activo frente a trematodos como Schistosoma spp. y Paragonimus spp., cestodos adultos y otros platelmintos excepto Fasciola spp.). En la tabla 8 se muestra el espectro de actividad de estos fármacos.
Actividad de los principales fármacos antihelmínticos
| Albendazol | Mebendazol | Pamoato de Pirantel | Ivermectina | Praziquantel | |
|---|---|---|---|---|---|
| Nematodos intestinalesa | |||||
| Ascaris spp. | ++ | ++ | +++ | + | - |
| Trichuris trichiurab | ++ | +++ | - | + | |
| Uncinarias | ++ | ++ | + | - | - |
| Enterobius vermicularis | ++ | ++ | ++ | ||
| Strongyloides stercoralis | ++ | + | + | +++ | - |
| Filariasa | |||||
| Filarias linfáticas | + | - | - | + | - |
| Onchocerca volvulus | - | - | - | +++ | - |
| Loa-loa | + | - | - | + | - |
| Mansonella spp. | M. perstans | - | - | M. ozzardi | - |
| Otros nematodosa | |||||
| Trichinella spp. | ++ | - | - | - | |
| Toxocara spp. | ++ | - | - | - | |
| Gnathostoma spp. | ++ | - | - | - | |
| Ancylostoma spp. (LCM) | ++ | - | - | +++ | - |
| Trematodosa | |||||
| Fasciola spp. | - | - | - | - | - |
| Opistorchis spp./Clonorchis spp. | - | - | - | - | +++ |
| Paragonimus spp. | - | - | - | - | +++ |
| Schistosoma spp. | - | - | - | - | +++ |
| Teniosis | - | - | - | - | +++ |
| Equinococosis | +++ | - | - | - | ++ |
| Cisticercosis | +++ | - | - | - | + |
| Otrosa | |||||
| Sarna | - | - | - | +++ | - |
El tratamiento de la infección por Trichuris trichiura con monodosis de los antihelmínticos habituales (pamoato de pirantel, mebendazol y albendazol) resulta insatisfactorio69, necesitando frecuentemente varias dosis o repetidas. Diversos estudios recientes han demostrado una mayor eficacia del pamoato de oxantel en niños, especialmente asociado a albendazol (Speich B, Ame SM, Alles R, Huwyler J, Hattendorf J, Utzinger J, et al. Oxantel pamoate-albendazole for Trichuris trichiura infection. N Engl J Med 2014; 370: 610-20.; Speich B, Ali SM, Ame SM, Bogoch II, Alles R, Huwyler J, et al. Efficacy and safety of albendazole plus ivermectin, albendazole plus mebendazole, albendazole plus oxantel pamoate, and mebendazole alone against Trichuris trichiura and concomitant soil-transmitted helminth infections: A four-arm, randomised controlled trial. Lancet Infect Dis 2015; 15: 277-84.)
El tratamiento se debe individualizar según las características del paciente y del fármaco elegido. Una primera opción es la monoterapia con albendazol: 400mg/24h durante 3-5días5, o 400mg/12h durante 336 o 518días. Es útil en viajeros de corta estancia con bajo riesgo de esquistosomiasis y filariosis18. La segunda opción es la asociación de albendazol e ivermectina (dosis habitual de 200μg/kg/día durante 2días consecutivos, aunque el régimen óptimo de ivermectina para S.stercoralis está aún por definir: una dosis única de 200μg/kg vs. 2 dosis de 200μg/kg durante 2días consecutivos, así como la necesidad de repetirlas a los 14días54). Esta combinación amplía el espectro etiológico frente a la mayoría de las filarias (exceptuando M.perstans) y las uncinarias zoonóticas causantes de LCM (Ancylostoma caninum y Ancylostoma braziliensis), y es sinérgica frente a las filarias linfáticas69. Finalmente, la triple asociación de albendazol (400mg/día, 5días), ivermectina (200μg/kg/día, 2días) y praziquantel (40mg/kg/día, repartida en 2dosis)16,22 es útil cuando exista riesgo epidemiológico de esquistosomiasis, y es una combinación segura y sin interacciones farmacológicas importantes.
No obstante, antes de iniciar el tratamiento es necesario tener en cuenta las siguientes recomendaciones para reducir el riesgo de lisis parasitaria masiva por la liberación de antígenos: 1)los pacientes con diagnóstico previo de neurocisticercosis no tratada o con antecedentes de convulsiones no filiadas (en particular los originarios de América Latina y Caribe)40 no deben recibir tratamiento empírico con albendazol ni praziquantel, debido al riesgo (bajo, pero no nulo) de desencadenar convulsiones; 2)los pacientes con sospecha clínica o epidemiológica de oncocercosis crónica (es decir, inmigrantes de África occidental y central con afectación ocular sugestiva, presencia de oncocercomas y/o lesiones cutáneas tipo oncodermatitis papular crónica o dermatosis hiperreactiva/swoda) es conveniente pretratarlos con prednisona (1mg/kg/día) varios días antes de administrar ivermectina, porque puede desencadenar una reacción de hipersensibilidad tipo Mazzotti grave con manifestaciones sistémicas graves y daño ocular irreversible, y 3)los inmigrantes de países endémicos de loaosis (Angola, Camerún, República Centroafricana, Chad, República del Congo, República Democrática del Congo [antiguo Zaire], Guinea Ecuatorial, Gabón, Nigeria y Sudán del Sur)71, en los que no se haya podido descartar una infección por Loa-loa en el estudio inicial, no deben recibir ivermectina empírica, debido al riesgo de encefalopatía grave). En la tabla 7 se muestran las opciones de tratamiento etiológico o dirigido de las principales causas de la eosinofilia importada, y en la tabla 9, los efectos adversos y las interacciones de los principales fármacos utilizados tanto en el tratamiento etiológico como en el dirigido.
Efectos adversos, interacciones y otras características de los principales fármacos antihelmínticos
| Albendazol | Ivermectina | Praziquantel | |
|---|---|---|---|
| Efectos adversos | |||
| Frecuentes | Dolor abdominal, ↑ transaminasas | Diarrea, dispepsia, cefalea (leves y transitorios) | Dolor abdominal, diarrea, malestar, cefalea, mareos |
| Ocasionales | Alopecia reversible, leucopenia | Reacción de hipersensibilidad (tipo Mazzotti) en oncocercosisa: fiebre, prurito, adenopatías, cefalea, artromialgias, daño ocular irreversible | Sedación, fiebre, nauseas, sudoración, eosinofilia |
| Raros | Rash, hepatotoxicidad, nefrotoxicidad | Hipotensión | Prurito, rash, edema, hipotensión |
| Interacciones | |||
| ↑ concentraciones del antihelmíntico | Praziquantelb, dexametasona, cimetidina | – | Ketoconazol, itraconazol, eritromicina, cimetidina |
| ↓ concentraciones del antihelmíntico | Carbamazepina, fenitoína, fenobarbital | – | Carbamazepina, fenitoína, fenobarbital, rifampicina, dexametasona |
| Otras interacciones | Acenocumarol (↑ riesgo de hemorragias) | ||
| Metabolismo | |||
| Toma del fármaco con comidas | Tras una comida rica en grasas (↑ biodisponibilidad y concentraciones tisulares) | Separada de las comidas (2 h) | Después de las comidas, con abundantes líquidos |
| Biodisponibilidad oral | < 5% | 60% | 80% |
| Metabolismo y eliminación | Hepático; biliar | Hepático (CYP3A4); fecal | Hepático, renal |
| Efecto de primer paso hepático | Sí, importante (↓ biodisponibilidad) | No | Sí, importante (↓ biodisponibilidad) |
| Concentración LCR | 43% de la sérica tras 7 días a dosis de 15 mg/kg/día v.o. | < 1% | 20% |
| Otras | Concentración biliar ≈ sérica | – | – |
| Situaciones especiales | |||
| Embarazo (teratogenicidad) | Uso con precaución durante el 1.er trimestre de embarazo Categoría FDA: C | Uso con precaución durante el 1.er trimestre de embarazo Categoría FDA: C | Se puede utilizar Categoría FDA: B |
| Lactancia | No contraindicado (OMS) | Evitarlo | No contraindicado |
| Niños | Contraindicado en < 1 año | Contraindicado en < 5 años | Contraindicado en < 4 años |
| Insuficiencia renal | No precisa modificar dosis | No precisa modificar dosis | No precisa modificar dosis |
| Insuficiencia hepática | Child-Pugh C u obstrucción biliar: reducir la dosis a la mitad | No precisa modificar dosis | Child-PughB o C: reducir la dosis a la mitadc |
| Otras | |||
| Vías de administración | Oral | Oral, tópica, subcutánea | Oral |
| Medicación extranjera | No | Sí | Sí |
| Evitar tratamiento empírico si: | Sospecha de neurocisticercosis (riesgo de convulsiones) | Sospecha de Loa-loa (especialmente si microfilaremia > 5.000/μl) por riesgo de encefalopatía graved Sospecha de oncocercosis con elevada carga parasitariaa, por riesgo de reacción tipo Mazzotti grave | Sospecha de neurocisticercosis (riesgo de convulsiones) |
| Otras | En tratamientos prolongados, monitorizar transaminasas y leucocitos cada 2 semanas | – | – |
Fuente: elaborada a partir de The Medical Letter61, Pérez-Molina et al.70, Kappagoda et al.72, Showler et al.73 y Taman y Azab74.
Países con riesgo de Loa-loa (CDC): Angola, Camerún, República Centroafricana, Chad, República del Congo, República Democrática del Congo (antiguo Zaire), Guinea Ecuatorial, Gabón, Nigeria y Sudán del Sur) (CDC71).
En los pacientes con diagnóstico etiológico es importante monitorizar la evolución de la cifra de eosinófilos tras el tratamiento dirigido e, idealmente, comprobar la curación clínica y parasitológica. En los pacientes sin diagnóstico etiológico tratados empíricamente se debe comprobar la normalización de la cifra de eosinófilos. Por lo general, descienden a los 15-20días del tratamiento, y se normalizan a los 1-3meses30, aunque con amplias variaciones: 2-3meses en la uncinariasis, 4-12meses en la esquistosomiasis aguda, 3 meses en las trematodosis hepáticas (p.ej., Opistorchis spp.) y 6meses o más en Trichinella spp. y S.stercoralis37,42. En la figura 2 se incluye un algoritmo para el seguimiento de los pacientes con eosinofilia importada.
La ausencia de respuesta al tratamiento (dirigido o empírico) plantea el diagnóstico diferencial de: 1)una reinfestación; 2)una parasitosis poco habitual, resistente (infrecuente; se han descrito casos en Schistosoma spp. y en T.trichiura) o insuficientemente tratada (posología o cumplimentación inadecuadas, malabsorción concomitante…); 3)una co-parasitación, o 4)una etiología no parasitaria7. En este último supuesto obliga a investigar una posible hipereosinofilia primaria, paraneoplásica o autoinmune y a detectar la posible afectación de órganos diana por la eosinofilia mantenida1-4,48.
FinanciaciónLos autores declaran no haber recibido financiación para la redacción de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.