Tras la consolidación de los programas de vacunación, los brotes de parotiditis siguen ocurriendo. En diciembre de 2011 se produjo en Zaragoza un brote escolar de parotiditis.
ObjetivoDescribir el brote y calcular la efectividad vacunal.
MétodoDefinición de caso: persona con inflamación de parótida/s u otras glándulas salivares de más de 2días sin otras causas aparentes.
Población de referenciaPersona perteneciente al Instituto de Educación Secundaria Obligatoria Parque Goya o con origen de la cadena de transmisión en el instituto.
Periodo del broteDesde 2días antes del inicio de síntomas del primer caso hasta 5días después del inicio del último caso. Se recogieron muestras para confirmación del virus (IgM, cultivo de orina y de exudado orofaríngeo) y los virus aislados fueron genotipados. Se realizó un estudio de cohortes retrospectivo en 2aulas del instituto para el cálculo de la efectividad vacunal. Se implantó vigilancia activa, aislamiento de los casos y recomendación de vacunación a contactos susceptibles.
ResultadosHubo 27 casos. El 77,8% estaban vacunados con 2dosis de triple vírica. El 44% fueron confirmados microbiológicamente. Se determinó el genotipo G1 en 6 casos. Según el estudio de cohortes, la efectividad vacunal para una dosis fue del 34%, (IC95%: −44 a 70) y para 2, del 67% (IC95%: 28 a 83).
ConclusionesLa efectividad vacunal se encuentra por debajo de lo esperado. La detección precoz y el aislamiento de los casos son fundamentales para prevenir nuevos casos en el ámbito escolar.
Mumps outbreaks continue to occur, even after the consolidation of vaccination programs. An outbreak of mumps occurred in a high school in Zaragoza during December 2011.
ObjectiveTo describe the outbreak and estimate vaccine effectiveness.
MethodsCase definition: unilateral or bilateral swelling of the parotid or other salivary glands for three or more days without any other apparent cause.
Reference populationPeople attending the ‘Parque Goya’ High School or with transmission chain origin in the High School.
Outbreak periodFrom two days before the onset of symptoms of the first case to five days after the last case. Samples were collected for virus confirmation (IgM, urine culture and oropharyngeal exudate), and isolates were processed for genotyping. A retrospective cohort study was performed in two high school classrooms to estimate vaccine efficacy. Public health authorities conducted active surveillance, isolation of cases, and vaccination of susceptible contacts.
ResultsThere were 27 cases. Twenty-one (77.8%) were vaccinated with two doses of Measles-Mumps-Rubella vaccine. Twelve (44%) were confirmed microbiologically. G1 genotype was determined in six cases. According to the cohort study, vaccine efficacy for one dose was 34% (95%CI: −44 to 70), and was 67% (95%CI: 28 to 83) for two doses.
ConclusionsVaccine effectiveness was lower than expected. Early detection and isolation of cases have been instrumental in preventing new cases in schools.
La incidencia de parotiditis ha disminuido desde la implantación de los programas de vacunación. En España, de 560 casos/100.000 habitantes en el año 1985 se pasó a 2,9 casos/100.000 habitantes en el año 2010. Durante este periodo se registraron 4 ondas epidémicas en los años 1988-1990, 1995-1996, 1998-2002 y 2006-2008, con picos de incidencia de 250, 50, 44 y 21 casos por 100.000 habitantes por año respectivamente1.
En Aragón la vacuna para la parotiditis se introdujo con una sola dosis en 1984 a los 15meses, y en 1995 se añadió la segunda dosis a los 11años. Posteriormente se establecieron 2 modificaciones: la segunda dosis se adelantó a los 6años (año 2005) y la primera a los 12meses (año 2011)2. Las cepas utilizadas en la vacuna han sido Jeryl-Lynn, RIT 4385 y Rubini, esta última solo durante los años 1995 a 1998 por haberse demostrado una efectividad menor que para la cepa Jeryl-Lynn3.
Las coberturas vacunales en la provincia de Zaragoza para la primera dosis desde el año 2001 hasta la actualidad fueron entre el 94 y el 98%, y para la segunda dosis, entre el 90 y el 98%.
Los estudios basados en la realización de ensayos clínicos demostraron una eficacia vacunal en torno al 95% para una dosis. Otros estudios basados en brotes muestran una efectividad menor, del 62-85% para una dosis, y del 76-95% para 2 dosis (Reino Unido y Canadá)4,5. Por esta razón, incluso en poblaciones con coberturas vacunales altas pueden producirse brotes epidémicos cuando no se alcanzan los suficientes niveles de inmunidad6.
En España los brotes de parotiditis han estado relacionados con personas no vacunadas o vacunadas con la cepa Rubini7-9. Con la aparición de brotes en población con altas coberturas vacunales para 2 dosis, incluso de cepas diferentes a Rubini, se concluyó que además podrían estar relacionados con el alto grado de exposición en lugares como centros educativos o domicilios10-12, donde la transmisión puede ser hasta un 75% mayor que en la comunidad13.
En la provincia de Zaragoza, el último estudio de efectividad vacunal data de 1990, cuando todavía no se había introducido la segunda dosis de triple vírica. En ese año se produjo un brote con 52 casos, y se calculó una efectividad vacunal (EV) del 74,78%, con un intervalo de confianza (IC) del 95% (53,27 a 86,11)11. Desde entonces hasta la actualidad los brotes han sido de magnitud inferior, entre 2-7 casos por brote, excepto en el año 2006, en que se registró un brote poblacional con 1.016 casos.
El 12 de diciembre de 2011 el director de un instituto de educación secundaria obligatoria de Zaragoza notificó a la Red de Vigilancia Epidemiológica de Aragón el diagnóstico de parotiditis en 2 niños del instituto y la ausencia inusual a clase de otros 5 niños.
La aparición de brotes de enfermedades vacunables representa una oportunidad para estudiar las características de la transmisión y permite estimar la efectividad vacunal.
El objetivo es describir el brote de parotiditis y calcular la efectividad vacunal.
MétodosEl instituto está situado al norte de la ciudad de Zaragoza. La población de referencia fueron los 235 alumnos y 27 profesores del curso escolar 2011-2012 y aquellos casos con origen en la cadena de transmisión en el instituto.
Definición de caso del brote: persona que presentó inflamación unilateral o bilateral, sensible al tacto y autolimitada, de la parótida u otras glándulas salivares superior a 2días y sin otras causas aparentes, perteneciente al Instituto Parque Goya o con origen de la cadena de transmisión en el instituto, durante el periodo definido del brote.
Definición de caso confirmado por laboratorio: persona en la que se aisló el virus de la parotiditis en una muestra clínica u obtuvo resultados IgM positivos para parotiditis en suero u obtuvo resultados PCR positivos en una muestra clínica.
Definición de brote: aparición de 2 o más generaciones de casos, considerándose generación de casos la aparición de 2 o más casos cuyas fechas de inicio de síntomas (FIS) distan menos de un periodo de incubación (de 14 a 25días).
Periodo de brote: desde 2días antes de la FIS del primer caso hasta 5días tras la FIS del último caso (del 23 de noviembre de 2011 al 17 de enero de 2012).
Se definió vacunado como aquella persona con datos de vacunación registrados en su cartilla de vacunación o en su historia clínica de atención primaria, y correctamente vacunado cuando aparecían registradas 2 dosis, siendo la primera después de los 12meses de edad y el periodo entre dosis superior a 4semanas.
Para la investigación microbiológica se recogieron de los casos muestras para serología IgM en suero, y para cultivo en orina y exudado orofaríngeo, considerando el tiempo óptimo de recogida (entre el 4.°-8.°día de la fecha de inicio de síntomas para IgM, y entre el 0-7.°día de la fecha de inicio de síntomas para ambos cultivos)14, y fueron analizadas en el Laboratorio de Microbiología del Hospital Universitario Miguel Servet. Los virus aislados en los cultivos de exudado orofaríngeo fueron enviados al Centro Nacional de Microbiología del Instituto de Salud CarlosIII en Majadahonda (Madrid) para la realización de PCR y genotipado.
La detección de IgM en suero se realizó mediante técnica ELISA en microplaca Enzygnost® (Siemens Healthcare, Marburg/Alemania). Para los cultivos se inocularon las muestras en tubos con monocapas de células vero, observando al microscopio invertido la aparición de efecto citopático (sincitios), y se incubaron 14días de máximo, siendo confirmados con anticuerpos monoclonales específicos mediante técnica de inmunofluorescencia indirecta (Light Diagnostics, Temecula/EE.UU.). Para el análisis de PCR y genotipado se realizaron 2 alícuotas de cada muestra. En la primera se realizó la extracción total de ácidos nucleicos con extractor automático (MagNa Pure LC total Nucleic) mediante lisis externa y se buscaron los extractos ARN mediante una nested-RT-PCR; las muestras positivas fueron confirmadas en una segunda nested-RT-PCR, y se realizó la amplificación de un fragmento del gen de la proteína SH. La segunda alícuota se utilizó para la confirmación de los resultados positivos. El genotipado se hizo por secuenciación del fragmento de amplificación del gen SH de la segunda RT-PCR15.
Las muestras se solicitaron por los médicos de los casos mediante un procedimiento común de diagnóstico, y los padres/tutores de los casos accedieron a la recogida de muestras, no siendo necesario el consentimiento informado por escrito.
Se diseñó un estudio de cohortes retrospectivo que incluyó a los alumnos de las aulas del instituto con mayor número de casos. Fueron 53 alumnos de 16-17años (27 de 3.°A y 26 de 3.°B), de los cuales el 55% fueron hombres. Se recogieron datos sobre el número de dosis, cepas, lotes y centros de administración de las vacunas. El periodo de observación fue desde 2días antes de la FIS del primer caso de la cohorte hasta 5días después de la FIS del último caso de la cohorte (del 23 de noviembre al 29 de diciembre de 2011).
Se calculó la asociación de enfermar con la edad, el sexo y el aula, utilizando la prueba de chi cuadrado para variables sexo y aula, y la de U de Man-Whitney para la variable edad, considerando diferencias estadísticamente significativas un valor de p<0,05. Se comprobó previamente la normalidad de las distribuciones por edad en casos y no casos con el test de Kolmogov-Smirnov, considerando distribución normal si p>0,05.
Para el cálculo de la efectividad vacunal se excluyeron del análisis los alumnos sin datos de vacunación y el caso primario (por desconocer su periodo de exposición).
Se calcularon tasas de incidencia (TI) en vacunados con una dosis, en correctamente vacunados, y en no vacunados, según lo siguientea:
Se calculó la razón de tasas de incidencia (RTI) con su IC del 95% (Katz)16 como:
Se calculó la efectividad vacunal (EV) y su IC del 95% según lo siguiente:
El límite superior del IC=(1−el límite inferior del IC de la RTI)·100
El límite inferior del IC=(1−el límite superior del IC de la RTI)·100
Se implantó vigilancia activa de nuevos casos en el instituto y en los domicilios de los casos hasta pasados 50días de la FIS del último caso. Se recomendó el aislamiento domiciliario a los casos hasta pasados 5días de la FIS, y la vacunación a convivientes de los casos, alumnos y profesores del instituto, y sanitarios contactos de los casos nacidos después del 1 de enero de 196617 y sin registro de vacunación con 2 dosis de triple vírica. No se recomendó la vacunación a aquellos con resultados microbiológicos positivos para el virus (IgG, IgM o cultivo) anteriores al brote, o los que aparecieron como casos de brote de parotiditis en el registro de la Red de Vigilancia Epidemiológica de Aragón.
Se utilizaron los programas Epidat 3.1 y SPSS 15.
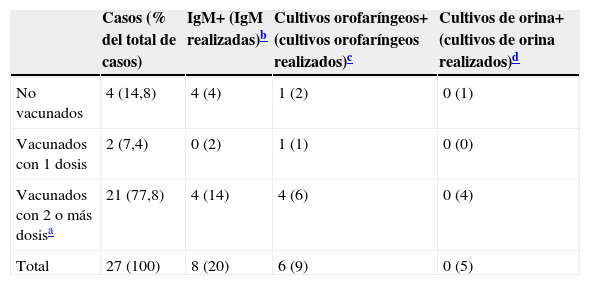
ResultadosDescripción del broteDurante el periodo del brote se detectaron 27 casos (19 alumnos del instituto, un profesor y 7 personas no pertenecientes al instituto). El periodo de incubación se pudo calcular para 23 casos (85%), siendo la mediana 18días (rango, 13 a 24). La mediana de edad fue 14años (rango, 10 a 39). El 70% de los casos fueron hombres. Todos los casos presentaron inflamación de parótidas (18,5% bilateral y 81,5% unilateral) y el 44,4%, fiebre. Otros síntomas fueron menos frecuentes (tabla 1). El 77,8% estaban correctamente vacunados según el Calendario de Vacunación Infantil de Aragón2 (tabla 2).
Síntomas de los casos del brote de parotiditis, Zaragoza 2011
| Síntomas | Casos | % |
|---|---|---|
| Inflamación de parótidas | 27 | 100 |
| Inflamación unilateral | 22 | 81,5 |
| Inflamación bilateral | 5 | 18,5 |
| Fiebre>38°C | 12 | 44,4 |
| Inflamación ganglionar | 6 | 22,2 |
| Otalgia | 4 | 14,8 |
| Amigdalitis | 3 | 11,1 |
| Orquitis | 2 | 7,4a |
| Cefalea | 2 | 7,4 |
| Astenia | 1 | 3,7 |
Vacunación y resultados microbiológicos de los casos del brote de parotiditis, Zaragoza 2011
| Casos (% del total de casos) | IgM+ (IgM realizadas)b | Cultivos orofaríngeos+ (cultivos orofaríngeos realizados)c | Cultivos de orina+ (cultivos de orina realizados)d | |
|---|---|---|---|---|
| No vacunados | 4 (14,8) | 4 (4) | 1 (2) | 0 (1) |
| Vacunados con 1 dosis | 2 (7,4) | 0 (2) | 1 (1) | 0 (0) |
| Vacunados con 2 o más dosisa | 21 (77,8) | 4 (14) | 4 (6) | 0 (4) |
| Total | 27 (100) | 8 (20) | 6 (9) | 0 (5) |
El caso primario fue una alumna de 3.°B con diagnóstico tardío. A partir de este, se produjo una segunda generación con 17 casos, una tercera generación con 8 casos, y una cuarta y última generación con un caso (fig. 1). El estudio de las relaciones entre los casos permitió trazar la cadena de transmisión desde el caso primario hasta el último caso, detectándose la transmisión escolar (71,1% de los casos), domiciliaria (11,1% de los casos), y otras menos frecuentes (fig. 2).
Estudio microbiológicoSe obtuvieron 20 muestras serológicas de 20 casos para determinación de IgM, de las cuales 8 fueron positivas. El porcentaje de positivos fue diferente entre los casos vacunados (25%) y los casos no vacunados (100%) (tabla 2).
Se aisló el virus de la parotiditis en 6 de los 9 exudados nasofaríngeos obtenidos para cultivo. En todas las cepas obtenidas se verificó el mismo patrón genético (G1). No se aisló el virus en ninguna de las 5 muestras de orina obtenidas para cultivo.
Estudio de cohortes retrospectivoCatorce alumnos de la cohorte (26,4%) padecieron parotiditis, y no hubo relación estadísticamente significativa entre ser caso con la edad (p=0,66), el sexo (p=0,84) o el aula (p=0,18).
Se obtuvieron datos de número de dosis de vacuna de todos los alumnos excepto de 2. Excluyendo a estos y al caso primario, la tasa de incidencia fue de 50 casos por 100 personas-día en no vacunados, 33 casos por 100 personas-día en vacunados con una sola dosis, y 18 casos por 100 personas-día en vacunados con 2 dosis o más. La estimación puntual de la efectividad vacunal fue del 34% en vacunados con una sola dosis, con un IC95% no significativo, y del 67% (IC95%: 28 a 83%) en vacunados con 2 dosis o más (tabla 3).
Tasas de incidencia y efectividad vacunal por dosis de vacuna para los alumnos del estudio de cohortes retrospectivo, Zaragoza 2011
| Total | Casos | TI (× 100 personas-día) | RTI | EV (%) | IC (95%) EV | |
|---|---|---|---|---|---|---|
| 0 dosis | 2 | 1 | 50 | − | − | − |
| 1 dosis | 5 | 2 | 33 | 0,66 | 34 | (−44 a 70) |
| 2 dosis o más | 43 | 10 | 16 | 0,33 | 67 | (28 a 83) |
| Totala | 50 | 13 | 20 | − | − | − |
EV: efectividad vacunal; IC: intervalo de confianza; RTI: razón de tasas de incidencia; TI: tasa de incidencia.
De los 53 alumnos de la cohorte observada se obtuvieron datos sobre cepas de las vacunas en 44 (5 vacunados con una dosis, 37 con dos dosis y 2 con 3 dosis). El estudio de las cepas reveló gran variabilidad respecto a la combinación de cepas utilizadas. El patrón más repetido fue vacunados con 2 dosis, la primera vacuna de la cepa Rubini y la segunda de la cepa Jeryl Lynn (19 individuos). Entre ellos se dieron 5 casos. En la cohorte hubo otras 8 combinaciones de cepas, y en 6 de ellas se registró al menos un caso (tabla 4).
Cepas vacunales
| Vacunados | Casosa | |
|---|---|---|
| Jerry Lynn (1 dosis) | 2 | 1 |
| Rubini (1 dosis) | 2 | 1 |
| RIT 4385 (1 dosis) | 1 | 0 |
| Rubini-Jeryl Lynn (2 dosis) | 19 | 5 |
| Rubini-RIT 4385 (2 dosis) | 5 | 1 |
| Jeryl Lynn-RIT 4385 (2 dosis) | 11 | 3 |
| Jeryl Lynn-Jeryl Lynn (2 dosis) | 2 | 0 |
| Rubini-Jeryl Lynn-RIT 4385 (3 dosis) | 1 | 1 |
| Rubini-RIT 4385-RIT 4385 (3 dosis) | 1 | 1 |
Las vacunas provenían de 28 lotes. Los casos recibieron vacunas de 14 lotes diferentes, produciéndose la máxima agrupación de casos (7) en los vacunados con el lote L07. Los otros lotes de vacunas que recibieron los casos en número inferior fueron: K09, J07, K001, M002, L001, N015, N020, N025, S9, P4, N4, T1 y N6.
Las vacunas habían sido administradas en 20 centros. Uno de los centros registró la máxima agrupación de casos (5), aunque hubo otros 10 centros en donde se administró la vacunación a los casos en menor número.
DiscusiónLos centros escolares y los domicilios favorecen la transmisión del virus de la parotiditis incluso en poblaciones con altas coberturas vacunales18. En el brote se ha demostrado la transmisión escolar, domiciliaria, y otras menos frecuentes. Diferentes estudios también han demostrado la transmisión escolar y domiciliaria, como en un brote en Vizcaya en 2006 en el que el 82,5% de los casos fueron alumnos de un mismo colegio12, o un estudio en los Países Bajos en 2010 en el que se describió la transmisión en contactos familiares mediante evidencia serológica de infección19.
Cuando aparecen brotes en poblaciones con altas coberturas de vacunación es inevitable que se produzca un alto porcentaje de casos en vacunados20,21. En el brote estudiado el 85,2% estaban vacunados (el 77,8% con 2 dosis); este porcentaje de casos en vacunados con 2 dosis fue del 99% en un brote con 97 casos universitarios de Kansas22.
El estudio microbiológico confirmó el virus de la parotiditis genotipo G1 como agente etiológico del brote, siendo este genotipo el que circula de forma mayoritaria en España desde el año 200523.
Se obtuvo un 75% de resultados negativos de IgM de las muestras de casos vacunados, además en 4 de ellos el cultivo de exudado orofaríngeo fue positivo; estos datos son acordes con lo descrito en la literatura24, e indican que la determinación de serología IgM tiene una sensibilidad baja para el diagnóstico en pacientes con antecedentes de vacunación.
No hemos podido determinar a qué es debida la discordancia entre los porcentajes de los resultados positivos de los cultivos de nuestro estudio (66% de los exudados faríngeos y 0% de las muestras de orina) y los de otros estudios (96% de los exudados faríngeos y 98% de las muestras de orina)25. Teniendo en cuenta que se descartó un error en la técnica y que las muestras fueron recogidas en tiempo óptimo, pensamos que sería necesario un estudio específico para valorar la contribución del cultivo de orina en el diagnóstico de confirmación de la parotiditis. En cualquier caso, es importante subrayar que se obtuvieron solamente 5 muestras de orina.
Dado que la efectividad de la vacuna es limitada4,5 y la acumulación de susceptibles es inevitable, el diagnóstico y aislamiento precoz de los casos es una medida fundamental en el control de brotes. En este brote el caso primario tuvo un diagnóstico tardío y la propagación del virus en el instituto pudo darse durante todo el periodo de transmisibilidad, provocando la mayor proporción de casos. Aunque no se evaluaron las medidas adoptadas, los datos parecen indicar que el aislamiento de los casos que aparecieron después de implantar las medidas de control tuvo un efecto importante, ya que la extensión a otras aulas fue muy limitada y no hay razón para pensar que los susceptibles estuvieran confinados en las aulas donde se dieron más casos.
La estimación de la efectividad vacunal, para los vacunados tanto con una dosis (34%) como con 2 (66%), fue inferior a la esperada (entre 62 y 85% para una dosis y entre 76 y 95% para 2 dosis)4,5.
Los fallos vacunales por causas prevenibles relacionadas con la fabricación, refrigeración o manipulación pueden ocurrir y afectan a la estimación de la efectividad vacunal21. No se ha detectado que ninguna cepa vacunal fuera un factor determinante en el brote, como ha ocurrido en otros11,26, ya que se han producido casos en vacunados con casi todas las combinaciones de cepas administradas. La variación de centros en los que se administraron las vacunas a la cohorte (20 diferentes) no apunta a rotura de la cadena del frío por fallo de conservación. Los defectos en la fabricación también pueden disminuir la efectividad y están ligados a la administración de lotes específicos; la cohorte llegó a recibir vacunas de 14 lotes diferentes, por lo que este defecto no parece posible.
Otra explicación posible de la baja efectividad son los sesgos inherentes al diseño del estudio analizados por Orenstein21. La asignación errónea de los miembros de la cohorte a la categoría de vacunados o no vacunados es uno de ellos. En nuestro estudio este sesgo es improbable, ya que el estado vacunal ha sido verificado documentalmente en toda la cohorte, y se han excluido del análisis los alumnos para los que no se obtuvieron datos. Existen otros sesgos que sí han podido afectar a nuestros resultados; uno de ellos es que no se consideraron los antecedentes de parotiditis, y es posible que los no vacunados tuvieran antecedentes de parotiditis con mayor frecuencia que los vacunados, lo que hubiera producido una subestimación de la efectividad vacunal. Este sesgo es difícil de controlar debido a los diferentes procesos que ocasionan inflamación de las glándulas parótidas27 y a la existencia de casos asintomáticos28.
En la mayoría de los brotes de parotiditis publicados7,10,11,29-31 se utilizan tasas de ataque para estimar la efectividad vacunal considerando que el tiempo de exposición para todos los individuos de la cohorte es el mismo. En nuestro estudio se han utilizado tasas de incidencia, considerando el periodo de exposición al virus de cada individuo y permitiendo así el cálculo de una efectividad vacunal menos sesgada. Esto no quiere decir que la estimación de la efectividad vacunal esté libre de sesgo de exposición. Hay que tener en cuenta que la interacción entre los estudiantes no se produce exclusivamente en el aula o en el centro escolar, sino en otros ámbitos. Una exposición extraescolar mayor en los vacunados podría haber sido otra de las razones por las que la eficacia vacunal calculada es inferior a la de otros estudios4-5.
ConclusionesEl estudio del brote ha determinado el virus de la parotiditis genotipo G1 como agente causal. La detección precoz y el aislamiento, incluso para casos vacunados con resultados IgM negativos, son fundamentales para prevenir casos en el ámbito escolar. Los datos del estudio de cohortes descartan como determinantes del brote los fallos vacunales prevenibles relacionados con la fabricación, refrigeración o manipulación. La estimación puntual de la efectividad vacunal se encuentra por debajo de lo esperado. No obstante, no se han considerado los antecedentes de parotiditis, pudiendo dar lugar a una infraestimación de la efectividad vacunal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A José Ignacio Lafuente Martínez, director del Instituto de Educación Secundaria Obligatoria Parque Goya, por su colaboración en la notificación del brote y aportación de datos imprescindibles para la realización del estudio.
A Manuel Tomás Omeñaca Teres, del Laboratorio de Microbiología del Hospital Universitario Miguel Servet, por su colaboración en la confirmación de los casos así como su aportación a la metodología respecto a las técnicas de análisis microbiológico.
A Inmaculada Cuesta Esteve, de la Sección de Programas de la Subdirección Provincial de Salud Pública de Zaragoza, por su colaboración en la aportación de datos de coberturas vacunales de la provincia de Zaragoza.
El periodo de exposición de los no casos fue el total de días desde el inicio del brote hasta el final del mismo, y para los casos desde el inicio del brote hasta el día de la fecha de inicio de síntomas. Los días de exposición fueron los de asistencia a clase, excluyendo sábados, domingos, festivos o días de absentismo escolar.