La diarrea del viajero (DV) se adquiere principalmente a través de la ingestión de alimentos y bebidas contaminados con patógenos que causan diarrea, y que pueden ser bacterias, protozoos, helmintos y virus. A nivel mundial, las causas más comunes de DV son 2 patotipos de Escherichia coli (enterotoxigénico y enteroagregativo) y Campylobacter, aunque hay variaciones importantes según el área geográfica visitada. La mayor parte de las DV tienen lugar en viajeros a países de baja y mediana renta. El tipo de viaje, la duración de la estancia, la edad del viajero y la presencia de ciertas patologías de base son factores de riesgo importantes a considerar para la adquisición de una DV. Aunque la DV es generalmente una enfermedad leve y autolimitada, la mitad de los viajeros con DV experimentarán una cierta limitación de las actividades durante su viaje, mientras que hasta el 10% experimentarán diarrea persistente u otras complicaciones.
El objetivo de este artículo es proporcionar un retrato microbiológico, epidemiológico y clínico actualizado de la DV, incluidos los factores de riesgo conocidos, y hacer recomendaciones sobre la prevención y el tratamiento de la DV.
Traveller's diarrhoea (TD) is acquired primarily through ingestion of food and drinks contaminated with pathogens that cause diarrhoea. They can be bacteria, protozoa, helminths, and viruses. Globally, the most common causes of TD are two pathotypes of Escherichia coli (enterotoxigenic and enteroaggregative) and Campylobacter, although there are significant variations by geographic area visited. Most TD occurs in individuals traveling to low-middle income countries. The type of travel, length of stay, traveller's age, and the presence of certain underlying conditions are important risk factors to consider for the acquisition of TD. While TD is usually a mild and self-limiting disease, half of travellers with TD experience some limitation of activities during their trip, while up to 10% will experience persistent diarrhoea or other complications.
The purpose of this article is to provide an updated microbiological, epidemiological, and clinical profile of traveller's diarrhoea, including known risk factors, as well as to make recommendations on the prevention and treatment of TD.
El aumento del turismo a nivel mundial ha provocado un incremento de las patologías importadas en los países occidentales, entre los cuales destaca, por su frecuencia, la diarrea del viajero (DV)1. No obstante, existen otros grupos de riesgo para el desarrollo de DV que deben ser tomados en consideración: militares desplazados, expatriados y misioneros y atletas olímpicos, entre otros2-5.
En la clínica de viajeros del Hospital Clínic de Barcelona, el 28% del total de consultas son debidas a la DV. Se calcula que actualmente los países de baja renta reciben el 20% del turismo mundial, y son estos países los que están considerados como una zona de alto riesgo para la adquisición de una diarrea. La frecuencia de diarrea en los viajeros a estas zonas es del orden del 30-50%1, según el área visitada.
Aunque la incidencia de la DV ha ido descendiendo en general en los últimos años, los problemas gastrointestinales continúan siendo el primer motivo de consulta en viajeros que regresan con problemas de salud de su estancia en el extranjero6. Según GeoSentil (Red de centros de atención al viajero a nivel mundial donde se registran de forma sistemática datos de morbilidad de los viajeros atendidos), se estima que un tercio de las vistas en las clínicas posviaje de la red están relacionadas con la DV7.
En este artículo pretendemos realizar una revisión de los aspectos microbiológicos, epidemiológicos y clínicos de la DV.
Características de la diarrea del viajeroLa DV se define como la presencia de 3 o más deposiciones de consistencia blanda-liquida en 24h, además de presentar al menos uno de los siguientes síntomas: dolor abdominal tipo cólico, tenesmo, náuseas, vómitos, fiebre o urgencia en la deposición8. Esta entidad se presenta fundamentalmente en viajeros de países con nivel socioeconómico alto que se desplazan por diferentes motivos a países de renta baja o intermedia.
Dado que la incidencia de la DV varía a lo largo del viaje, normalmente se calcula dicha incidencia durante las 2 primeras semanas del recorrido. En base a este período de 15días el riesgo de desarrollar DV se considera alto cuando la incidencia es ≥20%, intermedio con incidencias que oscilen entre el 8-20% y bajo cuando la incidencia cae por debajo del 8%9.
Según la literatura, la incidencia de la DV ha ido descendiendo en los últimos años, variando actualmente entre el 10 y el 40% cuando 20años atrás era del 65%10. En general se cree que la reducción en la incidencia de la DV se relaciona más estrechamente con el nivel de higiene del lugar de destino más que con las intervenciones específicas implementadas por el viajero10.
El 60% de los viajeros inician la DV la primera semana de viaje y la duración suele ser de 3-4días. La mayoría de diarreas suelen presentar unas heces de características líquidas, y en el 75% de los casos presentan alguna sintomatología que las acompaña (dolores abdominales, náuseas, vómitos), entre las que destacan la fiebre, que afecta a un 13% de los viajeros.
Factores de riesgoExisten diversos factores de riesgo asociados con el desarrollo de DV durante un viaje, fundamentalmente factores relacionados con el viaje y otros asociados al huésped o viajero. A continuación resumimos algunos de los más importantes y exponemos otros en los que existe controversia.
Factores ambientales o relacionados con el tipo de viajeTiempo de exposición y tipo de viajeEl presupuesto que se tiene para un viaje es lo que determina en gran medida el tipo de viaje y dónde se realizará la ingesta de alimentos durante el mismo. Los mochileros y personas jóvenes con presupuestos más reducidos suelen ser usuarios de puestos callejeros o de restaurantes más informales11.
Por otra parte, el hecho de viajar a hoteles de 4 o 5 estrellas no es un factor de protección absoluto frente a la adquisición de DV12,13. Se han descrito en la literatura brotes de DV después de eventos realizados en hoteles de 5 estrellas en situaciones donde la comida se ha servido en formato buffet, donde es más complicado mantener la comida a temperatura adecuada y la manipulación manual es más frecuente.
Los viajeros que van a visitar a su familia o amigos, los llamados VFR por sus iniciales en inglés (visting friends and relatives), junto con los mochileros y los viajeros del «todo incluido», presentan un riesgo algo mayor de DV que los viajeros a destinos de playa14,15 o en cruceros por el mar.
En los últimos años se ha objetivado un descenso en la incidencia de DV en los viajeros de cruceros16, y actualmente el riesgo de DV en estos viajes es inferior a un viaje de igual duración en tierra firme.
El tipo de viaje también es importante ya que, en los estudios efectuados, las personas que hacen viajes de aventura (trekking) tienen más riesgo de adquirir una DV. Los viajes que incluyen cruceros fluviales también son de riesgo para la DV, contrariamente a lo que sucede en los cruceros marítimos17.
Bebidas y alimentos consumidos durante el viajeAunque tradicionalmente siempre se ha correlacionado el consumo de alimentos de alto riesgo (tipo ensaladas, agua no embotellada, hielos, fruta no pelada, helados artesanales, etc.) con la adquisición de la DV, según las últimas publicaciones el hecho de evitar dichos alimentos no siempre se relaciona con un descenso en la DV.
Aunque teóricamente plausible desde el punto de vista fisiológico, la mayoría de estudios en los que se basa este tipo de restricciones alimentarias han sido retrospectivos. De los pocos estudios hechos prospectivamente para evitar el sesgo de recuerdo sugiere que el riesgo de DV aumenta con el número de errores alimentarios (definidos como ingesta de alimentos descritos previamente), aunque dado que solo se consiguió un índice de respuesta del 31%, los resultados no son concluyentes9.
En base a los conocimientos actuales parece que el riesgo de adquirir la DV se correlacionaría más con las medidas higiénicas de los locales de restauración donde se ingieren los alimentos (tipo presencia de picas para lavar las manos después de ir al baño los trabajadores, almacenar los alimentos en zonas cerradas para que no puedan acceder moscas, mantener los alimentos a una temperatura adecuada, etc.) que con las medidas de evitación o restricción alimentarias puestas en práctica por parte del viajero10.
Aunque hoy en día es necesario seguir aconsejando a los viajeros las precauciones habituales a la hora de seleccionar los alimentos ingeridos (beber agua embotella, fruta pelada y evitar los alimentos crudos y los hielos), no podemos asegurar que estas medidas preventivas sean realmente eficaces.
Factores del huéspedSexoNumerosos estudios han demostrado que no existe diferencia en la incidencia de la DV entre hombres y mujeres14,18, aunque sí existe diferencia en el comportamiento a la hora de buscar ayuda sanitaria una vez que la DV se presenta, siendo las mujeres más proclives a solicitar valoración por personal sanitario19.
EdadLos adultos jóvenes presentan una mayor frecuencia de diarrea que los de más edad. Las razones de este hecho se explican por el estilo más aventurero de los viajes en estas edades, una inmunidad adquirida menor y costumbres alimentarias diferentes18.
Antecedentes de patología gástrica o usuarios de inhibidores de la bomba de protonesEl antecedente de patología gástrica (gastritis, úlcera, gastrectomizados) es un factor de riesgo para la adquisición de DV20, de modo que las personas que sufren este tipo de problema tendrían que estar bien aconsejadas antes de hacer un viaje.
Pacientes inmunodeprimidos y antecedentes de enfermedad inflamatoria intestinalSegún la literatura, los pacientes con enfermedad inflamatoria intestinal presentan una incidencia mayor de DV, así como mayor duración de la misma, que los controles21. Por el contrario, no existe diferencia en la incidencia o duración de la DV en pacientes que toman medicación inmunosupresora22.
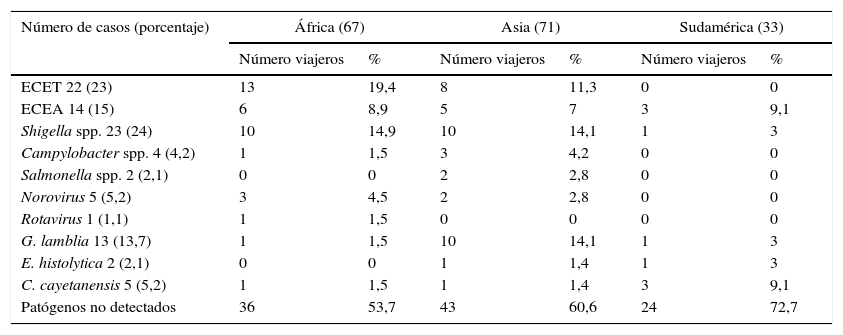
Etiología de la diarrea del viajeroLa etiología infecciosa del síndrome de la DV se reparte entre bacterias, protozoos, helmintos y virus. En la tabla 1 se pueden ver los principales diagnósticos efectuados en una serie de 174 pacientes con DV que habían viajado a países tropicales o subtropicales23. Entre los diferentes tipos de Escherichia coli diarreagénicos, las cepas enterotoxigénicas de Escherichia coli (ECET)24 son las más frecuentemente asociadas con DV. Además se han descrito también como una causa frecuente de diarrea en niños con edad inferior a 5años en países en vías de desarrollo25,26. ECET se adhiere y coloniza la mucosa intestinal humana gracias a fimbrias llamadas factores de colonización (CF)24. Después de la adhesión a la mucosa mediada por CF, ECET elabora la toxina lábil al calor (TL) y/o la toxina estable al calor (TE), provocando la secreción de agua y electrólitos24. Son las cepas con toxina termolábil las más aisladas en los viajeros catalanes27. Otro patotipo de E.coli frecuentemente encontrado como causa de DV es el E.coli enteroagregativo (ECEA)23,28. Este patotipo posee como principal característica su adherencia a células tipo HEp-2, presentando una agregación bacteriana. Si bien se han descrito diversos factores de virulencia en ECEA29, las fimbrias AAF/I, AAF/II, AAF/III, AAF/IV y AAF/V juegan un papel importante en la adherencia y están reguladas por el factor transcripcional AggR codificado por un gen localizado en un plásmido de virulencia30. Además, otro factor a tener en cuenta y que podría explicar la cronicidad que presentan las diarreas ocasionadas por este microorganismo es la producción de biopelícula que facilitaría la persistencia de la bacteria adherida a la mucosa del tracto intestinal31.
Principales bacterias, virus y protozoos aislados en un estudio de 174 pacientes con diarrea del viajero. Distribución geográfica
| Número de casos (porcentaje) | África (67) | Asia (71) | Sudamérica (33) | |||
|---|---|---|---|---|---|---|
| Número viajeros | % | Número viajeros | % | Número viajeros | % | |
| ECET 22 (23) | 13 | 19,4 | 8 | 11,3 | 0 | 0 |
| ECEA 14 (15) | 6 | 8,9 | 5 | 7 | 3 | 9,1 |
| Shigella spp. 23 (24) | 10 | 14,9 | 10 | 14,1 | 1 | 3 |
| Campylobacter spp. 4 (4,2) | 1 | 1,5 | 3 | 4,2 | 0 | 0 |
| Salmonella spp. 2 (2,1) | 0 | 0 | 2 | 2,8 | 0 | 0 |
| Norovirus 5 (5,2) | 3 | 4,5 | 2 | 2,8 | 0 | 0 |
| Rotavirus 1 (1,1) | 1 | 1,5 | 0 | 0 | 0 | 0 |
| G. lamblia 13 (13,7) | 1 | 1,5 | 10 | 14,1 | 1 | 3 |
| E. histolytica 2 (2,1) | 0 | 0 | 1 | 1,4 | 1 | 3 |
| C. cayetanensis 5 (5,2) | 1 | 1,5 | 1 | 1,4 | 3 | 9,1 |
| Patógenos no detectados | 36 | 53,7 | 43 | 60,6 | 24 | 72,7 |
Datos obtenidos de Zboromyrska et al.23.
Entre las especies del género Shigella, la que con mayor frecuencia encontramos como causa de DV es S.flexneri, que es la más prevalente en países en vías de desarrollo32. Otras bacterias encontradas como causa de DV, aunque en un porcentaje inferior, son Salmonella spp., Campylobacter spp. y Aeromonas spp.23,33. Campylobacter spp. es una causa frecuente de diarrea en el Sudeste asiático7 y también en viajeros a esta área geográfica23. Una revisión de 51 estudios sobre DV encontró que aproximadamente un tercio de los casos de DV de América Latina, el Caribe, África y Asia del Sur se debieron a ECET, y un tercio de los casos del Sudeste asiático se debieron a Campylobacter28. Otros patógenos bacterianos tales como Shigella y Salmonella representaron un total combinado del 10 al 15% de los casos de DV en esas regiones. Especies de Aeromonas y Plesiomonas se reportaron con mayor frecuencia en Asia y África y representaron el 5 y el 8% de los casos de DV en esas regiones, mientras que Vibrio cholerae representa el 9% de los casos en el Sudeste asiático28.
Entre los protozoos aislados como causa de DV cabe destacar Cyclospora cayetanensis y Giardia lamblia, seguido de Entamoeba hystolytica23. Otros protozoos aislados descritos en otras series son: Cryptosporidium spp., Cystoisospora belli, Blastocystis hominis. G.lamblia, Cryptosporidium spp. y E.histolytica, representan el 2% o menos de los casos de DV de América Latina, el Caribe y África, y entre el 8 y el 12% de los casos en Asia28. C.cayetanensis es causa de diarrea en viajeros que regresan de América Latina, el subcontinente indio y el sudeste asiático34.
Los patógenos virales más comunes que causan DV son los norovirus y rotavirus, que representaron el 19 y el 25% de los casos de DV en América Latina, el Caribe y África, y entre el 3 y el 5% de los casos de DV en Asia28. Los norovirus genotiposi y ii han sido también descritos como una causa frecuente de gastroenteritis vírica en viajeros a América Latina, África y Asia23,35. A pesar de que el rotavirus es una de las causas importantes de diarrea en los países del tercer mundo36 y ha estado implicado en la etiología de la DV37, ha sido detectado en porcentajes inferiores al 1,5% en viajeros catalanes23,38. Este dato a lo mejor refleja una inmunidad adquirida por parte de la población catalana.
DiagnósticoDebido a la heterogeneidad de la etiología de la DV, el diagnóstico microbiológico de esta requerirá diversas estrategias. La detección e identificación del o de los agentes etiológicos de la DV es necesaria para el manejo y tratamiento de los pacientes. Los cultivos específicos para el aislamiento de enteropatógenos bacterianos sigue siendo el método de referencia, aunque presenta importantes limitaciones, como son su baja sensibilidad, su laboriosidad y el tiempo requerido. Por otra parte, el examen de huevos y parásitos en heces (en fresco tras concentración y tinciones permanentes) se lleva a cabo mediante microscopia, pero esta también posee una baja sensibilidad y requiere formación específica de la persona que realiza la visualización para diferenciar los huevos y los parásitos. Además se pueden utilizar pruebas de detección de antígenos específicos del parásito. Se han desarrollado entre otros para detectar G.lamblia, Cryptosporidium spp. o E.histolytica. Sin embargo, las pruebas de detección de antígeno solo pueden detectar unos pocos parásitos específicos y por lo tanto no pueden sustituir al examen microscópico, que es capaz de detectar una variedad más amplia de parásitos. Por otro lado, las pruebas de detección de antígeno también se han utilizado para detectar los virus que causan gastroenteritis tales como rotavirus y adenovirus; sin embargo, estos exámenes muestran una sensibilidad variable. Algunas técnicas serológicas (detección de anticuerpos frente a E.histolytica en suero) pueden ser útiles en casos determinados. En la última década se han desarrollado algunas herramientas basadas principalmente en la reacción en cadena de la polimerasa (PCR) para detectar microorganismos específicos o múltiples enteropatógenos directamente de muestras de heces.
Aunque hay una amplia gama de ensayos moleculares disponibles para la detección de patógenos concretos, cada vez ganan más terreno los ensayos que permiten la detección simultánea de múltiples enteropatógenos, incluidos bacterias, virus y parásitos39. Entre los más estudiados está xTAG® Gastrointestinal Pathogen Panel (GPP) (Luminex Molecular Diagnostics, Toronto, Canadá). Este panel detecta 15 patógenos, incluyendo 9 bacterias, 3 virus y 3 parásitos, y ha sido evaluado para el diagnóstico de diarrea en distintas poblaciones, incluyendo los viajeros23,40,41. Entre otros ensayos presentes en el mercado hay que mencionar FilmArray GI panel (FilmArray) (BioFire, Inc., Salt Lake City, UT, EE.UU.), que permite la detección simultánea de 22 patógenos y tiene una ventaja de ser un sistema integrado que requiere tan solo 5min de manipulación de la muestra y además proporciona los resultados en una hora42,43. A pesar de que este ensayo no ha sido evaluado específicamente en diarrea de viajero, el amplio rango de patógenos incluidos en el kit lo hace muy atractivo para el diagnóstico de esta enfermedad que puede ser causada por microorganismos muy variables a pesar del cuadro clínico parecido. La principal limitación de este tipo de ensayos es su alto coste, comparando con los métodos convencionales, principalmente cultivo, detección de antígenos y PCR caseras. Por lo tanto, su aplicación dependerá de las posibilidades económicas de cada hospital y quizá de su coste-efectividad, que puede variar en función de tipo de pacientes a los que se aplica la prueba (población pediátrica, diarrea intrahospitalaria o comunitaria, diarrea de viajero, etc.).
Resistencia en bacterias aisladas como causa de diarrea del viajeroLos niveles de resistencia de los enteropatógenos bacterianos representan la situación que probablemente se observa en el país visitado. En general los porcentajes de resistencia a ampicilina, tetraciclinas y cotrimoxazol en aislamientos clínicos de ECET, ECEA y Shigella son superiores al 40%44-48. El alto porcentaje de resistencia a quinolonas en cepas de ECET, ECEA y Shigella aisladas de los pacientes con DV que han viajado al norte de África y a la India es una cuestión preocupante45,46. Por lo tanto, las quinolonas deben utilizarse con precaución en pacientes con DV que regresan de estas áreas geográficas. Los porcentajes de resistencia a los antibióticos citados anteriormente en Salmonella no tifoideas causantes de DV es normalmente bajo (<20%)49. Los macrólidos, la eritromicina y la azitromicina siguen siendo los antibióticos más activos frente a Campylobacter spp., con porcentajes de resistencia inferiores al 2%. Sin embargo, la resistencia de C.jejuni causante de DV a quinolonas se incrementó del 36% en el periodo 1993-1998 al 58% en el periodo 1999-200350.
La rifaximina es un agente antimicrobiano no absorbible que alcanza altas concentraciones en el tracto intestinal. Rifaximina presenta una buena actividad in vitro frente a varios enteropatógenos, tales como E.coli, Shigella spp. y Salmonella spp.51,52. Las concentraciones de rifaximina que se consiguen en el tracto intestinal son 10 veces superiores que las MIC de este agente antimicrobiano para los diferentes enteropatógenos mencionados. No obstante, su actividad in vivo frente a los enteropatógenos invasivos se ve reducida, probablemente debido a la baja penetración del antibiótico en los enterocitos53.
Medidas preventivas frente a la diarrea del viajeroAntibióticos: no como profilaxis, sí como autotratamientoAunque existen voces a favor de utilizar las quimioprofilaxis con antibióticos en viajeros de alto riesgo, actualmente no existe suficiente evidencia para corroborar esta indicación. La prevención de la DV con medicamentos antibióticos es controvertida, ya que si bien se sabe que son muy eficaces54, tienen también muchos inconvenientes: desde los efectos secundarios que pueden provocar hasta el riesgo de colonización con enterobacterias productoras de betalactamasas de espectro ampliado55.
Como la mayoría de DV se produce durante el viaje, cada vez existe mayor y creciente evidencia de la eficacia del autotratamiento en esta patología56. Para la mayoría de diarreas, una dieta adecuada, el uso de sales de rehidratación —ya sean comerciales o bien elaboradas por el propio viajero— y el uso de loperamida o racecadotrilo es lo más adecuado57. Conviene recordar que la loperamida está contraindicada en caso de diarrea con productos patológicos (sangre o moco) o presencia de fiebre. En estos casos conviene establecer un diagnóstico etiológico antes de iniciar un tratamiento.
En el caso de viajeros de riesgo (pacientes con enfermedad inflamatoria intestinal, pacientes en tratamiento inmunosupresor, VIH, etc.) es conveniente que se les recomiende llevar en su botiquín un antibiótico (ciprofloxacino o azitromicina dependiendo del destino) que solo utilizarán en el caso de presentar diarrea con sangre o acompañada de fiebre.
Otros fármacosLa utilización de fármacos no antibióticos para la prevención de la DV merece alguna consideración. Aunque diferentes probióticos y prebióticos han sido evaluados con el objetivo de prevenir la DV, hasta las fecha los datos no son concluyentes y no hay suficiente evidencia científica para avalar su recomendación. Tanto Lactobacillus acidophilus58 como el subsalicilato de bismuto59 han mostrado modesta eficacia en la prevención de la DV. Este último fármaco, en estudios realizados en Norteamérica, muestra una reducción del 65% en la DV si se toma 4 veces al día durante el viaje60. Aunque en general es un medicamento con un buen perfil de seguridad, dado su contenido en salicilatos su uso debe ser evitado en pacientes en tratamiento con anticoagulantes orales o antiagregantes tipo AAS. Además, la necesidad de tomarlo 4 veces al día lo hace poco práctico. El subsalicilato de bismuto no se ha comercializado en nuestro país.
VacunasHasta la fecha no existe una vacuna que proteja satisfactoriamente frente a la DV.
La vacuna frente a la fiebre tifoidea (Vivotif o Typhim Vi) es moderadamente efectiva en la protección frente la infección por salmonella entérica serotipo typhi, enfermedad que en algunos casos puede cursar con diarrea, pero no confiere inmunidad ni protección frente a otros enteropatógenos.
La protección de la vacuna contra el cólera (Dukoral®) frente a la DV es muy limitada. Según los últimos estudios, su nivel de eficacia en la prevención de la DV es del 7% o incluso menor61,62, por lo que no se recomienda su uso en la práctica habitual como medida preventiva frente a la DV, según una revisión sistemática reciente63. La vacuna del cólera solo estaría indicada a viajeros que se desplacen a zonas donde existe un brote activo de esta enfermedad.
Tratamiento antibiótico. ¿Qué antibiótico elegir de forma empírica una vez que la diarrea del viajero está establecida?El uso de antibioterapia en el tratamiento de la DV moderada-grave hace que se reduzca su duración (en un día y medio) y mejoren los síntomas. En casos de DV leve no está indicado el uso de antibióticos en su manejo.
La elección empírica del antibiótico frente a una DV moderada-grave variará en función del destino del viajero. Para la gran mayoría de destinos geográficos (exceptuando Asia) las fluoroquinolonas (fundamentalmente el ciprofloxacino) sigue siendo el antibiótico de elección (tabla 2). La rifaximina también podría ser una opción en caso de DV sin productos patológicos ni afectación del estado general, ya que no presenta suficiente actividad frente a patógenos enteroinvasivos53,64. En zonas donde Campylobacter spp. sea un patógeno frecuente (como en el caso del Sudeste asiático), la primera elección recomendable sería la azitromicina, dado que la gran mayoría de las cepas de Campylobacter son resistentes a las fluoroquinolonas.
Tratamiento de la diarrea de viajero. Opciones terapéuticas
| Antibiótico | Dosis | Efectos adversos |
|---|---|---|
| Ciprofloxacino | 500-750 mg/24 h × 3 días | |
| Azitromicina | 500 mg/24 h × 3 días o 1 g dosis única | Se puede usar en embarazadas Buena tolerancia, aunque se asocia con sensación nauseosa en la dosis única de 1 g Precaución en cardiópatas: riesgo excepcional de muerte súbita |
| Rifaximina | 200 mg/8 h × 3 días | No efectiva contra patógenos enteroinvasivos Se considera segura al no ser absorbida. Se absorbe menos del 1%. Al eliminarse da lugar a una coloración rojiza de la orina |
Aunque los probióticos pueden ser útiles en el tratamiento coadyuvante de la diarrea aguda en niños, su papel en el tratamiento de la DV no está establecido65.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.